ТЕОРИЯ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ Лектор: проф. Тонконогов Б. П.


ТЕОРИЯ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ Лектор: проф.Тонконогов Б.П.

ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ КАК НАУКА Слово “технология” происходит от греческого “téchnē” – искусство и “lógos” - наука. Химическая технология - прикладная наука о наиболее экономичных и экологически обоснованных средствах массовой химической переработки сырых природных материалов в предметы потребления и средства производства. Технология – наука техники; Технолог – сведущий в науке этой (словарь В.И.Даля) Технология – совокупность методов обработки, изготовления, изменения состояния, свойств, формы сырья, материала или полуфабриката, осуществляемых в процессе производства продукции. Различия в деятельности химика-исследователя и химика-технолога: - производство продукции в промышленных масштабах; - как можно более низкие экономические затраты на производство продукции; - решение экологических вопросов производства продукции Технология – совокупность знаний о способах обработки материалов, изделий, методах осуществления каких-либо производственных процессов.

Изучение химической технологии имеет следующие цели: 1) Ознакомление с используемыми в настоящее время методами переработки сырья и производства продукции (описание химико- технологических процессов, разбор их физико-химических основ и т.д.) – систематика химической технологии 2) Усвоение общих законов (физических, физико-химических, инженерных), последовательное применение которых дает возможность оптимального решения технологической проблемы, т.е. создания наилучших (в данных условиях) химической и технологической концепций нового метода производства – теория химической технологии Химическая технология подразделяется на: Общую – изучающую основные закономерности химико-технологических процессов и являющуюся фундаментом этой науки. Специальную – изучающую соответствующие отрасли промышленности с учетом их специфики.

ЭТАПЫ РАЗВИТИЯ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ 1 этап 15 - 16 вв. Химическая технология – как раздел прикладной химии, описывает производство и получение пороха, селитры, серной кислоты, соды и щелочей. 2 этап 18в. Выделение технологии в специальную отрасль знаний. Закладывались основы химической технологии как науки и учебной дисциплины. Впервые упоминание термина “технология“ (1772г. профессор Гёттингенского университета И. Бекман). В конце 18 в химическая технология – это обязательная учебная дисциплина в технологических университетах Европы и России. Появляются первые книги: 1795г. – “Руководство по технической химии“(И.Ф. Гмелин, Германия), 1808г. –“Начальные основания технологии, или краткое показание работ на заводах и фабриках производимых“ (И.А. Двигубский, Москва). В 1803г. В Российской академии наук была учреждена кафедра химической технологии.

ЭТАПЫ РАЗВИТИЯ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ 3 этап 19в. Химическая технология – самостоятельная научная дисциплина. Рост производства способствовал развитию научных основ химической технологии. В 1851 г. выходит книга П.А. Ильенкова “Курс химической технологии“. Это время множества открытий и строительства заводов: 1805-1810 гг. – первые заводы по производству серной кислоты в свинцовых камерах (Англия, Франция, Россия); 1823 г. – первый завод по промышленному производству соды (Англия); 1886 г. – промышленное производство серной кислоты контактным методом. 4 этап 20в. Бурное развитие химической промышленности и химической технологии, как науки. В 60-х, 70-х гг. развитие методов математического моделирования, оптимизации и автоматизированного управления ХТП. Основные тенденции развития современной химической промышленности ― связаны с решением глобальных проблем человечества: - продовольственные ресурсы Земли; - ресурсы минерального сырья для промышленности; - энергетические ресурсы; - предотвращение загрязнения биосферы.
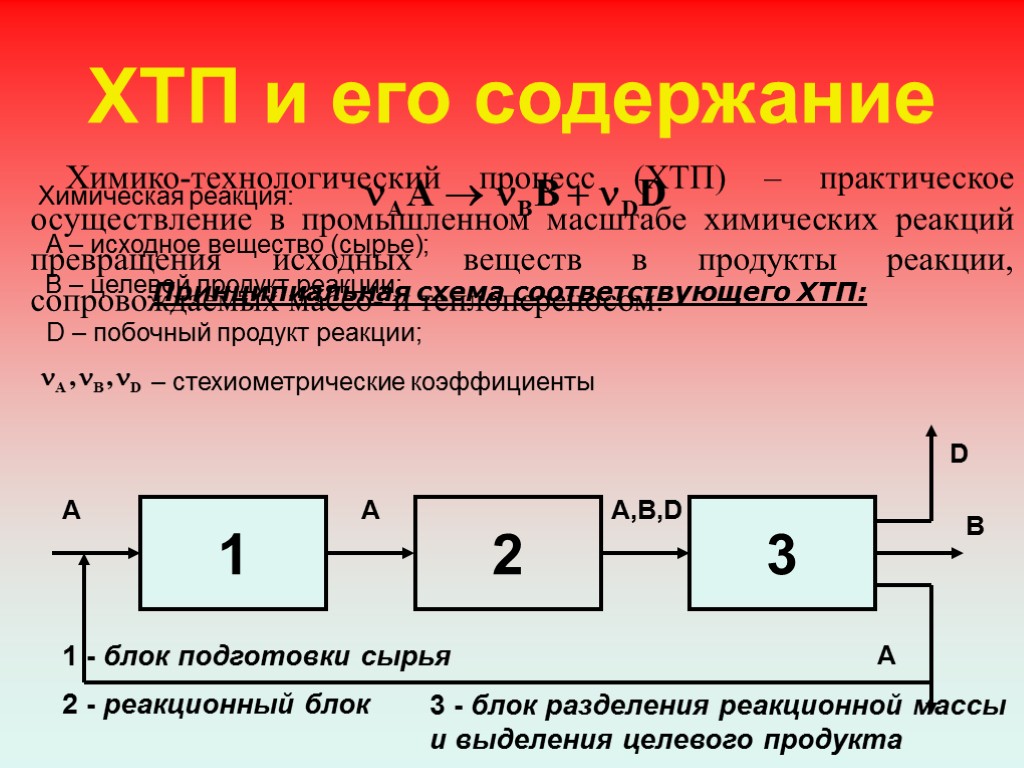
ХТП и его содержание Принципиальная схема соответствующего ХТП: 1 2 3 1 - блок подготовки сырья 2 - реакционный блок 3 - блок разделения реакционной массы и выделения целевого продукта Химико-технологический процесс (ХТП) – практическое осуществление в промышленном масштабе химических реакций превращения исходных веществ в продукты реакции, сопровождаемых массо- и теплопереносом. Химическая реакция: A – исходное вещество (сырье); B – целевой продукт реакции; D – побочный продукт реакции; – стехиометрические коэффициенты A A A,B,D D B A

КЛАССИФИКАЦИЯ ХТП Процессы, в которых не происходит химическое превращение сырья: механические гидродинамические тепловые массообменные Процессы, в которых происходит химическое превращение сырья: по сырью по потребительскому и товарному признаку по группам периодической системы элементов по температуре по типам химических реакций по давлению по применению катализатора по агрегатному состоянию

СТАДИИ ПРОЕКТИРОВАНИЯ ХТП 1 - Постановка задачи 2 - Создание химической концепции метода получения целевого продукта 3 - Создание технологической концепции метода получения целевого продукта Проект, являющийся основой промышленной реализации метода получения целевого продукта, наряду с технологическим, содержит также и другие необходимые разделы: 4 – Технологический проект - механический; - энергетический; - строительный; - автоматизации и КИП; - экологии и БЖД; Результатом работы химика-технолога по созданию нового ХТП является технологический проект, включающий в себя: - Характеристики исходных веществ, продуктов реакции, вспомогательных материалов и катализаторов; - Тип, число, размеры и последовательность всех аппаратов технологической цепочки; - Оптимальные значений всех параметров процесса - и др.

ЭТАПЫ СОЗДАНИЯ ХИМИЧЕСКОЙ КОНЦЕПЦИИ: 1 - Подбор по литературным, экспериментальным или производственным данным вариантов получения целевого продукта (вариантов химической концепции). 2 - Предварительный анализ вариантов и выбор наиболее многообещающего метода. 3 – Проведение (если это необходимо) лабораторных исследований с целью экспериментальной проверки выбранной концепции и установления оптимальных значений параметров процесса. 4 - Измерение и вычисление физико-химических свойств исходных веществ, конечных продуктов и реакционных систем, как для чистых (индивидуальных) веществ, так и для их смесей. Химическая концепция метода получения целевого продукта Это выбор исходных веществ, вспомогательных материалов, катализаторов и установление последовательности химических и физических превращений, обеспечивающих получение целевого продукта.

ЭТАПЫ СОЗДАНИЯ ХИМИЧЕСКОЙ КОНЦЕПЦИИ: 5 - Проведение стехиометрических и материальных расчетов для: установления количеств основных и вспомогательных веществ, необходимых для получения заданного количества целевого продукта, оценки хода процесса. 6 - Проведение термодинамических и термохимических расчетов. 7 - Изучение равновесия в многофазных системах, участвующих в процессе. 8 - Проведение кинетических расчетов, расчет и выбор реактора процесса.

Технологическая концепция метода получения целевого продукта Химическая концепция является основой для создания технологической концепции метода получения целевого продукта – окончательного выбора и упорядочения единичных процессов и операций, из которых состоит ХТП, а также определения способа их реализации.

Этапы создание технологической концепции: 1) Создание на базе общих технологических принципов принципиальной схемы процесса (начальной технологической концепции); 2) Предварительный анализ предложенной схемы материальными и энергетическими балансами; 3) Проведение масштабирования единичных элементов процесса, выбор типов аппаратов и конструкционных материалов. Составление предварительной технологической схемы; 4) Определение размеров, числа, параметров и графика работы аппаратов всего производственного процесса. Выбор способов управления, контроля и автоматизации процесса; 5) Составление окончательной технологической схемы. Детальный критический анализ процесса.

1-2. ВЫБОР ХИМИЧЕСКОЙ КОНЦЕПЦИИ Источниками информации для создания банка данных о методах получения целевого продукта являются: – литературные данные; – сведения, собранные при изучении работы действующих установок ; – результаты специально выполненных исследований. Начальным этапом разработки промышленного производства какого-либо продукта является установление химической концепции метода его получения, т.е. выбор определенной системы физико-химический превращений, необходимых для получения этого продукта. Первоначально собирают информацию о всех известных способах получения продукта, отличающихся исходными веществами, катализаторами, условиями процесса, реакционными устройствами и т.д.

Анализ подобранных вариантов проводят на основе рассмотрения следующих вопросов: доступность сырья степень превращения сырья и выход целевого продукта параметры процесса реакционные устройства и технологическое оформление процесса технико-экономические показатели экологические факторы (отходы производства, вредные выбросы и т.д.) На основании предварительного анализа выбирается наиболее перспективный, многообещающий метод, который и принимается в качестве химической концепции метода получения целевого продукта.
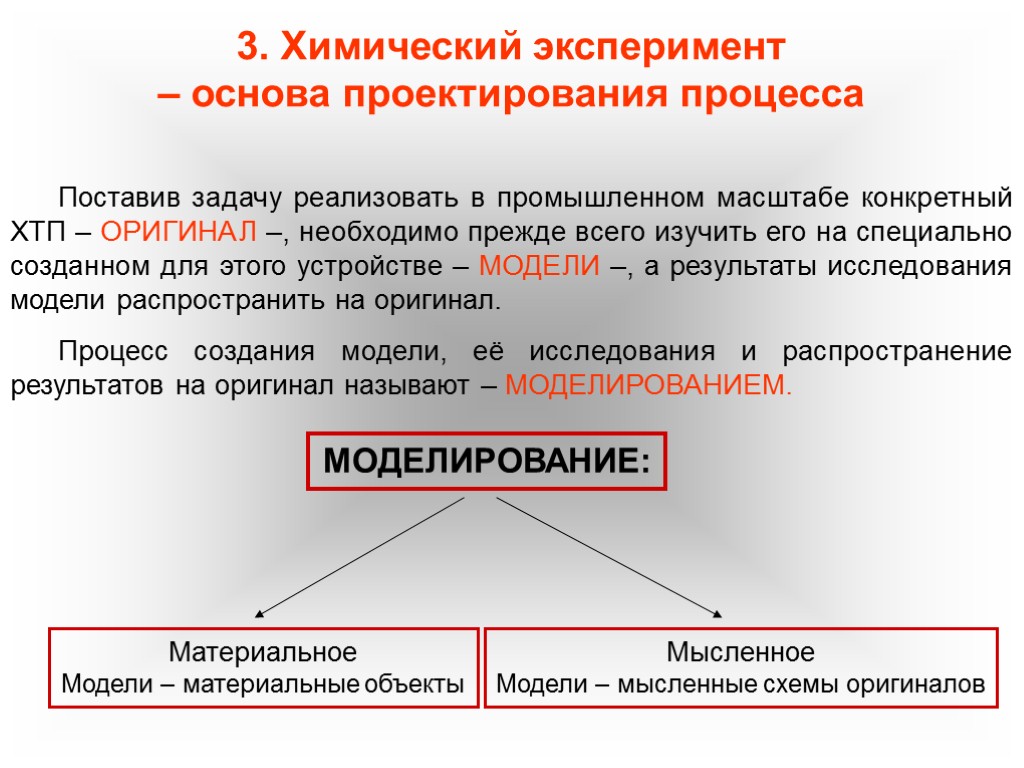
3. Химический эксперимент – основа проектирования процесса Поставив задачу реализовать в промышленном масштабе конкретный ХТП – ОРИГИНАЛ –, необходимо прежде всего изучить его на специально созданном для этого устройстве – МОДЕЛИ –, а результаты исследования модели распространить на оригинал. Процесс создания модели, её исследования и распространение результатов на оригинал называют – МОДЕЛИРОВАНИЕМ. МОДЕЛИРОВАНИЕ: Материальное Модели – материальные объекты Мысленное Модели – мысленные схемы оригиналов
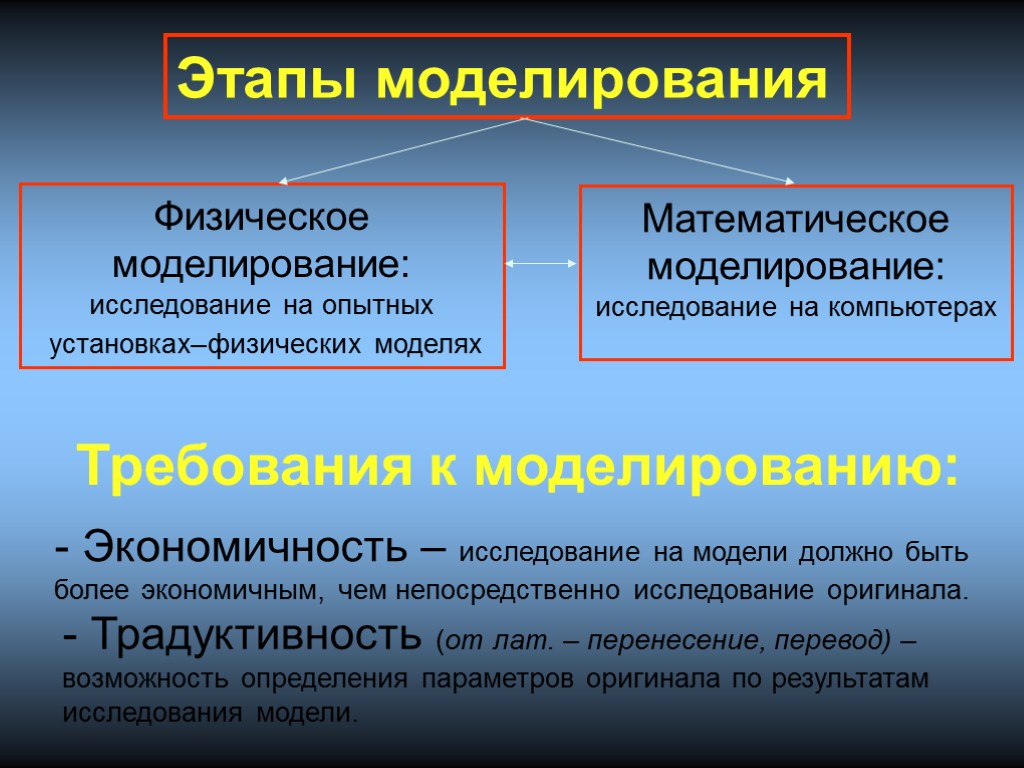
Этапы моделирования Физическое моделирование: исследование на опытных установках–физических моделях Математическое моделирование: исследование на компьютерах Требования к моделированию: - Экономичность – исследование на модели должно быть более экономичным, чем непосредственно исследование оригинала. - Традуктивность (от лат. – перенесение, перевод) – возможность определения параметров оригинала по результатам исследования модели.

Требования к эксперименту: 1. Эксперимент необходимо ставить так, чтобы полученные данные можно было обобщить, т.е. выводы из опыта распространить на условия, в которых будет проводиться промышленный процесс. 2. Следует изучить влияние изменения тех параметров, которые существенным образом воздействуют на ход процесса, но уменьшить при этом число исследуемых параметров до возможного минимума. 3. План эксперимента должен быть составлен так, чтобы можно было получить нужную информацию, проводя минимально необходимое количество опытов. 4. Результаты опытов следует подвергнуть критической оценке и представить в виде, удобном для их использования при проектировании. 1 и 2 требования → теория подобия 3 требование → статистические методы планирования эксперимента 4 требование → математические методы вычисления ошибок эксперимента и составления математического описания
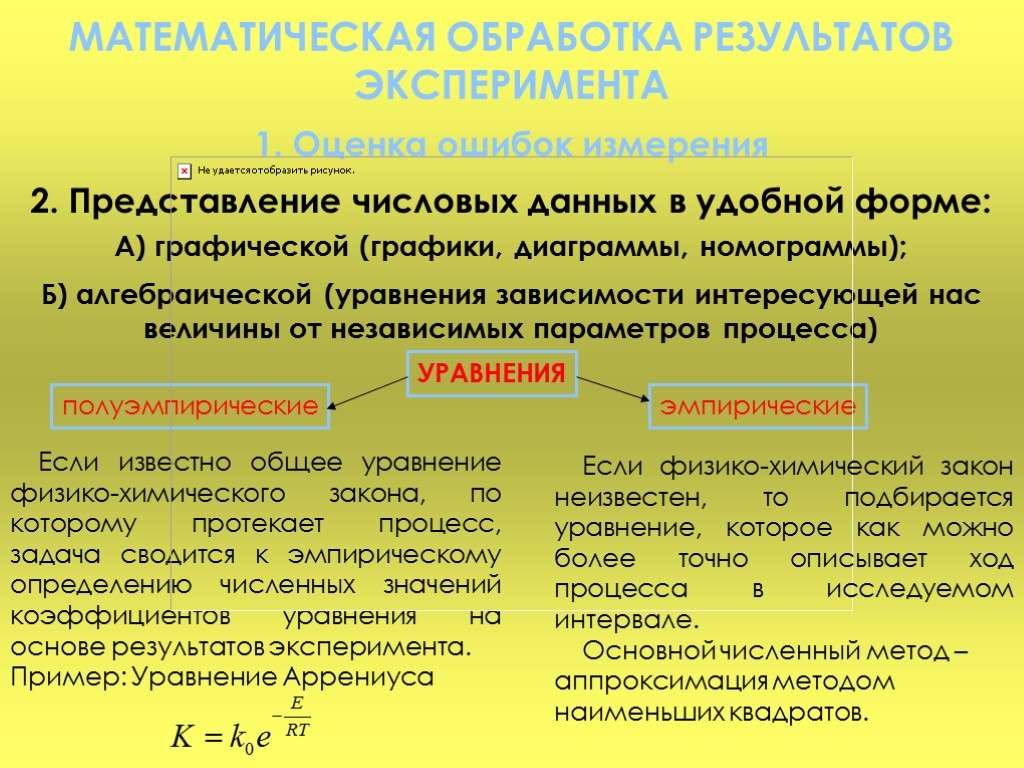
МАТЕМАТИЧЕСКАЯ ОБРАБОТКА РЕЗУЛЬТАТОВ ЭКСПЕРИМЕНТА 1. Оценка ошибок измерения 2. Представление числовых данных в удобной форме: А) графической (графики, диаграммы, номограммы); Б) алгебраической (уравнения зависимости интересующей нас величины от независимых параметров процесса) УРАВНЕНИЯ полуэмпирические эмпирические Если известно общее уравнение физико-химического закона, по которому протекает процесс, задача сводится к эмпирическому определению численных значений коэффициентов уравнения на основе результатов эксперимента. Пример: Уравнение Аррениуса Если физико-химический закон неизвестен, то подбирается уравнение, которое как можно более точно описывает ход процесса в исследуемом интервале. Основной численный метод – аппроксимация методом наименьших квадратов.

3. Нахождение значений параметров процесса, отсутствующих в таблицах, полученных в результате эксперимента или находящихся в справочной литературе, методами интерполяции и экстраполяции. ИНТЕРПОЛЯЦИЯ – поиск значения параметра, находящегося между двумя табличными значениями. ЭКСТРАПОЛЯЦИЯ – поиск значения параметра, находящегося за пределами (больше или меньше) табличных значений. МЕТОДЫ ИНТЕРПОЛЯЦИИ: - графическая - поиск искомого значения по графику, построенному по табличным данным; - алгебраическая – интерполяция с помощью многочлена Лагранжа:

4. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РЕАГЕНТОВ 4.1. Единицы физических величин в химии Физическая величина – характеристика одного из свойств физического объекта (системы, явления или процесса), общая в качественном отношении многим физическим объектам, но в количественном отношении индивидуальная для каждого объекта. Размер физической величины – количественная определенность физической величины, присущая конкретному материальному объекту, системе, явлению или процессу. Значение физической величины – оценка размера физической величины в виде некоторого числа принятых для нее единиц. Числовое значение физической величины – отвлеченное число, входящее в значение величины.

Единица физической величины – физическая величина фиксированного размера, которой условно присвоено числовое значение, равное 1 и применяемая для количественного выражения однородных физических величин. - значение физической величины; - числовое значение физической величины; - единица физической величины. Система физических величин – совокупность взаимосвязанных физических величин, образованная в соответствии с принятыми принципами, когда одни величины принимаются за независимые, а другие являются функциями независимых величин. Система физических величин состоит из основных и производных физических величин.
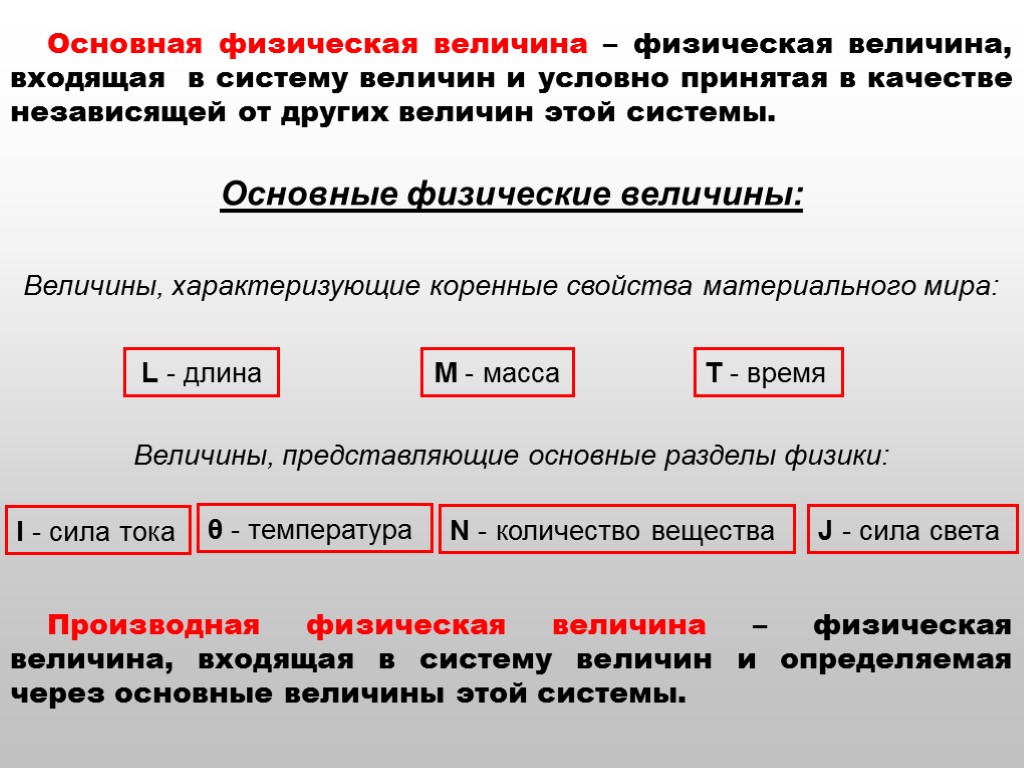
Основная физическая величина – физическая величина, входящая в систему величин и условно принятая в качестве независящей от других величин этой системы. Основные физические величины: M - масса L - длина T - время I - сила тока θ - температура N - количество вещества J - сила света Производная физическая величина – физическая величина, входящая в систему величин и определяемая через основные величины этой системы. Величины, характеризующие коренные свойства материального мира: Величины, представляющие основные разделы физики:

Размерность физической величины – выражение в форме степенного одночлена, составленное из произведений символов основных физических величин в различных степенях и отражающее связь данной физической величины с физическими величинами, принятыми в данной системе величин за основные и с коэффициентом пропорциональности, равным единице. Размерная физическая величина – физическая величина, в размерности которой хотя бы одна из основных физических величин возведена в степень, не равную нулю. Безразмерная физическая величина – физическая величина, в размерность которой все основные физические величины входят в степени, равной нулю. Скорость: Ускорение: Сила: В общем виде: где: α, β, …– показатели размерности физической величины (числа: целые, дробные, положительные, отрицательные, нуль).

Система единиц физических величин – совокупность основных и производных единиц физических величин, образованная в соответствии с принятыми принципами для заданной системы физических величин. Основная единица – единица основной физической величины в данной системе единиц. Дополнительная единица – (в СИ) – единица плоского (радиан) и телесного (стерадиан) углов. Производная единица – единица производной физической величины системы единиц, образованная в соответствии с уравнением, связывающими ее с основными или же с основными и уже определенными производными единицами. Системная единица – единица, входящая в одну из принятых систем единиц. Когерентная производная единица – производная единица, связанная с другими единицами системы уравнением, в котором числовой коэффициент принят равным единице. Кратная единица - единица, в целое число раз большее системной или внесистемной единицы. Дольная единица – единица, в целое число раз меньшее системной или внесистемной единицы.

СИСТЕМЫ ЕДИНИЦ ФИЗИЧЕСКИХ ВЕЛИЧИН 1 - Метрическая система мер (Франция, середина XIX в.) 2 – Система Гаусса (1832 г.) 3 – Система СГС (LMT) 4 – Система МКС (LMT) (Италия, 1901 г.) 5 – Система МТС (LMT) (Франция, 1919 г., СССР, 1933-1955 гг.) 6 – Система МКГСС (LFT) 7 – Естественная система 8 – Международная система единиц СИ (SI) ФИЗИЧЕСКИЕ ВЕЛИЧИНЫ, ПРИМЕНЯЕМЫЕ В ХИМИИ И ХИМИЧЕСКОЙ ТЕХНОЛОГИИ Количество вещества – физическая величина, равная числу структурных элементов, составляющих систему. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде–12 массой 0,012 кг

Масса вещества – одна из основных характеристик любого материального объекта, является мерой его инертности и гравитации. Относительная молекулярная масса вещества – величина, равная отношению средней массы молекулы данного вещества (

4.2. ОПРЕДЕЛЕНИЕ ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ РЕАГЕНТОВ 1- поиск экспериментальных значений свойств по справочникам 2 – проведение специальных экспериментов 3 – расчет или предсказание свойств Требования к расчетному методу: 1 – выдавать надежные физические и термодинамические данные для чистых веществ и их смесей при любых температурах и давлениях 2 – учитывать агрегатное состояние (т., ж., г.) 3 – обходится минимальным количеством входных данных 4 – выбирать путь расчета, ведущий к минимальной ошибке 5 – учитывать возможную ошибку 6 – минимизировать время расчета

МЕТОДЫ РАСЧЕТА 1. Полуэмпирические методы, основанные на теоретических предпосылках уравнение состояния Ван-дер-Ваальса для реальных газов: идеально-газовый закон (уравнение Менделеева-Клапейрона): 2. Методы расчета, основанные на конститутивных и аддитивных свойствах химических соединений Конститутивное свойство – зависимость какого-либо физико-химического свойства вещества от рода и числа атомов, групп атомов и способа связи в молекуле. Аддитивная величина – величина, в которой одинаковым элементам молекулы (атомам, группам, связям) в разных химических соединениях соответствуют одинаковые доли искомой физико-химической величины. 3. Методы расчета, основанные на подобии свойств различных веществ На подобии зависимостей физико-химических свойств двух различных веществ от независимых параметров основана теория соответственных состояний. На основе этой теории рассчитывают физико-химические свойства реальных газов и жидкостей (уравнения Ван-дер-Ваальса, Бенедикта-Вебба-Рубина, Редлиха-Квонга, Суги-Лю и др.) Справочник по методам расчета физико-химических свойств: Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей. – 3-е изд. – Л.: Химия, 1982. – 592 с.
teoria_khtp_ch_1.ppt
- Количество слайдов: 28

