Теория гибридизации (O)


Теория гибридизации (O)
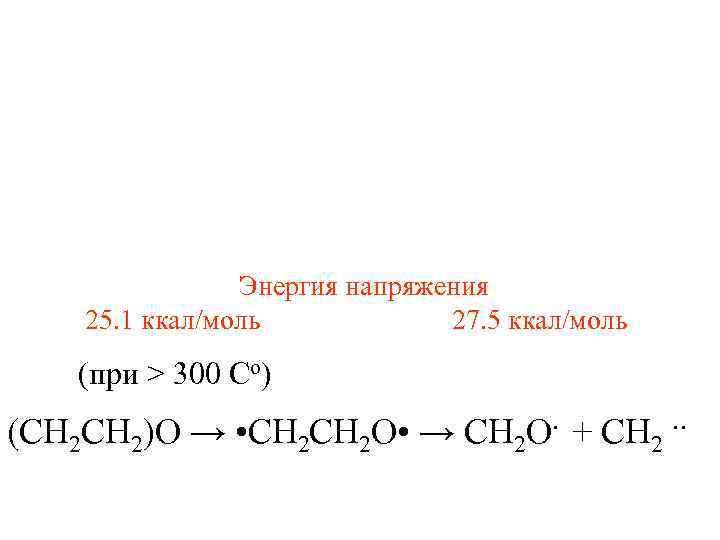
Энергия напряжения 25. 1 ккал/моль 27. 5 ккал/моль (при > 300 Сo) (CH 2)O → • CH 2 O • → CH 2 O. + CH 2. .

Распределение электронной плотности (x-ray, 25 k, ELI, электр. локализация неподел. пар) S Grabowsky et al. , Chem. Eur. J. , 2010, 12818

sp 3

sp 2

Изоэлектронность = изоструктурность A B

HF/6 -31 G* DHобр 22. 4 (стабильнее) 28. 1 ккал/моль IGLO (С 2, 3 ) d 67. 2 м. д. 183. 4, 189. 8 м. д. С 2, 3 (эксп. ) 190. 2 м. д. G. I. Borodkin et al. Mend. Commun. 1999, 83

50 o 2. 1 Å РСА (2 h, 3 h) PBE/3 z (11 s 6 p 2 d)/[6 s 3 p 2 d] ) Г. И. Бородкин и др. Ж. орг. хим. 2006. 418 Докл. АН СССР, 1986, 1364
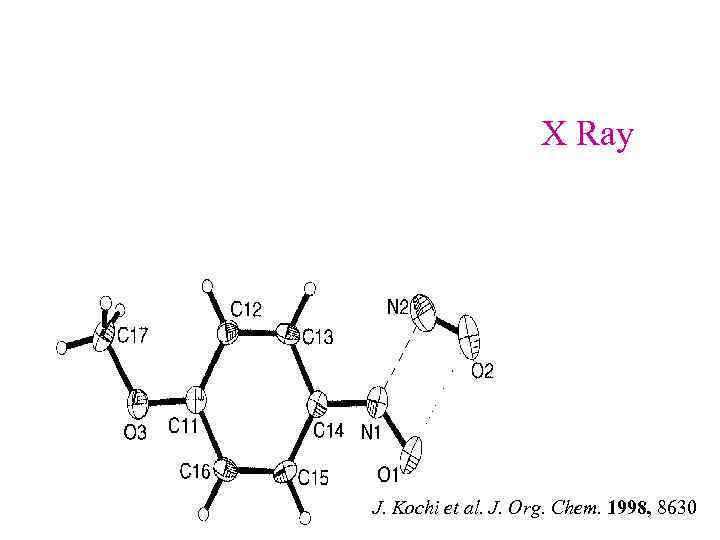
X Ray J. Kochi et al. J. Org. Chem. 1998, 8630
![NO+ + p-(t-Bu. Me. O)calix[4]arene (X Ray) K ~108 NO+ + p-(t-Bu. Me. O)calix[4]arene (X Ray) K ~108](https://present5.com/presentation/3/19373328_282978807.pdf-img/19373328_282978807.pdf-15.jpg)
NO+ + p-(t-Bu. Me. O)calix[4]arene (X Ray) K ~108 необычно стабилен ! J. Kochi et al. Ang. Chem. Int. 2000, 2123

RI-MP 2/L 1 (Урацил)

РСА SP-гибр. J. Kochi et al. J. Chem. Soc. , P. T. 2, 2000, 1919

Галогенониевые ионы R-Hal+-R I+ Br+ Cl+ I Br Cl F Ip, e. V 10. 5 11. 8 13. 0 17. 4 Ar-Hal+-Ar (акад. Несмеянов) Ph. N 2 BF 4 - + Ph. Br [Ph. Br+Ph] BF 4 - Т. пл. 120 -121 о Ph. N 2 BF 4 - + Ph. Cl [Ph. Cl+Ph] BF 4 - Т. пл. 109 -110 о
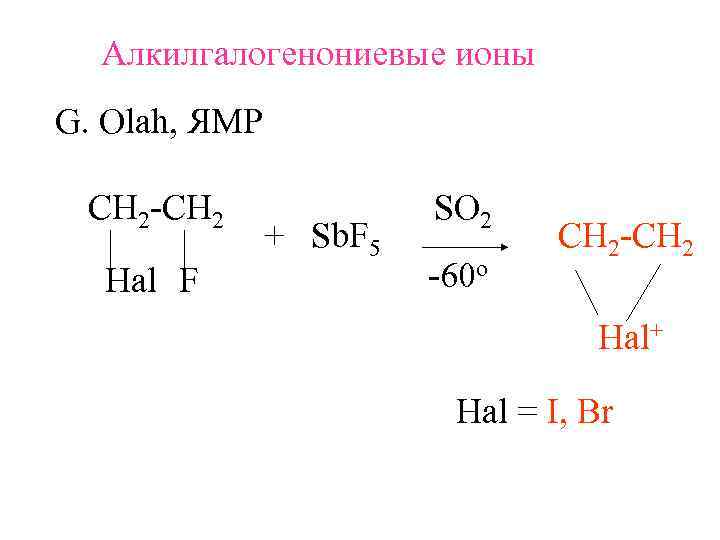
Алкилгалогенониевые ионы G. Olah, ЯМР СH 2 -CH 2 SO 2 + Sb. F 5 СH 2 -CH 2 Hal F -60 o Hal+ Hal = I, Br
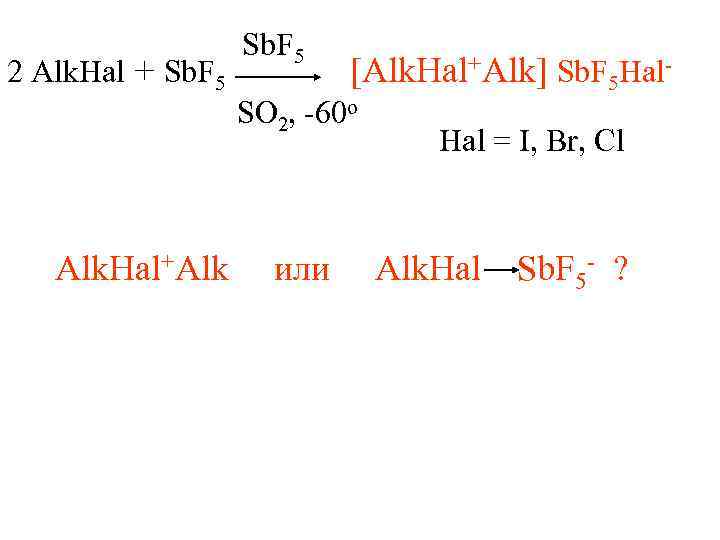
Sb. F 5 2 Alk. Hal + Sb. F 5 [Alk. Hal+Alk] Sb. F 5 Hal- SO 2, -60 o Hal = I, Br, Cl Alk. Hal+Alk или Alk. Hal Sb. F 5 - ?

3 -ий и более периоды ? 2 -ой период NH 3 OH 2 107 o 104 o 3 -ий период PH 3 SH 2 94 o 92 o 4 -ый период As. H 3 Se. H 2 91 o 90 o

Термическая устойчивость Ar 2 I+ > Ar 2 Br+ > Ar 2 Cl+ >> Alk 2 I+ > Alk 2 Br+ > Alk 2 Cl+ >
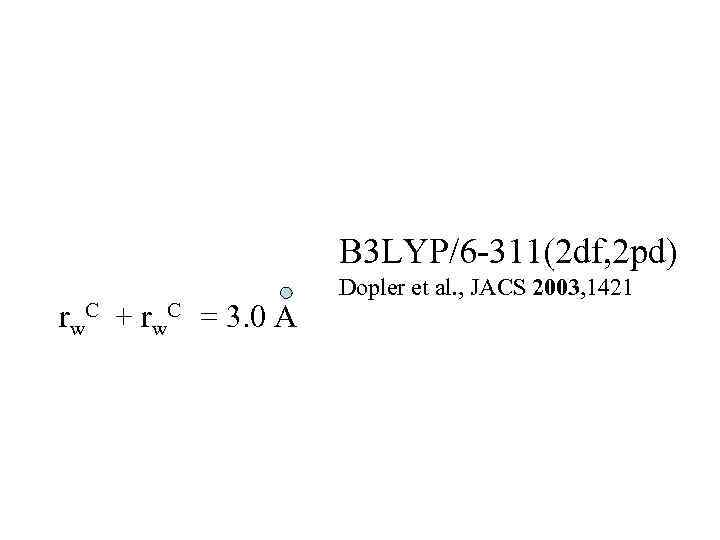
B 3 LYP/6 -311(2 df, 2 pd) Dopler et al. , JACS 2003, 1421 rw. C + rw. C = 3. 0 A
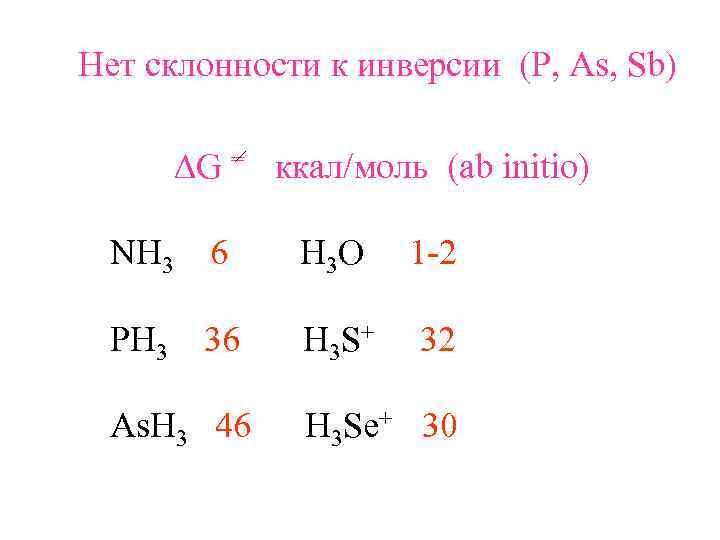
Нет склонности к инверсии (P, As, Sb) DG = ккал/моль (ab initio) NH 3 6 H 3 O 1 -2 PH 3 36 H 3 S + 32 As. H 3 46 H 3 Se+ 30
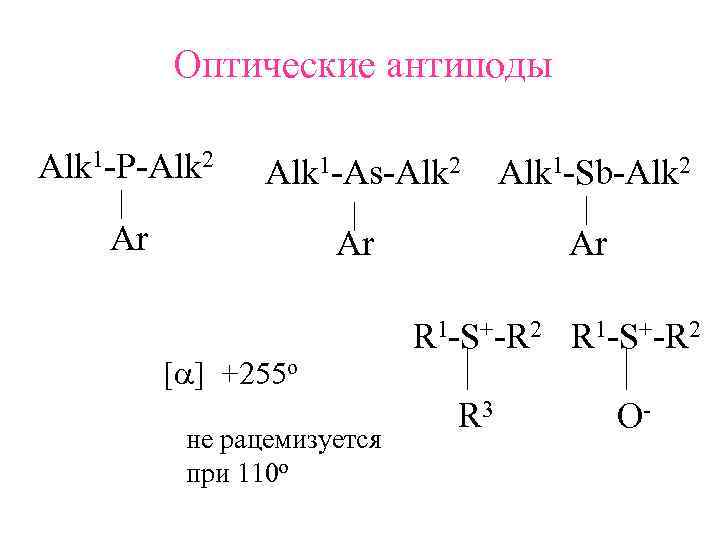
Оптические антиподы Alk 1 -P-Alk 2 Alk 1 -As-Alk 2 Alk 1 -Sb-Alk 2 Ar R 1 -S+-R 2 [a] +255 o R 3 O- не рацемизуется при 110 о

Псевдооктаэдр. oт-но I, промеж. AX 3 E, AX 3 E 2
Лекция 7a(теория гибридизации O).ppt
- Количество слайдов: 21

