Postulaty_Bora.ppt
- Количество слайдов: 11

Теория атома водорода по Бору

БОР Нильс Хендрик Давид (7. Х 1885 — 18. XI 1962) — выдающийся датский физик теоретик, один из создателей современной физи ки. Как ученый Бор формировался в очень острый для физики период, когда она вплот ную одошла к изучению мира атомных процессов и связанных с ними п полей. Ра боты . Планка, А. Эйнштейна, анализ спектров излучения атомов М уже показали не обычность закономерностей микромира. Был накоплен огромный экспериментальный материал, весьма противоречивый в свете ранее известных законов. Нужен был прин ципиально новый подход для создания физи ческой картины атомных процессов. Важная заслуга. Бора и состояла в том, что он нашел такой подход. Он ориентировал физиков на исследование противоречивых сторон физической реальности микромира, сформулировал идею о дискретности энергетических состояний атомов, в свете новых идей по строил атомную модель, открыв условия устойчивости атомов, и объяснил большой круг явлений. В 1913, исходя из идеи М. Планка о квантовании энергии, Бор на основе модели ато ма езерфорда Р создал свою теорию водородоподобного атома, основанную на двух постулатах, которые прямо противоречили классическим представлениям и законам. Это была первая квантовая модель атома, положившая начало новой эре в атомной теории. Согласно этой теории планетарная структура атома и свойства его спектра из лучения егко объясняются, если предполо жить, то движение электрона в л ч атоме «под чиняется» екоторым ограничениям, ко торые ор сформулировал в виде двух постулатов. н Б Бор установил наличие в атоме стационарных разрешенных орбит, двигаясь по которым электрон, вопреки законам элек тродинамики, не излучает энергию, однако может скачком перейти на более близкую к ядру также разрешенную орбиту, испустив при этом квант энергии, равный разности энергий атома в стационарных состояниях, разработал некоторые правила квантования. Теория Бора позволила объяснить целый ряд сложных вопросов строения атома и фактов, чего не в состоянии была сделать классическая физика. В частности, Бор на шел сновные законы спектральных линий и о электронных оболочек атомов, объяснил (1923) особенности периодической системы химических элементов, предложив свой ва риант зображения периодической системы элементов, и в том же году и пришел к пред ставлению об оболочечной структуре атома, основанной на классификации электронных орбит по главному и азимутальному кван товым ислам. За создание квантовой тео рии ч планетарного атома в 1922 удостоен Но белевской премии.

Опыт Резерфорда Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909– 1911 годах. Резерфорд предложил применить зондирование атома с помощью α частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α частицы с кинетической энергией около 5 Мэ. В (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др. ). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α частицы. Рассеяние, то есть изменение направления движения α частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда по рассеянию α частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп

• От радиоактивного источника, заключенного в свинцовый контейнер, α частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°. • Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находились в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α частицу, по закону Кулона возросла бы в n 2 раз. Следовательно, при достаточно большом значении n α частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома. .

• Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10– 14– 10– 15 м. Это ядро занимает только 10– 12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см 3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева. • Радикальные выводы о строении атома, следовавшие из опытов Резерфорда, заставляли многих ученых сомневаться в их справедливости. Не был исключением и сам Резерфорд, опубликовавший результаты своих исследований только в 1911 г. через два года после выполнения первых экспериментов. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
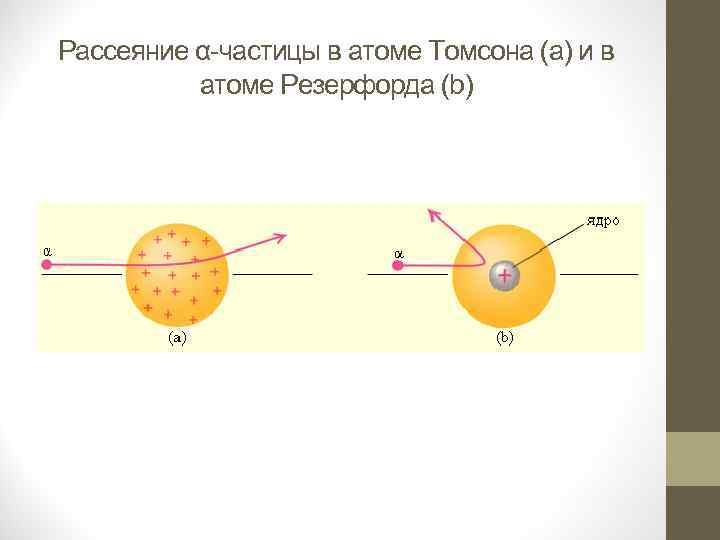
Рассеяние α частицы в атоме Томсона (a) и в атоме Резерфорда (b)

Линейчатый спектр атома водорода • Исследования спектров излучения разряженных газов (т. е. спектров излучения отдель ных атомов) показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий. Самым изученным является спектр наиболее простого атома — атома водорода. Швейцарский ученый И. Бальмер (1825— 1898) подобрал эмпирическую формулу, описывающую все известные в то время спектральные линии атома водорода в видимой области спектра: где R'=1, 10*107 м 1 —постоянная Ридберга. Так как v=c/λ , то формула (2. 1) может быть переписана для частот, где R=R'c=3, 29 1015 с-1 : Из данных выражений вытекает, что спектральные линии, отличающиеся различными значениями n, образуют группу или серию линий, называемую серией Бальмера. С увеличением n линии серии сближаются; значение n= определяет границу серии, к которой со стороны больших частот примыкает сплошной спектр.

• В дальнейшем (в начале XX в. ) в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана: В инфракрасной области спектра были также обнаружены: • серия Пашена • серия Брекета • серия Пфунда • серия Хэмфри • Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера: где m имеет в каждой данной серии постоянное значение, m= 1, 2, 3, 4, 5, 6 {определяет серию), n принимает целочисленные значения, начиная с m+1 (определяет отдельные линии этой серии).

Постулаты Бора • Первая попытка построить качественно новую — квантовую — теорию атома была предпринята в 1913 г. датским физиком Нильсом Бором (1885— 1962). Он поставил перед собой цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и погло щения света. В основу своей теории Бор положил два постулата. • Первый постулат Бора (постулат стационарных состояний). Атом может находиться не во всех состояниях, допускаемых классической физикой, а только в особых стационарных состояниях, каждому из которых соответствует своя определенная энергия Еn. В стационарном состоянии атом не излучает. В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные квантованные значения момента импульса, удовлетворяющие условию • где m — масса электрона, v — его скорость по n й орбите радиуса r, ħ=h/(2π)

•

Выводы • По теории Бора, количественно объяснив шей спектр атома водорода, спектральные серии соответствуют излучению, возника ющему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного. Спектр поглощения атома водорода является линейчатым, но содержит при нормальных условиях только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n=1), то при сообщении атомам извне опреде ленной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана). Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с дру гой — основывается на квантовых постулатах). В теории Бора рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, однако эта теория не смогла объяснить интенсивности спектральных линий и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недо статком теории Бора была невозможность описания с ее помощью спектра атома гелия — одного из простейших атомов, посредственно следующего за атомом водорода.
Postulaty_Bora.ppt