6. Адсорбция газов на тв. адс-нтах.ppt
- Количество слайдов: 28
 Теоретические основы очистки атмосферы от газовых загрязнений. Часть 2 АДСОРБЦИЯ ГАЗОВЫХ ПРИМЕСЕЙ
Теоретические основы очистки атмосферы от газовых загрязнений. Часть 2 АДСОРБЦИЯ ГАЗОВЫХ ПРИМЕСЕЙ
 Адсорбция газовых загрязнений — процесс избирательного поглощения компонента газа, пара или р-ра с помощью адсорбентов — пористых твёрдых материалов с большой удельной поверхностью. Газ-носитель — газовая среда, из к-рой происходит поглощение, адсорбент — твёрдое вещество, поглощающее компонент, адсорбтив—поглощаемое в-во, находящееся в очищаемом газе, адсорбат—поглощённое в-во в адсорбенте. Различают физическую, активированную и химическую адсорбцию. При физ. адсорбции между мол-ми адсорбента и адсорбата хим. взаим-вия не происходит. Физ. адсорбция обусловлена силами ММВ (дисперсионный, ориентационный и индукционный эффекты). Они слабы. Поглощённое в-во всегда может быть выделено из адсорбента десорбцией. Процесс физ. адсорбции протекает очень быстро, с выделением тепла, теплота физ. адсорбции невелика (порядок теплоты конденсации). Физ. адсорбция не избирательная или неспецифична, полностью обратима.
Адсорбция газовых загрязнений — процесс избирательного поглощения компонента газа, пара или р-ра с помощью адсорбентов — пористых твёрдых материалов с большой удельной поверхностью. Газ-носитель — газовая среда, из к-рой происходит поглощение, адсорбент — твёрдое вещество, поглощающее компонент, адсорбтив—поглощаемое в-во, находящееся в очищаемом газе, адсорбат—поглощённое в-во в адсорбенте. Различают физическую, активированную и химическую адсорбцию. При физ. адсорбции между мол-ми адсорбента и адсорбата хим. взаим-вия не происходит. Физ. адсорбция обусловлена силами ММВ (дисперсионный, ориентационный и индукционный эффекты). Они слабы. Поглощённое в-во всегда может быть выделено из адсорбента десорбцией. Процесс физ. адсорбции протекает очень быстро, с выделением тепла, теплота физ. адсорбции невелика (порядок теплоты конденсации). Физ. адсорбция не избирательная или неспецифична, полностью обратима.
 Активированная адсорбция – взаим-е между адс-батом и адснтом с обр-нием поверхностного соединения (мономолекулярная адсорбция). Акт. адсорбция протекает медленно, для ускорения необходимо повышение т-ры, действие света и пр. Теплота акт. адсорбции выше теплоты физической. Акт. адсорбция избирательна, десорбция затруднена. Хемосорбция происходит практически мгновенно и ведёт к обрнию обычных хим. соед-ний, теплота хемосорбции выше теплоты акт. адсорбции, выделение поглощённого в-ва практически невозможно. Св-ва и строение поверхностных хим. соед-ний еще мало изучены. Известно только, что они отличны от св-в объёмных соедний. Теплота хемосорбции ~ 200… 400 к. Дж/моль, физ. адсорбции < 60 к. Дж/моль. Величины физ. и хим. адсорбции с ростом т-ры ум-ся, однако при опр. т-ре физ. адсорбция может скачкообразно перейти в активированную. В некоторых случаях поглощение пара вызвано его конденсацией в порах поглотителя. Это - капиллярная конденсация. На практике отдельные виды адсорбции протекают одновременно.
Активированная адсорбция – взаим-е между адс-батом и адснтом с обр-нием поверхностного соединения (мономолекулярная адсорбция). Акт. адсорбция протекает медленно, для ускорения необходимо повышение т-ры, действие света и пр. Теплота акт. адсорбции выше теплоты физической. Акт. адсорбция избирательна, десорбция затруднена. Хемосорбция происходит практически мгновенно и ведёт к обрнию обычных хим. соед-ний, теплота хемосорбции выше теплоты акт. адсорбции, выделение поглощённого в-ва практически невозможно. Св-ва и строение поверхностных хим. соед-ний еще мало изучены. Известно только, что они отличны от св-в объёмных соедний. Теплота хемосорбции ~ 200… 400 к. Дж/моль, физ. адсорбции < 60 к. Дж/моль. Величины физ. и хим. адсорбции с ростом т-ры ум-ся, однако при опр. т-ре физ. адсорбция может скачкообразно перейти в активированную. В некоторых случаях поглощение пара вызвано его конденсацией в порах поглотителя. Это - капиллярная конденсация. На практике отдельные виды адсорбции протекают одновременно.
 Адсорбция является и продолжает оставаться осн. способом очистки технол. газовых выбросов. В принципе она м. б. применена для извлечения любых загрязнителей. При адсорбции возможны очень большие скорости поглощения и полное извлечение компонентов, выделение к-рых путём абсорбции было бы невозможно из-за их малой конц-ции. На практике область её применения ограничена рядом эксплуатац. , техн. и эконом. условий. Так, по требованиям пожаро- и взрывобезопасности нельзя подвергать адс. обработке газы с содержанием взрывоопасных компонентов более 2/3 от нижнего концентрационного предела воспламенения. Адсорбцию применяют для очистки газов с невысоким содержанием г/о или парообразных загрязнений до очень низких объёмных концентраций. Адсорбцию применяют для улавливания из газов, вентиляционных выбросов сернистых соед-ний, углеводородов, хлора, окислов азота, паров орг. р-лей и др.
Адсорбция является и продолжает оставаться осн. способом очистки технол. газовых выбросов. В принципе она м. б. применена для извлечения любых загрязнителей. При адсорбции возможны очень большие скорости поглощения и полное извлечение компонентов, выделение к-рых путём абсорбции было бы невозможно из-за их малой конц-ции. На практике область её применения ограничена рядом эксплуатац. , техн. и эконом. условий. Так, по требованиям пожаро- и взрывобезопасности нельзя подвергать адс. обработке газы с содержанием взрывоопасных компонентов более 2/3 от нижнего концентрационного предела воспламенения. Адсорбцию применяют для очистки газов с невысоким содержанием г/о или парообразных загрязнений до очень низких объёмных концентраций. Адсорбцию применяют для улавливания из газов, вентиляционных выбросов сернистых соед-ний, углеводородов, хлора, окислов азота, паров орг. р-лей и др.
 Оптим. конц-ции загрязнителей в очищаемых газах - 0, 02. . . 0, 5 об. %. (ММ~100). Совр. техн. возможности не позволяют снижать концции загрязнителей до санитарных норм. На практике мин. конечные конц-ции загрязнителей составляют ~0, 002. . . 0, 004 об. %. Поэтому адс. очистка газов с нач. содержанием загр-ля менее 0, 02% уместна, если это дорогой продукт или в-во высокого класса опасности. Обработка отбросных газов с высокой (более 0, 2. . . 0, 4 об. % для ММ ~ 100. . . 50) начальной конц-цией загр-ля требует значительного кол-ва адсорбента и больших габаритов адсорбера. Громоздкость аппаратов вызывается и малой (до 0, 5 м/с) скоростью потока через слой адсорбента. В потоках с 1. . . 1, 5 м/с унос адсорбента доходит до 5% в сутки. Однако возможности адсорбции ещё далеко не исчерпаны. В ряде случаев она м. б. использована для создания очистных систем нового поколения, удовлетворяющих не только сан. нормам, но и эконом. требованиям. Ех, адсорбцию можно применить в двухступенчатой схеме очистки для предварит. концентрирования сильно разб. орг. загрязнителей, поступающих затем на термообезвреживание. Т. о. , конц-ции загрязнителей в вентил. выбросах можно повысить в десятки раз.
Оптим. конц-ции загрязнителей в очищаемых газах - 0, 02. . . 0, 5 об. %. (ММ~100). Совр. техн. возможности не позволяют снижать концции загрязнителей до санитарных норм. На практике мин. конечные конц-ции загрязнителей составляют ~0, 002. . . 0, 004 об. %. Поэтому адс. очистка газов с нач. содержанием загр-ля менее 0, 02% уместна, если это дорогой продукт или в-во высокого класса опасности. Обработка отбросных газов с высокой (более 0, 2. . . 0, 4 об. % для ММ ~ 100. . . 50) начальной конц-цией загр-ля требует значительного кол-ва адсорбента и больших габаритов адсорбера. Громоздкость аппаратов вызывается и малой (до 0, 5 м/с) скоростью потока через слой адсорбента. В потоках с 1. . . 1, 5 м/с унос адсорбента доходит до 5% в сутки. Однако возможности адсорбции ещё далеко не исчерпаны. В ряде случаев она м. б. использована для создания очистных систем нового поколения, удовлетворяющих не только сан. нормам, но и эконом. требованиям. Ех, адсорбцию можно применить в двухступенчатой схеме очистки для предварит. концентрирования сильно разб. орг. загрязнителей, поступающих затем на термообезвреживание. Т. о. , конц-ции загрязнителей в вентил. выбросах можно повысить в десятки раз.
 Характеристики адсорбентов Любое в-во, обладающее пов-стью, потенциально явл-ся адсорбентом. Требования к пром. адсорбентам: важнейшая хар-ка адсорбента – его уд. пов-сть, должен иметь сильно развитую пов-сть; большую адс. ёмкость; высокую селективность; хим. инертность по отн -нию к компонентам разделяемой смеси; высокую мех. прочность; способность к регенерации. Осн. пром. адсорбентами являются активированные угли, сложные оксиды и импрегнированные сорбенты. Активированный уголь (АУ) нейтрален по отношению к полярным и неполярным молекулам адсорбируемых соединений. Он менее селективен, чем др. адсорбенты, и явл-ся одним из немногих, пригодных для работы во влажных газовых потоках. АУ используют, ех, для очистки газов от дурно пахнущих в-в, рекуперации р-лей и т. д. Оксидные адсорбенты (ОА) обладают более высокой селективностью к полярным мол-лам. Их недостатком явл-ся снижение эффективности в присутствии влаги. К классу ОА относят силикагели, синтетические цеолиты, оксид алюминия. Импрегнированные адсорбенты (ИА)
Характеристики адсорбентов Любое в-во, обладающее пов-стью, потенциально явл-ся адсорбентом. Требования к пром. адсорбентам: важнейшая хар-ка адсорбента – его уд. пов-сть, должен иметь сильно развитую пов-сть; большую адс. ёмкость; высокую селективность; хим. инертность по отн -нию к компонентам разделяемой смеси; высокую мех. прочность; способность к регенерации. Осн. пром. адсорбентами являются активированные угли, сложные оксиды и импрегнированные сорбенты. Активированный уголь (АУ) нейтрален по отношению к полярным и неполярным молекулам адсорбируемых соединений. Он менее селективен, чем др. адсорбенты, и явл-ся одним из немногих, пригодных для работы во влажных газовых потоках. АУ используют, ех, для очистки газов от дурно пахнущих в-в, рекуперации р-лей и т. д. Оксидные адсорбенты (ОА) обладают более высокой селективностью к полярным мол-лам. Их недостатком явл-ся снижение эффективности в присутствии влаги. К классу ОА относят силикагели, синтетические цеолиты, оксид алюминия. Импрегнированные адсорбенты (ИА)
 В последние годы широкое применение получают волокнистые сорбционно-активные материалы (более высокая терм. и хим. стойкость, однородность пористой структуры, значит. объём микропор и более высокий коэффициент массопередачи (в 10 - 100 раз больше, чем у зернистых адс-тов). Установки, в к-рых исп-ся волокнистые матлы, занимают значительно меньшую площадь. Масса адсорбента при их исп-нии меньше, чем у АУ в 15 -100 раз, а масса аппарата в 10 раз. Сопротивление слоя не превышает 100 Па. Высокой эфф-стью очистки хар-ся АУ сотовой (ячеистой) структуры, обладающие улучшенными гидравлическими хар-ками. Такие сорбенты м. б. получены нанесением определенных композиций с порошком АУ на вспененную синтетическую смолу или вспениванием смеси, содержащей АУ, а также выжиганием наполнителя из смеси, включающей АУ вместе со связующим. Разработка новых модификаций адсорбентов - силикагелей и цеолитов, обладающих повышенной терм. и мех. прочностью. Чтобы сделать силикагель гидрофобным, его модифицируют, ех, органическими ВМС. В последние годы синтезированы высококремнеземные и сверхвысококремнеземные цеолиты (СВКцеолиты), в к-рых отношение Si. О 2: Al 2 О 3 может достигать 100 и выше, что также повышает их гидрофобность.
В последние годы широкое применение получают волокнистые сорбционно-активные материалы (более высокая терм. и хим. стойкость, однородность пористой структуры, значит. объём микропор и более высокий коэффициент массопередачи (в 10 - 100 раз больше, чем у зернистых адс-тов). Установки, в к-рых исп-ся волокнистые матлы, занимают значительно меньшую площадь. Масса адсорбента при их исп-нии меньше, чем у АУ в 15 -100 раз, а масса аппарата в 10 раз. Сопротивление слоя не превышает 100 Па. Высокой эфф-стью очистки хар-ся АУ сотовой (ячеистой) структуры, обладающие улучшенными гидравлическими хар-ками. Такие сорбенты м. б. получены нанесением определенных композиций с порошком АУ на вспененную синтетическую смолу или вспениванием смеси, содержащей АУ, а также выжиганием наполнителя из смеси, включающей АУ вместе со связующим. Разработка новых модификаций адсорбентов - силикагелей и цеолитов, обладающих повышенной терм. и мех. прочностью. Чтобы сделать силикагель гидрофобным, его модифицируют, ех, органическими ВМС. В последние годы синтезированы высококремнеземные и сверхвысококремнеземные цеолиты (СВКцеолиты), в к-рых отношение Si. О 2: Al 2 О 3 может достигать 100 и выше, что также повышает их гидрофобность.

 Теоретические основы адсорбции Термодинамика адсорбции ü Адсорбция плоской поверхностью и пористыми телами. ü Адсорбция мономолекулярная, полимолекулярная, капиллярная конденсация и адсорбция микропористыми адсорбентами. ü Теории адсорбции, равновесие При физ. адсорбции для каждой конц-ции адсорбтива в окр. среде устанавливается состояние адс. равновесия, при к-ром устанавливается опр. зав-сть между конц-цией адс-мого в-ва Х (кг/кг адсорбента) и его равновесной конц-цией Y (кг/кг) в газовой фазе: X = A • Y 1/n, (4. 59) где А, n – коэффициенты, определяемые опытным путем ( n ≥ 1). Т. к. конц-ция компонента в газовой смеси при постоянной т-ре пропорциональна его давлению, то ур-ние (4. 59) можно представить также в виде: X = A 1·P 1/n, (4. 60) где A 1 – коэффициент; Р – равновесное давление поглощаемого вещества в парогазовой смеси, Па.
Теоретические основы адсорбции Термодинамика адсорбции ü Адсорбция плоской поверхностью и пористыми телами. ü Адсорбция мономолекулярная, полимолекулярная, капиллярная конденсация и адсорбция микропористыми адсорбентами. ü Теории адсорбции, равновесие При физ. адсорбции для каждой конц-ции адсорбтива в окр. среде устанавливается состояние адс. равновесия, при к-ром устанавливается опр. зав-сть между конц-цией адс-мого в-ва Х (кг/кг адсорбента) и его равновесной конц-цией Y (кг/кг) в газовой фазе: X = A • Y 1/n, (4. 59) где А, n – коэффициенты, определяемые опытным путем ( n ≥ 1). Т. к. конц-ция компонента в газовой смеси при постоянной т-ре пропорциональна его давлению, то ур-ние (4. 59) можно представить также в виде: X = A 1·P 1/n, (4. 60) где A 1 – коэффициент; Р – равновесное давление поглощаемого вещества в парогазовой смеси, Па.
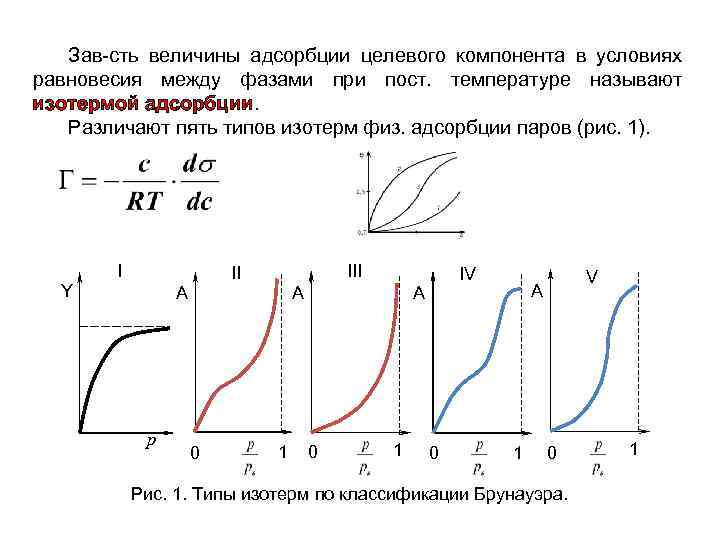 Зав-сть величины адсорбции целевого компонента в условиях равновесия между фазами при пост. температуре называют изотермой адсорбции. Различают пять типов изотерм физ. адсорбции паров (рис. 1). Y I А р III II 0 А 1 IV А 0 1 0 V А 1 0 Рис. 1. Типы изотерм по классификации Брунауэра. 1
Зав-сть величины адсорбции целевого компонента в условиях равновесия между фазами при пост. температуре называют изотермой адсорбции. Различают пять типов изотерм физ. адсорбции паров (рис. 1). Y I А р III II 0 А 1 IV А 0 1 0 V А 1 0 Рис. 1. Типы изотерм по классификации Брунауэра. 1
 При высоких т-рах или малых парц. давлениях изотермы адсорбции аппроксимируются законом Генри: a* = Ap·p (4. 61) где a* – кол-во поглощенного вещества, кг/кг (адсорбента) или кг/м 3; Ар – константа фаз. равновесия; р – парц. давление компонента в газе. В практич. расчётах широко используется ур-ние Фрейндлиха: a* = A 1·pп (4. 62) где А 1 и n – коэффициенты. Для мономолекулярной физ. адсорбции используется ур-ние Ленгмюра: Х* = b⋅am⋅p/(1 + b p), (4. 63) где b – коэффициент; am – предельная величина адсорбции.
При высоких т-рах или малых парц. давлениях изотермы адсорбции аппроксимируются законом Генри: a* = Ap·p (4. 61) где a* – кол-во поглощенного вещества, кг/кг (адсорбента) или кг/м 3; Ар – константа фаз. равновесия; р – парц. давление компонента в газе. В практич. расчётах широко используется ур-ние Фрейндлиха: a* = A 1·pп (4. 62) где А 1 и n – коэффициенты. Для мономолекулярной физ. адсорбции используется ур-ние Ленгмюра: Х* = b⋅am⋅p/(1 + b p), (4. 63) где b – коэффициент; am – предельная величина адсорбции.
 Универсальный характер имеет ур-ние БЭТ (Брунауер-Эммет. Теллер), описывающее мономолекулярную и полислойную адсорбцию: (4. 64) где ps – давление насыщенного пара; C – константа. На поглощаемые молекулы со стороны поверхности адсорбента действует сила притяжения, пропорциональная адсорбционному потенциалу: = R⋅T⋅ln ps/ p. (4. 65) Адсорбция микропористыми адсорбентами отражается теорией объёмного заполнения микропор ТОЗМ где β - коэффициент аффинности, E - характеристическая энергия адсорбции, Е/Ео=( / 0)V =
Универсальный характер имеет ур-ние БЭТ (Брунауер-Эммет. Теллер), описывающее мономолекулярную и полислойную адсорбцию: (4. 64) где ps – давление насыщенного пара; C – константа. На поглощаемые молекулы со стороны поверхности адсорбента действует сила притяжения, пропорциональная адсорбционному потенциалу: = R⋅T⋅ln ps/ p. (4. 65) Адсорбция микропористыми адсорбентами отражается теорией объёмного заполнения микропор ТОЗМ где β - коэффициент аффинности, E - характеристическая энергия адсорбции, Е/Ео=( / 0)V =
 Адсорбция ускоряется при понижении т-ры и при повышении давления. Десорбция, наоборот, ускоряется с повышением т-ры адсорбента и снижением давления, а также при пропускании через адсорбент паров, вытесняющих поглощенное вещество. Каждый адсорбент обладает способностью поглощать лишь определённые в-ва и не поглощать другие (избирательность). В отличие от абсорбции адсорбция позволяет проводить очистку газов при повышенных температурах. Процессы адсорбции проводят или периодически или непрерывно. Различают стационарные и нестационарные процессы адсорбции. В стационарном процессе конц-ция адсорбата в каждой точке слоя поглотителя постоянна и непрерывна. В практике санитарной очистки газа наиболее распространены нестационарные периодические процессы.
Адсорбция ускоряется при понижении т-ры и при повышении давления. Десорбция, наоборот, ускоряется с повышением т-ры адсорбента и снижением давления, а также при пропускании через адсорбент паров, вытесняющих поглощенное вещество. Каждый адсорбент обладает способностью поглощать лишь определённые в-ва и не поглощать другие (избирательность). В отличие от абсорбции адсорбция позволяет проводить очистку газов при повышенных температурах. Процессы адсорбции проводят или периодически или непрерывно. Различают стационарные и нестационарные процессы адсорбции. В стационарном процессе конц-ция адсорбата в каждой точке слоя поглотителя постоянна и непрерывна. В практике санитарной очистки газа наиболее распространены нестационарные периодические процессы.
 Кинетика и динамика адсорбции Процесс адсорбции складывается из последовательно протекающих стадий диффузии молекул поглощаемого в-ва из потока газа к внешней пов-сти адс-нта (внешняя диффузия), проникновения молекул внутри пористого поглотителя (внутренняя диффузия) и сорбции (конденсации) молекул на внутренней поверхности пор. Принято считать, что скорость собственно адсорбции велика и не лимитирует общую скорость процесса. След-но, лимитирующей стадией может быть диффузия (внешняя либо внутренняя). В некоторых случаях процесс лимитируется обеими этими стадиями. Нестационарная одномерная диффузия м. б. описана 2 -ым законом Фика: где ɑ = X и с = Y – концентрации компонента соот-но в тв. и газ. фазах; Dc – эфф. коэф-нт диффузии; F – пов-сть, нормальная к потоку; ∂2 c/∂z 2 – частная производная по градиенту конц-ции в направлении оси z.
Кинетика и динамика адсорбции Процесс адсорбции складывается из последовательно протекающих стадий диффузии молекул поглощаемого в-ва из потока газа к внешней пов-сти адс-нта (внешняя диффузия), проникновения молекул внутри пористого поглотителя (внутренняя диффузия) и сорбции (конденсации) молекул на внутренней поверхности пор. Принято считать, что скорость собственно адсорбции велика и не лимитирует общую скорость процесса. След-но, лимитирующей стадией может быть диффузия (внешняя либо внутренняя). В некоторых случаях процесс лимитируется обеими этими стадиями. Нестационарная одномерная диффузия м. б. описана 2 -ым законом Фика: где ɑ = X и с = Y – концентрации компонента соот-но в тв. и газ. фазах; Dc – эфф. коэф-нт диффузии; F – пов-сть, нормальная к потоку; ∂2 c/∂z 2 – частная производная по градиенту конц-ции в направлении оси z.
 Механизм конкретного процесса диффузии определяют на основе изучения зависимостей коэф-нтов диффузии от давления, темп-ры, мол. масс поглощаемого вещества и газа-носителя. Уравнение кинетики адсорбции: где β 0 – коэффициент массопередачи, выражаемый через коэффициенты внешнего β 1 и внутреннего β 2 массообмена где D* – коэффициент продольной диффузии; w – скорость потока газа. В основе расчёта процессов очистки и рекуперации, осуществляемых с помощью твёрдых сорбентов, лежат зак-сти динамики адсорбции, к-рая рассматривает пространственновременное распределение компонентов между фазами системы, возникающее при их перемещении друг отн. друга. Движение этого фронта по слою адсорбента зависит от вида изотермы адсорбции.
Механизм конкретного процесса диффузии определяют на основе изучения зависимостей коэф-нтов диффузии от давления, темп-ры, мол. масс поглощаемого вещества и газа-носителя. Уравнение кинетики адсорбции: где β 0 – коэффициент массопередачи, выражаемый через коэффициенты внешнего β 1 и внутреннего β 2 массообмена где D* – коэффициент продольной диффузии; w – скорость потока газа. В основе расчёта процессов очистки и рекуперации, осуществляемых с помощью твёрдых сорбентов, лежат зак-сти динамики адсорбции, к-рая рассматривает пространственновременное распределение компонентов между фазами системы, возникающее при их перемещении друг отн. друга. Движение этого фронта по слою адсорбента зависит от вида изотермы адсорбции.

 Для выпуклой изотермы адсорбции при с2 > c 1 f(c 1) > f(с2) и U 1 < U 2. Это означает, что точки, соответствующие меньшим конц-циям, движутся вдоль слоя адсорбента медленнее, чем точки с большими конц-циями и через определённый интервал времени в концентрационном поле должна установиться единственная конц-ция поглощаемого в-ва, равная начальной. Образуется сорбционный фронт, перемещающийся в слое параллельно самому себе, что приводит к послойной обработке сорбента. При этом конц-ция адсорбата в газ. фазе распределяется от С=0 до Сi (конц-ция проскока) и явл-ся наименьшей конц-цией поглощаемого в-ва на выходе из слоя адсорбента, к-рая определяется аналитически. Время, при к-ром за слоем сорбента появляется проскоковая конц -ция, называется временем проскока или временем защитного действия слоя τпр.
Для выпуклой изотермы адсорбции при с2 > c 1 f(c 1) > f(с2) и U 1 < U 2. Это означает, что точки, соответствующие меньшим конц-циям, движутся вдоль слоя адсорбента медленнее, чем точки с большими конц-циями и через определённый интервал времени в концентрационном поле должна установиться единственная конц-ция поглощаемого в-ва, равная начальной. Образуется сорбционный фронт, перемещающийся в слое параллельно самому себе, что приводит к послойной обработке сорбента. При этом конц-ция адсорбата в газ. фазе распределяется от С=0 до Сi (конц-ция проскока) и явл-ся наименьшей конц-цией поглощаемого в-ва на выходе из слоя адсорбента, к-рая определяется аналитически. Время, при к-ром за слоем сорбента появляется проскоковая конц -ция, называется временем проскока или временем защитного действия слоя τпр.
 Зависимость между временем защитного действия слоя τпр и длиной слоя Н устанавливается уравнением Шилова : τпр = k Н – τo, где k=1/U – коэффициент защитного действия (время задержания поглощаемого в-ва 1 см слоя сорбента в усл. стационар. режима); τo - потеря времени защитного действия, связанная с начальным периодом формирования кривой распределения адсорбата; U – скорость движения фронта. С/Сн τпр Δτ τ Обычно, чтобы обеспечить высокую степень очистки, адсорбер перед наступлением «проскока» переключают на стадию десорбции.
Зависимость между временем защитного действия слоя τпр и длиной слоя Н устанавливается уравнением Шилова : τпр = k Н – τo, где k=1/U – коэффициент защитного действия (время задержания поглощаемого в-ва 1 см слоя сорбента в усл. стационар. режима); τo - потеря времени защитного действия, связанная с начальным периодом формирования кривой распределения адсорбата; U – скорость движения фронта. С/Сн τпр Δτ τ Обычно, чтобы обеспечить высокую степень очистки, адсорбер перед наступлением «проскока» переключают на стадию десорбции.
 Кол-во в-ва, поглощённого слоем сорбента при появлении за ним проскоковой конц-ции, характеризует динамическую активность сорбента. Динам. активность сорбента всегда меньше его равновесной или статической активности, соответствующей кол-ву поглощенного в-ва после появления за слоем начальной конц-ции адсорбата Со. Динамическая активность в промышленных адсорберах составляет 45 − 90%. Для построения рабочей линии процесса необходимо располагать величинами динамической адсорбционной емкости адсорбента aд по извлекаемому компоненту для заданных концентраций адсорбента на входе в адсорбер и выходе из него: aд = C 0∙w 0∙τ , (4. 76) где C 0 – конц-ция примеси в очищаемом газе на входе в адсорбер; w 0 – скорость газа, приведённая к сечению аппарата; τ – время защитного действия слоя адсорбента.
Кол-во в-ва, поглощённого слоем сорбента при появлении за ним проскоковой конц-ции, характеризует динамическую активность сорбента. Динам. активность сорбента всегда меньше его равновесной или статической активности, соответствующей кол-ву поглощенного в-ва после появления за слоем начальной конц-ции адсорбата Со. Динамическая активность в промышленных адсорберах составляет 45 − 90%. Для построения рабочей линии процесса необходимо располагать величинами динамической адсорбционной емкости адсорбента aд по извлекаемому компоненту для заданных концентраций адсорбента на входе в адсорбер и выходе из него: aд = C 0∙w 0∙τ , (4. 76) где C 0 – конц-ция примеси в очищаемом газе на входе в адсорбер; w 0 – скорость газа, приведённая к сечению аппарата; τ – время защитного действия слоя адсорбента.
 Материальный баланс процесса адсорбции Мат. баланс выражается общим для всех процессов массопередачи ур-нием G∙d. Y = L∙d. X, (4. 66) где G – расход парогазовой фазы или раствора, кг (инертной части)/с; L – расход адсорбента, кг (активной части)/с; Y – раб. конц-ции адс. в-ва в парогаз. фазе или р-ре, кг/кг (инертной части); X – рабочие конц-ции адс. вещества в адсорбенте, кг/кг (адсорбента). Mz+dz dz w Адсорбция в слое неподвижного адсорбента явл-ся периодическим процессом, при к-ром концция поглощаемого в-ва в адсорбенте и в парогазовой фазе меняется во времени и в пространстве. (4. 72) S где ε – порозность адсорбента ; w – скорость потока газа Mz Рис. 2. Элемент неподвижного слоя адсорбента (4. 72) называют дифф-ным ур-ем мат. баланса периодического процесса адсорбции в слое неподвижного адсорбента.
Материальный баланс процесса адсорбции Мат. баланс выражается общим для всех процессов массопередачи ур-нием G∙d. Y = L∙d. X, (4. 66) где G – расход парогазовой фазы или раствора, кг (инертной части)/с; L – расход адсорбента, кг (активной части)/с; Y – раб. конц-ции адс. в-ва в парогаз. фазе или р-ре, кг/кг (инертной части); X – рабочие конц-ции адс. вещества в адсорбенте, кг/кг (адсорбента). Mz+dz dz w Адсорбция в слое неподвижного адсорбента явл-ся периодическим процессом, при к-ром концция поглощаемого в-ва в адсорбенте и в парогазовой фазе меняется во времени и в пространстве. (4. 72) S где ε – порозность адсорбента ; w – скорость потока газа Mz Рис. 2. Элемент неподвижного слоя адсорбента (4. 72) называют дифф-ным ур-ем мат. баланса периодического процесса адсорбции в слое неподвижного адсорбента.
 Построение изотермы адсорбции и рабочей линии процесса (рис. 3). Изотерму адсорбции строят по эксперим-ным и/или справочным данным. Если изотерма адсорбции неизвестна, её можно построить по изотерме адсорбции стандартного в-ва. В качестве стандарт. в-ва обычно выступает бензол. Точки А и В задаются исходным составом и условиями. Х, кг/м 3 Изотерма адсорбции Величина адсорбции: Х 2* = Х 1*(V 1/V 2) = X 1*(1/βa) В Х* Рабочая линия А Yк Y* Yн Y, кг/м 3 Рис. 3. Графическое изображение рабочей линии и изотермы адсорбции. (4. 82) где Х 1* – ордината изотермы станд. в-ва (обычно бензола), кг/кг; Х 2* – ордината определяемой изотермы, кг/кг; V 1 и V 2 – мольные объёмы станд. и иссл-го в-ва в ж. состоянии, м 3/кмоль; βа = V 2/V 1 – коэф-нты аффинности. Мольные объёмы в-в: V = M/ρж (4. 83) где М – мол. масса в-ва, кг/кмоль; ρж – плотность в-ва в ж. состоянии, кг/м 3.
Построение изотермы адсорбции и рабочей линии процесса (рис. 3). Изотерму адсорбции строят по эксперим-ным и/или справочным данным. Если изотерма адсорбции неизвестна, её можно построить по изотерме адсорбции стандартного в-ва. В качестве стандарт. в-ва обычно выступает бензол. Точки А и В задаются исходным составом и условиями. Х, кг/м 3 Изотерма адсорбции Величина адсорбции: Х 2* = Х 1*(V 1/V 2) = X 1*(1/βa) В Х* Рабочая линия А Yк Y* Yн Y, кг/м 3 Рис. 3. Графическое изображение рабочей линии и изотермы адсорбции. (4. 82) где Х 1* – ордината изотермы станд. в-ва (обычно бензола), кг/кг; Х 2* – ордината определяемой изотермы, кг/кг; V 1 и V 2 – мольные объёмы станд. и иссл-го в-ва в ж. состоянии, м 3/кмоль; βа = V 2/V 1 – коэф-нты аффинности. Мольные объёмы в-в: V = M/ρж (4. 83) где М – мол. масса в-ва, кг/кмоль; ρж – плотность в-ва в ж. состоянии, кг/м 3.
 единица переноса – участок (высота) массообменного аппарата, на к-ром изменение рабочих конц-ций равно средней движущей силе на данном участке (ун – ук = Δуср n =1 ) число единиц переноса – изменение рабочей концции распределяемого между фазами компонента, приходящееся на одну единицу движущей силы высота единицы переноса – участок (высота) массообменного аппарата, соответствующая одной единице переноса HH = h 0 y n 0 y теоретическая ступень изменения концентрации (теоретическая тарелка) – объём массообменного аппарата, в к-ром происходит процесс полного (теор. ) обмена распределяемого в-ва между обеими фазами.
единица переноса – участок (высота) массообменного аппарата, на к-ром изменение рабочих конц-ций равно средней движущей силе на данном участке (ун – ук = Δуср n =1 ) число единиц переноса – изменение рабочей концции распределяемого между фазами компонента, приходящееся на одну единицу движущей силы высота единицы переноса – участок (высота) массообменного аппарата, соответствующая одной единице переноса HH = h 0 y n 0 y теоретическая ступень изменения концентрации (теоретическая тарелка) – объём массообменного аппарата, в к-ром происходит процесс полного (теор. ) обмена распределяемого в-ва между обеими фазами.
 Необходимая высота (длина) H слоя поглотителя может быть рассчитана по общему уравнению массопередачи: (4. 77) откуда высота слоя w 0 /β 0 =hn где hn – высота единицы переноса; ny – число единиц переноса. Число единиц переноса определяют по формуле или (4. 79) где Yн, Yк – нач. и конеч. конц-ция адсорбтива в парогазовой смеси, кг/м 3; Хн, Хк – нач. и конеч. конц-ция адсорбата в твердой фазе, кг/м 3; X, Y – текущая (рабочая) конц-ция адсорбата и адсорбтива, соот-но, в твёрдой и парогазовой фазе, кг/м 3; X*, Y* – равновесные конц-ции адсорбата в твёрдой фазе и адсорбтива в парогазовой фазе при заданных значениях Х и Y (определяются по кривой равновесия).
Необходимая высота (длина) H слоя поглотителя может быть рассчитана по общему уравнению массопередачи: (4. 77) откуда высота слоя w 0 /β 0 =hn где hn – высота единицы переноса; ny – число единиц переноса. Число единиц переноса определяют по формуле или (4. 79) где Yн, Yк – нач. и конеч. конц-ция адсорбтива в парогазовой смеси, кг/м 3; Хн, Хк – нач. и конеч. конц-ция адсорбата в твердой фазе, кг/м 3; X, Y – текущая (рабочая) конц-ция адсорбата и адсорбтива, соот-но, в твёрдой и парогазовой фазе, кг/м 3; X*, Y* – равновесные конц-ции адсорбата в твёрдой фазе и адсорбтива в парогазовой фазе при заданных значениях Х и Y (определяются по кривой равновесия).
 Уравнение (4. 79) обычно решают методом графического интегрирования. Задавшись рядом значений Y в интервале (Yн – Yк), строят график в координатах 1/(Y – Y*), затем измеряют площадь криволинейной трапеции f, ограниченную кривой ab, осью абсцисс и прямыми, проведенными из точек Yк и Yн (рис. 2). а Число единиц переноса определяют из выражения n y = f M 1 M 2 , (4. 80) где М 1 – масштаб по оси 1/(Y – Y*); М 2 – масштаб по оси Y f – площадь трапеции. b Yк Yн Рис. 2. Зависимость 1/(Y – Y*) = f(Y). Y
Уравнение (4. 79) обычно решают методом графического интегрирования. Задавшись рядом значений Y в интервале (Yн – Yк), строят график в координатах 1/(Y – Y*), затем измеряют площадь криволинейной трапеции f, ограниченную кривой ab, осью абсцисс и прямыми, проведенными из точек Yк и Yн (рис. 2). а Число единиц переноса определяют из выражения n y = f M 1 M 2 , (4. 80) где М 1 – масштаб по оси 1/(Y – Y*); М 2 – масштаб по оси Y f – площадь трапеции. b Yк Yн Рис. 2. Зависимость 1/(Y – Y*) = f(Y). Y
 Высота единицы переноса h: h = Gг/(Sсл • βy) = Vгρг/(Sсл • βy) (4. 84) где Gг – массовый расход парогазовой смеси, кг/с; Sсл – сечение слоя адсорбента, м 2; βy – объёмный коэффициент массоотдачи в газовой смеси, 1/с; ρг – плотность парогазовой смеси, кг/м 3. Объёмный коэффициент массопередачи Ку : 1/Ку = (1/βу) + (m/βx) (4. 85) где βх – объёмный коэффициент массоотдачи в твёрдой смеси, 1/с; m = Yн/Xк* – коэф-нт распределения (средний тангенс угла наклона линии равновесия к оси абсцисс). Величина m = Yн /Xк* обычно мала, поэтому 1/Ку ≈ (1/βу) (4. 86) На этом основании в ур-нии (4. 84) вместо коэф-та массопередачи приведён коэффициент массоотдачи βу.
Высота единицы переноса h: h = Gг/(Sсл • βy) = Vгρг/(Sсл • βy) (4. 84) где Gг – массовый расход парогазовой смеси, кг/с; Sсл – сечение слоя адсорбента, м 2; βy – объёмный коэффициент массоотдачи в газовой смеси, 1/с; ρг – плотность парогазовой смеси, кг/м 3. Объёмный коэффициент массопередачи Ку : 1/Ку = (1/βу) + (m/βx) (4. 85) где βх – объёмный коэффициент массоотдачи в твёрдой смеси, 1/с; m = Yн/Xк* – коэф-нт распределения (средний тангенс угла наклона линии равновесия к оси абсцисс). Величина m = Yн /Xк* обычно мала, поэтому 1/Ку ≈ (1/βу) (4. 86) На этом основании в ур-нии (4. 84) вместо коэф-та массопередачи приведён коэффициент массоотдачи βу.
 Коэф-нт массоотдачи определяют по критерию Нуссельта (Nu′): Nu′ = βу dэ2/D. (4. 87) Критерий Нуссельта опр-ют в зав-сти от числ. значения модиф. критерия Рейнольдса (Re) и дифф. критерия Прандтля (Pr′): Re = wг dэ ρг/(εн μг); (4. 88) Pr′ = μг/( ρг D) (4. 89) где wг – скорость парогазовой смеси, отнесённая к свободному сечению слоя адсорбента, м/с; μг – динамическая вязкость газа, Па с; εн – порозность неподвижного слоя адсорбента; dэ – эквивалентный диаметр зерна адсорбента, м; D – коэффициент молекулярной диффузии, м 2/с. Nu´ = f(Re, Рr'). Объём слоя адсорбента Vад определяют по формуле Vад = H Sсл, (4. 90) где Н – высота слоя адсорбента, м; Sсл – сечение слоя адс-та, м 2
Коэф-нт массоотдачи определяют по критерию Нуссельта (Nu′): Nu′ = βу dэ2/D. (4. 87) Критерий Нуссельта опр-ют в зав-сти от числ. значения модиф. критерия Рейнольдса (Re) и дифф. критерия Прандтля (Pr′): Re = wг dэ ρг/(εн μг); (4. 88) Pr′ = μг/( ρг D) (4. 89) где wг – скорость парогазовой смеси, отнесённая к свободному сечению слоя адсорбента, м/с; μг – динамическая вязкость газа, Па с; εн – порозность неподвижного слоя адсорбента; dэ – эквивалентный диаметр зерна адсорбента, м; D – коэффициент молекулярной диффузии, м 2/с. Nu´ = f(Re, Рr'). Объём слоя адсорбента Vад определяют по формуле Vад = H Sсл, (4. 90) где Н – высота слоя адсорбента, м; Sсл – сечение слоя адс-та, м 2
 Продолжительность τ (с) процесса адсорбции опр-ют в зав-сти от вида изотермы адсорбции. 1) Если изотерма адсорбции – линейная (≈ соот-ет з-ну Генри): τ1/2 = (Х* Н/wг Yн)1/2 – b(X*/βy Yн)1/2, (4. 91) где Yн – нач. конц-ция адсорбируемого вещества в парогазовом потоке, кг/м 3; Х* – равновесное кол-во адс. в-ва, кг/кг (опр-ся по изотерме адсорбции и умножается на насыпную плотность адсорбента); Н – высота слоя адсорбента, м; b – коэф-нт, опр-ся по справочным данным. 2) Если зав-сть м. конц-цией газа и кол-вом поглощённого в-ва является криволинейной (вторая область изотермы адсорбции): τ = (Х*/wг Yн) {Н – wг/βy[(Y 1*/Yн) ln([Yн/Yк)] – 1) + ln([Yн/Yк] – 1)]} (4. 92) где Y 1* – содержание в-ва в газ. потоке, равновесное с кол-вом, равном половине вещества, максимально поглощаемого адсорбентом при данной температуре, т. е. при Xmax*/2, кг/м 3. 3) Если количество вещества, поглощаемого адсорбентом, достигает предела и остаётся постоянным (третья область изотермы адсорбции): τ = (Х*/wг Yн){H – wг/βy[ln(Yн/Yк) – 1]}. (4. 93)
Продолжительность τ (с) процесса адсорбции опр-ют в зав-сти от вида изотермы адсорбции. 1) Если изотерма адсорбции – линейная (≈ соот-ет з-ну Генри): τ1/2 = (Х* Н/wг Yн)1/2 – b(X*/βy Yн)1/2, (4. 91) где Yн – нач. конц-ция адсорбируемого вещества в парогазовом потоке, кг/м 3; Х* – равновесное кол-во адс. в-ва, кг/кг (опр-ся по изотерме адсорбции и умножается на насыпную плотность адсорбента); Н – высота слоя адсорбента, м; b – коэф-нт, опр-ся по справочным данным. 2) Если зав-сть м. конц-цией газа и кол-вом поглощённого в-ва является криволинейной (вторая область изотермы адсорбции): τ = (Х*/wг Yн) {Н – wг/βy[(Y 1*/Yн) ln([Yн/Yк)] – 1) + ln([Yн/Yк] – 1)]} (4. 92) где Y 1* – содержание в-ва в газ. потоке, равновесное с кол-вом, равном половине вещества, максимально поглощаемого адсорбентом при данной температуре, т. е. при Xmax*/2, кг/м 3. 3) Если количество вещества, поглощаемого адсорбентом, достигает предела и остаётся постоянным (третья область изотермы адсорбции): τ = (Х*/wг Yн){H – wг/βy[ln(Yн/Yк) – 1]}. (4. 93)
 Десорбция поглощенных примесей Адс-ные процессы носят циклический характер, т. к. необходима период. регенерация насыщенных целевыми компонентами поглотителей. Процесс извлечения адс. в-ва из адсорбента называется десорбцией. Освобожденный от поглощенного в-ва адсорбент м. б. использован вторично. Процесс десорбции ведут, используя повышение темп-ры, вытеснение адсорбата лучше сорбирующимся в-вом, снижение давления или комбинацию этих приемов. При термической десорбции насыщенный адсорбент нагревают путем прямого контакта с потоком водяного пара, горячего воздуха или инертного газа, либо нагревают через стенку с подачей отдувочного инертного газа. Интервал температур 100 -200°С обеспечивает десорбцию целевых компонентов, поглощенных активными углями, силикагелями и алюмогелями. Для десорбции примесей, поглощенных цеолитами, достаточны температуры от 200 до 400 0 С. Вытеснительная десорбция (холодная десорбция) основана на сорбируемости целевого компонента и вещества, используемого в качестве вытеснителя (десорбента). Для десорбции органических веществ можно использовать диоксид углерода, аммиак, воду, некоторые органические вещества. Десорбция снижением давления может быть реализована редуцированием давления в системе после насыщения поглотителя под избыточным давлением или созданием в системе разрежения при проведении стадии адсорбции под нормальным давлением. Время десорбции целевых компонентов (4. 94) где k∂ – константа скорости десорбции; εn – порозность слоя (εn= 1 — ρн /ρк); рк – кажущаяся плотность адсорбента; рн – насыпная плотность слоя гранул адсорбента; а 0 и а – соответственно начальная и текущая величина адсорбции.
Десорбция поглощенных примесей Адс-ные процессы носят циклический характер, т. к. необходима период. регенерация насыщенных целевыми компонентами поглотителей. Процесс извлечения адс. в-ва из адсорбента называется десорбцией. Освобожденный от поглощенного в-ва адсорбент м. б. использован вторично. Процесс десорбции ведут, используя повышение темп-ры, вытеснение адсорбата лучше сорбирующимся в-вом, снижение давления или комбинацию этих приемов. При термической десорбции насыщенный адсорбент нагревают путем прямого контакта с потоком водяного пара, горячего воздуха или инертного газа, либо нагревают через стенку с подачей отдувочного инертного газа. Интервал температур 100 -200°С обеспечивает десорбцию целевых компонентов, поглощенных активными углями, силикагелями и алюмогелями. Для десорбции примесей, поглощенных цеолитами, достаточны температуры от 200 до 400 0 С. Вытеснительная десорбция (холодная десорбция) основана на сорбируемости целевого компонента и вещества, используемого в качестве вытеснителя (десорбента). Для десорбции органических веществ можно использовать диоксид углерода, аммиак, воду, некоторые органические вещества. Десорбция снижением давления может быть реализована редуцированием давления в системе после насыщения поглотителя под избыточным давлением или созданием в системе разрежения при проведении стадии адсорбции под нормальным давлением. Время десорбции целевых компонентов (4. 94) где k∂ – константа скорости десорбции; εn – порозность слоя (εn= 1 — ρн /ρк); рк – кажущаяся плотность адсорбента; рн – насыпная плотность слоя гранул адсорбента; а 0 и а – соответственно начальная и текущая величина адсорбции.


