Теоретические основы аналитической химии.ppt
- Количество слайдов: 16
 Теоретические основы аналитической химии
Теоретические основы аналитической химии
 Предмет аналитической химии • Аналитическая химия – это наука, разрабатывающая теоретические основы и методы химического анализа. • Практическая задача аналитической химии – установление химического состава веществ или их смесей. • Задача качественного анализа – «открытие» отдельных элементов или ионов, входящих в состав веществ. • Задача количественного анализа – определение количественного содержания отдельных составных частей исследуемого вещества. • Качественный анализ предшествует количественному.
Предмет аналитической химии • Аналитическая химия – это наука, разрабатывающая теоретические основы и методы химического анализа. • Практическая задача аналитической химии – установление химического состава веществ или их смесей. • Задача качественного анализа – «открытие» отдельных элементов или ионов, входящих в состав веществ. • Задача количественного анализа – определение количественного содержания отдельных составных частей исследуемого вещества. • Качественный анализ предшествует количественному.
 Методы аналитической химии • Химический – определяемый элемент или ион переводят в какое-либо соединение, обладающее характерными свойствами на основании которых устанавливается, что образовалось именно это соединение. • Происходящее химическое превращение называют – аналитической реакцией, а вещество его вызывающее, - реагентом.
Методы аналитической химии • Химический – определяемый элемент или ион переводят в какое-либо соединение, обладающее характерными свойствами на основании которых устанавливается, что образовалось именно это соединение. • Происходящее химическое превращение называют – аналитической реакцией, а вещество его вызывающее, - реагентом.
 Физические методы • Спектральный анализ – исследует спектры излучения, возникающие при внесении вещества в пламя горелки, электрической дуги и т. д. • Присутствие элементов – по наличию в спектре линий; количество – по яркости линий • Метод чувствителен – может быть обнаружено • 10 -6 – 10 -8 г. • Люминесцентный анализ – наблюдаею люминесценцию т. е. свечение, вызываемое излучением. Цвет и интенсивность – аналитические признаки. Более чувствителен – 10 -10 г.
Физические методы • Спектральный анализ – исследует спектры излучения, возникающие при внесении вещества в пламя горелки, электрической дуги и т. д. • Присутствие элементов – по наличию в спектре линий; количество – по яркости линий • Метод чувствителен – может быть обнаружено • 10 -6 – 10 -8 г. • Люминесцентный анализ – наблюдаею люминесценцию т. е. свечение, вызываемое излучением. Цвет и интенсивность – аналитические признаки. Более чувствителен – 10 -10 г.
 Физико-химические методы • Колориметрический – основан на зависимости интенсивности окраски раствора от концентрации окрашенного вещества. • Хроматографический – исследуемый раствор пропускают через колонку твердого порошкообразного адсорбента, помещенного в стеклянную трубку. Так как способность к адсорбции различна, вещества разделяются и могут быть обнаружены на колонке либо по присущей им окраски, либо после обработки реагентами, образующими с веществами или ионами различно окрашенные соединения. • Физические и физико-химические методы объединяют общим названием – « инструментальные»
Физико-химические методы • Колориметрический – основан на зависимости интенсивности окраски раствора от концентрации окрашенного вещества. • Хроматографический – исследуемый раствор пропускают через колонку твердого порошкообразного адсорбента, помещенного в стеклянную трубку. Так как способность к адсорбции различна, вещества разделяются и могут быть обнаружены на колонке либо по присущей им окраски, либо после обработки реагентами, образующими с веществами или ионами различно окрашенные соединения. • Физические и физико-химические методы объединяют общим названием – « инструментальные»
 Методы качественного анализа • В зависимости от того, с какими количествами вещества оперируют при выполнении аналитических реакций, различают: • Макро- (исследуют большие количества веществ 0, 51 г или 20 -50 мл растворов) • Полумикро-(промежуточный между макро- и микро-; 1/20 -1/25 от макро- 50 мг или 1 мл) • Микро-(несколько мг или десятые доли мл т. е в 100 раз меньше, чем в макро- , реакции выполняют микрокристаллоскопическим или капельным методами)) • Ультрамикрометоды ( количество меньше 1 мг, все операции под микроскопом)
Методы качественного анализа • В зависимости от того, с какими количествами вещества оперируют при выполнении аналитических реакций, различают: • Макро- (исследуют большие количества веществ 0, 51 г или 20 -50 мл растворов) • Полумикро-(промежуточный между макро- и микро-; 1/20 -1/25 от макро- 50 мг или 1 мл) • Микро-(несколько мг или десятые доли мл т. е в 100 раз меньше, чем в макро- , реакции выполняют микрокристаллоскопическим или капельным методами)) • Ультрамикрометоды ( количество меньше 1 мг, все операции под микроскопом)
 Способы выполнения аналитических реакций • Выполняются «сухим» (исследуемое вещество и реагенты берут в твердом состоянии) и «мокрым» ( в растворах) путем. • Окрашивание пламени • Образование окрашенных перлов(стекол) – Na 2 B 4 O 7 x 10 H 2 O; Na. NH 4 HPO 4 x 4 H 2 O при сплавлении с солями некоторых металлов • Метод растирания (Ф. М. Флавицкий 1898 г), обнаружение кобальта: • Co. SO 4+4 NH 4 SCN = (NH 4)2[Co(SCN)4]+(NH 4)2 SO 4 • «Мокрый» метод – реакции в растворах, сопровождаются внешним эффектом
Способы выполнения аналитических реакций • Выполняются «сухим» (исследуемое вещество и реагенты берут в твердом состоянии) и «мокрым» ( в растворах) путем. • Окрашивание пламени • Образование окрашенных перлов(стекол) – Na 2 B 4 O 7 x 10 H 2 O; Na. NH 4 HPO 4 x 4 H 2 O при сплавлении с солями некоторых металлов • Метод растирания (Ф. М. Флавицкий 1898 г), обнаружение кобальта: • Co. SO 4+4 NH 4 SCN = (NH 4)2[Co(SCN)4]+(NH 4)2 SO 4 • «Мокрый» метод – реакции в растворах, сопровождаются внешним эффектом
 Общие реакции в качественном анализе • Групповые реакции. Групповые регенты одинаково реагируют с ионами одной группы. Требования к групповому реагенту: • 1)осаждает катионы практически количественно (после осаждения не больше 10 -6 г-ион/л); • 2)полученный осадок легко растворяется в кислотах, чтобы можно было провести дальнейший анализ; • 3)избыток реагента не должен мешать обнаружению ионов оставшихся в растворе • Селективные реакции – реакции, дающие сходный аналитический эффект с ограниченным числом ионов • Специфические – если при действии реактива в определенных условиях однозначно идентифицируют только один элемент или один ион.
Общие реакции в качественном анализе • Групповые реакции. Групповые регенты одинаково реагируют с ионами одной группы. Требования к групповому реагенту: • 1)осаждает катионы практически количественно (после осаждения не больше 10 -6 г-ион/л); • 2)полученный осадок легко растворяется в кислотах, чтобы можно было провести дальнейший анализ; • 3)избыток реагента не должен мешать обнаружению ионов оставшихся в растворе • Селективные реакции – реакции, дающие сходный аналитический эффект с ограниченным числом ионов • Специфические – если при действии реактива в определенных условиях однозначно идентифицируют только один элемент или один ион.
 Условия выполнения реакций • 1. Реакция среды • 2. Температура • 3. Достаточно большая концентрация • Чувствительность реакции – возможность четко и надежно идентифицировать небольшие количества компонентов, количественно характеризуется двумя показателями – открываемый минимум и предельное разбавление. • Открываемый минимум(m) – это наименьшее количество вещества или иона, которое может быть обнаружено посредством данной реакции при определенных условиях ее выполнения.
Условия выполнения реакций • 1. Реакция среды • 2. Температура • 3. Достаточно большая концентрация • Чувствительность реакции – возможность четко и надежно идентифицировать небольшие количества компонентов, количественно характеризуется двумя показателями – открываемый минимум и предельное разбавление. • Открываемый минимум(m) – это наименьшее количество вещества или иона, которое может быть обнаружено посредством данной реакции при определенных условиях ее выполнения.
 Условия выполнения реакций • Предельное разбавление –характеризует наименьшую концентрацию вещества (иона), при которой обнаружение его посредством данной реакции еще возможно (1: g)
Условия выполнения реакций • Предельное разбавление –характеризует наименьшую концентрацию вещества (иона), при которой обнаружение его посредством данной реакции еще возможно (1: g)
 Определение чувствительности реакций • 2 Ag+ + Cr. O 42 - =Ag 2 Cr. O 4 для определения чувствительности приготовлен нитрат серебра, содержащий 1 г Ag+ т. е. (1, 57 г регента) в 1 л. Было найдено, что при разбавлении этого раствора в 25 раз реакция удается, но при более сильном разбавлении становится ненадежной. Определить открываемый минимум и предельное разбавление для этой реакции при условии, что она получается с каплей раствора объемом 0, 02 мл.
Определение чувствительности реакций • 2 Ag+ + Cr. O 42 - =Ag 2 Cr. O 4 для определения чувствительности приготовлен нитрат серебра, содержащий 1 г Ag+ т. е. (1, 57 г регента) в 1 л. Было найдено, что при разбавлении этого раствора в 25 раз реакция удается, но при более сильном разбавлении становится ненадежной. Определить открываемый минимум и предельное разбавление для этой реакции при условии, что она получается с каплей раствора объемом 0, 02 мл.
 Решение • • • Предельное разбавление составляет 1/G=масса. Ag+/масса воды=1: 25000 Открываемый минимум: В 25000 мл - 1 г ионов серебра В 0, 02 мл - х Х = 0, 8 мкг • Между открываемым минимумом и предельным разбавлением существует зависимость: • m=1/g V 106 V - объем раствора в мл, который берут для выполнения реакции
Решение • • • Предельное разбавление составляет 1/G=масса. Ag+/масса воды=1: 25000 Открываемый минимум: В 25000 мл - 1 г ионов серебра В 0, 02 мл - х Х = 0, 8 мкг • Между открываемым минимумом и предельным разбавлением существует зависимость: • m=1/g V 106 V - объем раствора в мл, который берут для выполнения реакции
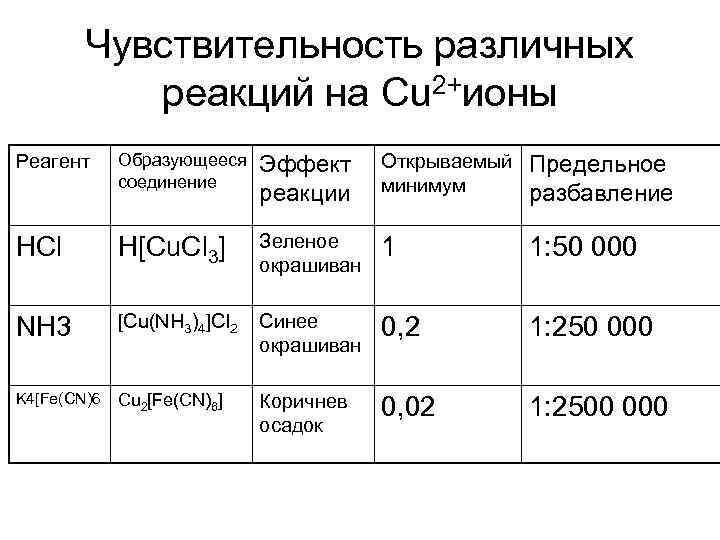 Чувствительность различных реакций на Cu 2+ионы Реагент Образующееся соединение Эффект реакции Открываемый минимум Предельное разбавление HCl H[Cu. Cl 3] Зеленое окрашиван 1 1: 50 000 NH 3 [Cu(NH 3)4]Cl 2 Синее окрашиван 0, 2 1: 250 000 K 4[Fe(CN)6 Cu 2[Fe(CN)6] Коричнев осадок 0, 02 1: 2500 000
Чувствительность различных реакций на Cu 2+ионы Реагент Образующееся соединение Эффект реакции Открываемый минимум Предельное разбавление HCl H[Cu. Cl 3] Зеленое окрашиван 1 1: 50 000 NH 3 [Cu(NH 3)4]Cl 2 Синее окрашиван 0, 2 1: 250 000 K 4[Fe(CN)6 Cu 2[Fe(CN)6] Коричнев осадок 0, 02 1: 2500 000
 • Наиболее чувствительна реакция с гексацианоферратом калия позволяющая обнаружить в 50 раз меньшее количество, чем при действии соляной кислоты, и в 10 раз меньшее, чем при действии аммиака
• Наиболее чувствительна реакция с гексацианоферратом калия позволяющая обнаружить в 50 раз меньшее количество, чем при действии соляной кислоты, и в 10 раз меньшее, чем при действии аммиака
 Дробный и систематический анализ • Дробный – ионы обнаруживаются непосредственно в отдельных порциях исследуемого раствора, не считаясь с тем, какие другие ионы содержатся в нем; при этом не имеет значение порядок обнаружения ионов. • Систематический –к обнаружению каждого данного иона приступают лишь после того, как все другие ионы, мешающие его обнаружению, будут предварительно обнаружены и удалены из раствора. • Полнота осаждения – отделяется выпавший осадок, а к раствору снова прибавляется реагент. • Реакции обнаружения и отделения
Дробный и систематический анализ • Дробный – ионы обнаруживаются непосредственно в отдельных порциях исследуемого раствора, не считаясь с тем, какие другие ионы содержатся в нем; при этом не имеет значение порядок обнаружения ионов. • Систематический –к обнаружению каждого данного иона приступают лишь после того, как все другие ионы, мешающие его обнаружению, будут предварительно обнаружены и удалены из раствора. • Полнота осаждения – отделяется выпавший осадок, а к раствору снова прибавляется реагент. • Реакции обнаружения и отделения
 Задачи и вопросы • 1. При микрокристаллоскопическом обнаружении ионов кальция в виде оксалата, реакция удается уже с 0, 001 мл 0, 002 н раствора хлорида кальция. Вычислить открываемый минимум и предельное растворение. • 2. Предельное разбавление для реакции К+ с раствором Na. HC 4 H 4 O 6 равно 1: 1000. Чему равна наименьшая нормальная концентрация раствора хлорида калия, при которой ион калия может быть обнаружен данной реакцией.
Задачи и вопросы • 1. При микрокристаллоскопическом обнаружении ионов кальция в виде оксалата, реакция удается уже с 0, 001 мл 0, 002 н раствора хлорида кальция. Вычислить открываемый минимум и предельное растворение. • 2. Предельное разбавление для реакции К+ с раствором Na. HC 4 H 4 O 6 равно 1: 1000. Чему равна наименьшая нормальная концентрация раствора хлорида калия, при которой ион калия может быть обнаружен данной реакцией.


