Khimichny_zvyazok_ta_budova_molekul.ppt
- Количество слайдов: 34

Тема: ХІМІЧНИЙ ЗВ’ЯЗОК ТА БУДОВА МОЛЕКУЛ 1. Види хімічних зв’язків 2. Основні характеристики ковалентного зв’язку 3. Гібридизація атомних орбіталей (АО) і геометрична форма молекул 4. Донорно-акцепторний (координаційний) зв’язок 5. Водневий зв’язок 6. Міжмолекулярні сили. Сили Ван-дер-Ваальса 7. Йонний зв’язок 8. Металічний зв’язок 9. Будова йонних сполук 10. Електронегативність

ВИДИ ХІМІЧНИХ ЗВ'ЯЗКІВ Вид хімічного зв'язку Визначення Йонний Зв'язок між йонами, що здійснюється завдяки електростатичному притяганню між ними Ковалентний Зв'язок атомів за допомогою спільних електронних пар. або це зв'язок, що утворюється в результаті перекривання електронних орбіталей атомів Донорно акцепторний Металічний Зв'язок між атомами, один з яких має неподілену пару електронів, а інший вільну атомну орбіталь Зв‘язок у металах та сплавах між позитивно зарядженими йонами та валентними електронами, що є спільними для всіх йонів Водневий Трицентровий зв'язок між двома електронегативними (міжмолеку л атомами, що здійснюється через атом Гідрогену ярний)
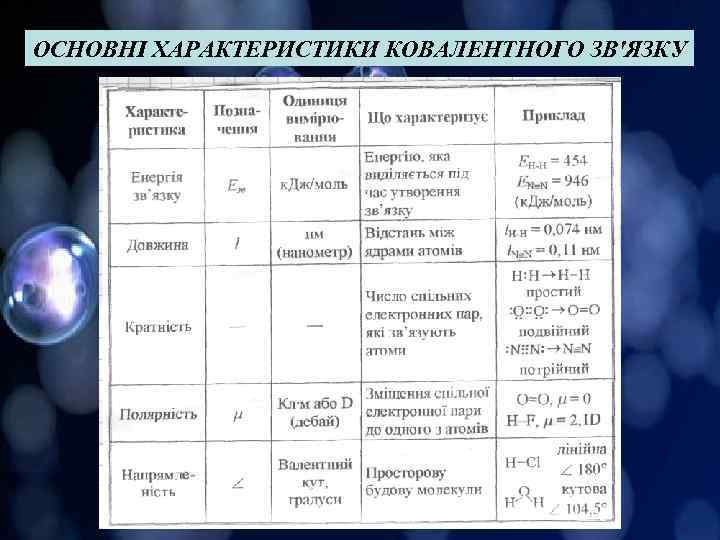
ОСНОВНІ ХАРАКТЕРИСТИКИ КОВАЛЕНТНОГО ЗВ'ЯЗКУ

Ковалентний зв‘язок виникає між атомами. Ковалентний зв'язок виникає між атомами не внаслідок переходу електронів від одного атома до іншого, а завдяки виникненню між атомами однієї або кількох спільних електронних пар. Спільні електронні пари між атомами виникають за рахунок неспарених електронів, які є в атомі і беруть участь в утворенні хімічного зв'язку. Ці електрони називаються валентними. Ковалентний зв'язок, у разі утворення якого електронна пара зміщується в бік одного з атомів, називається полярним зв'язком. Полярний ковалентний зв'язок Перекривання електронних хмар атомів Неполярний ковалентний зв'язок
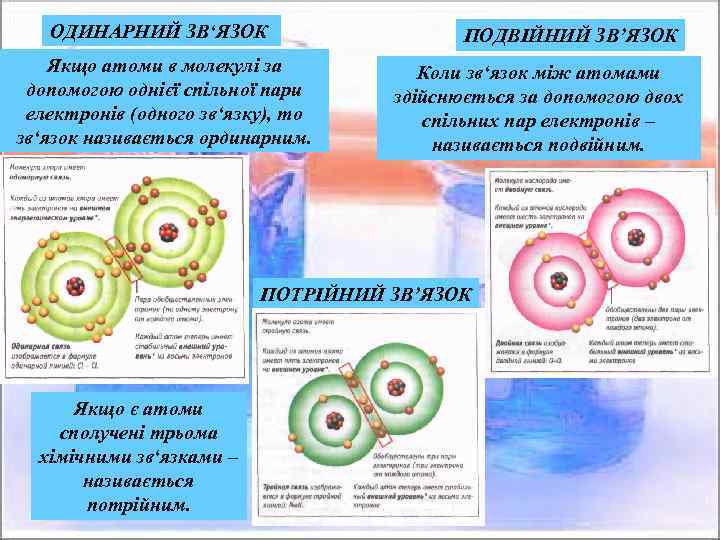
ОДИНАРНИЙ ЗВ‘ЯЗОК Якщо атоми в молекулі за допомогою однієї спільної пари електронів (одного зв‘язку), то зв‘язок називається ординарним. ПОДВІЙНИЙ ЗВ’ЯЗОК Коли зв‘язок між атомами здійснюється за допомогою двох спільних пар електронів – називається подвійним. ПОТРІЙНИЙ ЗВ’ЯЗОК Якщо є атоми сполучені трьома хімічними зв‘язками – називається потрійним.

КОВАЛЕНТНИЙ ЗВ’ЯЗОК Полярність ковалентного зв'язку. Якщо молекула (А—А) утворена двома однаковими атомами то електронна пара однаковою мірою належить обом атомам, тобто електронна пара розміщується симетрично відносно зв'язаних атомів. Такий зв'язок є неполярним, його дипольний момент μ дорівнює нулю. У молекулі (А—В) утвореній двома атомами з різними значеннями електронегативностей, електронна пара зміщена до одного з атомів, що характеризується більшою електронегативністю. Такий зв'язок називають полярним, а відповідні молекули - полярними. У полярних молекулах утворюється електричний диполь, який є системою з віддаленими у просторі різнойменними зарядами. Сумарний дипольний момент молекули дорівнює векторній сумі дипольних моментів окремих зв'язків. Наприклад, для молекул його визначають так: Значення дипольних моментів ковалентних молекул знаходяться в межах 0 - 4 D, а йонних 4 - 11 D, вони наводяться у таблицях.
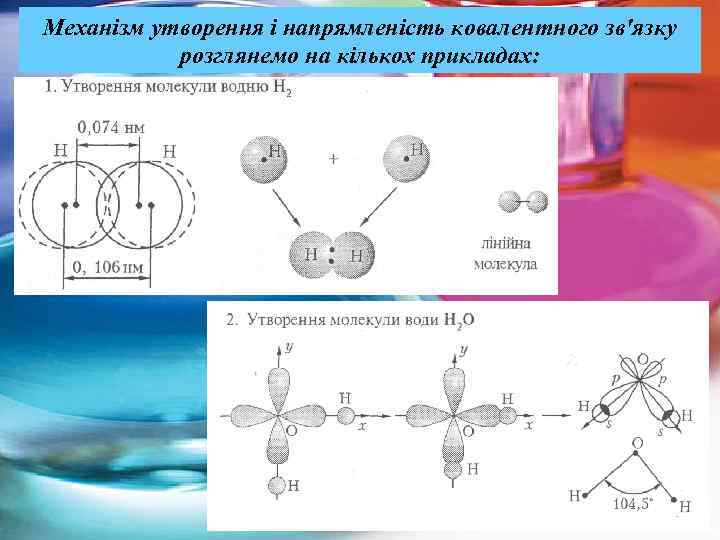
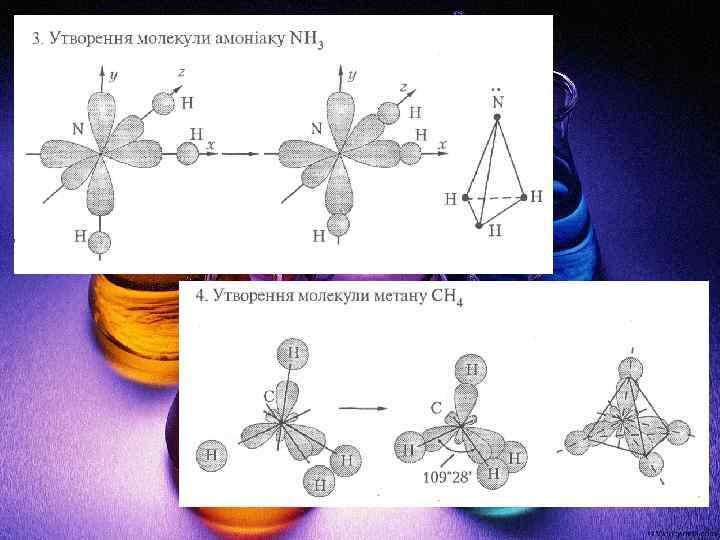
Механізм утворення і напрямленість ковалентного зв'язку розглянемо на кількох прикладах:
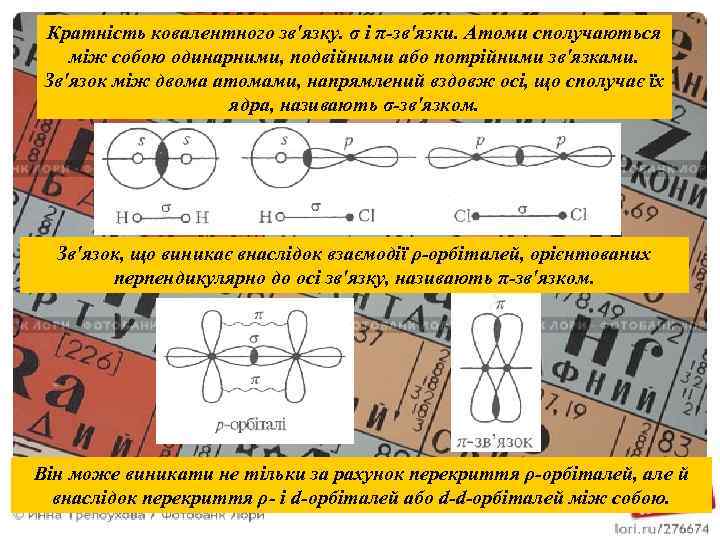
Кратність ковалентного зв'язку. σ і π-зв'язки. Атоми сполучаються між собою одинарними, подвійними або потрійними зв'язками. Зв'язок між двома атомами, напрямлений вздовж осі, що сполучає їх ядра, називають σ-зв'язком. Зв'язок, що виникає внаслідок взаємодії ρ-орбіталей, орієнтованих перпендикулярно до осі зв'язку, називають π-зв'язком. Він може виникати не тільки за рахунок перекриття ρ-орбіталей, але й внаслідок перекриття ρ- і d-орбіталей або d-d-орбіталей між собою.


Отже, ковалентний зв'язок утворюють атоми однакової хімічної природи, близькі за хімічними властивостями. У молекулі атоми утримуються разом за допомогою спільних електронних пар, отже хімічний зв'язок локалізований між двома атомами. Фактично ковалентний зв'язок утворюється внаслідок перекривання атомних орбіталей, тобто в просторі між зв'язаними атомами електронна густина підвищенна.

Хімічний зв'язок, у якому електронна пара належить одночасно двом атомам (двоцентровий зв'язок), називають локалізованим. Якщо при утворенні зв'язку електронні пари розмішуються між кількома атомами, то його називають нелокалізованим. Це — багатоцентровий зв'язок. Він є проміжним між одинарним і подвійним, тому його кратність характеризують дробовим числом. Прикладом може бути карбонат або нітрат-іони, а також нітратна кислота чи оксид нітрогену(V): Як видно з рисунків, у графічних формулах делокалізований зв'язок зображують штриховою лінією.

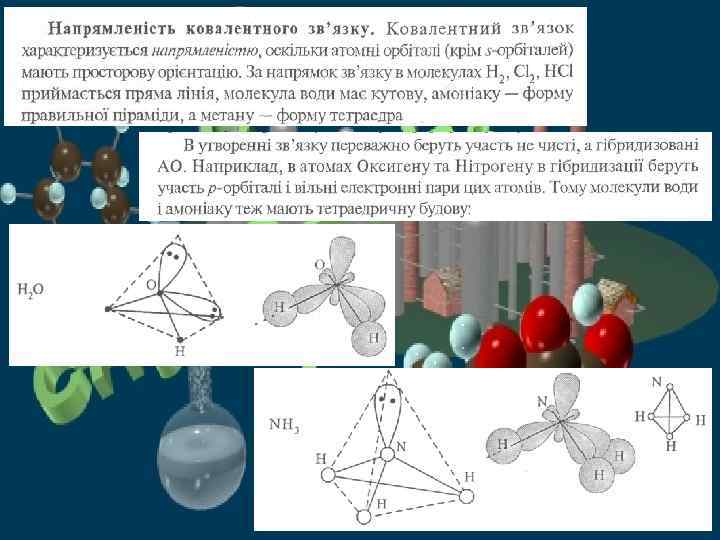
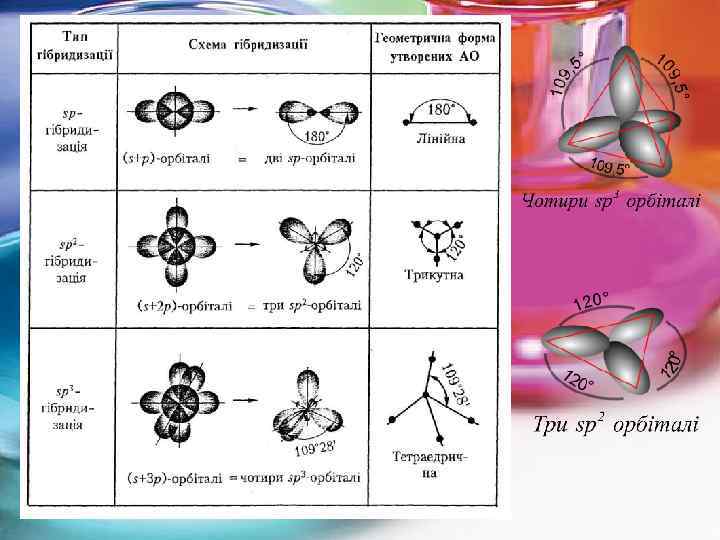
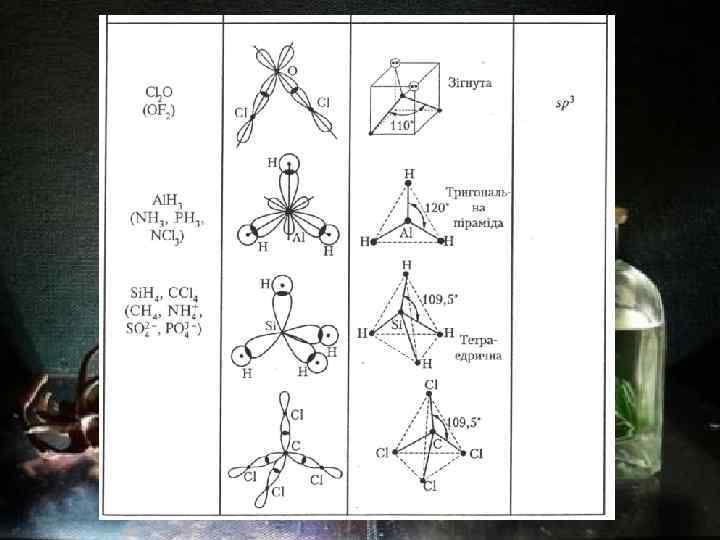
Гібридизація АО і геометрична форма молекул Зміну форми атомних орбіталей при утворенні хімічного зв'язку називають гібридизацією. Гібридизація орбіталей – суперпозиція різних, але близьких за енергією орбіталей даного атома, з виникненням того ж числа нових гібридних орбіталей, однакових за енергією. Гібридизація атомних орбіталей відбувається при виникненні ковалентних зв’язків між атомами. Атомні орбіталі одного енергетичного рівня, наприклад s- і p-орбіталі з різною симетрією, після гібридизації набувають однакової форми. Причому число гібридизованих орбіталей дорівнює числу орбіталей, які беруть участь в процесі гібридизації. Тип гібридизації визначається типом АО, що беруть участь у цьому процесі і їх кількістю. Основні типи гібридизації АО
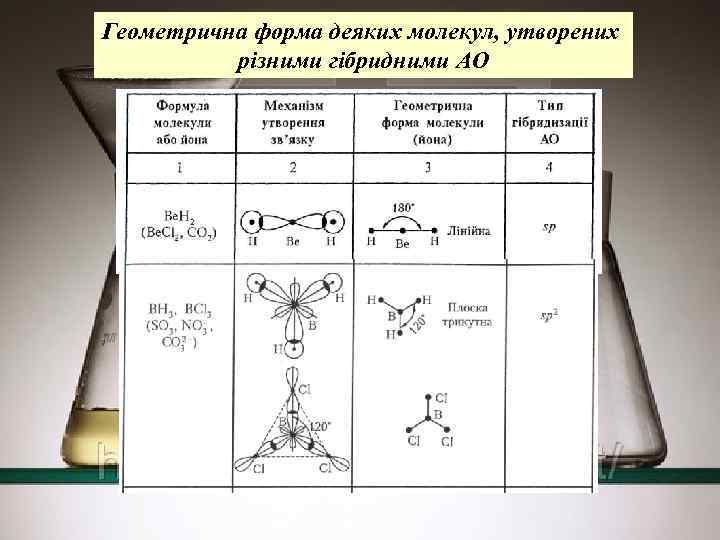
Геометрична форма деяких молекул, утворених різними гібридними АО

ДОНОРНО-АКЦЕПТОРНИЙ (КООРДИНАЦІЙНИЙ) ЗВ'ЯЗОК Координаційний зв'язок виникає між атомами, внаслідок узагальнення неподіленої електронної пари, що належала одному з них. Розглянемо на двох прикладах: 1. Утворення катіона амонію 2. Утворення катіона гідроксонію
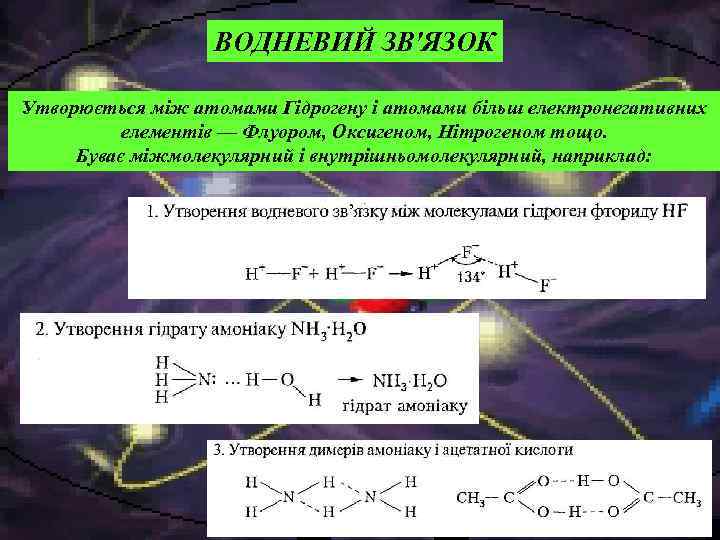
ВОДНЕВИЙ ЗВ'ЯЗОК Утворюється між атомами Гідрогену і атомами більш електронегативних елементів — Флуором, Оксигеном, Нітрогеном тощо. Буває міжмолекулярний і внутрішньомолекулярний, наприклад:
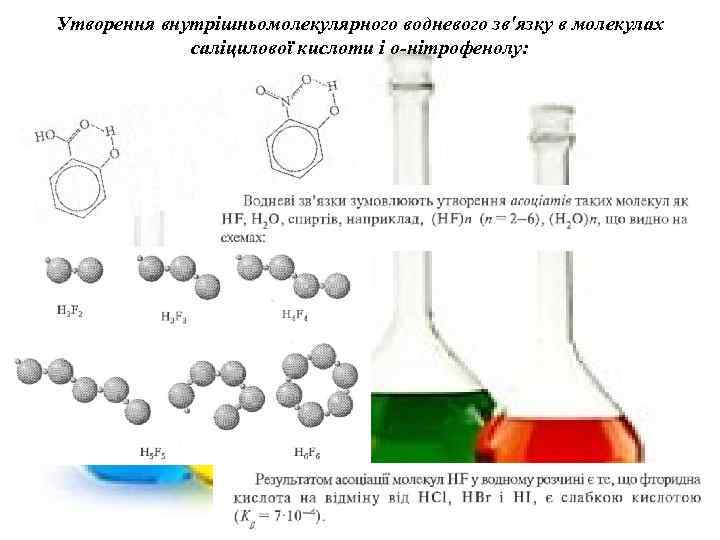
Утворення внутрішньомолекулярного водневого зв'язку в молекулах саліцилової кислоти і о-нітрофенолу:
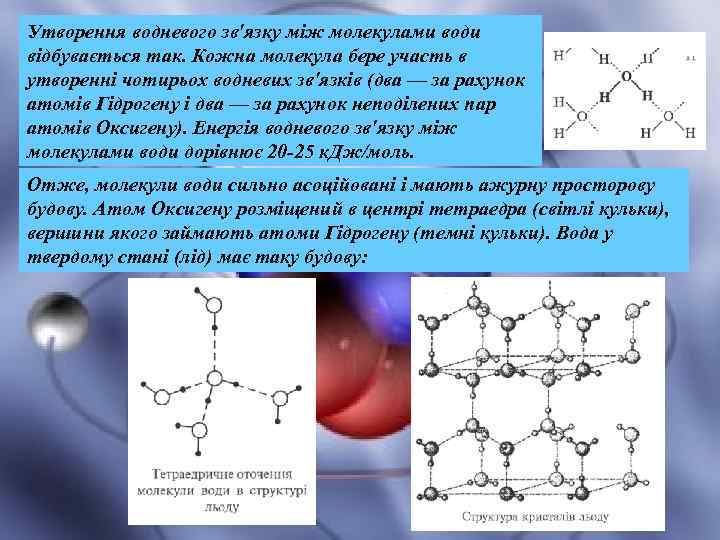
Утворення водневого зв'язку між молекулами води відбувається так. Кожна молекула бере участь в утворенні чотирьох водневих зв'язків (два — за рахунок атомів Гідрогену і два — за рахунок неподілених пар атомів Оксигену). Енергія водневого зв'язку між молекулами води дорівнює 20 -25 к. Дж/моль. Отже, молекули води сильно асоційовані і мають ажурну просторову будову. Атом Оксигену розміщений в центрі тетраедра (світлі кульки), вершини якого займають атоми Гідрогену (темні кульки). Вода у твердому стані (лід) має таку будову:

МІЖМОЛЕКУЛЯРНІ СИЛИ Сили Ван-дер-Ваальса Слабкі сили притягання між молекулами (міжмолекулярні сили), обумовлені нерівномірним розподілом і рухом електронів в атомах молекул. Сила притягання приблизно у двадцять разів менша, ніж у йонному зв’язку. Це сила, яка зкріплює молекулярні решітки, наприклад, йоду та твердого карбон(IV) оксид. Слабі Ван-дер-Ваальси сили скріплюють цю молекулярну решітку йоду. Атоми йоду у молекулах з’єднані ковалентним зв’язком

Йонний зв'язок виникає між типовими металами, які легко віддають валентні електрони і типовими неметалами, які приєднують їх. Вважають, що різниця відносних електронегативностей ΔХ йонного зв'язку має бути більше як 2, 1. Механізм утворення цього зв'язку розглянемо на прикладах:

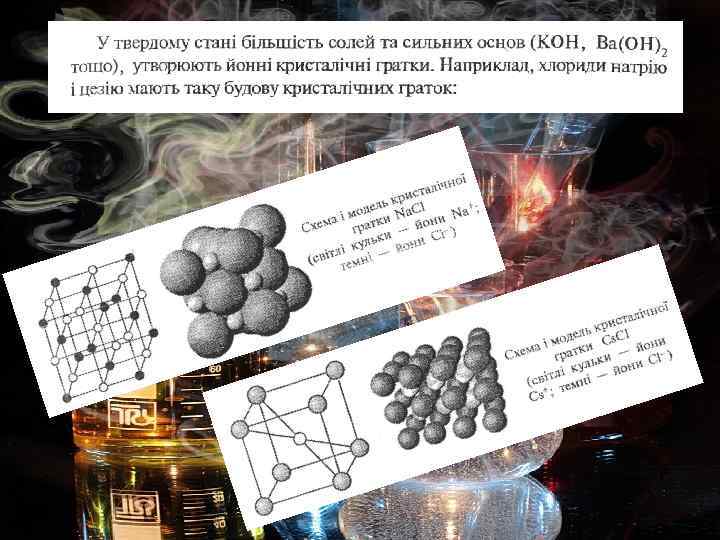
Сполук з чисто йонним зв'язком відомо небагато. Це, наприклад, фториди лужних і лужноземельних металів (ΔХ ≈ 2, 8 ÷ 3, 2). В інших сполуках металів з неметалами зв'язок має проміжний характер між йонним і ковалентним полярним.

МЕТАЛІЧНИЙ ЗВ'ЯЗОК Металічний зв'язок – це притягання між частинками в металічній гратці (тобто, в металах). Гратка складається із позитивних йонів металу з валентними електронами, які вільно переміщуються між ними. Вільні, або делокалізовані електрони утворюють зв’язви між йонами. Сили взаємодії між електронами і йонами в металах доволі великі. Для їх подолання необхідно більше енергії, тому метали мають високі точки плавлення та кипіння. Метали здатні проводити тепло та електричний струм. ДЕЛОКАЛІЗАЦІЯ Узагальнення валентних електронів всіма атомами в молекулі або металічній кристалічні гратці. Делокалізовані електрони можуть належати будь-якому із атомів у гратці та здатні переміщуватись по решітці, тому метал може проводити електричний струм і тепло.
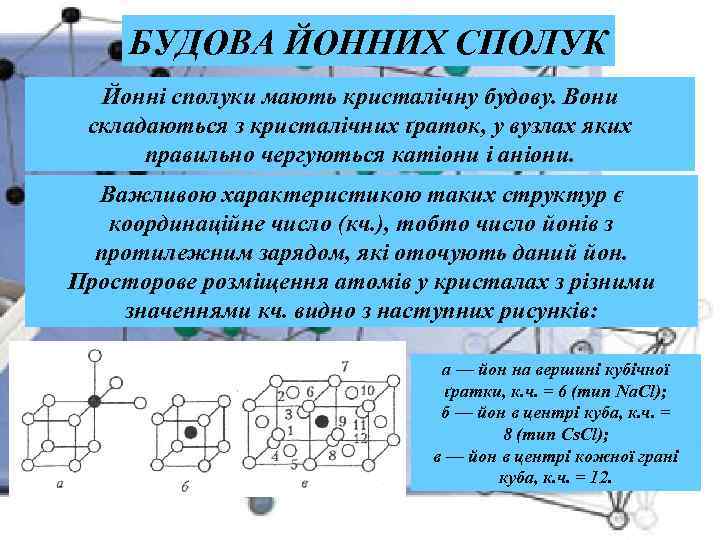
БУДОВА ЙОННИХ СПОЛУК Йонні сполуки мають кристалічну будову. Вони складаються з кристалічних ґраток, у вузлах яких правильно чергуються катіони і аніони. Важливою характеристикою таких структур є координаційне число (кч. ), тобто число йонів з протилежним зарядом, які оточують даний йон. Просторове розміщення атомів у кристалах з різними значеннями кч. видно з наступних рисунків: а — йон на вершині кубічної ґратки, к. ч. = 6 (тип Nа. Сl); б — йон в центрі куба, к. ч. = 8 (тип Cs. Cl); в — йон в центрі кожної грані куба, к. ч. = 12.
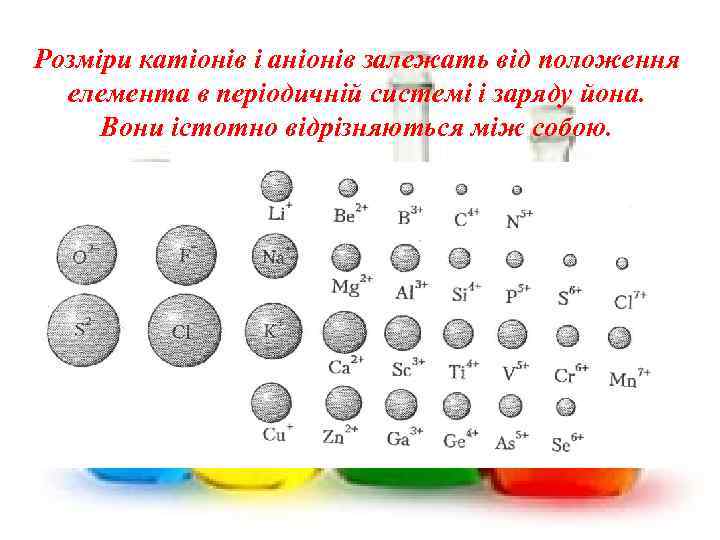
Розміри катіонів і аніонів залежать від положення елемента в періодичній системі і заряду йона. Вони істотно відрізняються між собою.

ВИДИ ХІМІЧНОГО ЗВ'ЯЗКУ І БУДОВА ДЕЯКИХ МОЛЕКУЛ
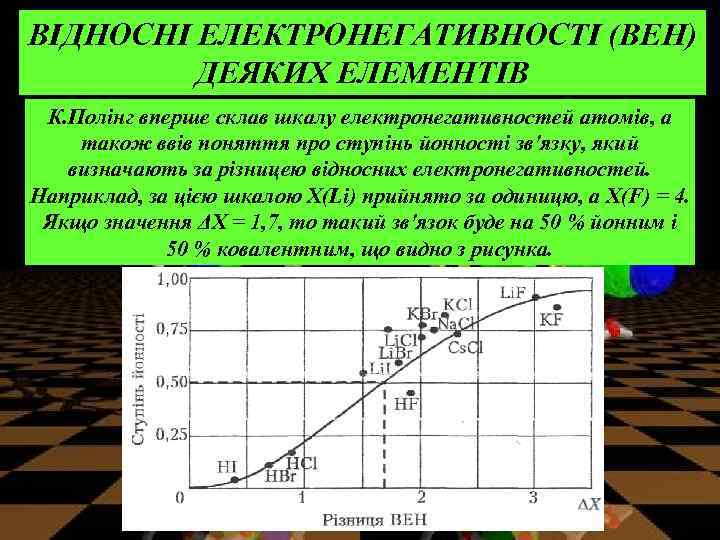
ВІДНОСНІ ЕЛЕКТРОНЕГАТИВНОСТІ (ВЕН) ДЕЯКИХ ЕЛЕМЕНТІВ К. Полінг вперше склав шкалу електронегативностей атомів, а також ввів поняття про ступінь йонності зв'язку, який визначають за різницею відносних електронегативностей. Наприклад, за цією шкалою Х(Lі) прийнято за одиницю, а Х(F) = 4. Якщо значення ΔХ = 1, 7, то такий зв'язок буде на 50 % йонним і 50 % ковалентним, що видно з рисунка.

Відносна електронегативність характеризує здатність атома стягувати на себе спільні електронні пари. За різницею ВЕН атомів можна встановити характер хімічного зв'язку, оскільки у багатьох сполуках зв'язок між атомами має проміжний характер між йонним і ковалентним. Відносні електронегативності (ВЕН) деяких елементів (за Полінгом)

Взаємозв'язок ВЕН з типом ХЗ і властивостями речовин
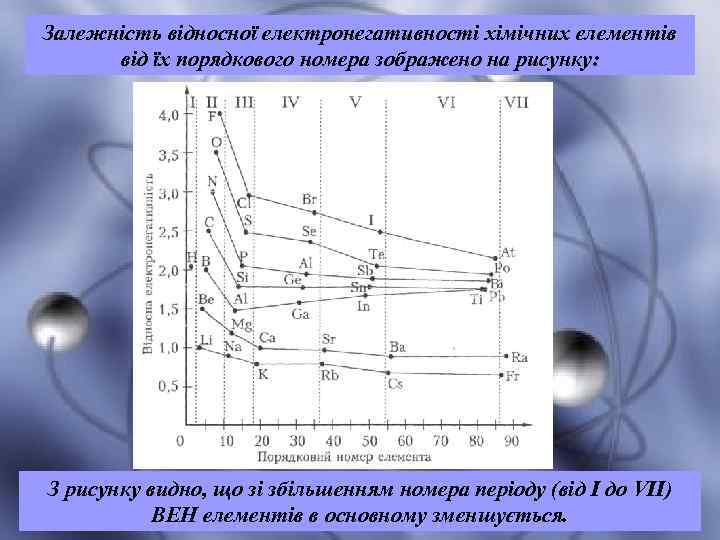
Залежність відносної електронегативності хімічних елементів від їх порядкового номера зображено на рисунку: З рисунку видно, що зі збільшенням номера періоду (від І до VII) ВЕН елементів в основному зменшується.

ЛІТЕРАТУРА 1. Романова Н. В. Загальна та неорганічна хімія: - К. , Ірпінь: ВТФ «Перун» , 1998. – 480 с. 2. Слободяник М. С. , Гордієнко О. В. , Корнілов М. Ю. , Павленко В. О. , Пономарьова В. В. Хімія: Навч. посібник. – К. : Либідь, 2003. – 352 с.
Khimichny_zvyazok_ta_budova_molekul.ppt