СРС по органической химии 97,2003.ppt
- Количество слайдов: 12

Тема: Химические и физические свойства карбоновых кислот. Свойства муравьиной и уксусной кислоты. Работу выполнили : Мустафаев А. и Рзаев Т. ХТМб 11 1

Карбоновые кислоты Физические свойства карбоновых кислот. Низшие карбоновые кислоты — жидкости с ост рым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а темпера тура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н нонановой) СН 3 (СН 2)7 СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота. На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи в них в большей степени поляризованы по типу Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.

Химические свойства карбоновых кислот 1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску): СH 3–COOH ↔ СH 3–COO + H+ 2. Взаимодействие с металлами, стоящими в электрохимическом ряду напряжений до водорода: 2 СН 3 СООН + Мg = H 2 + ( CH 3 COO)2 Mg 2 СН 3 СООН + Zn = H 2 + ( CH 3 COO)2 Zn Наиболее важные химические свойства, характерные для большинства карбоновых кислот: 3. Карбоновые кислоты при реакции с металлами, их оксидами или их осно вными гидроксидами дают соли соответствующих металлов: 4. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например: 5. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации): 6. При нагревании аммонийных солей карбоновых кислот образуются их амиды: 7. Под действием карбоновые кислоты превращаются в соответствующие хлорангидриды: 8. Взаимодействие уксусной кислоты с карбонатом натрия 2 СН 3 СООН + Na 2 CO 3 = H 2 O + CO 2 + 2 CH 3 COONa

Характерные свойства для карбоновых кислот 1. Реакция этерификации СН 3 СООН + СН 3 ОН→СН 3 СООСН 3+Н 2 О уксусная к та метанол метилацетат 2. Реакции замещения галогенирование СН 3 – СООН + Cl 2→CH 2 Cl – COOH + HCl хлоруксусная кислота 3. Горение уксусной кислоты СН 3 СООН + 2 О 2 = 2 H 2 О + 2 СО 2

Муравьиная кислота Физические и термодинамические свойства При нормальных условиях муравьиная кислота представляет собой бесцветную жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом

Свойства муравьиной кислоты Давление паров 120 мм. рт. ст. (при 50 °C) Стандартная энтальпия образования ΔH − 409, 19 к. Дж/моль (ж) (при 298 К) Стандартная энергия Гиббса образования G − 346 к. Дж/моль (ж) (при 298 К) Стандартная энтропия образования S 128, 95 Дж/моль·K (ж) (при 298 К) Стандартная мольная теплоёмкость Cp 98, 74 Дж/моль·K (ж) (при 298 К) Энтальпия плавления ΔHпл 12, 72 к. Дж/моль Энтальпия кипения ΔHкип 22, 24 к. Дж/моль Теплота сгорания -ΔH° 298 (конечные вещества CO 2, H 2 O) 254, 58 к. Дж/моль

Плотность водных растворов муравьиной кислоты при 20 °C Массо вое содер 1 жание HCOO H, % ρ, г/см³ 2 4 6 8 10 12 14 16 18 22 26 30 1, 0020 1, 0045 1, 0094 1, 0142 1, 0197 1, 0247 1, 0297 1, 0346 1, 0394 1, 0442 1, 0538 1, 0634 1, 0730 Поверхностное натяжение муравьиной кислоты Температура, °C 15 20 30 σ, Н/м 3, 813· 10− 2 3, 758· 10− 2 3, 648· 10− 2 Температура кипения при давлениях ниже атмосферного Давление, к. Па 0, 133(1) (мм. рт. ст. ) 0, 667(5) 1, 333(10) 2, 666(20) 5, 333(40) Tкип, °C − 5, 0 (кр. ) +2, 1 (кр. ) 10, 3 24, 0 Давление, к. Па 7, 999(60) (мм. рт. ст. ) 13, 333(100) 26, 66(200) 53, 33(400) 101, 32(760) Tкип, °C 43, 8 61, 4 80, 3 100, 7 − 20, 0 (кр. ) 32, 4
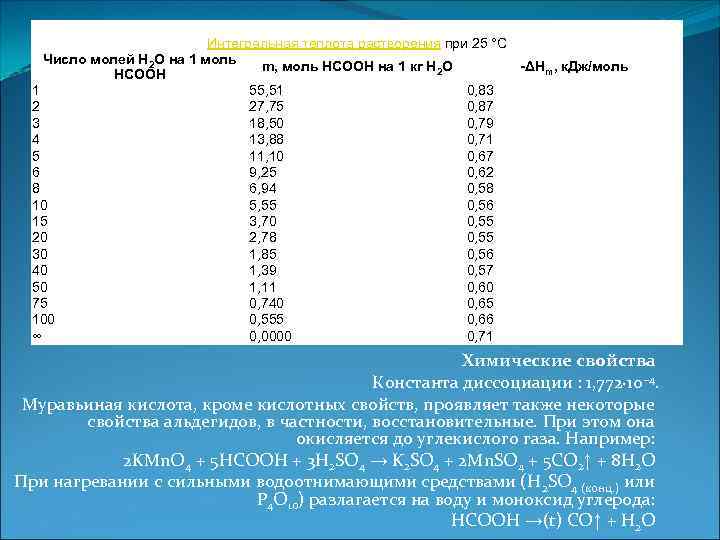
Интегральная теплота растворения при 25 °C Число молей H 2 O на 1 моль m, моль HCOOH на 1 кг H 2 O -ΔHm, к. Дж/моль HCOOH 1 55, 51 0, 83 2 27, 75 0, 87 3 18, 50 0, 79 4 13, 88 0, 71 5 11, 10 0, 67 6 9, 25 0, 62 8 6, 94 0, 58 10 5, 55 0, 56 15 3, 70 0, 55 20 2, 78 0, 55 30 1, 85 0, 56 40 1, 39 0, 57 50 1, 11 0, 60 75 0, 740 0, 65 100 0, 555 0, 66 ∞ 0, 0000 0, 71 Химические свойства Константа диссоциации : 1, 772· 10− 4. Муравьиная кислота, кроме кислотных свойств, проявляет также некоторые свойства альдегидов, в частности, восстановительные. При этом она окисляется до углекислого газа. Например: 2 KMn. O 4 + 5 HCOOH + 3 H 2 SO 4 → K 2 SO 4 + 2 Mn. SO 4 + 5 CO 2↑ + 8 H 2 O При нагревании с сильными водоотнимающими средствами (H 2 SO 4 (конц. ) или P 4 O 10) разлагается на воду и моноксид углерода: HCOOH →(t) CO↑ + H 2 O

Уксусная кислота Физические свойства Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислымвкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров. Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа). Давление паров (в мм. рт. ст. ): 10 (17, 1 °C) 40 (42, 4 °C) 100 (62, 2 °C) 400 (98, 1 °C) 560 (109 °C) 1520 (143, 5 °C) 3800 (180, 3 °C) Диэлектрическая проницаемость: 6, 15 (20 °C) Динамическая вязкость жидкостей и газов (в м. Па·с): 1, 155 (25, 2 °C); 0, 79 (50 °C) Поверхностное натяжение: 27, 8 м. Н/м (20 °C) Удельная теплоемкость при постоянном давлении: 2, 01 Дж/г·K (17 °C) Стандартная энергия Гиббса образования Δf. G 0 (298 К, к. Дж/моль): − 392, 5 (ж) Стандартная энтропия образования Δf. S 0 (298 К, Дж/моль·K): 159, 8 (ж) Энтальпия плавления ΔHпл: 11, 53 к. Дж/моль Температура вспышки в воздухе: 38 °C Температура самовоспламенения на воздухе: 454 °C Теплота сгорания: 876, 1 к. Дж/моль Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
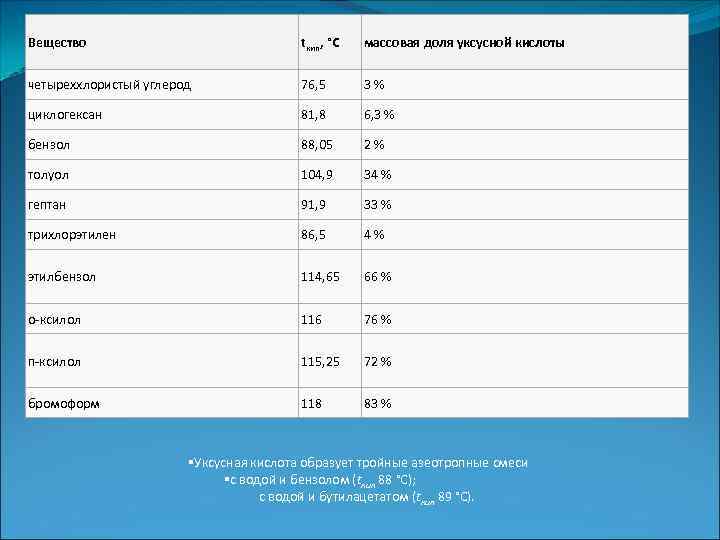
Вещество tкип, °C массовая доля уксусной кислоты четыреххлористый углерод 76, 5 3 % циклогексан 81, 8 6, 3 % бензол 88, 05 2 % толуол 104, 9 34 % гептан 91, 9 33 % трихлорэтилен 86, 5 4 % этилбензол 114, 65 66 % о-ксилол 116 76 % п-ксилол 115, 25 72 % бромоформ 118 83 % Уксусная кислота образует тройные азеотропные смеси с водой и бензолом (tкип 88 °C); с водой и бутилацетатом (tкип 89 °C).

Химические свойства Уксусная кислота обладает всеми свойствами карбоновых кислот. Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства. В результате диссоциации уксусной кислоты образуется ацетат-ион CH 3 COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением p. Ka в водном растворе равным 4, 75. Раствор с концентрацией 1. 0 M (приблизительная концентрация пищевого уксуса) имеет p. H 2, 4, что соответствует степени диссоциации 0, 4 %. Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями. Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты. Mg(тв) + 2 CH 3 COOH → (CH 3 COO)2 Mg + H 2 Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота. CH 3 COOH + Cl 2 → CH 2 Cl. COOH + HCl Этим путем могут быть получены также дихлоруксусная (CHCl 2 COOH) и трихлоруксусная (CCl 3 COOH) кислоты.

итог: Уксусная кислота вступает во все реакции, характерные для карбоновых кислот. Она может быть восстановлена до этанола действием алюмогидрида лития. Уксусная кислота также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусный кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана.
СРС по органической химии 97,2003.ppt