ЛК6 Хим.кинетика.pptx
- Количество слайдов: 18
 Тема: ХИМИЧЕСКАЯ КИНЕТИКА ПЛАН: 1. Основные понятия химической кинетики 2. Влияние природы реагирующих веществ. Закон действующих масс 3. Зависимость скорости химической реакции от температуры
Тема: ХИМИЧЕСКАЯ КИНЕТИКА ПЛАН: 1. Основные понятия химической кинетики 2. Влияние природы реагирующих веществ. Закон действующих масс 3. Зависимость скорости химической реакции от температуры
 Subject: Chemical Kinetics PLAN: 1. Basic concepts of chemical kinetics 2. Effect of the nature of the reactants. Law of mass action 3. The dependence of the chemical reaction rate of temperature
Subject: Chemical Kinetics PLAN: 1. Basic concepts of chemical kinetics 2. Effect of the nature of the reactants. Law of mass action 3. The dependence of the chemical reaction rate of temperature
 1. Основные понятия химической кинетики Химическая кинетика – раздел химии, изучающий скорости и механизмы химических реакций. Основным понятием химической кинетики является понятие о скорости химической реакции. Под скоростью химической реакции понимается число элементарных актов взаимодействия в единицу времени в единице объема (если реакция гомогенная) или число элементарных актов взаимодействия в единицу времени на единицу поверхности раздела фаз (если реакция гетерогенная).
1. Основные понятия химической кинетики Химическая кинетика – раздел химии, изучающий скорости и механизмы химических реакций. Основным понятием химической кинетики является понятие о скорости химической реакции. Под скоростью химической реакции понимается число элементарных актов взаимодействия в единицу времени в единице объема (если реакция гомогенная) или число элементарных актов взаимодействия в единицу времени на единицу поверхности раздела фаз (если реакция гетерогенная).
 1. Basic concepts of chemical kinetics Chemical kinetics - a branch of chemistry that studies the rate and mechanisms of chemical reactions. he basic concept of chemical kinetics is the concept of chemical reaction rate. Under the speed of a chemical reaction is meant the number of elementary acts of interaction per unit time per unit volume (if the reaction is homogeneous) or the number of elementary acts of interaction per unit time per unit area of the interface (if the reaction is heterogeneous).
1. Basic concepts of chemical kinetics Chemical kinetics - a branch of chemistry that studies the rate and mechanisms of chemical reactions. he basic concept of chemical kinetics is the concept of chemical reaction rate. Under the speed of a chemical reaction is meant the number of elementary acts of interaction per unit time per unit volume (if the reaction is homogeneous) or the number of elementary acts of interaction per unit time per unit area of the interface (if the reaction is heterogeneous).
 Скорость химической реакции зависит от различных факторов: природы реагирующих веществ; их концентрации; температуры протекания процесса; присутствия катализатора.
Скорость химической реакции зависит от различных факторов: природы реагирующих веществ; их концентрации; температуры протекания процесса; присутствия катализатора.
 The chemical reaction rate depends on various factors: nature of the reactants; concentration; the temperature of the process; the presence of a catalyst.
The chemical reaction rate depends on various factors: nature of the reactants; concentration; the temperature of the process; the presence of a catalyst.
 2. Влияние природы реагирующих веществ Например, взаимодействие натрия и меди с кислородом протекает в соответствии с уравнениями реакций: 1. 4 Na + O 2 = 2 Na 2 O; 2. 2 Cu +O 2 = 2 Cu. O. Первый процесс протекает со скоростью V 1, второй – V 2, причем, V 1 >> V 2.
2. Влияние природы реагирующих веществ Например, взаимодействие натрия и меди с кислородом протекает в соответствии с уравнениями реакций: 1. 4 Na + O 2 = 2 Na 2 O; 2. 2 Cu +O 2 = 2 Cu. O. Первый процесс протекает со скоростью V 1, второй – V 2, причем, V 1 >> V 2.
 2. Effect of the nature of the reactants For example, reaction of copper sulfate and oxygen proceeds in accordance with reaction equations: 1. 4 Na + O 2 = 2 Na 2 O; 2. 2 Cu + O 2 = 2 Cu. O. The first process is at a speed V 1, second - V 2, wherein, V 1 >> V 2.
2. Effect of the nature of the reactants For example, reaction of copper sulfate and oxygen proceeds in accordance with reaction equations: 1. 4 Na + O 2 = 2 Na 2 O; 2. 2 Cu + O 2 = 2 Cu. O. The first process is at a speed V 1, second - V 2, wherein, V 1 >> V 2.
 3. Закон действующих масс Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс. Этот закон установлен норвежскими учеными Гульдбергом и Вааге в 1867 г. Он формулируется следующим образом: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
3. Закон действующих масс Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действующих масс. Этот закон установлен норвежскими учеными Гульдбергом и Вааге в 1867 г. Он формулируется следующим образом: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
 3. Law of mass action The dependence of the reaction rate on the concentration of the reactants is determined by the law of mass action. This law established by Norwegian scientists Guldberg and Waage in 1867 It is formulated as follows: at a constant temperature chemical reaction rate is directly proportional to the product of the concentrations of the reactants, taken to the power of the stoichiometric coefficients in the reaction equation.
3. Law of mass action The dependence of the reaction rate on the concentration of the reactants is determined by the law of mass action. This law established by Norwegian scientists Guldberg and Waage in 1867 It is formulated as follows: at a constant temperature chemical reaction rate is directly proportional to the product of the concentrations of the reactants, taken to the power of the stoichiometric coefficients in the reaction equation.
 Константа скорости химической реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора и не зависит от концентрации реагирующих веществ. Для гомогенных газовых систем существует прямо пропорциональная зависимость между концентрацией газов и их парциальным давлением, определяемая уравнением Менделеева -Клапейрона:
Константа скорости химической реакции зависит от природы реагирующих веществ, температуры, присутствия катализатора и не зависит от концентрации реагирующих веществ. Для гомогенных газовых систем существует прямо пропорциональная зависимость между концентрацией газов и их парциальным давлением, определяемая уравнением Менделеева -Клапейрона:
 The rate constant of a chemical reaction depends on the nature of the reactants, temperature, presence of a catalyst and does not depend on the concentration of the reactants. For homogeneous gas systems exists a directly proportional relationship between the concentration of gases and their partial pressure, which is determined by the equation Mendeleev-Clapeyron:
The rate constant of a chemical reaction depends on the nature of the reactants, temperature, presence of a catalyst and does not depend on the concentration of the reactants. For homogeneous gas systems exists a directly proportional relationship between the concentration of gases and their partial pressure, which is determined by the equation Mendeleev-Clapeyron:

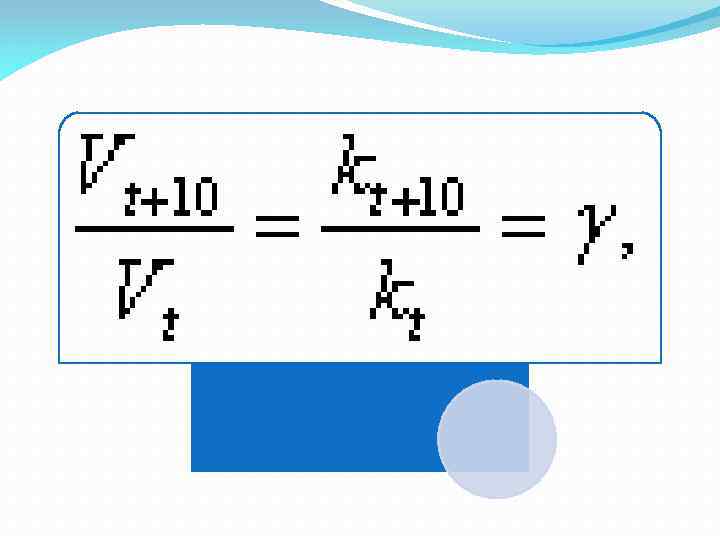
 6. 4. Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа и уравнением Аррениуса. Правило Вант-Гоффа: при увеличении температуры на каждые 100 скорость химической реакции возрастает в 2 -4 раза. Математически это запишется следующим образом:
6. 4. Зависимость скорости химической реакции от температуры определяется правилом Вант-Гоффа и уравнением Аррениуса. Правило Вант-Гоффа: при увеличении температуры на каждые 100 скорость химической реакции возрастает в 2 -4 раза. Математически это запишется следующим образом:
 6. 4. The dependence of reaction rate on temperature The dependence of the reaction rate on temperature is determined by the rule of van't Hoff and Arrhenius equation. Vant-Hoff rule: as the temperature increases for every 100 chemical reaction rate increases by 2 -4 times. Mathematically, this can be written as follows:
6. 4. The dependence of reaction rate on temperature The dependence of the reaction rate on temperature is determined by the rule of van't Hoff and Arrhenius equation. Vant-Hoff rule: as the temperature increases for every 100 chemical reaction rate increases by 2 -4 times. Mathematically, this can be written as follows:
 6. 5. Влияние катализатора Изменение скорости реакции под воздействием малых добавок особых веществ, количество которых в ходе процесса не меняется, называется катализом. Вещества, изменяющие скорость химической реакции, называются катализаторами (вещества, изменяющие скорость химических процессов в живых организмах – ферменты).
6. 5. Влияние катализатора Изменение скорости реакции под воздействием малых добавок особых веществ, количество которых в ходе процесса не меняется, называется катализом. Вещества, изменяющие скорость химической реакции, называются катализаторами (вещества, изменяющие скорость химических процессов в живых организмах – ферменты).
 6. 5. influence of catalyst Changing the speed of the reaction under the influence of small additions of specific substances, the number of which is not changed during the process, called catalysis. Substances that alter the rate of a chemical reaction are called catalysts (substances that change the rate of chemical processes in living organisms - enzymes).
6. 5. influence of catalyst Changing the speed of the reaction under the influence of small additions of specific substances, the number of which is not changed during the process, called catalysis. Substances that alter the rate of a chemical reaction are called catalysts (substances that change the rate of chemical processes in living organisms - enzymes).


