cd0644be0067127569de75b93e70b5d2.ppt
- Количество слайдов: 17
 Тема урока Железо Цель урока: Рассмотреть история развития железа, электронное строение атома железа, дать общую характеристику его. Изучить основные физические и химические свойства. Рассмотреть важнейшие соединения железа (ll) и (lll). Ознакомиться с природными соединениями железа
Тема урока Железо Цель урока: Рассмотреть история развития железа, электронное строение атома железа, дать общую характеристику его. Изучить основные физические и химические свойства. Рассмотреть важнейшие соединения железа (ll) и (lll). Ознакомиться с природными соединениями железа
 Проверка домашнего задания Упражнение № 5 Al 2 (SO 4)3+ KOH(нед) = Al 2(SO 4)3+ KOH(изб. ) = Упражнение № 6 Al Al. Cl 3 Al(OH)2 Al 2 O 3 Na. Al. O 2 Al 2(SO 4)3 Al(OH)3 Al. Cl 3 Na. Al. O 2
Проверка домашнего задания Упражнение № 5 Al 2 (SO 4)3+ KOH(нед) = Al 2(SO 4)3+ KOH(изб. ) = Упражнение № 6 Al Al. Cl 3 Al(OH)2 Al 2 O 3 Na. Al. O 2 Al 2(SO 4)3 Al(OH)3 Al. Cl 3 Na. Al. O 2
 Ответы Упражнения № 5 1. Al 2 (SO 4)3 + 6 KOH(нед. ) = 2 AL(OH)3 +3 K 2 SO 4 2. Al 2 (SO 4)3 + 8 KOH(изб) = 2 KAl. O 2 + 3 K 2 SO 4 + 4 H 2 O
Ответы Упражнения № 5 1. Al 2 (SO 4)3 + 6 KOH(нед. ) = 2 AL(OH)3 +3 K 2 SO 4 2. Al 2 (SO 4)3 + 8 KOH(изб) = 2 KAl. O 2 + 3 K 2 SO 4 + 4 H 2 O
 Упражнение № 6 1) 2) 3) 4) 5) 6) 7) 8) 2 Al +3 Cl 2 = 2 Al. Cl 3 + 3 Na. OH =Al(OH)3 + 3 Na. Cl 2 Al(OH)3 = Al 2 O 3 + 3 H 2 O Al 2 O 3 +2 Na. OH =2 Na. Al. O 2 + H 2 O 2 Na. Al. O 2 + 4 H 2 SO 4(изб. ) = Na 2 SO 4 + Al 2 (SO 4 )3 +4 H 2 O Al 2 (SO 4 ) + 6 Na. OH = 2 Al (OH)3 + 3 Na 2 SO 4 Al(OH)3 +3 HCl =Al. Cl 3 + 3 H 2 O Al. Cl 3 + 4 Na. OH(избыт. )= Na. Al. O 2 + 3 Na. Cl + 2 H 2 O
Упражнение № 6 1) 2) 3) 4) 5) 6) 7) 8) 2 Al +3 Cl 2 = 2 Al. Cl 3 + 3 Na. OH =Al(OH)3 + 3 Na. Cl 2 Al(OH)3 = Al 2 O 3 + 3 H 2 O Al 2 O 3 +2 Na. OH =2 Na. Al. O 2 + H 2 O 2 Na. Al. O 2 + 4 H 2 SO 4(изб. ) = Na 2 SO 4 + Al 2 (SO 4 )3 +4 H 2 O Al 2 (SO 4 ) + 6 Na. OH = 2 Al (OH)3 + 3 Na 2 SO 4 Al(OH)3 +3 HCl =Al. Cl 3 + 3 H 2 O Al. Cl 3 + 4 Na. OH(избыт. )= Na. Al. O 2 + 3 Na. Cl + 2 H 2 O
 Изучение нового материала Характеристика по плану: 1. Положение железа в ПСХЭ (период, ряд, группа, подгруппа, порядковый номер) 2. Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса) 3. Электронные слои, распределение электронов по слоям, электронная конфигурация.
Изучение нового материала Характеристика по плану: 1. Положение железа в ПСХЭ (период, ряд, группа, подгруппа, порядковый номер) 2. Атомное строение(число электронов, протонов , нейтронов, относительная атомная масса) 3. Электронные слои, распределение электронов по слоям, электронная конфигурация.
 Характеристика элемента 4 -период, 4 ряд, 8 -группа, побочная подгруппа, порядковый номер 26 26 электронов, 26 протонов, относительная атомная масса 56, 30 нейтронов. 4 электронных слоя, 2)8)14)2), электронная конфигурация 1 s 22 s 2 p 63 s 2 p 6 d 64 s 2 Степень окисления 0, +2, +3 , +4 и иногда + 6; является восстановителем
Характеристика элемента 4 -период, 4 ряд, 8 -группа, побочная подгруппа, порядковый номер 26 26 электронов, 26 протонов, относительная атомная масса 56, 30 нейтронов. 4 электронных слоя, 2)8)14)2), электронная конфигурация 1 s 22 s 2 p 63 s 2 p 6 d 64 s 2 Степень окисления 0, +2, +3 , +4 и иногда + 6; является восстановителем
 Физические свойства железа Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к намагничиванию. Плотность 7, 864 г/см 3, температура плавления 1539 * С
Физические свойства железа Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к намагничиванию. Плотность 7, 864 г/см 3, температура плавления 1539 * С
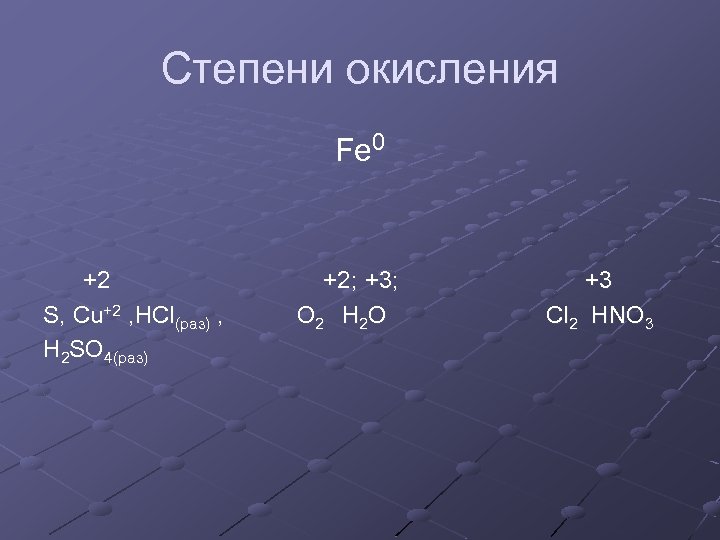 Степени окисления Fe 0 +2 S, Cu+2 , HCl(раз) , H 2 SO 4(раз) +2; +3; O 2 H 2 O +3 Cl 2 HNO 3
Степени окисления Fe 0 +2 S, Cu+2 , HCl(раз) , H 2 SO 4(раз) +2; +3; O 2 H 2 O +3 Cl 2 HNO 3
 Химические свойства При нагревании 2 Fe + 3 Cl 2 =2 Fe. Cl 3 3 Fe +2 O 2= Fe 3 O 4 (Fe. O Fe 2 O 3) Fe +S =Fe. S При очень высокой температуре 4 Fe + 3 C =Fe 4 C 3 4 Fe + 3 Si =Fe 4 Si 3 3 Fe + 2 P = Fe 3 P 2
Химические свойства При нагревании 2 Fe + 3 Cl 2 =2 Fe. Cl 3 3 Fe +2 O 2= Fe 3 O 4 (Fe. O Fe 2 O 3) Fe +S =Fe. S При очень высокой температуре 4 Fe + 3 C =Fe 4 C 3 4 Fe + 3 Si =Fe 4 Si 3 3 Fe + 2 P = Fe 3 P 2
 Химические свойства Fe + Cu. SO 4 = Cu + Fe. SO 4 Fe + 2 HClр = Fe. Cl 2 + H 2 Fe + H 2 SO 4 p= Fe. SO 4 + H 2 Fe + H 2 SO 4(k) =/= Fe + HNO 3 (к)=/=
Химические свойства Fe + Cu. SO 4 = Cu + Fe. SO 4 Fe + 2 HClр = Fe. Cl 2 + H 2 Fe + H 2 SO 4 p= Fe. SO 4 + H 2 Fe + H 2 SO 4(k) =/= Fe + HNO 3 (к)=/=
 При нагревании 2 Fe + 6 H 2 SO 4(k)=Fe 2(SO 4)3 + 3 SO 2+6 H 2 O Fe+ 6 HNO 3(k)= Fe(NO 3)3+ 3 NO 2+ 3 H 2 O
При нагревании 2 Fe + 6 H 2 SO 4(k)=Fe 2(SO 4)3 + 3 SO 2+6 H 2 O Fe+ 6 HNO 3(k)= Fe(NO 3)3+ 3 NO 2+ 3 H 2 O
 Химические свойства Fe 0 + HNO 3 (p) = Fe +2(NO 3 )2 + N 20 + H 2 O Fe 0 + HNO 3(р) = Fe+3 (NO 3)3 + N+2 O + H 20 Fe 0 + HNO 3(р) = Fe+2(NO 3)2 + N-3 H 4 N+5 O 3+ H 2 O
Химические свойства Fe 0 + HNO 3 (p) = Fe +2(NO 3 )2 + N 20 + H 2 O Fe 0 + HNO 3(р) = Fe+3 (NO 3)3 + N+2 O + H 20 Fe 0 + HNO 3(р) = Fe+2(NO 3)2 + N-3 H 4 N+5 O 3+ H 2 O
 Уравнивание реакций 5 Fe 0 + 12 HN+5 O 3 (p) = 5 Fe +3(NO 3 )2 + N 20 +6 H 2 O вос-ль окис-ль Fe 0 - 2 e = Fe+2 10 1 2 N+5 + 10 e = N 20 2 5 Fe 0 +4 HN+5 O 3 = Fe+3 (NO 3)3 + N+2 O + 2 H 20 Fe 0 - 3 e = Fe+3 3 1 +5 + 3 e = N+2 N 3 1 Fe 0 – восстановитель HNO 3 – окислитель 4 Fe 0 +10 HNO 3 =4 Fe+2(NO 3)2 + N-3 H 4 N+5 O 3+ 3 H 2 O вос-ль окис-ль Fe 0 - 2 e = Fe+2 N+5 + 8 e = N-3 8 2 4 1
Уравнивание реакций 5 Fe 0 + 12 HN+5 O 3 (p) = 5 Fe +3(NO 3 )2 + N 20 +6 H 2 O вос-ль окис-ль Fe 0 - 2 e = Fe+2 10 1 2 N+5 + 10 e = N 20 2 5 Fe 0 +4 HN+5 O 3 = Fe+3 (NO 3)3 + N+2 O + 2 H 20 Fe 0 - 3 e = Fe+3 3 1 +5 + 3 e = N+2 N 3 1 Fe 0 – восстановитель HNO 3 – окислитель 4 Fe 0 +10 HNO 3 =4 Fe+2(NO 3)2 + N-3 H 4 N+5 O 3+ 3 H 2 O вос-ль окис-ль Fe 0 - 2 e = Fe+2 N+5 + 8 e = N-3 8 2 4 1
 Минералы железо Fe 3 O 4 магнитный железняк или магнетит Fe 2 O 3 красный железняк или гематит 2 Fe 2 O 3. 3 H 2 O бурый железняк или лимонит Fe. S 2 железный или серный колчедан Fe. SO 4. 7 H 2 O железный купорос
Минералы железо Fe 3 O 4 магнитный железняк или магнетит Fe 2 O 3 красный железняк или гематит 2 Fe 2 O 3. 3 H 2 O бурый железняк или лимонит Fe. S 2 железный или серный колчедан Fe. SO 4. 7 H 2 O железный купорос
 Применение l l l l Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали) Железный колчедан – для производства серной кислоты Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил. Чугун и сталь в технике и в быту. Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей. Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии.
Применение l l l l Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали) Железный колчедан – для производства серной кислоты Железный купорос– для борьбы с вредителями растений, для приготовления минеральных красок, для обработки древесины Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил. Чугун и сталь в технике и в быту. Хлорид железа(lll)– при очистке воды, в качестве протравы при крашении тканей. Сульфат железа(lll) при очистке воды, в качестве растворителя в гидрометаллургии.
 Источники железа Шпинат Салат Капуста Черная черешня Говядина Телятина
Источники железа Шпинат Салат Капуста Черная черешня Говядина Телятина
 Дом. задание 1. & 14 № 4 -5. 2. Используя свои знания по химии написать сочинение «Художественный образ вещества»
Дом. задание 1. & 14 № 4 -5. 2. Используя свои знания по химии написать сочинение «Художественный образ вещества»


