окислительно восстановительные ppt
- Количество слайдов: 21
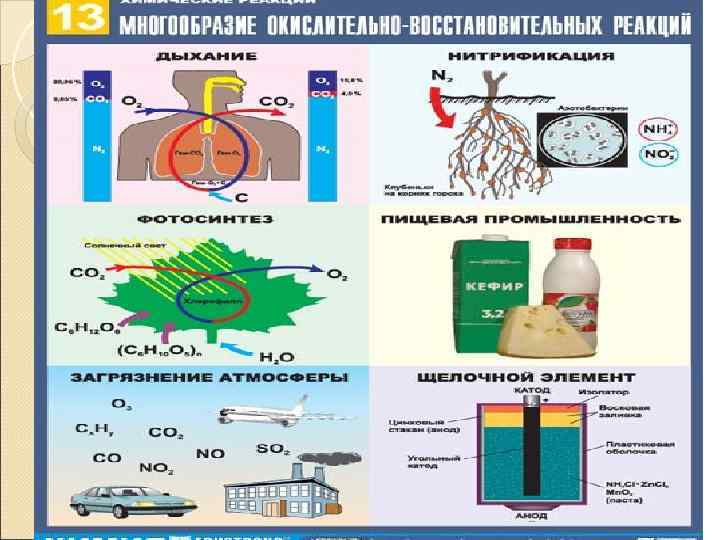
 Тема урока: ОВР ( …)
Тема урока: ОВР ( …)
 Признак классификации химической реакции 1. 2. 3. 4. 5. 6. По числу и составу реагирующих и образующихся веществ По агрегатному состоянию веществ По направлению По использованию катализатора По тепловому эффекту ? ? ?
Признак классификации химической реакции 1. 2. 3. 4. 5. 6. По числу и составу реагирующих и образующихся веществ По агрегатному состоянию веществ По направлению По использованию катализатора По тепловому эффекту ? ? ?
 Химические реакции C(тв. ) + O 2 (г. ) = CO 2(г. )↑ Ca. CO 3(тв. ) + Сa. O(тв. ) t = CO 2(г. )↑+
Химические реакции C(тв. ) + O 2 (г. ) = CO 2(г. )↑ Ca. CO 3(тв. ) + Сa. O(тв. ) t = CO 2(г. )↑+
 Строение атома С 0 +6 ) ) 2 е 4 е С+4 [ +6 ) ) ]+4 2 е 0 е С 0 → С+4 степень окисления увеличивается, процесс называется окислением С 0 - восстановитель
Строение атома С 0 +6 ) ) 2 е 4 е С+4 [ +6 ) ) ]+4 2 е 0 е С 0 → С+4 степень окисления увеличивается, процесс называется окислением С 0 - восстановитель
![Строение атома С 0 +6 ) ) С-4 [ +6 ) ) ]-4 2 Строение атома С 0 +6 ) ) С-4 [ +6 ) ) ]-4 2](https://present5.com/presentation/102357220_444258561/image-5.jpg) Строение атома С 0 +6 ) ) С-4 [ +6 ) ) ]-4 2 е 4 е 2 е 8 е С 0 → С-4 степень окисления уменьшается, процесс называется восстановлением. С 0 - окислитель
Строение атома С 0 +6 ) ) С-4 [ +6 ) ) ]-4 2 е 4 е 2 е 8 е С 0 → С-4 степень окисления уменьшается, процесс называется восстановлением. С 0 - окислитель
 Химические реакции C(тв. ) + O 2 (г. ) = CO 2(г. )↑ Ca. CO 3(тв. ) + Сa. O(тв. ) t. CO = ↑+ 2(г. )
Химические реакции C(тв. ) + O 2 (г. ) = CO 2(г. )↑ Ca. CO 3(тв. ) + Сa. O(тв. ) t. CO = ↑+ 2(г. )
 Признак классификации химической реакции 1. 2. 3. 4. 5. 6. По числу и составу реагирующих и образующихся веществ По агрегатному состоянию веществ По направлению По использованию катализатора По тепловому эффекту По изменению степени окисления
Признак классификации химической реакции 1. 2. 3. 4. 5. 6. По числу и составу реагирующих и образующихся веществ По агрегатному состоянию веществ По направлению По использованию катализатора По тепловому эффекту По изменению степени окисления
 Химические реакции 1) C 0 + O 02 = C+4 O-22↑ окислительновосстановительная реакция 2) Ca+2 C+4 O-23 =t C+2 O-22↑+Ca+2 O-2 не окислительно-восстановительная реакция
Химические реакции 1) C 0 + O 02 = C+4 O-22↑ окислительновосстановительная реакция 2) Ca+2 C+4 O-23 =t C+2 O-22↑+Ca+2 O-2 не окислительно-восстановительная реакция
 Тема урока: ОВР ( окислительновосстановительные реакции)
Тема урока: ОВР ( окислительновосстановительные реакции)
 Окислительновосстановительная реакция 2 Н 2 + = 2 Н 2 0 - 2 е → 2 Н+1 - процесс окисления, Н 2 0 - восстановитель O 20 + 4 е → 2 О-2 – процесс восстановления, 0 – окислитель O 2 0 0 O 2 +1 2 Н -2 O
Окислительновосстановительная реакция 2 Н 2 + = 2 Н 2 0 - 2 е → 2 Н+1 - процесс окисления, Н 2 0 - восстановитель O 20 + 4 е → 2 О-2 – процесс восстановления, 0 – окислитель O 2 0 0 O 2 +1 2 Н -2 O
 Работа с терминами • Окислитель • Восстановитель • Окисление • Восстановление • Окислительно- восстановительная реакция
Работа с терминами • Окислитель • Восстановитель • Окисление • Восстановление • Окислительно- восстановительная реакция
 Физкультминутка
Физкультминутка

 Тестовое задание Задание № 1. I вариант К окислительновосстановительным реакциям не относится реакция, представленная схемой: А) N 2 + 3 Н 2 = 2 NН 3 Б) Mg + 2 HCl = Mg. Cl 2 + + H 2↑ В)Mg. CO 3 = Mg. O + CO 2 ↑ Г) 2 Cu. O = 2 Cu + O 2↑ Задание № 1. II вариант К окислительновосстановительным реакциям относится реакция, представленная схемой: А) H 2 O + Ca. O = Ca(OH)2 Б) H 2 O + N 2 O 5 = 2 HNO 3 В) Na 2 CO 3 + 2 HCl = 2 Na. Cl + H 2 O + CO 2 Г) Cu. O + H 2 = Cu + H 2 O
Тестовое задание Задание № 1. I вариант К окислительновосстановительным реакциям не относится реакция, представленная схемой: А) N 2 + 3 Н 2 = 2 NН 3 Б) Mg + 2 HCl = Mg. Cl 2 + + H 2↑ В)Mg. CO 3 = Mg. O + CO 2 ↑ Г) 2 Cu. O = 2 Cu + O 2↑ Задание № 1. II вариант К окислительновосстановительным реакциям относится реакция, представленная схемой: А) H 2 O + Ca. O = Ca(OH)2 Б) H 2 O + N 2 O 5 = 2 HNO 3 В) Na 2 CO 3 + 2 HCl = 2 Na. Cl + H 2 O + CO 2 Г) Cu. O + H 2 = Cu + H 2 O
 Тестовое задание Задание № 2. I вариант В каком соединении степени окисления элементов равны -3 и +1 Задание № 2. II вариант В каком соединении степени окисления элементов равны +3 и -2 А) NF 3 Б) Cl 2 O 3 В) NH 3 Г) Al. Cl 3
Тестовое задание Задание № 2. I вариант В каком соединении степени окисления элементов равны -3 и +1 Задание № 2. II вариант В каком соединении степени окисления элементов равны +3 и -2 А) NF 3 Б) Cl 2 O 3 В) NH 3 Г) Al. Cl 3
 Тестовое задание Задание № 3. I вариант Схема Na 0 → Na+1 отражает процесс: А) Окисления Б) Восстановления В) Нейтрализации Г) Диссоциации Задание № 3. II вариант Схема Сl 0 → Сl-1 отражает процесс: А) Окисления Б) Восстановления В) Нейтрализации Г) Диссоциации
Тестовое задание Задание № 3. I вариант Схема Na 0 → Na+1 отражает процесс: А) Окисления Б) Восстановления В) Нейтрализации Г) Диссоциации Задание № 3. II вариант Схема Сl 0 → Сl-1 отражает процесс: А) Окисления Б) Восстановления В) Нейтрализации Г) Диссоциации
 Тестовое задание Задание № 4. I вариант Задание № 4. II вариант Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра: Окислительные свойства простых веществ, образованных элементами седьмой группы, главной подгруппы с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются
Тестовое задание Задание № 4. I вариант Задание № 4. II вариант Восстановительные свойства простых веществ, образованных элементами второго периода, с увеличением заряда ядра: Окислительные свойства простых веществ, образованных элементами седьмой группы, главной подгруппы с увеличением заряда ядра: А) Уменьшаются Б) Усиливаются В) Изменяются периодически Г) Не изменяются
 Ответы на тестовое задание I вариант II вариант 1 -В 2 -В 3 -А 4 -А 1 -Г 2 -Б 3 -Б 4 -А
Ответы на тестовое задание I вариант II вариант 1 -В 2 -В 3 -А 4 -А 1 -Г 2 -Б 3 -Б 4 -А
 Домашнее задание Учебник: § 43, стр. 229 -230 Работа с текстом
Домашнее задание Учебник: § 43, стр. 229 -230 Работа с текстом
 Тема урока: Окислительно- восстановительные реакции 0 4 Fe + 0 3 O 2 + 6 H 2 O +3(O-2 H) 4 Fe КОРРОЗИЯ 3
Тема урока: Окислительно- восстановительные реакции 0 4 Fe + 0 3 O 2 + 6 H 2 O +3(O-2 H) 4 Fe КОРРОЗИЯ 3