Ще Ме.pptx
- Количество слайдов: 22

ТЕМА УРОКА: «Общая характеристика элементов I группы главной подгруппы ПСХЭ Д. И. Менделеева»
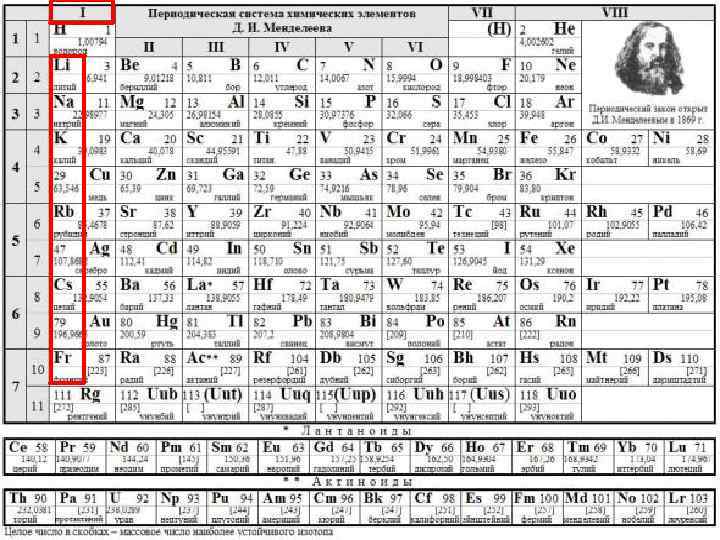
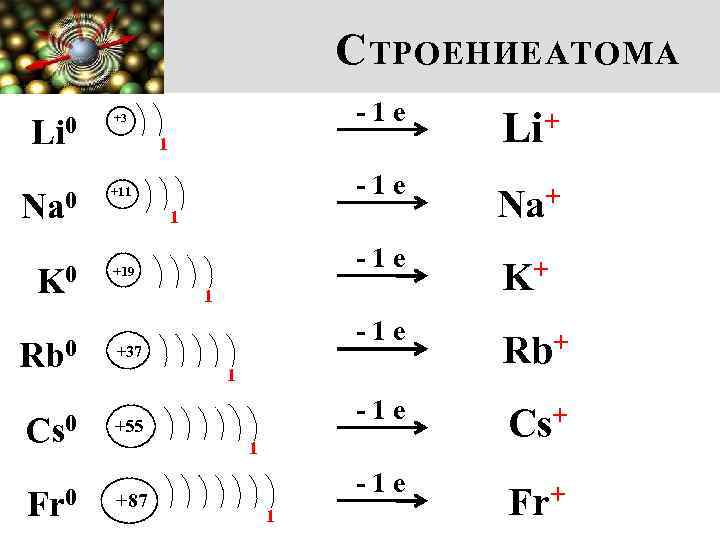
С ТРОЕНИЕ АТОМА Li 0 -1 е Na+ -1 е K+ -1 е Rb+ -1 е Cs+ -1 е Fr+ 1 Na 0 +11 K 0 +19 1 1 Rb 0 +37 Cs 0 +55 Fr 0 Li+ -1 е +3 1 1 +87 1

С ТРОЕНИЕ АТОМА Li +3 1 Na +11 K 1. Увеличивается заряд ядра +19 2. Растет число энергетических уровней 1 1 Rb +37 Cs +55 Fr +87 3. Увеличивается радиус атома 4. Увеличиваются металлические и восстановительные свойства 1 1 1

З АПОМНИ! Степень окисления металлов I группы главной подгруппы в соединениях постоянная и равна +1 +1 Na. OH, K 2 O, Li 3 PO 4, +1 +1 +1 K 2 CO 3, Na. Cl, Na 2 O 2
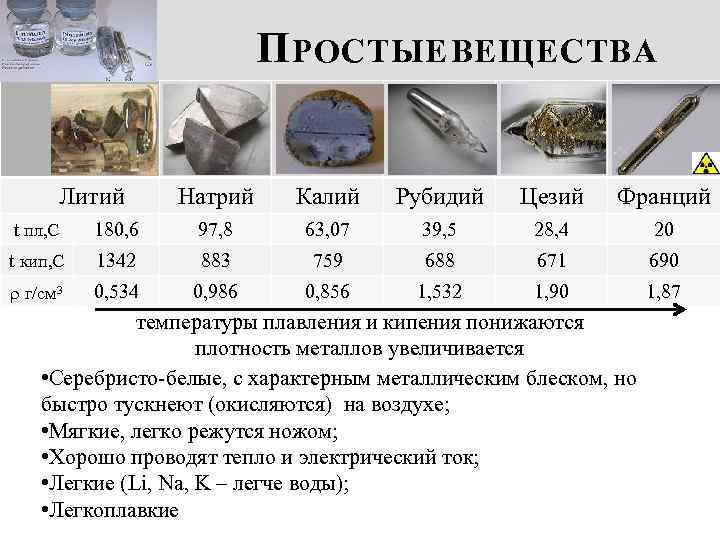
П РОСТЫЕ ВЕЩЕСТВА Литий Натрий Калий Рубидий Цезий Франций t пл, С 180, 6 97, 8 63, 07 39, 5 28, 4 20 t кип, С 1342 883 759 688 671 690 г/см 3 0, 534 0, 986 0, 856 1, 532 1, 90 1, 87 температуры плавления и кипения понижаются плотность металлов увеличивается • Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются) на воздухе; • Мягкие, легко режутся ножом; • Хорошо проводят тепло и электрический ток; • Легкие (Li, Na, K – легче воды); • Легкоплавкие

Х ИМИЧЕСКИЕСВОЙСТВА • Металлы I группы главной подгруппы – наиболее активные металлы, обладают высокой восстановительной способностью • В ряду Li - Na - K - Rb - Cs- Fr химическая активность увеличивается • Образуют соединения с ионной связью и ионной кристаллической решеткой
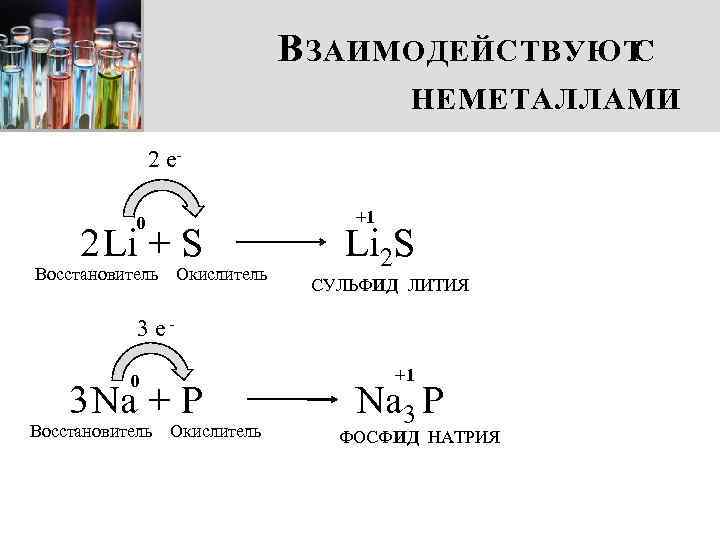
В ЗАИМОДЕЙСТВУЮТ С НЕМЕТАЛЛАМИ 2 e 0 2 Li + S Восстановитель Окислитель +1 Li 2 S СУЛЬФИД ЛИТИЯ 3 e 0 3 Na + P Восстановитель Окислитель +1 Na 3 P ФОСФИД НАТРИЯ
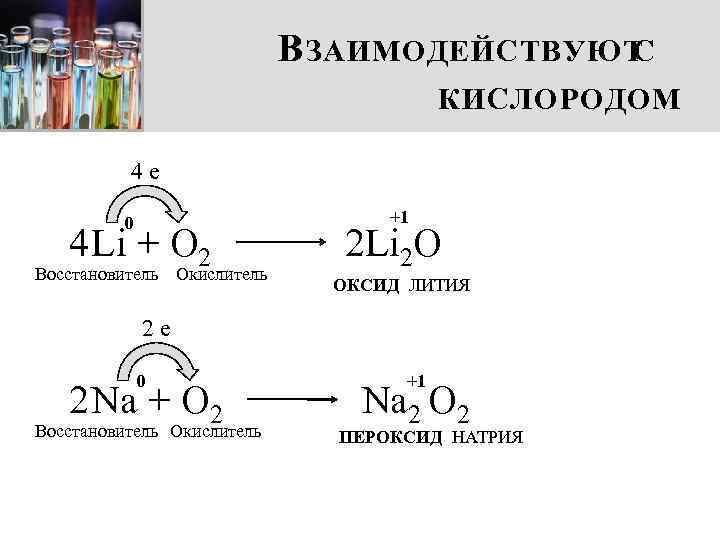
В ЗАИМОДЕЙСТВУЮТ С КИСЛОРОДОМ 4 e 0 4 Li + О 2 Восстановитель Окислитель +1 2 Li 2 O ОКСИД ЛИТИЯ 2 e 0 2 Na + O 2 Восстановитель Окислитель +1 Na 2 O 2 ПЕРОКСИД НАТРИЯ

В НИМАНИЕ! При взаимодействии с кислородом только литий образует оксид. Другие металлы I группы главной подгруппы при взаимодействии с кислородом образуют пероксиды. ПЕРОКСИД НАТРИЯ +1 Na -1 O +1 Na

A ЗНАЕТЕ ЛИ ВЫ? При взаимодействии пероксида натрия с углекислым газом протекает процесс, обратный дыханию углекислый газ связывается, а кислород выделяется: 2 Na 2 О 2 + 2 СО 2 → 2 Na 2 CО 3 + О 2 На этой реакции основано применение пероксида натрия для получения кислорода на подводных лодках и для регенерации воздуха в закрытых помещениях.

В ЗАИМОДЕЙСТВУЮТ С ВОДОЙ Металлы I группы главной подгруппы реагируют с водой бурно, с выделением теплоты. В результате взаимодействия образуется щелочь и выделяется водород Так как гидроксиды металлов I группы главной подгруппы образуют щелочи, то их групповое название – ЩЕЛОЧНЫЕ МЕТАЛЛЫ
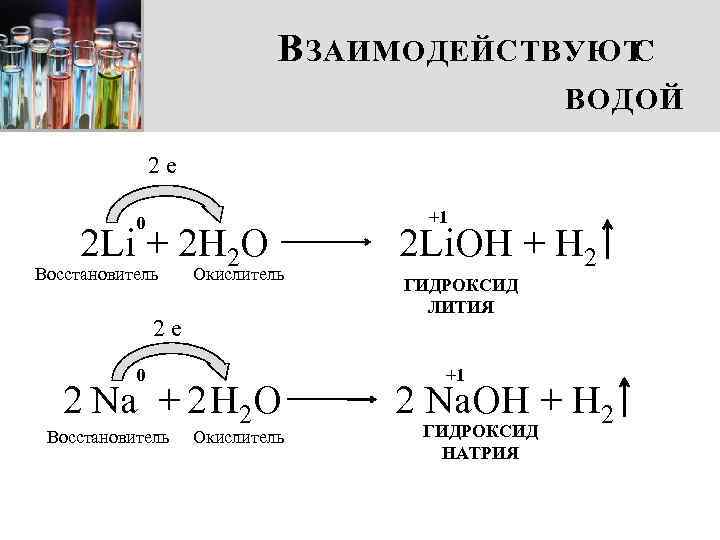
В ЗАИМОДЕЙСТВУЮТ С ВОДОЙ 2 e 0 2 Li + 2 H 2 О Восстановитель Окислитель 2 e 0 2 Na + 2 H 2 О Восстановитель Окислитель +1 2 Li. OH + H 2 ГИДРОКСИД ЛИТИЯ +1 2 Na. OH + H 2 ГИДРОКСИД НАТРИЯ

Х РАНЕНИЕЩЕЛОЧНЫХ МЕТАЛЛОВ Так как щелочные металлы легко окисляются и обладают высокой химической активностью, их хранят под слоем керосина Беречь от воды
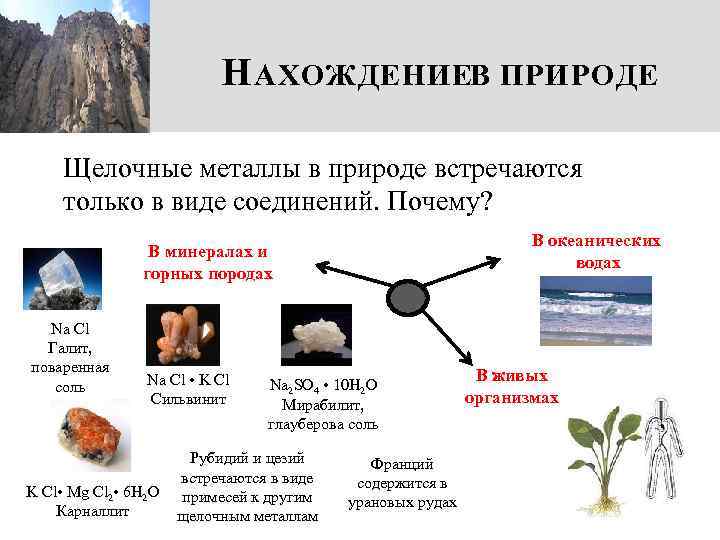
Н АХОЖДЕНИЕВ ПРИРОДЕ Щелочные металлы в природе встречаются только в виде соединений. Почему? В океанических водах В минералах и горных породах Na Cl Галит, поваренная соль Na Cl • K Cl Сильвинит K Cl • Mg Cl 2 • 6 H 2 O Карналлит Na 2 SO 4 • 10 H 2 O Мирабилит, глауберова соль Рубидий и цезий встречаются в виде примесей к другим щелочным металлам Франций содержится в урановых рудах В живых организмах
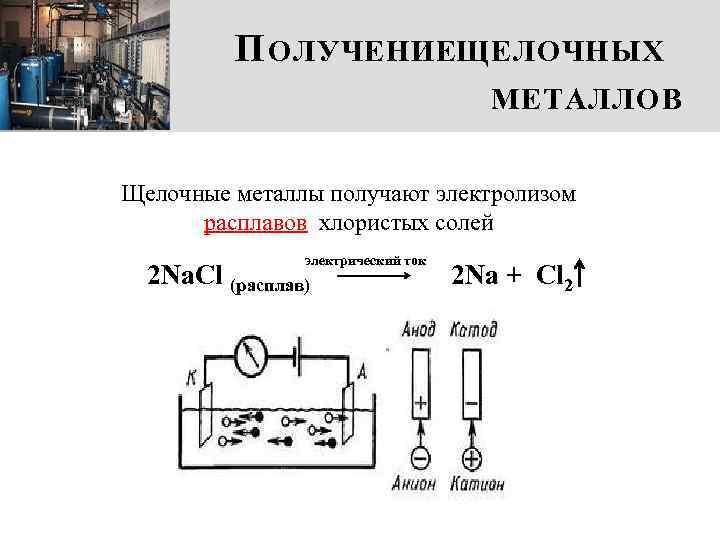
П ОЛУЧЕНИЕЩЕЛОЧНЫХ МЕТАЛЛОВ Щелочные металлы получают электролизом расплавов хлористых солей электрический ток 2 Na. Cl (расплав) 2 Na + Cl 2
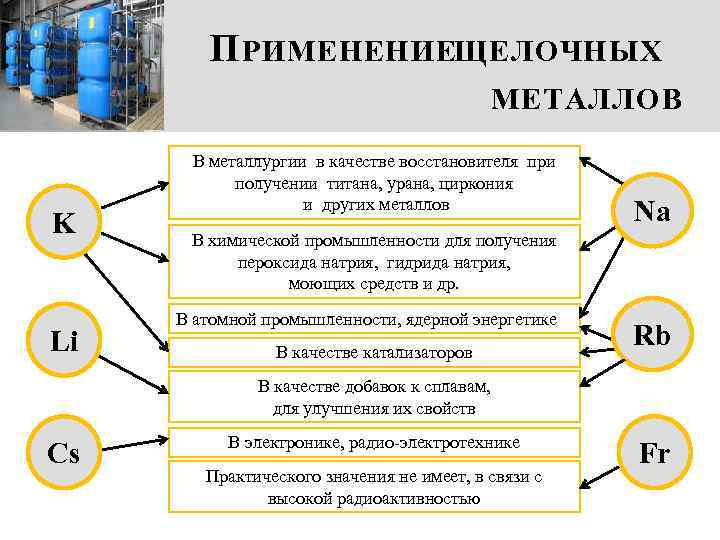
П РИМЕНЕНИЕЩЕЛОЧНЫХ МЕТАЛЛОВ K Li В металлургии в качестве восстановителя при получении титана, урана, циркония и других металлов Na В химической промышленности для получения пероксида натрия, гидрида натрия, моющих средств и др. В атомной промышленности, ядерной энергетике В качестве катализаторов Rb В качестве добавок к сплавам, для улучшения их свойств Cs В электронике, радио-электротехнике Практического значения не имеет, в связи с высокой радиоактивностью Fr

И З ИСТОРИИ Литий • Открыт в 1817 году шведским химиком А. Арфведсоном. Но в свободном виде был выделен позднее Г. Дэви путем электролиза щелочи Натрий Калий • В 1807 году английский химик Г. Дэви впервые получил в свободном виде путем электролиза увлажненных твердых щелочей Рубидий Цезий Франций • Немецкие химики Р. Бунзен и Г. Кирхгоф с помощью спектрального анализа обнаружили в минералах в 1860 году – цезий, а в 1861 году – рубидий • Открыт в 1939 году М. Перей при анализе продуктов радиоактивного распада актиния. В 1946 году М. Пере предложила назвать элемент в честь своей родины Франции

Д ОМАШНЕЕ ЗАДАНИЕ Параграф 11 (до соединений щелочных металлов) Упр. 1, 2

В ЫБЕРИ ПРАВИЛЬНЫЙ ОТВЕТ 1. Щелочной металл a) Mg б) Ba в) Al г) Rb 2. Наиболее ярко выражены металлические свойства a) Cs б) K в) Fr г) Li 3. При взаимодействии с кислородом образует пероксид a) Ca б) Na в) Li г) Mg 4. Степень окисления щелочных металлов a) +1 б) +2 в) +3 г) +4

Н АЙДИ СООТВЕТСТВИЕ 1. Li 2. Na 3. K А) В атоме 6 энергетических уровней 4. Rb Г) Общее число электронов в атоме 19 5. Cs Д) Входит в состав поваренной соли 1 В Б) Заряд ядра + 37 В) Самый легкий металл 2 Д 3 Г 4 Б 5 А

В ЫБЕРИТЕСВОЙСТВА ХАРАКТЕРНЫЕ ДЛЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ А) не взаимодейсвуют с кислородом Б) в соединениях проявляют переменную степень окисления В) быстро окисляются Г) имеют металлическую кристаллическую решетку Д) при взаимодействии с водой образуют щелочи Е) хорошие окислители В Г Д
Ще Ме.pptx