 Тема урока: .
Тема урока: .





 О ТРЕХ ПОНЯТИЯХ В ХИМИИ Электороотрицательность Степень окисления Валентность
О ТРЕХ ПОНЯТИЯХ В ХИМИИ Электороотрицательность Степень окисления Валентность
 Электороотрицательность Это способность атомов в молекуле притягивать к себе электроны (имеются в виду валентные электроны, которые учувствуют в образовании химической связи). Количественная характеристика ЭО является энергия Х=У+Е У - энергия ионизации Е - сродство к электрону
Электороотрицательность Это способность атомов в молекуле притягивать к себе электроны (имеются в виду валентные электроны, которые учувствуют в образовании химической связи). Количественная характеристика ЭО является энергия Х=У+Е У - энергия ионизации Е - сродство к электрону
 СТЕПЕНЬ ОКИСЛЕНИЯ С. О. – это условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит только из ионов. С. О. – количественно характеризует состояние атома или в соединении. С. О. – может иметь отрицательное, положительное и нулевое значение, которое обычно ставится над символом.
СТЕПЕНЬ ОКИСЛЕНИЯ С. О. – это условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит только из ионов. С. О. – количественно характеризует состояние атома или в соединении. С. О. – может иметь отрицательное, положительное и нулевое значение, которое обычно ставится над символом.
 ВАЛЕНТНОСТЬ. Валентностью характеризуется способность атомов элементов к образованию химической связи. Например: НСI H 2 O NH 3 CH 4 PCI 5 SF 6 Re. F 7 Os. F 8
ВАЛЕНТНОСТЬ. Валентностью характеризуется способность атомов элементов к образованию химической связи. Например: НСI H 2 O NH 3 CH 4 PCI 5 SF 6 Re. F 7 Os. F 8
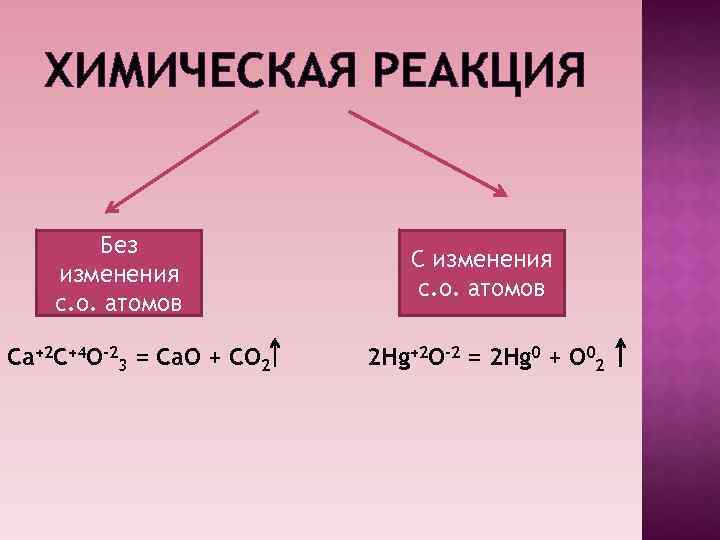 ХИМИЧЕСКАЯ РЕАКЦИЯ Без изменения с. о. атомов Ca+2 C+4 O-23 = Ca. O + CO 2 С изменения с. о. атомов 2 Hg+2 O-2 = 2 Hg 0 + O 02
ХИМИЧЕСКАЯ РЕАКЦИЯ Без изменения с. о. атомов Ca+2 C+4 O-23 = Ca. O + CO 2 С изменения с. о. атомов 2 Hg+2 O-2 = 2 Hg 0 + O 02
 ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ -Реакции протекающие с изменением степеней окисления, входящих в состав реагирующих веществ. -Это такие рекции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим
ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ -Реакции протекающие с изменением степеней окисления, входящих в состав реагирующих веществ. -Это такие рекции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим
 ОКИСЛЕНИЕ Процесс отдачи электронов атомами, ионами или молекулами. (С. О. при этом ) Al – 3 e = Al+3 H 2 – 2 e = 2 H+ Fe+2 -1 e = Fe+3 2 CI- -2 e = CI 02
ОКИСЛЕНИЕ Процесс отдачи электронов атомами, ионами или молекулами. (С. О. при этом ) Al – 3 e = Al+3 H 2 – 2 e = 2 H+ Fe+2 -1 e = Fe+3 2 CI- -2 e = CI 02
 ВОССТАНОВЛЕНИЕ Процесс присоединения электронов атомами, ионами или молекулами. (С. О. при этом ) S + 2 e = S-2 CI 02 + 2 e = 2 CIFe+3 +1 e = Fe+2
ВОССТАНОВЛЕНИЕ Процесс присоединения электронов атомами, ионами или молекулами. (С. О. при этом ) S + 2 e = S-2 CI 02 + 2 e = 2 CIFe+3 +1 e = Fe+2
 ПРОЦЕССЫ Окисление всегда сопровождается восстановлением: восстановление всегда связано с окислением, что можно выразить уравнениями. Восстановитель – е Окислитель + е Восстановитель Число отдаваемых электронов восстановителем равно числу электронов, присоединяемых окислителем
ПРОЦЕССЫ Окисление всегда сопровождается восстановлением: восстановление всегда связано с окислением, что можно выразить уравнениями. Восстановитель – е Окислитель + е Восстановитель Число отдаваемых электронов восстановителем равно числу электронов, присоединяемых окислителем
 ВОССТАНОВИТЕЛИ И ОКИСЛИТЕЛИ Атомы, молекулы или ионы принимающие электроны, называются окислителями. Атомы, молекулы или ионы отдающие электроны, называются восстановителями.
ВОССТАНОВИТЕЛИ И ОКИСЛИТЕЛИ Атомы, молекулы или ионы принимающие электроны, называются окислителями. Атомы, молекулы или ионы отдающие электроны, называются восстановителями.
 КЛАССИФИКАЦИЯ ОВР Межмоле куляр ные Внутрим олекуляр ные Диспроп орциони рования
КЛАССИФИКАЦИЯ ОВР Межмоле куляр ные Внутрим олекуляр ные Диспроп орциони рования
 МЕТОДЫ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОВР Метод электронного баланса Метод полуреакций Правила: 1) Число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. 2) Сумма зарядов в исходных веществах, всегда должна быть равна сумме зарядов в продуктах реакции.
МЕТОДЫ СОСТАВЛЕНИЯ УРАВНЕНИЙ ОВР Метод электронного баланса Метод полуреакций Правила: 1) Число одних и тех же атомов в исходных веществах и продуктах реакции должно быть одинаковым. 2) Сумма зарядов в исходных веществах, всегда должна быть равна сумме зарядов в продуктах реакции.
 МЕТОД ЭЛЕКТРОННОГО БАЛАНСА 1. Напишем схему реакции. H 2 S + KMn. O 4 + H 2 SO 4 S + Mn. SO 4 + K 2 SO 4 + H 2 O 2. Определим изменение с. о. атомов до и после реакции H 2 S + KMn. O 4 + H 2 SO 4 S + Mn. SO 4 + K 2 SO 4 + H 2 O 3. С. О. изменилась у серы и марганца H 2 S – восстановитель KMn. O 4 – окислитель 4. Составим электронное уравнение реакции S-2 -2 e = S 0 5 5 10 +7 +5 e = Mn+2 Mn 2 2
МЕТОД ЭЛЕКТРОННОГО БАЛАНСА 1. Напишем схему реакции. H 2 S + KMn. O 4 + H 2 SO 4 S + Mn. SO 4 + K 2 SO 4 + H 2 O 2. Определим изменение с. о. атомов до и после реакции H 2 S + KMn. O 4 + H 2 SO 4 S + Mn. SO 4 + K 2 SO 4 + H 2 O 3. С. О. изменилась у серы и марганца H 2 S – восстановитель KMn. O 4 – окислитель 4. Составим электронное уравнение реакции S-2 -2 e = S 0 5 5 10 +7 +5 e = Mn+2 Mn 2 2
 5. Находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что нужно взять 5 молей Н 2 S и 2 моля Mn. SO 4. Из сопоставления числа атомов в левой и правой частях уравнения найдем, что образуется также 1 моль К 2 SO 4 и Н 2 О. 6. Уравнение реакции будет иметь окончательный вид 5 H 2 S + 2 KMn. O 4 + 3 H 2 SO 4 5 S + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O 7. Переписываем уравнение реакции в ионной форме 8. 5 H 2 S + Mn. O 4 - + 6 Н+ = 5 S + 2 Mn 2+ + 8 H 2 O
5. Находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что нужно взять 5 молей Н 2 S и 2 моля Mn. SO 4. Из сопоставления числа атомов в левой и правой частях уравнения найдем, что образуется также 1 моль К 2 SO 4 и Н 2 О. 6. Уравнение реакции будет иметь окончательный вид 5 H 2 S + 2 KMn. O 4 + 3 H 2 SO 4 5 S + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 O 7. Переписываем уравнение реакции в ионной форме 8. 5 H 2 S + Mn. O 4 - + 6 Н+ = 5 S + 2 Mn 2+ + 8 H 2 O
 ЗАКЛЮЧЕНИЕ Таким образом сегодня на уроке мы узнали Ø Что такое ОВР Ø Окислители и восстановители Ø Процессы окисление и восстановление Ø Научились уравнивать реакции методом электронного баланса
ЗАКЛЮЧЕНИЕ Таким образом сегодня на уроке мы узнали Ø Что такое ОВР Ø Окислители и восстановители Ø Процессы окисление и восстановление Ø Научились уравнивать реакции методом электронного баланса


