ГИДРОЛИЗ СОЛЕЙ.ppt
- Количество слайдов: 37
 Тема урока: «Гидролиз солей»
Тема урока: «Гидролиз солей»
 Изменение цвета различных индикаторов при действии растворов кислот и щелочей Индикатор Цвет индикатора в среде кислой Лакмус Красный щелочной нейтральной Синий —— Фенолфта- Бесцветный Малиновый Бесцветный леин
Изменение цвета различных индикаторов при действии растворов кислот и щелочей Индикатор Цвет индикатора в среде кислой Лакмус Красный щелочной нейтральной Синий —— Фенолфта- Бесцветный Малиновый Бесцветный леин
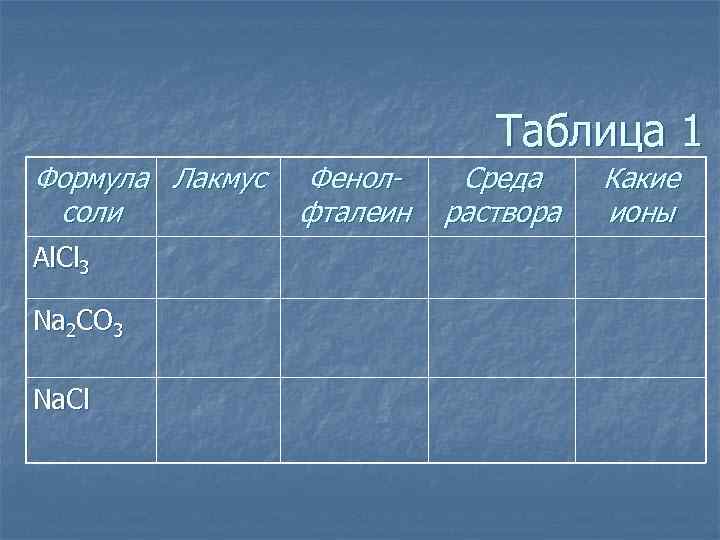 Таблица 1 Формула Лакмус соли Al. Cl 3 Na 2 CO 3 Na. Cl Фенолфталеин Среда раствора Какие ионы
Таблица 1 Формула Лакмус соли Al. Cl 3 Na 2 CO 3 Na. Cl Фенолфталеин Среда раствора Какие ионы
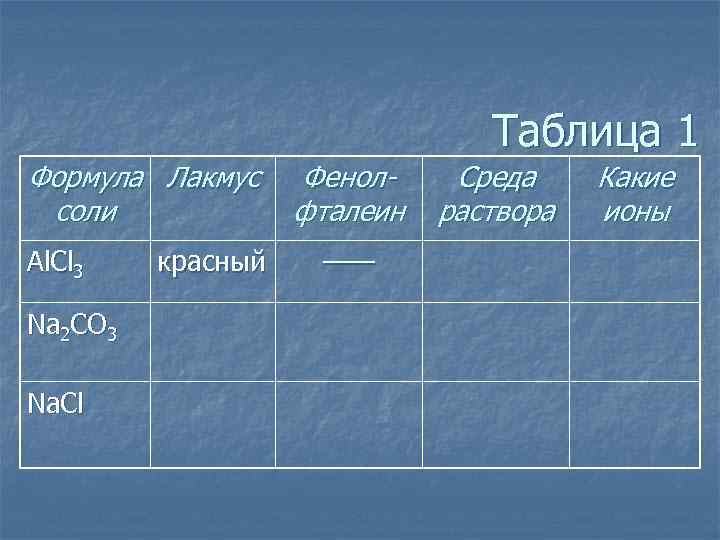 Таблица 1 Формула Лакмус соли Al. Cl 3 Na 2 CO 3 Na. Cl красный Фенолфталеин —— Среда раствора Какие ионы
Таблица 1 Формула Лакмус соли Al. Cl 3 Na 2 CO 3 Na. Cl красный Фенолфталеин —— Среда раствора Какие ионы
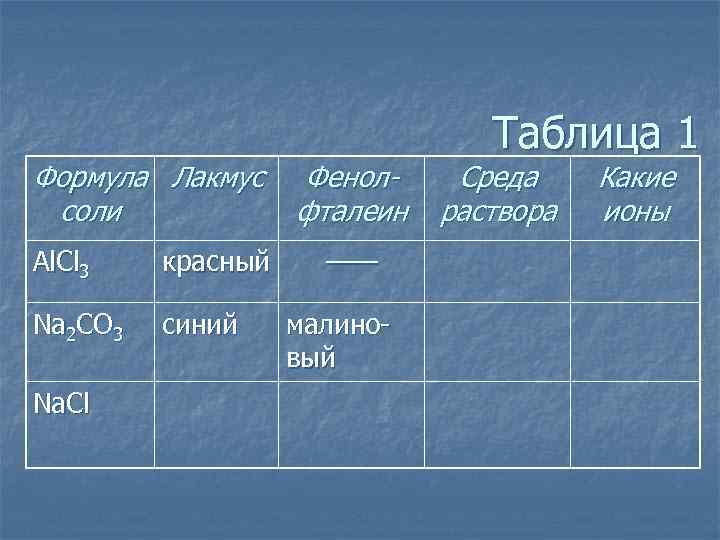 Формула Лакмус соли Al. Cl 3 красный Na 2 CO 3 синий Na. Cl Фенолфталеин —— малиновый Таблица 1 Среда раствора Какие ионы
Формула Лакмус соли Al. Cl 3 красный Na 2 CO 3 синий Na. Cl Фенолфталеин —— малиновый Таблица 1 Среда раствора Какие ионы
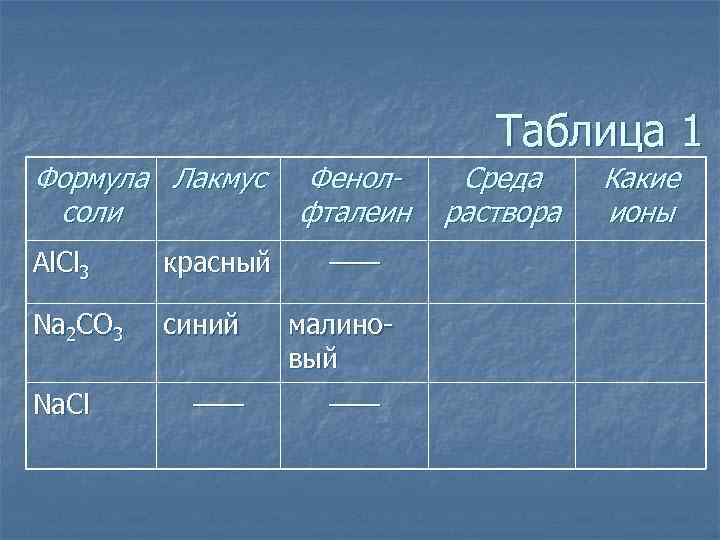 Таблица 1 Формула Лакмус соли Al. Cl 3 красный Na 2 CO 3 синий Na. Cl —— Фенолфталеин —— малиновый —— Среда раствора Какие ионы
Таблица 1 Формула Лакмус соли Al. Cl 3 красный Na 2 CO 3 синий Na. Cl —— Фенолфталеин —— малиновый —— Среда раствора Какие ионы
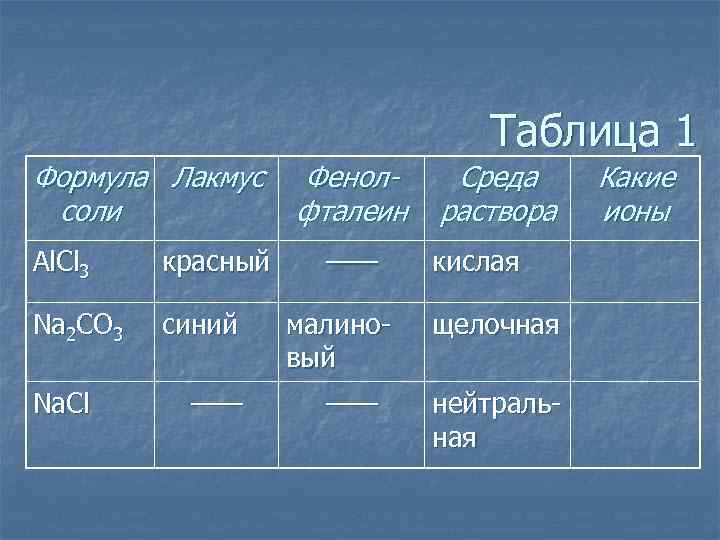 Таблица 1 Формула Лакмус соли Al. Cl 3 красный Na 2 CO 3 синий Na. Cl —— Фенолфталеин —— малиновый —— Среда раствора кислая щелочная нейтральная Какие ионы
Таблица 1 Формула Лакмус соли Al. Cl 3 красный Na 2 CO 3 синий Na. Cl —— Фенолфталеин —— малиновый —— Среда раствора кислая щелочная нейтральная Какие ионы
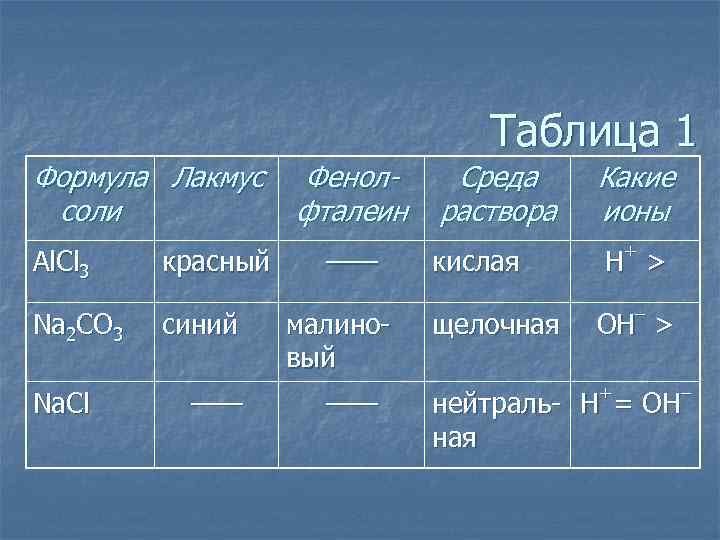 Таблица 1 Формула Лакмус соли Al. Cl 3 Na 2 CO 3 Na. Cl красный синий —— Фенолфталеин —— малиновый —— Среда раствора Какие ионы кислая Н+ > щелочная – OH > + – нейтраль- H = OH ная
Таблица 1 Формула Лакмус соли Al. Cl 3 Na 2 CO 3 Na. Cl красный синий —— Фенолфталеин —— малиновый —— Среда раствора Какие ионы кислая Н+ > щелочная – OH > + – нейтраль- H = OH ная
![Упрощенная схема гидролиза Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH–] < Упрощенная схема гидролиза Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH–] <](https://present5.com/presentation/3/106641256_368461177.pdf-img/106641256_368461177.pdf-9.jpg) Упрощенная схема гидролиза Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH–] < [H+] Кислая среда Что сильнее, того и больше!
Упрощенная схема гидролиза Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH–] < [H+] Кислая среда Что сильнее, того и больше!
 v. Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов водорода.
v. Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов водорода.
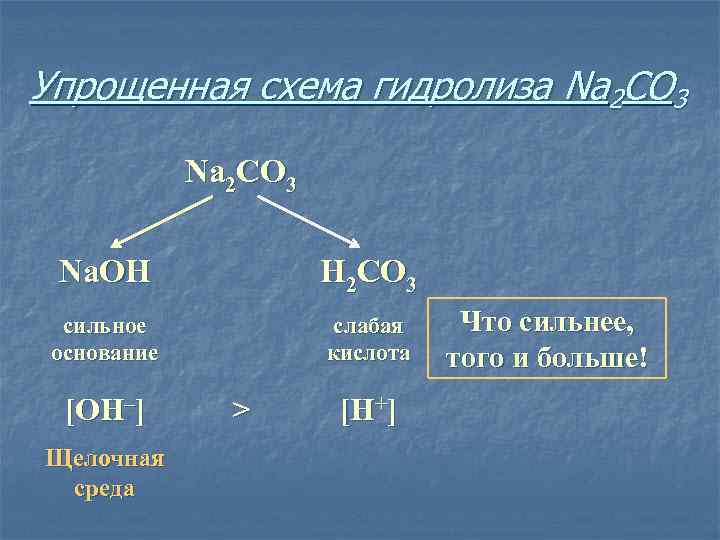 Упрощенная схема гидролиза Na 2 CO 3 Na. OH H 2 CO 3 сильное основание слабая кислота [OH–] Щелочная среда > [H+] Что сильнее, того и больше!
Упрощенная схема гидролиза Na 2 CO 3 Na. OH H 2 CO 3 сильное основание слабая кислота [OH–] Щелочная среда > [H+] Что сильнее, того и больше!
 v. Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
v. Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
![Упрощенная схема гидролиза Na. Cl Na. OH HCl сильное основание сильная кислота [OH–] = Упрощенная схема гидролиза Na. Cl Na. OH HCl сильное основание сильная кислота [OH–] =](https://present5.com/presentation/3/106641256_368461177.pdf-img/106641256_368461177.pdf-13.jpg) Упрощенная схема гидролиза Na. Cl Na. OH HCl сильное основание сильная кислота [OH–] = Нейтральная среда [H+] Что сильнее, того и больше!
Упрощенная схема гидролиза Na. Cl Na. OH HCl сильное основание сильная кислота [OH–] = Нейтральная среда [H+] Что сильнее, того и больше!
 v. Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество ионов водорода и гидроксид-ионов.
v. Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество ионов водорода и гидроксид-ионов.
 ● Гидролиз — это реакция обмена между некоторыми солями и водой ( «гидро» — вода, «лизис» — разложение)
● Гидролиз — это реакция обмена между некоторыми солями и водой ( «гидро» — вода, «лизис» — разложение)
 Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l – + 3 Сl
Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l – + 3 Сl
 Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН
Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН
 Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН ________________________________________
Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН ________________________________________
 Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН ________________________________________ 3+ Al – 2+ + 3 Сl + Н 2 O ↔ Аl. OН – + + 3 Сl + Н
Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН ________________________________________ 3+ Al – 2+ + 3 Сl + Н 2 O ↔ Аl. OН – + + 3 Сl + Н
 Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН ________________________________________ 3+ Al 3+ Аl – 2+ + 3 Сl + Н 2 O ↔ Аl. OН 2+ + Н 2 O ↔ Аl. OН + +Н – + + 3 Сl + Н
Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН ________________________________________ 3+ Al 3+ Аl – 2+ + 3 Сl + Н 2 O ↔ Аl. OН 2+ + Н 2 O ↔ Аl. OН + +Н – + + 3 Сl + Н
 Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН __________________________________ 3+ Al 3+ Аl – 2+ + 3 Сl + Н 2 O ↔ Аl. OН 2+ + Н 2 O ↔ Аl. OН Ш Избыток кислую краснеет. – + + 3 Сl + Н + +Н ионов водорода дает соли среду, поэтому лакмус
Уравнения гидролиза Аl. Сl 3 3+ Аl. Сl 3 ↔ А l + – + 3 Сl – Н 2 O ↔ Н + ОН __________________________________ 3+ Al 3+ Аl – 2+ + 3 Сl + Н 2 O ↔ Аl. OН 2+ + Н 2 O ↔ Аl. OН Ш Избыток кислую краснеет. – + + 3 Сl + Н + +Н ионов водорода дает соли среду, поэтому лакмус
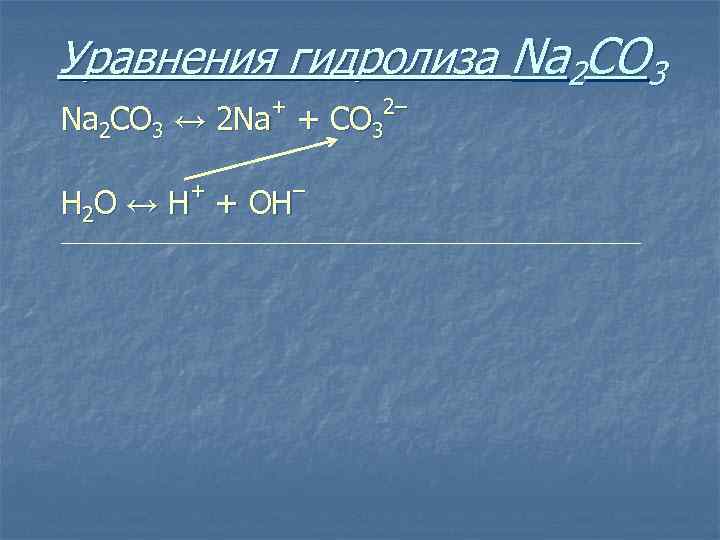
 Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + 2– С O 3
Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + 2– С O 3
 Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + – Н 2 O ↔ Н + ОН 2– С O 3
Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + – Н 2 O ↔ Н + ОН 2– С O 3
 Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________
Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________
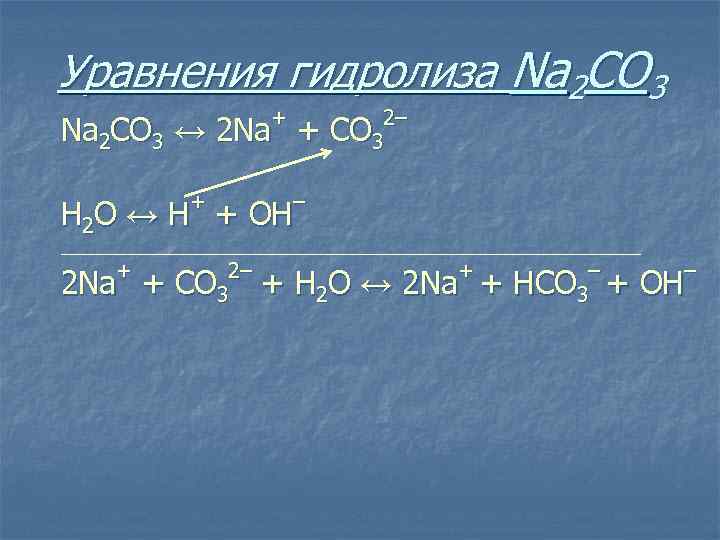 Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________ + 2 Na + 2– С O 3 + + Н 2 O ↔ 2 Na + – HCO 3 + – ОН
Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________ + 2 Na + 2– С O 3 + + Н 2 O ↔ 2 Na + – HCO 3 + – ОН
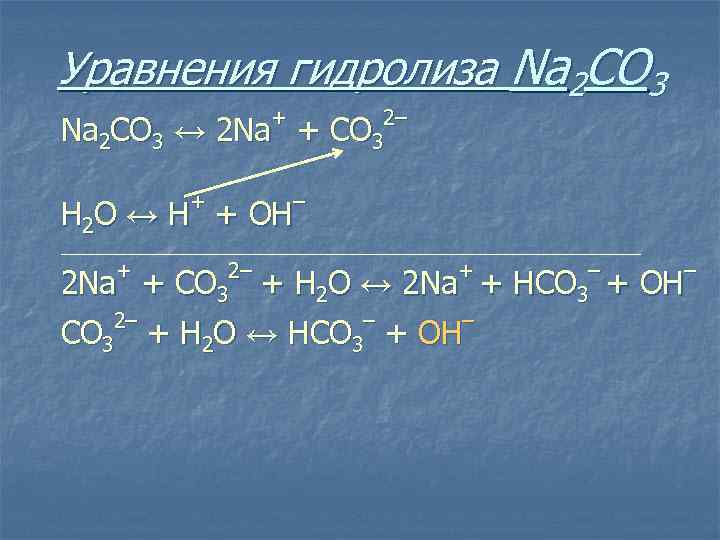 Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________ + 2– С O 3 + 2 Na + + Н 2 O ↔ 2 Na + 2– – – СO 3 + Н 2 O ↔ НСO 3 + ОН – HCO 3 + – ОН
Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________ + 2– С O 3 + 2 Na + + Н 2 O ↔ 2 Na + 2– – – СO 3 + Н 2 O ↔ НСO 3 + ОН – HCO 3 + – ОН
 Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________ + 2– С O 3 + 2 Na + + Н 2 O ↔ 2 Na + 2– – – СO 3 + Н 2 O ↔ НСO 3 + ОН Ш Избыток – HCO 3 + – ОН гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
Уравнения гидролиза Na 2 CO 3 + Na 2 CO 3 ↔ 2 Na + + 2– С O 3 – Н 2 O ↔ Н + ОН ______________________________________ + 2– С O 3 + 2 Na + + Н 2 O ↔ 2 Na + 2– – – СO 3 + Н 2 O ↔ НСO 3 + ОН Ш Избыток – HCO 3 + – ОН гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
 Уравнения гидролиза Na. Cl + – Na. Cl ↔ Na + Сl + – Н 2 O ↔ Н + ОН ______________________________________ + – Na + Сl + Н 2 O ↔ Na + Cl + H 2 O Ш Одинаковое количество гидроксидионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
Уравнения гидролиза Na. Cl + – Na. Cl ↔ Na + Сl + – Н 2 O ↔ Н + ОН ______________________________________ + – Na + Сl + Н 2 O ↔ Na + Cl + H 2 O Ш Одинаковое количество гидроксидионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
 • Какую среду будут иметь водные растворы следующих солей: 1 вариант а) нитрата цинка (II) б) сульфата калия в) сульфида натрия Ш Составьте 2 вариант а) хлорида меди (II) б) сульфита натрия в) нитрата бария ионное гидролиза этих солей. уравнение
• Какую среду будут иметь водные растворы следующих солей: 1 вариант а) нитрата цинка (II) б) сульфата калия в) сульфида натрия Ш Составьте 2 вариант а) хлорида меди (II) б) сульфита натрия в) нитрата бария ионное гидролиза этих солей. уравнение
 Ответы
Ответы
 а) 1 вариант 2+ Zn(NO 3)2 ↔ Zn + – 2 NO 3 Н 2 O ↔ Н+ + ОН – ____________________________ Zn 2+ + 2 NO 3– + Н 2 O ↔ Zn. OН+ + 2 NO 3– + Н+ Zn 2+ + Н 2 O ↔ Zn. OН+ + Н+ (среда кислая) Cu. Cl 2 ↔ Cu 2+ + 2 Сl – 2 вариант Н 2 O ↔ Н+ + ОН – ____________________________________________________________ Cu 2+ + Сl – + Н 2 O ↔ Cu. OH+ + Cl – + Н+ 2+ + + Сu + Н 2 O ↔ Сu. OH + Н (среда кислая)
а) 1 вариант 2+ Zn(NO 3)2 ↔ Zn + – 2 NO 3 Н 2 O ↔ Н+ + ОН – ____________________________ Zn 2+ + 2 NO 3– + Н 2 O ↔ Zn. OН+ + 2 NO 3– + Н+ Zn 2+ + Н 2 O ↔ Zn. OН+ + Н+ (среда кислая) Cu. Cl 2 ↔ Cu 2+ + 2 Сl – 2 вариант Н 2 O ↔ Н+ + ОН – ____________________________________________________________ Cu 2+ + Сl – + Н 2 O ↔ Cu. OH+ + Cl – + Н+ 2+ + + Сu + Н 2 O ↔ Сu. OH + Н (среда кислая)
 б) 1 вариант K 2 SO 4 ↔ 2 K+ + SO 42– Н 2 O ↔ Н+ + ОН – ______________________________________ 2 K+ + SO 42– + Н 2 O ↔ 2 K+ + SO 42– + H 2 O (среда нейтральная) 2 вариант + Na 2 SO 3 ↔ 2 Na + + Н 2 O ↔ Н + ОН 2– SO 3 – ______________________________________ 2 Na+ + SO 32– + Н 2 O ↔ 2 Na+ + HSO 3– + ОН 2– – – SO 3 + Н 2 O ↔ НSO 3 + ОН (среда щелочная)
б) 1 вариант K 2 SO 4 ↔ 2 K+ + SO 42– Н 2 O ↔ Н+ + ОН – ______________________________________ 2 K+ + SO 42– + Н 2 O ↔ 2 K+ + SO 42– + H 2 O (среда нейтральная) 2 вариант + Na 2 SO 3 ↔ 2 Na + + Н 2 O ↔ Н + ОН 2– SO 3 – ______________________________________ 2 Na+ + SO 32– + Н 2 O ↔ 2 Na+ + HSO 3– + ОН 2– – – SO 3 + Н 2 O ↔ НSO 3 + ОН (среда щелочная)
 в) + 2– Na 2 S ↔ 2 Na + S + Н 2 O ↔ Н + ОН 1 вариант – ______________________________________ + 2– + – – 2 Na + S + Н 2 O ↔ 2 Na + HS + ОН S 2– + Н 2 O ↔ НS– + ОН – (среда щелочная) 2 вариант Ba(NO 3)2 ↔ Ba 2+ + 2 NO 3– + Н 2 O ↔ Н + ОН – __________________________________ 2+ – 2 NO 3 2+ Ba + + Н 2 O ↔ Ba + (среда нейтральная) – 2 NO 3 + Н 2 O
в) + 2– Na 2 S ↔ 2 Na + S + Н 2 O ↔ Н + ОН 1 вариант – ______________________________________ + 2– + – – 2 Na + S + Н 2 O ↔ 2 Na + HS + ОН S 2– + Н 2 O ↔ НS– + ОН – (среда щелочная) 2 вариант Ba(NO 3)2 ↔ Ba 2+ + 2 NO 3– + Н 2 O ↔ Н + ОН – __________________________________ 2+ – 2 NO 3 2+ Ba + + Н 2 O ↔ Ba + (среда нейтральная) – 2 NO 3 + Н 2 O
 О значении и применении гидролиза. . . v v Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз крахмала, целлюлозы, белка, жиров. В технике крахмал подвергают гидролизу при взаимодействии с разбавленной серной кислотой и превращают в глюкозу (это реакция Кирхгофа, 1811 г. ). Продукты гидролиза крахмала широко используются в кондитерской промышленности, медицине, для технических целей. В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла, однако в настоящее время на производство моющих средств идут главным образом продукты переработки нефти. Продукты гидролиза целлюлозы в промышленности — это бумага, хлопчатобумажные ткани.
О значении и применении гидролиза. . . v v Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз крахмала, целлюлозы, белка, жиров. В технике крахмал подвергают гидролизу при взаимодействии с разбавленной серной кислотой и превращают в глюкозу (это реакция Кирхгофа, 1811 г. ). Продукты гидролиза крахмала широко используются в кондитерской промышленности, медицине, для технических целей. В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла, однако в настоящее время на производство моющих средств идут главным образом продукты переработки нефти. Продукты гидролиза целлюлозы в промышленности — это бумага, хлопчатобумажные ткани.
 Домашнее задание. n Пользуясь таблицей «Сильные и слабые электролиты» , приведите свои примеры солей, которые будут иметь кислую, щелочную и нейтральную среду раствора, и напишите к ним ионные уравнения гидролиза.
Домашнее задание. n Пользуясь таблицей «Сильные и слабые электролиты» , приведите свои примеры солей, которые будут иметь кислую, щелочную и нейтральную среду раствора, и напишите к ним ионные уравнения гидролиза.
 Урок окончен
Урок окончен
 Источники материалов n n Кузьменко Н. Е. , Еремин В. В. , Попков В. А. Начала химии. — М. : Экзамен, 2001. Хомченко Г. П. , Хомченко И. Г. Сборник задач по химии. — М. , 2000. http: //hydorlysis. narod. ru/pages/teoria. h tm http: //www. xumuk. ru/encyklopedia/1047. html
Источники материалов n n Кузьменко Н. Е. , Еремин В. В. , Попков В. А. Начала химии. — М. : Экзамен, 2001. Хомченко Г. П. , Хомченко И. Г. Сборник задач по химии. — М. , 2000. http: //hydorlysis. narod. ru/pages/teoria. h tm http: //www. xumuk. ru/encyklopedia/1047. html


