Растворы.ppt
- Количество слайдов: 19

ТЕМА РАСТВОРЫ. ПРИЧИНЫ ОБРАЗОВАНИЯ РАСТВОРОВ. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ ВЕЩЕСТВА В РАСТВОРЕ

Смеси веществ Смеси • Грубодисперсные системы (взвеси) • Тонкодисперсные системы (коллоидные системы) • Истинные растворы Размеры частиц • более 100 нм • 1 – 100 нм • менее 1 нм

Грубодисперсные системы • Дисперсионная среда – газообразная Дисперсная фаза: – твердая – пыль, дым, порошок – жидкая – смог, облако, туман • Дисперсионная среда – жидкая Дисперсионная фаза: – твердая – суспензия, паста – жидкая – эмульсия – газообразная – пена, газированная вода • Дисперсионная среда – твердая Дисперсная фаза: – твердая – горные породы, цветные стекла, композиты – жидкая – твердые эмульсии – газообразная – твердые пены

Нобелевские лауреаты • 1901 г. –Вант‐Гофф–первый Нобелевский лауреат, хим. кинетика, осмос • 1903 г. –Аррениус–электролитическая теория, диссоциация • 1909 г. –Оствальд–закон разведения • 1925 г. –Зигмонди–коллоидная химия Раствор – гомогенная система, состоящая из двух или более компонентов, имеющая переменный состав.
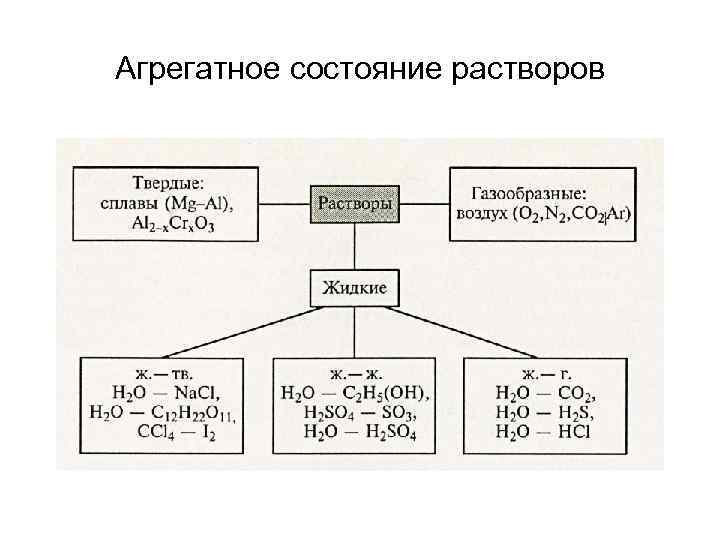
Агрегатное состояние растворов

Механизм растворения веществ Распределение частиц растворенного вещества молекулами растворителя
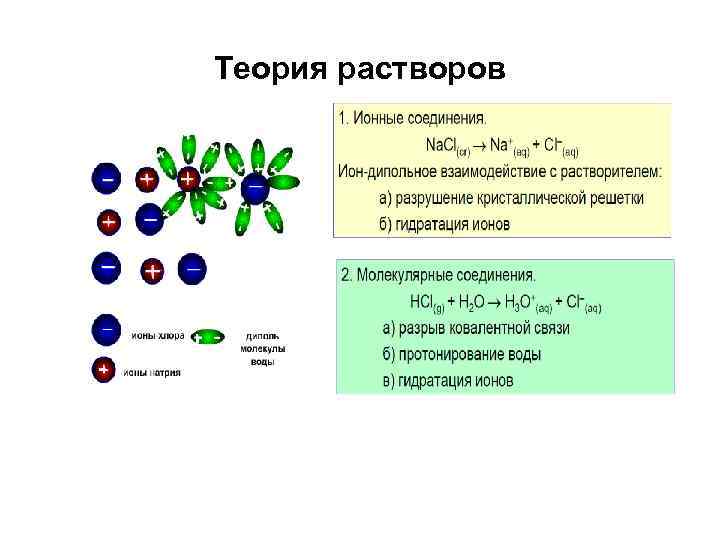
Теория растворов

Растворимость • РАСТВОРИМОСТЬЮ называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. • Если в 100 г воды растворяется более 10 г вещества, то такое вещество называют хорошо растворимым. • Если растворяется менее 1 г вещества – вещество малорастворимо. • Наконец, вещество считают практически нерастворимым, если в раствор переходит менее 0, 01 г вещества. Абсолютно нерастворимых веществ не бывает. Даже когда мы наливаем воду в стеклянный сосуд, очень небольшая часть молекул стекла неизбежно переходит в раствор.
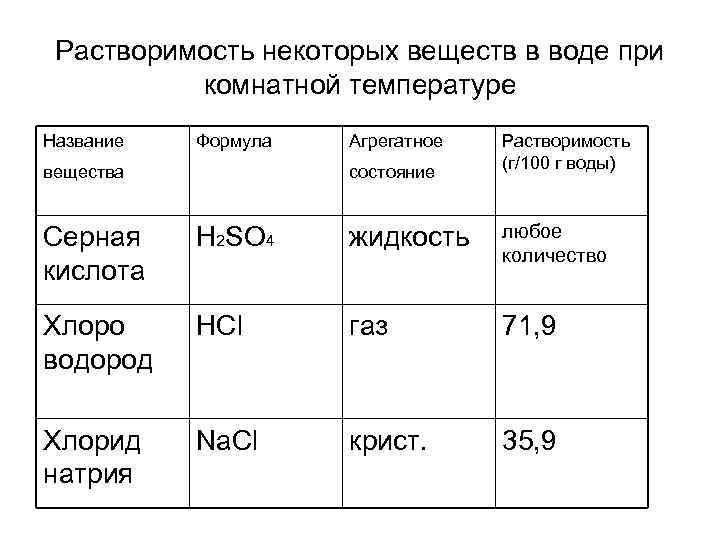
Растворимость некоторых веществ в воде при комнатной температуре Название Формула вещества Агрегатное состояние Растворимость (г/100 г воды) Серная кислота H 2 SO 4 жидкость любое количество Хлоро водород HCl газ 71, 9 Хлорид натрия Na. Cl крист. 35, 9

Растворимость газов в жидкостях § Влияние давления Увеличение давления -растворимость увеличивается. Уменьшение давления - растворимость уменьшается. § Влияние температуры Уменьшение температуры - растворимость увеличивается Увеличение температуры – растворимость уменьшается.
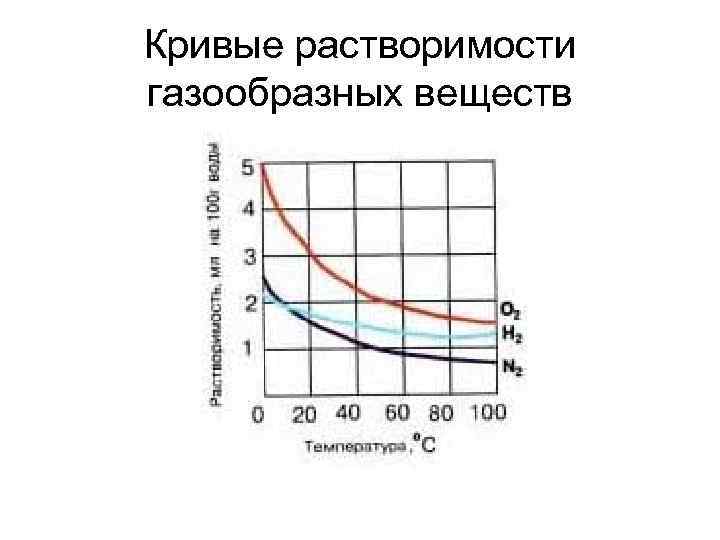
Кривые растворимости газообразных веществ
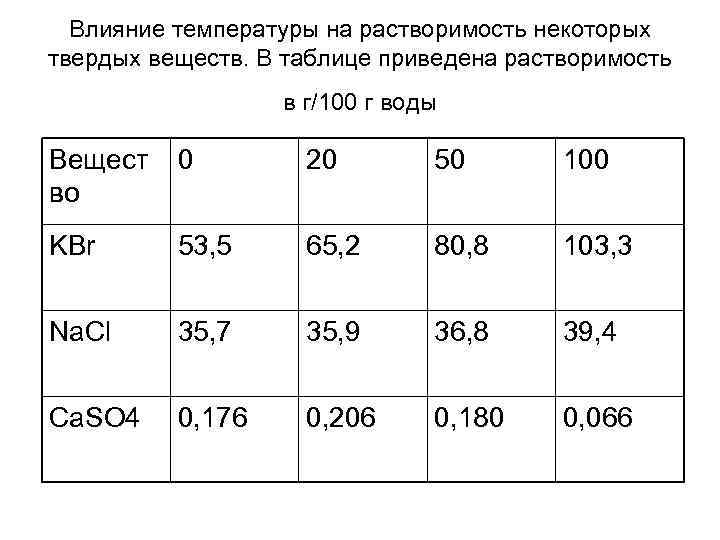
Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды Вещест во 0 20 50 100 KBr 53, 5 65, 2 80, 8 103, 3 Na. Cl 35, 7 35, 9 36, 8 39, 4 Ca. SO 4 0, 176 0, 206 0, 180 0, 066
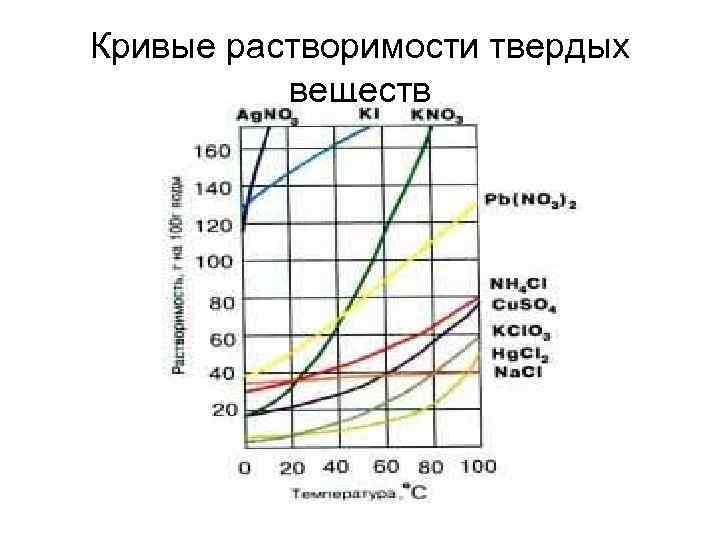
Кривые растворимости твердых веществ

Количественный состав раствора • Массовая доля • Молярная концентрация (молярность) • Молярная концентрация эквивалента (нормальность) • Титр Т= m/Vр-ра

Способы выражения концентрации растворов • Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m : w(B)= m(B) / m р-ра • Массовую долю растворённого вещества w(B) обычно выражают в долях единицы или в процентах. Например, массовая доля растворённого вещества – Ca. Cl 2 в воде равна 0, 06 или 6%. Это означает, что в растворе хлорида кальция массой 100 г содержится хлорид кальция массой 6 г и вода массой 94 г.

Молярная концентрация • Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора. C(B) = n(B) / V = m(B) / (M(B) · V), где М(B) - молярная масса растворенного вещества г/моль. • Молярная концентрация измеряется в моль/л и обозначается "M". Например, 2 M Na. OH - двухмолярный раствор гидроксида натрия. Один литр такого раствора содержит 2 моль вещества или 80 г (M(Na. OH) = 40 г/моль).

Молярная концентрация эквивалента • Молярная концентрация эквивалента, или нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора. Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это реальная или условная частица, соответствующая при химических превращениях 1 катиону водорода в кислотно-основных реакциях или 1 электрону в окислительно-восстановительных реакциях. Мэ основания = Моснования / число замещаемых в реакции гидроксильных групп Мэ кислоты = Мкислоты / число замещаемых в реакции атомов водорода Мэ соли = Мсоли / произведение числа катионов на его заряд

Молярная масса эквивалента • Вычисляется по формуле: Мэ = М·fэ, где fэ – фактор эквивалентности, то есть доля реальной частицы вещества, которая соответствует 1 катиону водорода в кислотноосновных реакциях или 1 электрону в окислительновосстановительных реакциях. fэ к-ты = 1/ число замещаемых в реакции атомов водорода fэ осн = 1/ число замещаемых в реакции гидроксильных групп fэ соли = 1/ произведение числа катионов на его заряд

Титр • Титр показывает число граммов растворенного вещества в 1 мл раствора. Вычисляется по формуле: Т= m/V [г/ мл]
Растворы.ppt