БУФЕР.ppt
- Количество слайдов: 60

Тема «Растворы электролитов и ионные равновесия. Буферные системы (растворы)»

Основные понятия теории растворов электролитов ¡ 1. Электролитами называют вещества, при взаимодействии с растворителем подвергающиеся диссоциации на ионы и сообщающие раствору способность проводить электрический ток.

Различают слабые и сильные электролиты Сильные электролиты в растворе полностью распадаются на ионы. К таким электролитам относятся сильные кислоты и основания, а также соли. ¡ Слабые электролиты в растворе распадаются на ионы частично. К слабым электролитам относятся карбоновые кислоты, аммиак, амины, фенолы и др. ¡

¡ Количество ионов каждого знака определяется стехиометрическими коэффициентами в формуле электролита при соблюдении закона электронейтральности, в соответствии с которым сумма положительных зарядов должна быть равна сумме отрицательных. Например, Са. CI 2→Ca 2++2 CI-.

Электролиты, молекулы которых распадаются на два иона, называются бинарными или симметричными. Если при этом образуются однозарядные ионы, электролит относится к типу 1, 1 -валентных (Na. Cl и т. д. ), если двухзарядные — к типу 2, 2 -валентных (Mg. SO 4 и т. д. ). ¡ Для несимметричных электролитов (K 2 SO 4 и т. д. ) тип электролита также устанавливается по заряду ионов и относится к типу 1, 2. ¡

2. Теория С Аррениуса (теория электролитической диссоциации (ТЭД) ¡ ¡ Согласно теории С. Аррениуса (1883— 1887), процесс распада растворенного вещества на ионы называют электролитической диссоциацией. Распад на ионы происходит независимо от того, подвергается или не подвергается вещество действию электрического тока. Способность электролитов распадаться на ионы количественно оценивают степенью диссоциации (α).

Степенью электролитической диссоциации называют отношение числа молекул распавшихся на ионы ni, к исходному числу молекул nΣ:

По значению α для растворов молярной концентрации эквивалента 0, 1 моль/л электролиты условно делят на 3 группы: ¡ ¡ Сильные (α ≥ 30%) Средней силы (α =3 -30%) Слабые (α ≥ 30%). Степень диссоциации слабого электролита уменьшается, если в раствор вводят один из ионов, образующихся при его диссоциации, -так называемый одноименный ион.

Слюна также является раствором электролитов, причем, регуляция электролитного состава слюны зависит от концентрации ионов в крови. ¡ Например, концентрация ионов в 1, 5 - 4 раза больше в слюне, чем в плазме, а концентрация ионов зависит от скорости слюноотделения и колеблется в пределах от 1 ммоль/дм 3 до 100 ммоль/дм 3.

Слюна (saliva) или чистая слюна – секрет слюнных ¡ крупных (околоушных, подчелюстных и подъязычных); 2) и малых слюнных желез (наибольшее количество их находятся в подслизистом слое губ, твердого и мягко нёба), выделяющийся в полость рта (рис. 1 и 2 соответственно). 1)
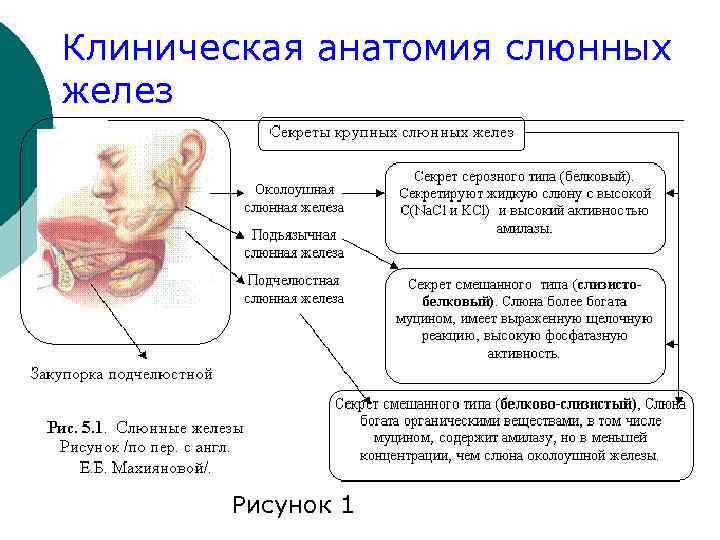
Клиническая анатомия слюнных желез Рисунок 1
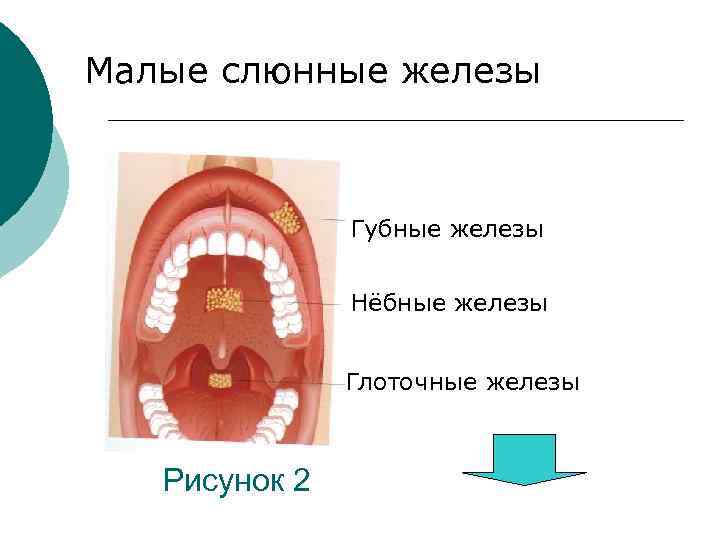
Малые слюнные железы Губные железы Нёбные железы Глоточные железы Рисунок 2

¡ За сутки выделяется 0, 5— 2, 0 л слюны, около трети ее образуется ¡ ¡ околоушными железами. Вне приема пищи слюна у человека выделяется для увлажнения полости рта в среднем со скоростью 0, 24 мл/мин. При жевании— со скоростью 3— 3, 5 мл/мин в зависимости от вида пищи; При введении в рот лимонной кислоты (0, 5 ммоль) — 7, 4 мл/мин.
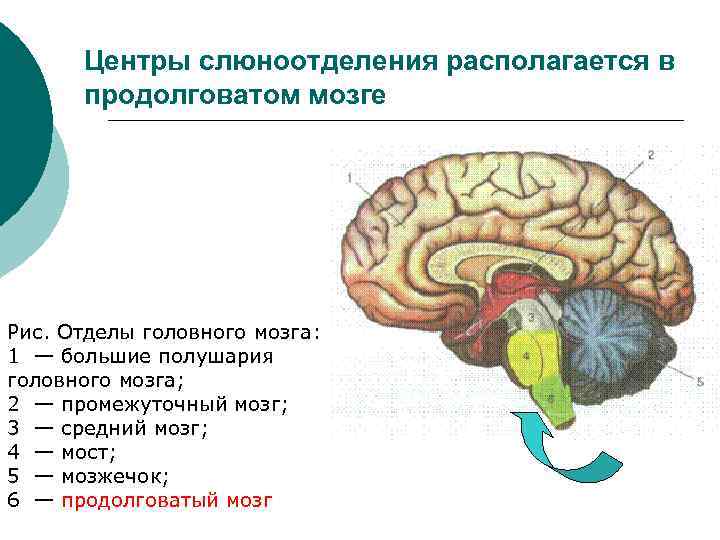
Центры слюноотделения располагается в продолговатом мозге Рис. Отделы головного мозга: 1 — большие полушария головного мозга; 2 — промежуточный мозг; 3 — средний мозг; 4 — мост; 5 — мозжечок; 6 — продолговатый мозг

Состав и свойства слюны ¡ В полости рта образуется смешанная слюна или ротовая жидкость, которая, кроме секретов слюнных желез включает микрофлору и продукты их жизнедеятельности, содержимое пародонтальных карманов, десневую жидкость, десквамированный (слущенный) эпителий, распавшиеся мигрирующие в полость рта лейкоциты, остатки пищевых продуктов и др.

Ротовая жидкость или смешанная слюна представляет собой вязкую, слегка опалесцирующую мутноватую жидкость с относительной плотностью 1, 001 -1, 017. ¡ Ротовая жидкость на 99, 0— 99, 4 % состоит из и 1, 0 -0, 6% растворенных в ней органических и минеральных веществ (см. таблицу) ¡ И меняется в зависимости от свойств, принимаемой пищи, возраста и ряда др. факторов (источника, метода сбора и вида стимулятора парасимпатической или симпатической нервной системой).
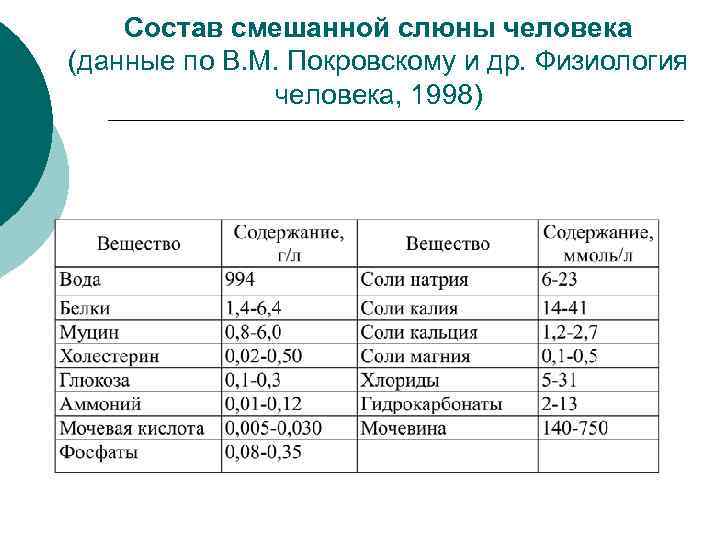
Состав смешанной слюны человека (данные по В. М. Покровскому и др. Физиология человека, 1998)

3. Равновесие электролитической диссоциации в растворе ¡ ¡ Диссоциация слабых электролитов подчиняется закону действующих масс и может быть количественно охарактеризована константой равновесия (при постоянных условиях не изменяющиеся во времени). Например, в системе вода– уксусная кислота устанавливается равновесие: CH 3 COOH↔H++CH 3 COO -. . ¡ Число молекул, распавшихся в единицу времени, равно числу молекул, образовавшихся за счет соединения ионов Н+ и CH 3 COO-.

Константа равновесия реакции диссоциации – это есть константа диссоциации (Кд). Например, выражение для Кд уксусной кислоты имеет вид: (1) где [Н +] и [CH 3 COO-] —равновесные концентрации соответствующих ионов, моль/л; [СНз. СООН] — равновесная концентрация недиссоциированных молекул кислоты, моль/л
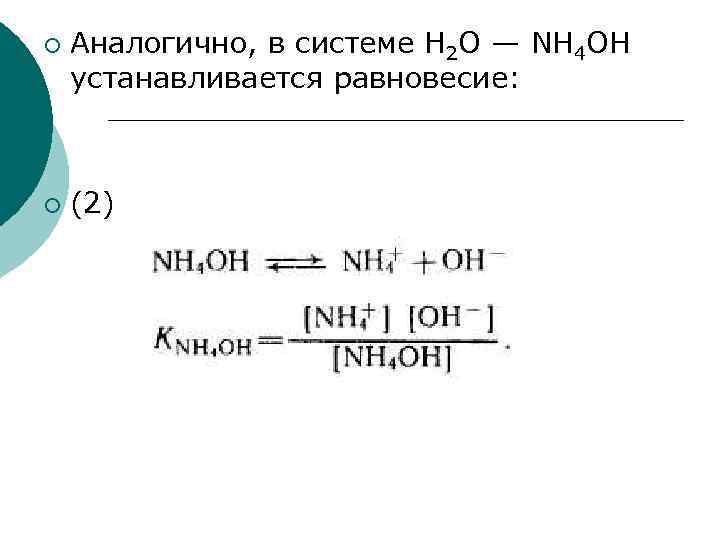
¡ ¡ Аналогично, в системе Н 2 О — NH 4 OH устанавливается равновесие: (2)

Константы диссоциации, выражаемые уравнениями (1 и 2), называют классическими (или концентрационными) константами и обозначают Кс (в отличие от термодинамических констант, которые обозначают Ка). В общем виде для кислоты НА и основания ВОН (1, 1 валентных электролитов): ¡ (3) (4) ¡

Концентрационную константу диссоциации можно выразить через степень диссоциации (α), если воспользоваться концентраций электролита (с) и определением степени диссоциации: (5 ) (6 ) (7 ) (8 )

¡ Уравнение (8) называют законом разведения Оствальда (связывает три величины: Кд, с и α). При небольших значениях α можно считать (1 — а) = 1 и

Как видно, степень диссоциации возрастает обратно пропорционально корню квадратному из концентрации электролита. Например, при уменьшении концентрации в 100 раз степень диссоциации возрастает в 10 раз. ¡ Степень диссоциации электролита зависит не только от концентрации, но и от природы растворителя, электролита и температуры. ¡ Чем больше Кдис. , тем сильнее электролит. ¡

¡ Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой Кс, а так называемым показателем константы диссоциации р. К, который определяется соотношением:

¡ Очевидно, что с возрастанием К, т. е. с увеличением силы кислоты, значение р. К уменьшается; следовательно, чем больше р. К, тем слабее кислоты.

¡ В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Так, диссоциация ортофосфорной кислоты протекает в три ступени: Как видно, что каждой из которых отвечает определенное значение ступенчатой константы диссоциации.

¡ Поскольку К 1>K 2> Кз, то в наибольшей степени протекает диссоциация по первой ступени, а при переходе к каждой последующей стадии степень диссоциации, как правило, резко уменьшается.

4. Ионное произведение воды Ион гидроксония Н 3 О+ — это протон, который связан с молекулой воды ковалентной связью.

Количественно диссоциация воды описывается: • константой диссоциации • и ионным произведением воды ионное произведение воды растет с увеличением температуры. ¡

Следовательно, в чистой воде и нейтральных растворах Таким образом,

5. Водородный показатель. Расчет р. Н растворов кислот и оснований ¡ ¡ Для удобства вычислений и построения графиков, выражающих зависимость какого-либо свойства от концентрации ионов водорода, был введен символ р. Н – водородный показатель — это десятичный логарифм активности (концентрации) водородных ионов в растворе, взятый с отрицательным знаком: p. H= -Ig[H+], аналогично р. ОН=-Ig[ОH-]; Логарифмируя уравнение получаем : -Ig[H+]+(-Ig[ОH-])= -Ig. КW=-Ig 1 10 -14 или р. Н+р. ОН=14. В водных растворах кислот и оснований р. Н среды зависит от природы и концентрации растворенного вещества.

¡ Для точного измерения р. Н используют специальные приборы – р. Н-метры, датчиками в которых служат стеклянные электроды, а для приблизительного определения р. Н служат кислотно-основные индикаторы (это слабые органические кислоты и основания, ионная и молекулярная формы которых сообщают раствору различную окраску). Например, молекула индикатора метилового оранжевого окрашивают раствор в красный цвет, а его анион в желтый.

¡ 1) 2) При вычислении р. Н раствора сильной кислоты или сильного основания необходимо знать: молярную концентрацию ([Н+] или [ОН-]) эквивалента данного вещества; коэффициент активности (γ или f) соответствующего иона (γ(Н+) или γ (ОН-)) в заданном растворе. При вычислении р. Н раствора слабой кислоты или слабого основания необходимо знать: молярную концентрацию данного вещества [Н+] или [ОН-]; константу его диссоциации (Кд).
![Расчет [H+], [OH-] и р. Н в растворах кислот и оснований Расчет [H+], [OH-] и р. Н в растворах кислот и оснований](https://present5.com/presentation/75708579_171426219/image-35.jpg)
Расчет [H+], [OH-] и р. Н в растворах кислот и оснований


Буферная система — это равновесная система, способная поддерживать примерно на постоянном уровне какой-либо параметр при незначительных внешних воздействиях. ¡
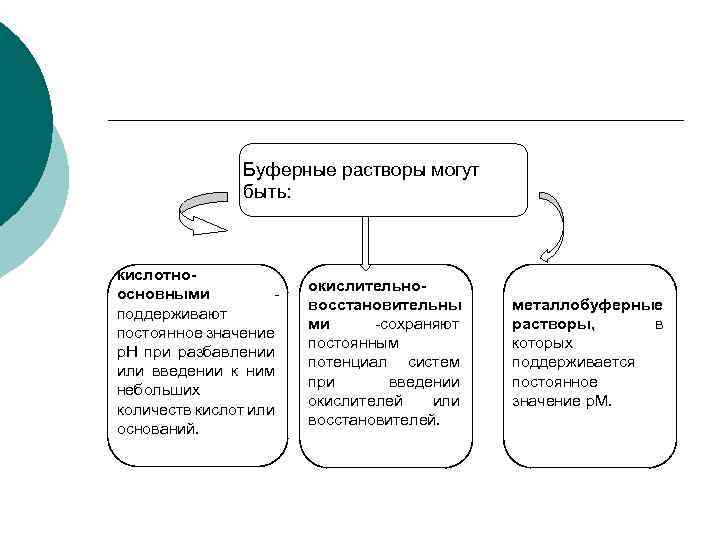
Буферные растворы могут быть: кислотноосновными поддерживают постоянное значение р. Н при разбавлении или введении к ним небольших количеств кислот или оснований. окислительновосстановительны ми -сохраняют постоянным потенциал систем при введении окислителей или восстановителей. металлобуферные растворы, в которых поддерживается постоянное значение р. М.

Кислотно-основные буферные системы /классификация/ 1) Кислотные: ¡ слабая кислота и ее анион НА/А-; например: ацетатная буферная система СН 3 СООН/СН 3 СОО-; ¡ анионы кислой и средней соли или двух кислых солей; например: карбонатная буферная система СО 32 -/НСО 3 -; фосфатная буферная система НРО 42/Н 2 РО 4 - (Н 2 РО 4 - играет роль слабой кислоты, а НРО 42 ее соли); 2) Основные. слабое основание и его катион В/ВН+; например: аммиачная буферная система NH 3/NH 4+;
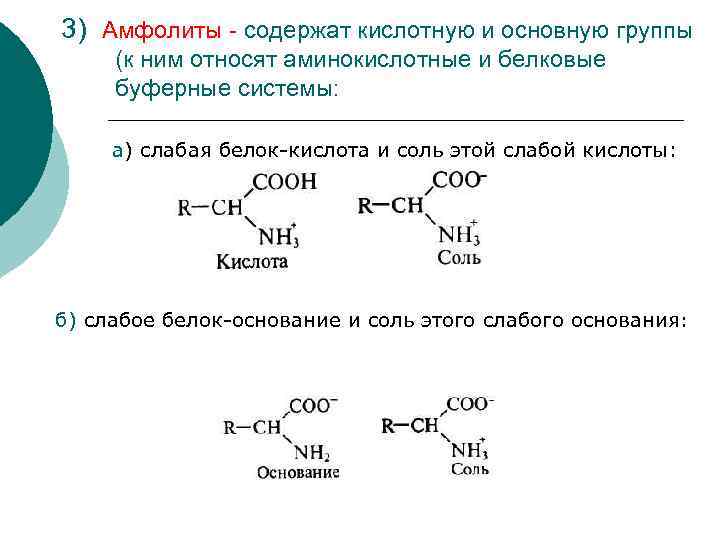
3) Амфолиты - содержат кислотную и основную группы (к ним относят аминокислотные и белковые буферные системы: а) слабая белок-кислота и соль этой слабой кислоты: б) слабое белок-основание и соль этого слабого основания:

¡ В протолитических (т. е. протонной) буферных растворах компонентами являются донор протона и акцептор протона, представляющие собой сопряженную кислотно-основную пару. 1)В качестве донора протона выступает слабая кислота (СН 3 СООН, H 2 CO 3) или сопряженная кислота слабого основания (NH 4+). 2) Акцептором протона в первом случае является анион слабой кислоты (СН 3 СОО-, НСОз-), а во втором - слабое основание (NH 3 Н 2 О).

Механизм действия буферных систем и расчетные формулы для определения р. Н в этих растворах ¡ Для объяснения механизм поддержания р. Н на одном уровне воспользуемся ацетатным буферным раствором (CH 3 COONa– как сильный электролит в водном растворе распадается на ионы нацело и СНз. СООН – как слабый электролит – лишь частично). В такой смеси протекают следующие реакции: Первая из реакций оказывается почти полностью подавленной из-за большой концентрации ацетат-ионов, вызванной диссоциацией сильного электролита — ацетата натрия.

¡ А) Если к такому раствору добавить сильную кислоту, то ионы водорода будут взаимодействовать с анионами с образованием молекул СНз. СООН и реакция среды не измениться, т. е. р. Н≈const. Ск↑, а Сс↓

¡ Б) Если к раствору добавлять сильное основание, то гидроксид-ионы будут взаимодействовать с ионами водорода (или с молекулами СН 3 СООН), хоть и в небольшом количестве, но содержащимися в растворе. Образование воды не влияет на реакцию среды. Пошедшие на реакцию с ОН- ионы водорода будут компенсированы за счет смещения равновесия реакции диссоциации СН 3 СООН вправо. р. Н≈const.

Вычисление р. Н буферных растворов Уравнение Гендерсона -Хассельбаха ¡ 1) Аналитическое выражение для расчета р. Н буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
![¡ разрешив его относительно концентрации ионов водорода [H+] можно написать: ¡ разрешив его относительно концентрации ионов водорода [H+] можно написать:](https://present5.com/presentation/75708579_171426219/image-46.jpg)
¡ разрешив его относительно концентрации ионов водорода [H+] можно написать:

¡ Уксусная кислота присутствует в растворе в смеси с CH 3 COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН 3 СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН 3 СОО-] = Ссоли, так как CH 3 COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:

¡ 2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем: но – Ig [Н+] есть р. Н, а – Ig К есть — силовой показатель кислоты. ¡ С учетом этого получим: ¡ р. К

Это уравнение называют уравнением буферного раствора (или уравнением Гендерсона. Гассельбаха). ¡ Аналогично для систем NH 4 OH + NH 4 C 1 получают выражения: ¡ 1. Запишем уравнение константы ионизации NH 4 OH и найдем [ОН-]: ¡

¡ 2. Отсюда находим: Зная, что р. Н + р. ОН = 14, получим:

Из уравнения Гендерсона-Гассельбаха следует ряд важных выводов. ¡ р. Н буферных растворов зависит от отрицательного десятичного логарифма константы диссоциации слабой кислоты р. Ка или основания р. Кв и от отношения концентраций кислотно-основной пары, но практически не зависит от разбавления раствора.

¡ ¡ ¡ Значения р. Ка любой кислоты и р. Кв любого основания можно вычислить по измеренному р. Н раствора, если известны молярные концентрации компонентов. Уравнение Гендерсона-Гассельбаха позволяет рассчитать р. Н буферного раствора, если известны значения р. Ка (р. Кв) и молярные концентрации компонентов. Уравнение Гендерсона-Гассельбаха можно использовать для определения отношения компонентов буфера, чтобы приготовить раствор с заданным значением р. Н.

Способность буферных растворов сохранять р. Н ограничена. Прибавлять кислоту и щелочь, существенно не меняя р. Н буферного раствора, можно лишь в небольших количествах. ¡ ¡ Величина, характеризующая способность буферного раствора противодействовать смещению реакции среды при добавлении кислот и щелочей, называется буферной емкостью. Буферная емкость (В) измеряется количеством моль или ммоль эквивалента кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет р. Н на единицу.

¡ Различают буферную емкость по кислоте (Вк) и буферную емкость по основанию (Вщ), которые рассчитываются с помощью уравнений:

р. Н слюны

Гидрокарбонатная буферная система обеспечивает 80% буферных свойств слюны и концентрация ее в слюне возрастает прямо пропорционально увеличению скорости секреции. ¡ Благодаря слюноотделению происходит вымывание ионов Н+ из зон, где они усиленно образуются. Это способствует уменьшению р. Н в полости рта, особенно после приема пищи. ¡

Буферная емкость нестимулированной слюны составляет 4, 45 -4, 65 ммоль/л НСl, а стимулированной — 5, 09 -5, 29 ммоль/л НСl. ¡ Следовательно, стимулированная слюна (собранная во время еды) обладает более высокой буферной емкостью, чем слюна, выделяемая в промежутках между приемами пищи. ¡

¡ Установлено, что приём в течение длительного времени углеводной пищи и отсутствие зубов снижает буферную ёмкость слюны, а приём высокобелковый повышает. Высокая буферная ёмкость слюны является фактором, повышающим резистентность к кариесу.

¡ Дёсневая жидкость образуется в значительно меньшем объеме, чем слюна, и также оказывает влияние на р. Н ротовой полости. Благодаря высокому содержанию аммония, катионных белков, мочевины, десневая жидкость имеет щелочную реакцию (р. Н = 7, 9 -8, 3).

БУФЕР.ppt