5 Физи-хим свойств почв.pptx
- Количество слайдов: 48
 Тема: Органическое вещество и физико-химические свойства почв • • Вопросы: 1. Органическое и гумусовое вещество 2. Поглотительная способность почв 3. Виды почвенной кислотности и щелочности. Буферность почв
Тема: Органическое вещество и физико-химические свойства почв • • Вопросы: 1. Органическое и гумусовое вещество 2. Поглотительная способность почв 3. Виды почвенной кислотности и щелочности. Буферность почв
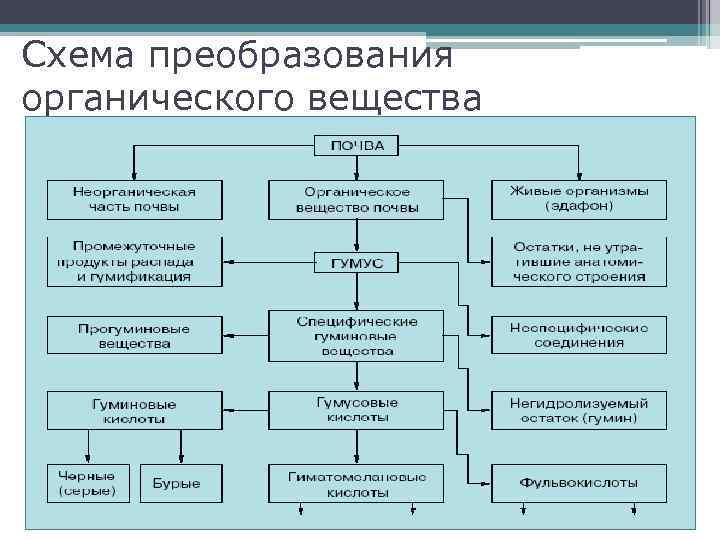 Схема преобразования органического вещества
Схема преобразования органического вещества

 • Органическое вещество (ОВ) – это совокупность разложившихся и неразложившихся остатков флоры и фауны, сконцентрированных в верхних горизонтах почвы. • Источники поступления ОВ: наземный опад, отмершие растения (их растительные остатки и корешки), не потерявшие анатомического строения, остатки животных и мертвой микробной массы, а также продукты их жизнедеятельности. • В элементарном составе органических остатков главную роль играют: углерод, кислород, водород и азот. • Из этих элементов построены тела растений и животных.
• Органическое вещество (ОВ) – это совокупность разложившихся и неразложившихся остатков флоры и фауны, сконцентрированных в верхних горизонтах почвы. • Источники поступления ОВ: наземный опад, отмершие растения (их растительные остатки и корешки), не потерявшие анатомического строения, остатки животных и мертвой микробной массы, а также продукты их жизнедеятельности. • В элементарном составе органических остатков главную роль играют: углерод, кислород, водород и азот. • Из этих элементов построены тела растений и животных.
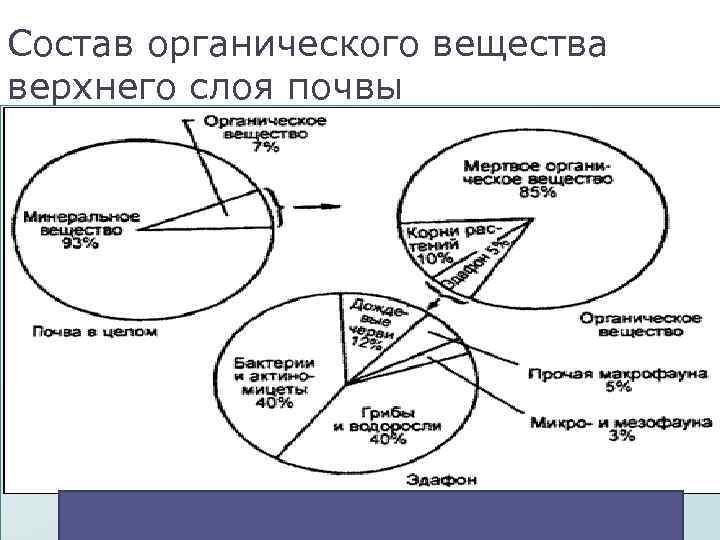 Состав органического вещества верхнего слоя почвы
Состав органического вещества верхнего слоя почвы
 • Важнейшими органическими соединениями, встречающимися в растениях и животных, являются углеводы, лигнин, азотистые вещества, жиры, воск, смолы, дубильные вещества. • Содержание органического вещества в гумусовом горизонте различных природных зон варьирует. • в пустынных и полупустынных почвах от 0, 5 -1, 0% • в черноземах лесостепной зоны от 4 -15%. • В пахотном слое почв, используемых в земледелии, содержание ОВ изменяется в пределах 2 -5%. Исследованиями Л. Е. Родина, Н. И. Базилевич и М. М. Кононовой установлено, что ежегодно в различных растительных ассоциациях в почву поступает от 1, 2 до 21 т/га растительных остатков, способствуя образованию гумуса
• Важнейшими органическими соединениями, встречающимися в растениях и животных, являются углеводы, лигнин, азотистые вещества, жиры, воск, смолы, дубильные вещества. • Содержание органического вещества в гумусовом горизонте различных природных зон варьирует. • в пустынных и полупустынных почвах от 0, 5 -1, 0% • в черноземах лесостепной зоны от 4 -15%. • В пахотном слое почв, используемых в земледелии, содержание ОВ изменяется в пределах 2 -5%. Исследованиями Л. Е. Родина, Н. И. Базилевич и М. М. Кононовой установлено, что ежегодно в различных растительных ассоциациях в почву поступает от 1, 2 до 21 т/га растительных остатков, способствуя образованию гумуса
 Типы и виды растительных остатков определяют количественную и качественную сторону в накоплении перегноя. • Вклад различных биоценозов в образовании перегноя неодинаков. В экосистемах тундры и пустыни количество ежегодного опада не превышает 1 т/га сухого вещества. • В экосистемах лесостепной зоны – его объём увеличивается до 10 -15 т/га, а в тропических лесах – до 25 и более т/га. • В агроценозах учитываются послеуборочные остатки: после пропашных культур – 1 -2, зерновых – 2 -3, многолетних трав 5 -8 т/га. • Больше остатков –больше перегноя.
Типы и виды растительных остатков определяют количественную и качественную сторону в накоплении перегноя. • Вклад различных биоценозов в образовании перегноя неодинаков. В экосистемах тундры и пустыни количество ежегодного опада не превышает 1 т/га сухого вещества. • В экосистемах лесостепной зоны – его объём увеличивается до 10 -15 т/га, а в тропических лесах – до 25 и более т/га. • В агроценозах учитываются послеуборочные остатки: после пропашных культур – 1 -2, зерновых – 2 -3, многолетних трав 5 -8 т/га. • Больше остатков –больше перегноя.
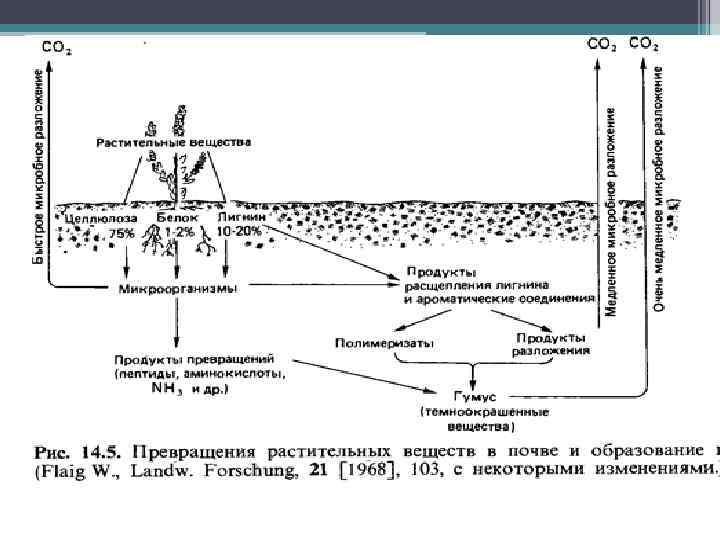
 Гумусообразование – процесс разложения растительных остатков на месте их отмирания и последующего новообразования гумуса. • Морфологически выражается в образовании поверхностного [темного] гумусового горизонта комковатой или зернистой структуры, содержащего значительное количество живых и мертвых корней. • Гумусонакопление - процесс аккумуляции гумуса в профиле почв в результате разложения ОВ и гумусообразования.
Гумусообразование – процесс разложения растительных остатков на месте их отмирания и последующего новообразования гумуса. • Морфологически выражается в образовании поверхностного [темного] гумусового горизонта комковатой или зернистой структуры, содержащего значительное количество живых и мертвых корней. • Гумусонакопление - процесс аккумуляции гумуса в профиле почв в результате разложения ОВ и гумусообразования.
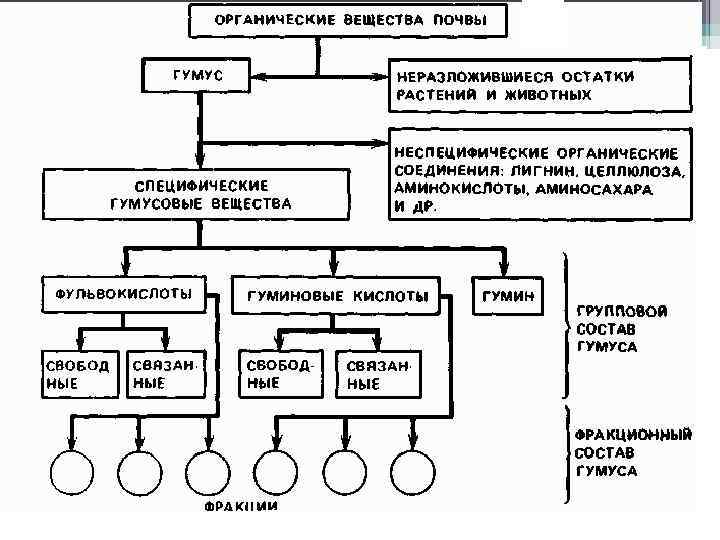
 Гумусом, или гумусовыми веществами, называются специфические органические соединения (гумусовые кислоты, гумин), образующиеся в результате множественных химических превращений и способные к полимеризации (уплотнению молекул). • Характерная черта гумуса – устойчивость против микроорганизмов и как следствие накопление и длительное сохранение в почве.
Гумусом, или гумусовыми веществами, называются специфические органические соединения (гумусовые кислоты, гумин), образующиеся в результате множественных химических превращений и способные к полимеризации (уплотнению молекул). • Характерная черта гумуса – устойчивость против микроорганизмов и как следствие накопление и длительное сохранение в почве.
 Гумусовые вещества (ГВ) составляют 80 -90% общего количества органического вещества в почве. • Г. В. – это высокомолекулярные соединения циклического строения, содержащие азот. • • Г. В. включают 3 группы соединений: гуминовые кислоты (ГК), Фульвокислоты (ФК), гумусовые угли – гумин, ульмин (ГУ).
Гумусовые вещества (ГВ) составляют 80 -90% общего количества органического вещества в почве. • Г. В. – это высокомолекулярные соединения циклического строения, содержащие азот. • • Г. В. включают 3 группы соединений: гуминовые кислоты (ГК), Фульвокислоты (ФК), гумусовые угли – гумин, ульмин (ГУ).
 Состав и строение почвенного гумуса. • Гуминовые кислоты состоят из: • углерода – 52 -58%; водорода - 3, 3 -4, 8%; • азота – 3, 6 -4, 1%; кислорода 34 -39%. • Фульвокислоты: • углерода – 45, 3%; водорода – 5, 0%; • азота – 2, 4%; кислорода - 47, 3%. • Отличие ФК от ГК – менее конденсированы, более просты по своему строению. В гумусовоиллювиальных горизонтах ряда подзолистых почв ФК закреплены в форме соединений с железом и особенно алюминием.
Состав и строение почвенного гумуса. • Гуминовые кислоты состоят из: • углерода – 52 -58%; водорода - 3, 3 -4, 8%; • азота – 3, 6 -4, 1%; кислорода 34 -39%. • Фульвокислоты: • углерода – 45, 3%; водорода – 5, 0%; • азота – 2, 4%; кислорода - 47, 3%. • Отличие ФК от ГК – менее конденсированы, более просты по своему строению. В гумусовоиллювиальных горизонтах ряда подзолистых почв ФК закреплены в форме соединений с железом и особенно алюминием.
 Гумин и ульмин (гумусовые угли) – инертная (труднорастворимая) часть почвенного гумуса. • По данным акад. И. В. Тюрина, гумин представляет собой сложный комплекс, в состав которого входят гуминовые и фульвокислоты, соединённые по типу сложных эфиров. • Инертность ГУ объясняется их прочной связью с минеральной частью почвы, особенно с частицами глинистых минералов. • Кроме того, в состав почвенного гумуса могут входить битумы, растворимые в органических растворителях (спирт, бензол и др. ). Их химический состав – совокупность жиров, высокомолекулярных жирных кислот, восков и смол. Их содержание в автоморфных почвах – 2 -4% от общего содержания гумуса, в заболоченных повышается до 10 -20%.
Гумин и ульмин (гумусовые угли) – инертная (труднорастворимая) часть почвенного гумуса. • По данным акад. И. В. Тюрина, гумин представляет собой сложный комплекс, в состав которого входят гуминовые и фульвокислоты, соединённые по типу сложных эфиров. • Инертность ГУ объясняется их прочной связью с минеральной частью почвы, особенно с частицами глинистых минералов. • Кроме того, в состав почвенного гумуса могут входить битумы, растворимые в органических растворителях (спирт, бензол и др. ). Их химический состав – совокупность жиров, высокомолекулярных жирных кислот, восков и смол. Их содержание в автоморфных почвах – 2 -4% от общего содержания гумуса, в заболоченных повышается до 10 -20%.
 Состав гумуса в разных типах почв – неодинаков. • Показателем их различия принято считать соотношение между гуминовыми кислотами и фульвокислотами. Исследованиями (М. М. Кононова и др. ) установлено, что в лесной сильноподзолистой почве в гор. А 2 это соотношение равно 0, 56%; • В гор. А 1 дерново-подзолистой почвы под лесом – 0, 79%; в тёмно-серой лесной – 1, 11; • в целинном обыкновенном чернозёме – 1, 6; в залежной тёмно-каштановой почве – 1, 7; в светлом серозёме на пашне – 0, 7; краснозёме под лесом -0, 8 %
Состав гумуса в разных типах почв – неодинаков. • Показателем их различия принято считать соотношение между гуминовыми кислотами и фульвокислотами. Исследованиями (М. М. Кононова и др. ) установлено, что в лесной сильноподзолистой почве в гор. А 2 это соотношение равно 0, 56%; • В гор. А 1 дерново-подзолистой почвы под лесом – 0, 79%; в тёмно-серой лесной – 1, 11; • в целинном обыкновенном чернозёме – 1, 6; в залежной тёмно-каштановой почве – 1, 7; в светлом серозёме на пашне – 0, 7; краснозёме под лесом -0, 8 %
 Итак, образование гумуса представляет собой совокупность ряда биологических процессов, объединённых в 2 группы: распада исходных органических соединений; синтеза новых, высокомолекулярных гумусовых соединений. Эти процессы идут непрерывно, в тесном взаимодействии друг с другом и в тесной зависимости от окружающих условий. Условия разложения органического вещества определили типы гумуса: мор, модер, мюлль, анмоор, а также олиготрофный и аутрофный торф.
Итак, образование гумуса представляет собой совокупность ряда биологических процессов, объединённых в 2 группы: распада исходных органических соединений; синтеза новых, высокомолекулярных гумусовых соединений. Эти процессы идут непрерывно, в тесном взаимодействии друг с другом и в тесной зависимости от окружающих условий. Условия разложения органического вещества определили типы гумуса: мор, модер, мюлль, анмоор, а также олиготрофный и аутрофный торф.
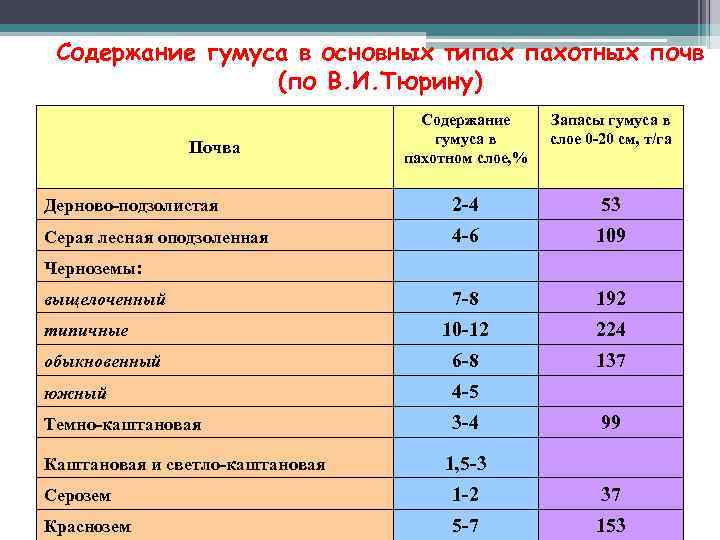 Содержание гумуса в основных типах пахотных почв (по В. И. Тюрину) Содержание гумуса в пахотном слое, % Запасы гумуса в слое 0 -20 см, т/га Дерново-подзолистая 2 -4 53 Серая лесная оподзоленная 4 -6 109 7 -8 192 10 -12 224 обыкновенный 6 -8 137 южный 4 -5 Темно-каштановая 3 -4 99 1, 5 -3 Серозем 1 -2 37 Краснозем 5 -7 153 Почва Черноземы: выщелоченный типичные Каштановая и светло-каштановая
Содержание гумуса в основных типах пахотных почв (по В. И. Тюрину) Содержание гумуса в пахотном слое, % Запасы гумуса в слое 0 -20 см, т/га Дерново-подзолистая 2 -4 53 Серая лесная оподзоленная 4 -6 109 7 -8 192 10 -12 224 обыкновенный 6 -8 137 южный 4 -5 Темно-каштановая 3 -4 99 1, 5 -3 Серозем 1 -2 37 Краснозем 5 -7 153 Почва Черноземы: выщелоченный типичные Каштановая и светло-каштановая
 Причины потерь гумуса пахотными почвами • Уменьшение количества растительных остатков, поступающих в почву, при смене естественного агроценоза агроценозом. • Усиление минерализации органического вещества в результате интенсивной обработки и повышения степени аэрации почв. • Деградация гумуса из-за применения физиологически кислых удобрений и активации микрофлоры из-за вносимых удобрений. • Усиление минерализации из-за осушительных мероприятий и орошения. • Водная и ветровая эрозия почв. Определение расходов гумуса пахотного горизонта почвы сводится к определению азота, израсходованного культурой. Если принять среднее содержание азота в гумусе за 5%, то при выносе 100 кг этого элемента с урожаем растений почва потеряет 2000 кг/га гумуса.
Причины потерь гумуса пахотными почвами • Уменьшение количества растительных остатков, поступающих в почву, при смене естественного агроценоза агроценозом. • Усиление минерализации органического вещества в результате интенсивной обработки и повышения степени аэрации почв. • Деградация гумуса из-за применения физиологически кислых удобрений и активации микрофлоры из-за вносимых удобрений. • Усиление минерализации из-за осушительных мероприятий и орошения. • Водная и ветровая эрозия почв. Определение расходов гумуса пахотного горизонта почвы сводится к определению азота, израсходованного культурой. Если принять среднее содержание азота в гумусе за 5%, то при выносе 100 кг этого элемента с урожаем растений почва потеряет 2000 кг/га гумуса.
 Роль гумуса в питании растений и баланс гумуса 1. Гумус – источник элементов питания для растений. В нем содержится 98 -99% азота, 30 -40% фосфора, 90% серы от общего содержания их в почве. 2. Гумусовые кислоты совместно с неспецифическими органическими и минеральными кислотами разрушают почвенные силикаты и алюмосиликаты, растворяют карбонаты кальция и магния, фосфаты, делая их доступными для растений. 3. Гумусовые кислоты в высокодисперсном состоянии могут выступать в микроколичествах как стимуляторы роста растений. 4. Органическое вещество почвы – источник пищи микроорганизмов. При отмирании микроорганизмов происходит высвобождение доступных для растений форм питательных элементов. 5. Органическое вещество почвы участвует в адсорбционных процессах в почве, повышая ее поглотительную способность и буферность, улучшает физические свойства почв (влагоемкость, водо- и воздухопроницаемость, тепловой режим.
Роль гумуса в питании растений и баланс гумуса 1. Гумус – источник элементов питания для растений. В нем содержится 98 -99% азота, 30 -40% фосфора, 90% серы от общего содержания их в почве. 2. Гумусовые кислоты совместно с неспецифическими органическими и минеральными кислотами разрушают почвенные силикаты и алюмосиликаты, растворяют карбонаты кальция и магния, фосфаты, делая их доступными для растений. 3. Гумусовые кислоты в высокодисперсном состоянии могут выступать в микроколичествах как стимуляторы роста растений. 4. Органическое вещество почвы – источник пищи микроорганизмов. При отмирании микроорганизмов происходит высвобождение доступных для растений форм питательных элементов. 5. Органическое вещество почвы участвует в адсорбционных процессах в почве, повышая ее поглотительную способность и буферность, улучшает физические свойства почв (влагоемкость, водо- и воздухопроницаемость, тепловой режим.
 По содержанию гумуса (общее содержание органического вещества в почве, %) все почвы условно делятся на: • безгумусные < 1 • очень низкогумусные I— 2 ▫ низкогумусмые 2— 4 • среднегумусные 4— 6 ▫ высокогумусные 6— 10 • очень высокогумусные (тучные). . 10— 15 ▫ перегнойные 15— 30 • торфяные 30
По содержанию гумуса (общее содержание органического вещества в почве, %) все почвы условно делятся на: • безгумусные < 1 • очень низкогумусные I— 2 ▫ низкогумусмые 2— 4 • среднегумусные 4— 6 ▫ высокогумусные 6— 10 • очень высокогумусные (тучные). . 10— 15 ▫ перегнойные 15— 30 • торфяные 30
 Вопрос 2. Поглотительная способность почв (ПСП) • – это явление поглощения и удерживания веществ из почвенного раствора, а также коллоидных ЭПЧ, паров, газов и живых микроорганизмов. • С поглотительной способностью связаны важнейшие особенности почвообразовательных процессов и многие свойства, определяющие плодородие почв. • Поглотительные свойства почв могут существенно изменяться под влиянием растений. • К. К. Гедройц выделил 5 видов поглотительной способности почв: механическую, физическую, химическую, биологическую и физико-химическую.
Вопрос 2. Поглотительная способность почв (ПСП) • – это явление поглощения и удерживания веществ из почвенного раствора, а также коллоидных ЭПЧ, паров, газов и живых микроорганизмов. • С поглотительной способностью связаны важнейшие особенности почвообразовательных процессов и многие свойства, определяющие плодородие почв. • Поглотительные свойства почв могут существенно изменяться под влиянием растений. • К. К. Гедройц выделил 5 видов поглотительной способности почв: механическую, физическую, химическую, биологическую и физико-химическую.
 Механическая ПСП – это свойство почвы поглощать твёрдые частицы, поступающие с водой или воздухом, размеры которых превышают размеры почвенных пор. В этом случае почву можно представить как набор сит с отверстиями разного диаметра. • Физическая ПСП (молекулярная адсорбция)- это свойство почвы изменяющее концентрацию молекул различных веществ на поверхности твёрдых частиц за счёт физического взаимодействия молекул. • Каждая почвенная частичка оказывается окружённой молекулярным слоем воды (плёнкой). Поэтому чем больше в почве мелких частиц, тем больше общая поверхность водной плёнки, а следовательно и энергия сил поверхностного натяжения, т. е. с изменением величины поверхности меняется и поверхностная энергия.
Механическая ПСП – это свойство почвы поглощать твёрдые частицы, поступающие с водой или воздухом, размеры которых превышают размеры почвенных пор. В этом случае почву можно представить как набор сит с отверстиями разного диаметра. • Физическая ПСП (молекулярная адсорбция)- это свойство почвы изменяющее концентрацию молекул различных веществ на поверхности твёрдых частиц за счёт физического взаимодействия молекул. • Каждая почвенная частичка оказывается окружённой молекулярным слоем воды (плёнкой). Поэтому чем больше в почве мелких частиц, тем больше общая поверхность водной плёнки, а следовательно и энергия сил поверхностного натяжения, т. е. с изменением величины поверхности меняется и поверхностная энергия.
 • Химическая ПСП (хемосорбция)- способность почвы удерживать катионы и анионы в форме нерастворимых или труднорастворимых соединений, выпадающих в осадок из почвенного раствора. Например, новообразования в форме белоглазки, псевдомицелия, охристых пятен, рудяковых зёрен. Благодаря химической ПС в почвах накапливаются такие элементы питания растений, как фосфор и сера. • Биологическая ПСП - способность почвы обеспечивать закрепление азота и основных элементов питания в соотношениях наиболее выгодных для растений. Она обусловлена избирательным поглощением элементов питания корнями растений и микроорганизмами. В определённых случаях возможна конкуренция между растениями и микроорганизмами.
• Химическая ПСП (хемосорбция)- способность почвы удерживать катионы и анионы в форме нерастворимых или труднорастворимых соединений, выпадающих в осадок из почвенного раствора. Например, новообразования в форме белоглазки, псевдомицелия, охристых пятен, рудяковых зёрен. Благодаря химической ПС в почвах накапливаются такие элементы питания растений, как фосфор и сера. • Биологическая ПСП - способность почвы обеспечивать закрепление азота и основных элементов питания в соотношениях наиболее выгодных для растений. Она обусловлена избирательным поглощением элементов питания корнями растений и микроорганизмами. В определённых случаях возможна конкуренция между растениями и микроорганизмами.
 Физико-химическая ПСП (обменная) – это способность коллоидных (илистых) частичек почвы удерживать и обменивать ионы с почвенным раствором. Водный раствор, окружающий почвенные частицы, содержит значительное количество веществ, диссоциированных на ионы – катионы (заряжены положительно, такие как Na+, K+, Mg 2+, Ca 2+, H+, F 3+) и анионы (заряжены отрицательно – Cl-, SO 4 2 -, PO 4 3 -, NO 3 2 -). • Она определяет физико-химические свойства почв, такие как кислотность, щелочность, буферная способность, которые в свою очередь определяют агрономические свойства почв и почвенное плодородие.
Физико-химическая ПСП (обменная) – это способность коллоидных (илистых) частичек почвы удерживать и обменивать ионы с почвенным раствором. Водный раствор, окружающий почвенные частицы, содержит значительное количество веществ, диссоциированных на ионы – катионы (заряжены положительно, такие как Na+, K+, Mg 2+, Ca 2+, H+, F 3+) и анионы (заряжены отрицательно – Cl-, SO 4 2 -, PO 4 3 -, NO 3 2 -). • Она определяет физико-химические свойства почв, такие как кислотность, щелочность, буферная способность, которые в свою очередь определяют агрономические свойства почв и почвенное плодородие.
 Почвенный поглощающий комплекс (ППК) – это совокупность минеральных, органических и органоминеральных частиц твёрдой фазы почв, преимущественно <0, 001 мм, обладающих физикохимической поглотительной способностью (Толковый словарь). • В значительной мере часть катионов взаимодействует с коллоидами почвы и переходит в связанное, поглощенное состояние. • Ёмкость катионного обмена (ЕКО) – это сумма поглощенных (обменных) катионов. • В то же время большая часть анионов, за исключением фосфатов, частично сульфатов и ряда анионов органических кислот, остается в растворе, не поглощаясь коллоидами, которые заряжены, как и анионы, отрицательно.
Почвенный поглощающий комплекс (ППК) – это совокупность минеральных, органических и органоминеральных частиц твёрдой фазы почв, преимущественно <0, 001 мм, обладающих физикохимической поглотительной способностью (Толковый словарь). • В значительной мере часть катионов взаимодействует с коллоидами почвы и переходит в связанное, поглощенное состояние. • Ёмкость катионного обмена (ЕКО) – это сумма поглощенных (обменных) катионов. • В то же время большая часть анионов, за исключением фосфатов, частично сульфатов и ряда анионов органических кислот, остается в растворе, не поглощаясь коллоидами, которые заряжены, как и анионы, отрицательно.

 Почвенные коллоиды • - это частицы с размером меньше 0, 0001 мм. • Коллоиды образуют пленки на поверхности почвенных первичных минералов. Коллоиды составляют почвенную плазму, часто образующую оптически ориентированную массу в порах почв, а также по граням структурных агрегатов почв, входя в состав кутан. • -Коллоиды благодаря своему малому размеру обладают очень большой удельной поверхностью (от 10 до 800 м 2/г массы). В слое 0– 15 см на гектаре общая суммарная площадь коллоидов в суглинистых и глинистых почвах может достигать 700 000 км 2. • -Поверхность коллоидов несет заряд как отрицательный, так и положительный, но обычно в почвенных коллоидах резко преобладает отрицательный заряд. Поэтому эти заряды притягивают (адсорбируют) катионы, чаще всего ионы Ca, Mg, Na, H, Al. Анионы (РО 4 , реже SO 4) могут поглощаться железоколлоидами, имеющими положительный заряд.
Почвенные коллоиды • - это частицы с размером меньше 0, 0001 мм. • Коллоиды образуют пленки на поверхности почвенных первичных минералов. Коллоиды составляют почвенную плазму, часто образующую оптически ориентированную массу в порах почв, а также по граням структурных агрегатов почв, входя в состав кутан. • -Коллоиды благодаря своему малому размеру обладают очень большой удельной поверхностью (от 10 до 800 м 2/г массы). В слое 0– 15 см на гектаре общая суммарная площадь коллоидов в суглинистых и глинистых почвах может достигать 700 000 км 2. • -Поверхность коллоидов несет заряд как отрицательный, так и положительный, но обычно в почвенных коллоидах резко преобладает отрицательный заряд. Поэтому эти заряды притягивают (адсорбируют) катионы, чаще всего ионы Ca, Mg, Na, H, Al. Анионы (РО 4 , реже SO 4) могут поглощаться железоколлоидами, имеющими положительный заряд.
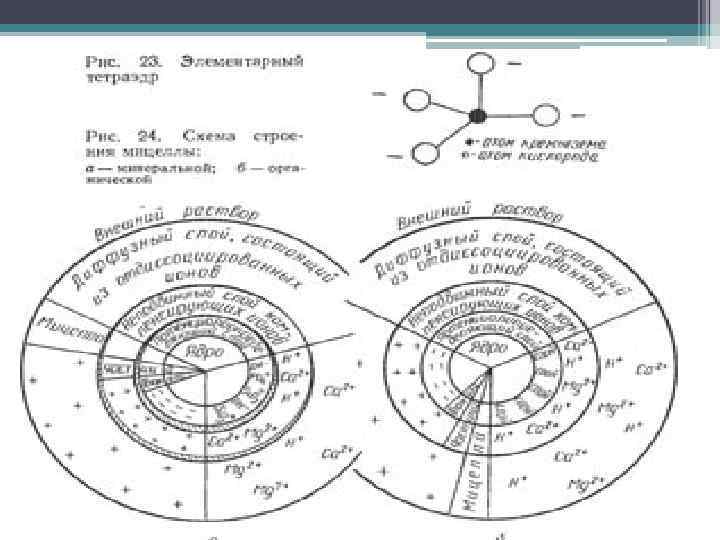
 • Минеральные коллоидные частицы состоят из вторичных глинистых минералов (гидрослюды, монтмориллонит, каолинит, гетит, гидраты окиси железа), а также мелкие частицы первичных минералов (в основном кварц и слюды). • Органические - представлены гумусовыми кислотами и их солями (гуминовые и фульвокислоты, белки, полисахариды). • Органо-минеральные – это соединения гумусовых веществ с глинистыми (вторичными) минералами (глинисто-гумусовые, алюмо- и железогумусовые сорбционные комплексы). -Каждая коллоидная частица состоит из однородного вещества кристаллического или аморфного строения.
• Минеральные коллоидные частицы состоят из вторичных глинистых минералов (гидрослюды, монтмориллонит, каолинит, гетит, гидраты окиси железа), а также мелкие частицы первичных минералов (в основном кварц и слюды). • Органические - представлены гумусовыми кислотами и их солями (гуминовые и фульвокислоты, белки, полисахариды). • Органо-минеральные – это соединения гумусовых веществ с глинистыми (вторичными) минералами (глинисто-гумусовые, алюмо- и железогумусовые сорбционные комплексы). -Каждая коллоидная частица состоит из однородного вещества кристаллического или аморфного строения.
 Обмен катионов в почве • Катионы могут быть обменными и необменными. Обменные катионы легко, но эквивалентно обмениваются на другие катионы, при этом свойства почв, характерные при данном обменом катионе, восстанавливаются после его вторичного замещения в составе активных центров на почвенной матрице. Необменные обычно фиксируются в почве (в решетке почвенных минералов), и заметно меняют основные свойства почв (их поглотительную способность, основную гидрофизическую характеристику). • Сорбция анионов в почвах определяется их свойствами, зарядом и свойствами ППК. • По способности к поглощению анионы располагаются в следующий ряд: Cl- < NO 3 - < SO 4 - < PO 4 -
Обмен катионов в почве • Катионы могут быть обменными и необменными. Обменные катионы легко, но эквивалентно обмениваются на другие катионы, при этом свойства почв, характерные при данном обменом катионе, восстанавливаются после его вторичного замещения в составе активных центров на почвенной матрице. Необменные обычно фиксируются в почве (в решетке почвенных минералов), и заметно меняют основные свойства почв (их поглотительную способность, основную гидрофизическую характеристику). • Сорбция анионов в почвах определяется их свойствами, зарядом и свойствами ППК. • По способности к поглощению анионы располагаются в следующий ряд: Cl- < NO 3 - < SO 4 - < PO 4 -
 Коллоидные частицы с водой образуют коллоидные растворы двух типов—золь и гель. • Золь - коллоидный раствор, в котором частицы находятся во взвешенном состоянии, так как они почти не оседают. Например, коллоидные растворы (гидрозоли) солонцовых почв не оседают в течение 2— 5 лет. • Гель – дисперсная студнеобразная или твёрдая система с жидкой или газообразной дисперсной средой и пространственной структурой, образуемой частицами дисперсной фазы. Гели образуются в результате коагуляции (свёртывания) золей и обладают пластичностью и тиксотропными свойствами.
Коллоидные частицы с водой образуют коллоидные растворы двух типов—золь и гель. • Золь - коллоидный раствор, в котором частицы находятся во взвешенном состоянии, так как они почти не оседают. Например, коллоидные растворы (гидрозоли) солонцовых почв не оседают в течение 2— 5 лет. • Гель – дисперсная студнеобразная или твёрдая система с жидкой или газообразной дисперсной средой и пространственной структурой, образуемой частицами дисперсной фазы. Гели образуются в результате коагуляции (свёртывания) золей и обладают пластичностью и тиксотропными свойствами.
 • Процесс перехода золя в гель называется коагуляцией, или свертыванием. Концентрация электролита — соли, при которой начинается процесс коагуляции, называется порогом коагуляции, который зависит от валентности и атомного веса катионов, образующих лиотропный ряд по увеличению коагулирующего влияния на коллоиды: Li+, Na+, NH 4 +, К+ , Н+ Са 2 +, Мg 2+, Fe 3+, Al 3+. • • Самые сильные коагуляторы—железо и алюминий, самые слабые — одновалентные элементы, затем двухвалентные, наиболее полно и быстро происходит коагуляция при • воздействии трехвалентных элементов. • При водонасыщении почвы часть коллоидов из геля переходит в золь.
• Процесс перехода золя в гель называется коагуляцией, или свертыванием. Концентрация электролита — соли, при которой начинается процесс коагуляции, называется порогом коагуляции, который зависит от валентности и атомного веса катионов, образующих лиотропный ряд по увеличению коагулирующего влияния на коллоиды: Li+, Na+, NH 4 +, К+ , Н+ Са 2 +, Мg 2+, Fe 3+, Al 3+. • • Самые сильные коагуляторы—железо и алюминий, самые слабые — одновалентные элементы, затем двухвалентные, наиболее полно и быстро происходит коагуляция при • воздействии трехвалентных элементов. • При водонасыщении почвы часть коллоидов из геля переходит в золь.
 Обычно при коагуляции происходит захват молекул воды, причем количество воды, которое может удерживать в себе гель, тем больше, чем меньше валентность и атомный вес элемента. Гели, насыщенные Na+, способны удерживать воды в 1000 раз больше своей массы. • Используя это свойство, из солей натрия и коллоидов силикатов изготавливают обычный канцелярский клей. • Коллоиды, удерживающие большое количество воды, называются гидрофильными (греч. hydor—вода, phileo—люблю). К ним относятся коллоиды, насыщенные Na+ , К+ , Са 2+, Mg 2+. • Коллоиды, удерживающие малое количество воды, называются гидрофобными (греч. phobos—страх). Эти коллоиды образуют при коагуляции гели, почти не содержащие воды, или порошки—седимент. Они не обладают клеящей способностью.
Обычно при коагуляции происходит захват молекул воды, причем количество воды, которое может удерживать в себе гель, тем больше, чем меньше валентность и атомный вес элемента. Гели, насыщенные Na+, способны удерживать воды в 1000 раз больше своей массы. • Используя это свойство, из солей натрия и коллоидов силикатов изготавливают обычный канцелярский клей. • Коллоиды, удерживающие большое количество воды, называются гидрофильными (греч. hydor—вода, phileo—люблю). К ним относятся коллоиды, насыщенные Na+ , К+ , Са 2+, Mg 2+. • Коллоиды, удерживающие малое количество воды, называются гидрофобными (греч. phobos—страх). Эти коллоиды образуют при коагуляции гели, почти не содержащие воды, или порошки—седимент. Они не обладают клеящей способностью.
 Емкость поглощения (Е) • это максимально возможное количество катионов, которое может сорбировать почва. Для различных почв емкость поглощения различна: • • у песчаных почв она равна 1— 5 мг-экв, супесчаных 7 — 8, суглинистых — от 7— 8 до 15— 18, глинистых — от 15 до 30 мг-экв и выше, у суглинистых подзолов колеблется в пределах 12— 18, • • у дерново-подзолистых почв 16— 25, серых лесных 18 — 30 и черноземов 30— 50 мг-экв на 100 г почвы. • • Емкость поглощения складывается из двух величин: суммы поглощенных оснований S, куда входят главным образом Na+, K+, Mg 2+, Са 2+, и поглощенного Н+, содержание которого обозначается буквой Н. Как и емкость поглощения, S и Н выражаются в мг-экв на 100 г почвы. Таким образом, E=S+H.
Емкость поглощения (Е) • это максимально возможное количество катионов, которое может сорбировать почва. Для различных почв емкость поглощения различна: • • у песчаных почв она равна 1— 5 мг-экв, супесчаных 7 — 8, суглинистых — от 7— 8 до 15— 18, глинистых — от 15 до 30 мг-экв и выше, у суглинистых подзолов колеблется в пределах 12— 18, • • у дерново-подзолистых почв 16— 25, серых лесных 18 — 30 и черноземов 30— 50 мг-экв на 100 г почвы. • • Емкость поглощения складывается из двух величин: суммы поглощенных оснований S, куда входят главным образом Na+, K+, Mg 2+, Са 2+, и поглощенного Н+, содержание которого обозначается буквой Н. Как и емкость поглощения, S и Н выражаются в мг-экв на 100 г почвы. Таким образом, E=S+H.
 В зависимости от соотношения суммы поглощенных оснований и содержания обменного водорода различают почвы • насыщенные и не насыщенные основаниями. • Почвы, не насыщенные основаниями, содержат в поглощающем комплексе большое количество обменного водорода и алюминия и называются кислыми — это подзолы, дерновоподзолистые, серые лесные и другие почвы. • Почвы, у которых сумма поглощенных оснований Са 2+, Mg 2+ и Na+ равна емкости поглощения, называются насыщенными основаниями — черноземы, сероземы, солонцы, каштановые почвы.
В зависимости от соотношения суммы поглощенных оснований и содержания обменного водорода различают почвы • насыщенные и не насыщенные основаниями. • Почвы, не насыщенные основаниями, содержат в поглощающем комплексе большое количество обменного водорода и алюминия и называются кислыми — это подзолы, дерновоподзолистые, серые лесные и другие почвы. • Почвы, у которых сумма поглощенных оснований Са 2+, Mg 2+ и Na+ равна емкости поглощения, называются насыщенными основаниями — черноземы, сероземы, солонцы, каштановые почвы.
 Вопрос 4. Виды почвенной кислотности и щелочности. Буферность почв • Реакция среды в почвах обусловлена наличием и соотношением в почвенном растворе водородных (H+) и гидроксильных (ОН-) ионов и характеризуется р. Н — отрицательным логарифмом активности водородных ионов в растворе.
Вопрос 4. Виды почвенной кислотности и щелочности. Буферность почв • Реакция среды в почвах обусловлена наличием и соотношением в почвенном растворе водородных (H+) и гидроксильных (ОН-) ионов и характеризуется р. Н — отрицательным логарифмом активности водородных ионов в растворе.
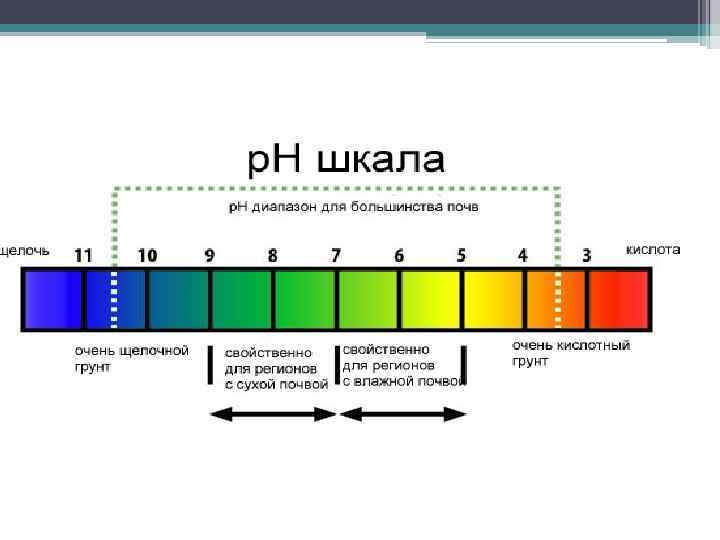
 Почвы могут иметь нейтральную (р. Н 7), кислую (р. Н<7)или щелочную (р. Н>7) реакцию • Реакция среды зависимости от состава растворенных веществ и характера их взаимодействия с твердой фазой почв, определяющих соотношение между концентрациями водородных и гидроксильных ионов в почвенном растворе. • Важнейшим регулятором реакции почвы являются находящиеся в ней соли. Нейтральные, кислые, щелочные соли, переходя из твердой фазы в раствор при увлажнении и обратно при иссушении, оказывают соответствующее влияние на характер реакции почвенного раствора, что отзывается и на плодородии почв.
Почвы могут иметь нейтральную (р. Н 7), кислую (р. Н<7)или щелочную (р. Н>7) реакцию • Реакция среды зависимости от состава растворенных веществ и характера их взаимодействия с твердой фазой почв, определяющих соотношение между концентрациями водородных и гидроксильных ионов в почвенном растворе. • Важнейшим регулятором реакции почвы являются находящиеся в ней соли. Нейтральные, кислые, щелочные соли, переходя из твердой фазы в раствор при увлажнении и обратно при иссушении, оказывают соответствующее влияние на характер реакции почвенного раствора, что отзывается и на плодородии почв.
 Кислотность почв • Это способность почвы подкислять воду, а также растворы солей • В зависимости от того, при каком взаимодействии она проявляется и измеряется различают два вида почвенной кислотности: ▫ актуальную (активную); ▫ потенциальную кислотность почв в.
Кислотность почв • Это способность почвы подкислять воду, а также растворы солей • В зависимости от того, при каком взаимодействии она проявляется и измеряется различают два вида почвенной кислотности: ▫ актуальную (активную); ▫ потенциальную кислотность почв в.
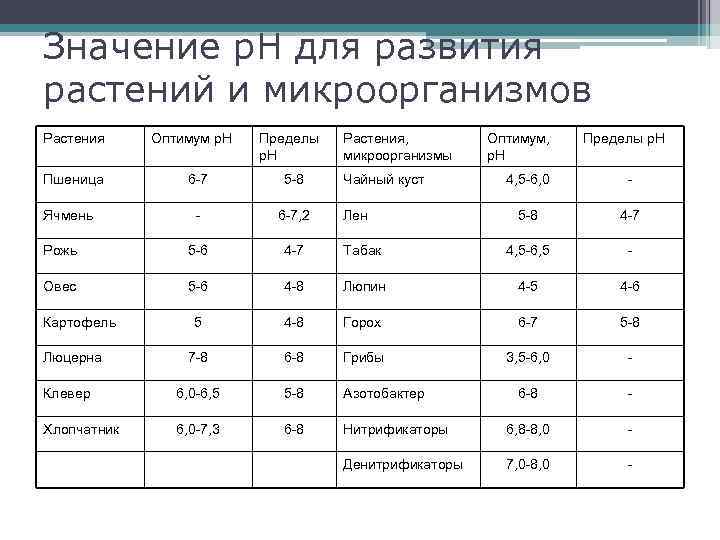 Значение р. Н для развития растений и микроорганизмов Растения Пшеница Оптимум р. Н Пределы р. Н 6 -7 5 -8 - 6 -7, 2 Рожь 5 -6 4 -7 Овес 5 -6 Растения, микроорганизмы Пределы р. Н 4, 5 -6, 0 - 5 -8 4 -7 Табак 4, 5 -6, 5 - 4 -8 Люпин 4 -5 4 -6 5 4 -8 Горох 6 -7 5 -8 7 -8 6 -8 Грибы 3, 5 -6, 0 - Клевер 6, 0 -6, 5 5 -8 Азотобактер 6 -8 - Хлопчатник 6, 0 -7, 3 6 -8 Нитрификаторы 6, 8 -8, 0 - Денитрификаторы 7, 0 -8, 0 - Ячмень Картофель Люцерна Чайный куст Оптимум, р. Н Лен
Значение р. Н для развития растений и микроорганизмов Растения Пшеница Оптимум р. Н Пределы р. Н 6 -7 5 -8 - 6 -7, 2 Рожь 5 -6 4 -7 Овес 5 -6 Растения, микроорганизмы Пределы р. Н 4, 5 -6, 0 - 5 -8 4 -7 Табак 4, 5 -6, 5 - 4 -8 Люпин 4 -5 4 -6 5 4 -8 Горох 6 -7 5 -8 7 -8 6 -8 Грибы 3, 5 -6, 0 - Клевер 6, 0 -6, 5 5 -8 Азотобактер 6 -8 - Хлопчатник 6, 0 -7, 3 6 -8 Нитрификаторы 6, 8 -8, 0 - Денитрификаторы 7, 0 -8, 0 - Ячмень Картофель Люцерна Чайный куст Оптимум, р. Н Лен
 Актуальная кислотность почвы • Характеризует активность свободных ионов водорода в почвенном растворе и вызвана наличием в нем свободных кислот, гиролитически кислых солей и степенью их диссоциации. • Для большинства почв актуальная кислотность обусловлена угольной кислотой и ее солями. • Для большинства культур сильно кислая или сильно щелочная реакция отрицательно сказывается на развитии растений. • Актуальная кислотность почвы измеряется при взаимодействии почвы с дистиллированной водой [водный р. Н, р. Нн 2 о, р. Н (Н 2 O)] при разбавлении 1: 2, 5 либо в пасте.
Актуальная кислотность почвы • Характеризует активность свободных ионов водорода в почвенном растворе и вызвана наличием в нем свободных кислот, гиролитически кислых солей и степенью их диссоциации. • Для большинства почв актуальная кислотность обусловлена угольной кислотой и ее солями. • Для большинства культур сильно кислая или сильно щелочная реакция отрицательно сказывается на развитии растений. • Актуальная кислотность почвы измеряется при взаимодействии почвы с дистиллированной водой [водный р. Н, р. Нн 2 о, р. Н (Н 2 O)] при разбавлении 1: 2, 5 либо в пасте.
 Потенциальная кислотность — • способность почвы при взаимодействии с растворами солей проявлять себя как слабая кислота. Определяется количеством H и Al, находящегося в ППК. Эта кислотность твердой фазы почвы. • Потенциальная кислотность подразделяется на ▫ обменную ▫ гидролитическую
Потенциальная кислотность — • способность почвы при взаимодействии с растворами солей проявлять себя как слабая кислота. Определяется количеством H и Al, находящегося в ППК. Эта кислотность твердой фазы почвы. • Потенциальная кислотность подразделяется на ▫ обменную ▫ гидролитическую
 Обменная кислотность • Определяется количеством поглощенных Н и Al, вытесняемых из почвы катионами нейтральных солей. • [ППК–] Н++КСl–>[ППК–]К++НСl, • [ППК 3–]Аl 3++ 3 КСl–>[ППК 3– ]3 К++Аl. С 13
Обменная кислотность • Определяется количеством поглощенных Н и Al, вытесняемых из почвы катионами нейтральных солей. • [ППК–] Н++КСl–>[ППК–]К++НСl, • [ППК 3–]Аl 3++ 3 КСl–>[ППК 3– ]3 К++Аl. С 13
 Гидролитическая кислотность • Определяется количеством поглощенных водорода и алюминия, вытесняемых гидролитически щелочной солью. • Гидролитическую кислотность рассматривают как суммарную кислотность почв, состоящую из актуальной и потенциальной кислотности. Ее величина обуславливает насыщенность почв основаниями. • Гидролитическая кислотность может быть выражена T=S+Hr тогда V=S/(S+Hr)100% • [ППК–]Н++CH 3 COONa –>[ППК– ]Na++СН 3 СООН
Гидролитическая кислотность • Определяется количеством поглощенных водорода и алюминия, вытесняемых гидролитически щелочной солью. • Гидролитическую кислотность рассматривают как суммарную кислотность почв, состоящую из актуальной и потенциальной кислотности. Ее величина обуславливает насыщенность почв основаниями. • Гидролитическая кислотность может быть выражена T=S+Hr тогда V=S/(S+Hr)100% • [ППК–]Н++CH 3 COONa –>[ППК– ]Na++СН 3 СООН
 Щелочность почв • создание щелочной реакции в почве обусловленной гидролитически щелочными солями слабых кислот и оснований: ▫ карбонатами и гидрокарбонатами щелочных и щелочноземельных элементов, ▫ силикатами, ▫ алюминатами, ▫ гуматами натрия. • Щелочная реакция, согласно теории кислот и оснований Бренсте-да — Лоури, может быть обусловлена анионами слабых кислот, которые переходят из твердой фазы почв в почвенные растворы и водные вытяжки и могут проявлять основные свойства.
Щелочность почв • создание щелочной реакции в почве обусловленной гидролитически щелочными солями слабых кислот и оснований: ▫ карбонатами и гидрокарбонатами щелочных и щелочноземельных элементов, ▫ силикатами, ▫ алюминатами, ▫ гуматами натрия. • Щелочная реакция, согласно теории кислот и оснований Бренсте-да — Лоури, может быть обусловлена анионами слабых кислот, которые переходят из твердой фазы почв в почвенные растворы и водные вытяжки и могут проявлять основные свойства.
 Актуальная и потенциальная щелочность • Актуальная щелочность обусловлена наличием в почве гидролитически щелочных солей, которые при диссоциации определяют повышенную концентрацию гидроксилионов. • Аl(Н 2 O)2(ОН)– 4+Н 2 O<–>Al(H 2 O)3(OH)– 3+ОН– • Потенциальная щелочность обусловлена содержанием обменно-поглощенного натрия, который может переходить в раствор и подщелачивать его. • [ППК 2–]2 Na++Ca. SO 4=[ППК 2–]Ca 2++Na 2 SO 4 • Na 2 CO 3+Ca. SO 4=Ca. CO 3+Na 2 SO 4 • Na 2 CO 3+H 2 SO 4=Na 2 SO 4+H 2 O+CO 2
Актуальная и потенциальная щелочность • Актуальная щелочность обусловлена наличием в почве гидролитически щелочных солей, которые при диссоциации определяют повышенную концентрацию гидроксилионов. • Аl(Н 2 O)2(ОН)– 4+Н 2 O<–>Al(H 2 O)3(OH)– 3+ОН– • Потенциальная щелочность обусловлена содержанием обменно-поглощенного натрия, который может переходить в раствор и подщелачивать его. • [ППК 2–]2 Na++Ca. SO 4=[ППК 2–]Ca 2++Na 2 SO 4 • Na 2 CO 3+Ca. SO 4=Ca. CO 3+Na 2 SO 4 • Na 2 CO 3+H 2 SO 4=Na 2 SO 4+H 2 O+CO 2
 Буферностью называется • способность почвы противостоять изменению ее актуальной реакции под воздействием различных факторов. • Различают буферность почв против кислотных и буферность против щелочных агентов. • Буферность почвы определяется свойствами ее твердой фазы, главным образом почвенных коллоидов. Кислота или щелочь, появляющиеся в почвенном растворе, вступают во взаимодействие с почвенными коллоидами, что ослабляет сдвиг реакции. • При взаимодействии почвы с кислотой происходит реакция обмена между обменными катионами и водородным ионом кислоты, в результате чего водородный ион оказывается связанным с твердой фазой почвы, а в растворе появляются катионы: • [ППК 2–]Са 2++НСl=[ППК 2–]2 Н++Са. С 12 • Если в почве появляется щелочь, водород или алюминий поглощающего комплекса обмениваются с катионами щелочи, которая нейтрализуется: • [ППК 2–]2 Н++Са(ОН)2=[ППК 2–]Са 2++2 Н 2 O
Буферностью называется • способность почвы противостоять изменению ее актуальной реакции под воздействием различных факторов. • Различают буферность почв против кислотных и буферность против щелочных агентов. • Буферность почвы определяется свойствами ее твердой фазы, главным образом почвенных коллоидов. Кислота или щелочь, появляющиеся в почвенном растворе, вступают во взаимодействие с почвенными коллоидами, что ослабляет сдвиг реакции. • При взаимодействии почвы с кислотой происходит реакция обмена между обменными катионами и водородным ионом кислоты, в результате чего водородный ион оказывается связанным с твердой фазой почвы, а в растворе появляются катионы: • [ППК 2–]Са 2++НСl=[ППК 2–]2 Н++Са. С 12 • Если в почве появляется щелочь, водород или алюминий поглощающего комплекса обмениваются с катионами щелочи, которая нейтрализуется: • [ППК 2–]2 Н++Са(ОН)2=[ППК 2–]Са 2++2 Н 2 O



