Кл неорг соединений.ppt
- Количество слайдов: 26
 Тема лекции: «Основные классы неорганических соединений» План: 1. Оксиды 2. Основания 3. Кислоты 4. Соли
Тема лекции: «Основные классы неорганических соединений» План: 1. Оксиды 2. Основания 3. Кислоты 4. Соли
 1. Оксиды 1. 1 Определение оксидов Оксиды ― сложные вещества, состоящие из двух элементов одним из которых является кислород. Э m. О n , где Э ― элемент, образующий оксид, m, n ― количество атомов элемента и кислорода в молекуле вещества. 1. 2 Номенклатура оксидов название оксида = оксид + название + валентность элемента Сu. О - оксид меди (II), Са. О - оксид кальция
1. Оксиды 1. 1 Определение оксидов Оксиды ― сложные вещества, состоящие из двух элементов одним из которых является кислород. Э m. О n , где Э ― элемент, образующий оксид, m, n ― количество атомов элемента и кислорода в молекуле вещества. 1. 2 Номенклатура оксидов название оксида = оксид + название + валентность элемента Сu. О - оксид меди (II), Са. О - оксид кальция
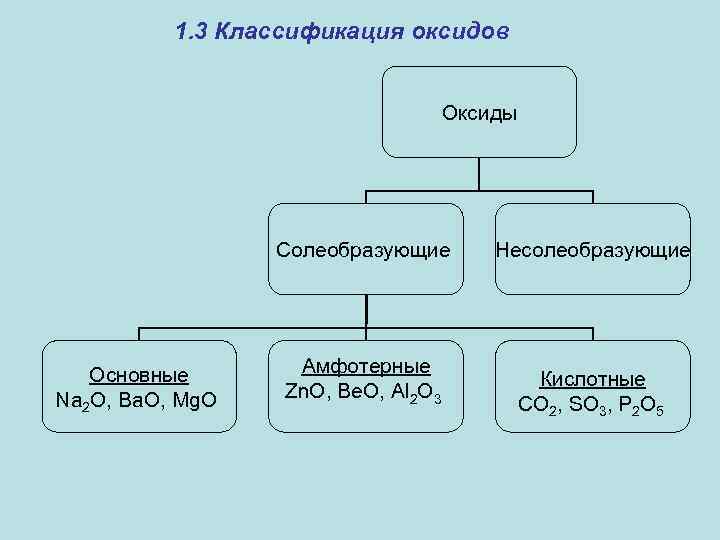 1. 3 Классификация оксидов Оксиды Солеобразующие Основные Na 2 O, Ba. O, Mg. O Амфотерные Zn. O, Be. O, Al 2 O 3 Несолеобразующие Кислотные CO 2, SO 3, P 2 O 5
1. 3 Классификация оксидов Оксиды Солеобразующие Основные Na 2 O, Ba. O, Mg. O Амфотерные Zn. O, Be. O, Al 2 O 3 Несолеобразующие Кислотные CO 2, SO 3, P 2 O 5
 1. 4 Физические свойства оксидов 1. Ø Ø Ø По агрегатному состоянию: твердые оксиды: К 2 O, Са. О, Аl 2 O 3, Мn. O 2, Р 2 O 5, Si. O 2 жидкие оксиды: SO 3, N 2 O 3, Сl 2 O 7, Mn 2 O 7 газообразные оксиды: СO 2, SO 2, NO, CO 2. По растворимости в воде: Ø растворимые в воде оксиды: Li 2 O, Na 2 O, Са. О, Sr. O Ø нерастворимые оксиды: Si. O 2, Аl 2 O 3, Сu. O
1. 4 Физические свойства оксидов 1. Ø Ø Ø По агрегатному состоянию: твердые оксиды: К 2 O, Са. О, Аl 2 O 3, Мn. O 2, Р 2 O 5, Si. O 2 жидкие оксиды: SO 3, N 2 O 3, Сl 2 O 7, Mn 2 O 7 газообразные оксиды: СO 2, SO 2, NO, CO 2. По растворимости в воде: Ø растворимые в воде оксиды: Li 2 O, Na 2 O, Са. О, Sr. O Ø нерастворимые оксиды: Si. O 2, Аl 2 O 3, Сu. O
 1. 5 Химические свойства оксидов 1. 5. 1 Химические свойства основных оксидов 1. 2. 3. Основный оксид + Кислота → Соль + Н 2 О Ва. О + 2 НСl → Ва. Сl 2 + Н 2 O Основный оксид + Кислотный оксид → Соль Са. О + SO 3 → Ca. SO 4 Оксид щелочного (щелочноземельного) металла + Н 2 O → Щелочь Na 2 O + Н 2 O → 2 Na. OH 1. 5. 2 Химические свойства кислотных оксидов 1. 2. 3. Кислотный оксид + Основание → Соль + Н 2 O Р 2 O 5 + 2 КОН → 2 К 3 РO 4 + 3 Н 2 O Кислотный оксид + Основный оксид → Соль Na 2 O + CO 2 → Na 2 CO 3 Кислотный оксид + Н 2 О → Кислота. Р 2 О 5 + 3 Н 2 О → 2 Н 3 РО 4
1. 5 Химические свойства оксидов 1. 5. 1 Химические свойства основных оксидов 1. 2. 3. Основный оксид + Кислота → Соль + Н 2 О Ва. О + 2 НСl → Ва. Сl 2 + Н 2 O Основный оксид + Кислотный оксид → Соль Са. О + SO 3 → Ca. SO 4 Оксид щелочного (щелочноземельного) металла + Н 2 O → Щелочь Na 2 O + Н 2 O → 2 Na. OH 1. 5. 2 Химические свойства кислотных оксидов 1. 2. 3. Кислотный оксид + Основание → Соль + Н 2 O Р 2 O 5 + 2 КОН → 2 К 3 РO 4 + 3 Н 2 O Кислотный оксид + Основный оксид → Соль Na 2 O + CO 2 → Na 2 CO 3 Кислотный оксид + Н 2 О → Кислота. Р 2 О 5 + 3 Н 2 О → 2 Н 3 РО 4
 1. 5. 3 Химические свойства амфотерных оксидов 1. Амфотерный оксид + Кислота → Соль + Н 2 O Zn. O + 2 НСl → Zn. Cl 2 + Н 2 О 2. Амфотерный оксид + Щелочь → Соль + Н 2 O Zn. O + 2 Na. OH → Na 2 Zn. O 2 + Н 2 O 3. Амфотерный оксид + Кислотный оксид → Соль Al 2 O 3 + 3 SO 3 → Al 2(SO 4)3 4. Амфотерный оксид + Основный оксид → Соль Al 2 O 3 + Na 2 O → 2 Na. Al. O 2
1. 5. 3 Химические свойства амфотерных оксидов 1. Амфотерный оксид + Кислота → Соль + Н 2 O Zn. O + 2 НСl → Zn. Cl 2 + Н 2 О 2. Амфотерный оксид + Щелочь → Соль + Н 2 O Zn. O + 2 Na. OH → Na 2 Zn. O 2 + Н 2 O 3. Амфотерный оксид + Кислотный оксид → Соль Al 2 O 3 + 3 SO 3 → Al 2(SO 4)3 4. Амфотерный оксид + Основный оксид → Соль Al 2 O 3 + Na 2 O → 2 Na. Al. O 2
 1. 6 Получение оксидов 1. 6. 1 Получение основных оксидов 1. Окисление металлов кислородом при нагревании: Металл + O 2 → Основный оксид 2 Cu + O 2 → 2 Сu. О. 2. Термическое разложение нерастворимых оснований: Нерастворимое основание → Основный оксид + Н 2 O 2 Fe(OH)3 → Fe 2 O 3 + 3 H 2 O 3. Карбонаты металлов Мех(СO 3)у (кроме карбонатов щелочных и щелочно-земельных металлов): Мех(СO 3)у → Мех. Оу + СO 2 Cu. CO 3 → Сu. О + СO 2 4. Сульфаты металлов Mex(SO 4)y, где Me = Сu, Al, Fe (кроме сульфатов щелочных и щелочно-земельных металлов): Mex(SO 4)y → Основной оксид + SO 3 Cu. SO 4 → Cu. O + SO 3 5. Нитраты металлов, находящихся в ряду напряжений от Mg до Сu включительно Me(NO 3)x Ме(NО 3)х → Основной оксид + NO 2 + О 2 2 Cu(NO 3)2 → 2 Cu. O + 4 NO 2 + O 2
1. 6 Получение оксидов 1. 6. 1 Получение основных оксидов 1. Окисление металлов кислородом при нагревании: Металл + O 2 → Основный оксид 2 Cu + O 2 → 2 Сu. О. 2. Термическое разложение нерастворимых оснований: Нерастворимое основание → Основный оксид + Н 2 O 2 Fe(OH)3 → Fe 2 O 3 + 3 H 2 O 3. Карбонаты металлов Мех(СO 3)у (кроме карбонатов щелочных и щелочно-земельных металлов): Мех(СO 3)у → Мех. Оу + СO 2 Cu. CO 3 → Сu. О + СO 2 4. Сульфаты металлов Mex(SO 4)y, где Me = Сu, Al, Fe (кроме сульфатов щелочных и щелочно-земельных металлов): Mex(SO 4)y → Основной оксид + SO 3 Cu. SO 4 → Cu. O + SO 3 5. Нитраты металлов, находящихся в ряду напряжений от Mg до Сu включительно Me(NO 3)x Ме(NО 3)х → Основной оксид + NO 2 + О 2 2 Cu(NO 3)2 → 2 Cu. O + 4 NO 2 + O 2
 1. 6. 2 Получение кислотных оксидов 1. Взаимодействие простых веществ с кислородом: Неметаллы и некоторые металлы (Сr, Mn) + O 2 = Кислотные оксиды N 2 + O 2 → 2 NO 2 2. Разложение некоторых оксокислот. Оксокислота → Кислотный оксид + Н 2 O 4 HNO 3 → 4 NO 2 + 2 Н 2 O 3. Разложение солей (см. получение основных оксидов). 1. 6. 3 Получение амфотнерных оксидов Амфотерные оксиды можно получить любым способом, применяемым для получения основных оксидов. 1. Ме + O 2 → Амфотерный оксид 4 Аl + 3 O 2 → 2 Аl 2 О 3 2. Амфотерный гидроксид → Амфотерный оксид + Н 2 O 2 Аl(ОН)3 → Аl 2 O 3+ 3 Н 2 O 3. Разложение карбонатов, сульфатов, нитратов соответствующих металлов: Аl 2(СO 3)3 → Аl 2 O 3 + 3 СO 2 4 Al 2(NO 3)3 → 2 Аl 2 O 3 + 12 NO 2 + 3 O 2.
1. 6. 2 Получение кислотных оксидов 1. Взаимодействие простых веществ с кислородом: Неметаллы и некоторые металлы (Сr, Mn) + O 2 = Кислотные оксиды N 2 + O 2 → 2 NO 2 2. Разложение некоторых оксокислот. Оксокислота → Кислотный оксид + Н 2 O 4 HNO 3 → 4 NO 2 + 2 Н 2 O 3. Разложение солей (см. получение основных оксидов). 1. 6. 3 Получение амфотнерных оксидов Амфотерные оксиды можно получить любым способом, применяемым для получения основных оксидов. 1. Ме + O 2 → Амфотерный оксид 4 Аl + 3 O 2 → 2 Аl 2 О 3 2. Амфотерный гидроксид → Амфотерный оксид + Н 2 O 2 Аl(ОН)3 → Аl 2 O 3+ 3 Н 2 O 3. Разложение карбонатов, сульфатов, нитратов соответствующих металлов: Аl 2(СO 3)3 → Аl 2 O 3 + 3 СO 2 4 Al 2(NO 3)3 → 2 Аl 2 O 3 + 12 NO 2 + 3 O 2.
 2. Основания 2. 1 Определение основания Основания — вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп. Ме(ОН)у, где: Me — металл, у — число гидроксидных групп, равное валентности металла. 2. 2 Номенклатура оснований Назавние = гидроксид + название + валентность основания металла Na. OH - гидроксид натрия Сu(ОН)2 - гидроксид меди (II)
2. Основания 2. 1 Определение основания Основания — вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп. Ме(ОН)у, где: Me — металл, у — число гидроксидных групп, равное валентности металла. 2. 2 Номенклатура оснований Назавние = гидроксид + название + валентность основания металла Na. OH - гидроксид натрия Сu(ОН)2 - гидроксид меди (II)
 2. 3 Классификация оснований 1. Ø Ø Ø 2. Ø Ø Классификация по числу гидроксидных групп в молекуле основания. Однокислотные основания — это основания, молекулы которых содержат одну гидроксидную группу, например: Na. OH, КОН, Сu. ОН, Ag. OH. Двухкислотные основания — это основания, молекулы которых содержат две гидроксидные группы, например: Са(ОН)2, Ва(ОН)2, Fe(OH)2, Cu(OH)2. Трехкислотные основания — это основания, молекулы которых содержат три гидроксидные группы, например: Аl(ОН)3, Fe(OH)3, Cr(OH)3. Классификация по растворимости в воде. Есть основания растворимые и нерастворимые в воде. Растворимые в воде основания называются щелочами. Щелочи образуются наиболее типичными, наиболее активными металлами. Щелочами являются: Li. OH, Na. OH, КОН, Rb. OH, Cs. OH, Са(ОН)2, Sr(OH)2, Ва(ОН)2. Все другие основания являются нерастворимыми в воде. Примеры нерастворимых оснований: Cu(OH)2, Fe(OH)2 и другие.
2. 3 Классификация оснований 1. Ø Ø Ø 2. Ø Ø Классификация по числу гидроксидных групп в молекуле основания. Однокислотные основания — это основания, молекулы которых содержат одну гидроксидную группу, например: Na. OH, КОН, Сu. ОН, Ag. OH. Двухкислотные основания — это основания, молекулы которых содержат две гидроксидные группы, например: Са(ОН)2, Ва(ОН)2, Fe(OH)2, Cu(OH)2. Трехкислотные основания — это основания, молекулы которых содержат три гидроксидные группы, например: Аl(ОН)3, Fe(OH)3, Cr(OH)3. Классификация по растворимости в воде. Есть основания растворимые и нерастворимые в воде. Растворимые в воде основания называются щелочами. Щелочи образуются наиболее типичными, наиболее активными металлами. Щелочами являются: Li. OH, Na. OH, КОН, Rb. OH, Cs. OH, Са(ОН)2, Sr(OH)2, Ва(ОН)2. Все другие основания являются нерастворимыми в воде. Примеры нерастворимых оснований: Cu(OH)2, Fe(OH)2 и другие.
 2. 3 Физические свойства оснований 1. Ø Ø По агрегатному состоянию практически все основания, кроме гидроксида аммония NH 4 OH, представляют собой твердые вещества разного цвета: основания, образованные щелочными и щелочноземельными металлами, являются бесцветными веществами, гидроксид меди (II) Сu(ОН)2 — голубого цвета, гидроксид железа (III) Fe(OH)3 — бурого цвета и т. д. Твердые основания не имеют запаха. Жидкое основание NH 4 OH, которое образуется в результате растворения газообразного аммиака NH 3 в воде, обладает запахом аммиака. 2. Ø Ø По растворимости в воде основания делятся на две группы: растворимые нерастворимые 3. Ø Ø По степени диссоциации: сильные Na. OH, KOH, Cs. OH, Ca(OH)2 и др. слабые NH 4 OH, гидроксиды, обозначенные в таблице растворимости буквой Н. Ø
2. 3 Физические свойства оснований 1. Ø Ø По агрегатному состоянию практически все основания, кроме гидроксида аммония NH 4 OH, представляют собой твердые вещества разного цвета: основания, образованные щелочными и щелочноземельными металлами, являются бесцветными веществами, гидроксид меди (II) Сu(ОН)2 — голубого цвета, гидроксид железа (III) Fe(OH)3 — бурого цвета и т. д. Твердые основания не имеют запаха. Жидкое основание NH 4 OH, которое образуется в результате растворения газообразного аммиака NH 3 в воде, обладает запахом аммиака. 2. Ø Ø По растворимости в воде основания делятся на две группы: растворимые нерастворимые 3. Ø Ø По степени диссоциации: сильные Na. OH, KOH, Cs. OH, Ca(OH)2 и др. слабые NH 4 OH, гидроксиды, обозначенные в таблице растворимости буквой Н. Ø
 2. 4 Химические свойства оснований 1. Ме(ОН)y ↔ Меу+ + у. ОНNa. OH ↔ Na+ + OHФенолфталеин 2. 3. 4. 5. 6. 7. Лакмус Метиловый оранжевый Основание + Кислота → Соль + Н 2 O 2 Na. OH + H 2 SO 4 → Na 2 SO 4 + 2 Н 2 O Основание + Кислотный оксид → Соль + Н 2 О КОН + СO 2 → КHСO 3 + Н 2 O 2 КОН + СO 2 → К 2 СO 3 + Н 2 O Щелочь + Соль → Соль + Нерастворимое основание 2 Na. OH + Cu. SO 4 → K 2 SO 4 + Cu(OH)2↓ Щелочь + Соль → Соль + Новая щелочь Ва(ОН)2 + Na 2 SO 4 → Ba. SO 4↓+ 2 Na. OH Me + Щелочь → Соль + Н 2 2 Аl + 2 КОН + 2 Н 2 O → 2 КАl. O 2 + 3 Н 2 Нерастворимое основание → Основный оксид + Н 2 O Cu(OH)2 → Сu. О + Н 2 O Нерастворимое основание + Кислота → Соль + Н 2 O Fe(OH)3 + 6 HCl → Fe. Cl 3 + 3 H 2 O
2. 4 Химические свойства оснований 1. Ме(ОН)y ↔ Меу+ + у. ОНNa. OH ↔ Na+ + OHФенолфталеин 2. 3. 4. 5. 6. 7. Лакмус Метиловый оранжевый Основание + Кислота → Соль + Н 2 O 2 Na. OH + H 2 SO 4 → Na 2 SO 4 + 2 Н 2 O Основание + Кислотный оксид → Соль + Н 2 О КОН + СO 2 → КHСO 3 + Н 2 O 2 КОН + СO 2 → К 2 СO 3 + Н 2 O Щелочь + Соль → Соль + Нерастворимое основание 2 Na. OH + Cu. SO 4 → K 2 SO 4 + Cu(OH)2↓ Щелочь + Соль → Соль + Новая щелочь Ва(ОН)2 + Na 2 SO 4 → Ba. SO 4↓+ 2 Na. OH Me + Щелочь → Соль + Н 2 2 Аl + 2 КОН + 2 Н 2 O → 2 КАl. O 2 + 3 Н 2 Нерастворимое основание → Основный оксид + Н 2 O Cu(OH)2 → Сu. О + Н 2 O Нерастворимое основание + Кислота → Соль + Н 2 O Fe(OH)3 + 6 HCl → Fe. Cl 3 + 3 H 2 O
 2. 5 Получение оснований 1. Взаимодействие щелочных и щелочноземельных металлов с водой. Me +Н 2 O → Растворимое основание (щелочь) + Н 2↑ 2 Na + 2 Н 2 О → 2 Na. OH + Н 2 ↑ 2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой: Ме 2 O + Н 2 O → 2 Ме. ОН или Ме. О + Н 2 O → Ме(ОН)2 Na 2 O + Н 2 O → 2 Na. OH 3. Действие щелочи на растворимую соль. Соль + Щелочь → Новая соль + Новая щелочь Na 2 SO 4 + Ва(ОН)2 → Ba. SO 4 + 2 Na. OH Соль + Щелочь → Нерастворимое основание + Новая соль Cu. SO 4 + 2 Na. OH → Cu(OH)2↓ + Na 2 SO 4
2. 5 Получение оснований 1. Взаимодействие щелочных и щелочноземельных металлов с водой. Me +Н 2 O → Растворимое основание (щелочь) + Н 2↑ 2 Na + 2 Н 2 О → 2 Na. OH + Н 2 ↑ 2. Взаимодействие оксидов щелочных и щелочноземельных металлов с водой: Ме 2 O + Н 2 O → 2 Ме. ОН или Ме. О + Н 2 O → Ме(ОН)2 Na 2 O + Н 2 O → 2 Na. OH 3. Действие щелочи на растворимую соль. Соль + Щелочь → Новая соль + Новая щелочь Na 2 SO 4 + Ва(ОН)2 → Ba. SO 4 + 2 Na. OH Соль + Щелочь → Нерастворимое основание + Новая соль Cu. SO 4 + 2 Na. OH → Cu(OH)2↓ + Na 2 SO 4
 3. Кислоты 3. 1 Определение кислот Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла, и кислотные остатки. Нx. Аn где: Аn — кислотный остаток, х — число атомов водорода, равное валентности кислотного остатка. 3. 2 Номенклатура кислот Названия кислотных остатков всех бескислородных кислот имеют одинаковые окончания «ид» . Название кислотных остатков образуются из латинских названий кислотообразующих элементов с добавлением окончаний -ат (для кислотных остатков с большей валентностью элемента) или -ит (с меньшей валентностью). При образовании одним элементом более двух оксокислот названия их кислотных остатков включают префиксы пер- (для кислотных остатков с наибольшей валентностью элемента) и гипо- (с наименьшей валентностью).
3. Кислоты 3. 1 Определение кислот Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла, и кислотные остатки. Нx. Аn где: Аn — кислотный остаток, х — число атомов водорода, равное валентности кислотного остатка. 3. 2 Номенклатура кислот Названия кислотных остатков всех бескислородных кислот имеют одинаковые окончания «ид» . Название кислотных остатков образуются из латинских названий кислотообразующих элементов с добавлением окончаний -ат (для кислотных остатков с большей валентностью элемента) или -ит (с меньшей валентностью). При образовании одним элементом более двух оксокислот названия их кислотных остатков включают префиксы пер- (для кислотных остатков с наибольшей валентностью элемента) и гипо- (с наименьшей валентностью).
 3. 3 Классификация кислот 1. По основности. Основность кислоты — это число атомов водорода в молекуле кислоты, способных замещаться атомами металла. Кислоты, молекулы которых содержат один атом водорода, способный замещаться атомами металла, называются одноосновными. К ним относятся, например: НСl, HNO 3. Примеры двухосновных кислот: H 2 S, H 2 CO 3, H 2 SO 4. Трехосновных кислот: Н 3 РО 4, Н 3 ВO 3. 2. По составу кислотного остатка кислоты делят на: Ø бескислородные - НСl, HСN, HBr, H 2 S и др. Ø кислородсодержащие (оксокислоты) - H 2 CO 3, H 2 SO 4, HNO 3 и др. Валентность кислотообразующего элемента в молекуле оксокислоты равна разности между суммой валентностей атомов кислорода и суммой валентностей атомов водорода. Так, валентности серы в H 2 SO 3 и H 2 SO 4 равны: IV и VI.
3. 3 Классификация кислот 1. По основности. Основность кислоты — это число атомов водорода в молекуле кислоты, способных замещаться атомами металла. Кислоты, молекулы которых содержат один атом водорода, способный замещаться атомами металла, называются одноосновными. К ним относятся, например: НСl, HNO 3. Примеры двухосновных кислот: H 2 S, H 2 CO 3, H 2 SO 4. Трехосновных кислот: Н 3 РО 4, Н 3 ВO 3. 2. По составу кислотного остатка кислоты делят на: Ø бескислородные - НСl, HСN, HBr, H 2 S и др. Ø кислородсодержащие (оксокислоты) - H 2 CO 3, H 2 SO 4, HNO 3 и др. Валентность кислотообразующего элемента в молекуле оксокислоты равна разности между суммой валентностей атомов кислорода и суммой валентностей атомов водорода. Так, валентности серы в H 2 SO 3 и H 2 SO 4 равны: IV и VI.
 3. По степени диссоциации: Ø сильные - H 2 SO 4, HNO 3, НСl, HBr, HI, HCl. O 4 Ø средние - HF, H 3 PO 4 Ø слабые - H 2 CO 3, H 2 S, HСN, H 2 Si. O 3 3. 4 Физические свойства кислот 1. По агрегатному состоянию 2. По растворимости
3. По степени диссоциации: Ø сильные - H 2 SO 4, HNO 3, НСl, HBr, HI, HCl. O 4 Ø средние - HF, H 3 PO 4 Ø слабые - H 2 CO 3, H 2 S, HСN, H 2 Si. O 3 3. 4 Физические свойства кислот 1. По агрегатному состоянию 2. По растворимости
 2. 3. 4. 5. 6. 3. 5 Химические свойства кислот 1. НАn ↔ Н+ + Аn. HCl ↔ Н+ + Cl. Фенолфталеин Лакмус Метиловый оранжевый (Бесцветный) (красный) (розовый) Кислота + Основание → Соль + Н 2 О HNО 3 + КОН → KNО 3 + Н 2 О Кислота + Основный оксид → Соль + Н 2 О H 2 SO 4 + Ca. O → Ca. SO 4 + H 2 O Кислота + Амфотерный оксид → Соль + Н 2 О 2 НСl + Zn. O → Zn. Cl 2 + Н 2 O Кислота + Амфотерный гидроксид → Соль + Н 2 O H 2 SO 4 + Zn(OH)2 → Zn. SO 4 + 2 Н 2 O Кислота + Нормальная → Новая нормальная + Новая соль кислота H 2 SO 4 + Ва. Сl 2 → Ba. SO 4↓ + 2 HCl 2 HNO 3 + Na 2 Si. O 3 → 2 Na. NO 3 + H 2 Si. O 3↓ 2 HCl + Са. СО 3 → Са. Сl 2 + H 2 O + CO 2↑
2. 3. 4. 5. 6. 3. 5 Химические свойства кислот 1. НАn ↔ Н+ + Аn. HCl ↔ Н+ + Cl. Фенолфталеин Лакмус Метиловый оранжевый (Бесцветный) (красный) (розовый) Кислота + Основание → Соль + Н 2 О HNО 3 + КОН → KNО 3 + Н 2 О Кислота + Основный оксид → Соль + Н 2 О H 2 SO 4 + Ca. O → Ca. SO 4 + H 2 O Кислота + Амфотерный оксид → Соль + Н 2 О 2 НСl + Zn. O → Zn. Cl 2 + Н 2 O Кислота + Амфотерный гидроксид → Соль + Н 2 O H 2 SO 4 + Zn(OH)2 → Zn. SO 4 + 2 Н 2 O Кислота + Нормальная → Новая нормальная + Новая соль кислота H 2 SO 4 + Ва. Сl 2 → Ba. SO 4↓ + 2 HCl 2 HNO 3 + Na 2 Si. O 3 → 2 Na. NO 3 + H 2 Si. O 3↓ 2 HCl + Са. СО 3 → Са. Сl 2 + H 2 O + CO 2↑
 7. Кислота + Нормальная соль → Кислая соль H 2 S + Na 2 S → 2 Na. HS 8. Кислота + Основная соль → Нормальная соль + Н 2 O НСl + Сu. ОНCl → Сu. Сl 2 + Н 2 O 9. При взаимодействии кислоты с основной солью другой кислоты, образуются две нормальные соли и вода: 2 HNO 3 + 2 Cu. OHCl → Cu(NO 3)2 + Сu. Сl 2 + 2 Н 2 O. 10. Кислота + Me → соль + разные продукты реакции Zn + H 2 SО 4 → Zn. SO 4 + H 2 (разб. ) 2 Са + 2 H 2 SO 4 → Ca. SO 4 + H 2 S↑ + 4 Н 2 O (конц. ) Сu + 2 H 2 SO 4 → Сu. SO 4 + SO 2↑ + 2 Н 2 О (конц. ) 4 Са + 10 HNО 3 → 3 Ca(NO 3)2 + NH 4 NO 3 + 3 H 2 O (разб. ) 3 Cu + 8 HNO 3 → 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O (разб. ) 4 Са + 10 HNO 3 → 3 Ca(NO 3)2 + N 2 O↑ + 5 Н 2 О (конц. ) Сu + 4 HNO 3 → Cu(NO 3)2 + 2 NO 2↑ + Н 2 O (конц. )
7. Кислота + Нормальная соль → Кислая соль H 2 S + Na 2 S → 2 Na. HS 8. Кислота + Основная соль → Нормальная соль + Н 2 O НСl + Сu. ОНCl → Сu. Сl 2 + Н 2 O 9. При взаимодействии кислоты с основной солью другой кислоты, образуются две нормальные соли и вода: 2 HNO 3 + 2 Cu. OHCl → Cu(NO 3)2 + Сu. Сl 2 + 2 Н 2 O. 10. Кислота + Me → соль + разные продукты реакции Zn + H 2 SО 4 → Zn. SO 4 + H 2 (разб. ) 2 Са + 2 H 2 SO 4 → Ca. SO 4 + H 2 S↑ + 4 Н 2 O (конц. ) Сu + 2 H 2 SO 4 → Сu. SO 4 + SO 2↑ + 2 Н 2 О (конц. ) 4 Са + 10 HNО 3 → 3 Ca(NO 3)2 + NH 4 NO 3 + 3 H 2 O (разб. ) 3 Cu + 8 HNO 3 → 3 Cu(NO 3)2 + 2 NO↑ + 4 H 2 O (разб. ) 4 Са + 10 HNO 3 → 3 Ca(NO 3)2 + N 2 O↑ + 5 Н 2 О (конц. ) Сu + 4 HNO 3 → Cu(NO 3)2 + 2 NO 2↑ + Н 2 O (конц. )
 На холоду концентрированная серная кислота пассивирует хром и железо. При нагревании железо реагирует с концентрированной серной кислотой по уравнению: 2 Fe + 6 H 2 SO 4 → Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O (конц. ) 3. 6 Получение кислот 1. 2. 3. 4. Неметалл + Н 2 → Водородное соединение неметалла Н 2 + Cl 2 ↔ 2 HCl Na. Cl (тв. ) + H 2 SO 4 → 2 Na. HSO 4 + НСl Кислотный оксид + Н 2 О → Оксокислота (кроме Si. О 2) SО 3 + Н 2 О → H 2 SО 4 Соль (1) + Кислота (1) → Соль (2) + Кислота (2)
На холоду концентрированная серная кислота пассивирует хром и железо. При нагревании железо реагирует с концентрированной серной кислотой по уравнению: 2 Fe + 6 H 2 SO 4 → Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O (конц. ) 3. 6 Получение кислот 1. 2. 3. 4. Неметалл + Н 2 → Водородное соединение неметалла Н 2 + Cl 2 ↔ 2 HCl Na. Cl (тв. ) + H 2 SO 4 → 2 Na. HSO 4 + НСl Кислотный оксид + Н 2 О → Оксокислота (кроме Si. О 2) SО 3 + Н 2 О → H 2 SО 4 Соль (1) + Кислота (1) → Соль (2) + Кислота (2)
 4. Соли 4. 1 Определение солей Соли — продукты замещения атомов водорода в молекулах кислот атомами металлов или продукты замещения гидроксидных групп в молекулах оснований кислотными остатками. 4. 2 Классификация солей Нормальные (средние) соли — это продукты полного замещения атомов водорода в молекулах кислот атомами металла или полного замещения гидроксидных групп в молекулах оснований кислотными остатками (Na 2 SO 4, Ва. Сl 2, Са 3(РO 4)2 и др. ). Кислые соли — это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла (Na. HCO 3, КН 2 РO 4, Ва. НРO 4 и др. )
4. Соли 4. 1 Определение солей Соли — продукты замещения атомов водорода в молекулах кислот атомами металлов или продукты замещения гидроксидных групп в молекулах оснований кислотными остатками. 4. 2 Классификация солей Нормальные (средние) соли — это продукты полного замещения атомов водорода в молекулах кислот атомами металла или полного замещения гидроксидных групп в молекулах оснований кислотными остатками (Na 2 SO 4, Ва. Сl 2, Са 3(РO 4)2 и др. ). Кислые соли — это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла (Na. HCO 3, КН 2 РO 4, Ва. НРO 4 и др. )
 Основные соли — это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками (Ca. OHNO 3, (Сu. OH)2 СO 3 и др. ) Двойными солями называются соли, в состав которых входят катионы двух различных металлов (или катион аммония) и анионы одного кислотного остатка. Такие соли образуются при соединении нейтральных молекул нормальных солей друг с другом: K 2 SO 4 + Al 2(SO 4)3 → K 2 SO 4·Al 2(SO 4)3 → 2 KAl(SO 4)2 сульфат алюминия-калия Смешанными солями называют такие соли, в состав которых входят катионы одного металла и анионы двух различных кислотных остатков: Pb. FCl — хлорид-фторид свинца, Са(Cl. O)Сl — хлорид-гипохлорид кальция. Комплексные соединения (координационные соединения) — сложные химические вещества, в составе которых имеются комплексные ионы, образованные центральным атомом и связанными с ним лигандами.
Основные соли — это продукты неполного замещения гидроксидных групп в молекулах многокислотных оснований кислотными остатками (Ca. OHNO 3, (Сu. OH)2 СO 3 и др. ) Двойными солями называются соли, в состав которых входят катионы двух различных металлов (или катион аммония) и анионы одного кислотного остатка. Такие соли образуются при соединении нейтральных молекул нормальных солей друг с другом: K 2 SO 4 + Al 2(SO 4)3 → K 2 SO 4·Al 2(SO 4)3 → 2 KAl(SO 4)2 сульфат алюминия-калия Смешанными солями называют такие соли, в состав которых входят катионы одного металла и анионы двух различных кислотных остатков: Pb. FCl — хлорид-фторид свинца, Са(Cl. O)Сl — хлорид-гипохлорид кальция. Комплексные соединения (координационные соединения) — сложные химические вещества, в составе которых имеются комплексные ионы, образованные центральным атомом и связанными с ним лигандами.
 4. 3 Номенклатура солей 1. Средние (нормальные) соли Нормальные название валентность соли = кислотного + металла остатка 2. Кислые соли Кислые гидроназвание валентность соли = или + кислотного + металла дигидро 3. Двойные соли Двойные название валентность соли = кислотного + металла 1 + металла 2 + металла остатка 4. Основные соли Основные гидроксоназвание валентность соли = или + кислотного + металла дигдроксоостатка 5. Смешанные соли Смешанные название валентность соли = кислотного + металла остатка 1 остатка 2
4. 3 Номенклатура солей 1. Средние (нормальные) соли Нормальные название валентность соли = кислотного + металла остатка 2. Кислые соли Кислые гидроназвание валентность соли = или + кислотного + металла дигидро 3. Двойные соли Двойные название валентность соли = кислотного + металла 1 + металла 2 + металла остатка 4. Основные соли Основные гидроксоназвание валентность соли = или + кислотного + металла дигдроксоостатка 5. Смешанные соли Смешанные название валентность соли = кислотного + металла остатка 1 остатка 2
 4. 4 Химические свойства солей 1. Растворимые в воде соли диссоциируют в водных растворах на ионы: Ø Средние соли: Cu. SO 4 ↔ Cu 2+ + SO 42Ø Кислые соли: Na. HCO 3 ↔ Na+ + HCO 3Ø Основные соли: Mg. OHCl ↔ Mg. OH+ + Cl-. 2. Растворимые в воде соли взаимодействуют с более активными металлами, чем металл, входящий в состав соли: Раствор соли (1) + Ме (1) → Раствор (2) + Me (2) Cu. SO 4 + Fe → Fe. SO 4 + Сu 3. Соли реагируют со щелочами. Fe. Cl 3 + 2 КОН → Fe(OH)2 Cl + 2 КСl Fe. Cl 3 + 3 КОН → Fe(OH)3↓ + 3 КСl 4. Соли взаимодействуют с кислотами. Pb(NO 3)2 + 2 НI → Pb. I 2↓+ 2 HNO 3 Рb(СН 3 СОО)2 + 2 HNO 3 → Pb(NO 3)2 + 2 CH 3 COOH
4. 4 Химические свойства солей 1. Растворимые в воде соли диссоциируют в водных растворах на ионы: Ø Средние соли: Cu. SO 4 ↔ Cu 2+ + SO 42Ø Кислые соли: Na. HCO 3 ↔ Na+ + HCO 3Ø Основные соли: Mg. OHCl ↔ Mg. OH+ + Cl-. 2. Растворимые в воде соли взаимодействуют с более активными металлами, чем металл, входящий в состав соли: Раствор соли (1) + Ме (1) → Раствор (2) + Me (2) Cu. SO 4 + Fe → Fe. SO 4 + Сu 3. Соли реагируют со щелочами. Fe. Cl 3 + 2 КОН → Fe(OH)2 Cl + 2 КСl Fe. Cl 3 + 3 КОН → Fe(OH)3↓ + 3 КСl 4. Соли взаимодействуют с кислотами. Pb(NO 3)2 + 2 НI → Pb. I 2↓+ 2 HNO 3 Рb(СН 3 СОО)2 + 2 HNO 3 → Pb(NO 3)2 + 2 CH 3 COOH
 5. Cu. OHNO 3 + HNO 3 → Cu(NO 3)2 + Н 2 O Cr(OH)2 Cl + НСl → Сr. ОНСl 2 + Н 2 O недостаток Cr(OH)2 Cl + 2 НСl → Сr. Сl 3 + 2 Н 2 O избыток 2 Cu. OHNO 3 + 2 НСl → Сu. Сl 2 + Сu(NO 3)2 + 2 Н 2 O 6. Mg(HCO 3)2 + 2 НСl → 2 СO 2 + 2 Н 2 O + Mg. Cl 2 7. Соль (1) + Соль (2) → Соль (3) + соль (4) Ag. NO 3 + NH 4 Cl → Ag. Cl↓ + NH 4 NO 3 8. Некоторые соли разлагаются при нагревании. Са. СО 3 → Са. О + СO 2 Cu. SO 4 → Cu. O + SO 3
5. Cu. OHNO 3 + HNO 3 → Cu(NO 3)2 + Н 2 O Cr(OH)2 Cl + НСl → Сr. ОНСl 2 + Н 2 O недостаток Cr(OH)2 Cl + 2 НСl → Сr. Сl 3 + 2 Н 2 O избыток 2 Cu. OHNO 3 + 2 НСl → Сu. Сl 2 + Сu(NO 3)2 + 2 Н 2 O 6. Mg(HCO 3)2 + 2 НСl → 2 СO 2 + 2 Н 2 O + Mg. Cl 2 7. Соль (1) + Соль (2) → Соль (3) + соль (4) Ag. NO 3 + NH 4 Cl → Ag. Cl↓ + NH 4 NO 3 8. Некоторые соли разлагаются при нагревании. Са. СО 3 → Са. О + СO 2 Cu. SO 4 → Cu. O + SO 3
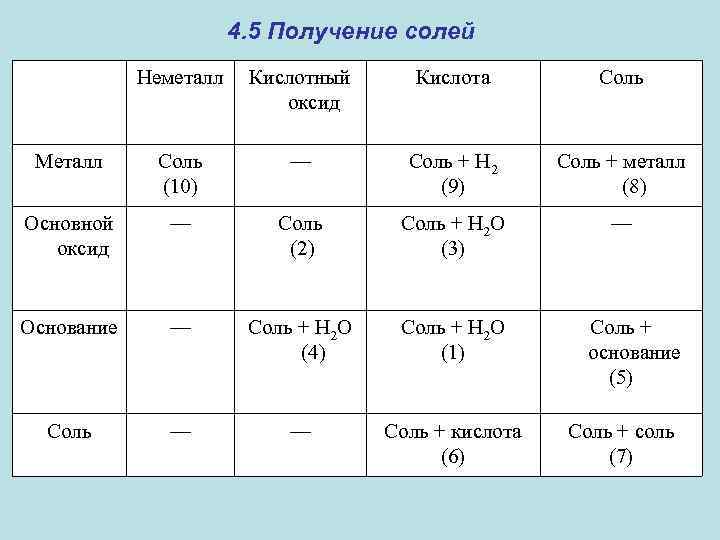 4. 5 Получение солей Неметалл Кислотный оксид Кислота Соль Металл Соль (10) — Соль + Н 2 (9) Соль + металл (8) Основной оксид — Соль (2) Соль + Н 2 O (3) — Основание — Соль + Н 2 О (4) Соль + Н 2 O (1) Соль — — Соль + кислота (6) Соль + основание (5) Соль + соль (7)
4. 5 Получение солей Неметалл Кислотный оксид Кислота Соль Металл Соль (10) — Соль + Н 2 (9) Соль + металл (8) Основной оксид — Соль (2) Соль + Н 2 O (3) — Основание — Соль + Н 2 О (4) Соль + Н 2 O (1) Соль — — Соль + кислота (6) Соль + основание (5) Соль + соль (7)
 Специфические методы получения. 1 Взаимодействие металлов, оксиды и гидроксиды которых амфотерны, со щелочами. Zn + 2 КОН → K 2 Zn. O 2 + Н 2 (сплавление) 2. С водным раствором щелочи цинк образует комплексную соль — тетрагидроксоцинкат калия: Zn + 2 КОН + 2 Н 2 O → K 2[Zn(OH)4] + Н 2 3. Сплавление солей с некоторыми кислотными оксидами. К 2 СO 3 + Si. O 2 → K 2 Si. O 3 + СO 2 4. Взаимодействие щелочей с галогенами. Сl 2 + 2 КОН → КСl + КСl. O + H 2 O 3 Сl 2 + 6 КОН → 5 КСl + КСl. O + 3 Н 2 O 5. Взаимодействие галогенидов металлов с галогенами. Более активный галоген вытесняет менее активный из раствора его соли. 2 KBr + Сl 2 → 2 КСl + Вr 2
Специфические методы получения. 1 Взаимодействие металлов, оксиды и гидроксиды которых амфотерны, со щелочами. Zn + 2 КОН → K 2 Zn. O 2 + Н 2 (сплавление) 2. С водным раствором щелочи цинк образует комплексную соль — тетрагидроксоцинкат калия: Zn + 2 КОН + 2 Н 2 O → K 2[Zn(OH)4] + Н 2 3. Сплавление солей с некоторыми кислотными оксидами. К 2 СO 3 + Si. O 2 → K 2 Si. O 3 + СO 2 4. Взаимодействие щелочей с галогенами. Сl 2 + 2 КОН → КСl + КСl. O + H 2 O 3 Сl 2 + 6 КОН → 5 КСl + КСl. O + 3 Н 2 O 5. Взаимодействие галогенидов металлов с галогенами. Более активный галоген вытесняет менее активный из раствора его соли. 2 KBr + Сl 2 → 2 КСl + Вr 2


