10_rnimu_Ammiak_Met-_gomoTsis.ppt
- Количество слайдов: 73

Тема лекции: Образование и обезвреживание аммиака Превращение отдельных аминокислот Тимин Олег Алексеевич Доцент кафедры биохимии и молекулярной и биологии ЛФ www. biokhimija. ru

Судьба аминокислот в клетке

Превращение аминокислот по карбоксильной группе Это удаление карбоксильной группы от аминокислоты и образование биогенных аминов: Ø гистамин Ø серотонин Ø дофамин Ø -аминомасляная кислота

Превращение аминокислот по радикалу
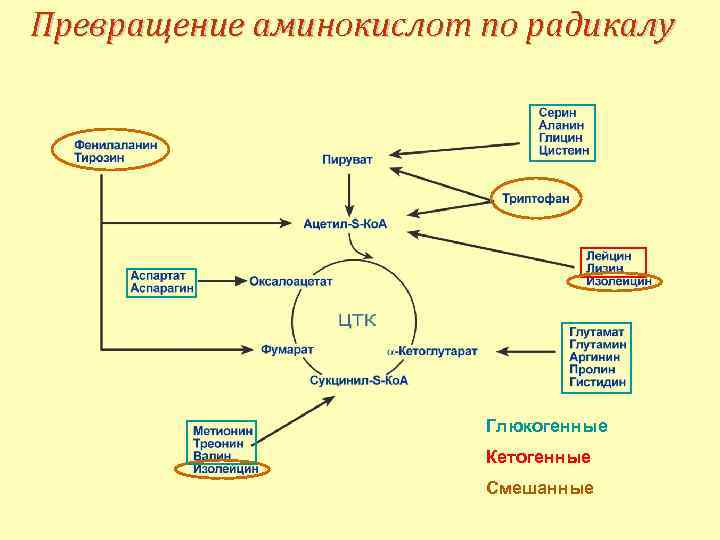
Превращение аминокислот по радикалу Глюкогенные Кетогенные Смешанные

Превращение с участием аминогруппы Превращение аминокислот с участием NH 2‑группы сводится к ее отщеплению от углеродного скелета – происходят реакции дезаминирования. Типы дезаминирования Ø внутримолекулярное, Ø восстановительное, Ø гидролитическое, Ø окислительное

Поступление аммиака

Источники аммиака Аммиак непрерывно образуется во всех органах и тканях организма. Основное количество NH 3 образуется в органах с высоким обменом аминокислот и биогенных аминов: • нервная ткань, • печень, • кишечник, • мышцы
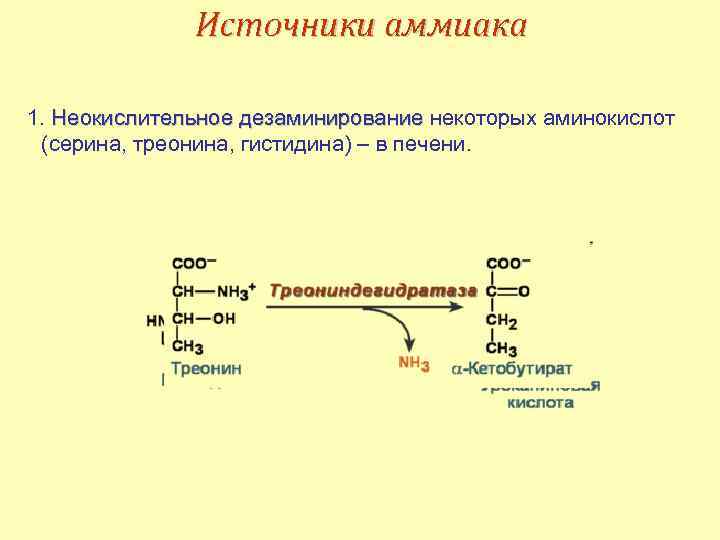
Источники аммиака 1. Неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени.
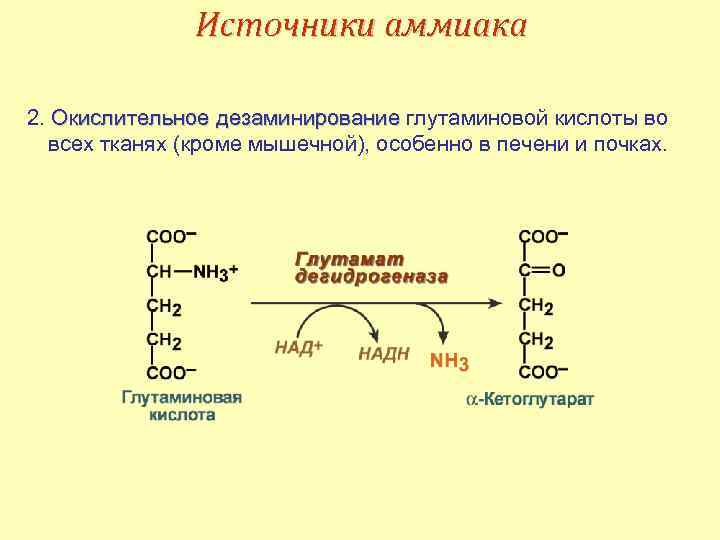
Источники аммиака 2. Окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках.
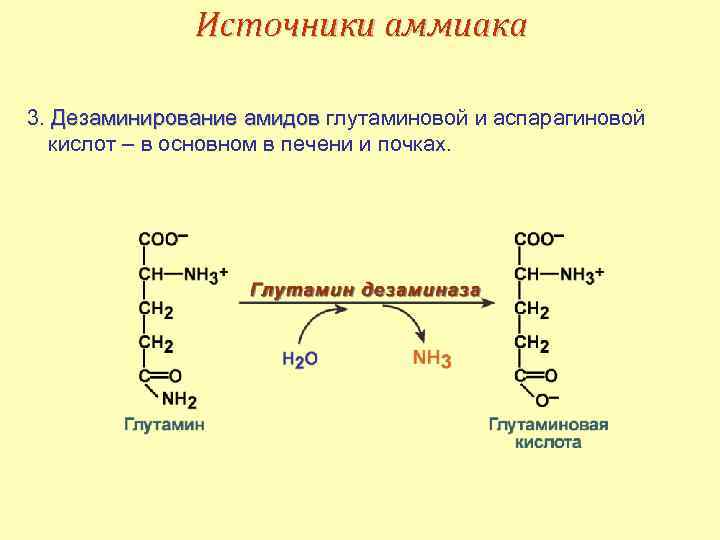
Источники аммиака 3. Дезаминирование амидов глутаминовой и аспарагиновой кислот – в основном в печени и почках.

Источники аммиака 4. Катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани.
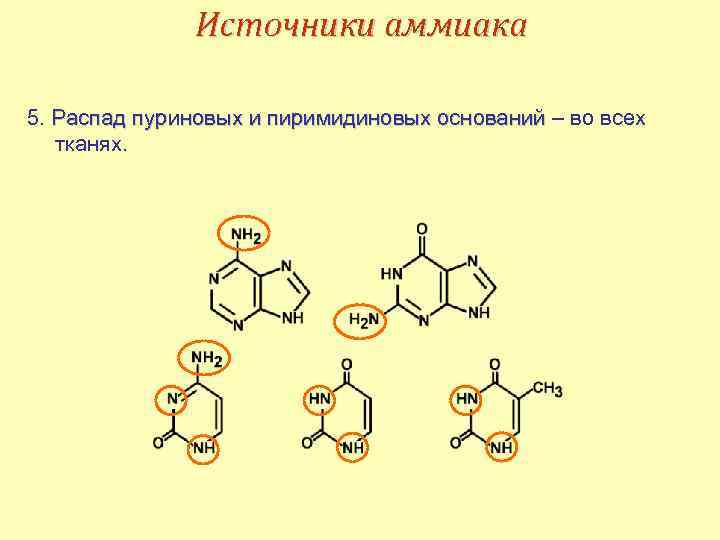
Источники аммиака 5. Распад пуриновых и пиримидиновых оснований – во всех тканях.

Источники аммиака 6. Жизнедеятельность бактерий толстого кишечника.

Источники аммиака 1. Неокислительное дезаминирование некоторых аминокислот (серина, треонина, гистидина) – в печени, 2. Окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках, 3. Дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках, 4. Катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани, 5. Распад пуриновых и пиримидиновых оснований – во всех тканях, 6. Жизнедеятельность бактерий толстого кишечника.

Нейтрализация аммиака

Связывание аммиака Реакции обезвреживания аммиака: 1. Синтез глутаминовой кислоты 2. Синтез глутамина. 3. Синтез аспарагина. 4. Синтез карбамоилфосфата.
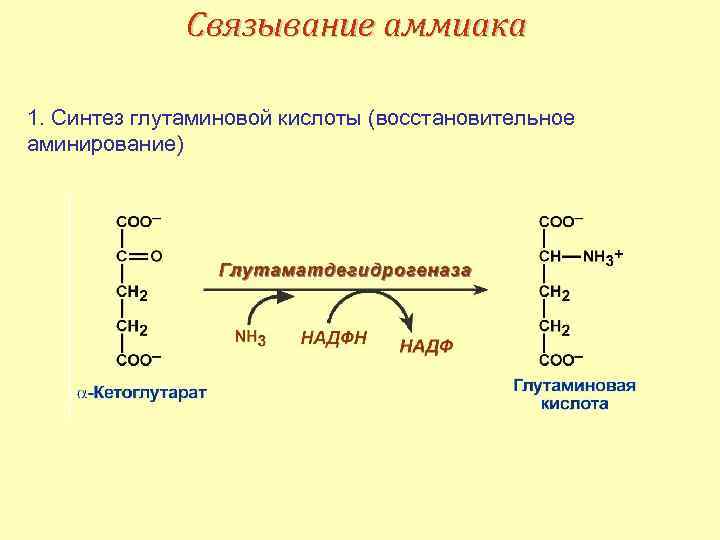
Связывание аммиака 1. Синтез глутаминовой кислоты (восстановительное аминирование)

Связывание аммиака 2. Синтез глутамина – главный способ уборки аммиака.
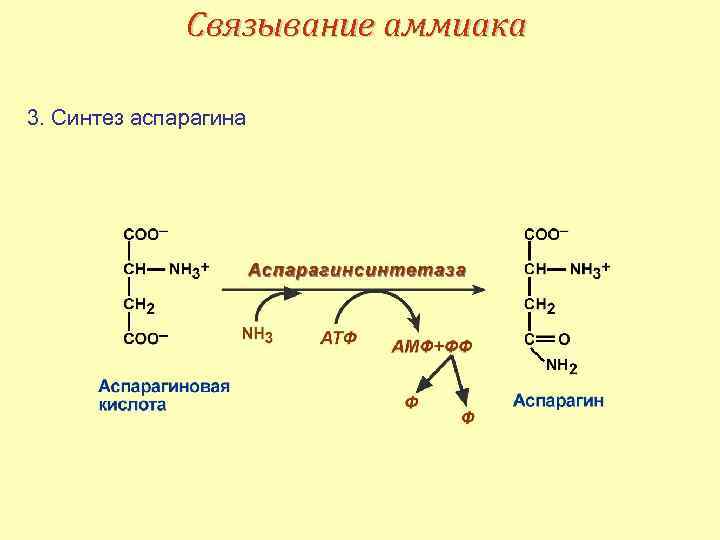
Связывание аммиака 3. Синтез аспарагина

Связывание аммиака 4. Синтез карбамоилфосфата

Связывание аммиака

Связывание аммиака Мышцы

Транспорт аммиака

Транспорт аммиака Транспортные формы Ø глутамин, Ø аланин, Ø аспарагин и глутамат, Ø в свободном виде.

Глюкозо-аланиновый цикл

Удаление аммиака из организма

Способы удаления азота в природе
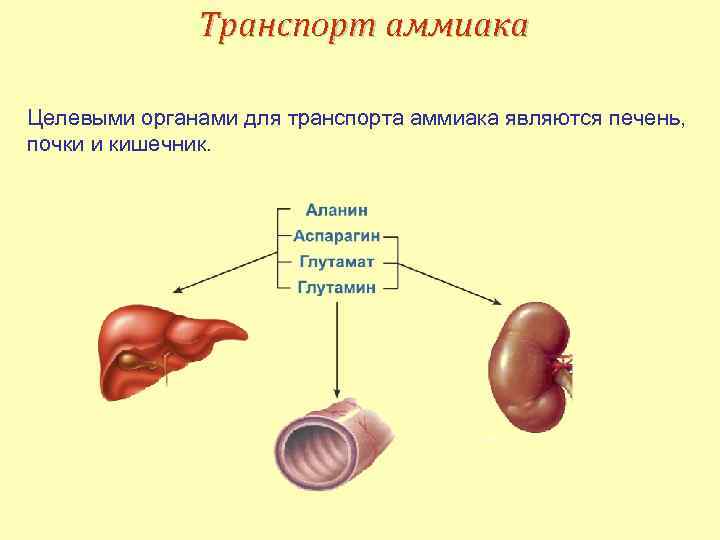
Транспорт аммиака Целевыми органами для транспорта аммиака являются печень, почки и кишечник.

Кишечник 1. Глутамин дезаминируется, образованный аммиак выделяется в просвет кишечника или в кровь v. portae. 2. Глутамат • дезаминируется, образованный аммиак выделяется в просвет кишечника или в кровь v. portae. • вступает в трансаминирование с пируватом, аланин по v. portae поступает в печень

Кишечник

Печень 1. Аспарагин и глутамин дезаминируются, 2. Аланин вступает в реакции трансаминирования с ‑кетоглутаратом, 3. Глутаминовая кислота подвергается окислительному дезаминированию.
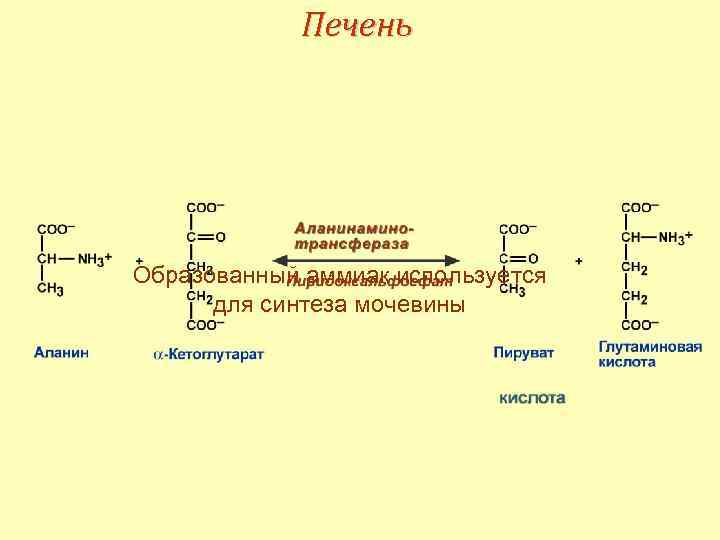
Печень Образованный аммиак используется для синтеза мочевины

Печень

Орнитиновый цикл синтеза мочевины Синтез мочевины начинается в митохондриях (1 -я и 2 -я реакции), оставшиеся три реакции идут в цитозоле. В образовании одной молекулы мочевины участвуют • 1 молекула NH 4+, • 1 молекула CO 2, • аминогруппа 1 молекулы аспарагиновой кислоты, • 4 макроэргические связи трех молекул АТФ.
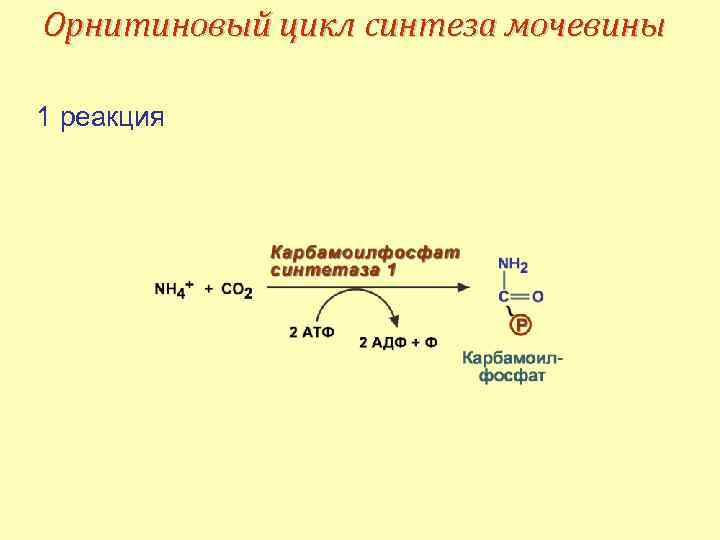
Орнитиновый цикл синтеза мочевины 1 реакция
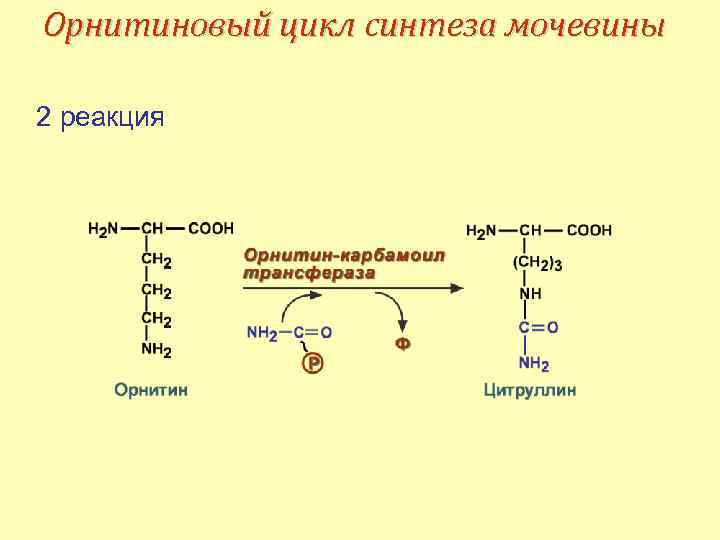
Орнитиновый цикл синтеза мочевины 2 реакция

Орнитиновый цикл синтеза мочевины 3 реакция
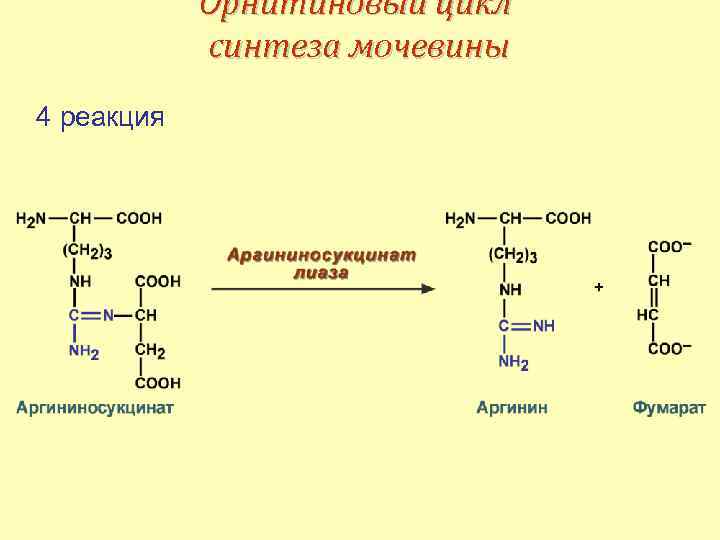
Орнитиновый цикл синтеза мочевины 4 реакция
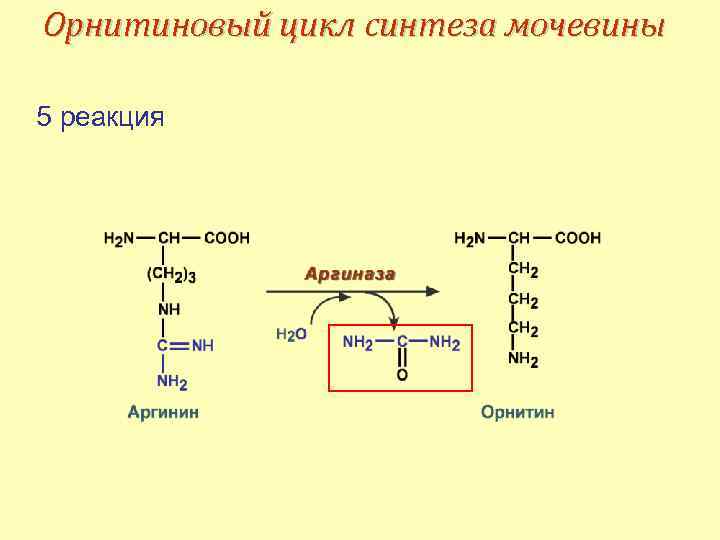
Орнитиновый цикл синтеза мочевины 5 реакция


Почки 1. Аспарагин и глутамин дезаминируются, 2. Глутаминовая кислота подвергается окислительному дезаминированию. Образованный аммиак используется для синтеза солей аммония

Почки

Синтез аммонийных солей

Синтез аммонийных солей

Синтез аммонийных солей
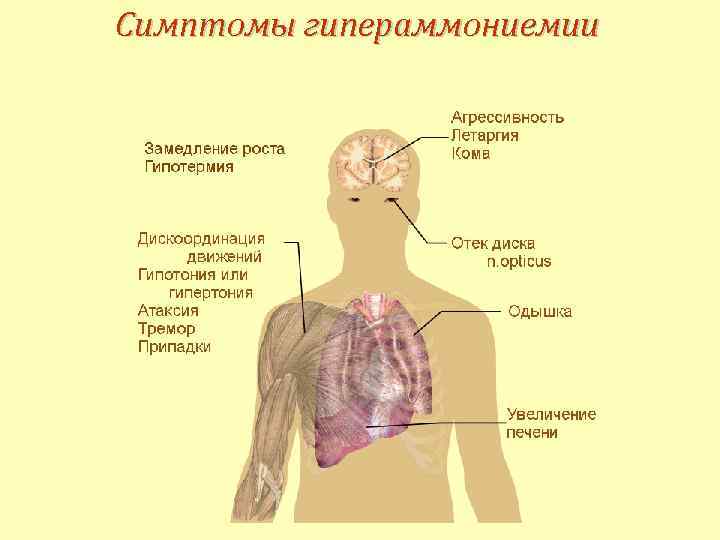
Симптомы гипераммониемии

Гипераммониемии Первичными признаками являются: Ø сонливость, Ø отказ от пищи, Ø рвота, Ø беспокойство, Ø судороги, Ø нарушение координации движений, Ø дыхательный алкалоз, Ø печеночная недостаточность, Ø легочные и внутричерепные кровоизлияния.

Гипераммониемии Наследственные формы - дефект ферментов синтеза мочевины. Например, гипераммониемия типа , связанная с недостатком орнитин-карбамоилтрансферазы. Заболевание рецессивно, сцеплено с Х‑хромосомой. При полном дефекте фермента наследственные гипераммониемии имеют раннее начало (в период до 48 часов после рождения). Без лечения – летальный исход. Лабораторно: накопление глутамина (в 20 и более раз) и аммиака в крови, ликворе и моче. Принцип лечения: ограничение белка в диете.

Гипераммониемии Тип наследования Клинические проявления Метаболиты Заболевание Дефект фермента Гипераммониемия, тип I Карбамоилфосфатсинтетаза I Гипераммониемия, тип II Орнитин. Сцепленный Гипотония, сниже- Глн, Ала, Оротат карбамоил- с X-хромоние толерантности к NH 3 трансфераза сомой белкам Цитруллинемия Аргининосукцинатсинтетаза Аутосомно- В течение 24 -48 ч рецессивный после рождения кома, смерть кровь моча Глн, Ала, Оротат NH 3 Аутосомно- Тяжелая гиперамрецессивный мониемия у новорожденных Цитрул- Цитруллин, NH 3 лин Аргининосукцинатурия сукцинатлиаза Аутосомно- Гипераммониемия, рецессивный атаксия, судороги, выпадение волос Аргинино сукцинат, NH 3 Гипер. Аргиназа аргининемия Аутосомно- Гипераргининемия рецессивный Аргинино Лиз, Арг, Орнитин Аргинино сукцинат, Глн, Ала, Лиз

Гипераммониемии Приобретенные формы Начинаются Ø вследствие заболеваний печени и вирусных инфекций – нарушается работа ферментов орнитинового цикла, Ø в результате повышения кишечной продукции аммиака – желудочно-кишечное кровотечение, запоры, избыток белков в пище, Ø из-за увеличения тканевой продукции аммиака – атрофия мышц, кровоизлияния в ткани, инфекция, сепсис.

Гипотезы токсичности аммиака 1. При синтезе глутамата происходит отток ‑кетоглутарата из ЦТК, при этом понижается образование энергии АТФ и ухудшается деятельность клеток. 2. Ионы аммония NH 4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду (эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток. 3. Накопление свободного иона NH 4+ в цитозоле конкурентно подавляет ионные каналы для Na+ и K+. 4. Глутамин приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга, кому и смерть. 5. Использование ‑кетоглутарата и глутамата для нейтрализации аммиака вызывает снижение синтеза ГАМК, тормозного медиатора нервной системы.

Превращение отдельных аминокислот

Взаимосвязь превращения серина, глицина, метионина и витаминов В 9, В 12

Взаимопревращение серина и глицина
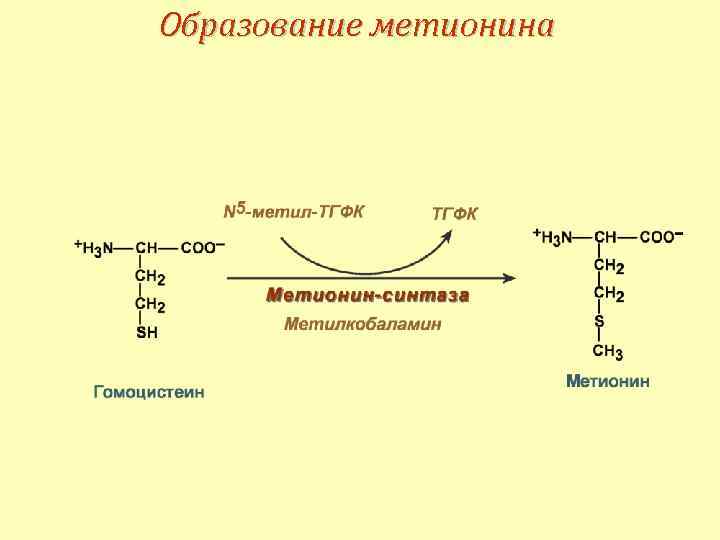
Образование метионина
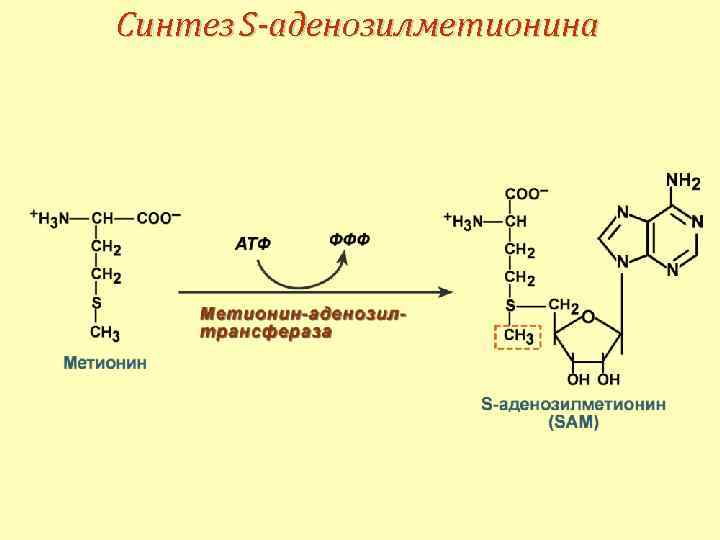
Синтез S-аденозилметионина
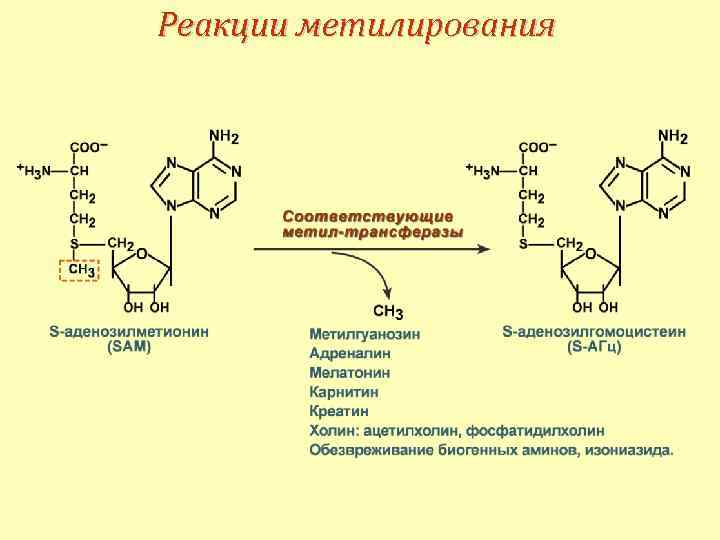
Реакции метилирования

Удаление гомоцистеина
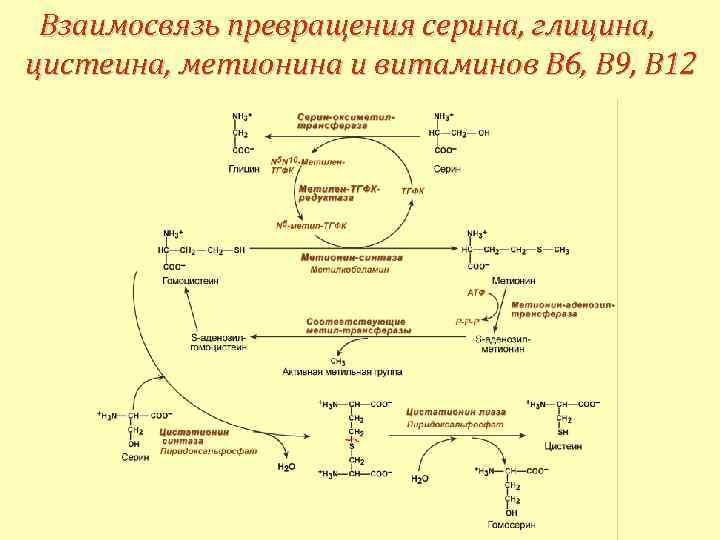
Взаимосвязь превращения серина, глицина, цистеина, метионина и витаминов В 6, В 9, В 12

Гомоцистеинемия Референсные величины концентрации гомоцистеина Дети около 5 мкмоль/л Подростки 6 -7 мкмоль/л. Взрослые 5, 0– 15, 0 мкмоль/л, Повышение уровня разделяют на легкое (16 -30), среднее (31100) и тяжелое (>100 мкмоль/л). Концентрации порядка 10 мкмоль/л были признаны ВОЗ пограничными при диагностике заболеваний, т. е. свыше этих показателей у людей, входящих в группу риска, можно утверждать о наличии патологии

Гомоцистеинемия Гомоцистеин является независимым фактором риска атеросклероза коронарных, периферических и мозговых сосудов. У лиц с повышенным содержанием ГЦ увеличивается риск развития инфаркта миокарда и инсульта мозга во всех возрастных группах независимо от курения, уровня ХС и артериальной гипертензии. Каждое повышение уровня ГЦ на 5 мкмоль/л сопровождается увеличением риска патологии мозговых артерий в 1, 5 раза и периферических артерий в 6, 8 раз. Увеличение концентрации ГЦ в крови (более 22 мкмоль/л) связано с 4 -кратным повышением риска возникновения тромбоза глубоких вен. У мужчин с уровнем ГЦ всего на 12% превышающим норму, наблюдается тройное увеличение риска сердечного приступа.

Гомоцистеинемия Генетические дефекты 1. Гомозиготный дефицит цистатионин-b-синтазы (врожденная гомоцистинурия). 2. Гомозиготный дефицит метилен-тетрагидрофолатредуктазы). 3. Нарушение превращения витамина В 12 в его коферменты снижение активности метионинсинтазы.

Гомоцистеинемия Приобретенные дефекты 1. Пищевая недостаточность витаминов В 6, В 9, В 12. 2. Заболевания желудочно-кишечного тракта (гипохлоргидия, дисбактериоз, отсутствие внутреннего фактора Касла) 3. Почечная недостаточность (снижение фильтрации и/или метаболизма в почках гомо. Цис). 4. Курение (повышение гомо. Цис на 20%), кофеин (на 2 -3 мкмоль/л выше).

Гомоцистеинемия Патогенез • повреждение клеток эндотелия, приводящее к нарушению их многочисленных функций, • окисление ЛПНП и нарушение их взаимодействия с апо-Врецепторами, • повышенная продукция тромбоцитарных факторов роста, • повышенное склеивание тромбоцитов, • образование нитей фибрина, • не образуются нормальные перекрестные сшивки в коллагене.

Гомоцистеинемия Повышенная концентрация гомоцистеина наблюдается при: • атеросклерозе, • тромбозе глубоких вен, • болезни Альцгеймера, • старческой деменции, • остеопатиях, остепорозе • при спонтанных абортах, мертворождениях, дефектах развития плода.
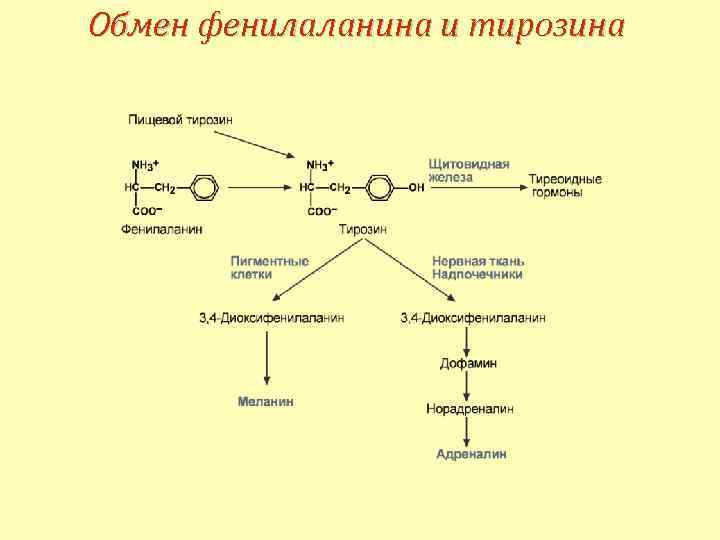
Обмен фенилаланина и тирозина
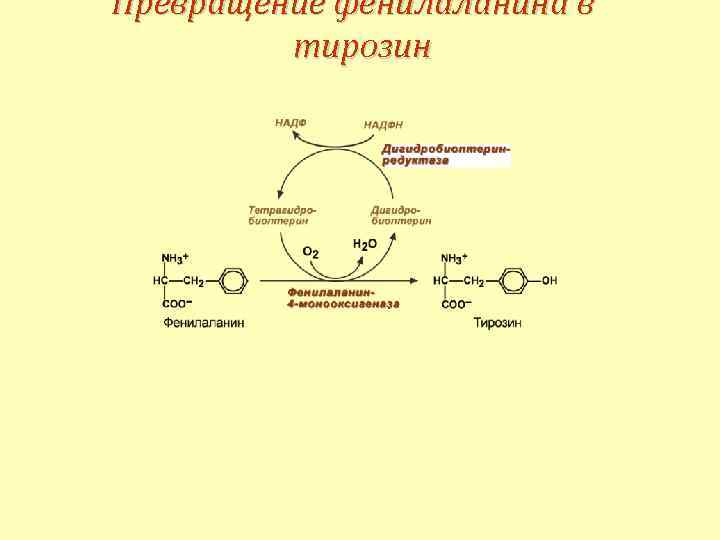
Превращение фенилаланина в тирозин

Фенилкетонурия 1 типа Этиология Аутосомно-рецессивное заболевание. Дефект фермента фенилаланин-4 -монооксигеназы Патогенез • накопление фенилаланина и его производных и вызванный ими ацидоз, • прямое токсическое действие производных и торможение активности ферментов – пируваткиназы, тирозиназы, пируваткиназы тирозин-гидроксилазы, тирозин-гидроксилазы • нарушение синтеза серотонина (монооксигеназа ароматических аминокислот), • конкурентное снижение фенилаланином транспорта в клетки ароматических аминокислот – триптофана и тирозина, тирозина • нарушение синтеза простых и сложных белков.

Фенилкетонурия 2 типа Этиология Аутосомно-рецессивное заболевание. Дефект фермента дигидробиоптерин редуктазы. Патогенез • схоже с фенилкетонурией 1 типа, • картина дефицита фолиевой кислоты.
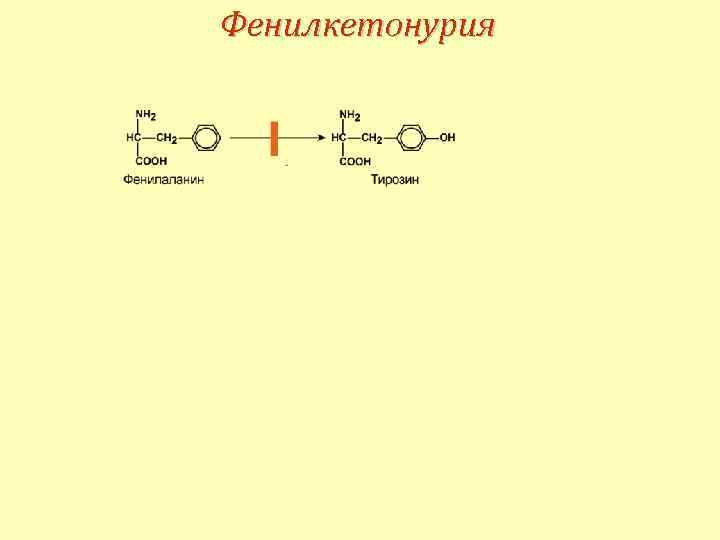
Фенилкетонурия

Обмен триптофана

Спасибо за внимание
10_rnimu_Ammiak_Met-_gomoTsis.ppt