1 Иммунитет-НЛВ новая 2012.ppt
- Количество слайдов: 154
 Тема лекции: «Механизмы защиты организма человека. Врожденный иммунитет»
Тема лекции: «Механизмы защиты организма человека. Врожденный иммунитет»
 Иммунитет – это способ защиты организма от генетически чужеродных веществ экзогенного и эндогенного происхождения, направленный на поддержание и сохранение гомеостаза, структурной и функциональной целостности организма, биологической индивидуальности организма и вида в целом.
Иммунитет – это способ защиты организма от генетически чужеродных веществ экзогенного и эндогенного происхождения, направленный на поддержание и сохранение гомеостаза, структурной и функциональной целостности организма, биологической индивидуальности организма и вида в целом.
 Иммунитет – это способность организма поддерживать постоянство своего макромолекулярного состава путем удаления чужеродных молекул, что обеспечивает устойчивость к инфекционным агентам и резистентность к опухолям (А. А. Ярилин. 2010).
Иммунитет – это способность организма поддерживать постоянство своего макромолекулярного состава путем удаления чужеродных молекул, что обеспечивает устойчивость к инфекционным агентам и резистентность к опухолям (А. А. Ярилин. 2010).
 Виды иммунитета: 1. Врожденный (видовой или конституциональный иммунитет) или неспецифический 2. Адаптивный (приспособительный) или специфический.
Виды иммунитета: 1. Врожденный (видовой или конституциональный иммунитет) или неспецифический 2. Адаптивный (приспособительный) или специфический.
 Молекулы-мишени иммунитета: Образы патогенности или патогенассоциированные молекулярные паттерны (РAMP – Pathogen-associated molecular patterns) – группы молекул, отсутствующие в организме-хозяине, но характерные для патогенов (вирусов, бактерий, грибов, простейших, паразитов). РАМР являются знаками опасности, универсальным сигналом о проникновении в организм не просто чужеродного, но биологически агрессивного агента. Рецепторы для РАМР – паттерн(патоген)распознающие рецепторы позволяют распознавать все возможные типы патогенов. Антигены – высокомолекулярные соединения, способные специфически стимулировать иммунокомпетентные лимфоциты. Распознаются антигенспецифическими рецепторами, представленными на лимфоцитах.
Молекулы-мишени иммунитета: Образы патогенности или патогенассоциированные молекулярные паттерны (РAMP – Pathogen-associated molecular patterns) – группы молекул, отсутствующие в организме-хозяине, но характерные для патогенов (вирусов, бактерий, грибов, простейших, паразитов). РАМР являются знаками опасности, универсальным сигналом о проникновении в организм не просто чужеродного, но биологически агрессивного агента. Рецепторы для РАМР – паттерн(патоген)распознающие рецепторы позволяют распознавать все возможные типы патогенов. Антигены – высокомолекулярные соединения, способные специфически стимулировать иммунокомпетентные лимфоциты. Распознаются антигенспецифическими рецепторами, представленными на лимфоцитах.
 Стрессорные молекулы – собственные молекулы организма, экспрессируемые на мембране клеток человека при клеточном стрессе и сигнализирующие об опасности эндогенного происхождения (любое повреждение). Они распознаются рецепторами некоторых разновидностей лимфоцитов (естественные киллеры - NKклетки, γδТ-лимфоциты). Они занимают промежуточное положение между врожденным и адаптивным иммунитетом. Родственную группу молекул образуют образы опасности (DАМР-danger-associated molecular paterns) – эндогенные молекулы, сигнализирующие о любом повреждающем воздействии (температурном, лучевом, инфекционном и др. ). Некоторые образы опасности (белки теплового шока) распознаются ПРР. DАМР – это эндогенные эквиваленты РАМР.
Стрессорные молекулы – собственные молекулы организма, экспрессируемые на мембране клеток человека при клеточном стрессе и сигнализирующие об опасности эндогенного происхождения (любое повреждение). Они распознаются рецепторами некоторых разновидностей лимфоцитов (естественные киллеры - NKклетки, γδТ-лимфоциты). Они занимают промежуточное положение между врожденным и адаптивным иммунитетом. Родственную группу молекул образуют образы опасности (DАМР-danger-associated molecular paterns) – эндогенные молекулы, сигнализирующие о любом повреждающем воздействии (температурном, лучевом, инфекционном и др. ). Некоторые образы опасности (белки теплового шока) распознаются ПРР. DАМР – это эндогенные эквиваленты РАМР.
 Врожденный или видовой (конституциональный) иммунитет – это состояние устойчивости к патогенному действию микроорганизмов, обусловленное молекулярными стями строения организма. особенно-
Врожденный или видовой (конституциональный) иммунитет – это состояние устойчивости к патогенному действию микроорганизмов, обусловленное молекулярными стями строения организма. особенно-
 Характеризуется следующими признаками: 1. Видовой иммунитет генетически детерми-нирован и передается по наследству. 2. Обладает специфичностью (устойчивость к одним инфекциям и чувствительность – к другим). 3. Обладает способностью распознавать группы чужеродных молекул.
Характеризуется следующими признаками: 1. Видовой иммунитет генетически детерми-нирован и передается по наследству. 2. Обладает специфичностью (устойчивость к одним инфекциям и чувствительность – к другим). 3. Обладает способностью распознавать группы чужеродных молекул.
 4. В основе защиты может лежать принцип молекулярной комплементарности. При этом устойчивость к инфекции определяется: отсутствием рецепторов на поверхности клеток организма человека для адгезии и колонизации отсутствием структур-мишеней, на которые действуют микробы и их токсины наличием специальных ферментов, разрушающих микроорганизмы (протеазы, ДНК-азы, РНК-азы и др. ) наличием специальных рецепторов для взаимодействия с патогенами
4. В основе защиты может лежать принцип молекулярной комплементарности. При этом устойчивость к инфекции определяется: отсутствием рецепторов на поверхности клеток организма человека для адгезии и колонизации отсутствием структур-мишеней, на которые действуют микробы и их токсины наличием специальных ферментов, разрушающих микроорганизмы (протеазы, ДНК-азы, РНК-азы и др. ) наличием специальных рецепторов для взаимодействия с патогенами
 Система врожденного иммунитета сформировалась у многоклеточных животных и человека более 1, 5 млрд. лет назад. Главные составные врожденного иммунитета: 1 – распознавание чужеродных агентов во внутренней среде организма с помощью рецепторов, специализированных на узнавании «образов» (паттернов) патогенности; 2 – элиминация опознанных чужеродных агентов из организма путем фагоцитоза и расщепления.
Система врожденного иммунитета сформировалась у многоклеточных животных и человека более 1, 5 млрд. лет назад. Главные составные врожденного иммунитета: 1 – распознавание чужеродных агентов во внутренней среде организма с помощью рецепторов, специализированных на узнавании «образов» (паттернов) патогенности; 2 – элиминация опознанных чужеродных агентов из организма путем фагоцитоза и расщепления.
 В процессе эволюции в организме закреплялись гены, кодирующие молекулырецепторы, предназначенные для распознавания не просто «чужого» , но заведомо опасного для данного организма. Эти рецепторы (мембранные или растворимые молекулы) обладают пространственным сродством к наиболее общим и связанным с патогенностью молекулярным маркерам чужеродных агентов: компонентам клеточной стенки бактерий, эндотоксинам, нуклеиновым кислотам и т. д.
В процессе эволюции в организме закреплялись гены, кодирующие молекулырецепторы, предназначенные для распознавания не просто «чужого» , но заведомо опасного для данного организма. Эти рецепторы (мембранные или растворимые молекулы) обладают пространственным сродством к наиболее общим и связанным с патогенностью молекулярным маркерам чужеродных агентов: компонентам клеточной стенки бактерий, эндотоксинам, нуклеиновым кислотам и т. д.
 Каждый рецептор распознает не молекулу, а целую группу чужеродных похожих молекул, служащих «образами» (паттернами) патогенности. Патоген(паттерн)распознающие рецепторы (ПРР = PRR) представлены: 1 – на поверхности клеток-эффекторов, 2 – в гранулах фагоцитов, 3 – в жидких средах организма. В организме имеется относительно небольшое количество генов, кодирующие распознавание практически всех патогенов.
Каждый рецептор распознает не молекулу, а целую группу чужеродных похожих молекул, служащих «образами» (паттернами) патогенности. Патоген(паттерн)распознающие рецепторы (ПРР = PRR) представлены: 1 – на поверхности клеток-эффекторов, 2 – в гранулах фагоцитов, 3 – в жидких средах организма. В организме имеется относительно небольшое количество генов, кодирующие распознавание практически всех патогенов.
 В результате распознавания образов патогенности происходит: 1 – активация клеток-фагоцитов: они убивают и затем элиминируют патогены внутриклеточный цитолиз; 2 – активация внеклеточных факторов – внеклеточный цитолиз (гуморальные факторы; 3 – активация контактных механизмов – контактный цитолиз. Во всех случаях окончательное расщепление убитых патогенов происходит в процессе фагоцитоза !
В результате распознавания образов патогенности происходит: 1 – активация клеток-фагоцитов: они убивают и затем элиминируют патогены внутриклеточный цитолиз; 2 – активация внеклеточных факторов – внеклеточный цитолиз (гуморальные факторы; 3 – активация контактных механизмов – контактный цитолиз. Во всех случаях окончательное расщепление убитых патогенов происходит в процессе фагоцитоза !
 Более 500 млн. назад у животных, а затем у человека в процессе эволюции сформировался адаптивный (приспособительный) или приобретенный (специфический) иммунитет. Главные составляющие адаптивного иммунитета: 1 – распознавание антигенов (чужеродных для организма веществ и структур), независимо от их связи с патогенностью, с помощью специальных клонально распределенных на клетках рецепторов; 2 – элиминация агентов; распознанных чужеродных 3 – формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять чужеродные агенты.
Более 500 млн. назад у животных, а затем у человека в процессе эволюции сформировался адаптивный (приспособительный) или приобретенный (специфический) иммунитет. Главные составляющие адаптивного иммунитета: 1 – распознавание антигенов (чужеродных для организма веществ и структур), независимо от их связи с патогенностью, с помощью специальных клонально распределенных на клетках рецепторов; 2 – элиминация агентов; распознанных чужеродных 3 – формирование иммунологической памяти о контакте с антигеном, позволяющей быстрее и эффективнее удалять чужеродные агенты.
 Особенности адаптивного иммунитета: 1 - специфичность антигенраспознающих рецепторов формируется в процессе дифференцировки клеток; 2 – селекция лимфоцитов для устранения «опасных» для организма клонов клеток (однако риск развития аутоиммунного процессов сохраняется); 3 -- наличие феномена иммунологической памяти; 4 – распознавание индивидуальных чужеродных молекул или похожих групп молекул – антигенов (существует около 106 различных антигенов);
Особенности адаптивного иммунитета: 1 - специфичность антигенраспознающих рецепторов формируется в процессе дифференцировки клеток; 2 – селекция лимфоцитов для устранения «опасных» для организма клонов клеток (однако риск развития аутоиммунного процессов сохраняется); 3 -- наличие феномена иммунологической памяти; 4 – распознавание индивидуальных чужеродных молекул или похожих групп молекул – антигенов (существует около 106 различных антигенов);
 5 - при развитии иммунного ответа в специализированных клонах лимфоцитов происходит перестройка их генов, кодирующих антигенраспознающие рецепторы, что приводит к образованию в каждой клетке рецепторов с уникальной специфичностью. При активации каждая клетка может дать начало клону, все клетки которого будут иметь рецепторы той же специфичности.
5 - при развитии иммунного ответа в специализированных клонах лимфоцитов происходит перестройка их генов, кодирующих антигенраспознающие рецепторы, что приводит к образованию в каждой клетке рецепторов с уникальной специфичностью. При активации каждая клетка может дать начало клону, все клетки которого будут иметь рецепторы той же специфичности.
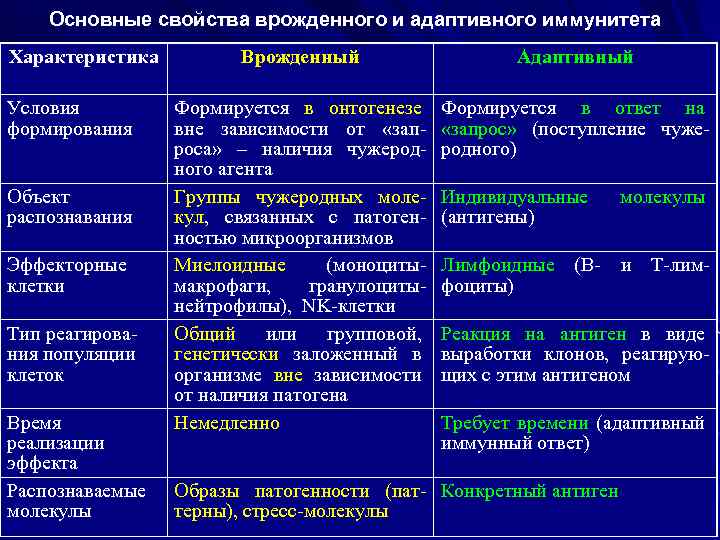 Основные свойства врожденного и адаптивного иммунитета Характеристика Условия формирования Объект распознавания Эффекторные клетки Тип реагирования популяции клеток Время реализации эффекта Распознаваемые молекулы Врожденный Адаптивный Формируется в онтогенезе вне зависимости от «запроса» – наличия чужеродного агента Группы чужеродных молекул, связанных с патогенностью микроорганизмов Миелоидные (моноцитымакрофаги, гранулоцитынейтрофилы), NK-клетки Общий или групповой, генетически заложенный в организме вне зависимости от наличия патогена Немедленно Формируется в ответ на «запрос» (поступление чужеродного) Индивидуальные (антигены) молекулы Лимфоидные (В- и Т-лимфоциты) Реакция на антиген в виде выработки клонов, реагирующих с этим антигеном Требует времени (адаптивный иммунный ответ) Образы патогенности (пат- Конкретный антиген терны), стресс-молекулы
Основные свойства врожденного и адаптивного иммунитета Характеристика Условия формирования Объект распознавания Эффекторные клетки Тип реагирования популяции клеток Время реализации эффекта Распознаваемые молекулы Врожденный Адаптивный Формируется в онтогенезе вне зависимости от «запроса» – наличия чужеродного агента Группы чужеродных молекул, связанных с патогенностью микроорганизмов Миелоидные (моноцитымакрофаги, гранулоцитынейтрофилы), NK-клетки Общий или групповой, генетически заложенный в организме вне зависимости от наличия патогена Немедленно Формируется в ответ на «запрос» (поступление чужеродного) Индивидуальные (антигены) молекулы Лимфоидные (В- и Т-лимфоциты) Реакция на антиген в виде выработки клонов, реагирующих с этим антигеном Требует времени (адаптивный иммунный ответ) Образы патогенности (пат- Конкретный антиген терны), стресс-молекулы
 Характеристика Врожденный Адаптивный Чем распознает Патогенраспознающие (распознающие рецепторы (ПРР=РRR) рецепторы) Антигенраспознающие рецепторы (В-клеточные=BCR и Т-клеточные=ТCR) Распознающие рецепторы BCR (на В-клетках), ТCR-γδ, (на γδТ-клетках), ТCR-αβ (на αβТ-клетках) TLR, NLR, CLR, RIG, DAO, Scavenger-рецепторы, растворимые рецепторы Распределение на Все клетки в популяции Клональное – по отдельным клетках экспрессируют одинаковые клонам клеток рецепторы Угроза аутоагрес- Минимальная (не способны Реальная (способны реагиросии (способность распознавать собственные вать на собственные молеразрушать собст- молекулы организма) кулы и вызывать повреждевенные клетки в ние организма человека) организме) Наличие иммуно- Отсутствует (каждый раз логической памяти реакции на внедрение чужеродных молекул развиваются как впервые) Формируются клоны клеток, сохраняющие память о предыдущей встрече с антигеном, что позволяет им реагировать на повторную встречу значительно быстрее
Характеристика Врожденный Адаптивный Чем распознает Патогенраспознающие (распознающие рецепторы (ПРР=РRR) рецепторы) Антигенраспознающие рецепторы (В-клеточные=BCR и Т-клеточные=ТCR) Распознающие рецепторы BCR (на В-клетках), ТCR-γδ, (на γδТ-клетках), ТCR-αβ (на αβТ-клетках) TLR, NLR, CLR, RIG, DAO, Scavenger-рецепторы, растворимые рецепторы Распределение на Все клетки в популяции Клональное – по отдельным клетках экспрессируют одинаковые клонам клеток рецепторы Угроза аутоагрес- Минимальная (не способны Реальная (способны реагиросии (способность распознавать собственные вать на собственные молеразрушать собст- молекулы организма) кулы и вызывать повреждевенные клетки в ние организма человека) организме) Наличие иммуно- Отсутствует (каждый раз логической памяти реакции на внедрение чужеродных молекул развиваются как впервые) Формируются клоны клеток, сохраняющие память о предыдущей встрече с антигеном, что позволяет им реагировать на повторную встречу значительно быстрее
 Механизмы врожденного иммунитета: 1. Анатомо-физиологические механизмы (барьерная и выделительная функции, воспаление и т. д. ) 2. Нормальная микрофлора 3. Гуморальные факторы (лизоцим, бета-лизины, комплемент, интерфероны, фибронектин, белки острой фазы, естественные или нормальныые антитела) 4. Клеточные факторы (фагоцитоз и естественная клеточная цитотоксичность)
Механизмы врожденного иммунитета: 1. Анатомо-физиологические механизмы (барьерная и выделительная функции, воспаление и т. д. ) 2. Нормальная микрофлора 3. Гуморальные факторы (лизоцим, бета-лизины, комплемент, интерфероны, фибронектин, белки острой фазы, естественные или нормальныые антитела) 4. Клеточные факторы (фагоцитоз и естественная клеточная цитотоксичность)
 Анатомо-физиологические механизмы: 1. Защитная функция кожи. 2. Защитная функция слизистых оболочек. 3. Барьерная функция органов и тканей. 4. Выделительная функция. 5. Температурная реакция.
Анатомо-физиологические механизмы: 1. Защитная функция кожи. 2. Защитная функция слизистых оболочек. 3. Барьерная функция органов и тканей. 4. Выделительная функция. 5. Температурная реакция.











 Нормальная микрофлора Функции нормальной микрофлоры кишечника: 1. Колонизационная резистентность, 2. Иммуномодулирующая функция, 3. Детоксикационная деятельность, 4. Витаминообразующая функция, 5. Переваривание и всасывание пищи, 6. Регуляция моторной деятельности кишечника.
Нормальная микрофлора Функции нормальной микрофлоры кишечника: 1. Колонизационная резистентность, 2. Иммуномодулирующая функция, 3. Детоксикационная деятельность, 4. Витаминообразующая функция, 5. Переваривание и всасывание пищи, 6. Регуляция моторной деятельности кишечника.
 Гуморальные механизмы 1. Лизоцим 3. Бета-лизин 2. Нормальные антитела 4. Система интерферонов 5. Система комплемента
Гуморальные механизмы 1. Лизоцим 3. Бета-лизин 2. Нормальные антитела 4. Система интерферонов 5. Система комплемента
 Нормальные антитела или конститутивные иммуноглобулины существуют в крови и других жидкостях до встречи с антигеном, относятся к Ig. G, реже к Ig. А и Ig. М, способны связывать множество патогенов (экзогенных и ауто АГ) мишенями для нормальных Ig могут быть другие молекулы: - другие Ig, - ТСR, - молекулы CD 4, CD 5, HLA-I, - рецепторы к Fc-фрагментам и Ig. G и др.
Нормальные антитела или конститутивные иммуноглобулины существуют в крови и других жидкостях до встречи с антигеном, относятся к Ig. G, реже к Ig. А и Ig. М, способны связывать множество патогенов (экзогенных и ауто АГ) мишенями для нормальных Ig могут быть другие молекулы: - другие Ig, - ТСR, - молекулы CD 4, CD 5, HLA-I, - рецепторы к Fc-фрагментам и Ig. G и др.
 Функции нормальных антител: «первая линия обороны» против инфекций; удаление из организма отживших клеток и продуктов катаболизма; представление АГ для Т-лимфоцитов; поддержание гомеостаза аутоиммунной реактивности; противовоспалительное действие (нейтрализация суперантигенов, индукция синтеза противовоспалительных цитокинов, снижение комплементзависимого повреждения тканей и др. ).
Функции нормальных антител: «первая линия обороны» против инфекций; удаление из организма отживших клеток и продуктов катаболизма; представление АГ для Т-лимфоцитов; поддержание гомеостаза аутоиммунной реактивности; противовоспалительное действие (нейтрализация суперантигенов, индукция синтеза противовоспалительных цитокинов, снижение комплементзависимого повреждения тканей и др. ).
 Выделяют 2 разновидности нормальных антител: I гр. Нормальные противоэритроцитарные антитела – изогемагглютинины α- и β. Образуются в результате пероральной иммунизации человека антигенами А и В, содержащимися в пище, а также в структуре многих бактерий.
Выделяют 2 разновидности нормальных антител: I гр. Нормальные противоэритроцитарные антитела – изогемагглютинины α- и β. Образуются в результате пероральной иммунизации человека антигенами А и В, содержащимися в пище, а также в структуре многих бактерий.
 Функции: 1 - нейтрализуют у беременных женщин токсические вещества, поступающие от плода в случае гетероспецифической беременности, препятствуют развитию токсикозов; 2 - связывают и нейтрализуют пищевые антигены, препятствуют в определенной мере развитию пищевой аллергии; 3 - выполняют роль опсонинов: - удаляют ожившие клетки в организме; - связывают микроорганизмы, на поверхности которых имеются антигены, схожие с эритроцитарными АГ человека, и передают их фагоцитам.
Функции: 1 - нейтрализуют у беременных женщин токсические вещества, поступающие от плода в случае гетероспецифической беременности, препятствуют развитию токсикозов; 2 - связывают и нейтрализуют пищевые антигены, препятствуют в определенной мере развитию пищевой аллергии; 3 - выполняют роль опсонинов: - удаляют ожившие клетки в организме; - связывают микроорганизмы, на поверхности которых имеются антигены, схожие с эритроцитарными АГ человека, и передают их фагоцитам.
 II гр. Нормальные противомикробные, противовирусные, противогрибковые, противопротозойные антитела. Образуются в результате спонтанной естественной иммунизации организма различными микроорганизмами в дозе ниже инфицирующей, а также появляются за счет наличия у сапрофитной и патогенной флоры общих антигенов.
II гр. Нормальные противомикробные, противовирусные, противогрибковые, противопротозойные антитела. Образуются в результате спонтанной естественной иммунизации организма различными микроорганизмами в дозе ниже инфицирующей, а также появляются за счет наличия у сапрофитной и патогенной флоры общих антигенов.
 Функции: 1 - защитная – связывает в воротах инфекции микроорганизмы, препятствуют их распространению и адсорбции к клеткам слизистых оболочек; 2 - выполняют роль опсонинов – связывают микроорганизмы и улучшают их поглощение фагоцитами; 3 - нейтрализуют токсины микробов; 4 - препятствуют всасыванию пищевых антигенов и развитию пищевой аллергии. Количество нормальных антител остается постоянным у каждого человека и незначительно изменяется с возрастом.
Функции: 1 - защитная – связывает в воротах инфекции микроорганизмы, препятствуют их распространению и адсорбции к клеткам слизистых оболочек; 2 - выполняют роль опсонинов – связывают микроорганизмы и улучшают их поглощение фагоцитами; 3 - нейтрализуют токсины микробов; 4 - препятствуют всасыванию пищевых антигенов и развитию пищевой аллергии. Количество нормальных антител остается постоянным у каждого человека и незначительно изменяется с возрастом.
 Система интерферонов (ИФН=IFN) Было отмечено, что если в организм человека или животных ввести два вируса, то они взаимно угнетают размножение друга – это явление было названо интерференцией. Интерфероны были открыты в 1957 г. Айзексом Л. (А. Исааксом) и Дж. Линдеманом. Они обнаружили, что это явление связано со способностью зараженных клеток к синтезу особого белка – интерферона. Исследования показали, что в организме человека существует система интерферонов.
Система интерферонов (ИФН=IFN) Было отмечено, что если в организм человека или животных ввести два вируса, то они взаимно угнетают размножение друга – это явление было названо интерференцией. Интерфероны были открыты в 1957 г. Айзексом Л. (А. Исааксом) и Дж. Линдеманом. Они обнаружили, что это явление связано со способностью зараженных клеток к синтезу особого белка – интерферона. Исследования показали, что в организме человека существует система интерферонов.
 Система интерферонов (ИФН=IFN) Включает 9 видов интерферонов, обозначаемых греческими буквами. объединяют в 3 типа. Их Типы: I тип включает 5 видов ИФН: ИФНα, ИФНβ, ИФНδ, ИФНε, ИФНκ; ИФНα имеет 13 разновидностей, обозначаемые цифрами (1, 2, 4 -8, 10, 13, 14, 16, 17, 21); II тип включает ИФНγ, ранее назвали «иммунный интерферон» ; III тип ИФНλ (3 его представителя ИФНλ 1, ИФНλ 2, ИФНλ 3.
Система интерферонов (ИФН=IFN) Включает 9 видов интерферонов, обозначаемых греческими буквами. объединяют в 3 типа. Их Типы: I тип включает 5 видов ИФН: ИФНα, ИФНβ, ИФНδ, ИФНε, ИФНκ; ИФНα имеет 13 разновидностей, обозначаемые цифрами (1, 2, 4 -8, 10, 13, 14, 16, 17, 21); II тип включает ИФНγ, ранее назвали «иммунный интерферон» ; III тип ИФНλ (3 его представителя ИФНλ 1, ИФНλ 2, ИФНλ 3.
 По своей химической природе – это гликопротеиды. Внутри каждого типа IFN подтипы различаются по биологическим свойствам, структуре, кислоточувствительности (выделяют кислотостабильные – α, β и кислотолабильные IFN). Образование интерферона: в норме его синтез в клетках заблокирован репрессором. При контакте клетки с индуктором интерферона (интерфероногены), репрессор связывается, что приводит к активации генов синтеза ИФН. Оперон для ИФН имеет до 12 структурных генов, которые расположены у человека на 12 и 9 -й хромосомах. После транскрипции и трансляции начинается синтез ИФН.
По своей химической природе – это гликопротеиды. Внутри каждого типа IFN подтипы различаются по биологическим свойствам, структуре, кислоточувствительности (выделяют кислотостабильные – α, β и кислотолабильные IFN). Образование интерферона: в норме его синтез в клетках заблокирован репрессором. При контакте клетки с индуктором интерферона (интерфероногены), репрессор связывается, что приводит к активации генов синтеза ИФН. Оперон для ИФН имеет до 12 структурных генов, которые расположены у человека на 12 и 9 -й хромосомах. После транскрипции и трансляции начинается синтез ИФН.
 Каждый вид и разновидность интерферонов кодируются отдельным геном. Гены интерферонов относят к индуцибильным: для секреции интерферонов необходима активация клеток-продуцентов. Гены интерферонов I и III типов находятся в 9 хромосоме, II типа – в 12 хромосоме. Мол. вес 19 -26 к. Да.
Каждый вид и разновидность интерферонов кодируются отдельным геном. Гены интерферонов относят к индуцибильным: для секреции интерферонов необходима активация клеток-продуцентов. Гены интерферонов I и III типов находятся в 9 хромосоме, II типа – в 12 хромосоме. Мол. вес 19 -26 к. Да.
 Для интеферонов характерно следующее: 1 - универсальность действия, т. е. активность в отношении различных вирусов; 2 - видовая специфичность – для лечения человека можно использовать только ИФН человеческого происхождения; 3 - наличие эффекта последействия; клетки сохраняют способность подавлять размножение вирусов даже после удаления интерферона: воздействие на рецепторы клеток - активация внеклеточных процессов; 4 - отсутствие токсического эффекта; 5 - высокая эффективность действия – действуют в малых дозах (достаточно для противовирусного действия несколько десятков молекул).
Для интеферонов характерно следующее: 1 - универсальность действия, т. е. активность в отношении различных вирусов; 2 - видовая специфичность – для лечения человека можно использовать только ИФН человеческого происхождения; 3 - наличие эффекта последействия; клетки сохраняют способность подавлять размножение вирусов даже после удаления интерферона: воздействие на рецепторы клеток - активация внеклеточных процессов; 4 - отсутствие токсического эффекта; 5 - высокая эффективность действия – действуют в малых дозах (достаточно для противовирусного действия несколько десятков молекул).
 Интерфероны I типа Основные клетки-продуценты ИФН I: 1 - плазмоцитоидные дендритные клетки или естественные интерферонпродуцирующие клетки 2 - моноциты / макрофаги 3 - эпителиальные клетки продуценты 4 - фибробласты ИФНβ, ИФНα 5 - все вирусинфицированные ядросодержащие клетки.
Интерфероны I типа Основные клетки-продуценты ИФН I: 1 - плазмоцитоидные дендритные клетки или естественные интерферонпродуцирующие клетки 2 - моноциты / макрофаги 3 - эпителиальные клетки продуценты 4 - фибробласты ИФНβ, ИФНα 5 - все вирусинфицированные ядросодержащие клетки.
 Основные индукторы интерферонов I типа: 1 - двуспиральная и односпиральная РНК вирусов, действующие соответственно через TLR-3 и TLR-7/ TLR-8; 2 - бактериальная ДНК – через TLR-9; 3 - бактериальные молекулы – ЛПС, рецептором для них служат TLR-4 (СD 14); 4 - синтетические индукторы. Действуют через сигнальные Му. D 88 - и TRIPзависимые пути, активируется NFk. B-фактор, приводящий к синтезу ИФН. Пик выработки интерферонов I типа наблюдается через 6 -12 час.
Основные индукторы интерферонов I типа: 1 - двуспиральная и односпиральная РНК вирусов, действующие соответственно через TLR-3 и TLR-7/ TLR-8; 2 - бактериальная ДНК – через TLR-9; 3 - бактериальные молекулы – ЛПС, рецептором для них служат TLR-4 (СD 14); 4 - синтетические индукторы. Действуют через сигнальные Му. D 88 - и TRIPзависимые пути, активируется NFk. B-фактор, приводящий к синтезу ИФН. Пик выработки интерферонов I типа наблюдается через 6 -12 час.
 Интерфероны III типа Клетки-продуценты: 1 - плазмацитоидные дендритные клетки, 2 - моноциты / макрофаги 3 - активированные эпителиальные клетки слизистых оболочек Индукторы – ИФНα и ИФНβ.
Интерфероны III типа Клетки-продуценты: 1 - плазмацитоидные дендритные клетки, 2 - моноциты / макрофаги 3 - активированные эпителиальные клетки слизистых оболочек Индукторы – ИФНα и ИФНβ.
 Рецепторы на поверхности клеток: для ИФН I типа – IFNAR состоят из двух молекул β 1 и β 2. Молекула ИФН I типа связывается одновременно с 2 молекулами, встраиваясь между ними. для ИФН III типа – представлены 2 молекулами IFNAR 1 и IL 1 OR 2 (общая с ИЛ 10)
Рецепторы на поверхности клеток: для ИФН I типа – IFNAR состоят из двух молекул β 1 и β 2. Молекула ИФН I типа связывается одновременно с 2 молекулами, встраиваясь между ними. для ИФН III типа – представлены 2 молекулами IFNAR 1 и IL 1 OR 2 (общая с ИЛ 10)
 Клетки-мишени, содержащие рецепторы для интерферонов I и III типов: 1 - макрофаги, 2 - нейтрофилы, 3 - дендритные клетки 4 - эозинофилы (ИФНα) 5 - Т- и В- лимфоциты, 6 - NK-клетки, 7 - фибробласты 8 - инфицированные вирусом клетки (ИФНα)
Клетки-мишени, содержащие рецепторы для интерферонов I и III типов: 1 - макрофаги, 2 - нейтрофилы, 3 - дендритные клетки 4 - эозинофилы (ИФНα) 5 - Т- и В- лимфоциты, 6 - NK-клетки, 7 - фибробласты 8 - инфицированные вирусом клетки (ИФНα)
 Биологические эффекты интерферонов I типа: 1. Противовирусное действие (ИФНα, ИФНβ) Механизмы: 1 - ИФН активируют гены протеинкиназы, что приводит к увеличению продукции протеинкиназы, которая вызывает фосфорилирование одного из факторов инициации трансляции, блокирует транскрипцию РНК и инициацию трансляции вирусных белков на рибосомах клетки– «хозяина» - блокада синтеза вирусных белков в инфицированной клетке.
Биологические эффекты интерферонов I типа: 1. Противовирусное действие (ИФНα, ИФНβ) Механизмы: 1 - ИФН активируют гены протеинкиназы, что приводит к увеличению продукции протеинкиназы, которая вызывает фосфорилирование одного из факторов инициации трансляции, блокирует транскрипцию РНК и инициацию трансляции вирусных белков на рибосомах клетки– «хозяина» - блокада синтеза вирусных белков в инфицированной клетке.
 2 - под влиянием ИФН в клетках экспрессируются гены синтеза олигоаденилатсинтетазы, приводящей к образованию 2/ 5/ - олигоадениловой кислоты. Она активирует клеточную эндонуклеазу, которая разрушает молекулы вирусной РНК, в т. ч. и м. РНК. 3 - индукция белков Мх, обладающих активностью ГТФазы. Они собираются в олигомерные комплексы, ингибируют траснкрипцию вирусных белков и другие этапы жизненного цикла вирусов. Повышают резистентность к инфицированию вирусом.
2 - под влиянием ИФН в клетках экспрессируются гены синтеза олигоаденилатсинтетазы, приводящей к образованию 2/ 5/ - олигоадениловой кислоты. Она активирует клеточную эндонуклеазу, которая разрушает молекулы вирусной РНК, в т. ч. и м. РНК. 3 - индукция белков Мх, обладающих активностью ГТФазы. Они собираются в олигомерные комплексы, ингибируют траснкрипцию вирусных белков и другие этапы жизненного цикла вирусов. Повышают резистентность к инфицированию вирусом.
 2. Усиление защиты от внутриклеточных патогенов(антибактериальное действие). Механизмы: 1 - активация метаболической, фагоцитарной и бактериальной активности макрофагов; 2 - стимуляция дифференцировки и повышение активности дендритных клеток и экспрессии ими костимулирующих молекул; 3 усиление выработки провоспалительных цитокинов, ИЛ-12, ИФНγ; 4 - усиление дифференцировки Т-хелперов в сторону образования Th. I-клеток; 5 - стимуляция клеточного иммунитета.
2. Усиление защиты от внутриклеточных патогенов(антибактериальное действие). Механизмы: 1 - активация метаболической, фагоцитарной и бактериальной активности макрофагов; 2 - стимуляция дифференцировки и повышение активности дендритных клеток и экспрессии ими костимулирующих молекул; 3 усиление выработки провоспалительных цитокинов, ИЛ-12, ИФНγ; 4 - усиление дифференцировки Т-хелперов в сторону образования Th. I-клеток; 5 - стимуляция клеточного иммунитета.
 3. Иммуномодулирующее действие: 1 - повышают активность естественных клетоккиллеров; 2 - усиливают Th. I-зависимый клеточный иммунитет, активируют цитотоксические Т-лимфоциты; 3 - стимулируют фагоцитоз; 4 - влияют на антителообразование (часто угнетают) и т. д; 5 - влияют на синтез цитокинов; 6 - усиливают экспрессию МНС I.
3. Иммуномодулирующее действие: 1 - повышают активность естественных клетоккиллеров; 2 - усиливают Th. I-зависимый клеточный иммунитет, активируют цитотоксические Т-лимфоциты; 3 - стимулируют фагоцитоз; 4 - влияют на антителообразование (часто угнетают) и т. д; 5 - влияют на синтез цитокинов; 6 - усиливают экспрессию МНС I.
 4. Противоопухолевый эффект: за счет влияния на систему регуляции синтеза НК и белка клетки-хозяина. Механизмы: 1 - активация фермента протеинкиназы (нарушение белкового обмена, подавление пролиферации опухолевых клеток); 2 - активация естественных киллеров; 3 - усиление экспрессии МНС I и презентация опухолевого антигена Т-лимфоцитам (усиление клеточного иммунитета); 4 - индукция дифференцировки клеток за счет активации аденилатциклазы и накопления ц АМФ; 5 - антиангиогенное действие.
4. Противоопухолевый эффект: за счет влияния на систему регуляции синтеза НК и белка клетки-хозяина. Механизмы: 1 - активация фермента протеинкиназы (нарушение белкового обмена, подавление пролиферации опухолевых клеток); 2 - активация естественных киллеров; 3 - усиление экспрессии МНС I и презентация опухолевого антигена Т-лимфоцитам (усиление клеточного иммунитета); 4 - индукция дифференцировки клеток за счет активации аденилатциклазы и накопления ц АМФ; 5 - антиангиогенное действие.
 5. Радиопротективное действие за счет воздействия на клеточный обмен – регуляция метаболических процессов.
5. Радиопротективное действие за счет воздействия на клеточный обмен – регуляция метаболических процессов.
 Интерфероны II типа = ИФНγ Обладает слабой противовирусной активностью, но имеет сильное иммунорегуляторное действие. Ген синтеза ИФНγ расположен в 12 -й хромосоме. Мол. масса 18 -25 к. Da. Основные клетки-продуценты: I – при отсутствии иммунного ответа: 1 - нормальные NK-лимфоциты, 2 - NKТ-клетки, 3 - макрофаги и дендритные клетки; II – при иммунном ответе: 1 - цитотоксические CD 8+ Т-лимфоциты, 2 - чаще Тh. I-лимфоциты. Синтез ИФНγ достигает максимума через 48 -72 час. после стимуляции клеток.
Интерфероны II типа = ИФНγ Обладает слабой противовирусной активностью, но имеет сильное иммунорегуляторное действие. Ген синтеза ИФНγ расположен в 12 -й хромосоме. Мол. масса 18 -25 к. Da. Основные клетки-продуценты: I – при отсутствии иммунного ответа: 1 - нормальные NK-лимфоциты, 2 - NKТ-клетки, 3 - макрофаги и дендритные клетки; II – при иммунном ответе: 1 - цитотоксические CD 8+ Т-лимфоциты, 2 - чаще Тh. I-лимфоциты. Синтез ИФНγ достигает максимума через 48 -72 час. после стимуляции клеток.
 Основные индукторы ИФНγ: 1 - антигены 2 - ИЛ-12 и ИЛ-18 3 - ИЛ-23 и ИЛ-27 Рецепторы для ИФНγ: 1 - IFNGR 1 = 2α-цепи (G-джи=γ-гамма) 2 - IFNGR 2 = 2β-цепи С ними взаимодействует ИФНγ, что приводит к активации внутриклеточных процессов.
Основные индукторы ИФНγ: 1 - антигены 2 - ИЛ-12 и ИЛ-18 3 - ИЛ-23 и ИЛ-27 Рецепторы для ИФНγ: 1 - IFNGR 1 = 2α-цепи (G-джи=γ-гамма) 2 - IFNGR 2 = 2β-цепи С ними взаимодействует ИФНγ, что приводит к активации внутриклеточных процессов.
 Клетки-мишени, имеющие рецепторы к ИФНγ: 1 - моноциты-макрофаги: усиливают экспрессию МНС II, активируют ферменты, отвечающие за формирование активных форм кислорода и за образование индуцибельной NО. Они необходимы для внутриклеточного киллинга микроорганизмов, в т. ч. микобактерий туберкулеза; 2 - дендритные клетки: усиление экспресии МНС II, активация; 3 - NK-лимфоциты: усиление цитотоксической активности; 4 - В-лимфоциты: участие в дифференцировке, усиление выработки Ig. G 2α-антител, снижения Ig. Е и Ig. G 1 антител; 5 - CD 8+-лимфоциты: участие в дифференцировке клеток и формировании клеточного адаптивного иммунитета; 6 - Тh 2 -лимфоциты: ослабление дифференцировки и секреции ИЛ-4 и ИЛ-5
Клетки-мишени, имеющие рецепторы к ИФНγ: 1 - моноциты-макрофаги: усиливают экспрессию МНС II, активируют ферменты, отвечающие за формирование активных форм кислорода и за образование индуцибельной NО. Они необходимы для внутриклеточного киллинга микроорганизмов, в т. ч. микобактерий туберкулеза; 2 - дендритные клетки: усиление экспресии МНС II, активация; 3 - NK-лимфоциты: усиление цитотоксической активности; 4 - В-лимфоциты: участие в дифференцировке, усиление выработки Ig. G 2α-антител, снижения Ig. Е и Ig. G 1 антител; 5 - CD 8+-лимфоциты: участие в дифференцировке клеток и формировании клеточного адаптивного иммунитета; 6 - Тh 2 -лимфоциты: ослабление дифференцировки и секреции ИЛ-4 и ИЛ-5
 Пропердин или фактор Р (от латинского слова pro perdere – подготавливать разрушение) Свойства: 1. Фактор Р – это γ-глобулин с молекулярным весом 190. 000 -220. 000 Д, термолабильное вещество. 2. Способен вступать во взаимодействие с высокомолекулярными полисахаридами (полисахариды - ПС и ЛПС клеточной стенки микробов, муцин и др. ) 3. Фактор Р в комплексе с ионами Mg 2+ и ПС активирует СЗ-компонент комплемента – образуется фермент СЗ - конвертаза – активация системы комплемента по альтернативному пути.
Пропердин или фактор Р (от латинского слова pro perdere – подготавливать разрушение) Свойства: 1. Фактор Р – это γ-глобулин с молекулярным весом 190. 000 -220. 000 Д, термолабильное вещество. 2. Способен вступать во взаимодействие с высокомолекулярными полисахаридами (полисахариды - ПС и ЛПС клеточной стенки микробов, муцин и др. ) 3. Фактор Р в комплексе с ионами Mg 2+ и ПС активирует СЗ-компонент комплемента – образуется фермент СЗ - конвертаза – активация системы комплемента по альтернативному пути.
 Пропердин Разрушает микробы, особенно грамотрицательные, в клеточной стенке которых содержится ЛПС Инактивирует вирусы Вызывает лизис аномальных и поврежденных клеток организма человека
Пропердин Разрушает микробы, особенно грамотрицательные, в клеточной стенке которых содержится ЛПС Инактивирует вирусы Вызывает лизис аномальных и поврежденных клеток организма человека
 Система комплемента
Система комплемента
 Система комплемента – сложная эффекторная система белков крови, играет важную роль в регуляции иммунного ответа и поддержании гомеостаза. Функции: 1 -распознование 2 -лизис 3 -элиминация генетически чужеродного материала из организма
Система комплемента – сложная эффекторная система белков крови, играет важную роль в регуляции иммунного ответа и поддержании гомеостаза. Функции: 1 -распознование 2 -лизис 3 -элиминация генетически чужеродного материала из организма
 В систему комплемента входят более 25 белков: 11 белков образуют основную эффекторную структуру, состоящую из 9 компонентов комплемента, Белки-регуляторы: активаторы и ингибиторы, Факторы, запускающие пути активации, Общие факторы (белки литического комплекса)
В систему комплемента входят более 25 белков: 11 белков образуют основную эффекторную структуру, состоящую из 9 компонентов комплемента, Белки-регуляторы: активаторы и ингибиторы, Факторы, запускающие пути активации, Общие факторы (белки литического комплекса)

 Компоненты комплемента обозначаются буквой С (“complementen”- дополнение) и цифрой: С 1, С 2, С 3……С 9 С 1 – компонент состоит из 3 белков – q, r, s. При активации компоненты С 2, С 3, С 4, С 5 распадаются на 2 фрагмента – а и b (С 2 а и С 2 b, С 3 а и С 3 b, С 4 а и С 4 b, С 5 а и С 5 в)
Компоненты комплемента обозначаются буквой С (“complementen”- дополнение) и цифрой: С 1, С 2, С 3……С 9 С 1 – компонент состоит из 3 белков – q, r, s. При активации компоненты С 2, С 3, С 4, С 5 распадаются на 2 фрагмента – а и b (С 2 а и С 2 b, С 3 а и С 3 b, С 4 а и С 4 b, С 5 а и С 5 в)
 Пусковые молекулы – С 1 q и МСБ Принадлежат к семейству коллектинов, в собранном виде имеют вид «букета тюльпанов» : N-концевые домены имеют коллагеноподобную структуру, переплетаются и образуют «ствол букета» С-концевые части образуют расходящиеся «ветви букета» . Бутонообразные окончания этих ветвей участвуют во взаимодействии с молекулами иммуноглобулинов - антител и лектинами
Пусковые молекулы – С 1 q и МСБ Принадлежат к семейству коллектинов, в собранном виде имеют вид «букета тюльпанов» : N-концевые домены имеют коллагеноподобную структуру, переплетаются и образуют «ствол букета» С-концевые части образуют расходящиеся «ветви букета» . Бутонообразные окончания этих ветвей участвуют во взаимодействии с молекулами иммуноглобулинов - антител и лектинами
 Продуценты компонентов комплемента: 1 - моноциты и макрофаги: КОСТНОГО МОЗГА, ПЕЧЕНИ, легких, лимфоидных образований кишечника, 2 - гепатоциты, 3 - клетки почечного эпителия, 4 – эндотелиальные клетки. 5 – нейтрофилы и жировая ткань Свойства: 1 - термолабильные вещества, разрушаются при температуре 560 С в течении 30 мин. , 2 - инактивируются при встряхивании крови, при хранении более 3 дней, при действии солнечного света, УФ-лучей, химических веществ, 3 - не проходят через плаценту
Продуценты компонентов комплемента: 1 - моноциты и макрофаги: КОСТНОГО МОЗГА, ПЕЧЕНИ, легких, лимфоидных образований кишечника, 2 - гепатоциты, 3 - клетки почечного эпителия, 4 – эндотелиальные клетки. 5 – нейтрофилы и жировая ткань Свойства: 1 - термолабильные вещества, разрушаются при температуре 560 С в течении 30 мин. , 2 - инактивируются при встряхивании крови, при хранении более 3 дней, при действии солнечного света, УФ-лучей, химических веществ, 3 - не проходят через плаценту
 Каждый компонент комплемента обладает 3 эффектами действия: 1 – активируется и присоединяется к предыдущему компоненту комплемента, 2 – активирует последующий компонент, 3 – обладает собственной биологической активностью.
Каждый компонент комплемента обладает 3 эффектами действия: 1 – активируется и присоединяется к предыдущему компоненту комплемента, 2 – активирует последующий компонент, 3 – обладает собственной биологической активностью.
 Система комплемента действует по принципу «каскада» , когда последовательно вовлекаются в активацию составляющие компоненты. Активация системы комплемента осуществляется в 2 основных этапа: 1 - активация с образованием С 3/С 5 конвертаз, 2 - лизис клеток-мишеней. Пути активации различны, а фаза лизиса одинакова для всех путей.
Система комплемента действует по принципу «каскада» , когда последовательно вовлекаются в активацию составляющие компоненты. Активация системы комплемента осуществляется в 2 основных этапа: 1 - активация с образованием С 3/С 5 конвертаз, 2 - лизис клеток-мишеней. Пути активации различны, а фаза лизиса одинакова для всех путей.
 Механизмы активации системы комплемента: 1 -классический, 2 -альтернативный, 3 -лектиновый или механизм С 1 -шунта
Механизмы активации системы комплемента: 1 -классический, 2 -альтернативный, 3 -лектиновый или механизм С 1 -шунта
 Классический путь активации системы комплемента (иммунный механизм разрушения чужеродных клеток) Активаторы: 1 - иммунные комплексы (чужеродная клетка – АГ, на которой адсорбированы специфические антитела –АТ): АГ+АТ 2 - агрегированные Ig 3 - С-реактивный белок как пентамер связывается с фосфорилхолином (ФХ) оболочек микроорганизмов, образуется комплекс СРБ+ФХ, который активирует систему комплемента по классическому пути.
Классический путь активации системы комплемента (иммунный механизм разрушения чужеродных клеток) Активаторы: 1 - иммунные комплексы (чужеродная клетка – АГ, на которой адсорбированы специфические антитела –АТ): АГ+АТ 2 - агрегированные Ig 3 - С-реактивный белок как пентамер связывается с фосфорилхолином (ФХ) оболочек микроорганизмов, образуется комплекс СРБ+ФХ, который активирует систему комплемента по классическому пути.

 Расщепление С 5 запускает терминальный этап активации комплемента – формирование литического комплекса. С 5 в как на мембране, так и в растворе, обладает способностью связывать компонент С 6 с образованием комплекса С 5 b. С 6 в этом комплексе связывает С 7. Формирующийся комплекс С 5 b. С 6 С 7 связывает С 8. Скорость их связывания высокая, так как все компоненты присутствуют в сыворотке крови в достаточно высокой концентрации. Cвязывание каждого нового компонента повышает прочность комплекса.
Расщепление С 5 запускает терминальный этап активации комплемента – формирование литического комплекса. С 5 в как на мембране, так и в растворе, обладает способностью связывать компонент С 6 с образованием комплекса С 5 b. С 6 в этом комплексе связывает С 7. Формирующийся комплекс С 5 b. С 6 С 7 связывает С 8. Скорость их связывания высокая, так как все компоненты присутствуют в сыворотке крови в достаточно высокой концентрации. Cвязывание каждого нового компонента повышает прочность комплекса.
 Связь комплекса с поверхностью клеток (мембран) усиливается благодаря наличию у С 7 и С 8 гидрофобных липофильных участков. С 8 ограничивает образование новых комплексов С 5 b. С 6 С 7 и их прикрепление к мембране. Гидрофобный участок у С 8 более протяженный, и комплекс С 5 b. С 6 С 7 С 8 насквозь «прошивает» мембрану с образованием пор. Их диаметр маленький – около 3 мкм и может вызывать лизис только эритроцитов и нейссерий.
Связь комплекса с поверхностью клеток (мембран) усиливается благодаря наличию у С 7 и С 8 гидрофобных липофильных участков. С 8 ограничивает образование новых комплексов С 5 b. С 6 С 7 и их прикрепление к мембране. Гидрофобный участок у С 8 более протяженный, и комплекс С 5 b. С 6 С 7 С 8 насквозь «прошивает» мембрану с образованием пор. Их диаметр маленький – около 3 мкм и может вызывать лизис только эритроцитов и нейссерий.
 Завершающий этап состоит в присоединении к комплексу С 5 b. С 6 С 7 С 8 12 -20 молекул С 9, повышающих их литическую активность в 1000 раз. С 9 способен к полимеризации. Он встраивается в мембрану, полимеризуется в ней с образованием пронизывающего мембрану цилиндра-поры. Внутрь цилиндра-поры обращены гидрофильные участки молекул, а гидрофобные – в сторону мембраны. Диаметр поры – 8 -12 нм, высота – 15 нм. Такие поры обеспечивают поступления в клетку протонов, Н 2 О, ионов Na+, что может привести к разрыву мембраны и гибели клетки по механизму некроза.
Завершающий этап состоит в присоединении к комплексу С 5 b. С 6 С 7 С 8 12 -20 молекул С 9, повышающих их литическую активность в 1000 раз. С 9 способен к полимеризации. Он встраивается в мембрану, полимеризуется в ней с образованием пронизывающего мембрану цилиндра-поры. Внутрь цилиндра-поры обращены гидрофильные участки молекул, а гидрофобные – в сторону мембраны. Диаметр поры – 8 -12 нм, высота – 15 нм. Такие поры обеспечивают поступления в клетку протонов, Н 2 О, ионов Na+, что может привести к разрыву мембраны и гибели клетки по механизму некроза.
 При соединении терминальных компонентов С 6, С 7, С 8 и С 9 в присутствии ионов Са 2+ и Мg 2+ на клеточной оболочке образуется кольцеобразный мембранатакующий комплекс (МАК). МАК : обладает липофильными свойствами, глубоко проникает в клеточную оболочку и ЦПМ, полимеризуется, образует трансмембранный белковый канал. Внутрь клетки поступают вода и ионы Na+ и за счет сил осмоса чужеродные клетки лизируются.
При соединении терминальных компонентов С 6, С 7, С 8 и С 9 в присутствии ионов Са 2+ и Мg 2+ на клеточной оболочке образуется кольцеобразный мембранатакующий комплекс (МАК). МАК : обладает липофильными свойствами, глубоко проникает в клеточную оболочку и ЦПМ, полимеризуется, образует трансмембранный белковый канал. Внутрь клетки поступают вода и ионы Na+ и за счет сил осмоса чужеродные клетки лизируются.
 Альтернативный механизм активации системы комплемента: неимунный механизм разрушения чужеродных клеток без участия С 1, С 4 и С 2 компонентов комплемента активация начинается с СЗ-компонента. Активация С 3 и фактора В происходит спонтанно и непрерывно на поверхности бактериальных клеток.
Альтернативный механизм активации системы комплемента: неимунный механизм разрушения чужеродных клеток без участия С 1, С 4 и С 2 компонентов комплемента активация начинается с СЗ-компонента. Активация С 3 и фактора В происходит спонтанно и непрерывно на поверхности бактериальных клеток.
 Активаторы: 1 - ЛПС клеточной стенки грамотрицательных микробов 2 - мембраны измененных клеток (вирусинфицированные клетки, опухолевые клетки) 3 - оболочка грибов 4 - другие факторы Принимают участие Р-пропердин (стабилизирует образующийся комплекс С 3 b. Bb и предотвращает расщепление его фактором Н), факторы В и D, регулирующие белки Н и I (сывороточные протеазы, расщепляющие С 3 b на поверхности клеток организма человека – нет повреждения собственных клеток)
Активаторы: 1 - ЛПС клеточной стенки грамотрицательных микробов 2 - мембраны измененных клеток (вирусинфицированные клетки, опухолевые клетки) 3 - оболочка грибов 4 - другие факторы Принимают участие Р-пропердин (стабилизирует образующийся комплекс С 3 b. Bb и предотвращает расщепление его фактором Н), факторы В и D, регулирующие белки Н и I (сывороточные протеазы, расщепляющие С 3 b на поверхности клеток организма человека – нет повреждения собственных клеток)

 Лектиновый механизм активации системы комплемента (механизм С 1 -шунта): происходит без участия С 1 компонента комплемента начинается с С 4 -компонента комплемента играет роль маннано- (или маннозо-) связывающий лектин – МСЛ.
Лектиновый механизм активации системы комплемента (механизм С 1 -шунта): происходит без участия С 1 компонента комплемента начинается с С 4 -компонента комплемента играет роль маннано- (или маннозо-) связывающий лектин – МСЛ.
 МСЛ: 1 - синтезируется в печени при воспалительном процессе, является белком 2 - по строению похож на С 1 q-компонент комплемента 3 - обладает способностью соединяться с углеводами (маннозой, маннаном, N-ацетилглюкозамином) поверхностных структур различных микроорганизмов (сальмонеллы, микобактерии, грибы и др. ) 4 - образует комплекс на поверхности клетки : МСЛ + поверхность клетки, который активирует сывороточные протеазы, действующие на С 4 и С 2 -компоненты комплемента. Происходит каскад реакций как при классическом механизме с образованием мембранатакующего комплекса.
МСЛ: 1 - синтезируется в печени при воспалительном процессе, является белком 2 - по строению похож на С 1 q-компонент комплемента 3 - обладает способностью соединяться с углеводами (маннозой, маннаном, N-ацетилглюкозамином) поверхностных структур различных микроорганизмов (сальмонеллы, микобактерии, грибы и др. ) 4 - образует комплекс на поверхности клетки : МСЛ + поверхность клетки, который активирует сывороточные протеазы, действующие на С 4 и С 2 -компоненты комплемента. Происходит каскад реакций как при классическом механизме с образованием мембранатакующего комплекса.

 Система комплемента выполняет следующие функции: 1 -лизис чужеродных клеток. 2 -опсонизация чужеродных клеток, в т. ч. бактерий, которые становятся более доступными для макрофагов благодаря «феномену иммунного прилипания» (он обусловлен фиксацией на клетках С 3 b, в меньшей степени – С 4 b, С 5 b, С 2 -компонентов и фрагментов С).
Система комплемента выполняет следующие функции: 1 -лизис чужеродных клеток. 2 -опсонизация чужеродных клеток, в т. ч. бактерий, которые становятся более доступными для макрофагов благодаря «феномену иммунного прилипания» (он обусловлен фиксацией на клетках С 3 b, в меньшей степени – С 4 b, С 5 b, С 2 -компонентов и фрагментов С).
 3 -стимуляция хемотаксиса (за счет С 5 а, С 3 b, комплекса С 5 b 67). 4 -стимуляция фагоцитоза – обусловлена присоединением к иммунному комплексу С 1 q или С 3 b. 5 -повышение сосудистой проницаемости – С 5 а, С 3 а, С 1. 6 -стимуляция анафилотоксинами (С 5 а, С 3 а) внутриклеточных процессов, в результате которых из тучных клеток выбрасываются биологически активные соединения (гистамин, брадикинин, лейкотриены, серотонин и др. ), которые обусловливают развитие воспаления.
3 -стимуляция хемотаксиса (за счет С 5 а, С 3 b, комплекса С 5 b 67). 4 -стимуляция фагоцитоза – обусловлена присоединением к иммунному комплексу С 1 q или С 3 b. 5 -повышение сосудистой проницаемости – С 5 а, С 3 а, С 1. 6 -стимуляция анафилотоксинами (С 5 а, С 3 а) внутриклеточных процессов, в результате которых из тучных клеток выбрасываются биологически активные соединения (гистамин, брадикинин, лейкотриены, серотонин и др. ), которые обусловливают развитие воспаления.
 Белки острой фазы - появляются в крови при тяжелых воспалительных процессах. Они синтезируются в печени по сигналу, подаваемому цитокинами - ТNF-α, ИЛ-1, ИЛ-6. Они появляются в крови уже в течение первых 2 дней острого воспалительного процесса. К ним относятся: 1. С-реактивный протеин (СРП) относится к пентраксинам – это белки, состоящие из пяти одинаковых субъединиц. СРП имеет химическое сродство к фосфохолину. Последний входит в состав клеточных стенок ряда бактерий и одноклеточных грибов.
Белки острой фазы - появляются в крови при тяжелых воспалительных процессах. Они синтезируются в печени по сигналу, подаваемому цитокинами - ТNF-α, ИЛ-1, ИЛ-6. Они появляются в крови уже в течение первых 2 дней острого воспалительного процесса. К ним относятся: 1. С-реактивный протеин (СРП) относится к пентраксинам – это белки, состоящие из пяти одинаковых субъединиц. СРП имеет химическое сродство к фосфохолину. Последний входит в состав клеточных стенок ряда бактерий и одноклеточных грибов.
 СРП связывается с соответсвующими микробными клетками и осуществляет 2 эффекта действия: 1) опсонизирует бактерии для фагоцитов; 2) активирует систему комплемента, т. к. связывает С 1 q – первый инициирующий компонент классического пути (СРП связывает С 1 q за коллагенподобную часть) → идет активация с последующим лизисом микробной клеток.
СРП связывается с соответсвующими микробными клетками и осуществляет 2 эффекта действия: 1) опсонизирует бактерии для фагоцитов; 2) активирует систему комплемента, т. к. связывает С 1 q – первый инициирующий компонент классического пути (СРП связывает С 1 q за коллагенподобную часть) → идет активация с последующим лизисом микробной клеток.
 2. Маннансвязывающий или маннозосвязывающий лектин (МСЛ) – кальцийзависимый сахарсвязывающий протеин (лектины – это белки, способные с высокой активностью связывать углеводы). МСЛ относится к семейству коллектинов. МСЛ связывает остатки маннозы, которые находятся на поверхности многих микробных клеток (сальмонеллы, микобактерии и др. ). МСЛ опсонизирует микробные клетки для фагоцитоза моноцитами.
2. Маннансвязывающий или маннозосвязывающий лектин (МСЛ) – кальцийзависимый сахарсвязывающий протеин (лектины – это белки, способные с высокой активностью связывать углеводы). МСЛ относится к семейству коллектинов. МСЛ связывает остатки маннозы, которые находятся на поверхности многих микробных клеток (сальмонеллы, микобактерии и др. ). МСЛ опсонизирует микробные клетки для фагоцитоза моноцитами.
 Клеточные факторы врожденного иммунитета Фагоцитоз – это процесс активного поглощения клетками организма различных чужеродных структур (размером более 0, 5 мкм) с последующим их разрушением с помощью внутриклеточных литических систем. «Профессиональные» фагоциты: I гр. – микрофаги: полиморфноядерные лейкоциты – нейтрофилы, эозинофилы, базофилы; II гр. – макрофаги: моноциты крови, тканевые макрофаги. По подвижности выделяют: 1 -свободные, подвижные фагоциты 2 -фиксированные (тканевые макрофаги).
Клеточные факторы врожденного иммунитета Фагоцитоз – это процесс активного поглощения клетками организма различных чужеродных структур (размером более 0, 5 мкм) с последующим их разрушением с помощью внутриклеточных литических систем. «Профессиональные» фагоциты: I гр. – микрофаги: полиморфноядерные лейкоциты – нейтрофилы, эозинофилы, базофилы; II гр. – макрофаги: моноциты крови, тканевые макрофаги. По подвижности выделяют: 1 -свободные, подвижные фагоциты 2 -фиксированные (тканевые макрофаги).
 Стадии фагоцитоза: I стадия – хемотаксис – направленное движение фагоцита к объекту фагоцитоза. На данный процесс влияют хемотаксические вещества – хемоатрактанты: компоненты комплемента, хемокины и др. Происходит ослабление сцепления между молекулами ЦПМ фагоцита – образуются псевдоподии – наблюдается движение фагоцита к объекту фагоцитоза.
Стадии фагоцитоза: I стадия – хемотаксис – направленное движение фагоцита к объекту фагоцитоза. На данный процесс влияют хемотаксические вещества – хемоатрактанты: компоненты комплемента, хемокины и др. Происходит ослабление сцепления между молекулами ЦПМ фагоцита – образуются псевдоподии – наблюдается движение фагоцита к объекту фагоцитоза.
 II стадия – адсорбция чужеродных клеток на поверхности фагоцита. Осуществляется в результате: 1 -электростатического взаимодействия ЦПМ фагоцита с гидрофобными частицами или положительно заряженной поверхностью чужеродной клетки; 2 -рецептор (лиганд) – рецепторного взаимодействия фагоцита с чужеродными клетками (микроорганизмы). Этот процесс происходит при участии опсонинов – веществ, облегчающих адсорбцию и поглощение чужеродных клеток: компоненты комплемента, антитела – Ig. G и Ig. M.
II стадия – адсорбция чужеродных клеток на поверхности фагоцита. Осуществляется в результате: 1 -электростатического взаимодействия ЦПМ фагоцита с гидрофобными частицами или положительно заряженной поверхностью чужеродной клетки; 2 -рецептор (лиганд) – рецепторного взаимодействия фагоцита с чужеродными клетками (микроорганизмы). Этот процесс происходит при участии опсонинов – веществ, облегчающих адсорбцию и поглощение чужеродных клеток: компоненты комплемента, антитела – Ig. G и Ig. M.
 Рецепторы на поверхности фагоцитов: 1 - рецепторы к С 3 в-компоненту комплемента – СR 3 в: за счет химического сродства связывают через С 3 в (опсонин) липополисахариды грамотрицательных микробов, липопротеиды простейших, поверхностные структуры грибов; 2 - рецепторы для связывания маннозы (лектина) на поверхности сальмонелл, микобактерий и др. клеток; 3 - рецепторы для Fc-фрагментов Ig. G – через Ig. G (опсонин) адсорбция различных чужеродных клеток; 4 - скавенджер – рецепторы для производных лигандов сиаловых кислот, находящихся на клетках (деградирующие и погибающие собственные клетки) – это рецепторы для «уборки мусора» (“scavenger receptor”).
Рецепторы на поверхности фагоцитов: 1 - рецепторы к С 3 в-компоненту комплемента – СR 3 в: за счет химического сродства связывают через С 3 в (опсонин) липополисахариды грамотрицательных микробов, липопротеиды простейших, поверхностные структуры грибов; 2 - рецепторы для связывания маннозы (лектина) на поверхности сальмонелл, микобактерий и др. клеток; 3 - рецепторы для Fc-фрагментов Ig. G – через Ig. G (опсонин) адсорбция различных чужеродных клеток; 4 - скавенджер – рецепторы для производных лигандов сиаловых кислот, находящихся на клетках (деградирующие и погибающие собственные клетки) – это рецепторы для «уборки мусора» (“scavenger receptor”).
 Чужеродные клетки за счет опсонинов и рецепторов взаимодействуют с мембраной фагоцита по принципу «замка молнии» . В фагоцитах активируются метаболические процессы.
Чужеродные клетки за счет опсонинов и рецепторов взаимодействуют с мембраной фагоцита по принципу «замка молнии» . В фагоцитах активируются метаболические процессы.
 III стадия – поглощение чужеродных клеток фагоцитом и образование фаголизосом ЦПМ обтекает чужеродную клетку – образуется фагосома – мембрана фагосомы сливается с мембраной лизосомы – образуется фаголизосма. У макрофагов поглотительная способность выражена в большой степени, чем у нейтрофилов.
III стадия – поглощение чужеродных клеток фагоцитом и образование фаголизосом ЦПМ обтекает чужеродную клетку – образуется фагосома – мембрана фагосомы сливается с мембраной лизосомы – образуется фаголизосма. У макрофагов поглотительная способность выражена в большой степени, чем у нейтрофилов.
 Клетки врожденного иммунитета натуральный киллер, NК эозинофил нейтрофил базофил Гранулярные лейкоциты Моноцит Тканевой макрофаг Дендритная клетка
Клетки врожденного иммунитета натуральный киллер, NК эозинофил нейтрофил базофил Гранулярные лейкоциты Моноцит Тканевой макрофаг Дендритная клетка
 Кроветворная стволовая клетка и кроветворение
Кроветворная стволовая клетка и кроветворение
 Миелоидные клетки как основа врожденного иммунитета CD 34 Гранулоцитарно-макрофагальная линия (GM-линия) ? Моноцитарная Гранулоцитарная (М-линия) (G-линия) Эозинофильная и базофильная линии
Миелоидные клетки как основа врожденного иммунитета CD 34 Гранулоцитарно-макрофагальная линия (GM-линия) ? Моноцитарная Гранулоцитарная (М-линия) (G-линия) Эозинофильная и базофильная линии
 Кроветворная стволовая клетка и кроветворение Моноцитарномакрофагальный колониестимулирующий фактор (M-CSF) 5 сут. Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) Гранулоцитаргный колониестимулирующий фактор (G-CSF) 2 сут. ? 10 2 -4 дня
Кроветворная стволовая клетка и кроветворение Моноцитарномакрофагальный колониестимулирующий фактор (M-CSF) 5 сут. Гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) Гранулоцитаргный колониестимулирующий фактор (G-CSF) 2 сут. ? 10 2 -4 дня
 1 стадия – развитие в костном мозге 2 стадия - циркуляция в крови кратковременная длительная Нейтрофилы, моноциты Дендритные Тучные Быстрая миграция в ткань Спонтанная миграция в ткани Макрофаги длительно функционируют в тканях Экстренная миграция в ткани Нейтрофил быстро погибает
1 стадия – развитие в костном мозге 2 стадия - циркуляция в крови кратковременная длительная Нейтрофилы, моноциты Дендритные Тучные Быстрая миграция в ткань Спонтанная миграция в ткани Макрофаги длительно функционируют в тканях Экстренная миграция в ткани Нейтрофил быстро погибает
 Клетки Развитие в костном мозге Циркуляция в крови Пребывание в тканях Моноциты 8 -9 суток 1 -2 сут 20 сут годы Нейтрофи 18 -20 сут лы 7 -10 часов 3 -5 суток Эозинофи лы 5 -10 часов 10 -12 сут 8 -10 сут
Клетки Развитие в костном мозге Циркуляция в крови Пребывание в тканях Моноциты 8 -9 суток 1 -2 сут 20 сут годы Нейтрофи 18 -20 сут лы 7 -10 часов 3 -5 суток Эозинофи лы 5 -10 часов 10 -12 сут 8 -10 сут
 Нейтрофилы ВОСПАЛЕНИЕ IL-23 IL-17 НОРМА в крови 2 – 7, 5 · 10 в 9 /л G-CSF В КРОВЬ
Нейтрофилы ВОСПАЛЕНИЕ IL-23 IL-17 НОРМА в крови 2 – 7, 5 · 10 в 9 /л G-CSF В КРОВЬ
 Миграция
Миграция
 Рецепторы нейтрофилов Толл-подобные TLR 1, 2, 4, 5. 6. 7, 8, 9, 10 Лектиновые + Fс-рецепторы К иммуноглобулинам G и А Цитокиновые к IL -17 и – 23 , G-CSF Хемокиновые IL-8 Интегрины Молекулы главного комплекса гистосовместимости MHC-I класса CD 14, 13 Рецептор для вирусов и ЛПС Костимулирующие -
Рецепторы нейтрофилов Толл-подобные TLR 1, 2, 4, 5. 6. 7, 8, 9, 10 Лектиновые + Fс-рецепторы К иммуноглобулинам G и А Цитокиновые к IL -17 и – 23 , G-CSF Хемокиновые IL-8 Интегрины Молекулы главного комплекса гистосовместимости MHC-I класса CD 14, 13 Рецептор для вирусов и ЛПС Костимулирующие -
 Гранулы нейтрофилов
Гранулы нейтрофилов
 Моноцит/макрофаг
Моноцит/макрофаг
 Рецепторы макрофагов Толл-подобные TLR 1, 2, 3, 4, 5. 6. 7, 8, 9, 10 Лектиновые + Fс-рецепторы К иммуноглобулинам G и А Цитокиновые к IL -1, 2, 3, 4, 6, 10, 15, 21 и – 23 , GМ-CSF, М-CSF И ДР. Хемокиновые IL-8 И ДР Интегрины + Молекулы главного комплекса гистосовместимости MHC-I И II класса CD 14, 13, 16 Рецептор для вирусов и ЛПС Костимулирующ ие CD 80, 86 при активации Рецепторы комплимента ++++
Рецепторы макрофагов Толл-подобные TLR 1, 2, 3, 4, 5. 6. 7, 8, 9, 10 Лектиновые + Fс-рецепторы К иммуноглобулинам G и А Цитокиновые к IL -1, 2, 3, 4, 6, 10, 15, 21 и – 23 , GМ-CSF, М-CSF И ДР. Хемокиновые IL-8 И ДР Интегрины + Молекулы главного комплекса гистосовместимости MHC-I И II класса CD 14, 13, 16 Рецептор для вирусов и ЛПС Костимулирующ ие CD 80, 86 при активации Рецепторы комплимента ++++
 Сравнение резидентных и воспалительных макрофагов Показатель РМ ВМ Направление миграции В нормальные ткани В Воспалительные ткани Функции Тканевой гомеостаз, Развитие воспаления, клиренс защита от патогенов, апоптотических клеток заживление ран Срок жизни Годы Недели
Сравнение резидентных и воспалительных макрофагов Показатель РМ ВМ Направление миграции В нормальные ткани В Воспалительные ткани Функции Тканевой гомеостаз, Развитие воспаления, клиренс защита от патогенов, апоптотических клеток заживление ран Срок жизни Годы Недели
 Функциональные различия нейтрофилов и моноцитов Свойство Н М Сроки жизни Короткий (3 -5) Длинный Темп мобилизации и активации Быстрый (минуты) Более медленный (часы) Длительность активации Короткая (минуты) Длительная (часы) Способность к фагоцитозу Очень высокая Высокая Регенерация мембран - + Нелизосомальная секреция - +
Функциональные различия нейтрофилов и моноцитов Свойство Н М Сроки жизни Короткий (3 -5) Длинный Темп мобилизации и активации Быстрый (минуты) Более медленный (часы) Длительность активации Короткая (минуты) Длительная (часы) Способность к фагоцитозу Очень высокая Высокая Регенерация мембран - + Нелизосомальная секреция - +
 Клеточные факторы врожденного иммунитета Фагоцитоз – это процесс активного поглощения клетками организма различных чужеродных структур с последующим их разрушением с помощью внутриклеточных литических систем. «Профессиональные» фагоциты: I гр. – микрофаги: полиморфноядерные лейкоциты – нейтрофилы, эозинофилы, базофилы; II гр. – макрофаги: моноциты крови, тканевые макрофаги. По подвижности выделяют: 1 -свободные, подвижные фагоциты 2 -фиксированные (тканевые макрофаги).
Клеточные факторы врожденного иммунитета Фагоцитоз – это процесс активного поглощения клетками организма различных чужеродных структур с последующим их разрушением с помощью внутриклеточных литических систем. «Профессиональные» фагоциты: I гр. – микрофаги: полиморфноядерные лейкоциты – нейтрофилы, эозинофилы, базофилы; II гр. – макрофаги: моноциты крови, тканевые макрофаги. По подвижности выделяют: 1 -свободные, подвижные фагоциты 2 -фиксированные (тканевые макрофаги).
 Фагоцитоз
Фагоцитоз

 Стадии фагоцитоза 1. Хемотаксис 2. Адгезия 3. Активация Мембраны 4. Погружение 5. Образование фагосомы 6. Образование фаголизосомы 7. Киллинг и переваривание 8. Выброс продуктов деградации
Стадии фагоцитоза 1. Хемотаксис 2. Адгезия 3. Активация Мембраны 4. Погружение 5. Образование фагосомы 6. Образование фаголизосомы 7. Киллинг и переваривание 8. Выброс продуктов деградации
 I ст. Эмиграция и хемотаксис нейтрофилов Качение Активация рецепторов адгезии адгезия экстравазация Миграция нейтрофила IL 1β, FNO-α Проникновение м/о через барьер Активация резидентного макрофага Хемотаксис нейтрофила к бактерии Ламеллоподия
I ст. Эмиграция и хемотаксис нейтрофилов Качение Активация рецепторов адгезии адгезия экстравазация Миграция нейтрофила IL 1β, FNO-α Проникновение м/о через барьер Активация резидентного макрофага Хемотаксис нейтрофила к бактерии Ламеллоподия

 II ст. Адгезия Бактерия с опсонинами Бактерия
II ст. Адгезия Бактерия с опсонинами Бактерия

 Рецепторы на поверхности фагоцитов: 1 - рецепторы к С 3 b-компоненту комплемента – СR 3 b: за счет химического сродства связывают через С 3 b (опсонин) липополисахариды грамотрицательных микробов, липопротеиды простейших, поверхностные структуры грибов; 2 - рецепторы для связывания маннозы (лектина) на поверхности сальмонелл, микобактерий и др. клеток; 3 - рецепторы для Fc-фрагментов Ig. G – через Ig. G (опсонин) адсорбция различных чужеродных клеток; 4 - скавенджер – рецепторы для производных лигандов сиаловых кислот, находящихся на клетках (деградирующие и погибающие собственные клетки) – это рецепторы для «уборки мусора» (“scavenger receptor”).
Рецепторы на поверхности фагоцитов: 1 - рецепторы к С 3 b-компоненту комплемента – СR 3 b: за счет химического сродства связывают через С 3 b (опсонин) липополисахариды грамотрицательных микробов, липопротеиды простейших, поверхностные структуры грибов; 2 - рецепторы для связывания маннозы (лектина) на поверхности сальмонелл, микобактерий и др. клеток; 3 - рецепторы для Fc-фрагментов Ig. G – через Ig. G (опсонин) адсорбция различных чужеродных клеток; 4 - скавенджер – рецепторы для производных лигандов сиаловых кислот, находящихся на клетках (деградирующие и погибающие собственные клетки) – это рецепторы для «уборки мусора» (“scavenger receptor”).
 III-IV ст. Активация мембраны и поглощение чужеродного агента Фагоцитарная чаша актин
III-IV ст. Активация мембраны и поглощение чужеродного агента Фагоцитарная чаша актин

 V ст. Формирование фагосомы
V ст. Формирование фагосомы
 VI cт. Фаголизосома
VI cт. Фаголизосома
 VII стадия – киллинг или внутриклеточное разрушение чужеродных клеток Выделяют 2 системы цитотоксичности фагоцитов: 1 -кислородзависимая 2 -кислороднезависимая
VII стадия – киллинг или внутриклеточное разрушение чужеродных клеток Выделяют 2 системы цитотоксичности фагоцитов: 1 -кислородзависимая 2 -кислороднезависимая
 В процессе фагоцитоза в фагоцитах происходит серия метаболических изменений – «дыхательный» или «кислородный взрыв» . Это сопровождается образованием и накоплением различных веществ: I. Образование и накопление АФК: 1 -увеличение содержания О 2 за счет его интенсивного поглощения (в 2 -10 раз);
В процессе фагоцитоза в фагоцитах происходит серия метаболических изменений – «дыхательный» или «кислородный взрыв» . Это сопровождается образованием и накоплением различных веществ: I. Образование и накопление АФК: 1 -увеличение содержания О 2 за счет его интенсивного поглощения (в 2 -10 раз);
 2 -образование супероксидного аниона О-2: под действием НАДФ-оксидазы ЦПМ фагоцита и цитохрома b О 2 трансформируется в –О 2 (НАДФН + 2 О 2 НАДФ+ + 2 О-2 + Н+); 3 -образование перекиси водорода – Н 2 О 2: под действием фермента супероксиддисмутазы супероксидный анион трансформируется в Н 2 О 2 (2 О-2 + Н 2 О фермент Н 2 О 2 + О 2) 4 -образование гидроксильного радикала – ОНв присутствии ионов Fe 2+ супероксид и перекись водорода вступают в реакцию Хабер-Вайса с образованием ОН(Н 2 О 2 + О 2 - Fe О 2 + ОН-);
2 -образование супероксидного аниона О-2: под действием НАДФ-оксидазы ЦПМ фагоцита и цитохрома b О 2 трансформируется в –О 2 (НАДФН + 2 О 2 НАДФ+ + 2 О-2 + Н+); 3 -образование перекиси водорода – Н 2 О 2: под действием фермента супероксиддисмутазы супероксидный анион трансформируется в Н 2 О 2 (2 О-2 + Н 2 О фермент Н 2 О 2 + О 2) 4 -образование гидроксильного радикала – ОНв присутствии ионов Fe 2+ супероксид и перекись водорода вступают в реакцию Хабер-Вайса с образованием ОН(Н 2 О 2 + О 2 - Fe О 2 + ОН-);
 5 -образование гипохлорита – НCl. O-: фермент миелопероксидаза в присутствии Н 2 О 2 трансформирует ионы Cl- в ионы гипохлорита (Cl- + Н 2 О 2 фермент 2 НCl. О-). Миелопероксидаза (МПО) является маркерным белком азурофильных гранул нейтрофилов. Она входит в состав микробицидной миелопероксидазной системы, которая включает в себя окислитель Н 2 О 2 и кофакторы (I-, Cl-, Br -, SCN-). МПОсистема подавляет жизнедеятельность бактерий, грибов, микоплазм и вирусов – универсальный антимикробный фактор.
5 -образование гипохлорита – НCl. O-: фермент миелопероксидаза в присутствии Н 2 О 2 трансформирует ионы Cl- в ионы гипохлорита (Cl- + Н 2 О 2 фермент 2 НCl. О-). Миелопероксидаза (МПО) является маркерным белком азурофильных гранул нейтрофилов. Она входит в состав микробицидной миелопероксидазной системы, которая включает в себя окислитель Н 2 О 2 и кофакторы (I-, Cl-, Br -, SCN-). МПОсистема подавляет жизнедеятельность бактерий, грибов, микоплазм и вирусов – универсальный антимикробный фактор.
 МПО-система вызывает: галогенирование биополимеров полисахаридов, ненасыщенных кислот): (белков, жирных биополимер+Н 2 О 2+I-+ МПО ОН-+Н 2 О 2+ галогенированный биополимер Свободный йод переводится в органически связанное состояние. Происходит опосредованное I-окисление сульфгидрильных групп белков, что снижает жизнеспособность бактерий.
МПО-система вызывает: галогенирование биополимеров полисахаридов, ненасыщенных кислот): (белков, жирных биополимер+Н 2 О 2+I-+ МПО ОН-+Н 2 О 2+ галогенированный биополимер Свободный йод переводится в органически связанное состояние. Происходит опосредованное I-окисление сульфгидрильных групп белков, что снижает жизнеспособность бактерий.
 6 -образование синглетного кислорода – 1 О 2: при взаимодействии гипохлорита с перекисью водорода (Н 2 О 2+ОCl- Cl-+Н 2 О 2+1 О 2). Синглентный кислород взаимодействует с полиненасыщенными жирными кислотами фосфолипидов, инициирует их перекисное окисление, что приводит к нарушению целостности ЦПМ; 7 -образование радикала оксида азота – NO- за счет активации фермента NO-синтазы.
6 -образование синглетного кислорода – 1 О 2: при взаимодействии гипохлорита с перекисью водорода (Н 2 О 2+ОCl- Cl-+Н 2 О 2+1 О 2). Синглентный кислород взаимодействует с полиненасыщенными жирными кислотами фосфолипидов, инициирует их перекисное окисление, что приводит к нарушению целостности ЦПМ; 7 -образование радикала оксида азота – NO- за счет активации фермента NO-синтазы.
 II. Образование хлораминов за счет взаимодействия гипохлорита с пептидами фагоцита. МПО-система при использовании хлорида окисляет сначала ионы Cl- до катиона в составе гипохлоритного аниона (ОCl-) Н 2 О 2+Cl- +Н+ МПО НОCl-+Н 2 О хлорноватистая кислота НОCl взаимодействует в кислой среде с аминокислотами (аспарагиновой, аланином, серенином, лизином) с образованием соответствующих хлораминов. Хлорноватистая кислота способна реагировать с пептидными связями в микробных белках в результате чего образуются хлорамиды.
II. Образование хлораминов за счет взаимодействия гипохлорита с пептидами фагоцита. МПО-система при использовании хлорида окисляет сначала ионы Cl- до катиона в составе гипохлоритного аниона (ОCl-) Н 2 О 2+Cl- +Н+ МПО НОCl-+Н 2 О хлорноватистая кислота НОCl взаимодействует в кислой среде с аминокислотами (аспарагиновой, аланином, серенином, лизином) с образованием соответствующих хлораминов. Хлорноватистая кислота способна реагировать с пептидными связями в микробных белках в результате чего образуются хлорамиды.
 Хлорамиды в свою очередь гидролизуются с разрушением пептидной связи и формированием NCl -пептидов, которые окисляют компоненты микроба и усиливают их структурные нарушения. Хлорамины аминокислот под действием воды разлагаются до альдегидов, которые являются «когтями и клыками» (А. Сент-Дьердьи, 1971) макроорганизма в защите от инфекционных агентов, так как они активно реагируют с функционально важными группами чужеродных молекул (-SH, -NH 2, OH), лишая их биологической активности: гипохлорит блокирует функционирование дыхательной цепи бактерий.
Хлорамиды в свою очередь гидролизуются с разрушением пептидной связи и формированием NCl -пептидов, которые окисляют компоненты микроба и усиливают их структурные нарушения. Хлорамины аминокислот под действием воды разлагаются до альдегидов, которые являются «когтями и клыками» (А. Сент-Дьердьи, 1971) макроорганизма в защите от инфекционных агентов, так как они активно реагируют с функционально важными группами чужеродных молекул (-SH, -NH 2, OH), лишая их биологической активности: гипохлорит блокирует функционирование дыхательной цепи бактерий.
 III. Образование молочной кислоты и снижение р. Н от 6, 5 до 3, 0 внутри фагосом в результате активизации гликолитического пути метаболизма углеводов в фагоците.
III. Образование молочной кислоты и снижение р. Н от 6, 5 до 3, 0 внутри фагосом в результате активизации гликолитического пути метаболизма углеводов в фагоците.
 Данные процессы обусловливают следующие эффекты в поглощенных чужеродных клетках: перекисное окисление мембранных липидов; инактивация ферментов и деградация белков за счет разрушения пептидных связей; подавление синтеза РНК и ДНК. Нарушается структурная целостность чужеродных клеток, разрушаются основные их биомолекулы (ДНК, РНК, белки, липиды, полисахариды), что в конечном итоге приводит к их лизису.
Данные процессы обусловливают следующие эффекты в поглощенных чужеродных клетках: перекисное окисление мембранных липидов; инактивация ферментов и деградация белков за счет разрушения пептидных связей; подавление синтеза РНК и ДНК. Нарушается структурная целостность чужеродных клеток, разрушаются основные их биомолекулы (ДНК, РНК, белки, липиды, полисахариды), что в конечном итоге приводит к их лизису.
 Различают: 1. Завершенный фагоцитоз, когда поглощение заканчивается полным разрушением чужеродных частиц; 2. Незавершенный фагоцитоз, когда поглощенные частицы сохраняются в фагосомах.
Различают: 1. Завершенный фагоцитоз, когда поглощение заканчивается полным разрушением чужеродных частиц; 2. Незавершенный фагоцитоз, когда поглощенные частицы сохраняются в фагосомах.
 Персистирование связано с 3 механизмами: 1. блокада фаголизосомального слияния (вирусы, микобактерии, простейшие). 2. резистентность к лизосомальным ферментам (гонококки, стафилококки) 3. способность м/о покидать фагосомы после поглощения и сохраняться в цитоплазме (риккетсии).
Персистирование связано с 3 механизмами: 1. блокада фаголизосомального слияния (вирусы, микобактерии, простейшие). 2. резистентность к лизосомальным ферментам (гонококки, стафилококки) 3. способность м/о покидать фагосомы после поглощения и сохраняться в цитоплазме (риккетсии).
 Функции фагоцитов Удаление из организма отмирающих и поврежденных клеток Поглощение и инактивирование микробов Презентация АГ Т-хелперам (антигенпрезентирующая функция) Участие в регуляции иммунной системы, синтез биологически активных веществ Удаление неметабилизируемых неорганических веществ (частички угля, пыли и др. )
Функции фагоцитов Удаление из организма отмирающих и поврежденных клеток Поглощение и инактивирование микробов Презентация АГ Т-хелперам (антигенпрезентирующая функция) Участие в регуляции иммунной системы, синтез биологически активных веществ Удаление неметабилизируемых неорганических веществ (частички угля, пыли и др. )
 Кислороднезависимая система инактивации микроорганизмов при фагоцитозе Определяет действие на чужеродные клетки различных биологически активных веществ. Антибиотические пептиды: 1. Дефенсины (HNP 1 -3) – лизосомальные катионные белки, локализованы в азурофильных гранулах нейтрофилов (αдефенсины). Они содержат аминокислоты с гидрофобными боковыми цепями (изолейцин, пролин, лейцин, валин); 6 остатков цистеина с тремя дисульфидными мостиками, что придает пептиду повышенную устойчивость к протеиназам нейтрофилов и очагов воспаления. В таком виде они являются активными мембранотропными веществами: взаимодействуют с фосфолипидами, внедряются в липидный бислой чужеродных клеток. Обладают активностью в отношении микробов, оболочных вирусов, опухолевых клеток.
Кислороднезависимая система инактивации микроорганизмов при фагоцитозе Определяет действие на чужеродные клетки различных биологически активных веществ. Антибиотические пептиды: 1. Дефенсины (HNP 1 -3) – лизосомальные катионные белки, локализованы в азурофильных гранулах нейтрофилов (αдефенсины). Они содержат аминокислоты с гидрофобными боковыми цепями (изолейцин, пролин, лейцин, валин); 6 остатков цистеина с тремя дисульфидными мостиками, что придает пептиду повышенную устойчивость к протеиназам нейтрофилов и очагов воспаления. В таком виде они являются активными мембранотропными веществами: взаимодействуют с фосфолипидами, внедряются в липидный бислой чужеродных клеток. Обладают активностью в отношении микробов, оболочных вирусов, опухолевых клеток.
 2. Кателицидины – положительно заряженные пептиды, тропные к мембранам микроорганизмов, являются ингибиторами катепсина L. Обладают активностью в отношении грамположительных и грамотрицательных микробов, грибов, сложных вирусов.
2. Кателицидины – положительно заряженные пептиды, тропные к мембранам микроорганизмов, являются ингибиторами катепсина L. Обладают активностью в отношении грамположительных и грамотрицательных микробов, грибов, сложных вирусов.
 Механизм действия: Как положительно заряженные пептиды взаимодействуют с отрицательно заряженными молекулами оболочек чужеродных клеток – фософлипидами ЦПМ, ЛПС, тейхоевыми кислотами, кислыми белками, пептидогликанами. Благодаря элекростатическому взаимодействию происходит сорбция петидов на поверхности микробных клеток. При взаимодействии с наружной и цитоплазматической мембраной образуются димеры дефенсинов, которые внедряются в эти бислои мембран и увеличивают их проницаемость.
Механизм действия: Как положительно заряженные пептиды взаимодействуют с отрицательно заряженными молекулами оболочек чужеродных клеток – фософлипидами ЦПМ, ЛПС, тейхоевыми кислотами, кислыми белками, пептидогликанами. Благодаря элекростатическому взаимодействию происходит сорбция петидов на поверхности микробных клеток. При взаимодействии с наружной и цитоплазматической мембраной образуются димеры дефенсинов, которые внедряются в эти бислои мембран и увеличивают их проницаемость.
 Процесс внедрения и прохождения катионных белков через ЦПМ сопровождается нарушением ее целостности с образованием пор. В результате изменяется осмотический барьер, вода накапливается в клетках происходит разрыв клетки происходит вытекание жизненно важных компонентов (ионов К+, Са 2+, аминокислот, нуклеотидов, ферментов и др. ), деполяризация мембранного потенциала. дезорганизация мембранных мультиферментных комплексов приводит: к подавлению дыхания, синтеза белков, репликации нуклеиновых кислот. В результате происходит гибель микроорганизмов.
Процесс внедрения и прохождения катионных белков через ЦПМ сопровождается нарушением ее целостности с образованием пор. В результате изменяется осмотический барьер, вода накапливается в клетках происходит разрыв клетки происходит вытекание жизненно важных компонентов (ионов К+, Са 2+, аминокислот, нуклеотидов, ферментов и др. ), деполяризация мембранного потенциала. дезорганизация мембранных мультиферментных комплексов приводит: к подавлению дыхания, синтеза белков, репликации нуклеиновых кислот. В результате происходит гибель микроорганизмов.
 Лактоферрины (ЛФ) – железосвязывающие гликопротеины представлены одноцепочечными белками с мол. массой около 80 Кда. Содержатся в гранулах нейтрофилов. ЛФ представляют собой природные комплексоны, прочно связывающие катионы металлов переменной валентности (Fe 3+, Cr 3+, Co 3+, Mn. O 3, Cd 2+, Zn 2+, Ni 2+), чаще взаимодействует с ионами Fe, Cu и Zn. Реакция связывания ионов Fe протекает с обязательным участием бикарбонатных анионов: 2 Fe 2+ + 2 НСО 3 - + ЛФ(Н 3)2 бикарбонатный анион ЛФFe 2(НСО 3)2 + 6 Н 2+
Лактоферрины (ЛФ) – железосвязывающие гликопротеины представлены одноцепочечными белками с мол. массой около 80 Кда. Содержатся в гранулах нейтрофилов. ЛФ представляют собой природные комплексоны, прочно связывающие катионы металлов переменной валентности (Fe 3+, Cr 3+, Co 3+, Mn. O 3, Cd 2+, Zn 2+, Ni 2+), чаще взаимодействует с ионами Fe, Cu и Zn. Реакция связывания ионов Fe протекает с обязательным участием бикарбонатных анионов: 2 Fe 2+ + 2 НСО 3 - + ЛФ(Н 3)2 бикарбонатный анион ЛФFe 2(НСО 3)2 + 6 Н 2+
 Комплексообразующая способность ЛФ лежит в основе их детоксицирующей, транспортной и антимикробной функций. Связывая ионы металлов ЛФ лишает поверхностные стуктуры микроорганизмов жизненно важных микроэлементов, входящих в состав цитохромов дыхательной цепи, каталаз, пероксидаз, супероксиддисмутаз, сдерживая рост и размножения микробов и грибов – оказывает бактериостатическое действие. Насыщенный железом ЛФ уже не проявляет микробостатической активности. Отсюда важно именно связывание и удерживание Fe.
Комплексообразующая способность ЛФ лежит в основе их детоксицирующей, транспортной и антимикробной функций. Связывая ионы металлов ЛФ лишает поверхностные стуктуры микроорганизмов жизненно важных микроэлементов, входящих в состав цитохромов дыхательной цепи, каталаз, пероксидаз, супероксиддисмутаз, сдерживая рост и размножения микробов и грибов – оказывает бактериостатическое действие. Насыщенный железом ЛФ уже не проявляет микробостатической активности. Отсюда важно именно связывание и удерживание Fe.
 ЛФ оказывает прямое бактерицидное действие на стрептококки, холерный вибрион, синегнойную палочку (ненасыщенный железом ЛФ – аполактоферрин): происходят изменения в структуре микробных клеток – высвобождение ЛПС из наружной мембраны клеточной стенки за счет связывания ионов Ca 2+ u Mg 2+, выпадение кето- дезоксиоктоновой кислоты из ЛПС; активируются литические ферменты ЦПМ (фосфолипазы, гликаназы) – аутолиз микробных клеток; образуются короткие катионные пептиды из ЛФ за счет ограниченного протеолиза, которые проникают в КС и ЦПМ микробов, образуют поры, происходит их осмотический лизис. ЛФ обладает способностью стимулировать NKклетки, нейтрофилы и макрофаги.
ЛФ оказывает прямое бактерицидное действие на стрептококки, холерный вибрион, синегнойную палочку (ненасыщенный железом ЛФ – аполактоферрин): происходят изменения в структуре микробных клеток – высвобождение ЛПС из наружной мембраны клеточной стенки за счет связывания ионов Ca 2+ u Mg 2+, выпадение кето- дезоксиоктоновой кислоты из ЛПС; активируются литические ферменты ЦПМ (фосфолипазы, гликаназы) – аутолиз микробных клеток; образуются короткие катионные пептиды из ЛФ за счет ограниченного протеолиза, которые проникают в КС и ЦПМ микробов, образуют поры, происходит их осмотический лизис. ЛФ обладает способностью стимулировать NKклетки, нейтрофилы и макрофаги.
 Бактерицидный проницаемость увеличивающий белок (БПУ-белок или холобелки): 1. Содержится в азурофильных гранулах нейтро- филов 2. Белки с мол. весом 50 -60 к. Да, богатые гидрофобными аминокислотами. Они состоят из катионной лизин-обогащенной N-концевой части и гидрофобной слабо заряженной С-концевой половины, их соединяет гидрофильный пролинбогатый участок. 3. Ингибирует рост и размножение многих видов грамотрицательных, в том числе капсулообразующих микробов. Не оказывает цитотоксического действия на грамположительные микробы и эукариотические клетки.
Бактерицидный проницаемость увеличивающий белок (БПУ-белок или холобелки): 1. Содержится в азурофильных гранулах нейтро- филов 2. Белки с мол. весом 50 -60 к. Да, богатые гидрофобными аминокислотами. Они состоят из катионной лизин-обогащенной N-концевой части и гидрофобной слабо заряженной С-концевой половины, их соединяет гидрофильный пролинбогатый участок. 3. Ингибирует рост и размножение многих видов грамотрицательных, в том числе капсулообразующих микробов. Не оказывает цитотоксического действия на грамположительные микробы и эукариотические клетки.
 4. Цитотоксическое действие реализуется в 2 стадии: 1 стадия – при нейтральных значениях р. Н БПУ-белок в течении первых минут обратимо подавляет размножение микробов за счет связывания с белком наружной мембраны и активацией литических ферментов (фосфолипазы А 2, пептидогликаназы) КС. Наблюдаются структурные изменения в КС. Кроме того, N-концевая часть молекулы БПУ-белка обладает высоким положительным зарядом и гидрофобностью обеспечивает повышенное сродство белка к ЛПС наружной мембраны КС, блокируют основные ЛПСопосредованные эффекты и обладает эндотоксинсвязывающей способностью. 2 стадия – необратимая – лизис микробных клеток.
4. Цитотоксическое действие реализуется в 2 стадии: 1 стадия – при нейтральных значениях р. Н БПУ-белок в течении первых минут обратимо подавляет размножение микробов за счет связывания с белком наружной мембраны и активацией литических ферментов (фосфолипазы А 2, пептидогликаназы) КС. Наблюдаются структурные изменения в КС. Кроме того, N-концевая часть молекулы БПУ-белка обладает высоким положительным зарядом и гидрофобностью обеспечивает повышенное сродство белка к ЛПС наружной мембраны КС, блокируют основные ЛПСопосредованные эффекты и обладает эндотоксинсвязывающей способностью. 2 стадия – необратимая – лизис микробных клеток.
 Катионный холобелок электростатически связывается с поверхностными областями КС, идет конкурентное вытеснение ионов Са 2+ и Мg 2+ из наружной мембраны. Повышается ее проницаемость, обнажаются ее гидрофобные области, с которыми взаимодействует гидрофобный С конец БПУ-белка. Образуются поры, через которые из микробных клеток происходит утечка жизненно важных элементов и молекул. Кроме того, за счет активации литических ферментов происходит разрушение фосфолипидов мембран и пептидогликанового скелета; блокируются транспортные и энергетические процессы.
Катионный холобелок электростатически связывается с поверхностными областями КС, идет конкурентное вытеснение ионов Са 2+ и Мg 2+ из наружной мембраны. Повышается ее проницаемость, обнажаются ее гидрофобные области, с которыми взаимодействует гидрофобный С конец БПУ-белка. Образуются поры, через которые из микробных клеток происходит утечка жизненно важных элементов и молекул. Кроме того, за счет активации литических ферментов происходит разрушение фосфолипидов мембран и пептидогликанового скелета; блокируются транспортные и энергетические процессы.
 Серпроцидины 1. Катепсин G – это сериновая протеаза с оптимальной ферментативной активностью в нейтрально-щелочной среде, содержится в гранулах нейтрофилов и моноцитов (макрофагов, характеризуется положительным зарядом своих молекул. Доказана антимикробная активность в отношении грамположительных и грамотрицательных микробов, грибов. Катепсин G является поверхностно активным веществом и как катионный белок нарушает функции КС, подавляет синтез белка, ДНК- и РНК-молекул в микробной клетке, Резко снижает функции ЦПМ, в частности, энергетический метаболизм.
Серпроцидины 1. Катепсин G – это сериновая протеаза с оптимальной ферментативной активностью в нейтрально-щелочной среде, содержится в гранулах нейтрофилов и моноцитов (макрофагов, характеризуется положительным зарядом своих молекул. Доказана антимикробная активность в отношении грамположительных и грамотрицательных микробов, грибов. Катепсин G является поверхностно активным веществом и как катионный белок нарушает функции КС, подавляет синтез белка, ДНК- и РНК-молекул в микробной клетке, Резко снижает функции ЦПМ, в частности, энергетический метаболизм.
 2. Эластаза. Локализована в азурофильных гранулах нейтрофилов; может высвобождаться в фагосому и во внеклеточное пространство. Это катионный гликопротеин с активностью сериновой протеиназы. Проявляет оптимальную ферментативную активность при р. Н=8 -9. Обладает способностью расщеплять эластин, коллаген, фибриноген, гемоглобин, протеогликаны, кининогены, компоненты комплемента. Эластаза вызывает субклеточные изменения в структуре клеточных оболочек бактерий, повышает их чувствительность к воздействию МПО-системы, катепсин G и БПУ-белка. Доказана переваривающая активность эластаза в отношении некоторых белков наружной мембраны грамотрицательных микробов.
2. Эластаза. Локализована в азурофильных гранулах нейтрофилов; может высвобождаться в фагосому и во внеклеточное пространство. Это катионный гликопротеин с активностью сериновой протеиназы. Проявляет оптимальную ферментативную активность при р. Н=8 -9. Обладает способностью расщеплять эластин, коллаген, фибриноген, гемоглобин, протеогликаны, кининогены, компоненты комплемента. Эластаза вызывает субклеточные изменения в структуре клеточных оболочек бактерий, повышает их чувствительность к воздействию МПО-системы, катепсин G и БПУ-белка. Доказана переваривающая активность эластаза в отношении некоторых белков наружной мембраны грамотрицательных микробов.
 3. Азуроцидин (белок САР 37) катионный белок в азурофильных гранулах нейтрофилов, избирательно активен в отношении грамотрицательных бактерий, гликопротеин с тремя потенциальными сайтами гликозилрования, мол. вес 25 -29 к. Да, вместе с эластазой и катепсином G инактивирует бактерии ротовой полости, действует в кислой среде, нарушает функцию ЦПМ микробов.
3. Азуроцидин (белок САР 37) катионный белок в азурофильных гранулах нейтрофилов, избирательно активен в отношении грамотрицательных бактерий, гликопротеин с тремя потенциальными сайтами гликозилрования, мол. вес 25 -29 к. Да, вместе с эластазой и катепсином G инактивирует бактерии ротовой полости, действует в кислой среде, нарушает функцию ЦПМ микробов.
 Лизоцим (мурамидаза, мукопептидгликогидролаза) содержится в гранулах нейтрофилов и макрофагов, является катионным белком с низким молекулярным весом около 15 к. Да, механизм действия: гидролизует 1, 4 β-связи между остатками N-ацетилмурамовой кислотой и N-ацетилглюкозамином, может осуществлять полное растворение пептидогликанового слоя, в результате чего образуются сферо - и протопласты. Последние лизируются за счет разрыва ЦПМ, не выдерживающей высокого осмотического давления, реализация бактерицидного эффекта происходит в присутствии других активных веществ (дефенсины, БПУ-белка и др. ), которые в процессе дегрануляции оказываются в фаголизосомах, изменяют структуру КС и делают ее чувствительной к лизоциму.
Лизоцим (мурамидаза, мукопептидгликогидролаза) содержится в гранулах нейтрофилов и макрофагов, является катионным белком с низким молекулярным весом около 15 к. Да, механизм действия: гидролизует 1, 4 β-связи между остатками N-ацетилмурамовой кислотой и N-ацетилглюкозамином, может осуществлять полное растворение пептидогликанового слоя, в результате чего образуются сферо - и протопласты. Последние лизируются за счет разрыва ЦПМ, не выдерживающей высокого осмотического давления, реализация бактерицидного эффекта происходит в присутствии других активных веществ (дефенсины, БПУ-белка и др. ), которые в процессе дегрануляции оказываются в фаголизосомах, изменяют структуру КС и делают ее чувствительной к лизоциму.
 VIII ст. Заключительная – экзоцитоз продуктов деградации чужеродных клеток
VIII ст. Заключительная – экзоцитоз продуктов деградации чужеродных клеток


 Функции моноцитов/макрофагов Удаление из организма отмирающих и поврежденных клеток Поглощение и инактивирование микробов Презентация АГ Т-хелперам (антигенпрезентирующая функция) Участие в регуляции иммунной системы, синтез биологически активных веществ Удаление неметабилизируемых неорганических веществ (частички угля, пыли и др. )
Функции моноцитов/макрофагов Удаление из организма отмирающих и поврежденных клеток Поглощение и инактивирование микробов Презентация АГ Т-хелперам (антигенпрезентирующая функция) Участие в регуляции иммунной системы, синтез биологически активных веществ Удаление неметабилизируемых неорганических веществ (частички угля, пыли и др. )
 Эозинофилы Защита от многоклеточных паразитов Внеклеточный цитолиз
Эозинофилы Защита от многоклеточных паразитов Внеклеточный цитолиз
 Естественные киллеры Контактный цитолиз Распознавание мишени и контакт Активация киллера Программирование гибели Уничтожение
Естественные киллеры Контактный цитолиз Распознавание мишени и контакт Активация киллера Программирование гибели Уничтожение


