Тема: Клеточный специфический иммунитет



























































8 Клеточный иммунитет.ppt
- Количество слайдов: 64
 Тема: Клеточный специфический иммунитет
Тема: Клеточный специфический иммунитет
 Т-клеточные механизмы специфического иммунитета играют роль в развитии: I – противоинфекционного иммунитета: 1 -на микроорганизмы, преимущественно с внутриклеточ- ной локализацией (туберкулезная палочка, бруцеллы и др. ), 2 -формируют противовирусный, противогрибковый, про- тивопаразитарный, противопротозойный иммунитет, 3 -реакции клеточного типа определяют развитие ГЗТ на микроорганизмы и продукты их жизнедеятельности, например, при туберкулезе, бруцеллезе. II – неинфекционного иммунитета: 1 -создают трансплантационный иммунитет – цитотокси- ческие реакции лимфоцитов на трансплантированные клетки тканей и органов, что приводит к отторжению трансплантанта.
Т-клеточные механизмы специфического иммунитета играют роль в развитии: I – противоинфекционного иммунитета: 1 -на микроорганизмы, преимущественно с внутриклеточ- ной локализацией (туберкулезная палочка, бруцеллы и др. ), 2 -формируют противовирусный, противогрибковый, про- тивопаразитарный, противопротозойный иммунитет, 3 -реакции клеточного типа определяют развитие ГЗТ на микроорганизмы и продукты их жизнедеятельности, например, при туберкулезе, бруцеллезе. II – неинфекционного иммунитета: 1 -создают трансплантационный иммунитет – цитотокси- ческие реакции лимфоцитов на трансплантированные клетки тканей и органов, что приводит к отторжению трансплантанта.
 При несовместимости отторжение первичного трансплантанта набл. через 6 -25 дней (в среднем – через 7 -9 дней). Вторичные трансплантанты отторгаются в более короткие сроки – через 4 -15 дней (в средние – 4 -6 дней), что связано с образованием «клеток памяти» , которые «живут» в течение года и более после пересадки. Образуются Т-киллеры , которые затем либо сами оказывают деструктивное действие на клетки и ткани трансплантанта (выделение протеолитических ферментов), или выделяют цитокины или мобилизуют макрофаги , которые с помощью фагоцитоза и цитотоксических веществ разрушают трансплантанты, или активируют NK-клетки.
При несовместимости отторжение первичного трансплантанта набл. через 6 -25 дней (в среднем – через 7 -9 дней). Вторичные трансплантанты отторгаются в более короткие сроки – через 4 -15 дней (в средние – 4 -6 дней), что связано с образованием «клеток памяти» , которые «живут» в течение года и более после пересадки. Образуются Т-киллеры , которые затем либо сами оказывают деструктивное действие на клетки и ткани трансплантанта (выделение протеолитических ферментов), или выделяют цитокины или мобилизуют макрофаги , которые с помощью фагоцитоза и цитотоксических веществ разрушают трансплантанты, или активируют NK-клетки.
 2 -формируют «реакции трансплантат против хозяина» – РТПХ представляет реакцию клеток донора на антигены МНС и других систем тканевой совместимости реципиента. Основными условиями развития РТПХ является: жизнеспособность клеток донора (химеризм в организме реципиента), сниженная реактивность клеток реципиента по отношению к клеткам донора, при введении иммунокомпетентных клеток внутри- венно или внутрибрюшинно и не возникает при их внутримышечном и подкожном введении, возникает при переливании свежей крови или при пересадке костного мозга, Т-лимфоциты донора оказывают цитотоксическое действие сами или через медиаторы.
2 -формируют «реакции трансплантат против хозяина» – РТПХ представляет реакцию клеток донора на антигены МНС и других систем тканевой совместимости реципиента. Основными условиями развития РТПХ является: жизнеспособность клеток донора (химеризм в организме реципиента), сниженная реактивность клеток реципиента по отношению к клеткам донора, при введении иммунокомпетентных клеток внутри- венно или внутрибрюшинно и не возникает при их внутримышечном и подкожном введении, возникает при переливании свежей крови или при пересадке костного мозга, Т-лимфоциты донора оказывают цитотоксическое действие сами или через медиаторы.
 При острой РТПХ наблюдается пролиферация лимфоидной и ретикулярной ткани, увеличение селезенки, печени, лимфатических узлов, некроз слизистых оболочек кишечника (язвы), анемия, лейкопения, тромбоцитопения. Имеет место атрофия тимуса. При хронической РТПХ (введение небольшого количества лимфоцитов) имеет место снижение веса, диарея, сколиоз, понижение температуры, анемия, лейкопения, тромбоцитопения. 3 -разрушение опухолевых клеток активированными цитотоксическими Т-лимфоцитами, NK и макро- фагами. 4 -обуславливают реакции клеточного типа при ал- лергических и аутоиммунных расстройствах – ГЗТ.
При острой РТПХ наблюдается пролиферация лимфоидной и ретикулярной ткани, увеличение селезенки, печени, лимфатических узлов, некроз слизистых оболочек кишечника (язвы), анемия, лейкопения, тромбоцитопения. Имеет место атрофия тимуса. При хронической РТПХ (введение небольшого количества лимфоцитов) имеет место снижение веса, диарея, сколиоз, понижение температуры, анемия, лейкопения, тромбоцитопения. 3 -разрушение опухолевых клеток активированными цитотоксическими Т-лимфоцитами, NK и макро- фагами. 4 -обуславливают реакции клеточного типа при ал- лергических и аутоиммунных расстройствах – ГЗТ.
 Общими признаками для этих реакций служит: 1. Участие С D 8 + - ЦТЛ-лимфоцитов. Т-лимфоцит в качестве клетки эффектора – конечного продукта процесса дифференцировки, разрушающего клет- ку-мишень. 2. Участие С D 4 + - лимфоцитов. Т-эффекторы, которые под влиянием ГЗТ γ ИФН и ИЛ-12 трансформи- руется в Тh. I Т-клеток иммунологической памяти. 3. АПК-макрофаги или дендритные клетки. 4. Ответ развивается на тимусзависимые антигены: - измененные клетки собственного организма – клетки-мишени, - клетки трансплантанта, - Другие чужеродные клетки и частицы (вирусы), которые поглощаются АПК.
Общими признаками для этих реакций служит: 1. Участие С D 8 + - ЦТЛ-лимфоцитов. Т-лимфоцит в качестве клетки эффектора – конечного продукта процесса дифференцировки, разрушающего клет- ку-мишень. 2. Участие С D 4 + - лимфоцитов. Т-эффекторы, которые под влиянием ГЗТ γ ИФН и ИЛ-12 трансформи- руется в Тh. I Т-клеток иммунологической памяти. 3. АПК-макрофаги или дендритные клетки. 4. Ответ развивается на тимусзависимые антигены: - измененные клетки собственного организма – клетки-мишени, - клетки трансплантанта, - Другие чужеродные клетки и частицы (вирусы), которые поглощаются АПК.
 Зрелые Т-лимфоциты представляют собой круглую клетку размером 4, 5 мкм. Образование Т-лимфоцитов и формирова- ние клеточного иммунитета – процесс наи- более сложный и многоступенчатый по срав- нению с образованием иммунокомпетентных клеток других типов. Так же как и у В-клеток он включает 2 фазы. Формирование Т-системы иммунитета включает 2 фазы: 1 - антигеннезависимую – лимфопоэз – обра- зование клеток, участвующих в иммунном ответе, 2 - антигензависимую – иммуногенез – собст- венный иммунный ответ.
Зрелые Т-лимфоциты представляют собой круглую клетку размером 4, 5 мкм. Образование Т-лимфоцитов и формирова- ние клеточного иммунитета – процесс наи- более сложный и многоступенчатый по срав- нению с образованием иммунокомпетентных клеток других типов. Так же как и у В-клеток он включает 2 фазы. Формирование Т-системы иммунитета включает 2 фазы: 1 - антигеннезависимую – лимфопоэз – обра- зование клеток, участвующих в иммунном ответе, 2 - антигензависимую – иммуногенез – собст- венный иммунный ответ.
 I. Лимфопоэз. Антигензависимая фаза образования Т-лим- фоцитов осуществляется последовательно в двух цент- ральных органах иммунной системы – в костном мозге и в тимусе. В очагах костномозгового кроветворения из пула полипотентных стволовых кроветворных клеток образуется общий пул стволовых лимфоидных клеток. Из него возникает пул предшественников Т-лимфоцитов: в костном мозге образуются: пре -Тαβ пре-Тγ тимус 99% прибар. ткани 1% пре-Т-клетки мигрируют из костного поддержание противовирусного мозга в тимус, где происходит их иммунитета (кожа, слизистые окончательная дифференцировка оболочки) и ГЗТ. в зрелые наивные Т-лимфоциты под влиянием гормонов, образуемых эпи- телиальными клетками этого ограна. Все эти пулы имеют неограниченную способность к поддержанию и рециркулируют через кровоток между различными очагами костного мозга, чем поддерживают эквивалентность пулов этих клеток во всех очагах крове- творения.
I. Лимфопоэз. Антигензависимая фаза образования Т-лим- фоцитов осуществляется последовательно в двух цент- ральных органах иммунной системы – в костном мозге и в тимусе. В очагах костномозгового кроветворения из пула полипотентных стволовых кроветворных клеток образуется общий пул стволовых лимфоидных клеток. Из него возникает пул предшественников Т-лимфоцитов: в костном мозге образуются: пре -Тαβ пре-Тγ тимус 99% прибар. ткани 1% пре-Т-клетки мигрируют из костного поддержание противовирусного мозга в тимус, где происходит их иммунитета (кожа, слизистые окончательная дифференцировка оболочки) и ГЗТ. в зрелые наивные Т-лимфоциты под влиянием гормонов, образуемых эпи- телиальными клетками этого ограна. Все эти пулы имеют неограниченную способность к поддержанию и рециркулируют через кровоток между различными очагами костного мозга, чем поддерживают эквивалентность пулов этих клеток во всех очагах крове- творения.
 Поступление в тимус клеток-предшествен- ников представляет собой циклический про- цесс, который включает: выход ПТК , достигших определенной сте- пени двигательной активности и утративших прочные связи со стромой, в кровоток; хемоаттракция их тимусом; преодоление гемато-тимического барьера , который образован 3 компонентами: 1. стенки сосудов (посткаппилярные венулы или капилляры). В тимусе они характеризуются черепицеобразным наложением клеток друг на друга и редкостного межклеточных щелей; 2. макрофаги, окружающие сосуды; 3. самый «жесткий» – эпителиальные клетки , выстилающие снаружи внутреннее пространство тимуса (эпителиальный компартмент).
Поступление в тимус клеток-предшествен- ников представляет собой циклический про- цесс, который включает: выход ПТК , достигших определенной сте- пени двигательной активности и утративших прочные связи со стромой, в кровоток; хемоаттракция их тимусом; преодоление гемато-тимического барьера , который образован 3 компонентами: 1. стенки сосудов (посткаппилярные венулы или капилляры). В тимусе они характеризуются черепицеобразным наложением клеток друг на друга и редкостного межклеточных щелей; 2. макрофаги, окружающие сосуды; 3. самый «жесткий» – эпителиальные клетки , выстилающие снаружи внутреннее пространство тимуса (эпителиальный компартмент).
 Это происходит за счет инвазивности пре-Т- лимфоцитов и взаимного распознавания мембран- ных структур пре-Т-лимфоцитов и клеток барьера. Играют роль рецепторы и молекулы – лиганды. Пре-Т-лимфоциты проходят 3 последователь- ных стадии в своем развитии: 1 - субкапсулярные ПЛТ, 2 - кортикальные незрелые и зрелые малые тимоциты, 3 - медуллярные зрелые средние тимоциты. Эти процессы связаны с : 1) действии гормонов тимуса (тимозин, тимулин, тимопоэтин), 2) лимфокинами , продуцируемыми частью зрелых тимоцитов, остающимися в медуллярной зоне тимуса, 3) продуктами активированных макрофагов.
Это происходит за счет инвазивности пре-Т- лимфоцитов и взаимного распознавания мембран- ных структур пре-Т-лимфоцитов и клеток барьера. Играют роль рецепторы и молекулы – лиганды. Пре-Т-лимфоциты проходят 3 последователь- ных стадии в своем развитии: 1 - субкапсулярные ПЛТ, 2 - кортикальные незрелые и зрелые малые тимоциты, 3 - медуллярные зрелые средние тимоциты. Эти процессы связаны с : 1) действии гормонов тимуса (тимозин, тимулин, тимопоэтин), 2) лимфокинами , продуцируемыми частью зрелых тимоцитов, остающимися в медуллярной зоне тимуса, 3) продуктами активированных макрофагов.
 Происходит изменение мембранных мар- керов клеток , и они приобретают определен- ные функциональные свойства (в корк. слое происходит селекция Т-лимфоцитов: поло- жительная - 1% и отрицательная - до 99% подвергается апоптозу) и рецепторы ( CD 4 + CD 3+, CD 8+, CD 3+). Т-лимфоциты, созревшие в тимусе способны распознавать АГ и реагировать на него формированием киллеров, хелперов, супрессоров. При этом они гетерогенны как по функциональным свойствам, так и по специфичности в отношении к конкретным АГ и особенностям их распознавания.
Происходит изменение мембранных мар- керов клеток , и они приобретают определен- ные функциональные свойства (в корк. слое происходит селекция Т-лимфоцитов: поло- жительная - 1% и отрицательная - до 99% подвергается апоптозу) и рецепторы ( CD 4 + CD 3+, CD 8+, CD 3+). Т-лимфоциты, созревшие в тимусе способны распознавать АГ и реагировать на него формированием киллеров, хелперов, супрессоров. При этом они гетерогенны как по функциональным свойствам, так и по специфичности в отношении к конкретным АГ и особенностям их распознавания.
 Созревшие наивные CD 4+ и CD 8+ - Т-лимфо- циты мигрируют из тимуса через кровоток во вторичные лимфоидные органы, где в их тимусзависимых зонах происходит антигенза- висимая фаза дифференцировки Т-клеток или иммуногенез. Она включает в себя 4 последовательно протекающих стадии: I. Афферентная или стадия распознавания антигена; II. Центральная или стадия накопления клеток – ЦТЛ; III. Эфферентная или стадия уничтожения антигена; IV. Заключительная или стадия очищения организма.
Созревшие наивные CD 4+ и CD 8+ - Т-лимфо- циты мигрируют из тимуса через кровоток во вторичные лимфоидные органы, где в их тимусзависимых зонах происходит антигенза- висимая фаза дифференцировки Т-клеток или иммуногенез. Она включает в себя 4 последовательно протекающих стадии: I. Афферентная или стадия распознавания антигена; II. Центральная или стадия накопления клеток – ЦТЛ; III. Эфферентная или стадия уничтожения антигена; IV. Заключительная или стадия очищения организма.
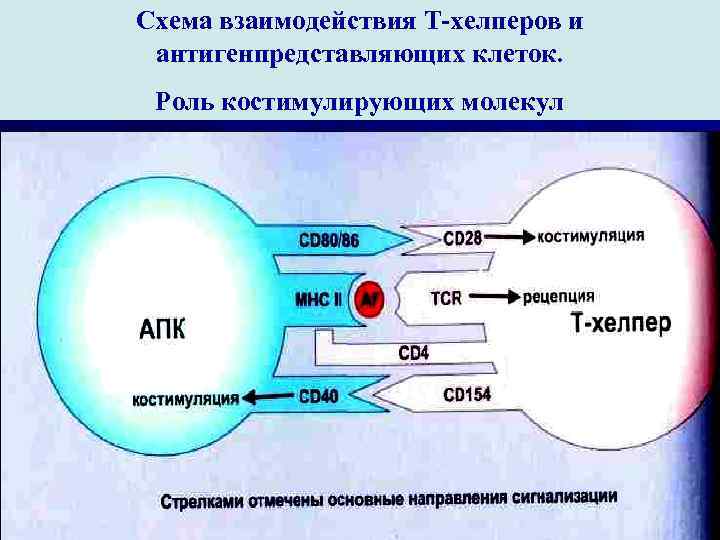
 I стадия. Иммунный ответ развивается только на тимусзависимые АГ. На этой стадии в индукции клеточного иммунного ответа принимают участие АПК (макрофаги, содержащие МНС класса II ) и регуляторные клетки Т-хелперы I порядка. Макрофаги захватывают около 80 -90% антигена, остальная его часть подвергается процессингу и связыванию с МНС II класса. В макрофагах и ДК синтезируются КО- стимуляторы, которые выделяются также на поверхности клеток.
I стадия. Иммунный ответ развивается только на тимусзависимые АГ. На этой стадии в индукции клеточного иммунного ответа принимают участие АПК (макрофаги, содержащие МНС класса II ) и регуляторные клетки Т-хелперы I порядка. Макрофаги захватывают около 80 -90% антигена, остальная его часть подвергается процессингу и связыванию с МНС II класса. В макрофагах и ДК синтезируются КО- стимуляторы, которые выделяются также на поверхности клеток.
 В таком виде процессированный АТ АГ подается субпопуляции наивных Т-хелперов , которые обладают способностью распозна- вать чужеродный АГ в комплексе с моле- кулами – МНС II класса. В этом процессе участвуют также CD 80/90 м/ср= DC и CD 28 наивных Th 0. Одновременно макрофаги вырабатывают цитокины , которые способен активировать Т- хелперы. В свою очередь Т-лимфоциты выделяют индуктор – γ -интерферон , способствующий активации макрофагов и экспрессии транс- мембранного гликопротеида. ИЛ-12 и γ ИФН способствуют дифферен- цировке CD 4+ Тh 0 в Th 1.
В таком виде процессированный АТ АГ подается субпопуляции наивных Т-хелперов , которые обладают способностью распозна- вать чужеродный АГ в комплексе с моле- кулами – МНС II класса. В этом процессе участвуют также CD 80/90 м/ср= DC и CD 28 наивных Th 0. Одновременно макрофаги вырабатывают цитокины , которые способен активировать Т- хелперы. В свою очередь Т-лимфоциты выделяют индуктор – γ -интерферон , способствующий активации макрофагов и экспрессии транс- мембранного гликопротеида. ИЛ-12 и γ ИФН способствуют дифферен- цировке CD 4+ Тh 0 в Th 1.
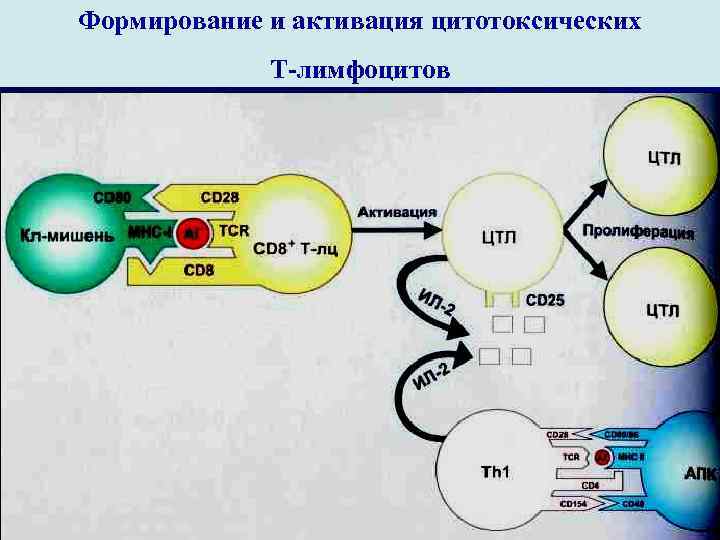
 II стадия. В эту стадию Th 1 индукторы передают полученную информацию CD 8 + Т-клеткам , активируя их помощью γ -ИФН и ИЛ-2 эффекторов как за счет выработки γ -ИФН и ИЛ-2 , который является являетс фактором роста и созревания Т-клеток, так и непосредственно контактируют с АГ + МНС I с по- мощью TCR-рецептора и чужеродными клетками. Т-предшественники эффектора последовательно проходят ряд превращений до лимфобласта (3 митоза), больного (2 митоза), среднего (2 митоза) лимфоцита и, превращается в малые лимфоциты ЦТЛ – Т-киллеры. Одна их часть становится цито- токсическими клетками – ЦТЛ, которые отличаются радиорезистентностью и устойчивостью к действию ингибиторов митоза. Образуется клон ЦТЛ со специфическими TCR+клетки иммунной памяти.
II стадия. В эту стадию Th 1 индукторы передают полученную информацию CD 8 + Т-клеткам , активируя их помощью γ -ИФН и ИЛ-2 эффекторов как за счет выработки γ -ИФН и ИЛ-2 , который является являетс фактором роста и созревания Т-клеток, так и непосредственно контактируют с АГ + МНС I с по- мощью TCR-рецептора и чужеродными клетками. Т-предшественники эффектора последовательно проходят ряд превращений до лимфобласта (3 митоза), больного (2 митоза), среднего (2 митоза) лимфоцита и, превращается в малые лимфоциты ЦТЛ – Т-киллеры. Одна их часть становится цито- токсическими клетками – ЦТЛ, которые отличаются радиорезистентностью и устойчивостью к действию ингибиторов митоза. Образуется клон ЦТЛ со специфическими TCR+клетки иммунной памяти.
 III стадия. Условия: 1. Требуется тесный контакт между эффекторной клеткой и ее мишенью. 2. Клетки-мишени лизируются в результате однократного взаимодействия с Т-киллером. 3. Акт лизиса происходит очень быстро за 40 -60 секунд. 4. Эффекторная клетка обязательно должна быть жизне- способной. 5. Клетка-мишень является совершенно пассивным партне- ром в акте лизиса. 6. Роль клетки-мишени заключается лишь в экспозиции антигена. 7. Клетка-мишень , атакованная эффекторной клеткой, неспо- собна восстанавливать свою мембрану и всегда погибает. 8. Эффекторная клетка , напротив, после взаимодействия с клеткой-мишенью и ее уничтожения выживает и может взаимодействовать с другими мишенями. ЦТЛ – это серийные киллеры. 9. Процесс Т-клеточного лизиса является циклическим.
III стадия. Условия: 1. Требуется тесный контакт между эффекторной клеткой и ее мишенью. 2. Клетки-мишени лизируются в результате однократного взаимодействия с Т-киллером. 3. Акт лизиса происходит очень быстро за 40 -60 секунд. 4. Эффекторная клетка обязательно должна быть жизне- способной. 5. Клетка-мишень является совершенно пассивным партне- ром в акте лизиса. 6. Роль клетки-мишени заключается лишь в экспозиции антигена. 7. Клетка-мишень , атакованная эффекторной клеткой, неспо- собна восстанавливать свою мембрану и всегда погибает. 8. Эффекторная клетка , напротив, после взаимодействия с клеткой-мишенью и ее уничтожения выживает и может взаимодействовать с другими мишенями. ЦТЛ – это серийные киллеры. 9. Процесс Т-клеточного лизиса является циклическим.
 Этапы литического цикла, осуществляемого Т-клетками. 1. Межклеточное взаимодействие – установление плот- ного контакта – интерфейс. На поверхности эффектор- ных ЦТЛ-лимфоцитов имеются специфические TCR = антигенузнающие рецепторы , по биохимической природе структурно сходные с иммуноглобулинами. Для процесса адгезии необходимы двухвалентные катионы: Mg 2+ требуется для связывания цитотоксической клетки с ее мишенью. Са 2+ выполняет двойную роль – участвует как в адгезии, так и в програмировании лизиса. Причем непосредст- венно сам лизис может происходить в отсутствии катионов. TCR Т-киллера соединяются с АГ, который находится на поверхности клетки-мишени в комплексе с МНС I клетки. Образуется зона контакта или « межклеточный интерфейс»
Этапы литического цикла, осуществляемого Т-клетками. 1. Межклеточное взаимодействие – установление плот- ного контакта – интерфейс. На поверхности эффектор- ных ЦТЛ-лимфоцитов имеются специфические TCR = антигенузнающие рецепторы , по биохимической природе структурно сходные с иммуноглобулинами. Для процесса адгезии необходимы двухвалентные катионы: Mg 2+ требуется для связывания цитотоксической клетки с ее мишенью. Са 2+ выполняет двойную роль – участвует как в адгезии, так и в програмировании лизиса. Причем непосредст- венно сам лизис может происходить в отсутствии катионов. TCR Т-киллера соединяются с АГ, который находится на поверхности клетки-мишени в комплексе с МНС I клетки. Образуется зона контакта или « межклеточный интерфейс»
 2. Програмирование лизиса или активация Т- киллера: 1) В клетках начинается синтез особых веществ – цитотоксинов. 2) Они накапливаются в гранулах , которые пере- двигаются и располагаются возле TCR. Такая локализация обеспечивает возможность строго направленного киллерного удара Т-лимфоцита на клетку-мишень. 3) Сами цитотоксины неспецифичны и одинаковы для всех антигенов. 4) При работе не повреждаются ни ЦТЛ , ни здоровые клетки тканей организма, а только измененные клетки, на которых экспрессированы АГ вирусов или других внеклеточных патогенов в комплексе с МНС I клетки.
2. Програмирование лизиса или активация Т- киллера: 1) В клетках начинается синтез особых веществ – цитотоксинов. 2) Они накапливаются в гранулах , которые пере- двигаются и располагаются возле TCR. Такая локализация обеспечивает возможность строго направленного киллерного удара Т-лимфоцита на клетку-мишень. 3) Сами цитотоксины неспецифичны и одинаковы для всех антигенов. 4) При работе не повреждаются ни ЦТЛ , ни здоровые клетки тканей организма, а только измененные клетки, на которых экспрессированы АГ вирусов или других внеклеточных патогенов в комплексе с МНС I клетки.
 3. Летальный удар – или экзоцистоз токсичес- ких субстанций. ЦТЛ связывает своим TCR антиген на поверхности клетки-мишени и в связи быстро формируется межклеточный интерфейс – зона контакта. В области этого контакта ЦТЛ вырабатывает содержимое гранул. Этот процесс зависит от Са 2+. Цитотоксины гранул ЦТЛ – это минимум три типа белков: - перфорины, - гранзимы, - гранулизины.
3. Летальный удар – или экзоцистоз токсичес- ких субстанций. ЦТЛ связывает своим TCR антиген на поверхности клетки-мишени и в связи быстро формируется межклеточный интерфейс – зона контакта. В области этого контакта ЦТЛ вырабатывает содержимое гранул. Этот процесс зависит от Са 2+. Цитотоксины гранул ЦТЛ – это минимум три типа белков: - перфорины, - гранзимы, - гранулизины.
 4. Разрушение клетки-мишени (токсическое воздействие) Механизмы повреждения: 1. Через пору внутрь клетки-мишени ЦТЛ инъецирует гранзимы А, В и С – это специализированные сериновые протеазы. Они действуют на специаль- ные ферменты, предназначенные для инициации программы апоптоза. При апоптозе активируются ферменты деградации нуклеиновых кислот и белков, что приводит к разрушению клетки и находящихся в ней вирусов. 2. Гранулизины – вещества с ферментативной актив- ностью, запускают апоптоз , повреждая мембрану митохондрий клеток-мишеней. 3. Кроме того через поры в клетку может входить вода , и клетки-мишени разрушаются за счет осмотичес- кого лизиса , но при этом могут не погибнуть вирусы или другие патогены.
4. Разрушение клетки-мишени (токсическое воздействие) Механизмы повреждения: 1. Через пору внутрь клетки-мишени ЦТЛ инъецирует гранзимы А, В и С – это специализированные сериновые протеазы. Они действуют на специаль- ные ферменты, предназначенные для инициации программы апоптоза. При апоптозе активируются ферменты деградации нуклеиновых кислот и белков, что приводит к разрушению клетки и находящихся в ней вирусов. 2. Гранулизины – вещества с ферментативной актив- ностью, запускают апоптоз , повреждая мембрану митохондрий клеток-мишеней. 3. Кроме того через поры в клетку может входить вода , и клетки-мишени разрушаются за счет осмотичес- кого лизиса , но при этом могут не погибнуть вирусы или другие патогены.
 4. ЦТЛ за счет апоптоза разрушает клетки в течение 5 мин. , после чего он атакует другую клетку-мишень, т. е. ЦТЛ является серийным киллером. 5. ЦТЛ еще продуцирует цитокин – ИФН- γ, ФНО- α, ФНО -β (лимфотоксин). ИФН-γ: 1 - прямо ингибирует репликацию вирусов; 2 - он индуцирует в клетках повышенную экспрессию МНС I и II кл. , что способствует более эффективному представлению вирусных антигенов для Т-лимфоцитов и киллинга; 3 - активирует макрофаги и NK. 4 - активирует дифференцировку из Th 0 - лимф – Th. I кор. За счет специфического распознавания Т-киллерами чужеродных антигенов на поверхности клетки-мишени в организме осуществляется направленный цитотокси- ческий удар на эти клетки и предотвращается разрушение собственных нормальных клеток.
4. ЦТЛ за счет апоптоза разрушает клетки в течение 5 мин. , после чего он атакует другую клетку-мишень, т. е. ЦТЛ является серийным киллером. 5. ЦТЛ еще продуцирует цитокин – ИФН- γ, ФНО- α, ФНО -β (лимфотоксин). ИФН-γ: 1 - прямо ингибирует репликацию вирусов; 2 - он индуцирует в клетках повышенную экспрессию МНС I и II кл. , что способствует более эффективному представлению вирусных антигенов для Т-лимфоцитов и киллинга; 3 - активирует макрофаги и NK. 4 - активирует дифференцировку из Th 0 - лимф – Th. I кор. За счет специфического распознавания Т-киллерами чужеродных антигенов на поверхности клетки-мишени в организме осуществляется направленный цитотокси- ческий удар на эти клетки и предотвращается разрушение собственных нормальных клеток.
 Т-лимфоцитзависимые эффекторные механизмы иммунитета: 1. Убийство клеток-мишеней цитотоксическими CD + 8 Т-лимфоцитами; 2. Иммунное воспаление тканей, называемое ГЗТ , которое организует CD + 4 Т-лимфоцит субпопуляции Th. I , а клетками исполнителями являются активированные макрофаги; 3. Иммунное восстановление тканей, вызываемое токсичными продуктами эозинофилов , активированных Th. II (ИЛ-5). Такое воспаление наблюдается при аллергических реакциях и отторжении трансплантанта.
Т-лимфоцитзависимые эффекторные механизмы иммунитета: 1. Убийство клеток-мишеней цитотоксическими CD + 8 Т-лимфоцитами; 2. Иммунное воспаление тканей, называемое ГЗТ , которое организует CD + 4 Т-лимфоцит субпопуляции Th. I , а клетками исполнителями являются активированные макрофаги; 3. Иммунное восстановление тканей, вызываемое токсичными продуктами эозинофилов , активированных Th. II (ИЛ-5). Такое воспаление наблюдается при аллергических реакциях и отторжении трансплантанта.
 Роль ЦТЛ: В этом процессе участвуют CD 8 + Т лимфоциты – ЦТЛ. TCR этих лимфоцитов распознает свой антиген с молекулами МНС I на мембране клеток собственного организма – это клетки-мишени. ЦТЛ являются киллерами-специалистами. Специализированный механизм киллинга локализован в гранулах ЦТЛ. Неиммунные зрелые CD + ЦТЛ после выхода из тимуса имеют только программу для биосинтеза эффекторных молекул.
Роль ЦТЛ: В этом процессе участвуют CD 8 + Т лимфоциты – ЦТЛ. TCR этих лимфоцитов распознает свой антиген с молекулами МНС I на мембране клеток собственного организма – это клетки-мишени. ЦТЛ являются киллерами-специалистами. Специализированный механизм киллинга локализован в гранулах ЦТЛ. Неиммунные зрелые CD + ЦТЛ после выхода из тимуса имеют только программу для биосинтеза эффекторных молекул.
 Иммунный ответ заканчивается образова- нием Т-супрессоров. Они взаимодействуют с активированными лимфоцитами, выделяют фактор белковой природы и блокируют ответ. IV стадия. В очаг воспаления устремляются макрофа- ги, нейтрофилы , NK -клетки которые фагоци- тируют разрушенные чужеродные клетки и очищают организм.
Иммунный ответ заканчивается образова- нием Т-супрессоров. Они взаимодействуют с активированными лимфоцитами, выделяют фактор белковой природы и блокируют ответ. IV стадия. В очаг воспаления устремляются макрофа- ги, нейтрофилы , NK -клетки которые фагоци- тируют разрушенные чужеродные клетки и очищают организм.
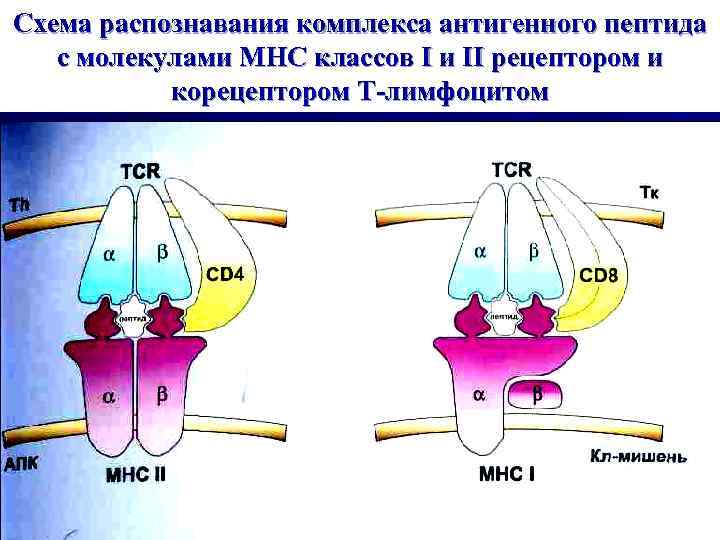
 Схема распознавания комплекса антигенного пептида с молекулами МНС классов I и II рецептором и корецептором Т-лимфоцитом
Схема распознавания комплекса антигенного пептида с молекулами МНС классов I и II рецептором и корецептором Т-лимфоцитом
 Схема взаимодействия Т-хелперов и антигенпредставляющих клеток. Роль костимулирующих молекул
Схема взаимодействия Т-хелперов и антигенпредставляющих клеток. Роль костимулирующих молекул
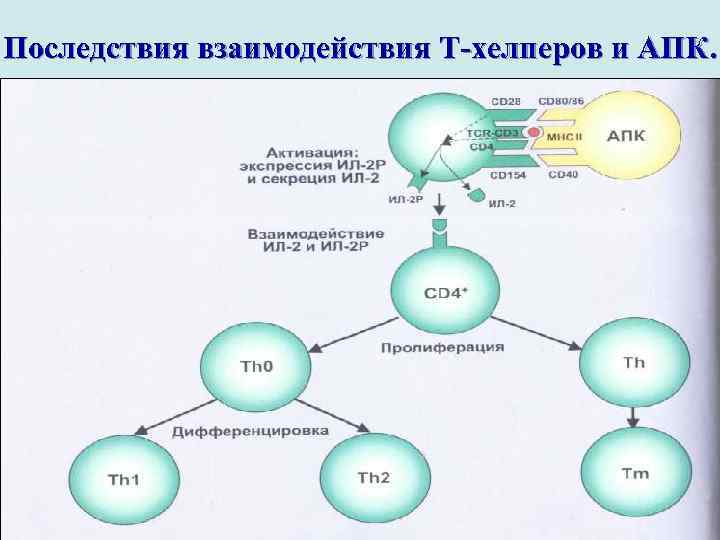
 Последствия взаимодействия Т-хелперов и АПК.
Последствия взаимодействия Т-хелперов и АПК.
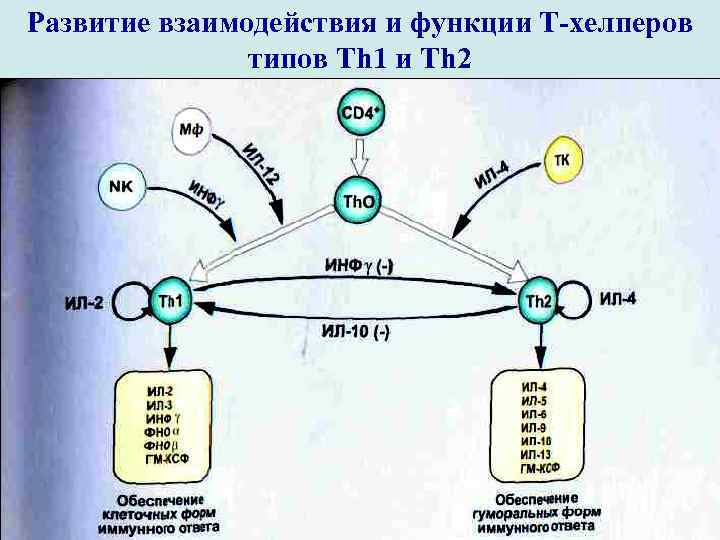
 Развитие взаимодействия и функции Т-хелперов типов Th 1 и Th 2
Развитие взаимодействия и функции Т-хелперов типов Th 1 и Th 2
 Формирование и активация цитотоксических Т-лимфоцитов
Формирование и активация цитотоксических Т-лимфоцитов
 Цитокины – это продуцируемые активированны- ми клетками низкомолекулярные белковые вещест- ва, осуществляющие эндогенную регуляцию межкле- точных взаимодействий всех звеньев иммунной системы, а также гемопоэза, воспаления и межсис- темных взаимодействий. Цитокины отличаются множественностью, разнообразием функций, струк- турой и еще многими свойствами и от нейромеди- аторов, и от гормонов внутренней секреции. Взаимо- действия посредством цитокинов более динамичны и оперативны благодаря определенным особенностям синтеза, секреции и рецепции цитокинов. В отличие от гормонов внутренней секреции в норме цитокины практически не попадают в системную циркуляцию и действуют локально в тканях в месте их выработки.
Цитокины – это продуцируемые активированны- ми клетками низкомолекулярные белковые вещест- ва, осуществляющие эндогенную регуляцию межкле- точных взаимодействий всех звеньев иммунной системы, а также гемопоэза, воспаления и межсис- темных взаимодействий. Цитокины отличаются множественностью, разнообразием функций, струк- турой и еще многими свойствами и от нейромеди- аторов, и от гормонов внутренней секреции. Взаимо- действия посредством цитокинов более динамичны и оперативны благодаря определенным особенностям синтеза, секреции и рецепции цитокинов. В отличие от гормонов внутренней секреции в норме цитокины практически не попадают в системную циркуляцию и действуют локально в тканях в месте их выработки.
 Цитокины определяют: - выживаемость клеток, - стимуляцию роста клеток, - дифференцировку клеток, - функциональную активацию, - апоптоз клеток
Цитокины определяют: - выживаемость клеток, - стимуляцию роста клеток, - дифференцировку клеток, - функциональную активацию, - апоптоз клеток
 Общие свойства: 1. Синтезируются в процессе реализации механизмов естественного или специфического иммунитета; 2. Проявляют свою активность при очень низких концентрациях (порядка 10 -11 моль/л); 3. Цитокины – это «эсперанто» в межклеточном обще- нии. Одноименные цитокины продуцируются клет- ками разной тканевой дифференцировки. И рецеп- торы для одноименных цитокинов экспрессированы на клетках различной тканевой дифференцировки. Именно посредством цитокинов в первую очередь система лимфоцитарного иммунитета сращена с другими биологическими системами резистентности к инфекциям и со всем организмом в целом.
Общие свойства: 1. Синтезируются в процессе реализации механизмов естественного или специфического иммунитета; 2. Проявляют свою активность при очень низких концентрациях (порядка 10 -11 моль/л); 3. Цитокины – это «эсперанто» в межклеточном обще- нии. Одноименные цитокины продуцируются клет- ками разной тканевой дифференцировки. И рецеп- торы для одноименных цитокинов экспрессированы на клетках различной тканевой дифференцировки. Именно посредством цитокинов в первую очередь система лимфоцитарного иммунитета сращена с другими биологическими системами резистентности к инфекциям и со всем организмом в целом.
 4. Цитокины не депонируются в клетках, а синтезируются импульсно «по запросу» , начиная с транскрипции м. РНК цитокина соответствующего гена. Исключение – депонирование небольших количеств TNF -а в гранулах тучных клеток и, возможно, еще IL -1 депонируется в некоторых количествах в кератиноцитах. Матричная РНК цитокинов короткоживущая, что объясняет тран- зиторный характер их продукции клеткой: они вырабатываются вскоре после получения «зап- роса» на их продукцию и недолго. 5. Для цитокинов характерна взаимосвязь друг с другом по типу «передай другому» : воздействие одного цитокина на клетку вызывает выработку этой клеткой других цитокинов. Это явление называют цитокиновым каскадом.
4. Цитокины не депонируются в клетках, а синтезируются импульсно «по запросу» , начиная с транскрипции м. РНК цитокина соответствующего гена. Исключение – депонирование небольших количеств TNF -а в гранулах тучных клеток и, возможно, еще IL -1 депонируется в некоторых количествах в кератиноцитах. Матричная РНК цитокинов короткоживущая, что объясняет тран- зиторный характер их продукции клеткой: они вырабатываются вскоре после получения «зап- роса» на их продукцию и недолго. 5. Для цитокинов характерна взаимосвязь друг с другом по типу «передай другому» : воздействие одного цитокина на клетку вызывает выработку этой клеткой других цитокинов. Это явление называют цитокиновым каскадом.
 6. Цитокины служат медиаторами иммунной и воспалительной реакций и обладают следую- щими эффектами: а) аутокринным – действуют на те же клетки, которые продуцируют их; б) паракринным – влияют на различные типы клеток, находящиеся в непосредственной близости от клеток – продуцентов; в) эндокринным – действуют как гормоны, оказывают системные (системной или дистант- ной) действие. При этом цитокины достигают клеток мишеней с кровью. Эндокринные эффекты выявлены только для 4 цитокинов (TNF - α , IL-1, IL-6, M-CSF) и не у здоровых организмов, а при тяжелой системной патологии типа септического шока.
6. Цитокины служат медиаторами иммунной и воспалительной реакций и обладают следую- щими эффектами: а) аутокринным – действуют на те же клетки, которые продуцируют их; б) паракринным – влияют на различные типы клеток, находящиеся в непосредственной близости от клеток – продуцентов; в) эндокринным – действуют как гормоны, оказывают системные (системной или дистант- ной) действие. При этом цитокины достигают клеток мишеней с кровью. Эндокринные эффекты выявлены только для 4 цитокинов (TNF - α , IL-1, IL-6, M-CSF) и не у здоровых организмов, а при тяжелой системной патологии типа септического шока.
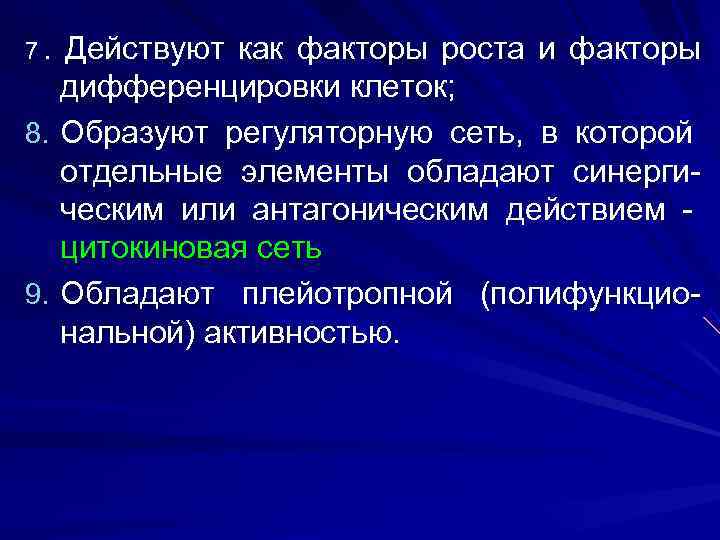
 7. Действуют как факторы роста и факторы дифференцировки клеток; 8. Образуют регуляторную сеть, в которой отдельные элементы обладают синерги- ческим или антагоническим действием - цитокиновая сеть 9. Обладают плейотропной (полифункцио- нальной) активностью.
7. Действуют как факторы роста и факторы дифференцировки клеток; 8. Образуют регуляторную сеть, в которой отдельные элементы обладают синерги- ческим или антагоническим действием - цитокиновая сеть 9. Обладают плейотропной (полифункцио- нальной) активностью.
 Классификация: I. В зависимости от того, какие клетки преимущественно синтезируют тот или иной цитокин, различают: 1 – интерлейкины 2 – монокины 3 – лимфокины 4 – интерфероны JFN
Классификация: I. В зависимости от того, какие клетки преимущественно синтезируют тот или иной цитокин, различают: 1 – интерлейкины 2 – монокины 3 – лимфокины 4 – интерфероны JFN
 II. По биологической активности все цитокины разделяют на 3 группы: 1. Цитокины – регуляторы воспалительных процессов. К ним относят: ИЛ-8, PF -тромбоцитарный фактор, MIP -1 α - макрофагальный белок воспаления; макрофагальный хемотаксический фактор, ИЛ-1; ИЛ-6, JNF α, CSF и др. 1) провоспалительные – ИЛ-1, 6, 8, 12, α-ФНО, ГМ-КСФ, Г-КСФ; 2) противовоспалительные – ИЛ-4, 10, 13, TGF-β. 2. Цитокины – регуляторы «клеточного» антигенспецифичес- кого иммунного ответа: ИЛ-1, ИЛ-2, ИЛ-10, 12, γJFN, Jho, Jh. I 3. Цитокины – регуляторы «гуморального» антигенспецифи- ческого иммунного ответа: ИЛ-4, 5, 6, 10, 13, 14; JNFγ, Jho, Jh. II.
II. По биологической активности все цитокины разделяют на 3 группы: 1. Цитокины – регуляторы воспалительных процессов. К ним относят: ИЛ-8, PF -тромбоцитарный фактор, MIP -1 α - макрофагальный белок воспаления; макрофагальный хемотаксический фактор, ИЛ-1; ИЛ-6, JNF α, CSF и др. 1) провоспалительные – ИЛ-1, 6, 8, 12, α-ФНО, ГМ-КСФ, Г-КСФ; 2) противовоспалительные – ИЛ-4, 10, 13, TGF-β. 2. Цитокины – регуляторы «клеточного» антигенспецифичес- кого иммунного ответа: ИЛ-1, ИЛ-2, ИЛ-10, 12, γJFN, Jho, Jh. I 3. Цитокины – регуляторы «гуморального» антигенспецифи- ческого иммунного ответа: ИЛ-4, 5, 6, 10, 13, 14; JNFγ, Jho, Jh. II.
 III. По функциональному предназначению с известной долей относительности выделяют 4 группы цитокинов: 1. Медиаторы доиммунного медиатора 2. Регуляторы активации, пролиферации и дифференцировки лимфоцитов. 3. Регуляторы иммунного воспаления. 4. Факторы роста клеток – предшественников гемопоэза.
III. По функциональному предназначению с известной долей относительности выделяют 4 группы цитокинов: 1. Медиаторы доиммунного медиатора 2. Регуляторы активации, пролиферации и дифференцировки лимфоцитов. 3. Регуляторы иммунного воспаления. 4. Факторы роста клеток – предшественников гемопоэза.
 VI. По семейству (семейство –это гомологичные по структуре молекулы): 1. Семейство цитокинов- гематопоэтинов. 2. Семейство интерферонов (IFN)-α, β, γ. 3. «Бессемейственные» цитокины: трансформи- рующий фактор роста TGF - β , ИЛ-1 α , 1 β ; ИЛ-10, ИЛ-12, ИЛ-16, ИЛ-17, ИЛ-18, MIF. 4. Семейство молекул TNF или ФНО (α- TNF )
VI. По семейству (семейство –это гомологичные по структуре молекулы): 1. Семейство цитокинов- гематопоэтинов. 2. Семейство интерферонов (IFN)-α, β, γ. 3. «Бессемейственные» цитокины: трансформи- рующий фактор роста TGF - β , ИЛ-1 α , 1 β ; ИЛ-10, ИЛ-12, ИЛ-16, ИЛ-17, ИЛ-18, MIF. 4. Семейство молекул TNF или ФНО (α- TNF )
 Хемокины — это цитокины специального назна- чения: они привлекают в очаг воспаления лимфоциты и лейкоциты из циркулирующей крови. Молекулы хемокинов невелики, состоят из 66 -76 аминокислотных остатков. Они обладают свойством связываться с молекулами межклеточного матрик- са, с одной стороны, и обратимо связывать свои молекулы-лиганды на мембране клетки-мишени, с другой. Хемокин диффундирует от клетки-проду- цента по межклеточному матриксу, при этом создается градиент его концентрации, нарастающей по мере приближения к месту продукции хемокина. Нужный лимфоцит или лейкоцит «прыгает» по молекулам хемокина, фиксированным на матриксе, как с кочки на кочку.
Хемокины — это цитокины специального назна- чения: они привлекают в очаг воспаления лимфоциты и лейкоциты из циркулирующей крови. Молекулы хемокинов невелики, состоят из 66 -76 аминокислотных остатков. Они обладают свойством связываться с молекулами межклеточного матрик- са, с одной стороны, и обратимо связывать свои молекулы-лиганды на мембране клетки-мишени, с другой. Хемокин диффундирует от клетки-проду- цента по межклеточному матриксу, при этом создается градиент его концентрации, нарастающей по мере приближения к месту продукции хемокина. Нужный лимфоцит или лейкоцит «прыгает» по молекулам хемокина, фиксированным на матриксе, как с кочки на кочку.
 По особенностям химической структуры молекулы хемокины делят минимум на 6 групп (семейств): СС — содержат два остатка цистеина подряд; ELR +- CXC — содержат в том же месте два остатка цистеина, разделенных вариабельной аминокислотой ( X ), перед ними расположены остатки глутамина (Е), лейцина ( L ), аргинина ( R ) — такие хемокины являются аттрактантами для нейтрофилов; ELR-- CXC — содержат в том же месте два остатка цистеина, разделенных вариабельной аминокислотой ( X ), перед ними расположены другие аминокислоты (не Glu — Leu — Arg ) такие хемокины являются аттрактантными для лимфоцитов; С — содержит один остаток цистеина в гомологичном месте молекулы; СХХХС (или СХЗС) — содержат два остатка цистеина, разделенных какими-либо 3 аминокислотными остатками; 6 -цистеин-СС — содержат, кроме двух остатков цистеина, еще один остаток цистеина в 6 -м положении.
По особенностям химической структуры молекулы хемокины делят минимум на 6 групп (семейств): СС — содержат два остатка цистеина подряд; ELR +- CXC — содержат в том же месте два остатка цистеина, разделенных вариабельной аминокислотой ( X ), перед ними расположены остатки глутамина (Е), лейцина ( L ), аргинина ( R ) — такие хемокины являются аттрактантами для нейтрофилов; ELR-- CXC — содержат в том же месте два остатка цистеина, разделенных вариабельной аминокислотой ( X ), перед ними расположены другие аминокислоты (не Glu — Leu — Arg ) такие хемокины являются аттрактантными для лимфоцитов; С — содержит один остаток цистеина в гомологичном месте молекулы; СХХХС (или СХЗС) — содержат два остатка цистеина, разделенных какими-либо 3 аминокислотными остатками; 6 -цистеин-СС — содержат, кроме двух остатков цистеина, еще один остаток цистеина в 6 -м положении.
 Семейство цитокинов - гемопоэтинов. Еро (эритропоэтин): в молекуле 165 аминокислотных остатков, мономер. Клетки-продуценты - клетки почки и гепатоциты. Биологический эффект: стимуляция эритропоэза. Нокаут гена Еро или гена рецептора для него приводит к гибели организма в эмбриональном периоде. Интерлейкин-2 ( IL -2): в молекуле 133 аминокислотных остатка, мономер. Рецепторы: CD 25, CD 122 и CD 132 Клетки - продуценты IL-2: активированные Т-лимфоциты (субпопуляция Тh).
Семейство цитокинов - гемопоэтинов. Еро (эритропоэтин): в молекуле 165 аминокислотных остатков, мономер. Клетки-продуценты - клетки почки и гепатоциты. Биологический эффект: стимуляция эритропоэза. Нокаут гена Еро или гена рецептора для него приводит к гибели организма в эмбриональном периоде. Интерлейкин-2 ( IL -2): в молекуле 133 аминокислотных остатка, мономер. Рецепторы: CD 25, CD 122 и CD 132 Клетки - продуценты IL-2: активированные Т-лимфоциты (субпопуляция Тh).
 Основные биологические эффекты от сигнала IL-2 - стимуляция пролиферации Т- и NK-клеток. Нокаут гена IL-2 приводит к резкому снижению пролиферации Т-лимфоцитов и досрочному апоптозу Т- лимфоцитов. Нокаут гена IL-2 Rα приводит к недоразвитию Т-лимфоцитов. Нокаут гена IL-2 Rβ приводит к развитию аутоиммунных процессов, зависящих от Т-лимфоцитов. Интерлейкин-3 ( IL -3), мультиколониестимулирующий фактор, костимулятор пролиферации и дифференцировки всех ранних ростков гемопоэза. Рецептор - CD 123 . эпителиальные клетки стромы тимуса. Нокаут гена IL-3 приводит к нечувствительности ткани костного мозга к воздействиям GM - CSF и IL -5. Н клеточном уровне нарушено развитие эозинофилов.
Основные биологические эффекты от сигнала IL-2 - стимуляция пролиферации Т- и NK-клеток. Нокаут гена IL-2 приводит к резкому снижению пролиферации Т-лимфоцитов и досрочному апоптозу Т- лимфоцитов. Нокаут гена IL-2 Rα приводит к недоразвитию Т-лимфоцитов. Нокаут гена IL-2 Rβ приводит к развитию аутоиммунных процессов, зависящих от Т-лимфоцитов. Интерлейкин-3 ( IL -3), мультиколониестимулирующий фактор, костимулятор пролиферации и дифференцировки всех ранних ростков гемопоэза. Рецептор - CD 123 . эпителиальные клетки стромы тимуса. Нокаут гена IL-3 приводит к нечувствительности ткани костного мозга к воздействиям GM - CSF и IL -5. Н клеточном уровне нарушено развитие эозинофилов.
 Интерлейкин-4 ( IL -4): в молекуле 129 аминокислотных остатков. Рецепторы: CD 124, CD 132. Клетки-продуценты: Т-лимфоциты с Th 2, тучные клетки. Внутри клетки рецепторы для IL-4 активируют главным образом молекулы STAT 6. Молекулы STAT 6 и Bc 1 - обладают сродством к одним и тем же последо- вательностям в ДНК, но Bc 1 -6 ингибирует, a STAT 6 активирует транскрипцию. Биологические эффекты: иммунное отклонение дифференцировки CD 4+ Т-лим фоцитов в сторону Th 2, активация В-лимфоцитов, переключение синтеза класса иммуноглобулинов на Е. В макрофагах STAT 6 индуцирует биосинтез антагониста рецептора для IL -1 (это единственный известный для сигнала от IL -4 противовоспалительный эффект). Нокаут гена IL -4 или гена рецептора, а также гена STAT 6 приводит к отсутствию Th 2, снижению биосинтеза Ig. E. Нокаут гена Bcl -6 приводит к гипертрофии Th 2 и патологическому преобладанию Т h 2 -зависимых процессов иммунног воспаления.
Интерлейкин-4 ( IL -4): в молекуле 129 аминокислотных остатков. Рецепторы: CD 124, CD 132. Клетки-продуценты: Т-лимфоциты с Th 2, тучные клетки. Внутри клетки рецепторы для IL-4 активируют главным образом молекулы STAT 6. Молекулы STAT 6 и Bc 1 - обладают сродством к одним и тем же последо- вательностям в ДНК, но Bc 1 -6 ингибирует, a STAT 6 активирует транскрипцию. Биологические эффекты: иммунное отклонение дифференцировки CD 4+ Т-лим фоцитов в сторону Th 2, активация В-лимфоцитов, переключение синтеза класса иммуноглобулинов на Е. В макрофагах STAT 6 индуцирует биосинтез антагониста рецептора для IL -1 (это единственный известный для сигнала от IL -4 противовоспалительный эффект). Нокаут гена IL -4 или гена рецептора, а также гена STAT 6 приводит к отсутствию Th 2, снижению биосинтеза Ig. E. Нокаут гена Bcl -6 приводит к гипертрофии Th 2 и патологическому преобладанию Т h 2 -зависимых процессов иммунног воспаления.
 Интерлейкин-5 ( IL -5): в молекуле 115 аминокислотных остатка. Рецептор - CD 125. Клетки-продуценты : субпопуляция Th 2 и тучные клетки. Биологические эффекты : дифференцировка и активация эозинофилов. Нокаут гена IL -5 приводит к снижению уровня эозинофилов, снижению биосинтеза Ig. E и Ig. Gl , а также биосинтеза IL-9 и 10. Интерлейкин-6 ( IL -6): в молекуле 184 аминокислотных остатка. Рецепторы : CD 126 (α-цепь), CD 130. Клетки-продуценты лимфоциты, макрофаги, клетки эндотелия. Биологические эффекты : локально стимулирует пролиферацию и дифференцировку Т- и В-лимфоцитов. Системные эффекты : стимуляция продукции печенью белков острой фазы, индукция лихорадки. Поддерживает рост клеток линии ES ( «эмбриональные стволовые клетки» ). Нокаут гена IL -6 приводит к ингибиции системных реакций острой фазы, а также снижению биосинтеза Ig. A. Интерлейкин-7 ( IL -7): в молекуле 152 аминокислотных остатка. Рецепторы: CD 127, CD 132. Клетки-продуценты — строма костного мозга. Поддерживает пролиферацию пре-В- и пре-Т- лимфоцитов. Нокаут гена IL -7 приводит к развитию синдрома тяжелого комбинированного иммунодефицита (SCID).
Интерлейкин-5 ( IL -5): в молекуле 115 аминокислотных остатка. Рецептор - CD 125. Клетки-продуценты : субпопуляция Th 2 и тучные клетки. Биологические эффекты : дифференцировка и активация эозинофилов. Нокаут гена IL -5 приводит к снижению уровня эозинофилов, снижению биосинтеза Ig. E и Ig. Gl , а также биосинтеза IL-9 и 10. Интерлейкин-6 ( IL -6): в молекуле 184 аминокислотных остатка. Рецепторы : CD 126 (α-цепь), CD 130. Клетки-продуценты лимфоциты, макрофаги, клетки эндотелия. Биологические эффекты : локально стимулирует пролиферацию и дифференцировку Т- и В-лимфоцитов. Системные эффекты : стимуляция продукции печенью белков острой фазы, индукция лихорадки. Поддерживает рост клеток линии ES ( «эмбриональные стволовые клетки» ). Нокаут гена IL -6 приводит к ингибиции системных реакций острой фазы, а также снижению биосинтеза Ig. A. Интерлейкин-7 ( IL -7): в молекуле 152 аминокислотных остатка. Рецепторы: CD 127, CD 132. Клетки-продуценты — строма костного мозга. Поддерживает пролиферацию пре-В- и пре-Т- лимфоцитов. Нокаут гена IL -7 приводит к развитию синдрома тяжелого комбинированного иммунодефицита (SCID).
 Интерлейкин-9 ( IL -9 ): в молекуле 125 аминокислотных остатков. Рецептор - IL-9 R. Клетки-продуценты - Th 2 -лимфоциты. Биологический эффект - усиление активности тучных клеток. Интерлейкин-13 (IL-13) (P 600): в молекуле 132 аминокислотных остатка. Рецепторы : IL -13 R (общая γ-цепь CD 132). Клетк продуценты - Th 2. Биологические эффекты : аналог IL -4 сдвигает иммунное отклонение в пользу Th 2, способствует переключению биосинтеза иммуноглобулинов на Ig. E ; ингибирует продукцию провоспалительных цитокинов макрофагами; ингибирует дифференцировку Т h ; поддерживает пролиферацию и дифференцировку В-лимфоцитов. Интерлейкин-15 ( IL -15): в молекуле 114 аминокислотных остатков. Рецепторы: IL-15 R (CD 122), CD 132. Клетки-продуценты - Т-лимфоциты. Биологические эффекты : стимулирует пролиферацию Т-лимфоцитов и NK подобно IL -2; стимулирует пролиферацию эпителия кишки (энтероцитов). Нарушение проведения сигнала с рецептора для IL-15 приводит к тому, что в организме отсутствуют NK.
Интерлейкин-9 ( IL -9 ): в молекуле 125 аминокислотных остатков. Рецептор - IL-9 R. Клетки-продуценты - Th 2 -лимфоциты. Биологический эффект - усиление активности тучных клеток. Интерлейкин-13 (IL-13) (P 600): в молекуле 132 аминокислотных остатка. Рецепторы : IL -13 R (общая γ-цепь CD 132). Клетк продуценты - Th 2. Биологические эффекты : аналог IL -4 сдвигает иммунное отклонение в пользу Th 2, способствует переключению биосинтеза иммуноглобулинов на Ig. E ; ингибирует продукцию провоспалительных цитокинов макрофагами; ингибирует дифференцировку Т h ; поддерживает пролиферацию и дифференцировку В-лимфоцитов. Интерлейкин-15 ( IL -15): в молекуле 114 аминокислотных остатков. Рецепторы: IL-15 R (CD 122), CD 132. Клетки-продуценты - Т-лимфоциты. Биологические эффекты : стимулирует пролиферацию Т-лимфоцитов и NK подобно IL -2; стимулирует пролиферацию эпителия кишки (энтероцитов). Нарушение проведения сигнала с рецептора для IL-15 приводит к тому, что в организме отсутствуют NK.
 Гранулоцит-колониестимулирующий фактор (G-CSF): Рецептор - G - CSFR. Клетки-продуценты : фибробласты фибробласт моноциты. Биологический эффект — поддерживает развитие нейтрофилов в костном мозге. При генетическом нокауте - дефекты миелопоэза, нейтропения. Гранулоцит-моноцит-колониестимулирующий фактор ( GM - CSF ): в молекуле 127 аминокислотн остатков. Рецептор - CD 116 (β-цепь). Клетки-продуценты : макрофаги, Т-лимфоциты. Биологические эффекты : поддерживает пролиферацию и дифференцировку ростков миелопоэза и моноцитопоэза в костном мозге. При нокауте гена развивается легочный альвеолярный протеинозис. Лейкоз-ингибирующий фактор ( LIF ): в молекуле 179 аминокислотных остатков. Рецепторы: LIFR, CD 130. Клетки -продуценты - фибробласты стромы костного мозга. Поддерживает рост клеток линии ES. Нокаут гена LIFR приводит к смерти животного при рождении или вскоре после него, при этом наблюдают острое истощение пула стволовых кроветворных клеток.
Гранулоцит-колониестимулирующий фактор (G-CSF): Рецептор - G - CSFR. Клетки-продуценты : фибробласты фибробласт моноциты. Биологический эффект — поддерживает развитие нейтрофилов в костном мозге. При генетическом нокауте - дефекты миелопоэза, нейтропения. Гранулоцит-моноцит-колониестимулирующий фактор ( GM - CSF ): в молекуле 127 аминокислотн остатков. Рецептор - CD 116 (β-цепь). Клетки-продуценты : макрофаги, Т-лимфоциты. Биологические эффекты : поддерживает пролиферацию и дифференцировку ростков миелопоэза и моноцитопоэза в костном мозге. При нокауте гена развивается легочный альвеолярный протеинозис. Лейкоз-ингибирующий фактор ( LIF ): в молекуле 179 аминокислотных остатков. Рецепторы: LIFR, CD 130. Клетки -продуценты - фибробласты стромы костного мозга. Поддерживает рост клеток линии ES. Нокаут гена LIFR приводит к смерти животного при рождении или вскоре после него, при этом наблюдают острое истощение пула стволовых кроветворных клеток.
 Семейство интерферонов (IFN). Известно 3 типа интерферонов: IFN-α, IFN-β, IFN-γ. Interfere with - мешать (репликации вирусов). IFN -γ - единственный, иммунным интерфероном, так как именно и только его продуцируют иммунные Т-лимфоциты - субпопуляции Th 1, CD 8+ ЦТЛ и NK. IFN -γ, продукт единственного структурного гена, полипептид из 143 остатков аминокислот, мономер. Рецептор для IFN -γ, мембранная молекула CD 119, состоит из α- и β-цепей.
Семейство интерферонов (IFN). Известно 3 типа интерферонов: IFN-α, IFN-β, IFN-γ. Interfere with - мешать (репликации вирусов). IFN -γ - единственный, иммунным интерфероном, так как именно и только его продуцируют иммунные Т-лимфоциты - субпопуляции Th 1, CD 8+ ЦТЛ и NK. IFN -γ, продукт единственного структурного гена, полипептид из 143 остатков аминокислот, мономер. Рецептор для IFN -γ, мембранная молекула CD 119, состоит из α- и β-цепей.
 Описаны люди с мутациями в генах обеих цепей рецептора для IFN -γ, клинически у них наблюдается иммунодефицит со снижением резистентности к внутриклеточным бактериальным инфекциям. IFN -γ индуцирует также экспрессию супрессорной молекулы SOCS-1.
Описаны люди с мутациями в генах обеих цепей рецептора для IFN -γ, клинически у них наблюдается иммунодефицит со снижением резистентности к внутриклеточным бактериальным инфекциям. IFN -γ индуцирует также экспрессию супрессорной молекулы SOCS-1.
 Главные биологические эффекты IFN-γ следующие: является самым сильным активатором макро- фагов. Именно посредством цитокина IFN -γ, Thl , ЦТЛ и NK «нанимают» макрофаги для выполнения деструктивных функций в отношении тканей, поврежденных антигеном в очаге воспаления. В деструкцию вовлекаются и прилегающие клетки окружающих тканей. Активированные макрофаги выделяют кислородные радикалы, радикал окиси азота, гидролитические ферменты, которые, пыта- ясь разрушить патоген, травмируют и собственные клетки. Очаги «Т h 1 - макрофаг» -опосредованного воспаления в коже и есть то, что называют исторически оставшимся в употреблении терми- ном «гиперчувствительность замедленного типа» (ГЗТ);
Главные биологические эффекты IFN-γ следующие: является самым сильным активатором макро- фагов. Именно посредством цитокина IFN -γ, Thl , ЦТЛ и NK «нанимают» макрофаги для выполнения деструктивных функций в отношении тканей, поврежденных антигеном в очаге воспаления. В деструкцию вовлекаются и прилегающие клетки окружающих тканей. Активированные макрофаги выделяют кислородные радикалы, радикал окиси азота, гидролитические ферменты, которые, пыта- ясь разрушить патоген, травмируют и собственные клетки. Очаги «Т h 1 - макрофаг» -опосредованного воспаления в коже и есть то, что называют исторически оставшимся в употреблении терми- ном «гиперчувствительность замедленного типа» (ГЗТ);
 активирует также NK к осуществлению ими цитолиза клеток-мишеней; индуцирует экспрессию на клетках белков MHC - I и МНС- II , тем самым способствуя представлению антигенов (в том числе и вирусных) для Т- лимфоцитов, способствуя прогрессивному развитию противовирусного иммунного ответа; IFN - , продуцируемый CD 8+ ЦТЛ, вносит сво вклад в противовирусное действие ЦТЛ; является локальным кофактором в направлении дифференцировки CD 4+ Th 0 -клеток в Тh 1; участвует в переключении биосинтеза изотипов иммуноглобулинов.
активирует также NK к осуществлению ими цитолиза клеток-мишеней; индуцирует экспрессию на клетках белков MHC - I и МНС- II , тем самым способствуя представлению антигенов (в том числе и вирусных) для Т- лимфоцитов, способствуя прогрессивному развитию противовирусного иммунного ответа; IFN - , продуцируемый CD 8+ ЦТЛ, вносит сво вклад в противовирусное действие ЦТЛ; является локальным кофактором в направлении дифференцировки CD 4+ Th 0 -клеток в Тh 1; участвует в переключении биосинтеза изотипов иммуноглобулинов.
 При нокауте гена IFN - или рецептора для него наблюдают сниженную резистентность организма к бактериальным инфекциям, особенно микобакте- риальным, а также к некоторым вирусам. IFN - индуцирует такие гены, как ген интерферонов и , хемокина RANTES , молекулы адгезии ICAM -1, NO -синтазы, MHC - II , Fa Fas. L и каспаз. Внутри клетки сигнал от рецептора для IFN - y проводят молекулы STAT 1. IFN блокирует процессы ангиогенеза в опухолевой ткани. IFN - - это семейство из 20 близкородственных полипептидов , состоящих из 166 аминокислотных остатков. Рецептор для них один - CD 118. IFN - продуцируют лейкоциты, поэтому его(их) еще называют лейкоцитарным интерфероном. IFN - продуцируют фибробласты , поэтому ег называют фибробластным интерфероном, состоит из 166 остатков аминокислот. Рецептор - CD 118.
При нокауте гена IFN - или рецептора для него наблюдают сниженную резистентность организма к бактериальным инфекциям, особенно микобакте- риальным, а также к некоторым вирусам. IFN - индуцирует такие гены, как ген интерферонов и , хемокина RANTES , молекулы адгезии ICAM -1, NO -синтазы, MHC - II , Fa Fas. L и каспаз. Внутри клетки сигнал от рецептора для IFN - y проводят молекулы STAT 1. IFN блокирует процессы ангиогенеза в опухолевой ткани. IFN - - это семейство из 20 близкородственных полипептидов , состоящих из 166 аминокислотных остатков. Рецептор для них один - CD 118. IFN - продуцируют лейкоциты, поэтому его(их) еще называют лейкоцитарным интерфероном. IFN - продуцируют фибробласты , поэтому ег называют фибробластным интерфероном, состоит из 166 остатков аминокислот. Рецептор - CD 118.
 Биологические свойства IFN - и , одинаковы. П совокупности эти интерфероны проявляют противовирусное действие и усиливают экспрессию молекул MHC-I. Естественным индуктором биосинтеза IFN- и являются двуспиральные РНК , которых в норме не бывает в эукариотических клетках, но которые являются характерным продуктом в жизненном цикле многих вирусов. При нокауте гена IFN - наблюдают снижени противовирусной резистентности организма. IFN - и индуцируют транскрипцию с генов, продукты которых способны подавлять репликацию вирусов и редупликацию собственной ДНК клетки и, следовательно, пролиферацию клеток. На этом основано применение интерферонов при онкологических заболеваниях в тех случаях, когда на опухолевых клетках экспрессированы рецепторы для интерферонов.
Биологические свойства IFN - и , одинаковы. П совокупности эти интерфероны проявляют противовирусное действие и усиливают экспрессию молекул MHC-I. Естественным индуктором биосинтеза IFN- и являются двуспиральные РНК , которых в норме не бывает в эукариотических клетках, но которые являются характерным продуктом в жизненном цикле многих вирусов. При нокауте гена IFN - наблюдают снижени противовирусной резистентности организма. IFN - и индуцируют транскрипцию с генов, продукты которых способны подавлять репликацию вирусов и редупликацию собственной ДНК клетки и, следовательно, пролиферацию клеток. На этом основано применение интерферонов при онкологических заболеваниях в тех случаях, когда на опухолевых клетках экспрессированы рецепторы для интерферонов.
 Один из известных антипролиферативных механизмов действия интерферонов заключается в индукции ими синтеза особого фермента - олигоаденилатсинтетазы , которая полимеризует АТФ в 2'-5'-олигомеры, тогда как в нормальных природных нуклеиновых кислотах нуклеотиды связаны по 3'-5'-позициям. Аномальные 2'-5'-олигонуклео- тиды активируют эндорибонуклеазы, которые расщепляют РНК, в том числе вирусную. Еще один известный белок, индуцируемый IFN - и - серин/треонинкиназа (Р 1). Эта киназа избирательно фосфорилирует и тем самым инактивирует некий фактор e. IF -2, инициирующий синтез белков в эукариотических клетках, в результате чего тормозится трансляция белков, что препятствует в том числе и репликации вирусов в клетке. IFN - и индуцируют экспрессию молекул MHC - I (но не МНС-П в отличие от IFN - ), что способствует распознава- нию вирусинфицированных клеток CD 8+ Т-лимфо-цитами (ЦТЛ). IFN - и активируют NK к лизису вирусинфициро- ванных клеток. Повышение экспрессии MHC-I на неинфици- рованных клетках способствует их защите от киллерной атаки NK.
Один из известных антипролиферативных механизмов действия интерферонов заключается в индукции ими синтеза особого фермента - олигоаденилатсинтетазы , которая полимеризует АТФ в 2'-5'-олигомеры, тогда как в нормальных природных нуклеиновых кислотах нуклеотиды связаны по 3'-5'-позициям. Аномальные 2'-5'-олигонуклео- тиды активируют эндорибонуклеазы, которые расщепляют РНК, в том числе вирусную. Еще один известный белок, индуцируемый IFN - и - серин/треонинкиназа (Р 1). Эта киназа избирательно фосфорилирует и тем самым инактивирует некий фактор e. IF -2, инициирующий синтез белков в эукариотических клетках, в результате чего тормозится трансляция белков, что препятствует в том числе и репликации вирусов в клетке. IFN - и индуцируют экспрессию молекул MHC - I (но не МНС-П в отличие от IFN - ), что способствует распознава- нию вирусинфицированных клеток CD 8+ Т-лимфо-цитами (ЦТЛ). IFN - и активируют NK к лизису вирусинфициро- ванных клеток. Повышение экспрессии MHC-I на неинфици- рованных клетках способствует их защите от киллерной атаки NK.
 «Бессемейственные» цитокины. Трансформирующий фактор роста- ( TGF - - transforming grows factor - ): в молекуле 112 аминокислотных остатков. Клетки-продуценты: хондроциты, активированные моноциты, активированные Т-лимфоциты. Биологические эффекты TGF- : индуцирует синтез белков межклеточного матрикса - коллагенов, индуцирует на клетках экспрессию рецепторов для межклеточного матрикса способствует росту кровеносных сосудов (ангиогенезу) при регенерации и репарации тканей. TGF- является самым сильным ингибитором пролиферации лимфоцитов, ингибирует функциональное созревание ЦТЛ, ингибирует активацию макрофагов и полиморфно-ядерных лейкоцитов, ингибирует активацию эндотелия другими цитокинами провоспалительной «направленности» . Нокаут гена TGF - 1 приводит летальным воспалительным процессам.
«Бессемейственные» цитокины. Трансформирующий фактор роста- ( TGF - - transforming grows factor - ): в молекуле 112 аминокислотных остатков. Клетки-продуценты: хондроциты, активированные моноциты, активированные Т-лимфоциты. Биологические эффекты TGF- : индуцирует синтез белков межклеточного матрикса - коллагенов, индуцирует на клетках экспрессию рецепторов для межклеточного матрикса способствует росту кровеносных сосудов (ангиогенезу) при регенерации и репарации тканей. TGF- является самым сильным ингибитором пролиферации лимфоцитов, ингибирует функциональное созревание ЦТЛ, ингибирует активацию макрофагов и полиморфно-ядерных лейкоцитов, ингибирует активацию эндотелия другими цитокинами провоспалительной «направленности» . Нокаут гена TGF - 1 приводит летальным воспалительным процессам.
 Интерлейкин- la ( IL - la ): в молекуле 159 аминокислотных остатков. Рецепторы: CD 121 a , CD 121 b продуценты: макрофаги, эпителий покровных тканей. Биологические эффекты: локальные - активация Т- лимфоцитов и макрофагов; системные - лихорадка и другие симптомы септического шока. Интерлейкин-1 ( IL -1 ): в молекуле 153 кислотных остатка. Рецепторы: CDlila, CD 121 b. Структурная гомология между IL - l и IL -1 составляет менее 30 %, у них общий рецептор, известные на сегодня биологические эффекты и клетки-продуценты. Однако IL - l преимущественно находится в клетке молекула мигрирует в ядро клетки. IL -1 в основном секретируется клеткой во вне. Нокаут гена IL -1 обусловливает невозможность развития реакций острой фазы.
Интерлейкин- la ( IL - la ): в молекуле 159 аминокислотных остатков. Рецепторы: CD 121 a , CD 121 b продуценты: макрофаги, эпителий покровных тканей. Биологические эффекты: локальные - активация Т- лимфоцитов и макрофагов; системные - лихорадка и другие симптомы септического шока. Интерлейкин-1 ( IL -1 ): в молекуле 153 кислотных остатка. Рецепторы: CDlila, CD 121 b. Структурная гомология между IL - l и IL -1 составляет менее 30 %, у них общий рецептор, известные на сегодня биологические эффекты и клетки-продуценты. Однако IL - l преимущественно находится в клетке молекула мигрирует в ядро клетки. IL -1 в основном секретируется клеткой во вне. Нокаут гена IL -1 обусловливает невозможность развития реакций острой фазы.
 Интерлейкин-10 ( IL -10 ): в молекуле 1 аминокислотных остатков. Клетки-продуценты: Th 2, макрофаги и В-лимфоциты, инфициро- ванные вирусом Эпштейна-Барр. Он является сильным ингибитором активности макрофагов, в том числе и их функционирования в роли антигенпредставляющих клеток, IL -10 ингиби- рует Т-лимфоцитарные реакции. При этом IL-10 стимулирует дифференцировку В-лимфоцитов в направлении переключения синтеза изотипа иммуноглобулинов на G 4 у человека. Нокаут гена IL -10 или рецептора для него приводит к развитию тяжелого энтероколита, анемии и задержке роста.
Интерлейкин-10 ( IL -10 ): в молекуле 1 аминокислотных остатков. Клетки-продуценты: Th 2, макрофаги и В-лимфоциты, инфициро- ванные вирусом Эпштейна-Барр. Он является сильным ингибитором активности макрофагов, в том числе и их функционирования в роли антигенпредставляющих клеток, IL -10 ингиби- рует Т-лимфоцитарные реакции. При этом IL-10 стимулирует дифференцировку В-лимфоцитов в направлении переключения синтеза изотипа иммуноглобулинов на G 4 у человека. Нокаут гена IL -10 или рецептора для него приводит к развитию тяжелого энтероколита, анемии и задержке роста.
 Интерлейкин-12 ( IL -12). Клетки-продуценты: макрофаги, В-лимфоциты. Рецептор состоит из двух субъединиц - 1, и 2. 2 -Цепь экспрессирована в Т h 1, но отсутствует в Т h 2. В клетке сигнал от IL -12 проводит STAT 4. Нокаут гена STAT 4 приводит к дефекту развития Тh 1. Именно субъединица 2 имеет решающее значен проведения сигнала внутрь CD 4+ Th 0 -лимфоцита для программирования дифференцировки Th 0 в направ- направ лении Т h 1. Сигнал с рецептора для IL -12 стимулирует экспрессию генов IFN- , а также рецептора для IL-18 и 2 -цепи рецептора для самого IL -12. Главная биологическая активность сигнала от IL -12 - направлять дифференцировку CD 4+ Th 0 -лимфоцитов в сторону Т h 1. Кроме того, IL -12 - сильный стимулятор функций NK. IL - 12 стимулирует функциональное созревание CD 8+ ЦТЛ. Нокаут гена IL -12 приводит к развитию дефицита продукции IFN- в организме и дефициту Тh 1.
Интерлейкин-12 ( IL -12). Клетки-продуценты: макрофаги, В-лимфоциты. Рецептор состоит из двух субъединиц - 1, и 2. 2 -Цепь экспрессирована в Т h 1, но отсутствует в Т h 2. В клетке сигнал от IL -12 проводит STAT 4. Нокаут гена STAT 4 приводит к дефекту развития Тh 1. Именно субъединица 2 имеет решающее значен проведения сигнала внутрь CD 4+ Th 0 -лимфоцита для программирования дифференцировки Th 0 в направ- направ лении Т h 1. Сигнал с рецептора для IL -12 стимулирует экспрессию генов IFN- , а также рецептора для IL-18 и 2 -цепи рецептора для самого IL -12. Главная биологическая активность сигнала от IL -12 - направлять дифференцировку CD 4+ Th 0 -лимфоцитов в сторону Т h 1. Кроме того, IL -12 - сильный стимулятор функций NK. IL - 12 стимулирует функциональное созревание CD 8+ ЦТЛ. Нокаут гена IL -12 приводит к развитию дефицита продукции IFN- в организме и дефициту Тh 1.
 Интерлейкин-16 (IL-16): Рецептор - CD 4. Клетки-продуценты: Т-лимфоциты, тучные клетки, эозинофилы. Биологические эффекты: хемоат- трактант для CD 4+ Т-лимфоцитов, моноцитов и эозино- филов; защищает от апоптоза Т-лимфоциты, стимулиро- ванные IL-2. Интерлейкин-17 (IL-17). Клетки-продуценты - CD 4+ Т-лимфоциты памяти. Биологи- ческий эффект - индуцирует продукцию цитокинов клетками эпителия, эндотелия и фибробластами. Интерлейкин-18 (IL-18). Клетки-продуценты: активированные макрофаги, в том числе купферовские клетки печени. Биологические эффекты: индуцирует продукцию IFN - Т-лимфоцитами и NK, способствует дифференцировке Тh 1. Миграцию ингибирующий фактор (МIF): Клетки-продуценты: Т-лимфоциты, клетки гипофиза. Биологические эффекты: ингибирует миграцию моноцитов, «высаживая» их в виде тканевых макрофагов, активирует макрофаги.
Интерлейкин-16 (IL-16): Рецептор - CD 4. Клетки-продуценты: Т-лимфоциты, тучные клетки, эозинофилы. Биологические эффекты: хемоат- трактант для CD 4+ Т-лимфоцитов, моноцитов и эозино- филов; защищает от апоптоза Т-лимфоциты, стимулиро- ванные IL-2. Интерлейкин-17 (IL-17). Клетки-продуценты - CD 4+ Т-лимфоциты памяти. Биологи- ческий эффект - индуцирует продукцию цитокинов клетками эпителия, эндотелия и фибробластами. Интерлейкин-18 (IL-18). Клетки-продуценты: активированные макрофаги, в том числе купферовские клетки печени. Биологические эффекты: индуцирует продукцию IFN - Т-лимфоцитами и NK, способствует дифференцировке Тh 1. Миграцию ингибирующий фактор (МIF): Клетки-продуценты: Т-лимфоциты, клетки гипофиза. Биологические эффекты: ингибирует миграцию моноцитов, «высаживая» их в виде тканевых макрофагов, активирует макрофаги.
 Семейство молекул TNF. Включает в себя по крайней мере 8 известных членов, из которых два — секретируемые цитокины ( TNF - , LT ), остальные - молекулы клеточной мембраны. Фактор некроза опухолей- : Рецепторы: CD 120 a , р55, CD 120 b , p продуценты: активированные макрофаги, активированные нейтрофилы, NK и тучные клетки. Локальные эффекты TNF - создают очаг местного воспаления в барьерных тканях при внедрении в них патогена: поверхность эндотелия активируется таким образом, что инициирует свертывание крови в сосудах микроциркуляции, закупоривая их. Это является попыткой «не пустить» патоген в системную циркуляцию. Локальный отек способствует дренажу патогена в регионарные лимфатические узлы, где в норме есть все условия для развития лимфоцитарного иммунного ответа. Если здоровому животному вводят внутрикожно определенную дозу бактерий, то процесс ограничивается локальным воспалением в месте введения. Если ту же дозу бактерий вводят после инъекции антител к TNF - , то у животного развивается смертельный сепсис.
Семейство молекул TNF. Включает в себя по крайней мере 8 известных членов, из которых два — секретируемые цитокины ( TNF - , LT ), остальные - молекулы клеточной мембраны. Фактор некроза опухолей- : Рецепторы: CD 120 a , р55, CD 120 b , p продуценты: активированные макрофаги, активированные нейтрофилы, NK и тучные клетки. Локальные эффекты TNF - создают очаг местного воспаления в барьерных тканях при внедрении в них патогена: поверхность эндотелия активируется таким образом, что инициирует свертывание крови в сосудах микроциркуляции, закупоривая их. Это является попыткой «не пустить» патоген в системную циркуляцию. Локальный отек способствует дренажу патогена в регионарные лимфатические узлы, где в норме есть все условия для развития лимфоцитарного иммунного ответа. Если здоровому животному вводят внутрикожно определенную дозу бактерий, то процесс ограничивается локальным воспалением в месте введения. Если ту же дозу бактерий вводят после инъекции антител к TNF - , то у животного развивается смертельный сепсис.
 Системные эффекты TNF- наступают при септическом заражении крови, когда доза микробных «раздражителей» настолько велика, что активирует огромную массу тканевых макрофагов во всем теле (в первую очередь в печени), и макрофаги выбрасывают значительные количества TNF - в кровь. Если животному при этом ввести достаточное количество антител, нейтрализующих TNF - , то симптомы септического шока удастся отменить (но не инфекционный процесс, который все равно закончится летальным исходом). Именно TNF - в первую очередь и индуцированные им цитокины IL -1 и 6 ответственны за развитие характерных симптомов септического шока (лихорадка, коллапс, ДВС- синдром и др. ).
Системные эффекты TNF- наступают при септическом заражении крови, когда доза микробных «раздражителей» настолько велика, что активирует огромную массу тканевых макрофагов во всем теле (в первую очередь в печени), и макрофаги выбрасывают значительные количества TNF - в кровь. Если животному при этом ввести достаточное количество антител, нейтрализующих TNF - , то симптомы септического шока удастся отменить (но не инфекционный процесс, который все равно закончится летальным исходом). Именно TNF - в первую очередь и индуцированные им цитокины IL -1 и 6 ответственны за развитие характерных симптомов септического шока (лихорадка, коллапс, ДВС- синдром и др. ).
 Системные эффекты TNF- при септическом шоке или иных тяжелых генерализованных патологических процессах следующие: системная вазодилатация, падение кровяного давления (коллапс); повышение проницаемости сосудов, экстраваза- ция плазмы из сосудов в ткани (отеки); диссеминированное внутрисосудистое свертыва- ние крови (ДВС-синдром), как следствие – масси- рованная потеря факторов коагуляции и, повышенная кровопотеря при травматизации тканей; развитие органной недостаточности почек, печени, сердца и легких в результате нарушения их перфузии;
Системные эффекты TNF- при септическом шоке или иных тяжелых генерализованных патологических процессах следующие: системная вазодилатация, падение кровяного давления (коллапс); повышение проницаемости сосудов, экстраваза- ция плазмы из сосудов в ткани (отеки); диссеминированное внутрисосудистое свертыва- ние крови (ДВС-синдром), как следствие – масси- рованная потеря факторов коагуляции и, повышенная кровопотеря при травматизации тканей; развитие органной недостаточности почек, печени, сердца и легких в результате нарушения их перфузии;
 TNF - , прямо действует на клетки гипоталамуса, индуцируя высокую лихорадку; концентрация глюкозы в крови падает до уровней, несовместимых с нормальным метаболизмом в мозге; TNF - , действует на эндотелий костного мозга мозг таким образом, что «заставляет» его выбросить в циркуляцию имеющиеся запасы нейтрофилов. Если процесс развивается подостро, то через несколько дней можно зарегистрировать признаки угнетения кроветворения. При подостром развитии процесса можно также зарегистрировать существенную потерю массы тела (раннее название TNF - , - кахектин) в результа повышенного и несбалансированного катаболизма жиров и белков в жировой и мышечной тканях.
TNF - , прямо действует на клетки гипоталамуса, индуцируя высокую лихорадку; концентрация глюкозы в крови падает до уровней, несовместимых с нормальным метаболизмом в мозге; TNF - , действует на эндотелий костного мозга мозг таким образом, что «заставляет» его выбросить в циркуляцию имеющиеся запасы нейтрофилов. Если процесс развивается подостро, то через несколько дней можно зарегистрировать признаки угнетения кроветворения. При подостром развитии процесса можно также зарегистрировать существенную потерю массы тела (раннее название TNF - , - кахектин) в результа повышенного и несбалансированного катаболизма жиров и белков в жировой и мышечной тканях.
 Названные острые патологические процессы приводят к высокой летальности в случаях септического шока. TNF - индуцирует биосинтез и секрецию в циркуляцию теми же макрофагами еще двух цитокинов - IL -1 и 6, которые помогают TNF - «организовать» индукцию биосинтеза белков острой фазы в печени: СРП (С-реактивного протеина из семейства пентраксинов), МСЛ [маннан связывающего лектина из семейства коллектинов ( collectins )], фибриногена и сывороточного амилоида. Функции белков острой фазы (это связывание бактерий, опсонизация их для поглощения фагоцитами и активация системы комплемента). Белки острой фазы вырабатываются печенью гораздо раньше, чем может состояться лимфоцитарный иммунный ответ и выработаются специфические антитела. Белки острой фазы «пытаются» связать и элиминировать микроорганизмы уже в первые 2 сут после заражения.
Названные острые патологические процессы приводят к высокой летальности в случаях септического шока. TNF - индуцирует биосинтез и секрецию в циркуляцию теми же макрофагами еще двух цитокинов - IL -1 и 6, которые помогают TNF - «организовать» индукцию биосинтеза белков острой фазы в печени: СРП (С-реактивного протеина из семейства пентраксинов), МСЛ [маннан связывающего лектина из семейства коллектинов ( collectins )], фибриногена и сывороточного амилоида. Функции белков острой фазы (это связывание бактерий, опсонизация их для поглощения фагоцитами и активация системы комплемента). Белки острой фазы вырабатываются печенью гораздо раньше, чем может состояться лимфоцитарный иммунный ответ и выработаются специфические антитела. Белки острой фазы «пытаются» связать и элиминировать микроорганизмы уже в первые 2 сут после заражения.

