Mnogoelektronnye_atomy_l5 (1).pptx
- Количество слайдов: 62

Тема II. Многоэлектронные атомы

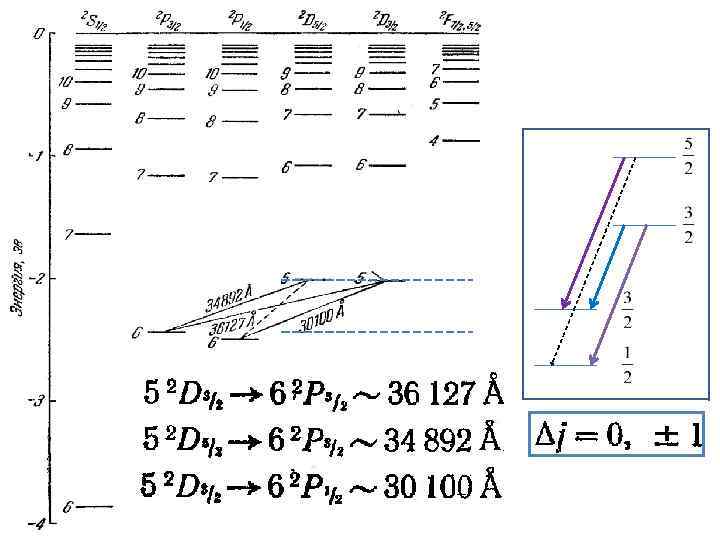
Balmer Lyman Paschen Pfund Разность постоянного и переменного термов

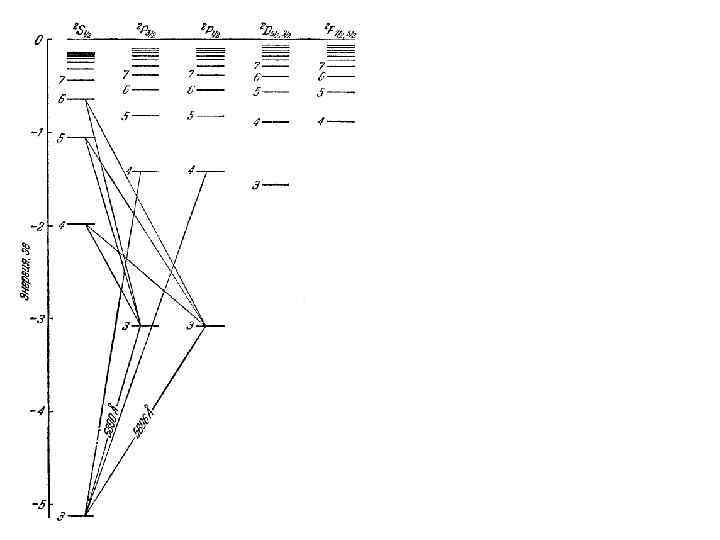
1. Спектры щелочных металлов ω = T 1(m) –T 2(n) Натрий • • sharp резкая principal главная diffuse fundamental ω∞ - граница серии
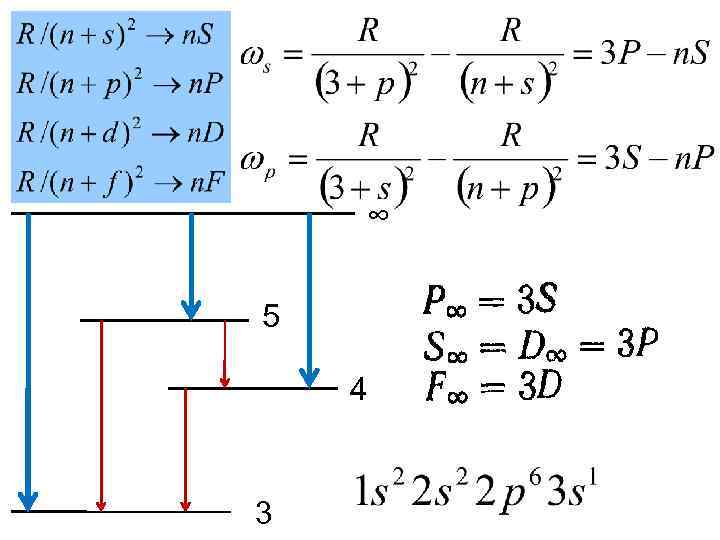
∞ 5 4 3
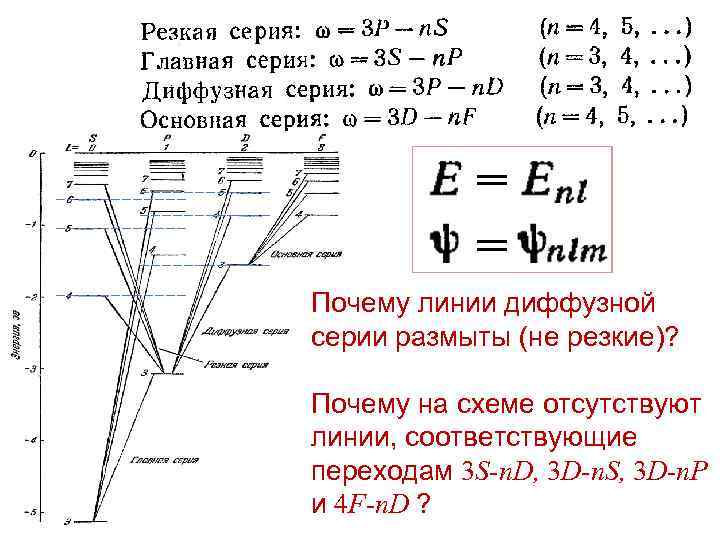
Почему линии диффузной серии размыты (не резкие)? Почему на схеме отсутствуют линии, соответствующие переходам 3 S-n. D, 3 D-n. S, 3 D-n. P и 4 F-n. D ?
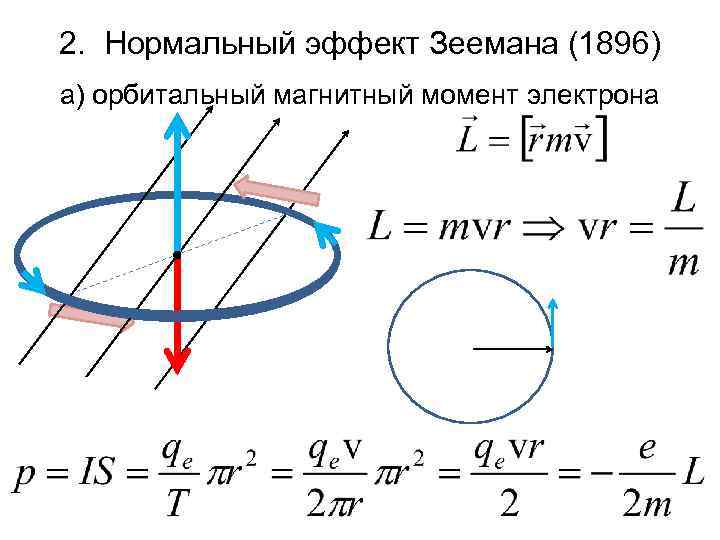
2. Нормальный эффект Зеемана (1896) а) орбитальный магнитный момент электрона

• механический момент • момент импульса
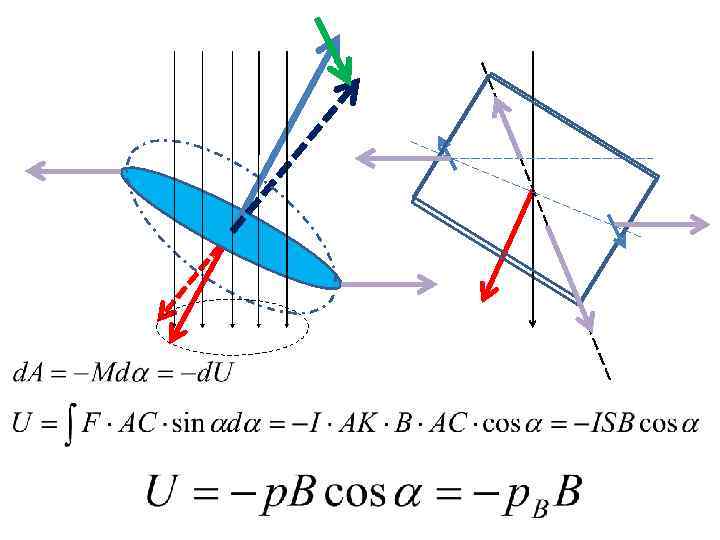
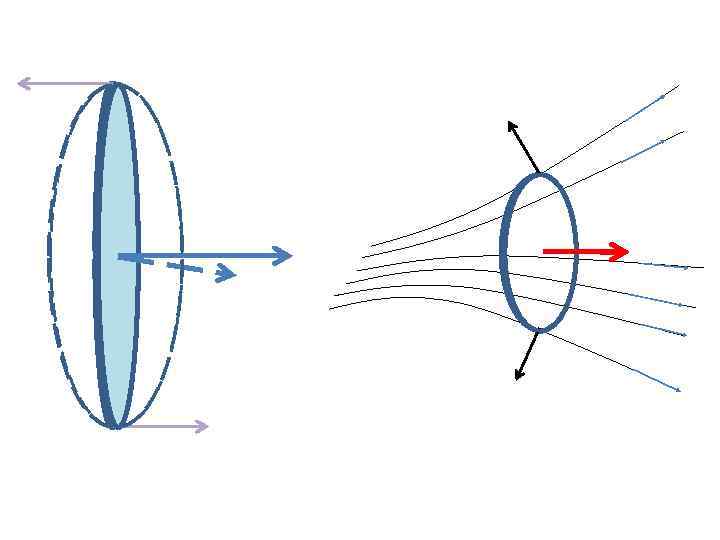
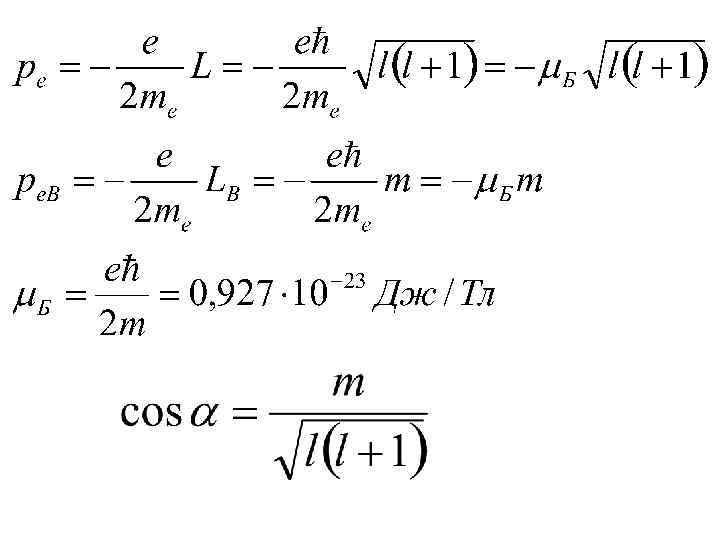

Feedback • • В каких единицах системы СИ измеряется МОМЕНТ ИМПУЛЬСА? МОМЕНТ СИЛЫ? МАГНИТНЫЙ МОМЕНТ?
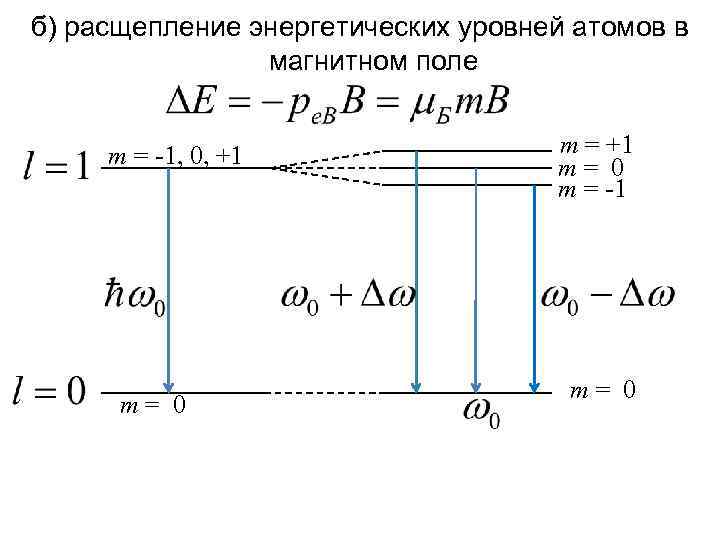
б) расщепление энергетических уровней атомов в магнитном поле m = -1, 0, +1 m= 0 m = -1 m= 0
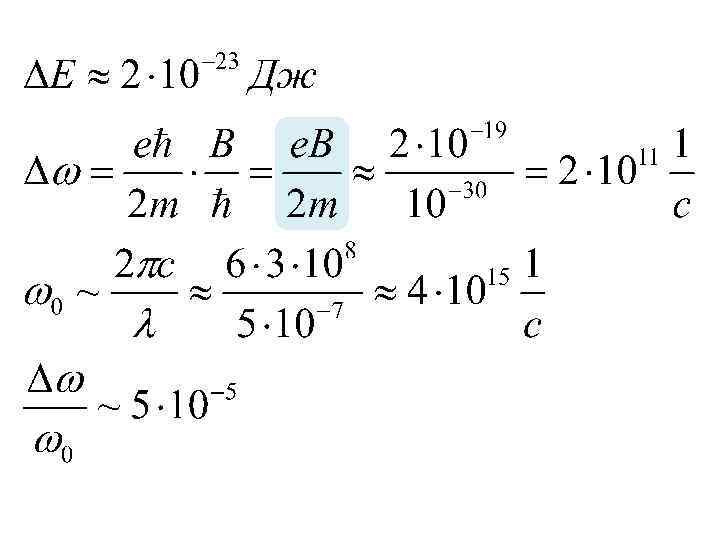
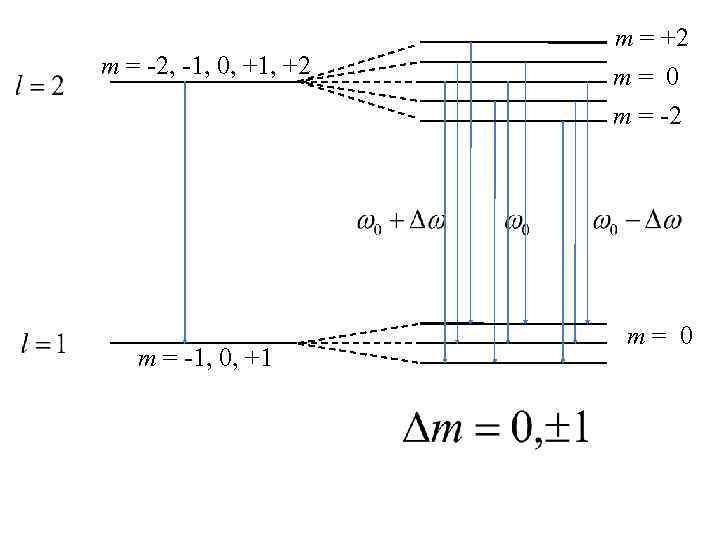
m = -2, -1, 0, +1, +2 m = +2 m= 0 m = -2 m = -1, 0, +1 m= 0

Johannes Robert Rydberg 1854 -1919 Pieter Zeeman 1865 — 1943
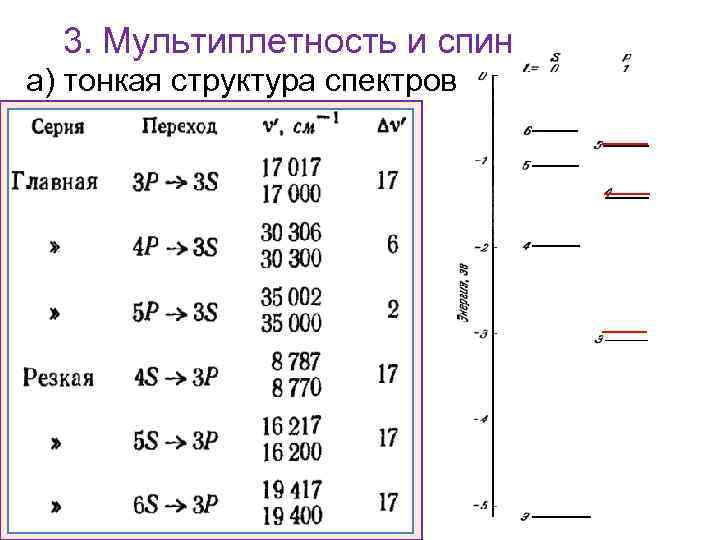
3. Мультиплетность и спин а) тонкая структура спектров
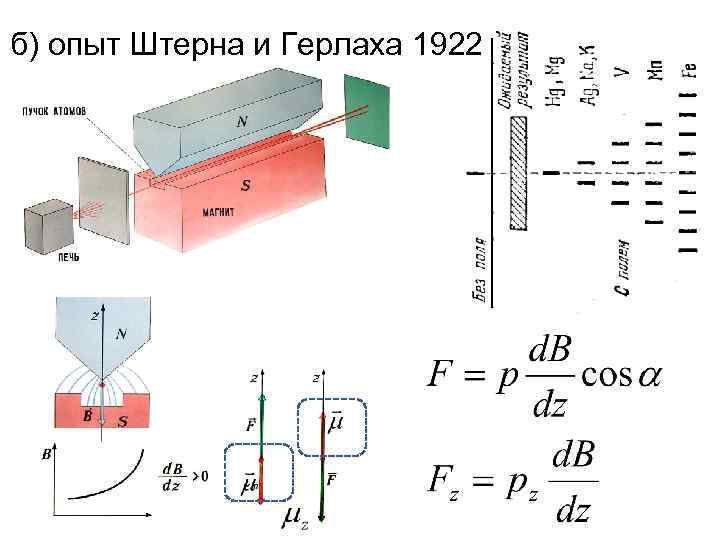
б) опыт Штерна и Герлаха 1922
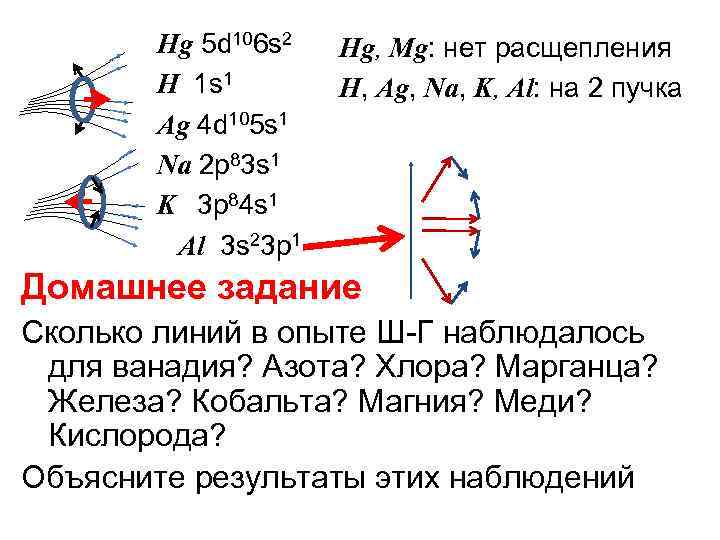
Hg 5 d 106 s 2 Н 1 s 1 Ag 4 d 105 s 1 Na 2 p 83 s 1 K 3 p 84 s 1 Al 3 s 23 p 1 Hg, Mg: нет расщепления Н, Ag, Na, K, Al: на 2 пучка Домашнее задание Сколько линий в опыте Ш-Г наблюдалось для ванадия? Азота? Хлора? Марганца? Железа? Кобальта? Магния? Меди? Кислорода? Объясните результаты этих наблюдений

Otto Stern 1888 — 1969 Walther Gerlach 1889 - 1979
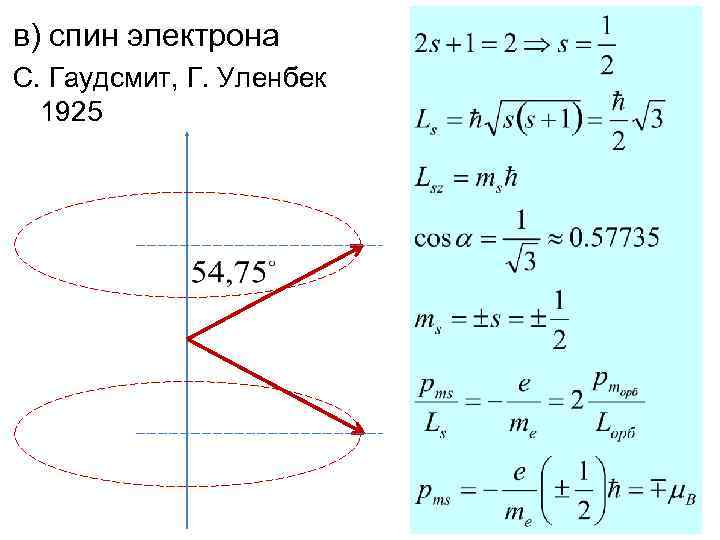
в) спин электрона С. Гаудсмит, Г. Уленбек 1925

Samuel Abraham Goudsmit 1902 -1978 George Eugene Uhlenbeck 1900 -1988

В 1921 году Артур Комптон, пытаясь объяснить магнитные свойства вещества, высказал мысль об электроне, вращающемся «подобно миниатюрному гироскопу» . Позже Вольфганг Паули в знаменитой работе, посвященной принципу запрета, был вынужден приписать электрону «двузначность, не описываемую классически» . В начале 1925 года Ральф Крониг предположил, что эту двузначность можно объяснить вращением электрона вокруг оси, однако вскоре он столкнулся с серьёзными трудностями (согласно расчетам, скорость на поверхности электрона должна превышать скорость света). Кроме того, эта гипотеза встретила негативную реакцию со стороны Паули, Хендрика Крамерса и Вернера Гейзенберга, и Крониг решил не публиковать её Идея спина буквально витала в воздухе: помимо уже упомянутых учёных, схожие мысли высказывали Гарольд Юри (для электрона), Шатьендранат Бозе (для фотона) и тот же Паули (для атомного ядра). По этой причине однозначно определить приоритет в вопросе открытия спина не представляется возможным. Видимо, это и стало основной причиной того, что открытие спина так и не было удостоено Нобелевской премии. «…как физики мы с Уленбеком мало походили друг на друга. Это лучше всего объяснить на следующем упрощенном примере. Когда я ему рассказал о g-факторах Ланде, то он спросил, к моему большому удивлению: «Кто такой Ланде? » Когда же он упомянул четыре степени свободы электрона, то я спросил его: «А что такое степень свободы? »

Гаудсмит, не обладая большими аналитическими способностями, полагался в большей мере на интуицию, подкрепленную знанием эмпирических данных «Среди физиков абсолютно никто не был на него похож. Он был физикомтеоретиком, но большинство теоретиков, явно склонные к математике и наполненные квантовой механикой и прочим, задрали бы носы перед Сэмом, поскольку, если что-то должно быть сложным, то это не для него… Однако у него было много действительно блестящих идей» «Он испытывал комплекс неполноценности, ощущение ненадежности. Я думаю, причиной был тот факт, что он никогда не был силен в теоретической физике… он был, скорее, «детективом» в физике»

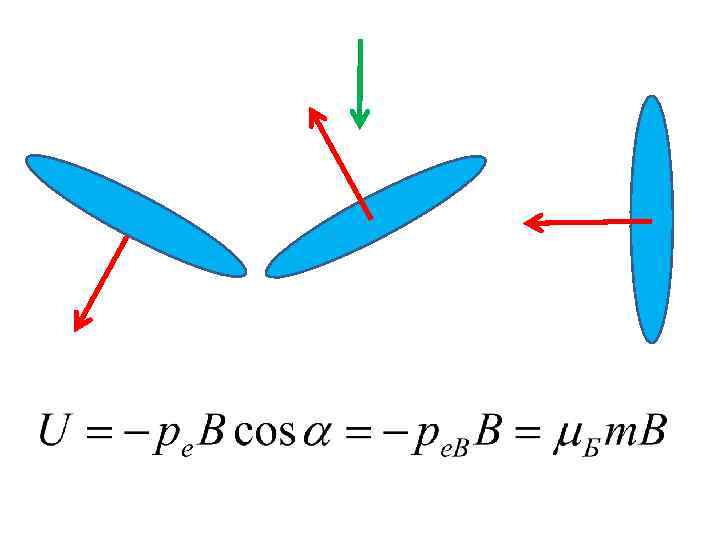
г) пространственное квантование суммарного момента импульса электрона
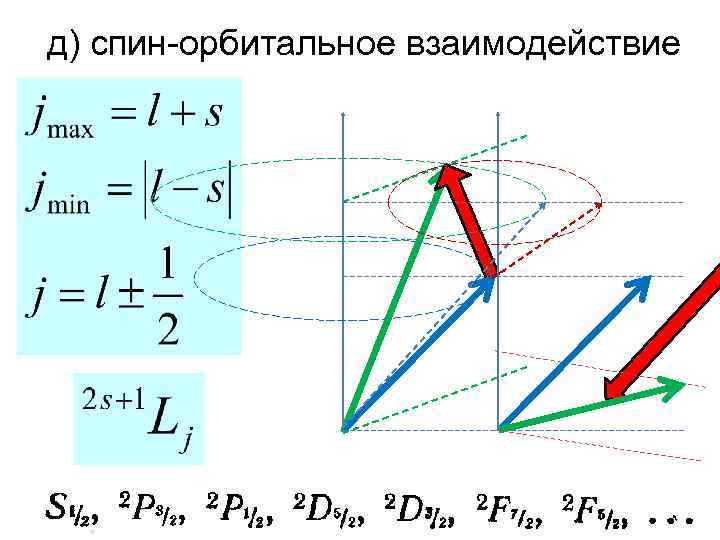
д) спин-орбитальное взаимодействие

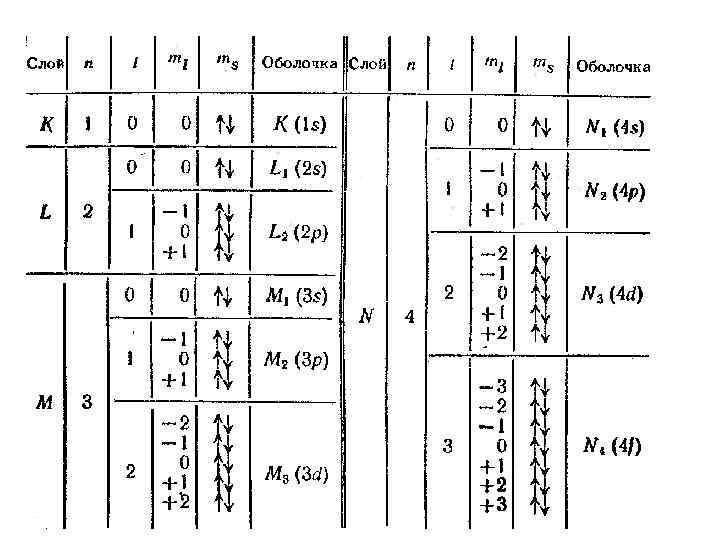
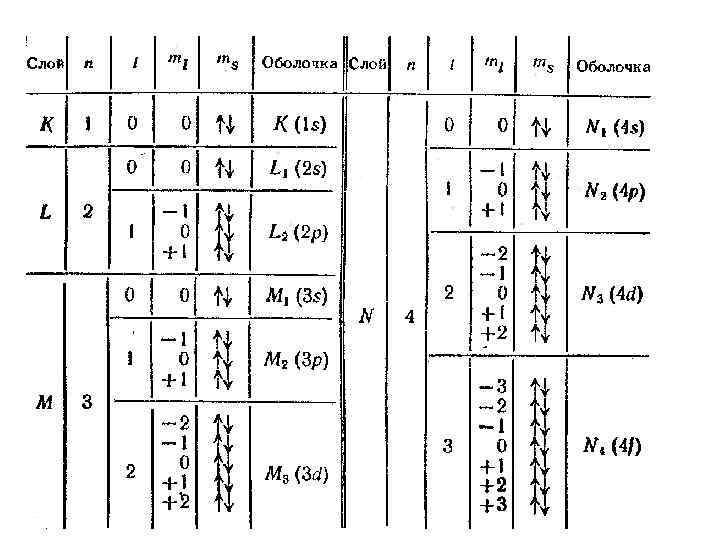
4. Периодическая система Д. И. Менделеева а) распределение электронов в атоме по энергетическим уровням. Принцип Паули слой оболочка 2 2

Wolfgang Ernst Pauli 1900 — 1958


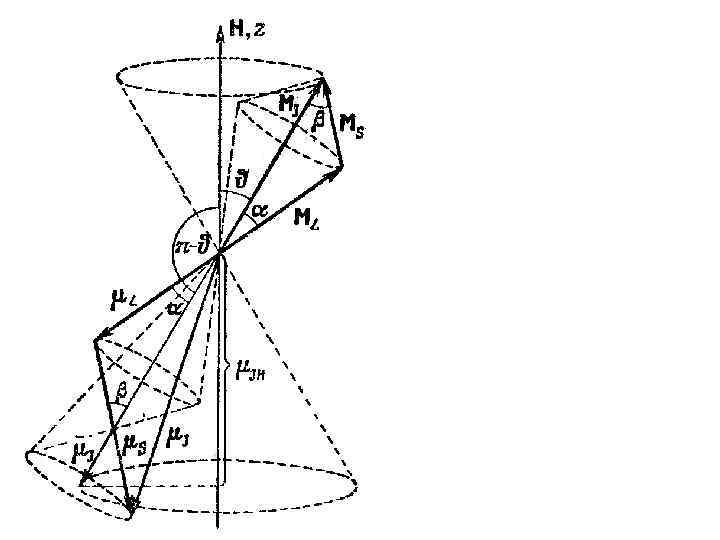
б) суммирование орбитальных и спиновых моментов импульса электронов многоэлектронных атомов Связь Рессель-Саундерса: орбитальные и спиновые магнитные моменты в каждом отдельном электроне действуют друг на друга слабее, чем взаимодействуют магнитные поля, создаваемые «орбитальным» движением разных электронов одного атома, а также чем взаимодействуют магнитные поля связанные со спинами разных электронов
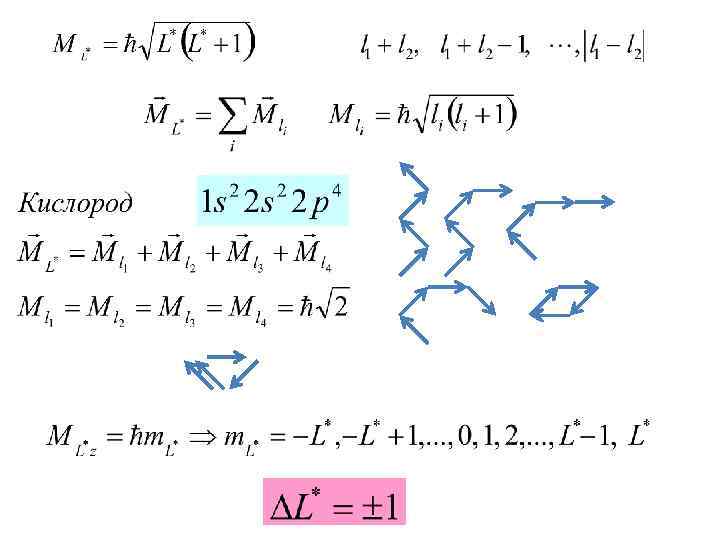
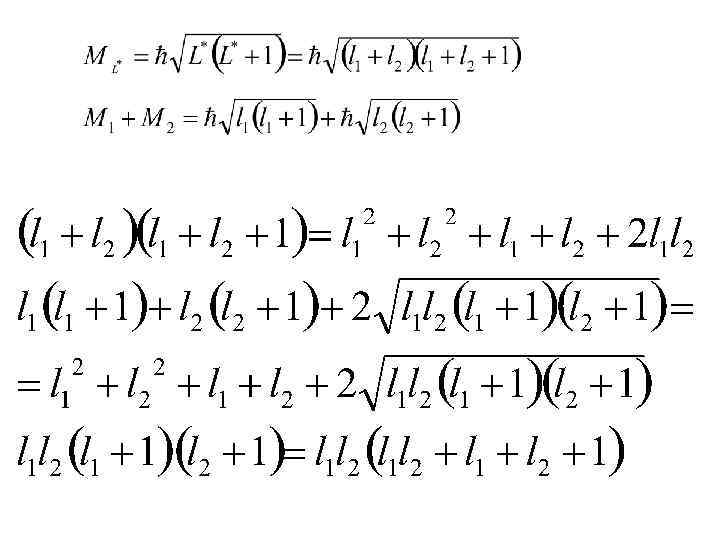
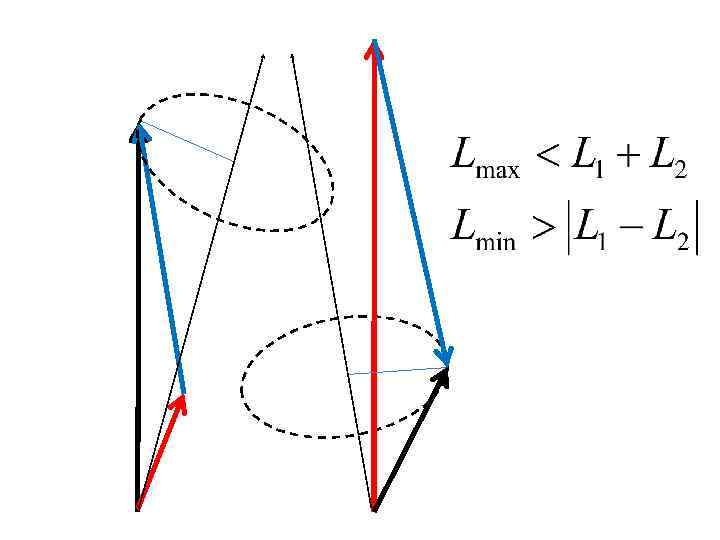

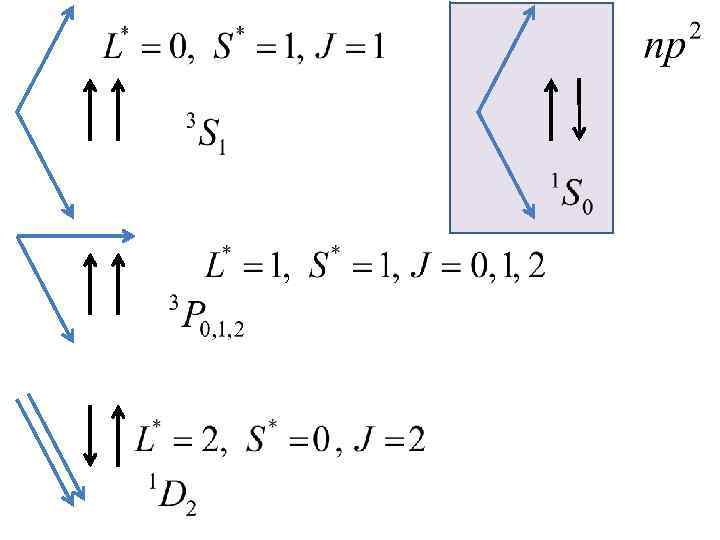
Энергия многоэлектронного атома зависит от взаимной ориентации моментов Мl, Ms, и МL* и МS* (то есть от квантовых чисел L* , S*, J )
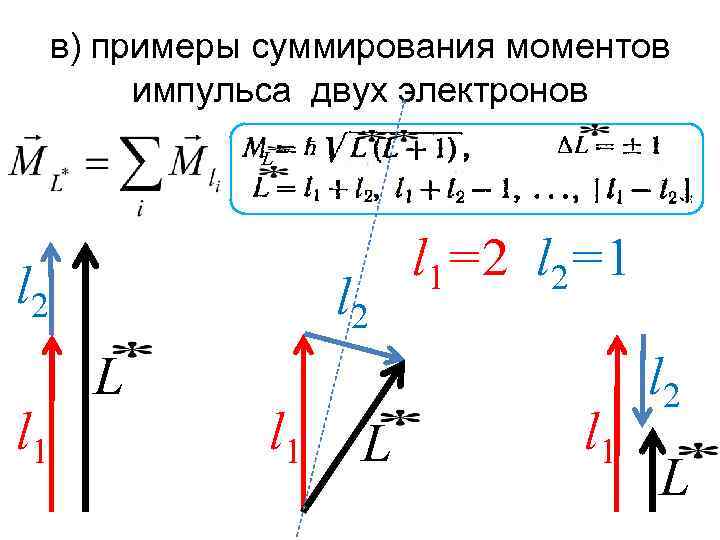
в) примеры суммирования моментов импульса двух электронов L l 2 l 1 l 2 L l 1=2 l 2=1 l 2 L

Feedback Покажите с помощью условной векторной схемы все возможные способы сложения моментов импульса двух электронов с орбитальными квантовыми числами l 1=2 и l 2=4
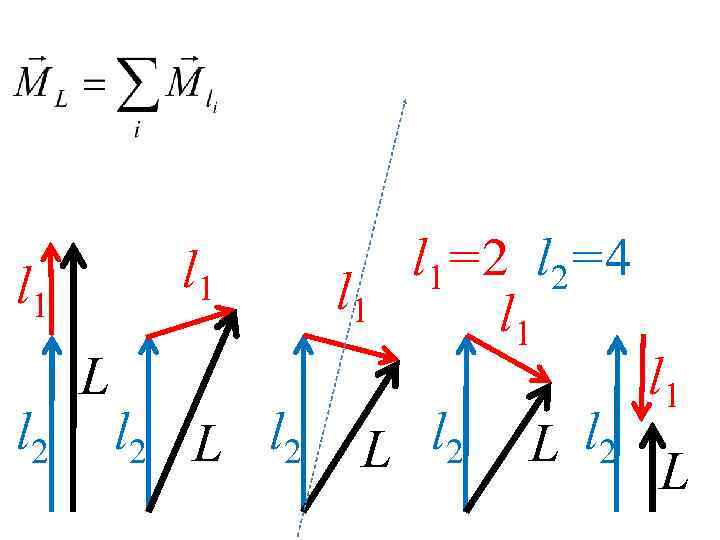
l 1 l 2 L l 2 l 1=2 l 2=4 l 1 l 2 L L l 2 l 1 L

г) правила Хунда Наименьшей энергией обладает оболочка с наибольшим возможным значением и наибольшим возможным при таком значением Если заполнено не более половины оболочки, энергия атома минимальна при минимальном , и наоборот


Домашнее задание: как обозначить основные термы алюминия, хрома, титана, железа, кобальта и никеля?
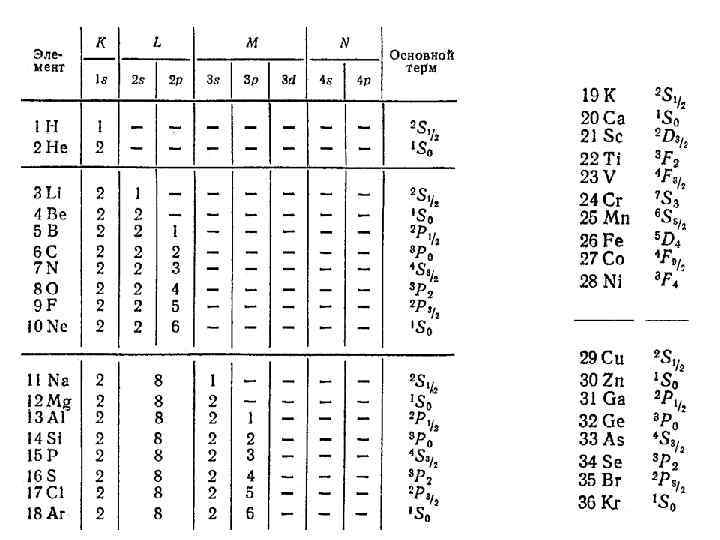

д) химические элементы в таблице Д. И. Менделеева Таблица Д. И. Менделеева

Конец темы
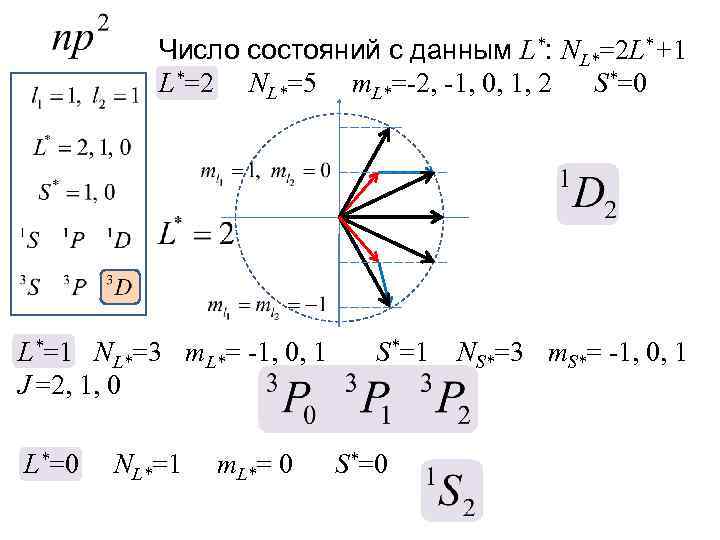
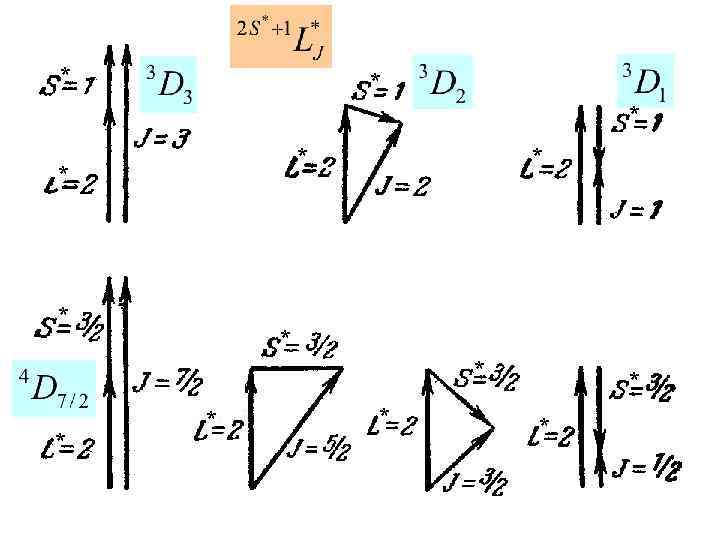
Число состояний с данным L*: NL*=2 L*+1 L*=2 NL*=5 m. L*=-2, -1, 0, 1, 2 S*=0 L*=1 NL*=3 m. L*= -1, 0, 1 J =2, 1, 0 L*=0 NL*=1 m. L*= 0 S*=1 S*=0 NS*=3 m. S*= -1, 0, 1
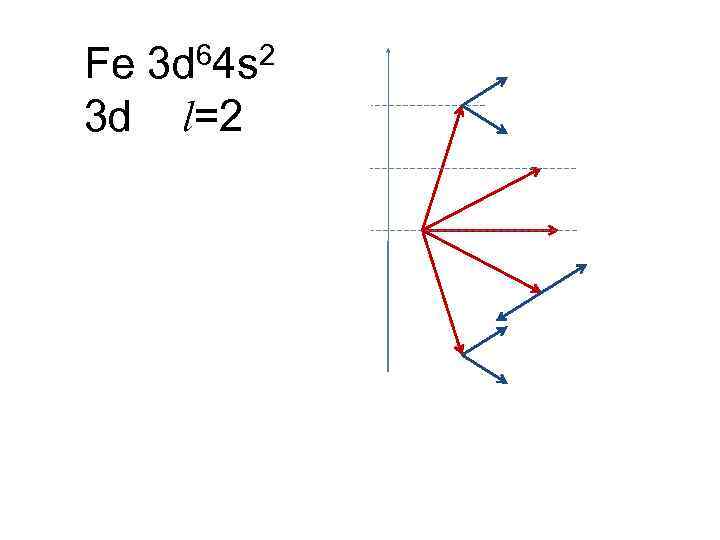
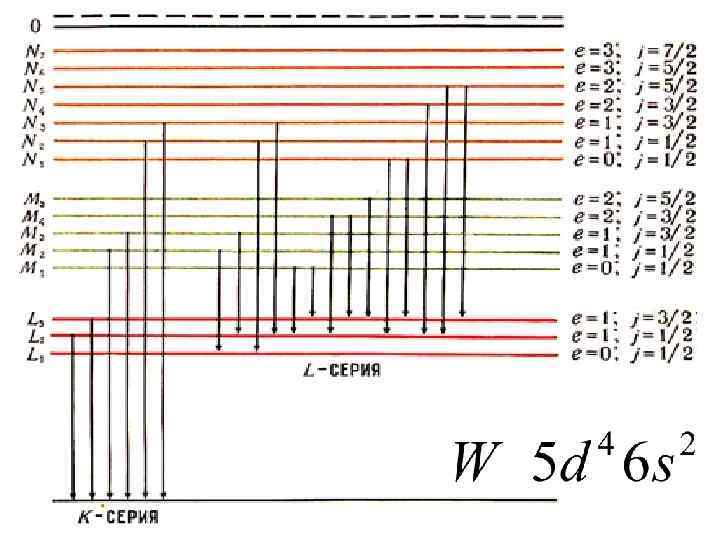
Fe 3 d 64 s 2 3 d l=2
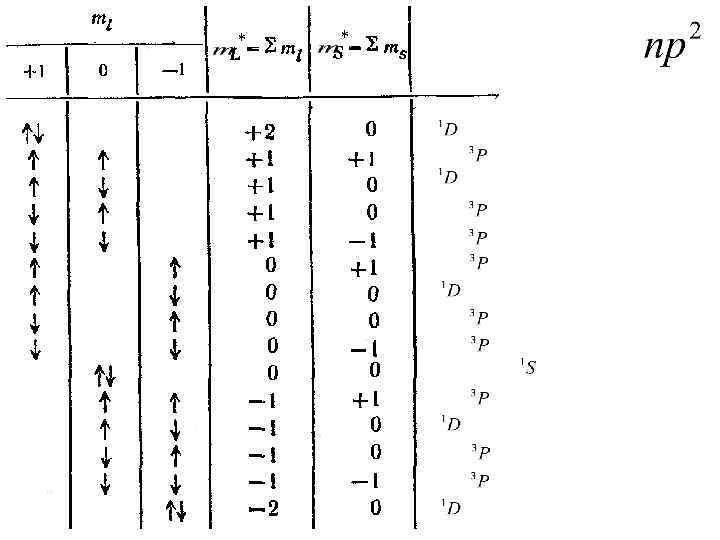
* *

4. Момент импульса многоэлектронных атомов а) момент импульса в квантовой механике
* * * *
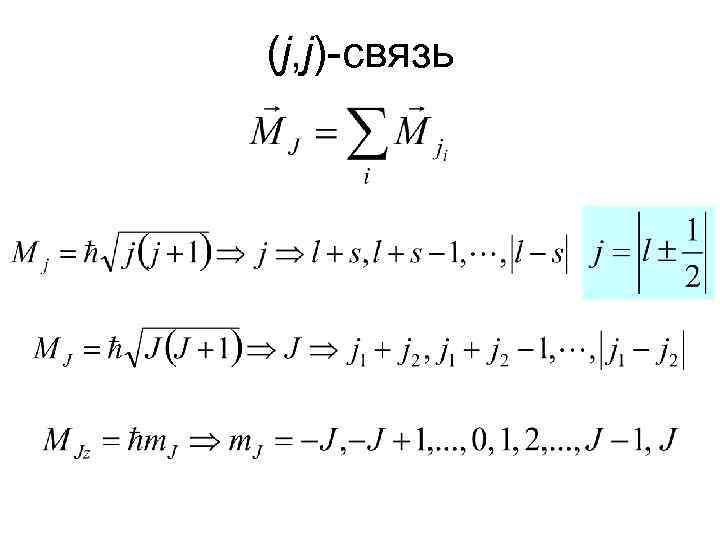
(j, j)-связь

Na 1 s 22 p 63 s 1
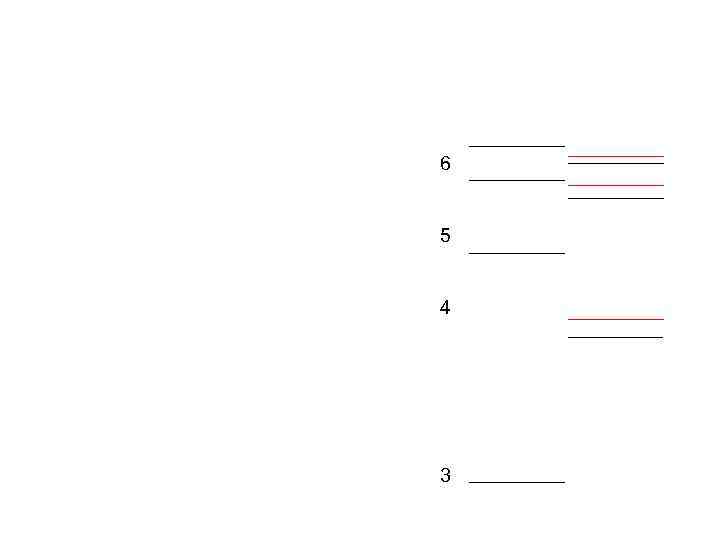
6 5 4 3
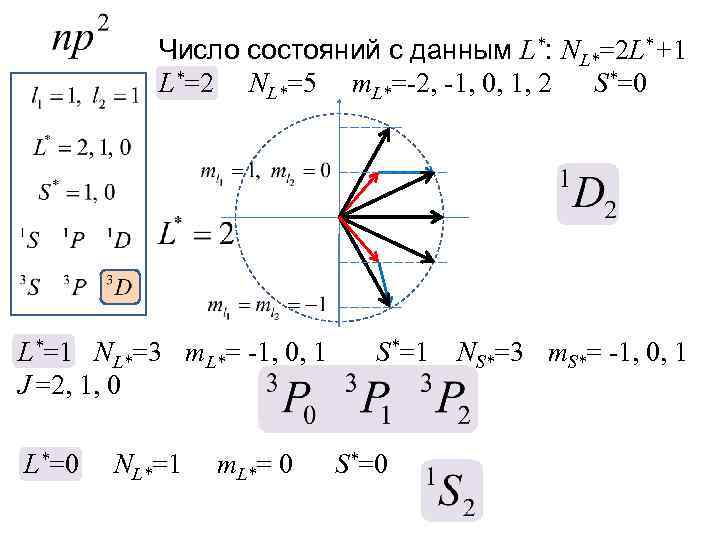
Число состояний с данным L*: NL*=2 L*+1 L*=2 NL*=5 m. L*=-2, -1, 0, 1, 2 S*=0 L*=1 NL*=3 m. L*= -1, 0, 1 J =2, 1, 0 L*=0 NL*=1 m. L*= 0 S*=1 S*=0 NS*=3 m. S*= -1, 0, 1
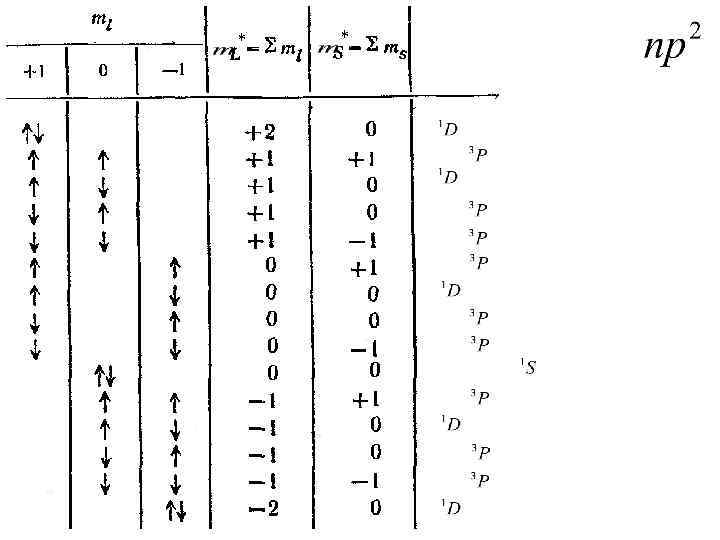
* *
Mnogoelektronnye_atomy_l5 (1).pptx