 Тема: «Элементы V группы главной подгруппы, или «пниктогены» образующие селитры» Махметова Р. К.
Тема: «Элементы V группы главной подгруппы, или «пниктогены» образующие селитры» Махметова Р. К.
 V A группа Общая характеристика l l l l N - неметалл, P - неметалл As - неметалл Sb, Bi – металлы неметаллические свойства уменьшаются, металлические – усиливаются атомный радиус -увеличивается ЭО – уменьшается l ns 2 np 3
V A группа Общая характеристика l l l l N - неметалл, P - неметалл As - неметалл Sb, Bi – металлы неметаллические свойства уменьшаются, металлические – усиливаются атомный радиус -увеличивается ЭО – уменьшается l ns 2 np 3
 Азот Массовая доля азота в земной коре составляет 0, 03% (16 место среди всех элементов, 18 -ое среди всех неметаллов). l 1. Характерные степени окисления: -3 0 +1 +2 NН 3 N 2↑ N 2 О↑ NО↑ +3 +4 +5 N 2 О 3 NО 2↑ N 2 О 5 l 2. Молекула азота состоит из двух атомов N 2. l
Азот Массовая доля азота в земной коре составляет 0, 03% (16 место среди всех элементов, 18 -ое среди всех неметаллов). l 1. Характерные степени окисления: -3 0 +1 +2 NН 3 N 2↑ N 2 О↑ NО↑ +3 +4 +5 N 2 О 3 NО 2↑ N 2 О 5 l 2. Молекула азота состоит из двух атомов N 2. l
 Способы получения l. В лаборатории разложением нитрита аммония: NH 4 NO 2 N 2 +2 H 2 O l В промышленности из воздуха, который переводят в жидкое состояние, и при – 1960 С азот испаряется.
Способы получения l. В лаборатории разложением нитрита аммония: NH 4 NO 2 N 2 +2 H 2 O l В промышленности из воздуха, который переводят в жидкое состояние, и при – 1960 С азот испаряется.
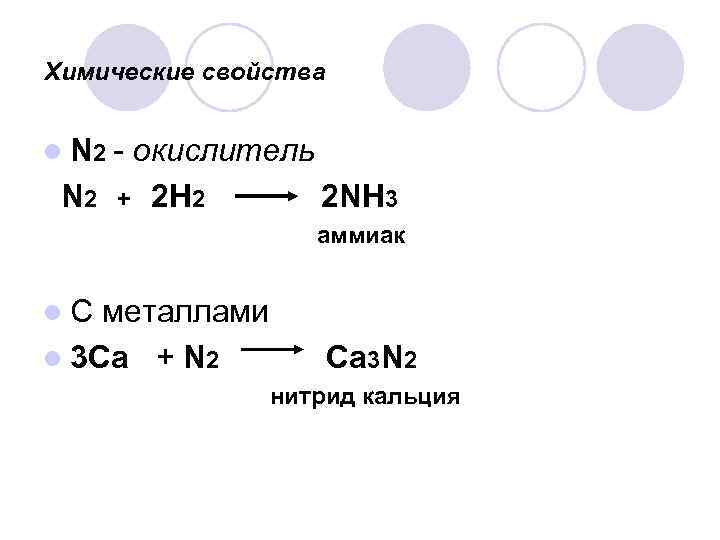 Химические свойства l N 2 - N 2 окислитель + 2 Н 2 2 NH 3 аммиак l. С металлами l 3 Са + N 2 Ca 3 N 2 нитрид кальция
Химические свойства l N 2 - N 2 окислитель + 2 Н 2 2 NH 3 аммиак l. С металлами l 3 Са + N 2 Ca 3 N 2 нитрид кальция
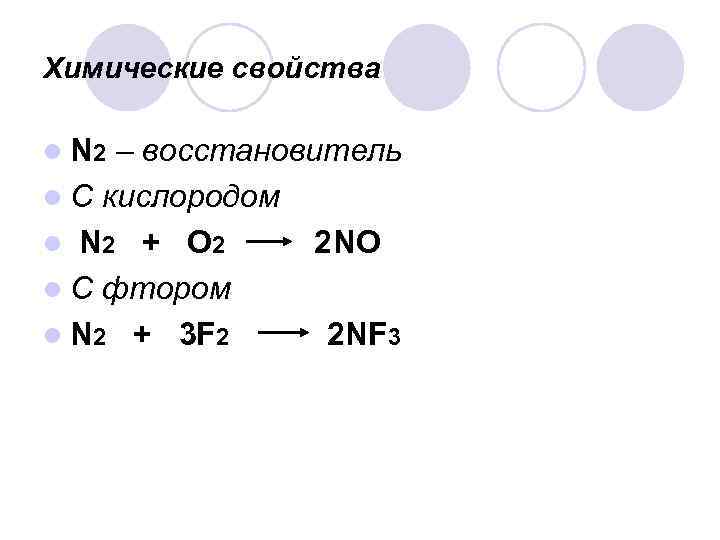 Химические свойства l N 2 – восстановитель l С кислородом l N 2 + О 2 2 NO l С фтором l N 2 + 3 F 2 2 NF 3
Химические свойства l N 2 – восстановитель l С кислородом l N 2 + О 2 2 NO l С фтором l N 2 + 3 F 2 2 NF 3
 Аммиак l Физические свойства: NH 3 – газ без цвета с характерным запахом, легче воздуха, хорошо растворим в воде, водный раствор называется аммиачной водой или нашатырным спиртом, в 1 л воды растворяется 700 л аммиака, ядовит tкип = ─ 330 С.
Аммиак l Физические свойства: NH 3 – газ без цвета с характерным запахом, легче воздуха, хорошо растворим в воде, водный раствор называется аммиачной водой или нашатырным спиртом, в 1 л воды растворяется 700 л аммиака, ядовит tкип = ─ 330 С.
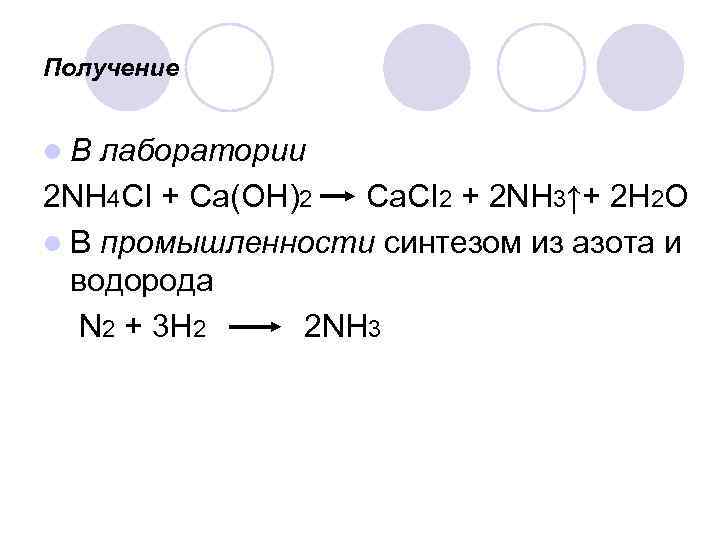 Получение l. В лаборатории 2 NH 4 CI + Ca(OH)2 Ca. CI 2 + 2 NH 3↑+ 2 H 2 O l В промышленности синтезом из азота и водорода N 2 + 3 H 2 2 NH 3
Получение l. В лаборатории 2 NH 4 CI + Ca(OH)2 Ca. CI 2 + 2 NH 3↑+ 2 H 2 O l В промышленности синтезом из азота и водорода N 2 + 3 H 2 2 NH 3
 Химические свойства аммиака l 1/ горит 2 NH 3 + 1, 5 О 2 → N 2 +3 Н 2 О l 2/ окисляется в присутствии катализатора l 2 NH 3 + 2, 5 О 2 → 2 NО +3 Н 2 О l 3/ восстанавливает металлы из их оксидов 2 NH 3 + 3 Cu. O → 3 Cu +N 2 + 3 Н 2 О
Химические свойства аммиака l 1/ горит 2 NH 3 + 1, 5 О 2 → N 2 +3 Н 2 О l 2/ окисляется в присутствии катализатора l 2 NH 3 + 2, 5 О 2 → 2 NО +3 Н 2 О l 3/ восстанавливает металлы из их оксидов 2 NH 3 + 3 Cu. O → 3 Cu +N 2 + 3 Н 2 О
 Химические свойства аммиака l 1/ с водой: NH 3 + HOH → NH 4 OH l 2/ с кислотами: l NH 3 + H+CI → NH 4 CI (хлорид аммония) l NH 3 + H 2 SO 4 → NH 4 HSO 4 (гидросульфат аммония) l 2 NH 3 + H 2 SO 4 → (NH 4)2 SO 4 (сульфат аммония)
Химические свойства аммиака l 1/ с водой: NH 3 + HOH → NH 4 OH l 2/ с кислотами: l NH 3 + H+CI → NH 4 CI (хлорид аммония) l NH 3 + H 2 SO 4 → NH 4 HSO 4 (гидросульфат аммония) l 2 NH 3 + H 2 SO 4 → (NH 4)2 SO 4 (сульфат аммония)
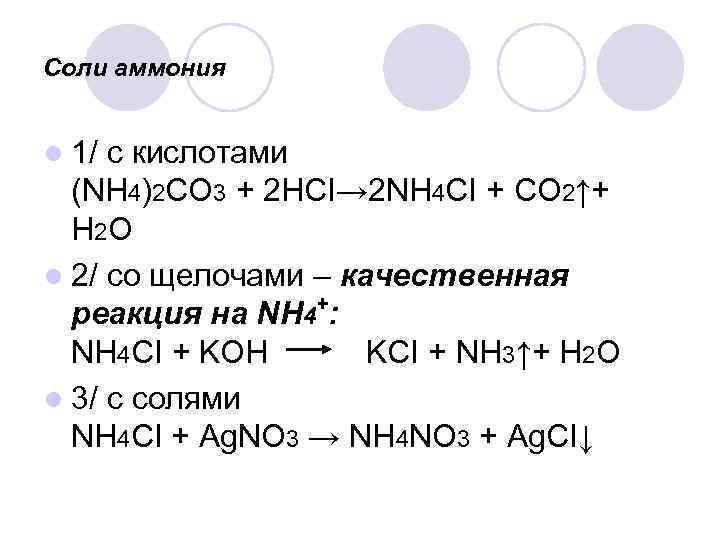 Соли аммония l 1/ с кислотами (NH 4)2 CO 3 + 2 HCI→ 2 NH 4 CI + CO 2↑+ H 2 O l 2/ со щелочами – качественная + реакция на NH 4 : NH 4 CI + KOH KCI + NH 3↑+ H 2 O l 3/ с солями NH 4 CI + Ag. NO 3 → NH 4 NO 3 + Ag. CI↓
Соли аммония l 1/ с кислотами (NH 4)2 CO 3 + 2 HCI→ 2 NH 4 CI + CO 2↑+ H 2 O l 2/ со щелочами – качественная + реакция на NH 4 : NH 4 CI + KOH KCI + NH 3↑+ H 2 O l 3/ с солями NH 4 CI + Ag. NO 3 → NH 4 NO 3 + Ag. CI↓
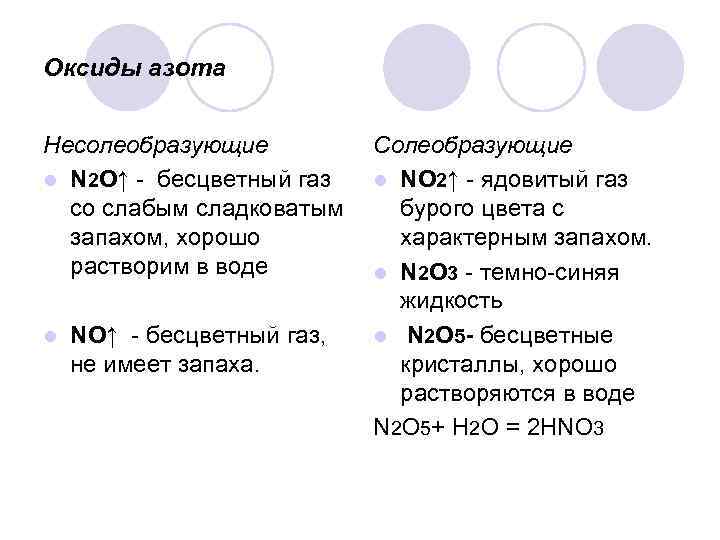 Оксиды азота Несолеобразующие l N 2 О↑ - бесцветный газ со слабым сладковатым запахом, хорошо растворим в воде l NО↑ - бесцветный газ, не имеет запаха. Солеобразующие l NО 2↑ - ядовитый газ бурого цвета с характерным запахом. l N 2 О 3 - темно-синяя жидкость l N 2 О 5 - бесцветные кристаллы, хорошо растворяются в воде N 2 О 5+ H 2 O = 2 НNО 3
Оксиды азота Несолеобразующие l N 2 О↑ - бесцветный газ со слабым сладковатым запахом, хорошо растворим в воде l NО↑ - бесцветный газ, не имеет запаха. Солеобразующие l NО 2↑ - ядовитый газ бурого цвета с характерным запахом. l N 2 О 3 - темно-синяя жидкость l N 2 О 5 - бесцветные кристаллы, хорошо растворяются в воде N 2 О 5+ H 2 O = 2 НNО 3