ОФД-Л 9 Контроль качества ЛС.pptx
- Количество слайдов: 37
 ТЕМА 9: ОРГАНИЗАЦИЯ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВ Цель: сформировать у студентов знания по системе обеспечения качества ЛС в РК и по видам внутриаптечного контроля лекарственных средств и оценке качества ЛС, изготовляемых в аптеке. Лекторы: доцент Шопабаева А. Р. доцент НФа. У Хименко С. В. 1
ТЕМА 9: ОРГАНИЗАЦИЯ ВНУТРИАПТЕЧНОГО КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВ Цель: сформировать у студентов знания по системе обеспечения качества ЛС в РК и по видам внутриаптечного контроля лекарственных средств и оценке качества ЛС, изготовляемых в аптеке. Лекторы: доцент Шопабаева А. Р. доцент НФа. У Хименко С. В. 1
 ПЛАН 1. 2. 3. 4. Обеспечение качества ЛС как международная проблема. Система обеспечения качества ЛС (Система – далее) в РК. Государственная регистрация и сертификация ЛС как механизм государственного контроля качества препаратов. Аптека в структуре Системы. 2
ПЛАН 1. 2. 3. 4. Обеспечение качества ЛС как международная проблема. Система обеспечения качества ЛС (Система – далее) в РК. Государственная регистрация и сертификация ЛС как механизм государственного контроля качества препаратов. Аптека в структуре Системы. 2
 Обеспечение качества ЛС как международная проблема 3
Обеспечение качества ЛС как международная проблема 3
 n Cубстандартный – препарат, произведенный легальным производителем с правильной маркировкой, но который во время его производства, транспортировки, хранения утратил соответствие требованиям, утвержденным АНД (аналитиконормативной документацией) n Фальсифицированный или контрафактный – препарат, который преднамеренно и противоправно был оформлен этикеткой, которая неверно указывает на достоверность препарата и/или его производителя n Незарегистрированный – препарат, который не прошел официальной процедуры государственной регистрации по занесению его в Государственный реестр ЛС 4
n Cубстандартный – препарат, произведенный легальным производителем с правильной маркировкой, но который во время его производства, транспортировки, хранения утратил соответствие требованиям, утвержденным АНД (аналитиконормативной документацией) n Фальсифицированный или контрафактный – препарат, который преднамеренно и противоправно был оформлен этикеткой, которая неверно указывает на достоверность препарата и/или его производителя n Незарегистрированный – препарат, который не прошел официальной процедуры государственной регистрации по занесению его в Государственный реестр ЛС 4
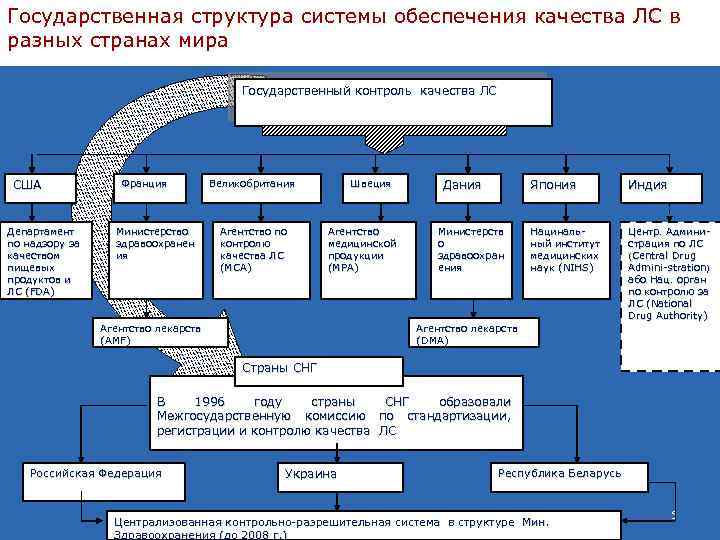 Государственная структура системы обеспечения качества ЛС в разных странах мира Государственный контроль качества ЛС США Департамент по надзору за качеством пищевых продуктов и ЛС (FDA) Франция Министерство здравоохранен ия Великобритания Агентство по контролю качества ЛС (МСА) Швеция Агентство медицинской продукции (МРА) Агентство лекарств (AMF) Дания Япония Министерств о здравоохран ения Индия Нацинальный институт медицинских наук (NIHS) Центр. Администрация по ЛС (Central Drug Admini-stration) Adminiабо Нац. орган по контролю за ЛС (National Drug Authority) Агентство лекарств (DMA) Страны СНГ В 1996 году страны СНГ образовали Межгосударственную комиссию по стандартизации, регистрации и контролю качества ЛС Российская Федерация Украина Республика Беларусь Централизованная контрольно-разрешительная система в структуре Мин. Здравоохранения (до 2008 г. ) 5
Государственная структура системы обеспечения качества ЛС в разных странах мира Государственный контроль качества ЛС США Департамент по надзору за качеством пищевых продуктов и ЛС (FDA) Франция Министерство здравоохранен ия Великобритания Агентство по контролю качества ЛС (МСА) Швеция Агентство медицинской продукции (МРА) Агентство лекарств (AMF) Дания Япония Министерств о здравоохран ения Индия Нацинальный институт медицинских наук (NIHS) Центр. Администрация по ЛС (Central Drug Admini-stration) Adminiабо Нац. орган по контролю за ЛС (National Drug Authority) Агентство лекарств (DMA) Страны СНГ В 1996 году страны СНГ образовали Межгосударственную комиссию по стандартизации, регистрации и контролю качества ЛС Российская Федерация Украина Республика Беларусь Централизованная контрольно-разрешительная система в структуре Мин. Здравоохранения (до 2008 г. ) 5
 Россия, Казахстан и Беларусь создадут Единый реестр лекарственных средств 6
Россия, Казахстан и Беларусь создадут Единый реестр лекарственных средств 6
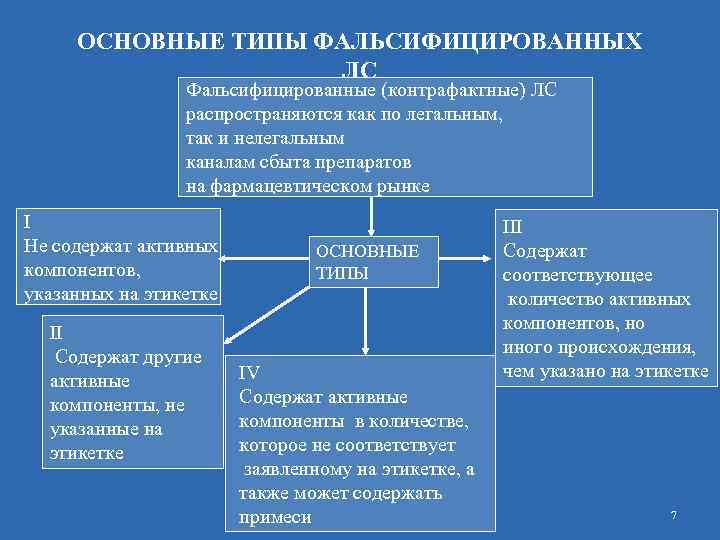 ОСНОВНЫЕ ТИПЫ ФАЛЬСИФИЦИРОВАННЫХ ЛС Фальсифицированные (контрафактные) ЛС распространяются как по легальным, так и нелегальным каналам сбыта препаратов на фармацевтическом рынке І Не содержат активных компонентов, указанных на этикетке ІІ Содержат другие активные компоненты, не указанные на этикетке ОСНОВНЫЕ ТИПЫ ІV Содержат активные компоненты в количестве, которое не соответствует заявленному на этикетке, а также может содержать примеси ІІІ Содержат соответствующее количество активных компонентов, но иного происхождения, чем указано на этикетке 7
ОСНОВНЫЕ ТИПЫ ФАЛЬСИФИЦИРОВАННЫХ ЛС Фальсифицированные (контрафактные) ЛС распространяются как по легальным, так и нелегальным каналам сбыта препаратов на фармацевтическом рынке І Не содержат активных компонентов, указанных на этикетке ІІ Содержат другие активные компоненты, не указанные на этикетке ОСНОВНЫЕ ТИПЫ ІV Содержат активные компоненты в количестве, которое не соответствует заявленному на этикетке, а также может содержать примеси ІІІ Содержат соответствующее количество активных компонентов, но иного происхождения, чем указано на этикетке 7
 БАЗА ДАННЫХ ВОЗ ПО ФАЛЬСИФИЦИРОВАННЫМ ЛС 8
БАЗА ДАННЫХ ВОЗ ПО ФАЛЬСИФИЦИРОВАННЫМ ЛС 8
 Официально проблема фальсификации ЛС ВОЗ стала рассматриваться с 1982 года. По указанному вопросу ВОЗ сотрудничает с: Международной ассоциацией фармацевтических работников; n Международной системой сотрудничества фармацевтических инспекций (PIC/S); n мировой организацией по охране интеллектуальной собственности; n Интерполом. n 9
Официально проблема фальсификации ЛС ВОЗ стала рассматриваться с 1982 года. По указанному вопросу ВОЗ сотрудничает с: Международной ассоциацией фармацевтических работников; n Международной системой сотрудничества фармацевтических инспекций (PIC/S); n мировой организацией по охране интеллектуальной собственности; n Интерполом. n 9
 PIC/S - это международный инструмент взаимодействия между странами и регуляторными органами в сфере контроля качества ЛС (национальными фармацевтическими инспекторатами), обеспечивающими совместно активное и конструктивное сотрудничество в сфере надлежащей производственной практики (GMP), инспектирования и лицензирования. 10
PIC/S - это международный инструмент взаимодействия между странами и регуляторными органами в сфере контроля качества ЛС (национальными фармацевтическими инспекторатами), обеспечивающими совместно активное и конструктивное сотрудничество в сфере надлежащей производственной практики (GMP), инспектирования и лицензирования. 10
 В 1995 году ВОЗ разработала “Программу помощи национальным системам здравоохранения в борьбе с некачественными и фальсифицированными ЛС”. Была создана: Мировая база данных ВОЗ по случаям выявления фальсифицированных ЛС n Методика выявления фальсифицированных и субстандартных ЛС n Глобальная сеть (110 стран) работников национальных систем здравоохранения, ответственных за работу по выявлению фальсифицированных и субстандартных ЛС. n 11
В 1995 году ВОЗ разработала “Программу помощи национальным системам здравоохранения в борьбе с некачественными и фальсифицированными ЛС”. Была создана: Мировая база данных ВОЗ по случаям выявления фальсифицированных ЛС n Методика выявления фальсифицированных и субстандартных ЛС n Глобальная сеть (110 стран) работников национальных систем здравоохранения, ответственных за работу по выявлению фальсифицированных и субстандартных ЛС. n 11
 СИСТЕМА ОБЕСПЕЧЕНИЯ КАЧЕСТВА ЛС В КАЗАХСТАНЕ 12
СИСТЕМА ОБЕСПЕЧЕНИЯ КАЧЕСТВА ЛС В КАЗАХСТАНЕ 12
 Согласно международному опыту и требованиям ВОЗ национальные Системы должны функционировать в условиях обеспечения качества ЛС на всех этапах их жизненного цикла: разработка → доклинические испытания → производство → оптовая реализация → отпуск конечному потребителю 13
Согласно международному опыту и требованиям ВОЗ национальные Системы должны функционировать в условиях обеспечения качества ЛС на всех этапах их жизненного цикла: разработка → доклинические испытания → производство → оптовая реализация → отпуск конечному потребителю 13
 Гарантирование качества ЛС на указанных этапах должно обеспечивать лицензирование согласно правилам и нормам надлежащих практик (GCP→GLP→GMP→GDP→GPP), а также стандартам ISO серии 9000 Для поддержания качества ЛС во время их оптовой и розничной реализации в развитых странах в деятельность фирм и аптек дополнительно вводятся Надлежащая практика закупок („Good Pharmaceutical Procurement Practice” – GPPР) и Надлежащая практика хранения („Good Storage Practice” – GSP). 14
Гарантирование качества ЛС на указанных этапах должно обеспечивать лицензирование согласно правилам и нормам надлежащих практик (GCP→GLP→GMP→GDP→GPP), а также стандартам ISO серии 9000 Для поддержания качества ЛС во время их оптовой и розничной реализации в развитых странах в деятельность фирм и аптек дополнительно вводятся Надлежащая практика закупок („Good Pharmaceutical Procurement Practice” – GPPР) и Надлежащая практика хранения („Good Storage Practice” – GSP). 14
 Задачи Системы – обеспечение качества субстанций, ЛС и ИМН, БАД на этапах создания, ввоза на территорию Казахстана, производства, оптовой и розничной реализации. Система имеет 3 организационных уровня: Общегосударственный; n Региональный; n Субъекты хозяйственной деятельности n 15
Задачи Системы – обеспечение качества субстанций, ЛС и ИМН, БАД на этапах создания, ввоза на территорию Казахстана, производства, оптовой и розничной реализации. Система имеет 3 организационных уровня: Общегосударственный; n Региональный; n Субъекты хозяйственной деятельности n 15
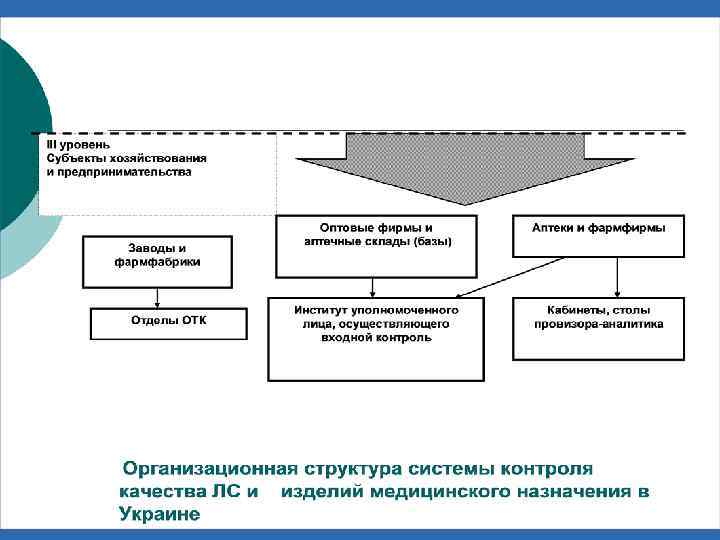
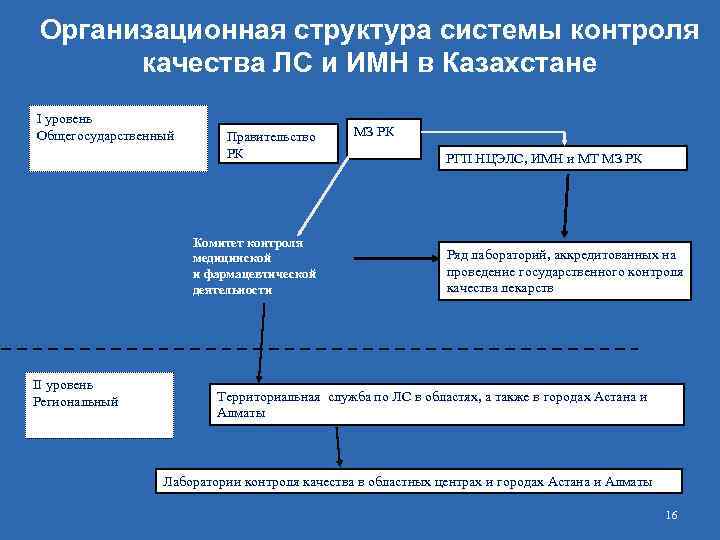 Организационная структура системы контроля качества ЛС и ИМН в Казахстане I уровень Общегосударственный Правительство РК Комитет контроля медицинской и фармацевтической деятельности II уровень Региональный МЗ РК РГП НЦЭЛС, ИМН и МТ МЗ РК Ряд лабораторий, аккредитованных на проведение государственного контроля качества лекарств Территориальная служба по ЛС в областях, а также в городах Астана и Алматы Лаборатории контроля качества в областных центрах и городах Астана и Алматы 16
Организационная структура системы контроля качества ЛС и ИМН в Казахстане I уровень Общегосударственный Правительство РК Комитет контроля медицинской и фармацевтической деятельности II уровень Региональный МЗ РК РГП НЦЭЛС, ИМН и МТ МЗ РК Ряд лабораторий, аккредитованных на проведение государственного контроля качества лекарств Территориальная служба по ЛС в областях, а также в городах Астана и Алматы Лаборатории контроля качества в областных центрах и городах Астана и Алматы 16
 17
17
 РГП «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» МЗ РК является государственной экспертной организацией в сфере обращения лекарственных средств. Основной целью Национального центра является осуществление деятельности в области здравоохранения по обеспечению безопасности, эффективности и качества лекарственных средств. 18
РГП «Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» МЗ РК является государственной экспертной организацией в сфере обращения лекарственных средств. Основной целью Национального центра является осуществление деятельности в области здравоохранения по обеспечению безопасности, эффективности и качества лекарственных средств. 18
 Территориальные подразделения, предприятия представлены органами по подтверждению соответствия и испытательными лабораториями, аккредитованными в государственной системе технического регулирования РК. 19
Территориальные подразделения, предприятия представлены органами по подтверждению соответствия и испытательными лабораториями, аккредитованными в государственной системе технического регулирования РК. 19
 Государственная регистрация и сертификация ЛС как механизм государственного контроля качества ЛС 20
Государственная регистрация и сертификация ЛС как механизм государственного контроля качества ЛС 20
 21
21
 Ø Ø Составными Системы сертификации ВОЗ являются: национальная система лицензирования; соблюдение производителями ЛС требований надлежащей производственной практики, соответствующие требованиям GMP WHO; регистрация ЛС; национальная фармацевтическая инспекция по контролю за ЛС. 22
Ø Ø Составными Системы сертификации ВОЗ являются: национальная система лицензирования; соблюдение производителями ЛС требований надлежащей производственной практики, соответствующие требованиям GMP WHO; регистрация ЛС; национальная фармацевтическая инспекция по контролю за ЛС. 22
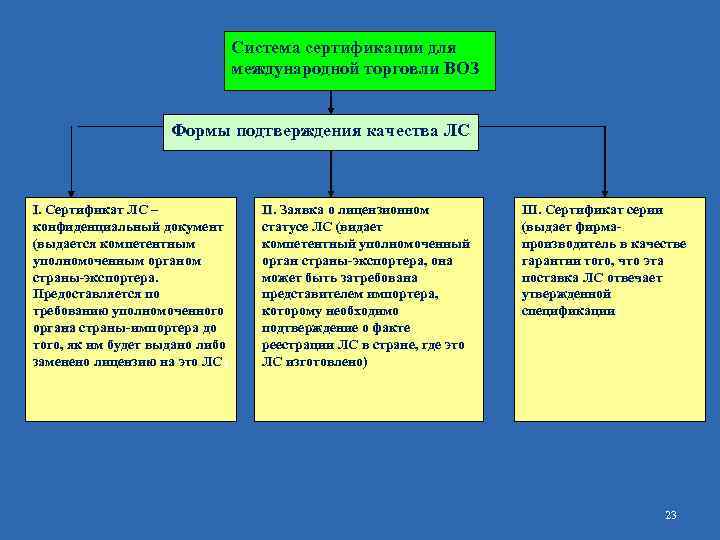 Система сертификации для международной торговли ВОЗ Формы подтверждения качества ЛС I. Сертификат ЛС – конфиденциальный документ (выдается компетентным уполномоченным органом страны-экспортера. Предоставляется по требованию уполномоченного органа страны-импортера до органа того, як им будет выдано либо заменено лицензию на это ЛС) ІІ. Заявка о лицензионном ІІ статусе ЛС (видает компетентный уполномоченный орган страны-экспортера, она может быть затребована представителем импортера, которому необходимо подтверждение о факте реестрации ЛС в стране, где это ЛС изготовлено) ІІІ. Сертификат серии (выдает фирмапроизводитель в качестве гарантии того, что эта поставка ЛС отвечает утвержденной спецификации) 23
Система сертификации для международной торговли ВОЗ Формы подтверждения качества ЛС I. Сертификат ЛС – конфиденциальный документ (выдается компетентным уполномоченным органом страны-экспортера. Предоставляется по требованию уполномоченного органа страны-импортера до органа того, як им будет выдано либо заменено лицензию на это ЛС) ІІ. Заявка о лицензионном ІІ статусе ЛС (видает компетентный уполномоченный орган страны-экспортера, она может быть затребована представителем импортера, которому необходимо подтверждение о факте реестрации ЛС в стране, где это ЛС изготовлено) ІІІ. Сертификат серии (выдает фирмапроизводитель в качестве гарантии того, что эта поставка ЛС отвечает утвержденной спецификации) 23
 Аптека в структуре Системы контроля 24
Аптека в структуре Системы контроля 24
 Организация внутриаптечного контроля изготовленных лекарственных препаратов 25
Организация внутриаптечного контроля изготовленных лекарственных препаратов 25
 Правила проведения внутриаптечного контроля изготовленных лекарственных препаратов (далее - Правила) устанавливают требования к обеспечению качества лекарственных препаратов, изготовленных в аптеке, и организации проведения внутриаптечного контроля. Действие Правил распространяется на все аптеки, в том числе гомеопатические, независимо от их формы собственности и ведомственной принадлежности, которые изготовляют лекарственные препараты. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 26
Правила проведения внутриаптечного контроля изготовленных лекарственных препаратов (далее - Правила) устанавливают требования к обеспечению качества лекарственных препаратов, изготовленных в аптеке, и организации проведения внутриаптечного контроля. Действие Правил распространяется на все аптеки, в том числе гомеопатические, независимо от их формы собственности и ведомственной принадлежности, которые изготовляют лекарственные препараты. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 26
 3. Руководитель аптеки приказом назначает фармацевта (провизора-аналитика), ответственного за организацию и проведение контроля качества изготовляемых ЛП в аптеке и снижения риска допущения ошибок при изготовлении ЛП. 4. Руководитель аптеки обеспечивает рабочее место специалиста типовым набором средств измерений, испытательным оборудованием, лабораторной посудой, вспомогательными материалами, применяемыми проведении аналитических работ в аптеках, в соответствии с установленным перечнем согласно приложению 1 к настоящим Правилам, а также нормативными правовыми актами РК, регламентирующими порядок изготовления и проведения контроля качества лекарственных препаратов, изготовленных в аптеке, и справочной литературой. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 27
3. Руководитель аптеки приказом назначает фармацевта (провизора-аналитика), ответственного за организацию и проведение контроля качества изготовляемых ЛП в аптеке и снижения риска допущения ошибок при изготовлении ЛП. 4. Руководитель аптеки обеспечивает рабочее место специалиста типовым набором средств измерений, испытательным оборудованием, лабораторной посудой, вспомогательными материалами, применяемыми проведении аналитических работ в аптеках, в соответствии с установленным перечнем согласно приложению 1 к настоящим Правилам, а также нормативными правовыми актами РК, регламентирующими порядок изготовления и проведения контроля качества лекарственных препаратов, изготовленных в аптеке, и справочной литературой. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 27
 Рабочее место фармацевта-аналитика размещается в специальном помещении вблизи от асептического блока, дефектарской и ассистентской. Фармацевт-аналитик, впервые назначенный на эту должность, должен пройти курс стажировки в аккредитованной испытательной лаборатории на договорной основе или в аптеке, на рабочем месте у фармацевтааналитика, имеющего стаж работы не менее 3 лет. Фармацевт-аналитик должен повышать квалификацию 1 раз в 5 лет на курсах повышения квалификации. 28
Рабочее место фармацевта-аналитика размещается в специальном помещении вблизи от асептического блока, дефектарской и ассистентской. Фармацевт-аналитик, впервые назначенный на эту должность, должен пройти курс стажировки в аккредитованной испытательной лаборатории на договорной основе или в аптеке, на рабочем месте у фармацевтааналитика, имеющего стаж работы не менее 3 лет. Фармацевт-аналитик должен повышать квалификацию 1 раз в 5 лет на курсах повышения квалификации. 28
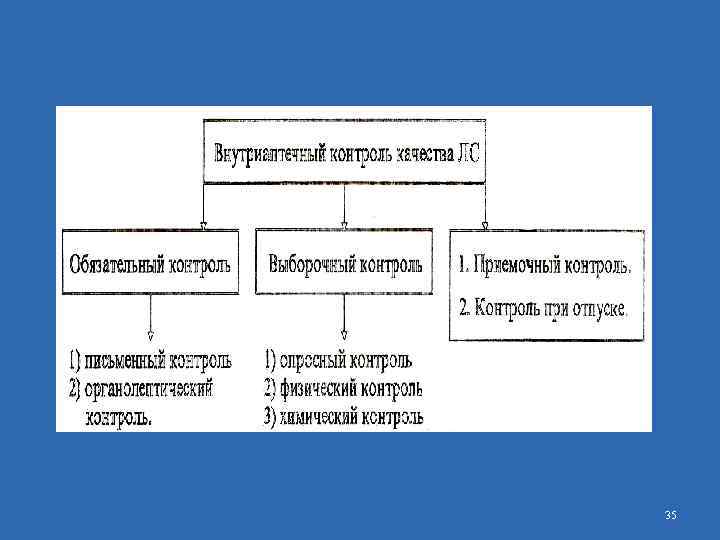
 5. ЛП, изготовленные в аптеке (в том числе внутриаптечная заготовка, фасованная продукция, концентраты и полуфабрикаты), подвергаются внутриаптечному контролю. 6. Внутриаптечный контроль выполняется проведением следующего: 1) предупредительных мероприятий; 2) приемочного контроля исходных материалов, используемых для изготовления лекарственных препаратов; 3) обязательного письменного контроля; 4) выборочного опросного контроля; 5) обязательного органолептического контроля; 6) выборочного физического контроля; 7) химического контроля; 8) контроля при отпуске. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 29
5. ЛП, изготовленные в аптеке (в том числе внутриаптечная заготовка, фасованная продукция, концентраты и полуфабрикаты), подвергаются внутриаптечному контролю. 6. Внутриаптечный контроль выполняется проведением следующего: 1) предупредительных мероприятий; 2) приемочного контроля исходных материалов, используемых для изготовления лекарственных препаратов; 3) обязательного письменного контроля; 4) выборочного опросного контроля; 5) обязательного органолептического контроля; 6) выборочного физического контроля; 7) химического контроля; 8) контроля при отпуске. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 29
 7. Результаты органолептического, физического и химического контроля ЛП регистрируются в Журнале регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, ЛП, изготовленных по индивидуальным рецептам (требованиям медицинских организаций), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки по форме согласно приложению 2 к настоящим Правилам. Журнал должен быть пронумерован, прошнурован, скреплен печатью территориального органа в сфере обращения ЛП, ИМН и МТ Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 30
7. Результаты органолептического, физического и химического контроля ЛП регистрируются в Журнале регистрации результатов органолептического, физического и химического контроля внутриаптечной заготовки, ЛП, изготовленных по индивидуальным рецептам (требованиям медицинских организаций), концентратов, полуфабрикатов, тритураций, спирта этилового и фасовки по форме согласно приложению 2 к настоящим Правилам. Журнал должен быть пронумерован, прошнурован, скреплен печатью территориального органа в сфере обращения ЛП, ИМН и МТ Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 30
 8. При проведении внутриаптечного контроля качество ЛП, в том числе гомеопатических, изготовляемых в аптеке, устанавливается по комплексу показателей, дающих полную характеристику ЛП. Для оценки качества лекарственных препаратов, изготовляемых в аптеке, применяются два термина: "удовлетворяет" ("годная продукция"), "не удовлетворяет" ("бракованная"). Изготовленные лекарственные препараты в случаях признания по результатам внутриаптечного контроля как "не удовлетворительные" ("бракованные") подлежат изъятию и уничтожению. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 31
8. При проведении внутриаптечного контроля качество ЛП, в том числе гомеопатических, изготовляемых в аптеке, устанавливается по комплексу показателей, дающих полную характеристику ЛП. Для оценки качества лекарственных препаратов, изготовляемых в аптеке, применяются два термина: "удовлетворяет" ("годная продукция"), "не удовлетворяет" ("бракованная"). Изготовленные лекарственные препараты в случаях признания по результатам внутриаптечного контроля как "не удовлетворительные" ("бракованные") подлежат изъятию и уничтожению. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 31
 9. Аптеки с правом изготовления лекарственных препаратов ежегодно по итогам года составляют отчет аптеки о работе по контролю качества лекарственных препаратов (в том числе гомеопатических) по форме согласно приложению 3 к настоящим Правилам, который в срок до 10 января следующего за отчетным года направляется в территориальные органы в сфере обращения лекарственных средств, изделий медицинского назначения, медицинской техники. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 32
9. Аптеки с правом изготовления лекарственных препаратов ежегодно по итогам года составляют отчет аптеки о работе по контролю качества лекарственных препаратов (в том числе гомеопатических) по форме согласно приложению 3 к настоящим Правилам, который в срок до 10 января следующего за отчетным года направляется в территориальные органы в сфере обращения лекарственных средств, изделий медицинского назначения, медицинской техники. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 32
 ОРГАНИЗАЦИЯ РАБОТЫ ПО КОНТРОЛЬНО-АНАЛИТИЧЕСКОМУ ОБСЛУЖИВАНИЮ АПТЕКИ 10. Для осуществления контроля за производственной деятельностью, выполнением аптекой предупредительных мероприятий, а также за качеством изготовляемых ЛП аптека заключает с органом по сертификации ЛС или с одной из аккредитованных испытательных лабораторий договор о контрольно-аналитическом обслуживании и обеспечении необходимыми химическими реактивами, титрованными растворами, приготовленными испытательной лабораторией по требованию аптеки. Оплата стоимости контрольно-аналитического обслуживания и обеспечения необходимыми химическими реактивами, титрованными растворами производится на счет аптеки в соответствии с договором. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 33
ОРГАНИЗАЦИЯ РАБОТЫ ПО КОНТРОЛЬНО-АНАЛИТИЧЕСКОМУ ОБСЛУЖИВАНИЮ АПТЕКИ 10. Для осуществления контроля за производственной деятельностью, выполнением аптекой предупредительных мероприятий, а также за качеством изготовляемых ЛП аптека заключает с органом по сертификации ЛС или с одной из аккредитованных испытательных лабораторий договор о контрольно-аналитическом обслуживании и обеспечении необходимыми химическими реактивами, титрованными растворами, приготовленными испытательной лабораторией по требованию аптеки. Оплата стоимости контрольно-аналитического обслуживания и обеспечения необходимыми химическими реактивами, титрованными растворами производится на счет аптеки в соответствии с договором. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 33
 Предупредительные мероприятия 14. Предупредительные мероприятия направлены на снижение риска возникновения ошибок и на обеспечение качества изготовляемых ЛП. Предупредительные мероприятия заключаются в выполнении: 1) условий асептического изготовления ЛП; 2) обеспечения исправности и точности весо-измерительных приборов, проведение ежегодной их поверки; 3) получения, сбора, хранения воды очищенной, воды для инъекций и маркировки емкости в виде указания на бирке; 4) сроков, условий хранения реактивов, эталонных и титрованных растворов и правильном их оформлении ; 5) определения отклонений в проверяемых ЛП; 6) обработки, заполнения, оформления штангласов, бюреточной установки и нанесения на них необходимой информации. 34
Предупредительные мероприятия 14. Предупредительные мероприятия направлены на снижение риска возникновения ошибок и на обеспечение качества изготовляемых ЛП. Предупредительные мероприятия заключаются в выполнении: 1) условий асептического изготовления ЛП; 2) обеспечения исправности и точности весо-измерительных приборов, проведение ежегодной их поверки; 3) получения, сбора, хранения воды очищенной, воды для инъекций и маркировки емкости в виде указания на бирке; 4) сроков, условий хранения реактивов, эталонных и титрованных растворов и правильном их оформлении ; 5) определения отклонений в проверяемых ЛП; 6) обработки, заполнения, оформления штангласов, бюреточной установки и нанесения на них необходимой информации. 34
 35
35
 ЛИТЕРАТУРА 1. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 36
ЛИТЕРАТУРА 1. Постановление Правительства Республики Казахстан от 19 января 2012 года № 114 Об утверждении Правил проведения внутриаптечного контроля изготовленных лекарственных препаратов. 36
 КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Единые правила оформления лекарственных форм, изготовленных в аптеках. 2. Маркировка лекарственных средств. 3. Виды этикеток. 4. Предупредительные надписи. 5. Контроль при отпуске лекарственных средств. 6. Отпуск лекарственных средств. 37
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Единые правила оформления лекарственных форм, изготовленных в аптеках. 2. Маркировка лекарственных средств. 3. Виды этикеток. 4. Предупредительные надписи. 5. Контроль при отпуске лекарственных средств. 6. Отпуск лекарственных средств. 37


