Курс лекций КСЕ_3.ppt
- Количество слайдов: 42
 Тема 6. Современные концепции химии Вспомните, кто первым ввёл понятие «атом» ?
Тема 6. Современные концепции химии Вспомните, кто первым ввёл понятие «атом» ?
 Современное понятие химии: НАУКА ОБ ИЗМЕНЕНИЯХ ВО ВНЕШНИХ ЭЛЕКТРОННЫХ ОБОЛОЧКАХ АТОМОВ. Схема образования простейших молекул:
Современное понятие химии: НАУКА ОБ ИЗМЕНЕНИЯХ ВО ВНЕШНИХ ЭЛЕКТРОННЫХ ОБОЛОЧКАХ АТОМОВ. Схема образования простейших молекул:
 Основные химические константы: 1. Универсальная газовая постоянная R = 8, 314 Дж/моль∙К 2. Число Авогадро – число структурных единиц (атомов, молекул, ионов) в 1 моль вещества NA=6, 022· 1023 моль– 1 3. Мольный объём газа при н. у. Vm=22, 4 л/моль 4. Постоянная Больцмана k=1, 38· 10– 23 Дж/К
Основные химические константы: 1. Универсальная газовая постоянная R = 8, 314 Дж/моль∙К 2. Число Авогадро – число структурных единиц (атомов, молекул, ионов) в 1 моль вещества NA=6, 022· 1023 моль– 1 3. Мольный объём газа при н. у. Vm=22, 4 л/моль 4. Постоянная Больцмана k=1, 38· 10– 23 Дж/К
 Знакомо ли вам понятие «энтропия» ?
Знакомо ли вам понятие «энтропия» ?
 Энтропия В физике: – мера беспорядка в системе, или мера «обесцененной» энергии. В информатике: – мера неопределённости информации об объекте.
Энтропия В физике: – мера беспорядка в системе, или мера «обесцененной» энергии. В информатике: – мера неопределённости информации об объекте.
 Термодинамический смысл: Величина, равная отношению некоторой приведенной теплоты к абсолютной температуре: S ≥ δQ / Т имеет ту же размерность, что и постоянная R (Дж/моль∙К)
Термодинамический смысл: Величина, равная отношению некоторой приведенной теплоты к абсолютной температуре: S ≥ δQ / Т имеет ту же размерность, что и постоянная R (Дж/моль∙К)
 Статистический смысл: Исходит из того, что термодинамические возникают вследствие хаотичного теплового движения частиц: S = k · ln P P – число элементарных микроскопических состояний системы, k – постоянная Больцмана.
Статистический смысл: Исходит из того, что термодинамические возникают вследствие хаотичного теплового движения частиц: S = k · ln P P – число элементарных микроскопических состояний системы, k – постоянная Больцмана.
 Смысл энтропии раскрывается в формулировках 2 -го закона термодинамики: 1. Невозможна работа за счет энергии тел, находящихся в состоянии термодинамического равновесия.
Смысл энтропии раскрывается в формулировках 2 -го закона термодинамики: 1. Невозможна работа за счет энергии тел, находящихся в состоянии термодинамического равновесия.
 2. Невозможна самопроизвольная передача энергии от более горячего тела к более холодному. ? ? ? : а в это время у вас на кухне работает холодильник, который внутри охлаждается, а снаружи нагревается…
2. Невозможна самопроизвольная передача энергии от более горячего тела к более холодному. ? ? ? : а в это время у вас на кухне работает холодильник, который внутри охлаждается, а снаружи нагревается…
 3. Термодинамические процессы необратимы, а система стремится к состоянию теплового равновесия, в котором температуры тел выравниваются. На самом деле процессы бывают обратимыми ТОЛЬКО ПОД ДЕЙСТВИЕМ ВНЕШНИХ СИЛ.
3. Термодинамические процессы необратимы, а система стремится к состоянию теплового равновесия, в котором температуры тел выравниваются. На самом деле процессы бывают обратимыми ТОЛЬКО ПОД ДЕЙСТВИЕМ ВНЕШНИХ СИЛ.
 Пример, изменение агрегатного состояния веществ: таяние льда – процесс, обратный замерзанию (кристаллизации) жидкой воды. Вопрос: что в этих процессах является движущей (внешней) силой?
Пример, изменение агрегатного состояния веществ: таяние льда – процесс, обратный замерзанию (кристаллизации) жидкой воды. Вопрос: что в этих процессах является движущей (внешней) силой?
 4. Энтропия незамкнутой системы возрастает, а ее максимальное значение достигается в состоянии теплового равновесия.
4. Энтропия незамкнутой системы возрастает, а ее максимальное значение достигается в состоянии теплового равновесия.
 5. Энтропия идеального кристалла при абсолютном нуле температуры равна нулю. Сравните: S=k·ln. P. При Т=0 К атомы находятся в состоянии абсолютного покоя, поэтому число возможных состояний P=1, энтропия – S=0.
5. Энтропия идеального кристалла при абсолютном нуле температуры равна нулю. Сравните: S=k·ln. P. При Т=0 К атомы находятся в состоянии абсолютного покоя, поэтому число возможных состояний P=1, энтропия – S=0.
 А теперь ещё раз внимательно прочитаем все 5 формулировок и запишем новую – шестую. Какие есть варианты?
А теперь ещё раз внимательно прочитаем все 5 формулировок и запишем новую – шестую. Какие есть варианты?
 6. Абсолютного нуля температуры достичь невозможно.
6. Абсолютного нуля температуры достичь невозможно.
 Свойством обратимости обладают и химические реакции. Например, сгорание водорода – процесс, обратный реакции электролиза (разложения электрическим током) воды на газообразные водород и кислород: 2 Н 2 (г. ) + О 2 (г. ) ↔ 2 Н 2 О (ж. )
Свойством обратимости обладают и химические реакции. Например, сгорание водорода – процесс, обратный реакции электролиза (разложения электрическим током) воды на газообразные водород и кислород: 2 Н 2 (г. ) + О 2 (г. ) ↔ 2 Н 2 О (ж. )
 ХИМИЧЕСКОЕ РАВНОВЕСИЕ – такое состояние системы, когда скорости прямого и обратного процессов равны. Равновесие может существовать ТОЛЬКО В ЗАМКНУТОЙ (изолированной) СИСТЕМЕ. Какие системы называются изолированными?
ХИМИЧЕСКОЕ РАВНОВЕСИЕ – такое состояние системы, когда скорости прямого и обратного процессов равны. Равновесие может существовать ТОЛЬКО В ЗАМКНУТОЙ (изолированной) СИСТЕМЕ. Какие системы называются изолированными?
 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ – изменение концентрации вещества в единицу времени: v = ± d. C / dt «+» - рост концентрации продукта, «–» - расходование реагента.
СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ – изменение концентрации вещества в единицу времени: v = ± d. C / dt «+» - рост концентрации продукта, «–» - расходование реагента.
 ЗАКОН ДЕЙСТВУЮЩИХ МАСС: скорость реакции зависит от концентраций реагирующих веществ в данный момент времени. Для прямой реакции (сгорания Н 2) и для обратной (разложения Н 2 О): vпрям. = Кпрям. ·[Н 2]2·[О 2] vобр. = Кобр. ·[Н 2 О]2
ЗАКОН ДЕЙСТВУЮЩИХ МАСС: скорость реакции зависит от концентраций реагирующих веществ в данный момент времени. Для прямой реакции (сгорания Н 2) и для обратной (разложения Н 2 О): vпрям. = Кпрям. ·[Н 2]2·[О 2] vобр. = Кобр. ·[Н 2 О]2
![В случае равенства vпрям. и vобр. состояние равновесия описывается константой равновесия Кр: 2·[О ] В случае равенства vпрям. и vобр. состояние равновесия описывается константой равновесия Кр: 2·[О ]](https://present5.com/presentation/-78331350_333453675/image-20.jpg) В случае равенства vпрям. и vобр. состояние равновесия описывается константой равновесия Кр: 2·[О ] [Н 2 2] Кр = ––––– 2 [Н 2 О]
В случае равенства vпрям. и vобр. состояние равновесия описывается константой равновесия Кр: 2·[О ] [Н 2 2] Кр = ––––– 2 [Н 2 О]
 ПРИНЦИП Ле ШАТЕЛЬЕ: Если на систему, находящуюся в устойчивом равновесии, оказать внешнее воздействие, то РАВНОВЕСИЕ СМЕЩАЕТСЯ в направлении, КОТОРОЕ ПРОТИВОДЕЙСТВУЕТ этому изменению.
ПРИНЦИП Ле ШАТЕЛЬЕ: Если на систему, находящуюся в устойчивом равновесии, оказать внешнее воздействие, то РАВНОВЕСИЕ СМЕЩАЕТСЯ в направлении, КОТОРОЕ ПРОТИВОДЕЙСТВУЕТ этому изменению.
 К факторам, влияющим на смещение равновесия, относятся: КОНЦЕНТРАЦИИ, ДАВЛЕНИЕ (продуктов, реагентов) и ТЕМПЕРАТУРА системы. На смещение равновесия НЕ ВЛИЯЕТ НАЛИЧИЕ КАТАЛИЗАТОРОВ, т. к. они одновременно ускоряют и прямой, и обратный процесс.
К факторам, влияющим на смещение равновесия, относятся: КОНЦЕНТРАЦИИ, ДАВЛЕНИЕ (продуктов, реагентов) и ТЕМПЕРАТУРА системы. На смещение равновесия НЕ ВЛИЯЕТ НАЛИЧИЕ КАТАЛИЗАТОРОВ, т. к. они одновременно ускоряют и прямой, и обратный процесс.
 Тема 7. Процессы самооорганизации в природе Вспомним, что такое ЭНТРОПИЯ
Тема 7. Процессы самооорганизации в природе Вспомним, что такое ЭНТРОПИЯ
 Почему тепло переходит от горячего тела к холодному? Почему пирамида Хеопса разрушается, а не восстанавливается?
Почему тепло переходит от горячего тела к холодному? Почему пирамида Хеопса разрушается, а не восстанавливается?
 Самоорганизация: 1. Фундаментальное понятие, указывающее на развитие в направлении от менее сложных объектов к более сложным и упорядоченным формам организации материи. 2. Образование упорядоченных структур, происходящие не за счет действия внешних сил (факторов), а в результате внутренней перестройки системы.
Самоорганизация: 1. Фундаментальное понятие, указывающее на развитие в направлении от менее сложных объектов к более сложным и упорядоченным формам организации материи. 2. Образование упорядоченных структур, происходящие не за счет действия внешних сил (факторов), а в результате внутренней перестройки системы.
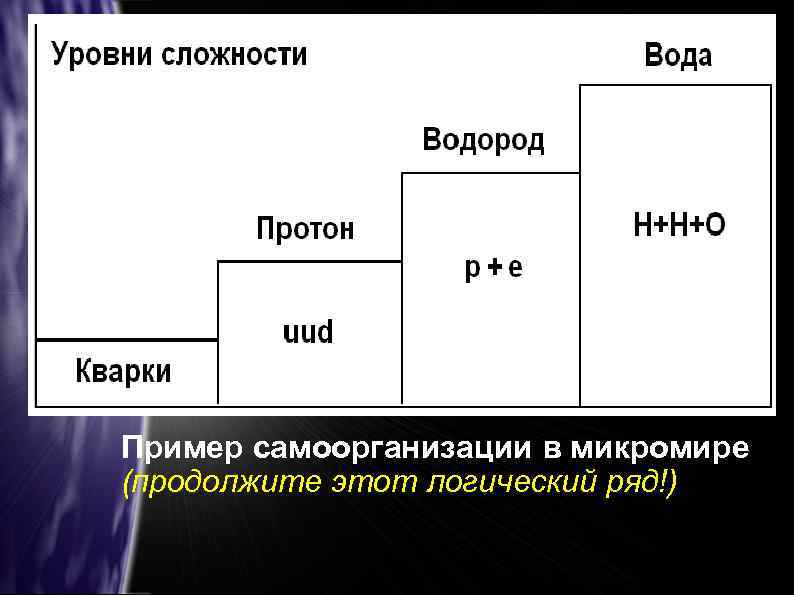 Пример самоорганизации в микромире (продолжите этот логический ряд!)
Пример самоорганизации в микромире (продолжите этот логический ряд!)
 Разработкой теории самоорганизации занимаются: 1. Термодинамика неравновесных (открытых) систем. 2. Синергетика. 3. Теория катастроф (ТК).
Разработкой теории самоорганизации занимаются: 1. Термодинамика неравновесных (открытых) систем. 2. Синергетика. 3. Теория катастроф (ТК).
 ТК сводит многообразие встречающихся ситуаций к набору стандартных схем. Применяется: в механике конструкций, метеорологии, аэродинамике, оптике, теории кооперативных явлений, квантовой динамике.
ТК сводит многообразие встречающихся ситуаций к набору стандартных схем. Применяется: в механике конструкций, метеорологии, аэродинамике, оптике, теории кооперативных явлений, квантовой динамике.
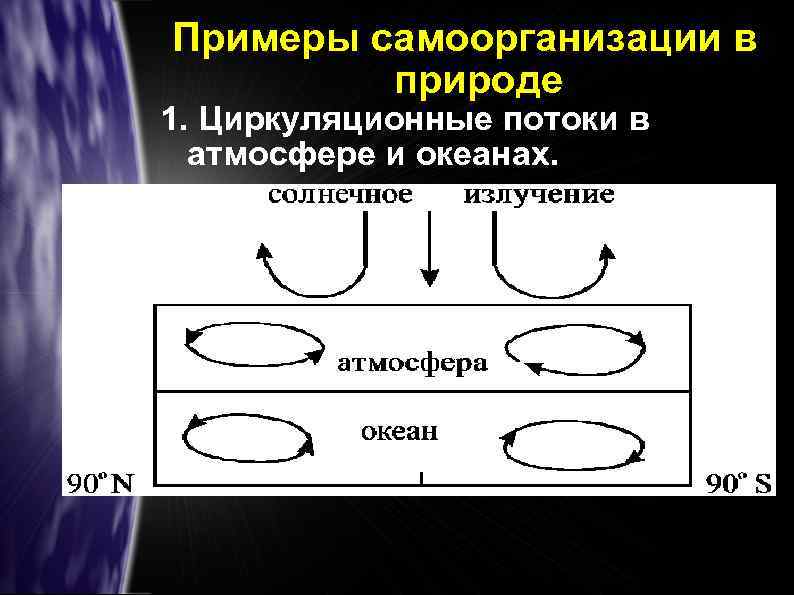 Примеры самоорганизации в природе 1. Циркуляционные потоки в атмосфере и океанах.
Примеры самоорганизации в природе 1. Циркуляционные потоки в атмосфере и океанах.
 Главная причина воздушных течений – неравномерное распределение тепла на поверхности Земли, что приводит к неодинаковому нагреву в различных поясах.
Главная причина воздушных течений – неравномерное распределение тепла на поверхности Земли, что приводит к неодинаковому нагреву в различных поясах.
 2. Ячейки Бенара — упорядоченные конвективные ячейки (цилиндры или 6 гранники) в слое вязкой жидкости (силиконовое масло) с вертикальным градиентом температуры, т. е. равномерно подогреваемой снизу.
2. Ячейки Бенара — упорядоченные конвективные ячейки (цилиндры или 6 гранники) в слое вязкой жидкости (силиконовое масло) с вертикальным градиентом температуры, т. е. равномерно подогреваемой снизу.
 3. Реакция Белоусова – Жаботинского: хаотические автоколебательные процессы. При окислении бромата калия малоновой кислотой в кислой среде в присутствии катализатора — ионов церия Ce(+3) раствор в колбе может часами со строгой периодичностью изменять цвет во всем видимом диапазоне от рубиново-красного до голубого.
3. Реакция Белоусова – Жаботинского: хаотические автоколебательные процессы. При окислении бромата калия малоновой кислотой в кислой среде в присутствии катализатора — ионов церия Ce(+3) раствор в колбе может часами со строгой периодичностью изменять цвет во всем видимом диапазоне от рубиново-красного до голубого.
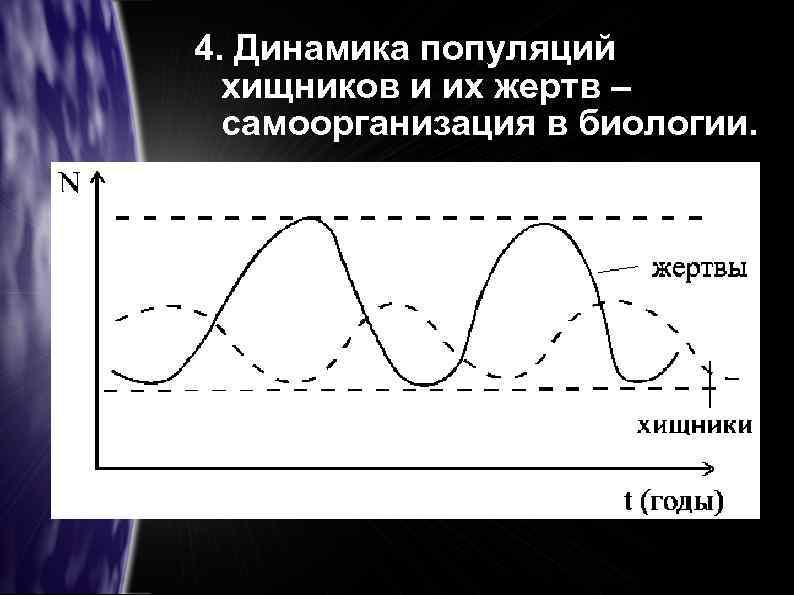 4. Динамика популяций хищников и их жертв – самоорганизация в биологии.
4. Динамика популяций хищников и их жертв – самоорганизация в биологии.
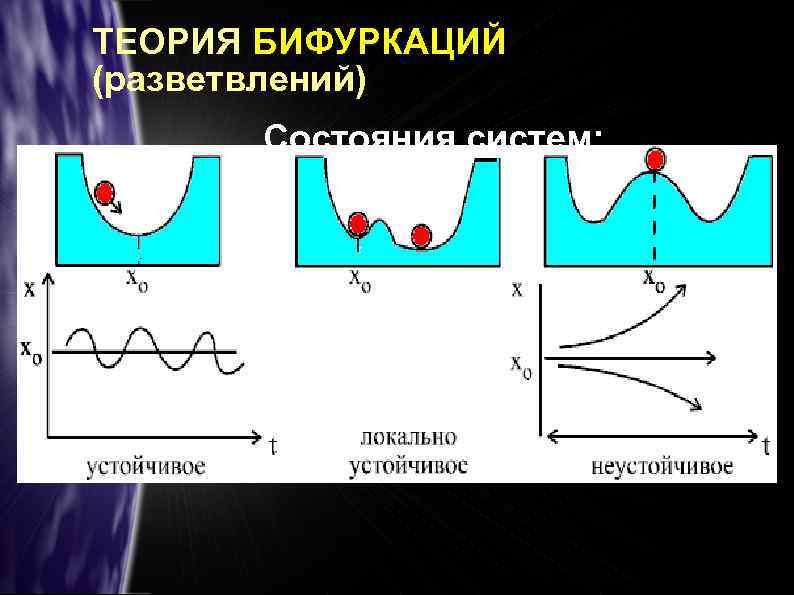 ТЕОРИЯ БИФУРКАЦИЙ (разветвлений) Состояния систем:
ТЕОРИЯ БИФУРКАЦИЙ (разветвлений) Состояния систем:
 Момент перехода системы в новое состояние зависит от ФЛУКТУАЦИЙ — малых СЛУЧАЙНЫХ ОТКЛОНЕНИЙ ПАРАМЕТРОВ системы ОТ СРЕДНИХ ЗНАЧЕНИЙ. В момент бифуркации возможно НЕСКОЛЬКО вариантов дальнейшего развития объекта.
Момент перехода системы в новое состояние зависит от ФЛУКТУАЦИЙ — малых СЛУЧАЙНЫХ ОТКЛОНЕНИЙ ПАРАМЕТРОВ системы ОТ СРЕДНИХ ЗНАЧЕНИЙ. В момент бифуркации возможно НЕСКОЛЬКО вариантов дальнейшего развития объекта.
 Поэтому природа ограничивает возможности точного прогнозирования развития. ПЕРЕХОД из критического состояния ОСУЩЕСТВЛЯЕТСЯ СКАЧКОМ. Если тело плывет по реке точно посередине, оно с равной вероятностью пойдет через правый или левый рукав относительно волнореза под действием случайных сил.
Поэтому природа ограничивает возможности точного прогнозирования развития. ПЕРЕХОД из критического состояния ОСУЩЕСТВЛЯЕТСЯ СКАЧКОМ. Если тело плывет по реке точно посередине, оно с равной вероятностью пойдет через правый или левый рукав относительно волнореза под действием случайных сил.
 Самоорганизация не связана с особым классом веществ, но она существует лишь в системах, удовлетворяющих условиям: 1. Открытые системы; 2. Макроскопические системы, описываемые нелинейными уравнениями.
Самоорганизация не связана с особым классом веществ, но она существует лишь в системах, удовлетворяющих условиям: 1. Открытые системы; 2. Макроскопические системы, описываемые нелинейными уравнениями.
 Неравновесные процессы идут С ВОЗНИКНОВЕНИЕМ ОСОБЫХ УПОРЯДОЧЕННЫХ устойчивых (ДИССИПАТИВНЫХ) СТРУКТУР.
Неравновесные процессы идут С ВОЗНИКНОВЕНИЕМ ОСОБЫХ УПОРЯДОЧЕННЫХ устойчивых (ДИССИПАТИВНЫХ) СТРУКТУР.
 К диссипативным относится любая упорядоченная неравновесная структура, возникающая в результате самоорганизации (например, правильный кристалл, возникающий при охлаждении жидкости).
К диссипативным относится любая упорядоченная неравновесная структура, возникающая в результате самоорганизации (например, правильный кристалл, возникающий при охлаждении жидкости).
 Кстати, как получить кристалл правильной формы в домашних условиях?
Кстати, как получить кристалл правильной формы в домашних условиях?
 Рецепт Берётся поваренная соль (Na. Cl) или медный купорос (Cu. SO 4), готовится горячий (80 -90°С) НАСЫЩЕННЫЙ РАСТВОР, наливается в бытовой термос, туда же опускается нитка с узелком (на котором начнётся процесс кристаллизации). Термос оставляется в покое на несколько суток. ВНИМАНИЕ! При контакте с парами и раствором Cu. SO 4 соблюдайте осторожность!
Рецепт Берётся поваренная соль (Na. Cl) или медный купорос (Cu. SO 4), готовится горячий (80 -90°С) НАСЫЩЕННЫЙ РАСТВОР, наливается в бытовой термос, туда же опускается нитка с узелком (на котором начнётся процесс кристаллизации). Термос оставляется в покое на несколько суток. ВНИМАНИЕ! При контакте с парами и раствором Cu. SO 4 соблюдайте осторожность!



