Тема 5 Металлы и среды.ppt
- Количество слайдов: 15
 Тема 5. Поведение металлических конструкционных материалов в воде, растворах кислот, оснований и солей
Тема 5. Поведение металлических конструкционных материалов в воде, растворах кислот, оснований и солей
 5. 1. Общие представления о конструкционных материалах ¡ Под конструкционными материалами понимают материалы, предназначенные для изготовления промышленных конструкций. Конструкционный материал Элемент - основа Растворенные элементы Стали Дуралюмин Силумин Монель Хастеллой Нихром Латуни Бронзы Титановые сплавы Fe Al Al Ni Ni Ni Cu Cu Ti C (Cr, Ni, Mo, Ti и др. ) Cu (Mg, Mn) Si Cu (Fe) Mo (Cr, Fe) Cr Zn Sn (Mo, Cr, V, Mn) В качестве покрытий используют Zn, Ni, Cr, Pb и другие металлы
5. 1. Общие представления о конструкционных материалах ¡ Под конструкционными материалами понимают материалы, предназначенные для изготовления промышленных конструкций. Конструкционный материал Элемент - основа Растворенные элементы Стали Дуралюмин Силумин Монель Хастеллой Нихром Латуни Бронзы Титановые сплавы Fe Al Al Ni Ni Ni Cu Cu Ti C (Cr, Ni, Mo, Ti и др. ) Cu (Mg, Mn) Si Cu (Fe) Mo (Cr, Fe) Cr Zn Sn (Mo, Cr, V, Mn) В качестве покрытий используют Zn, Ni, Cr, Pb и другие металлы
 5. 2. Поведение металлов в воде Н 20 → Н+ + ОН- ¡ ¡ ¡ ¡ ¡ Основной катодный деполяризатор – ионы водорода An: Me ⇄ Men+ + n e– Kt: H+ +2 e- ↔ H 2 В воде φ2 H+/H 2 = -0, 415 В Металлы, потенциал которых отрицательнее потенциала восстановления ионов водорода (-0, 415 В), окисляются, вытесняя водород из воды. Эти металлы стоят в ряду напряжений до Fe (включительно). Металлы, образующие растворимые оксиды, взаимодействуют с водой, образуя основания. Эти металлы стоят в ряду напряжений до Mg. Na + H 2 O → Na. OH + H 2 Fe + H 2 O → Fe. O + H 2 Mg, Al, Zn и Cr в воде пассивируются и не взаимодействуют с ней. Al + H 2 O ↛ (пассивация)
5. 2. Поведение металлов в воде Н 20 → Н+ + ОН- ¡ ¡ ¡ ¡ ¡ Основной катодный деполяризатор – ионы водорода An: Me ⇄ Men+ + n e– Kt: H+ +2 e- ↔ H 2 В воде φ2 H+/H 2 = -0, 415 В Металлы, потенциал которых отрицательнее потенциала восстановления ионов водорода (-0, 415 В), окисляются, вытесняя водород из воды. Эти металлы стоят в ряду напряжений до Fe (включительно). Металлы, образующие растворимые оксиды, взаимодействуют с водой, образуя основания. Эти металлы стоят в ряду напряжений до Mg. Na + H 2 O → Na. OH + H 2 Fe + H 2 O → Fe. O + H 2 Mg, Al, Zn и Cr в воде пассивируются и не взаимодействуют с ней. Al + H 2 O ↛ (пассивация)
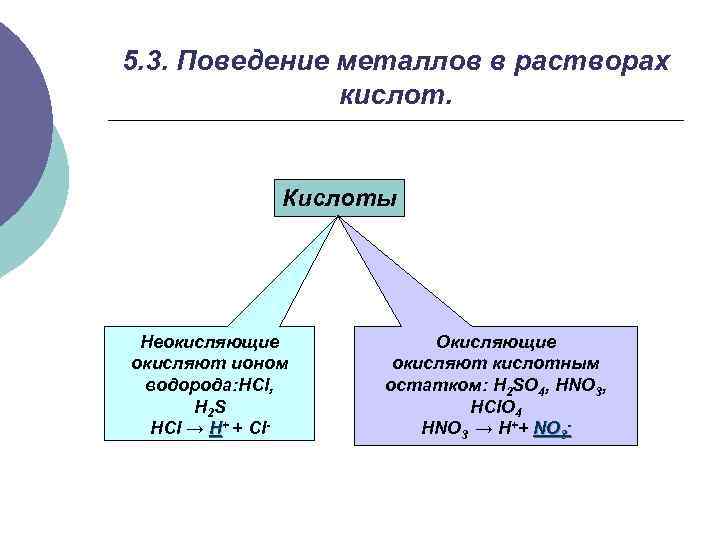 5. 3. Поведение металлов в растворах кислот. Кислоты Неокисляющие окисляют ионом водорода: HCl, H 2 S HCl → H+ + Cl- Окисляющие окисляют кислотным остатком: H 2 SO 4, HNO 3, HCl. O 4 HNO 3 → H++ NO 3 -
5. 3. Поведение металлов в растворах кислот. Кислоты Неокисляющие окисляют ионом водорода: HCl, H 2 S HCl → H+ + Cl- Окисляющие окисляют кислотным остатком: H 2 SO 4, HNO 3, HCl. O 4 HNO 3 → H++ NO 3 -
 5. 3. 1. Поведение металлов в растворах неокисляющих кислот ¡ ¡ ¡ ¡ ¡ Общие принципы Основной катодный деполяризатор – ионы водорода An: Me ⇄ Men+ + n e– Kt: H+ +2 e- ↔ H 2 Металлы, потенциал которых в данных условиях отрицатель-нее потенциала восстановления ионов водорода, вытеснят его из растворов неокисляющих кислот. Остальные металлы с неокисляющими кислотами не взаимодействуют: Me + Hk. An → Mem. Ann + H 2 если φMen+/Me< φ2 H+/H 2 Me + Hk. An ↛ если φMen+/Me> φ2 H+/H 2 При стандартных условиях с неокисляющими кислотами взаимодействуют только металлы, стоящие в ряду напряжений до водорода: Fe + Hk. An → Fem. Ann + H 2 Cu + Hk. An ↛
5. 3. 1. Поведение металлов в растворах неокисляющих кислот ¡ ¡ ¡ ¡ ¡ Общие принципы Основной катодный деполяризатор – ионы водорода An: Me ⇄ Men+ + n e– Kt: H+ +2 e- ↔ H 2 Металлы, потенциал которых в данных условиях отрицатель-нее потенциала восстановления ионов водорода, вытеснят его из растворов неокисляющих кислот. Остальные металлы с неокисляющими кислотами не взаимодействуют: Me + Hk. An → Mem. Ann + H 2 если φMen+/Me< φ2 H+/H 2 Me + Hk. An ↛ если φMen+/Me> φ2 H+/H 2 При стандартных условиях с неокисляющими кислотами взаимодействуют только металлы, стоящие в ряду напряжений до водорода: Fe + Hk. An → Fem. Ann + H 2 Cu + Hk. An ↛
 Взаимодействие металлов с растворами соляной кислоты HCl – типичная неокисляющая кислота Me + HCl→ Me. Cln + H 2 если φMen+/Me< φ2 H+/H 2 Me + HCl ↛ если φMen+/Me> φ2 H+/H 2 Fe + 2 HCl → Fe. Cl 2 + H 2 Cu + 2 HClр ↛ Особенности поведения металлов в растворах соляной кислоты. Титан в разбавленных растворах HCl сохраняет пассивное состояние и не растворяется. В концентрированных растворах пассивное состояние нарушается и происходит растворение титана. Медь в растворах соляной кислоты высокой концентрации (>30%) образует комплексные соединения (2 Cu +4 HCl→ 2 H[Cu. Cl 2] + H 2). При этом потенциал меди смещается в сторону отрицательных значений и она (и ее сплавы) растворяется. В HCl корродируют все технически важные металлы. Для защиты металлоконструкций используют неметаллические материалы (резину, эмаль, керамику и др. )
Взаимодействие металлов с растворами соляной кислоты HCl – типичная неокисляющая кислота Me + HCl→ Me. Cln + H 2 если φMen+/Me< φ2 H+/H 2 Me + HCl ↛ если φMen+/Me> φ2 H+/H 2 Fe + 2 HCl → Fe. Cl 2 + H 2 Cu + 2 HClр ↛ Особенности поведения металлов в растворах соляной кислоты. Титан в разбавленных растворах HCl сохраняет пассивное состояние и не растворяется. В концентрированных растворах пассивное состояние нарушается и происходит растворение титана. Медь в растворах соляной кислоты высокой концентрации (>30%) образует комплексные соединения (2 Cu +4 HCl→ 2 H[Cu. Cl 2] + H 2). При этом потенциал меди смещается в сторону отрицательных значений и она (и ее сплавы) растворяется. В HCl корродируют все технически важные металлы. Для защиты металлоконструкций используют неметаллические материалы (резину, эмаль, керамику и др. )
 Взаимодействие металлов с растворами разбавленной (до 40%) серной кислоты ¡ ¡ ¡ Из-за высокой гигроскопичности иона SO 42 разбавлен-ная серная кислота (ω<40%) ведет себя как неокисля-ющая : Me+ H 2 SO 4 → Me. SO 4 + H 2 если φMen+/Me< φ2 H+/H 2 Me + H 2 SO 4 ↛ если φMen+/Me> φ2 H+/H 2 Fe + H 2 SO 4 → Fe. SO 4 + H 2 Cu + H 2 SO 4 ↛ Свинец в разбавленных растворах серной кислоты пассивируется и не растворяется в ней (образуется плотная, нерастворимая в серной кислоте пленка сульфата свинца).
Взаимодействие металлов с растворами разбавленной (до 40%) серной кислоты ¡ ¡ ¡ Из-за высокой гигроскопичности иона SO 42 разбавлен-ная серная кислота (ω<40%) ведет себя как неокисля-ющая : Me+ H 2 SO 4 → Me. SO 4 + H 2 если φMen+/Me< φ2 H+/H 2 Me + H 2 SO 4 ↛ если φMen+/Me> φ2 H+/H 2 Fe + H 2 SO 4 → Fe. SO 4 + H 2 Cu + H 2 SO 4 ↛ Свинец в разбавленных растворах серной кислоты пассивируется и не растворяется в ней (образуется плотная, нерастворимая в серной кислоте пленка сульфата свинца).
 5. 3. 2. Поведение металлов в растворах окисляющих кислот ¡ ¡ Общие принципы Металлы, потенциал которых в данных условиях отрицательнее потенциала восстановления кислотного остатка, окисляются за счет восстановления этого кислотного остатка Глубина восстановления кислотного остатка тем выше, чем активнее взаимодействующий с ней металл, выше температура и ниже концентрация кислоты. В концентрированных растворах серной и азотной кислот Fe, Al и Cr при низких температурах (до 40 o. С) пассивируются и не взаимодействуют с кислотами. При повышении температуры и при разбавлении кислоты пассивное состояние нарушается и металлы взаимодействуют с раствором кислоты.
5. 3. 2. Поведение металлов в растворах окисляющих кислот ¡ ¡ Общие принципы Металлы, потенциал которых в данных условиях отрицательнее потенциала восстановления кислотного остатка, окисляются за счет восстановления этого кислотного остатка Глубина восстановления кислотного остатка тем выше, чем активнее взаимодействующий с ней металл, выше температура и ниже концентрация кислоты. В концентрированных растворах серной и азотной кислот Fe, Al и Cr при низких температурах (до 40 o. С) пассивируются и не взаимодействуют с кислотами. При повышении температуры и при разбавлении кислоты пассивное состояние нарушается и металлы взаимодействуют с раствором кислоты.
 Взаимодействие металлов с растворами концентрированной (выше 40%) серной кислоты Me + H 2 S+6 O 4 → Men(SO 4)m + (S+4 O 3, S 0, H 2 S 2 -) + H 2 O Глубина восстановления (SO 4)2 - возрастает Cu + H 2 SO 4 → Cu. SO 4 + SO 3 + H 2 O Ca + H 2 SO 4 → Ca. SO 4 + H 2 S + H 2 O Fe + H 2 SO 4 конц ↛ (пассивация) Fe + H 2 SO 4 → Fe 2(SO 4)3 + S + H 2 O An: Fe → Fe 3+ + 3 e. Kt: SO 42 - + 8 H+ +6 e- →S + 4 H 2 O В растворах H 2 SO 4 концентрацией 92 – 96% при температуре до 400 С железо, хром и алюминий надежно пассивируются за счет образования плотных, нерастворимых в серной кислоте пленок Fe. SO 4, Cr 2(SO 4)3 и Al 2(SO 4)3 соответственно. При повышении температуры и снижении концентрации кислоты растворимость солей в ней возрастает и пассивное состояние металлов нарушается. При работе с концентрированными растворами серной кислоты в области пассивирующих концентраций и температур используют аппараты из углеродистых сталей, а при других условиях – из стали 06 ХН 28 МДТ и аппараты с покрытиями из неметаллических материалов (эмалей, резины) и из керамики.
Взаимодействие металлов с растворами концентрированной (выше 40%) серной кислоты Me + H 2 S+6 O 4 → Men(SO 4)m + (S+4 O 3, S 0, H 2 S 2 -) + H 2 O Глубина восстановления (SO 4)2 - возрастает Cu + H 2 SO 4 → Cu. SO 4 + SO 3 + H 2 O Ca + H 2 SO 4 → Ca. SO 4 + H 2 S + H 2 O Fe + H 2 SO 4 конц ↛ (пассивация) Fe + H 2 SO 4 → Fe 2(SO 4)3 + S + H 2 O An: Fe → Fe 3+ + 3 e. Kt: SO 42 - + 8 H+ +6 e- →S + 4 H 2 O В растворах H 2 SO 4 концентрацией 92 – 96% при температуре до 400 С железо, хром и алюминий надежно пассивируются за счет образования плотных, нерастворимых в серной кислоте пленок Fe. SO 4, Cr 2(SO 4)3 и Al 2(SO 4)3 соответственно. При повышении температуры и снижении концентрации кислоты растворимость солей в ней возрастает и пассивное состояние металлов нарушается. При работе с концентрированными растворами серной кислоты в области пассивирующих концентраций и температур используют аппараты из углеродистых сталей, а при других условиях – из стали 06 ХН 28 МДТ и аппараты с покрытиями из неметаллических материалов (эмалей, резины) и из керамики.
 Взаимодействие металлов с растворами азотной кислоты ¡ Me + HN+5 O 3 → Me(NO 3)m + (N+4 O 2, N+32 O 3, …N-3 H 4 NO 3) + H 2 O Глубина восстановления (NO 3)2 - возрастает ¡ ¡ ¡ ¡ Cu + HNO 3 → Cu(NO 3)2 + NO 2 + H 2 O Zn + HNO 3 разб → Zn(NO 3)2 + NH 4 NO 3 + H 2 O Fe + HNO 3 конц ↛ (пассивация) Fe + HNO 3 разб → Fe(NO 3)3 + NO + H 2 O An: Fe → Fe 3+ + 3 e. Kt: 4 H++NO 3 -+3 e- →NO + 2 H 2 O HNO 3 концентрацией выше 50% пассивирует железо, хром и алюминий. Но их пассивное состояние является ненадежным: потенциал поверхности лежит в области близкой к потенциалу перепассивации. В растворах азотной кислоты надежно работают аппараты из стали 12 Х 18 Н 10 Т.
Взаимодействие металлов с растворами азотной кислоты ¡ Me + HN+5 O 3 → Me(NO 3)m + (N+4 O 2, N+32 O 3, …N-3 H 4 NO 3) + H 2 O Глубина восстановления (NO 3)2 - возрастает ¡ ¡ ¡ ¡ Cu + HNO 3 → Cu(NO 3)2 + NO 2 + H 2 O Zn + HNO 3 разб → Zn(NO 3)2 + NH 4 NO 3 + H 2 O Fe + HNO 3 конц ↛ (пассивация) Fe + HNO 3 разб → Fe(NO 3)3 + NO + H 2 O An: Fe → Fe 3+ + 3 e. Kt: 4 H++NO 3 -+3 e- →NO + 2 H 2 O HNO 3 концентрацией выше 50% пассивирует железо, хром и алюминий. Но их пассивное состояние является ненадежным: потенциал поверхности лежит в области близкой к потенциалу перепассивации. В растворах азотной кислоты надежно работают аппараты из стали 12 Х 18 Н 10 Т.
 5. 4. Взаимодействие металлов с растворами щелочей ¡ ¡ ¡ ¡ Общие принципы Основной катодный деполяризатор – вода An: Me + 4 OH- → Me. O 2 - + 2 H 2 O +3 e– Kt: 2 H 2 O + 2 e- → 2 OH- + 2[H] (H 2) В растворах щелочей легко растворяются цинк и алюминий: 2 Al + 2 Na. OH + 2 H 2 O → 2 Na. Al. O 2 + 3 H 2 Zn + Na. OH → Na 2 Zn. O 2 + H 2 Железо взаимодействует с концентрированными растворами щелочей (выше 10%)только при высоких температурах (выше 500 С). An: Fe + 4 OH- → Fe. O 2 - + 2 H 2 O +3 e– Kt: 2 H 2 O + 2 e- → 2 OH- + 2[H] (H 2) Растворение металла происходит по границам зерен. Остальная поверхность – пассивна. Выделяющийся в результате катодного процесса атомарный водород частично молизуется, а частично проникает в металл и повышает его хрупкость. При наличии растягивающих напряжений все это приводит к щелочному коррозионному растрескиванию стали. При низких концентрациях (до 10%) и температурах (до 500 С) раствора щелочи коррозии железо пассивируется и не корродирует или корродирует с кислородной деполяризацией (в разбавленных растворах). В концентрированных растворах щелочей при повышенных температурах работоспособны стали 08 Х 13, 12 Х 18 Н 10 Т, а при высоких температурах – никелевые сплавы.
5. 4. Взаимодействие металлов с растворами щелочей ¡ ¡ ¡ ¡ Общие принципы Основной катодный деполяризатор – вода An: Me + 4 OH- → Me. O 2 - + 2 H 2 O +3 e– Kt: 2 H 2 O + 2 e- → 2 OH- + 2[H] (H 2) В растворах щелочей легко растворяются цинк и алюминий: 2 Al + 2 Na. OH + 2 H 2 O → 2 Na. Al. O 2 + 3 H 2 Zn + Na. OH → Na 2 Zn. O 2 + H 2 Железо взаимодействует с концентрированными растворами щелочей (выше 10%)только при высоких температурах (выше 500 С). An: Fe + 4 OH- → Fe. O 2 - + 2 H 2 O +3 e– Kt: 2 H 2 O + 2 e- → 2 OH- + 2[H] (H 2) Растворение металла происходит по границам зерен. Остальная поверхность – пассивна. Выделяющийся в результате катодного процесса атомарный водород частично молизуется, а частично проникает в металл и повышает его хрупкость. При наличии растягивающих напряжений все это приводит к щелочному коррозионному растрескиванию стали. При низких концентрациях (до 10%) и температурах (до 500 С) раствора щелочи коррозии железо пассивируется и не корродирует или корродирует с кислородной деполяризацией (в разбавленных растворах). В концентрированных растворах щелочей при повышенных температурах работоспособны стали 08 Х 13, 12 Х 18 Н 10 Т, а при высоких температурах – никелевые сплавы.
 5. 5. Поведение металлов в растворах солей ¡ ¡ ¡ ¡ 1. Более активные металлы вытесняют менее активные из их солей. Fe + Cu. SO 4 → Fe. SO 4 + Cu φFe 2+/Fe< φCu 2+/Cu An: Fe → Fe 2+ +2 e. Kt: Cu 2++ 2 e- → Cu 2. Если соль, в растворе которой находится металл, подвергается гидролизу, то поведение металла зависит от состава продуктов гидролиза. Cu. Cl 2 + H 2 O →Cu. OHCl + HCl Fe + HCl → Fe. Cl 2 + H 2 An: Fe → Fe 2+ +2 e. Kt: 2 H++ 2 e- → H 2 3. Если соль, в растворе которой находится металл, не подвергается гидролизу, то металл корродирует в ней с кислородной деполяризацией: В растворе Na. Cl: 2 Fe + O 2 + 2 H 2 O → 2 Fe(OH)2 An: Fe → Fe 2+ +2 e. Kt: O 2+4 e-+2 H 2 O → 4 OH-
5. 5. Поведение металлов в растворах солей ¡ ¡ ¡ ¡ 1. Более активные металлы вытесняют менее активные из их солей. Fe + Cu. SO 4 → Fe. SO 4 + Cu φFe 2+/Fe< φCu 2+/Cu An: Fe → Fe 2+ +2 e. Kt: Cu 2++ 2 e- → Cu 2. Если соль, в растворе которой находится металл, подвергается гидролизу, то поведение металла зависит от состава продуктов гидролиза. Cu. Cl 2 + H 2 O →Cu. OHCl + HCl Fe + HCl → Fe. Cl 2 + H 2 An: Fe → Fe 2+ +2 e. Kt: 2 H++ 2 e- → H 2 3. Если соль, в растворе которой находится металл, не подвергается гидролизу, то металл корродирует в ней с кислородной деполяризацией: В растворе Na. Cl: 2 Fe + O 2 + 2 H 2 O → 2 Fe(OH)2 An: Fe → Fe 2+ +2 e. Kt: O 2+4 e-+2 H 2 O → 4 OH-
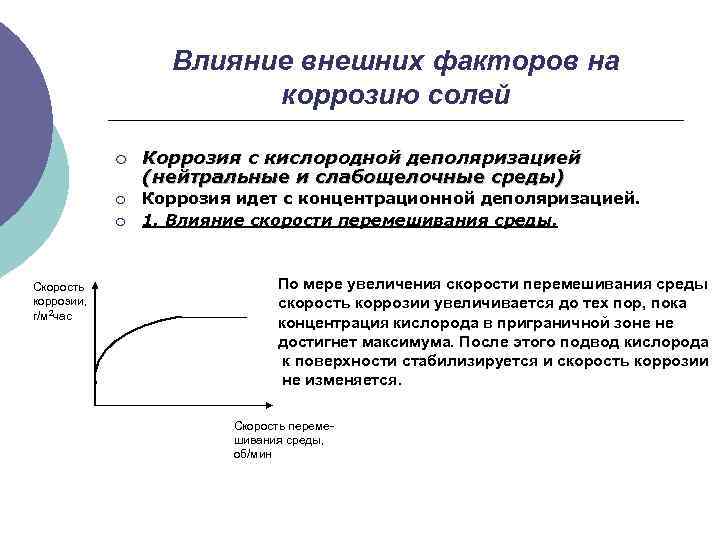 Влияние внешних факторов на коррозию солей ¡ ¡ ¡ Скорость коррозии, г/м 2 час Коррозия с кислородной деполяризацией (нейтральные и слабощелочные среды) Коррозия идет с концентрационной деполяризацией. 1. Влияние скорости перемешивания среды. По мере увеличения скорости перемешивания среды скорость коррозии увеличивается до тех пор, пока концентрация кислорода в приграничной зоне не достигнет максимума. После этого подвод кислорода к поверхности стабилизируется и скорость коррозии не изменяется. Скорость перемешивания среды, об/мин
Влияние внешних факторов на коррозию солей ¡ ¡ ¡ Скорость коррозии, г/м 2 час Коррозия с кислородной деполяризацией (нейтральные и слабощелочные среды) Коррозия идет с концентрационной деполяризацией. 1. Влияние скорости перемешивания среды. По мере увеличения скорости перемешивания среды скорость коррозии увеличивается до тех пор, пока концентрация кислорода в приграничной зоне не достигнет максимума. После этого подвод кислорода к поверхности стабилизируется и скорость коррозии не изменяется. Скорость перемешивания среды, об/мин
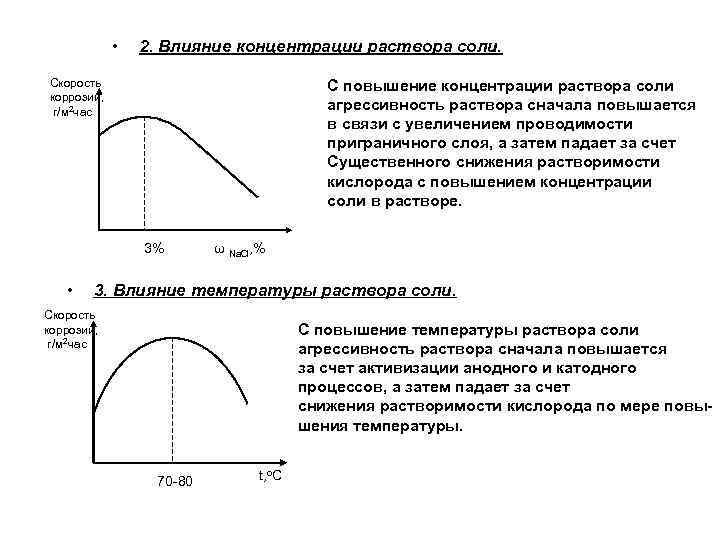 • 2. Влияние концентрации раствора соли. Скорость коррозии, г/м 2 час С повышение концентрации раствора соли агрессивность раствора сначала повышается в связи с увеличением проводимости приграничного слоя, а затем падает за счет Существенного снижения растворимости кислорода с повышением концентрации соли в растворе. 3% • ω Na. Cl, % 3. Влияние температуры раствора соли. Скорость коррозии, г/м 2 час С повышение температуры раствора соли агрессивность раствора сначала повышается за счет активизации анодного и катодного процессов, а затем падает за счет снижения растворимости кислорода по мере повышения температуры. 70 -80 t, o. C
• 2. Влияние концентрации раствора соли. Скорость коррозии, г/м 2 час С повышение концентрации раствора соли агрессивность раствора сначала повышается в связи с увеличением проводимости приграничного слоя, а затем падает за счет Существенного снижения растворимости кислорода с повышением концентрации соли в растворе. 3% • ω Na. Cl, % 3. Влияние температуры раствора соли. Скорость коррозии, г/м 2 час С повышение температуры раствора соли агрессивность раствора сначала повышается за счет активизации анодного и катодного процессов, а затем падает за счет снижения растворимости кислорода по мере повышения температуры. 70 -80 t, o. C
 Коррозия с водородной деполяризацией (кислые среды) Коррозия идет с активационной деполяризацией. ¡ ¡ 1. Влияние скорости перемешивания среды. Скорость перемешивания не влияет на скорость коррозии. 2. Влияние концентрации раствора соли. Концентрация раствора соли влияет не непосредственно, а через изменение кислотности среды. Чем ниже значение р. Н раствора, тем выше скорость коррозии. ¡ 3. Влияние температуры раствора соли. ¡ Чем выше температура, тем выше скорость коррозии.
Коррозия с водородной деполяризацией (кислые среды) Коррозия идет с активационной деполяризацией. ¡ ¡ 1. Влияние скорости перемешивания среды. Скорость перемешивания не влияет на скорость коррозии. 2. Влияние концентрации раствора соли. Концентрация раствора соли влияет не непосредственно, а через изменение кислотности среды. Чем ниже значение р. Н раствора, тем выше скорость коррозии. ¡ 3. Влияние температуры раствора соли. ¡ Чем выше температура, тем выше скорость коррозии.


