Термодинамика 40 лекция.ppt
- Количество слайдов: 25
 Тема 40: Межмолекулярные взаимодействия в реальных системах. Силы межмолекулярного взаимодействия. Модельные потенциалы взаимодействия. Водородная связь. Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер. Ваальсом в 1873 году. Центральные силы – силы взаимодействия между двумя частицами, зависящие только от расстояния между ними. и в случае центральных взаимодействий связаны соотношением -потенциальная энергия взаимодействия пары молекул. при
Тема 40: Межмолекулярные взаимодействия в реальных системах. Силы межмолекулярного взаимодействия. Модельные потенциалы взаимодействия. Водородная связь. Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами. Впервые были учтены Я. Д. Ван-дер. Ваальсом в 1873 году. Центральные силы – силы взаимодействия между двумя частицами, зависящие только от расстояния между ними. и в случае центральных взаимодействий связаны соотношением -потенциальная энергия взаимодействия пары молекул. при
 Зависимость потенциальной энергии взаимодействия двух молекул от расстояния Кривая 1 - потенциал сил отталкивания. Кривая 2 - потенциал сил притяжения. Кривая 3 - результирующий потенциал (результат наложения кривых 1 и 2) Минимум кривой 3 соответствует равновесному состоянию (r=r 0). При r < r 0 F(r) > 0, что соответствует отталкиванию молекул. При r > r 0 F(r) < 0 - молекулы притягиваются. Результирующий потенциал складывается аддитивно из потенциала притяжения (потенциала дальнодействующих сил) и потенциала отталкивания (потенциала короткодействующих сил): и - функции от координат молекул, найденные соответственно для малых и больших расстояний r
Зависимость потенциальной энергии взаимодействия двух молекул от расстояния Кривая 1 - потенциал сил отталкивания. Кривая 2 - потенциал сил притяжения. Кривая 3 - результирующий потенциал (результат наложения кривых 1 и 2) Минимум кривой 3 соответствует равновесному состоянию (r=r 0). При r < r 0 F(r) > 0, что соответствует отталкиванию молекул. При r > r 0 F(r) < 0 - молекулы притягиваются. Результирующий потенциал складывается аддитивно из потенциала притяжения (потенциала дальнодействующих сил) и потенциала отталкивания (потенциала короткодействующих сил): и - функции от координат молекул, найденные соответственно для малых и больших расстояний r
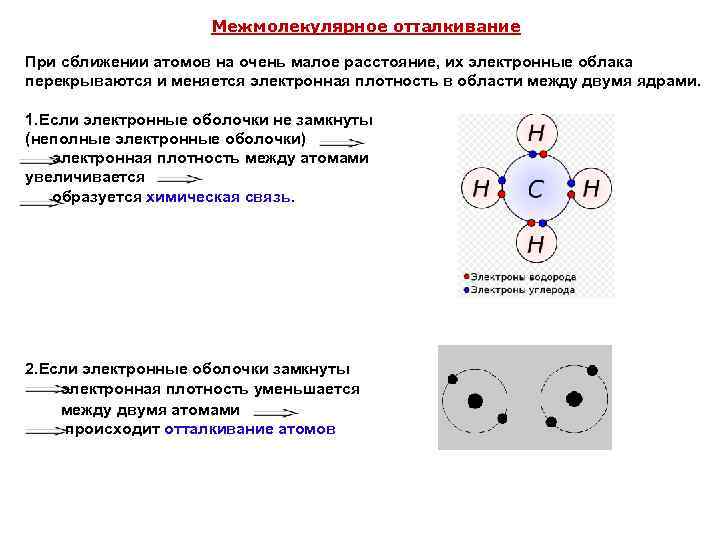 Межмолекулярное отталкивание При сближении атомов на очень малое расстояние, их электронные облака перекрываются и меняется электронная плотность в области между двумя ядрами. 1. Если электронные оболочки не замкнуты (неполные электронные оболочки) электронная плотность между атомами увеличивается образуется химическая связь. 2. Если электронные оболочки замкнуты электронная плотность уменьшается между двумя атомами происходит отталкивание атомов
Межмолекулярное отталкивание При сближении атомов на очень малое расстояние, их электронные облака перекрываются и меняется электронная плотность в области между двумя ядрами. 1. Если электронные оболочки не замкнуты (неполные электронные оболочки) электронная плотность между атомами увеличивается образуется химическая связь. 2. Если электронные оболочки замкнуты электронная плотность уменьшается между двумя атомами происходит отталкивание атомов
 Межмолекулярное отталкивание Силы отталкивания – приближенные, были получены путем квантовомеханических расчетов. Потенциал отталкивания - сумма членов вида - относительно медленно изменяющаяся функция r (полином). Простейшая функция, отражающая данную зависимость: - постоянные для пары молекул данного вида В статистических расчетах используется приближение в виде степенной зависимости:
Межмолекулярное отталкивание Силы отталкивания – приближенные, были получены путем квантовомеханических расчетов. Потенциал отталкивания - сумма членов вида - относительно медленно изменяющаяся функция r (полином). Простейшая функция, отражающая данную зависимость: - постоянные для пары молекул данного вида В статистических расчетах используется приближение в виде степенной зависимости:
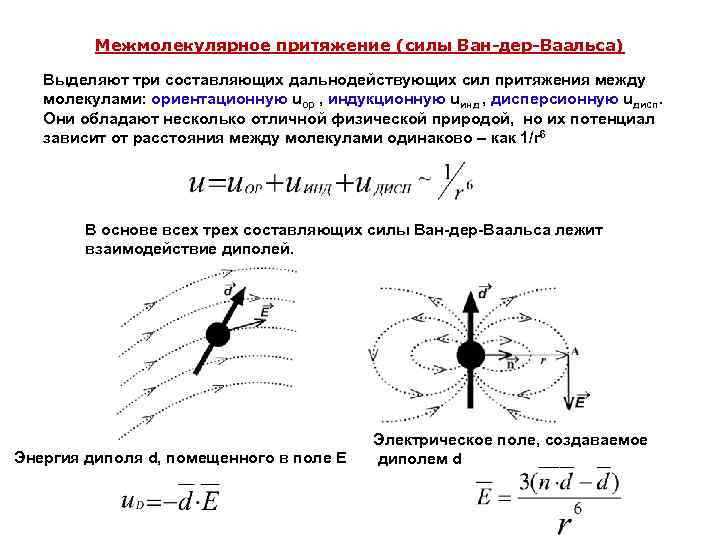 Межмолекулярное притяжение (силы Ван-дер-Ваальса) Выделяют три составляющих дальнодействующих сил притяжения между молекулами: ориентационную uор , индукционную uинд , дисперсионную uдисп. Они обладают несколько отличной физической природой, но их потенциал зависит от расстояния между молекулами одинаково – как 1/r 6 В основе всех трех составляющих силы Ван-дер-Ваальса лежит взаимодействие диполей. Энергия диполя d, помещенного в поле Е Электрическое поле, создаваемое диполем d
Межмолекулярное притяжение (силы Ван-дер-Ваальса) Выделяют три составляющих дальнодействующих сил притяжения между молекулами: ориентационную uор , индукционную uинд , дисперсионную uдисп. Они обладают несколько отличной физической природой, но их потенциал зависит от расстояния между молекулами одинаково – как 1/r 6 В основе всех трех составляющих силы Ван-дер-Ваальса лежит взаимодействие диполей. Энергия диполя d, помещенного в поле Е Электрическое поле, создаваемое диполем d
 Полярные и неполярные молекулы Для расстояний, больших по сравнению с размерами молекулы, действие электронов эквивалентно действию их суммарного заряда, помещенного в некоторую точку внутри молекулы- центр тяжести отрицательных зарядов; действие ядер эквивалентно действию их суммарного заряда, помещенного в центр тяжести положительных зарядов. В отсутствии внешнего эл. поля центры тяжести положительных и отрицательных зарядов либо совпадают, либо сдвинуты друг относительно друга. В первом случае молекула называется неполярной (не обладает электрическим моментом). Например молекула кислорода О 2 Во втором случае молекула называется полярной (эквивалентна электрическому диполю). Например, молекула воды Н 2 О
Полярные и неполярные молекулы Для расстояний, больших по сравнению с размерами молекулы, действие электронов эквивалентно действию их суммарного заряда, помещенного в некоторую точку внутри молекулы- центр тяжести отрицательных зарядов; действие ядер эквивалентно действию их суммарного заряда, помещенного в центр тяжести положительных зарядов. В отсутствии внешнего эл. поля центры тяжести положительных и отрицательных зарядов либо совпадают, либо сдвинуты друг относительно друга. В первом случае молекула называется неполярной (не обладает электрическим моментом). Например молекула кислорода О 2 Во втором случае молекула называется полярной (эквивалентна электрическому диполю). Например, молекула воды Н 2 О
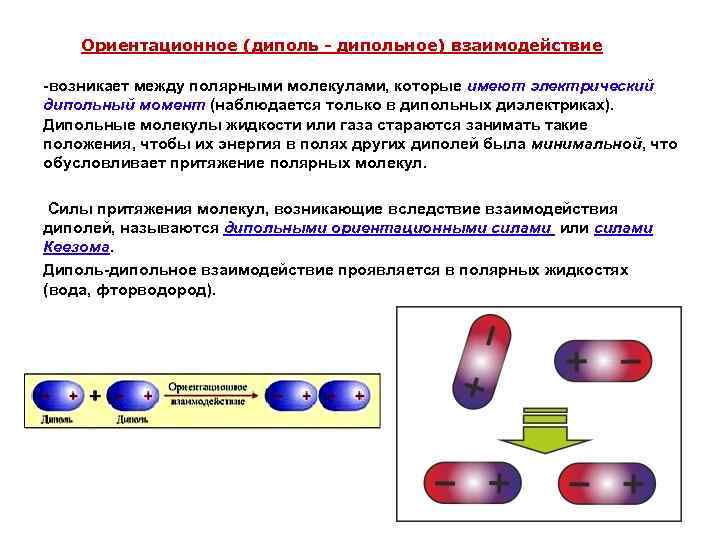 Ориентационное (диполь - дипольное) взаимодействие -возникает между полярными молекулами, которые имеют электрический дипольный момент (наблюдается только в дипольных диэлектриках). Дипольные молекулы жидкости или газа стараются занимать такие положения, чтобы их энергия в полях других диполей была минимальной, что обусловливает притяжение полярных молекул. Силы притяжения молекул, возникающие вследствие взаимодействия диполей, называются дипольными ориентационными силами или силами Кеезома. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фторводород).
Ориентационное (диполь - дипольное) взаимодействие -возникает между полярными молекулами, которые имеют электрический дипольный момент (наблюдается только в дипольных диэлектриках). Дипольные молекулы жидкости или газа стараются занимать такие положения, чтобы их энергия в полях других диполей была минимальной, что обусловливает притяжение полярных молекул. Силы притяжения молекул, возникающие вследствие взаимодействия диполей, называются дипольными ориентационными силами или силами Кеезома. Диполь-дипольное взаимодействие проявляется в полярных жидкостях (вода, фторводород).
 Для взаимодействия двух диполей энергия притяжения между ними выражается соотношением: формула Кеезома μ 1 и μ 2 – дипольные моменты взаимодействующих диполей; r – расстояние между диполями; k – постоянная Больцмана; Т – температура.
Для взаимодействия двух диполей энергия притяжения между ними выражается соотношением: формула Кеезома μ 1 и μ 2 – дипольные моменты взаимодействующих диполей; r – расстояние между диполями; k – постоянная Больцмана; Т – температура.
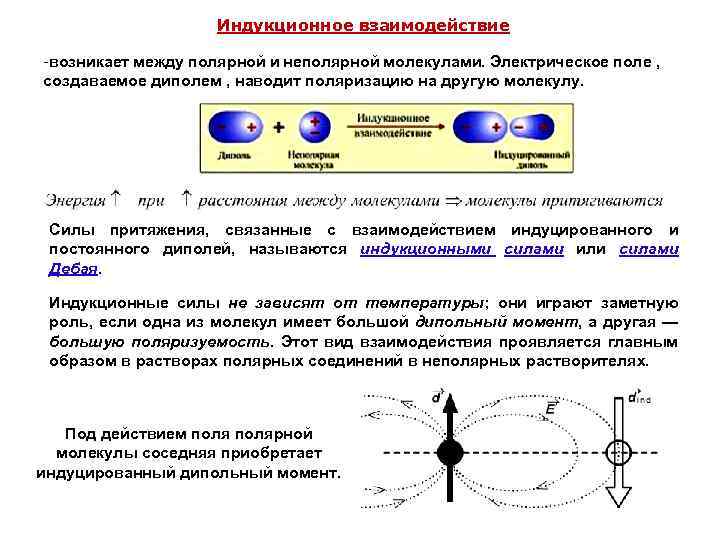 Индукционное взаимодействие -возникает между полярной и неполярной молекулами. Электрическое поле , создаваемое диполем , наводит поляризацию на другую молекулу. Силы притяжения, связанные с взаимодействием индуцированного и постоянного диполей, называются индукционными силами или силами Дебая. Индукционные силы не зависят от температуры; они играют заметную роль, если одна из молекул имеет большой дипольный момент, а другая — большую поляризуемость. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях. Под действием полярной молекулы соседняя приобретает индуцированный дипольный момент.
Индукционное взаимодействие -возникает между полярной и неполярной молекулами. Электрическое поле , создаваемое диполем , наводит поляризацию на другую молекулу. Силы притяжения, связанные с взаимодействием индуцированного и постоянного диполей, называются индукционными силами или силами Дебая. Индукционные силы не зависят от температуры; они играют заметную роль, если одна из молекул имеет большой дипольный момент, а другая — большую поляризуемость. Этот вид взаимодействия проявляется главным образом в растворах полярных соединений в неполярных растворителях. Под действием полярной молекулы соседняя приобретает индуцированный дипольный момент.
 Энергия притяжения между постоянным и наведенным диполем определяется выражением: Энергия Дебая μ – дипольный момент первой молекулы; α – поляризуемость второй молекулы; r – расстояние между молекулами.
Энергия притяжения между постоянным и наведенным диполем определяется выражением: Энергия Дебая μ – дипольный момент первой молекулы; α – поляризуемость второй молекулы; r – расстояние между молекулами.
 Дисперсионное взаимодействие - один из типов межмолекулярного взаимодействия, возникающего между двумя любыми молекулами независимо от наличия у них собственного дипольного момента. В квантовой механике электрон рассматривается как точечный заряд, так что в любой момент времени электрон и ядро образуют диполь. Диполь первого атома поляризует второй атом, диполь второго атома поляризует первый атом. Вследствие взаимодействия мгновенных и индуцированных диполей возникает притяжение между атомами. Это притяжение лежит в основе сил Ван-дер-Ваальса. Неполярные молекулы за счет квантовой неопределенности обладают "мгновенными" дипольными моментами, возникает их взаимодействие.
Дисперсионное взаимодействие - один из типов межмолекулярного взаимодействия, возникающего между двумя любыми молекулами независимо от наличия у них собственного дипольного момента. В квантовой механике электрон рассматривается как точечный заряд, так что в любой момент времени электрон и ядро образуют диполь. Диполь первого атома поляризует второй атом, диполь второго атома поляризует первый атом. Вследствие взаимодействия мгновенных и индуцированных диполей возникает притяжение между атомами. Это притяжение лежит в основе сил Ван-дер-Ваальса. Неполярные молекулы за счет квантовой неопределенности обладают "мгновенными" дипольными моментами, возникает их взаимодействие.
 Энергия дисперсионного взаимодействия определяется соотношением: энергия Лондона J 1 и J 2 - потенциалы ионизации молекул; α 1 и α 2 – поляризуемость молекул; r – расстояние между молекулами.
Энергия дисперсионного взаимодействия определяется соотношением: энергия Лондона J 1 и J 2 - потенциалы ионизации молекул; α 1 и α 2 – поляризуемость молекул; r – расстояние между молекулами.
 Ориентационное: взаимодействуют 2 поляризованные молекулы; Индукционное: взаимодействуют поляризованная и неполяризованная молекулы; Дисперсионное: взаимодействуют 2 любые( даже неполяризованные) молекулы. Все три типа межмолекулярного взаимодействия одинаковым образом зависят от расстояния и могут быть выражены одной формулой: А – величина, объединяющая все постоянные в формулах для энергий ориентационного, индукционного и дисперсионного взаимодействия:
Ориентационное: взаимодействуют 2 поляризованные молекулы; Индукционное: взаимодействуют поляризованная и неполяризованная молекулы; Дисперсионное: взаимодействуют 2 любые( даже неполяризованные) молекулы. Все три типа межмолекулярного взаимодействия одинаковым образом зависят от расстояния и могут быть выражены одной формулой: А – величина, объединяющая все постоянные в формулах для энергий ориентационного, индукционного и дисперсионного взаимодействия:
 Потенциальная энергия взаимодействия многих молекул определяется как - потенциал взаимодействия для изолированной пары молекул. Для центральных взаимодействий - радиус – вектор - й частицы, - расстояние между частицами и Аддитивность энергии взаимодействия выполняется строго при электростатическом взаимодействии точечных зарядов, при межмолекулярном взаимодействии это выполняется приближенно. Для Ван – дер – вальсовых сил справедливо допущение об аддитивном характере сил межмолекулярного взаимодействия. Но! Потенциал отталкивания, как правило, не является аддитивным.
Потенциальная энергия взаимодействия многих молекул определяется как - потенциал взаимодействия для изолированной пары молекул. Для центральных взаимодействий - радиус – вектор - й частицы, - расстояние между частицами и Аддитивность энергии взаимодействия выполняется строго при электростатическом взаимодействии точечных зарядов, при межмолекулярном взаимодействии это выполняется приближенно. Для Ван – дер – вальсовых сил справедливо допущение об аддитивном характере сил межмолекулярного взаимодействия. Но! Потенциал отталкивания, как правило, не является аддитивным.
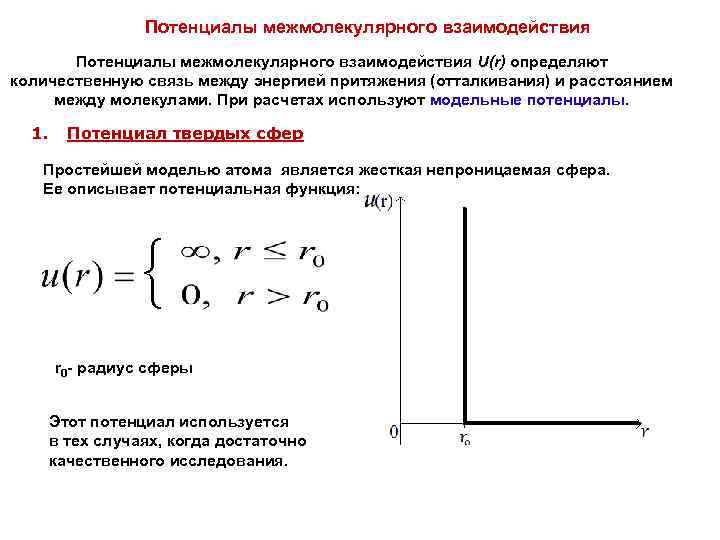 Потенциалы межмолекулярного взаимодействия U(r) определяют количественную связь между энергией притяжения (отталкивания) и расстоянием между молекулами. При расчетах используют модельные потенциалы. 1. Потенциал твердых сфер Простейшей моделью атома является жесткая непроницаемая сфера. Ее описывает потенциальная функция: { r 0 - радиус сферы Этот потенциал используется в тех случаях, когда достаточно качественного исследования.
Потенциалы межмолекулярного взаимодействия U(r) определяют количественную связь между энергией притяжения (отталкивания) и расстоянием между молекулами. При расчетах используют модельные потенциалы. 1. Потенциал твердых сфер Простейшей моделью атома является жесткая непроницаемая сфера. Ее описывает потенциальная функция: { r 0 - радиус сферы Этот потенциал используется в тех случаях, когда достаточно качественного исследования.
 2. Потенциал прямоугольной ямы Часто к потенциалу твердой сферы добавляется часть, связанная с притяжением. В наиболее простой форме - это прямоугольная яма глубиной ε и шириной r 0(а-1) { r 0 - радиус сферы
2. Потенциал прямоугольной ямы Часто к потенциалу твердой сферы добавляется часть, связанная с притяжением. В наиболее простой форме - это прямоугольная яма глубиной ε и шириной r 0(а-1) { r 0 - радиус сферы
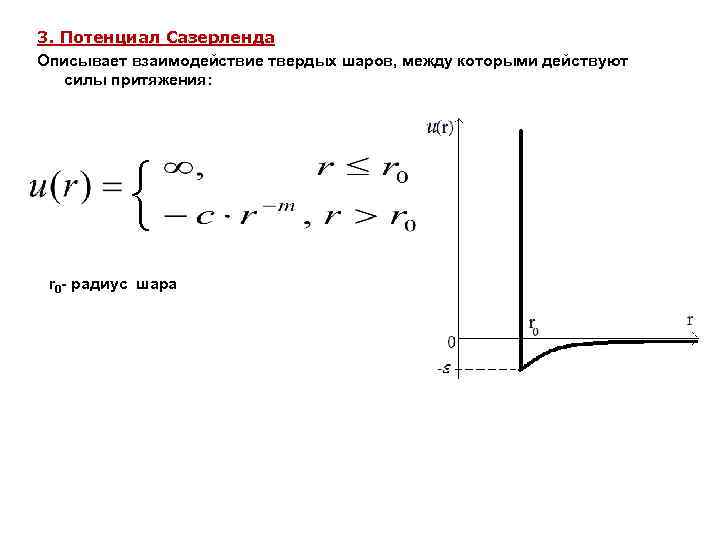 3. Потенциал Сазерленда Описывает взаимодействие твердых шаров, между которыми действуют силы притяжения: { r 0 - радиус шара
3. Потенциал Сазерленда Описывает взаимодействие твердых шаров, между которыми действуют силы притяжения: { r 0 - радиус шара
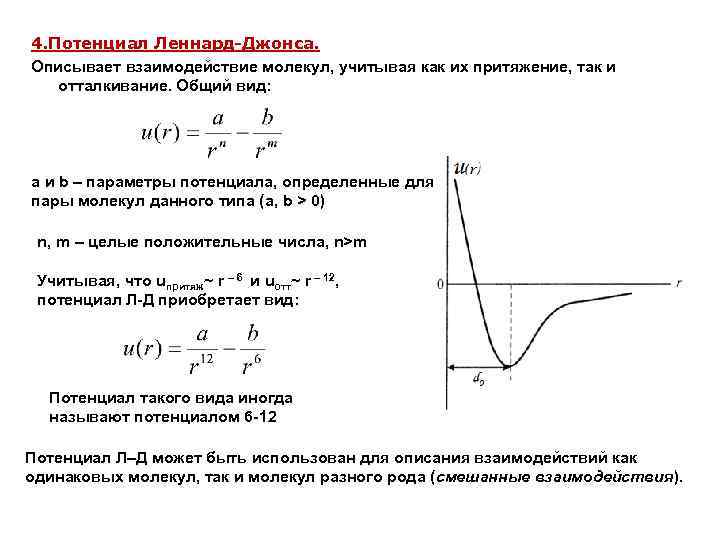 4. Потенциал Леннард-Джонса. Описывает взаимодействие молекул, учитывая как их притяжение, так и отталкивание. Общий вид: a и b – параметры потенциала, определенные для пары молекул данного типа (а, b > 0) n, m – целые положительные числа, n>m Учитывая, что uпритяж~ r – 6 и uотт~ r – 12, потенциал Л-Д приобретает вид: Потенциал такого вида иногда называют потенциалом 6 -12 Потенциал Л–Д может быть использован для описания взаимодействий как одинаковых молекул, так и молекул разного рода (смешанные взаимодействия).
4. Потенциал Леннард-Джонса. Описывает взаимодействие молекул, учитывая как их притяжение, так и отталкивание. Общий вид: a и b – параметры потенциала, определенные для пары молекул данного типа (а, b > 0) n, m – целые положительные числа, n>m Учитывая, что uпритяж~ r – 6 и uотт~ r – 12, потенциал Л-Д приобретает вид: Потенциал такого вида иногда называют потенциалом 6 -12 Потенциал Л–Д может быть использован для описания взаимодействий как одинаковых молекул, так и молекул разного рода (смешанные взаимодействия).
 5. Потенциал Штокмайера описывает взаимодействия небольших молекул, обладающих электрическими дипольными моментами. Представляет собой наложение потенциала 6 -12 и потенциала ориентационного взаимодействия двух точечных диполей. -углы, задающие ориентации осей диполей; -дипольные моменты поляризованных молекул; - глубина потенциальной ямы; -сумма радиусов всех взаимодействующих молекул.
5. Потенциал Штокмайера описывает взаимодействия небольших молекул, обладающих электрическими дипольными моментами. Представляет собой наложение потенциала 6 -12 и потенциала ориентационного взаимодействия двух точечных диполей. -углы, задающие ориентации осей диполей; -дипольные моменты поляризованных молекул; - глубина потенциальной ямы; -сумма радиусов всех взаимодействующих молекул.
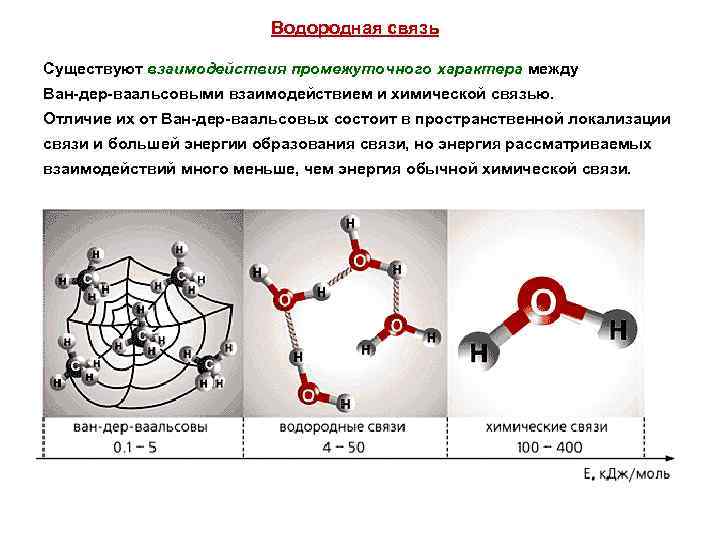 Водородная связь Существуют взаимодействия промежуточного характера между Ван-дер-ваальсовыми взаимодействием и химической связью. Отличие их от Ван-дер-ваальсовых состоит в пространственной локализации связи и большей энергии образования связи, но энергия рассматриваемых взаимодействий много меньше, чем энергия обычной химической связи.
Водородная связь Существуют взаимодействия промежуточного характера между Ван-дер-ваальсовыми взаимодействием и химической связью. Отличие их от Ван-дер-ваальсовых состоит в пространственной локализации связи и большей энергии образования связи, но энергия рассматриваемых взаимодействий много меньше, чем энергия обычной химической связи.
 Водородная связь - это связь между функциональной группой А – Н и электроотрицательным атомом или группой атомов В той же или другой молекулы; особое участие в этой связи принимает атом водорода, уже связанный с А (связь А – H···В). Группа A – H выступает как донор протона, группа В как донор электрона. Водородная связь возможна только между двумя атомами. Такая связь осуществляется между атомами водорода Н и атомами N, О, F, S, Cl в веществах, молекулы которых содержат эти атомы. При образовании водородной связи изменяются межъядерные расстояния в молекуле, связь А – Н удлиняется.
Водородная связь - это связь между функциональной группой А – Н и электроотрицательным атомом или группой атомов В той же или другой молекулы; особое участие в этой связи принимает атом водорода, уже связанный с А (связь А – H···В). Группа A – H выступает как донор протона, группа В как донор электрона. Водородная связь возможна только между двумя атомами. Такая связь осуществляется между атомами водорода Н и атомами N, О, F, S, Cl в веществах, молекулы которых содержат эти атомы. При образовании водородной связи изменяются межъядерные расстояния в молекуле, связь А – Н удлиняется.
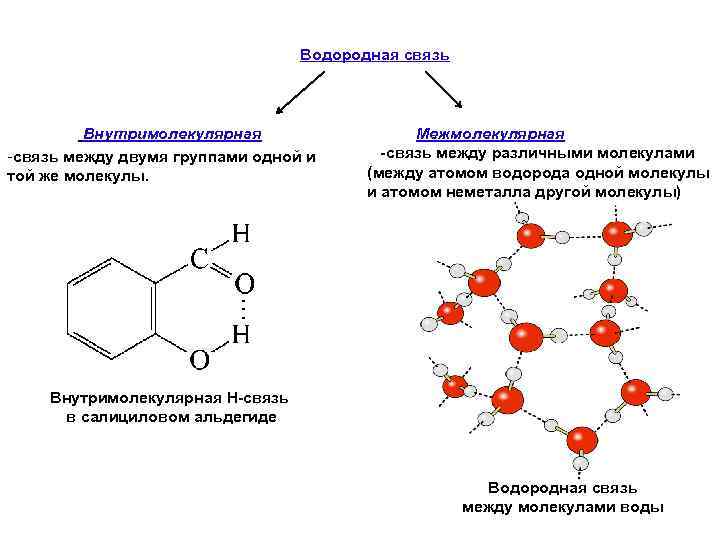 Водородная связь Внутримолекулярная -связь между двумя группами одной и той же молекулы. Межмолекулярная -связь между различными молекулами (между атомом водорода одной молекулы и атомом неметалла другой молекулы) Внутримолекулярная Н-связь в салициловом альдегиде Водородная связь между молекулами воды
Водородная связь Внутримолекулярная -связь между двумя группами одной и той же молекулы. Межмолекулярная -связь между различными молекулами (между атомом водорода одной молекулы и атомом неметалла другой молекулы) Внутримолекулярная Н-связь в салициловом альдегиде Водородная связь между молекулами воды
 Проявления водородных связей • Газы: существование и структура димеров (спектры) • Конденсированные фазы (жидкости, твердые тела): – температуры кипения (жидкости), плавления, сублимации (твердые тела), – теплоемкость, – термическое расширение, – механические свойства (упругость, сжимаемость, пластичность, хрупкость, анизотропия), – фазовые переходы, химические реакции – структуры (в т. ч. – вторичная и третичная структуры биополимеров, например, белков), – в параметрах спектров (смещения частот, изменение ширины и интенсивности полос, полосы самих водородных связей)
Проявления водородных связей • Газы: существование и структура димеров (спектры) • Конденсированные фазы (жидкости, твердые тела): – температуры кипения (жидкости), плавления, сублимации (твердые тела), – теплоемкость, – термическое расширение, – механические свойства (упругость, сжимаемость, пластичность, хрупкость, анизотропия), – фазовые переходы, химические реакции – структуры (в т. ч. – вторичная и третичная структуры биополимеров, например, белков), – в параметрах спектров (смещения частот, изменение ширины и интенсивности полос, полосы самих водородных связей)
 Ассоциация — объединение простых молекул или ионов в более сложные, не вызывающие изменения химической природы вещества. Ассоциация ионов Ассоциация молекул Ассоциация ионов основана на проявлении электростатических сил. Простейшие ионные ассоциаты состоят из двух или трех ионов и представляют собой нейтральные или заряженные частицы.
Ассоциация — объединение простых молекул или ионов в более сложные, не вызывающие изменения химической природы вещества. Ассоциация ионов Ассоциация молекул Ассоциация ионов основана на проявлении электростатических сил. Простейшие ионные ассоциаты состоят из двух или трех ионов и представляют собой нейтральные или заряженные частицы.
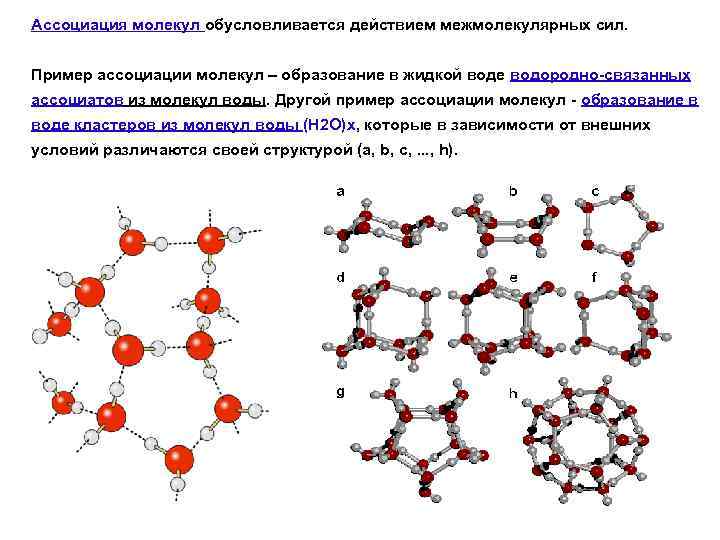 Ассоциация молекул обусловливается действием межмолекулярных сил. Пример ассоциации молекул – образование в жидкой воде водородно-связанных ассоциатов из молекул воды. Другой пример ассоциации молекул - образование в воде кластеров из молекул воды (Н 2 О)x, которые в зависимости от внешних условий различаются своей структурой (а, b, c, . . . , h).
Ассоциация молекул обусловливается действием межмолекулярных сил. Пример ассоциации молекул – образование в жидкой воде водородно-связанных ассоциатов из молекул воды. Другой пример ассоциации молекул - образование в воде кластеров из молекул воды (Н 2 О)x, которые в зависимости от внешних условий различаются своей структурой (а, b, c, . . . , h).


