4 Кинетика электрохим кор.ppt
- Количество слайдов: 12
 Тема 4. Основы кинетики электрохимической коррозии
Тема 4. Основы кинетики электрохимической коррозии
 4. 1. Кинетические характеристики электрохимических процессов n Скорость коррозии, массовый показатель, г/м 2 час Δm – изменение массы образца в течение времени, выбранного в качестве базового (обычно 200 часов); S – площадь корродирующей поверхности, м 2; τ – база испытания, час. n Скорость коррозии, глубинный показатель (глубина проникновения коррозии), мм/год Δδ – уменьшение толщины стенки металлоконструкции за контрольный период, мм; τ – продолжительность контрольного периода, годы.
4. 1. Кинетические характеристики электрохимических процессов n Скорость коррозии, массовый показатель, г/м 2 час Δm – изменение массы образца в течение времени, выбранного в качестве базового (обычно 200 часов); S – площадь корродирующей поверхности, м 2; τ – база испытания, час. n Скорость коррозии, глубинный показатель (глубина проникновения коррозии), мм/год Δδ – уменьшение толщины стенки металлоконструкции за контрольный период, мм; τ – продолжительность контрольного периода, годы.
 n Плотность тока коррозии i, А/м 2
n Плотность тока коррозии i, А/м 2
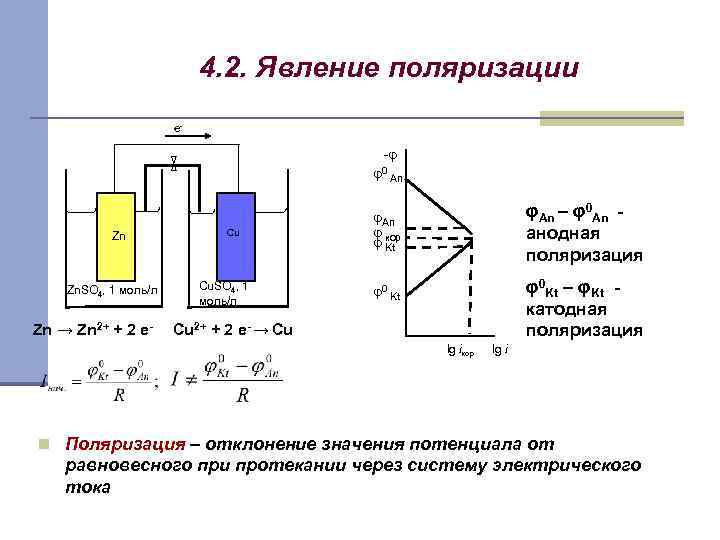 4. 2. Явление поляризации e- -φ φ0 An Zn Zn. SO 4, 1 моль/л Zn → Zn 2+ + 2 e- Cu Cu. SO 4, 1 моль/л φAn φ кор φ Kt φAn – φ0 An анодная поляризация φ0 Kt φ0 Kt – φKt катодная поляризация Cu 2+ + 2 e- → Cu lg iкор lg i n Поляризация – отклонение значения потенциала от равновесного при протекании через систему электрического тока
4. 2. Явление поляризации e- -φ φ0 An Zn Zn. SO 4, 1 моль/л Zn → Zn 2+ + 2 e- Cu Cu. SO 4, 1 моль/л φAn φ кор φ Kt φAn – φ0 An анодная поляризация φ0 Kt φ0 Kt – φKt катодная поляризация Cu 2+ + 2 e- → Cu lg iкор lg i n Поляризация – отклонение значения потенциала от равновесного при протекании через систему электрического тока
 Причины поляризации Возникновение поляризации связано с отставанием процессов стекания ионов с анода, переноса ионов или молекул по раствору электролита, разрядки их на поверхности катода от процесса переноса электронов по металлу. n Активационная (химическая) поляризация определяется энергетическими затруднениями при стекании ионов с анода в раствор электролита или при восстановлении ионов или молекул на поверхности катода. n Концентрационная поляризация связана с затруднениями при диффузии ионов или молекул от поверхности анода к поверхности катода. n При коррозии металлов анодная реакция может протекать как с активационной, так и с концентрационной поляризацией, а катодная , если деполяризатором служат ионы водорода – с активационной, а если молекулы кислорода – с диффузионной деполяризацией. n
Причины поляризации Возникновение поляризации связано с отставанием процессов стекания ионов с анода, переноса ионов или молекул по раствору электролита, разрядки их на поверхности катода от процесса переноса электронов по металлу. n Активационная (химическая) поляризация определяется энергетическими затруднениями при стекании ионов с анода в раствор электролита или при восстановлении ионов или молекул на поверхности катода. n Концентрационная поляризация связана с затруднениями при диффузии ионов или молекул от поверхности анода к поверхности катода. n При коррозии металлов анодная реакция может протекать как с активационной, так и с концентрационной поляризацией, а катодная , если деполяризатором служат ионы водорода – с активационной, а если молекулы кислорода – с диффузионной деполяризацией. n
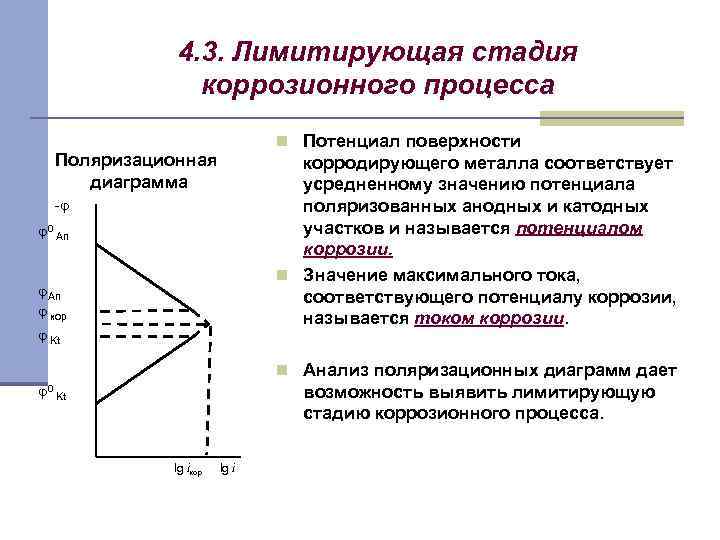 4. 3. Лимитирующая стадия коррозионного процесса n Потенциал поверхности Поляризационная диаграмма корродирующего металла соответствует усредненному значению потенциала поляризованных анодных и катодных участков и называется потенциалом коррозии. n Значение максимального тока, соответствующего потенциалу коррозии, называется током коррозии. -φ φ0 An φ кор φ Kt n Анализ поляризационных диаграмм дает φ 0 возможность выявить лимитирующую стадию коррозионного процесса. Kt lg iкор lg i
4. 3. Лимитирующая стадия коррозионного процесса n Потенциал поверхности Поляризационная диаграмма корродирующего металла соответствует усредненному значению потенциала поляризованных анодных и катодных участков и называется потенциалом коррозии. n Значение максимального тока, соответствующего потенциалу коррозии, называется током коррозии. -φ φ0 An φ кор φ Kt n Анализ поляризационных диаграмм дает φ 0 возможность выявить лимитирующую стадию коррозионного процесса. Kt lg iкор lg i
 Варианты течения коррозионного процесса: 1. -φ φ An φ кор φ Kt lg iкор lg i 2. -φ φ An φ кор φ Kt lg iкор lg i Лимитирующая стадия – анодный процесс ( коррозия идет с анодным контролем). контролем Анодная поляризация больше катодной Потенциал коррозии близок к потенциалу катода разомкнутого контура. Для подавления коррозии стремятся подавить анодный процесс, например, путем подсоединения объекта к отрицательному полюсу источника питания: Fe → Fe 2+ + 2 e- Лимитирующая стадия – катодный процесс ( коррозия идет с катодным контролем). контролем Катодная поляризация больше анодной Потенциал коррозии близок к потенциалу анода разомкнутого контура. Для подавления коррозии стремятся подавить катодный процесс, например, путем нейтрализации среды при водородной поляризации, или путем деаэрации при кислородной.
Варианты течения коррозионного процесса: 1. -φ φ An φ кор φ Kt lg iкор lg i 2. -φ φ An φ кор φ Kt lg iкор lg i Лимитирующая стадия – анодный процесс ( коррозия идет с анодным контролем). контролем Анодная поляризация больше катодной Потенциал коррозии близок к потенциалу катода разомкнутого контура. Для подавления коррозии стремятся подавить анодный процесс, например, путем подсоединения объекта к отрицательному полюсу источника питания: Fe → Fe 2+ + 2 e- Лимитирующая стадия – катодный процесс ( коррозия идет с катодным контролем). контролем Катодная поляризация больше анодной Потенциал коррозии близок к потенциалу анода разомкнутого контура. Для подавления коррозии стремятся подавить катодный процесс, например, путем нейтрализации среды при водородной поляризации, или путем деаэрации при кислородной.
 3. -φ Лимитирующая стадия – перенос зарядов ( коррозия идет с омическим контролем). контролем Поляризация за счет падения напряжения превышает анодную и катодную. Для подавления коррозии используют изоляционные покрытия φ An Iкор. R φ Kt lg iкор 4. lg i φ φ An Лимитирующая стадия – выявляется ( коррозия идет со смешанным контролем). контролем Все виды поляризации соизмеримы. Для подавления коррозии используют комплексную защиту. φ кор φ Kt lg iкор lg i
3. -φ Лимитирующая стадия – перенос зарядов ( коррозия идет с омическим контролем). контролем Поляризация за счет падения напряжения превышает анодную и катодную. Для подавления коррозии используют изоляционные покрытия φ An Iкор. R φ Kt lg iкор 4. lg i φ φ An Лимитирующая стадия – выявляется ( коррозия идет со смешанным контролем). контролем Все виды поляризации соизмеримы. Для подавления коррозии используют комплексную защиту. φ кор φ Kt lg iкор lg i
 4. 4. Представления о пассивности n Пассивность – это состояние повышенной устойчивости к коррозии термодинамически активного металла, связанное с торможением анодного процесса. n Причины возникновения пассивного состояния – разные, в том числе, возникновение защитных пленок продуктов коррозии на поверхности металла, внешняя катодная поляризация и др. n Кинетику растворения металла при пассивации удобно оценить по ходу поляризационных кривых.
4. 4. Представления о пассивности n Пассивность – это состояние повышенной устойчивости к коррозии термодинамически активного металла, связанное с торможением анодного процесса. n Причины возникновения пассивного состояния – разные, в том числе, возникновение защитных пленок продуктов коррозии на поверхности металла, внешняя катодная поляризация и др. n Кинетику растворения металла при пассивации удобно оценить по ходу поляризационных кривых.
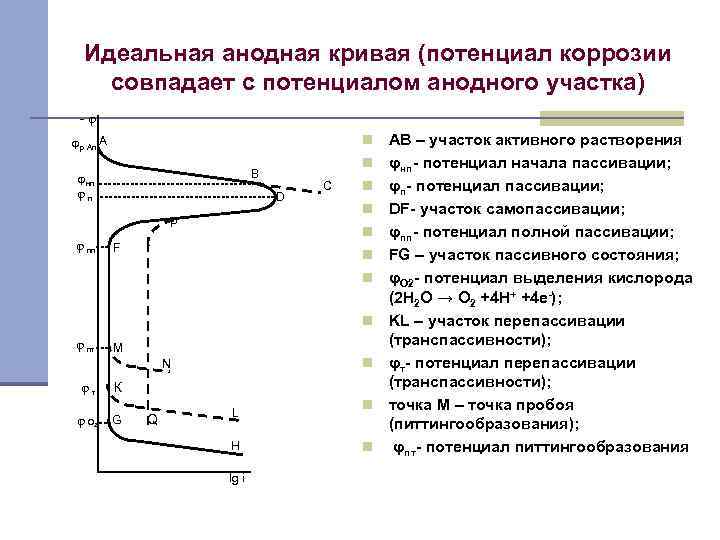 Идеальная анодная кривая (потенциал коррозии совпадает с потенциалом анодного участка) -φ n φр An A n B φнп φп D P φ пп C n n n F n n n φ пт M n N φт φО 2 К G Q L H lg i n n АВ – участок активного растворения φнп- потенциал начала пассивации; φп- потенциал пассивации; DF- участок самопассивации; φпп- потенциал полной пассивации; FG – участок пассивного состояния; φО 2 - потенциал выделения кислорода (2 Н 2 О → О 2 +4 Н+ +4 е-); KL – участок перепассивации (транспассивности); φт- потенциал перепассивации (транспассивности); точка М – точка пробоя (питтингообразования); φпт- потенциал питтингообразования
Идеальная анодная кривая (потенциал коррозии совпадает с потенциалом анодного участка) -φ n φр An A n B φнп φп D P φ пп C n n n F n n n φ пт M n N φт φО 2 К G Q L H lg i n n АВ – участок активного растворения φнп- потенциал начала пассивации; φп- потенциал пассивации; DF- участок самопассивации; φпп- потенциал полной пассивации; FG – участок пассивного состояния; φО 2 - потенциал выделения кислорода (2 Н 2 О → О 2 +4 Н+ +4 е-); KL – участок перепассивации (транспассивности); φт- потенциал перепассивации (транспассивности); точка М – точка пробоя (питтингообразования); φпт- потенциал питтингообразования
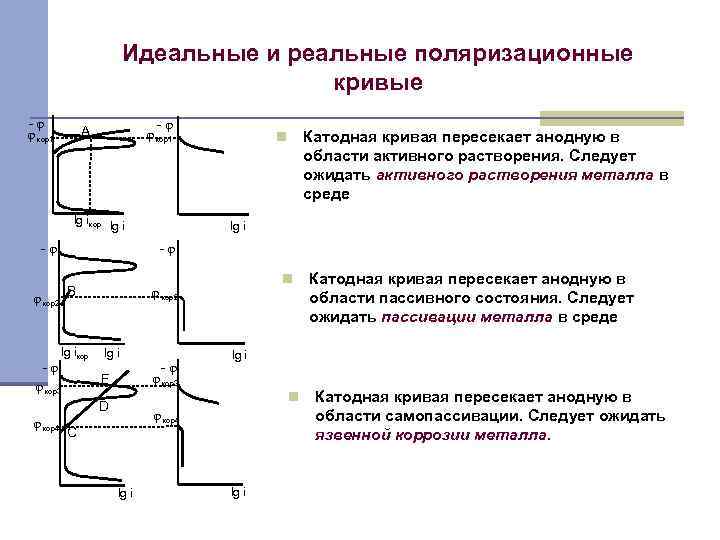 Идеальные и реальные поляризационные кривые -φ φ кор1 А lg iкор lg i -φ В lg iкор n φ кор2 lg i -φ φ кор3 F φ кор3 φ кор4 C lg i Катодная кривая пересекает анодную в области пассивного состояния. Следует ожидать пассивации металла в среде lg i n D φ кор4 lg i -φ φ кор2 -φ Катодная кривая пересекает анодную в области активного растворения. Следует ожидать активного растворения металла в среде n lg i Катодная кривая пересекает анодную в области самопассивации. Следует ожидать язвенной коррозии металла.
Идеальные и реальные поляризационные кривые -φ φ кор1 А lg iкор lg i -φ В lg iкор n φ кор2 lg i -φ φ кор3 F φ кор3 φ кор4 C lg i Катодная кривая пересекает анодную в области пассивного состояния. Следует ожидать пассивации металла в среде lg i n D φ кор4 lg i -φ φ кор2 -φ Катодная кривая пересекает анодную в области активного растворения. Следует ожидать активного растворения металла в среде n lg i Катодная кривая пересекает анодную в области самопассивации. Следует ожидать язвенной коррозии металла.
 4. 5. Общие представления о коррозионностойком легировании сталей n При коррозионностойком легировании в сталь вводят n n элементы, повышающие стойкость к электрохимической коррозии. Введение никеля способствует образованию кристаллического строения стали, с максимальной реализацией валентных возможностей атомов железа. Это снижает способность железа взаимодействовать со средой. Введение хрома способствует пассивации стали. 08 Х 13 – 0, 08%C и 13%Сr 12 Х 18 Н 10 Т - 0, 12%С, 18%Cr, 10%Ni и до 1% Ti
4. 5. Общие представления о коррозионностойком легировании сталей n При коррозионностойком легировании в сталь вводят n n элементы, повышающие стойкость к электрохимической коррозии. Введение никеля способствует образованию кристаллического строения стали, с максимальной реализацией валентных возможностей атомов железа. Это снижает способность железа взаимодействовать со средой. Введение хрома способствует пассивации стали. 08 Х 13 – 0, 08%C и 13%Сr 12 Х 18 Н 10 Т - 0, 12%С, 18%Cr, 10%Ni и до 1% Ti


