Лекция 3 -(2)-ПиА.ppt
- Количество слайдов: 28

Тема 3 МАССООБМЕННЫЕ ПРОЦЕССЫ План (2 часа) 1. Общие сведения о массообменных процессах 2. Способы выражения состава фаз 3. Относительный весовой состав фаз 4. Равновесие между фазами 5. Материальный баланс процессов массообмена 6. Уравнение массопередачи Якуб Лидия Николаевна к. ф. -м. н. , доцент Процессы и аппараты. Тема 3.

1. Общие сведения о массообменных процессах • В химической технике широко применяют массообменные процессы: абсорбцию, экстракцию, ректификацию, адсорбцию и сушку. • Абсорбция — избирательное поглощение газов или паров жидким поглотителем (абсорбентом). • Этот процесс представляет собой переход вещества из газовой или паровой фазы в жидкую. • Экстракция — извлечение растворенного в одной жидкости вещества другой жидкостью. • К экстракции относят также процесс извлечения веществ из твердой фазы в жидкую. • Этот процесс представляет собой переход вещества из одной жидкой фазы в другую. 2/1/2018 Процессы и аппараты. Тема 3. 2

Общие сведения о массообменных процессах • Ректификация — разделение жидкой смеси на компоненты путем противоточного взаимодействия потоков пара и жидкости. • Этот процесс включает переходы вещества из жидкой фазы в паровую и из паровой в жидкую. • Адсорбция — избирательное поглощение газов, паров или растворенных в жидкости веществ поверхностью пористого твердого поглотителя (адсорбента), способного поглощать одно или несколько веществ из их смеси. • Этот процесс представляет собой переход вещества из газовой, паровой или жидкой фаз в пористый твердый материал. • Сушка — удаление влаги из твердых влажных материалов путем ее испарения. • Этот процесс представляет собой переход влаги из твердого влажного материала в паровую или газовую фазу. 2/1/2018 Процессы и аппараты. Тема 3. 3

Общие сведения о массообменных процессах • Скорость перечисленных процессов определяется скоростью перехода вещества из одной фазы в другую (скоростью массопередачи). • В большинстве процессов массопередачи участвуют три вещества: • 1) распределяющее вещество, составляющее первую фазу; • 2) распределяющее вещество, составляющее вторую фазу; • 3) распределяемое вещество, переходящее из одной фазы в другую. 2/1/2018 Процессы и аппараты. Тема 3. 4

2. Способы выражения состава фаз • Распределяющие вещества не участвуют в процессе массопередачи, являются носителями распределяемого вещества. • Массообменные процессы обратимы, т. е. распределяемое вещество может переходить из одной фазы в другую в зависимости от концентрации этого вещества в обеих фазах и условий равновесия • Весовой и молярный состав фаз. • В технике состав выражают обычно в весовых долях (или весовых процентах), т. е. в виде отношения массы компонента в данной фазе к массе всей фазы. 2/1/2018 Процессы и аппараты. Тема 3. 5

Способы выражения состава фаз • Если масса фазы G, а масса содержащихся в ней компонентов А, В, С, . . . составляют соответственно GА, GB, Gc, . . . , то весовые доли 2/1/2018 Процессы и аппараты. Тема 3. 6

Способы выражения состава фаз • Во многих случаях состав выражают в молярных долях, т. е. в виде отношения числа киломолей компонента в данной фазе к общему числу киломолей в этой фазе. • Если всего в фазе содержится n кмоль, а число киломолей компонентов А, В, С, . . . составляет n. A, nв, nс, то молярные доли компонентов будут: 2/1/2018 Процессы и аппараты. Тема 3. 7

Способы выражения состава фаз • Состав смеси двух компонентов (двойные смеси) полностью характеризуется содержанием в ней лишь одного из двух компонентов. • Пусть весовая и мольная доли этого компонента a и x. Тогда весовая и мольная доля другого компонента • (1 - а) и (1 –x). • Содержание компонентов газообразной смеси часто выражают через парциальные давления. • Под парциальным давлением компонента понимают давление, под которым находился бы данный компонент, если бы в отсутствие других компонентов он занимал весь объем смеси при ее температуре. 2/1/2018 Процессы и аппараты. Тема 3. 8

Способы выражения состава фаз • Согласно закону Дальтона, полное давление Р газовой смеси равно сумме парциальных давлений компонентов PА, PВ, PC. • Отношение парциального давления компонента к полному давлению равно объемной доле компонента в смеси. 2/1/2018 Процессы и аппараты. Тема 3. 9

3. Относительный весовой состав фаз • Состав двойной смеси можно выразить в виде отношения массы распределяемого компонента к массе носителя. Это отношение называется относительным весовым составом. • Связь между относительным весовым составом X и весовой долей а выражается следующим соотношением: • При расчете состав газовой смеси, выраженный через парциальное давление компонента р, часто приходится пересчитывать в относительный весовой состав 2/1/2018 Процессы и аппараты. Тема 3. 10

Относительный весовой состав фаз • Если, общее давление смеси Р, парциальное давление носителя (Р — р); • тогда уравнение состояния для компонента будет иметь вид: • и для носителя: • где V - объем смеси, м 3; • Gк и Gн — количества компонента и носителя в объеме V, кг • Мк и Мн —молекулярные массы компонента и носителя 2/1/2018 Процессы и аппараты. Тема 3. 11

Относительный весовой состав фаз • Деля первое уравнение на второе, получим: • Отсюда находим относительный весовой состав: 2/1/2018 Процессы и аппараты. Тема 3. 12

4. Равновесие между фазами • Подобно тому, как передача тепла протекает лишь при отклонении от состояния равновесия, т. е. при наличии разности температур между теплоносителями, так и переход вещества из одной фазы в другую происходит при отсутствии равновесия между фазами. • Пусть имеются две фазы G и L, причем распределяемое вещество вначале находится только в первой фазе G и имеет концентрацию Y. • Если привести фазы в соприкосновение, то распределяемое вещество начнет переходить в фазу L. • С момента появления распределяемого вещества в фазе L начнется и обратный переход его в фазу G. 2/1/2018 Процессы и аппараты. Тема 3. 13

Равновесие между фазами • Скорость обратного перехода будет увеличиваться по мере повышения концентрации распределяемого вещества в фазе L. • В некоторый момент скорости перехода вещества из фазы G в фазу L и обратно станут одинаковыми. • При этом установится состояние равновесия между фазами, при котором явного перехода вещества из одной фазы в другую происходить не будет. • Условие равновесия, выраженное уравнением (1), позволяет определить направление процесса. 2/1/2018 Процессы и аппараты. Тема 3. 14

Равновесие между фазами • Если рабочая концентрация распределяемого вещества в фазе G больше равновесной (Y>Y*), вещество будет переходить из фазы G в фазу L. • Если же Y < Y *, вещество переходит из фазы L в фазу G. • Равновесие между фазами можно представить графически на Y –X диаграмме. • По оси абсцисс откладывается концентрация X распределяемого вещества в фазе L, а по оси у – его концентрация в фазе G. • OC – изображает зависимость равновесной концентрации Y* от X - называется линией равновесия. 2/1/2018 Процессы и аппараты. Тема 3. 15
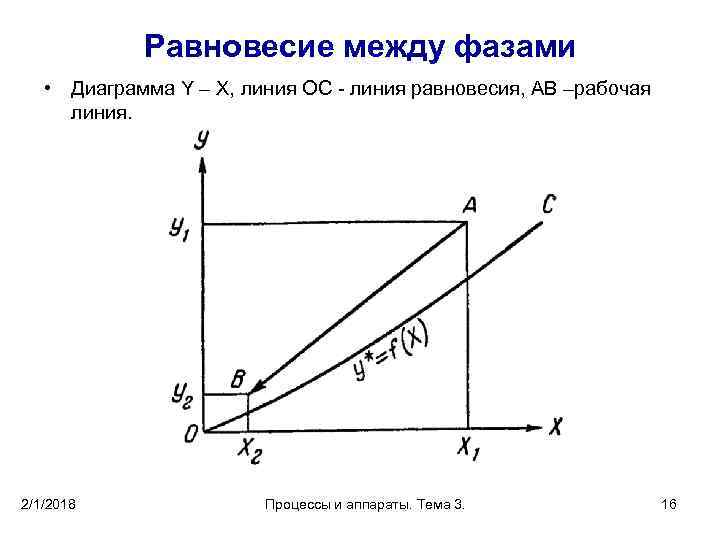
Равновесие между фазами • Диаграмма Y – X, линия ОС - линия равновесия, АВ –рабочая линия. 2/1/2018 Процессы и аппараты. Тема 3. 16

5. Материальный баланс процессов массообмена • Рассмотрим схему движения потоков в противоточном аппарате для массообмена рис. 2. • В аппарат поступают фазы G (например, газ) и L (например, жидкость). • Пусть расход носителя в фазе G составляет G кг/сек, а в фазе L равен L кг/сек. • Содержание распределяемого компонента, выраженное в виде относительных весовых составов, в фазе G обозначим через У, в фазе L — через X. • Предположим, что распределяемый компонент переходит из фазы G в фазу L (например, абсорбируется из газовой смеси жидкостью), причем содержание этого компонента в фазе G уменьшается от Y 1 (на входе в аппарат) до У 2 (на выходе из аппарата). 2/1/2018 Процессы и аппараты. Тема 3. 17
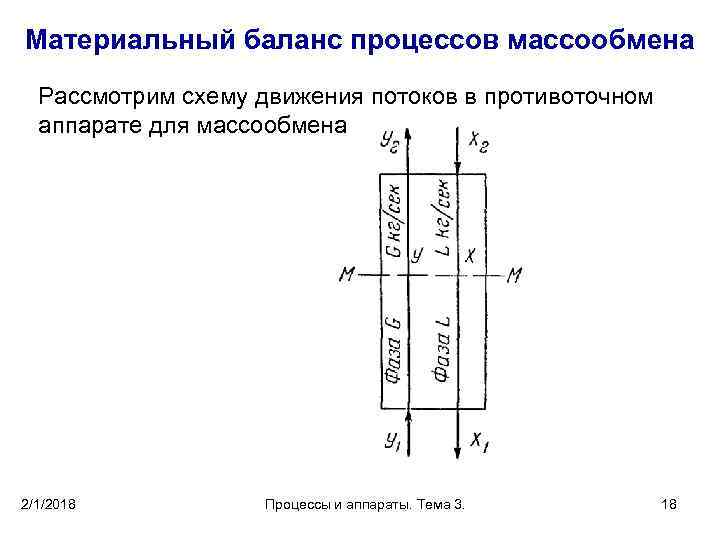
Материальный баланс процессов массообмена Рассмотрим схему движения потоков в противоточном аппарате для массообмена 2/1/2018 Процессы и аппараты. Тема 3. 18

Материальный баланс процессов массообмена • Соответственно содержание этого же компонента в фазе L увеличивается от Х 2 (при входе в аппарат) до Х 1 (на выходе из аппарата). • Носители не участвуют в процессе массообмена, следовательно, их количества G и L не изменяются по длине аппарата. • Тогда количество компонента, перешедшего из фазы G, составит: • 2/1/2018 и количество компонента, перешедшего в фазу L: Процессы и аппараты. Тема 3. 19

Материальный баланс процессов массообмена • Оба эти количества равны, поэтому можно написать уравнение материального баланса в следующем виде: • Отсюда находим соотношения между количествами носителя в обеих фазах: 2/1/2018 Процессы и аппараты. Тема 3. 20

Материальный баланс процессов массообмена • Рассмотрим произвольное сечение аппарата М - N, в котором составы фаз будут У и X и напишем уравнение материального баланса для части аппарата, расположенной выше этого сечения: • откуда: • Уравнение, называемое уравнением рабочей линии, выражает зависимость между неравновесными составами фаз (У, X) в любом сечении аппарата. • 2/1/2018 Процессы и аппараты. Тема 3. 21

Материальный баланс процессов массообмена • Как видно из этого уравнения, , на диаграмме Y — X рабочая линия представляет собой прямую с наклоном к оси абсцисс под углом, тангенс которого равен l. • Подставив в уравнение (5) значение l из уравнения (4 ), получим после простейших преобразований: • Это выражение является уравнением прямой (см. рис1), проходящей через точку А с координатами Х 1 Y 1 и через точку В - с координатами Х 2, Y 2. 2/1/2018 Процессы и аппараты. Тема 3. 22

Материальный баланс процессов массообмена • На рис. 1 рабочая линия расположена выше линии равновесия т. е. рабочие концентрации распределяемого компонента в фазе G выше равновесных концентраций и компонент переходит из фазы G в фазу L. • Если компонент переходит из фазы L в фазу G, то рабочие концентрации в фазе G ниже равновесных; • В этом случае рабочая линия расположена ниже линии равновесия. 2/1/2018 Процессы и аппараты. Тема 3. 23

6. Уравнение массопередачи • При отклонении от состояния равновесия происходит переход вещества из фазы, в которой его содержание выше равновесного, в фазу, где содержание этого вещества ниже равновесного. • Скорость перехода пропорциональна степени отклонения от равновесия, которою можно выразить как разность концентраций – рабочей концентрации вещества в одной из фаз и равновесной концентрации в ней данного вещества. • Эта разность концентраций является движущей силой процесса массопередачи. • Кроме того, скорость перехода вещества пропорциональна поверхности соприкосновения фаз. 2/1/2018 Процессы и аппараты. Тема 3. 24

Уравнение массопередачи • Скорость перехода вещества можно определить как количество вещества, переходящего в единицу времени из одной фазы в другую. Тогда уравнение массопередачи можно записать в виде: где М – количество вещества, перешедшего из одной фазы в другую, кг/сек • K – коэффициент пропорциональности, называемый коэффициентом массопередачи; • F - поверхность соприкосновения фаз, м 2 • D - движущая сила процесса массопередачи. 2/1/2018 Процессы и аппараты. Тема 3. 25

Средняя движущая сила и методы расчета процессов массопередачи • Движущая сила не остается постоянной по длине аппарата. • Рассмотрим методы определения средней движущей силы. • Среднелогарифмическая движущая сила определяется по формуле: • где D 1 и D 2 — значения движущей силы на входе и выходе из аппарата. 2/1/2018 Процессы и аппараты. Тема 3. 26

Средняя движущая сила и методы расчета процессов массопередачи – При соотношении 2 > D 1/ D 2 > 0, 5 можно с достаточной точностью пользоваться среднеарифметическим значением; • Среднелогарифмическое значение движущей силы точно лишь в том случае, если линия равновесия и рабочая линия являются прямыми, а коэффициент массопередачи сохраняется постоянным по всей длине аппарата. 2/1/2018 Процессы и аппараты. Тема 3. 27

Благодарю за внимание 2/1/2018 Процессы и аппараты. Тема 3. 28
Лекция 3 -(2)-ПиА.ppt