 Тема 2. Окисление металла по химическому механизму. Химическая коррозия
Тема 2. Окисление металла по химическому механизму. Химическая коррозия
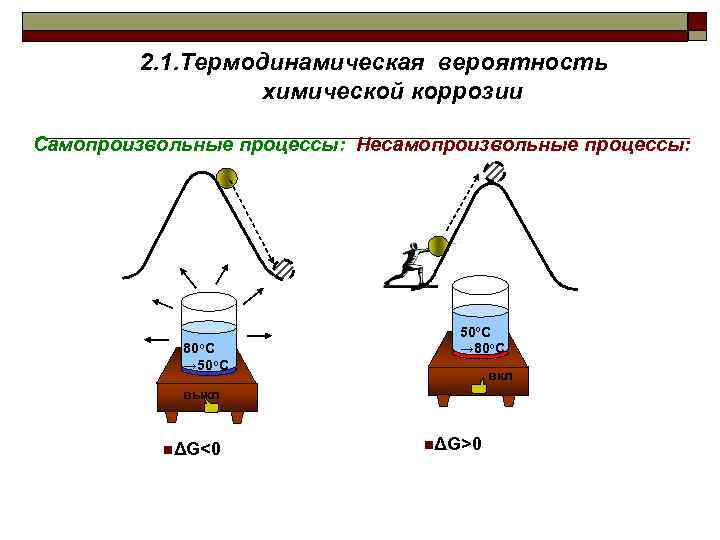 2. 1. Термодинамическая вероятность химической коррозии Самопроизвольные процессы: Несамопроизвольные процессы: 80 o. С → 50 o. С → 80 o. С вкл выкл nΔG<0 nΔG>0
2. 1. Термодинамическая вероятность химической коррозии Самопроизвольные процессы: Несамопроизвольные процессы: 80 o. С → 50 o. С → 80 o. С вкл выкл nΔG<0 nΔG>0
 Основное условие протекание процесса взаимодействия металла с окислителем: ΔG<0 o 4 Fe + 3 O 2 = 2 Fe 2 O 3 (1) При стандартных условиях: ΔG = Σ Δ Gконечн – Σ Δ Gисх ΔG 0298 = 2ΔG 0298 Fe 2 O 3 - 4 ΔG 0298 Fe -3 ΔG 0298 O 2 = 2(-740, 3) – 0 =-1480, 6 (к. Дж).
Основное условие протекание процесса взаимодействия металла с окислителем: ΔG<0 o 4 Fe + 3 O 2 = 2 Fe 2 O 3 (1) При стандартных условиях: ΔG = Σ Δ Gконечн – Σ Δ Gисх ΔG 0298 = 2ΔG 0298 Fe 2 O 3 - 4 ΔG 0298 Fe -3 ΔG 0298 O 2 = 2(-740, 3) – 0 =-1480, 6 (к. Дж).
 Влияние парциального давления окислителя на термодинамическую вероятность окисления металла a. A+b. B=c. C+d. D R- универсальная газовая постоянная, R=8, 3 Дж/моль К, Т – температура, К рi - парциальное давление окислителя в рассматриваемых условиях рi 0 – парциальное давление окислителя в равновесных условиях o Для реакции 4/3 Fe + O 2 = 2/3 Fe 2 O 3 ΔG<0, если или р > ро Коррозия возможна, если давление окислителя в системе выше равновесного давления (давления диссоциации оксида).
Влияние парциального давления окислителя на термодинамическую вероятность окисления металла a. A+b. B=c. C+d. D R- универсальная газовая постоянная, R=8, 3 Дж/моль К, Т – температура, К рi - парциальное давление окислителя в рассматриваемых условиях рi 0 – парциальное давление окислителя в равновесных условиях o Для реакции 4/3 Fe + O 2 = 2/3 Fe 2 O 3 ΔG<0, если или р > ро Коррозия возможна, если давление окислителя в системе выше равновесного давления (давления диссоциации оксида).
 Диаграмма для определения равновесного давления диссоциации оксида металла
Диаграмма для определения равновесного давления диссоциации оксида металла
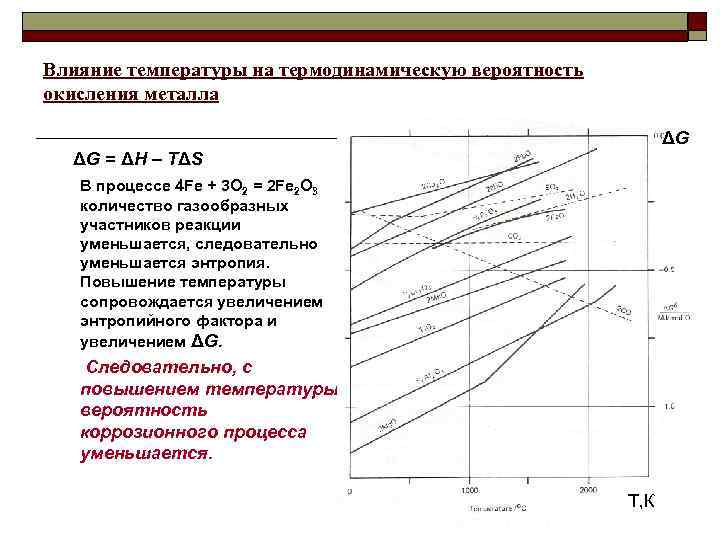 Влияние температуры на термодинамическую вероятность окисления металла ΔG = ΔH – TΔS В процессе 4 Fe + 3 O 2 = 2 Fe 2 O 3 количество газообразных участников реакции уменьшается, следовательно уменьшается энтропия. Повышение температуры сопровождается увеличением энтропийного фактора и увеличением ΔG. Следовательно, с повышением температуры вероятность коррозионного процесса уменьшается. Т, К
Влияние температуры на термодинамическую вероятность окисления металла ΔG = ΔH – TΔS В процессе 4 Fe + 3 O 2 = 2 Fe 2 O 3 количество газообразных участников реакции уменьшается, следовательно уменьшается энтропия. Повышение температуры сопровождается увеличением энтропийного фактора и увеличением ΔG. Следовательно, с повышением температуры вероятность коррозионного процесса уменьшается. Т, К
 2. 2. Кинетические закономерности химической коррозии o o Основные кинетические характеристики: Скорость коррозии, массовый показатель, г/м 2 час Δm – изменение массы образца в течение времени, выбранного в качестве базового (обычно 200 часов); S – площадь корродирующей поверхности, м 2; τ – база испытания, час. o Скорость коррозии, глубинный показатель (глубина проникновения коррозии), мм/год Δδ – уменьшение толщины стенки металлоконструкции за контрольный период, мм; τ – продолжительность контрольного периода, годы.
2. 2. Кинетические закономерности химической коррозии o o Основные кинетические характеристики: Скорость коррозии, массовый показатель, г/м 2 час Δm – изменение массы образца в течение времени, выбранного в качестве базового (обычно 200 часов); S – площадь корродирующей поверхности, м 2; τ – база испытания, час. o Скорость коррозии, глубинный показатель (глубина проникновения коррозии), мм/год Δδ – уменьшение толщины стенки металлоконструкции за контрольный период, мм; τ – продолжительность контрольного периода, годы.
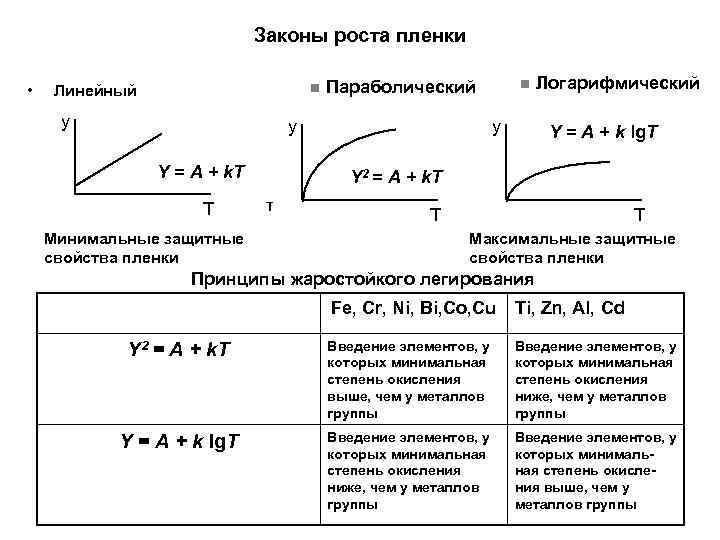 Законы роста пленки • n Логарифмический n Параболический Линейный у у Y = A + k. T Т Минимальные защитные свойства пленки у Y = A + k lg. T Y 2 = A + k. T τ Т Т Максимальные защитные свойства пленки Принципы жаростойкого легирования Fe, Cr, Ni, Bi, Co, Cu Ti, Zn, Al, Cd Y 2 = A + k. T Введение элементов, у которых минимальная степень окисления выше, чем у металлов группы Введение элементов, у которых минимальная степень окисления ниже, чем у металлов группы Y = A + k lg. T Введение элементов, у которых минимальная степень окисления ниже, чем у металлов группы Введение элементов, у которых минимальная степень окисления выше, чем у металлов группы
Законы роста пленки • n Логарифмический n Параболический Линейный у у Y = A + k. T Т Минимальные защитные свойства пленки у Y = A + k lg. T Y 2 = A + k. T τ Т Т Максимальные защитные свойства пленки Принципы жаростойкого легирования Fe, Cr, Ni, Bi, Co, Cu Ti, Zn, Al, Cd Y 2 = A + k. T Введение элементов, у которых минимальная степень окисления выше, чем у металлов группы Введение элементов, у которых минимальная степень окисления ниже, чем у металлов группы Y = A + k lg. T Введение элементов, у которых минимальная степень окисления ниже, чем у металлов группы Введение элементов, у которых минимальная степень окисления выше, чем у металлов группы