тема_15 лекция_15 Цикл Кребса и ЭТЦ бактерий.ppt
- Количество слайдов: 43

Тема 15. Лекция 11. Цикл Кребса и электроннотранспортная цепь бактерий.

У аэробных бактерий образующийся при катаболизме глюкозы пируват обычно окисляется до СО 2 Первый этап — окисление пирувата до ацетил-Со. А с восстановлением NAD+ — катализирует пируватдегидрогеназа: Пируват + Со. А + NAD+ → Ацетил-Со. А + СО 2 + NADH
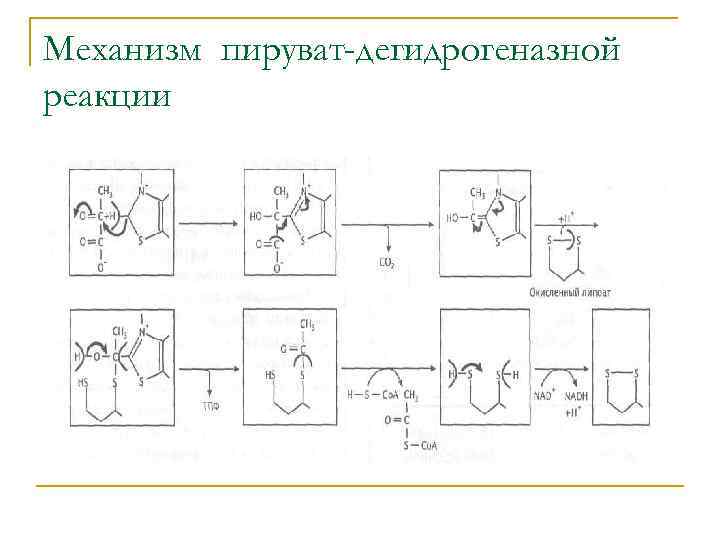
Механизм пируват-дегидрогеназной реакции

По механизму пируватдегидрогеназная реакция сходна с глицеральдегид-3 фосфатдегидрогеназной: в обоих случаях окисление альдегидной группы субстрата приводит к образованию высокоэнергетического соединения через образование тиоэфира как интермедиата. Продуктом глицеральдегид-3 -фосфатдегидрогеназной реакции является ацилфосфат, в то время как продукт пируватдегидрогеназной реакции — тиоэфир.

В реакциях ЦТК происходит окисление ацетильной группы ацетил-Со. А до СО 2 с восстановлением NAD+ и убихинона (Q): Основная цель образования [Н] состоит в том, чтобы обеспечить процесс окислительного фосфорилирования восстановительными эквивалентами с наиболее низким окислительновосстановительным потенциалом. Чем ниже окислительно-восстановительный потенциал восстановительных эквивалентов, переносимых на кислород, тем выше выход АТФ при окислительном фосфорилировании.
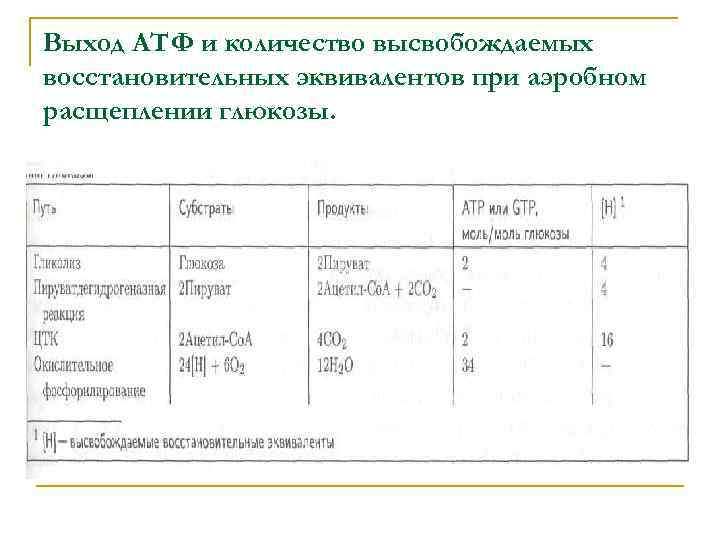
Выход АТФ и количество высвобождаемых восстановительных эквивалентов при аэробном расщеплении глюкозы.
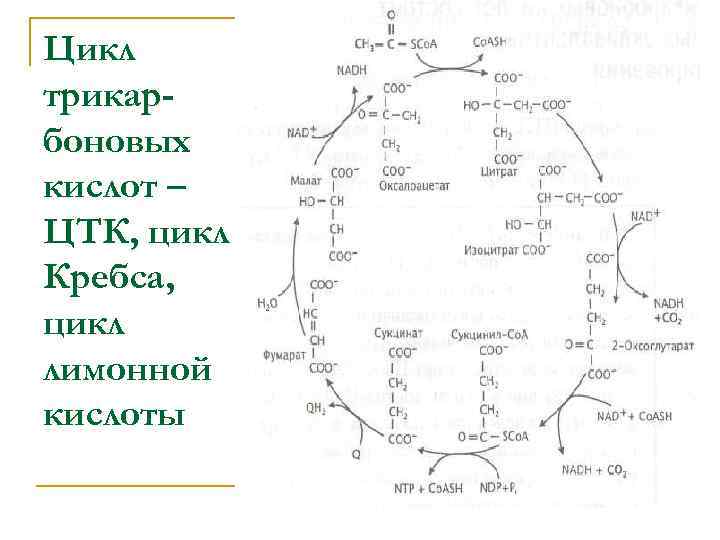
Цикл трикарбоновых кислот – ЦТК, цикл Кребса, цикл лимонной кислоты
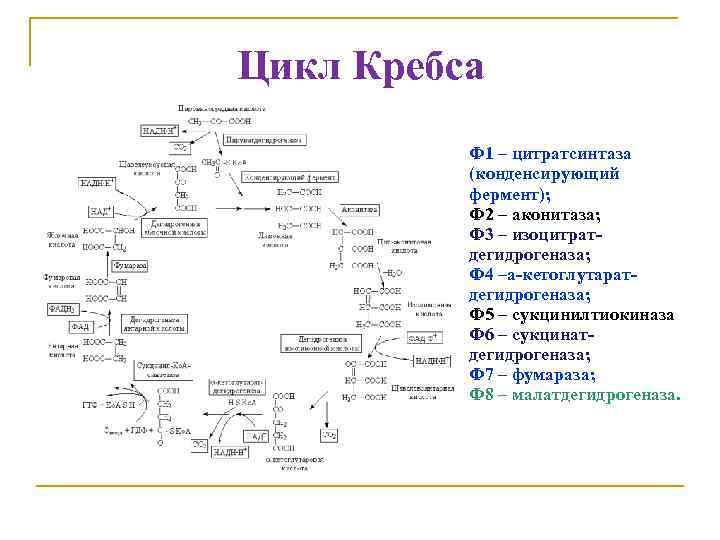
Цикл Кребса Ф 1 Ф 2 Ф 3 Ф 1 – цитратсинтаза (конденсирующий фермент); Ф 2 – аконитаза; Ф 3 – изоцитратдегидрогеназа; Ф 4 –a-кетоглутаратдегидрогеназа; Ф 5 – сукцинилтиокиназа; Ф 6 – сукцинатдегидрогеназа; Ф 7 – фумараза; Ф 8 – малатдегидрогеназа.

Общее изменение свободной энергии при окислении ацетил-Со. А составляет сумма величин ∆G 0' индивидуальных реакций цикла. Эта суммарная величина (— 59 к. Дж/моль ацетил. Со. А) более чем в десять раз меньше изменения свободной энергии, обеспечивающего окислительное фосфорилирование (814 к. Дж/моль ацетил-Со. А). только небольшая часть энергии, выделяющейся при окислении ацетил-Со. А с восстановлением О 2, расходуется на обеспечение работы ЦТК, в то время как основная ее часть запасается в виде восстановительных эквивалентов с относительно низким окислительновосстановительным потенциалом и используется далее для синтеза АТФ в процессе окислительного фосфорилирования.

Электронтранспортное фосфорилирование Электронно-транспортным фосфорилированием (ЭТФ) называют образование АТФ, сопряженное с транспортом электронов по цепи переносчиков от донора на акцептор через ряд окислительновосстановительных реакций. В бактериальных электронно-транспортных цепях (ЭТЦ) конечным акцептором электронов может служить молекулярный кислород и многие другие соединения. Образование АТФ в процессе дыхания с участием кислорода в качестве акцептора электронов называют окислительным фосфорилированием

В отличие от субстратного фосфорилирования (СФ), ЭТФ обеспечивается совместным функционированием многоферментной электронно-транспортной цепи и АТР-синтазы в плазматической мембране бактериальной клетки. Топологически АТР-синтаза отделена от ЭТЦ, но ее активность связана с образующимся при транспорте электронов трансмембранным электрохимическим протонным потенциалом (∆р), называемым также протондвижущей силой.

Перенос электронов по цепи транспорта позволяет запасать энергию окисления в форме свободной энергии ∆р благодаря одновременному перемещению протонов из цитоплазмы через мембрану в наружную среду. Энергия ∆р, высвобождаемая при движении протонов в обратном направлении, по градиенту концентрации, используется АТФ-синтазой для синтеза АТФ.
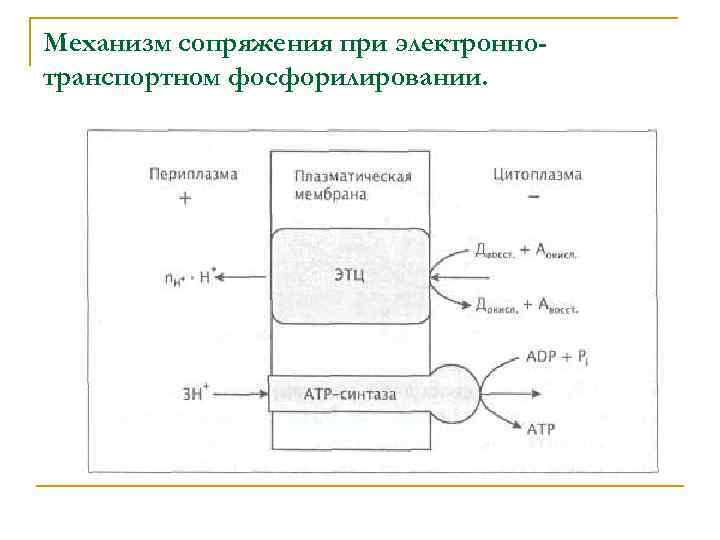
Механизм сопряжения при электроннотранспортном фосфорилировании.

Выход АТФ при электронно-транспортном фосфорилировании в дыхательной цепи с участием кислорода в качестве конечного акцептора электронов, как правило, выражают в виде коэффициента Р/О, т. е. как количество (моль) АТФ, образующееся при восстановлении атома кислорода до Н 2 О (переносе двух электронов).

Для аэробных эубактерий характерна меньшая степень сопряжения электронного транспорта в дыхательной цепи с фосфорилированием, проявляющаяся в низком значении коэффициента Р/O. В опытах с использованием препаратов бактериальных мембран, это отношение в большинстве случаев не превышало 1. Невысокое значение Р/O связано с тем, что в бактериальных дыхательных цепях локализовано меньше генераторов Dm. H+, чем в митохондриальной дыхательной цепи.

Наиболее точно соотношение Р/О измерено для ЭТЦ в митохондриях. При дыхании с использованием NADH его величина равна 1, 5, с использованием сукцината— 1 (при окислении 1 моль NADH или сукцината в дыхательную цепь поступает 2 моль электронов).

У Е. coil и Azotobacter vinelandii отношение P/O равно 2, у Corynebacterium diphteriae — 1, а у Mycobacterium phlei — 3. дыхательные цепи бактерий весьма существенно отличаются от аналогичной системы, функционирующей в эукариотных клетках. Они менее стабильны по составу и значительно менее энергетически эффективны.

Выход АТР и количество перенесенных через мембрану протонов на электрон при дыхании с использованием NADH и сукцината в случае митохондрий
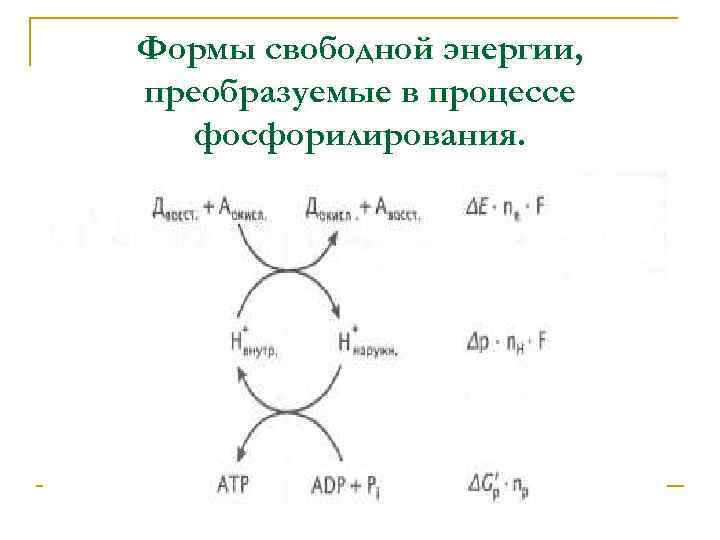
Формы свободной энергии, преобразуемые в процессе фосфорилирования.

В отличие от электронно-транспортных цепей, состоящих из нескольких ферментных комплексов, АТФ-синтаза, или АТФ-аза, представляет собой единый сложный полипептидный комплекс, который можно выделить из мембраны. АТФ-азы, выделенные из различных прокариотических и эукариотических клеток, сходны по структуре и аминокислотным последовательностям основных субъединиц.

Этот фермент обнаружен в клетках аэробных, анаэробных и фототрофных бактерий, в митохондриях, хлоропластах и даже у таких бактерий, которые не способны осуществлять окислительное фосфорилирование, например у Streptococcus faecalis. В последнем случае она выполняет функцию протон-переносящего фермента и создает протонный градиент, необходимый для осуществления транспортных процессов.
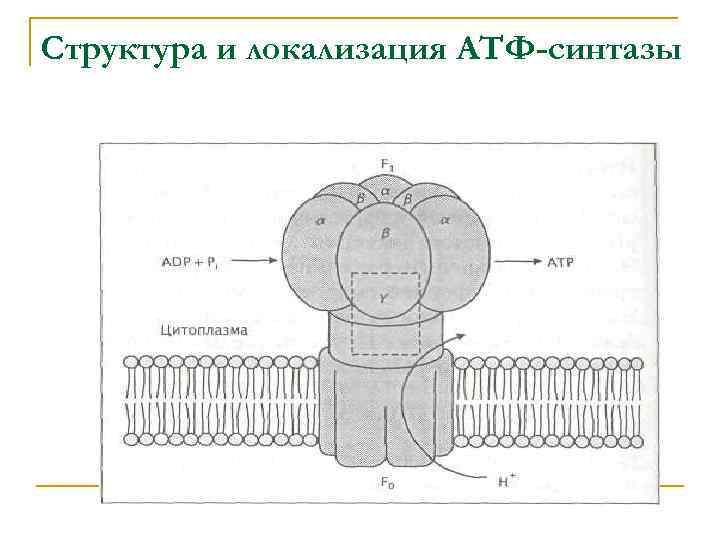
Структура и локализация АТФ-синтазы
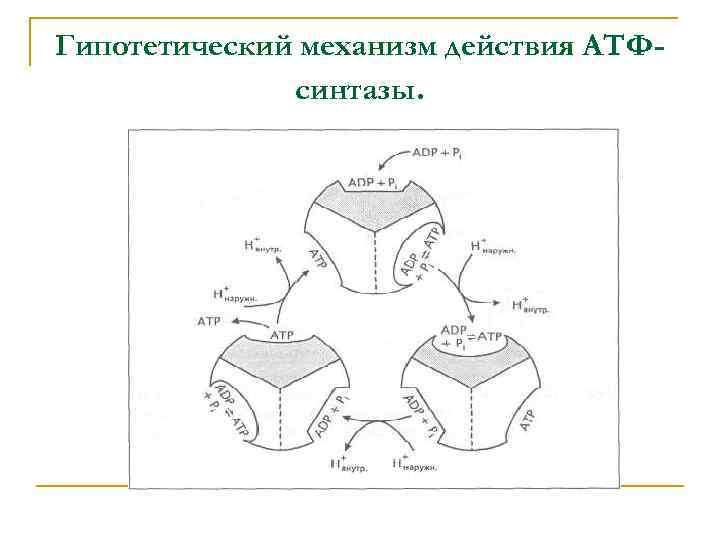
Гипотетический механизм действия АТФсинтазы.

Электронно-транспортная цепь представляет собой не единый белковый комплекс, а набор отдельно расположенных компонентов, и в том числе включает не менее двух топологически разделенных ферментов — дегидрогеназу и редуктазу. Эти ферменты перемещаются независимо в фосфолипидном бислое и обычно присутствуют в мембране в разных количествах. Дегидрогеназа и редуктаза функционально связаны через входящий в состав дыхательной цепи хинон, способный свободно диффундировать в липидной фазе мембраны. Дегидрогеназы катализируют восстановление хинона субстратом-донором, редуктазы — реокисление хинона субстратом-акцептором.

Дыхательные электронтранспортные цепи состоят из локализованных в мембране переносчиков, с помощью которых электроны передаются в виде атомов водорода, или без них. Компонентами цепи являются переносчики белковой (флавопротеины, Fe. S-белки, цитохромы) или небелковой (хиноны) природы. Флавопротеины и хиноны осуществляют перенос атомов водорода, а Fe. S-белки и цитохромы — электронов.
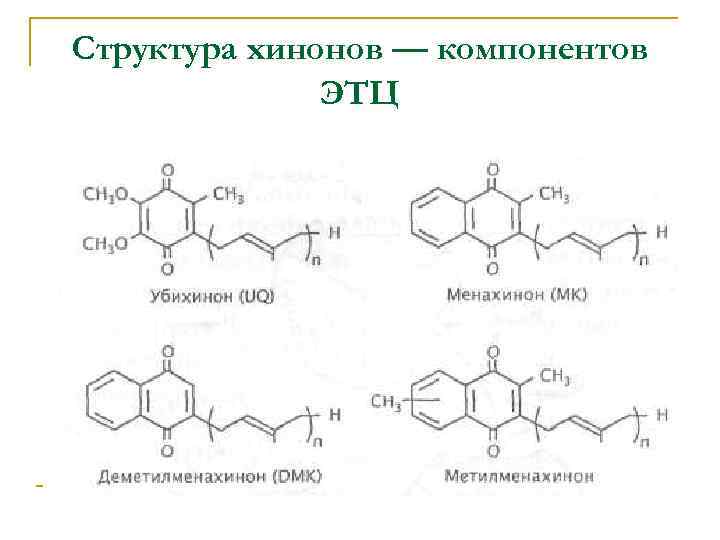
Структура хинонов — компонентов ЭТЦ
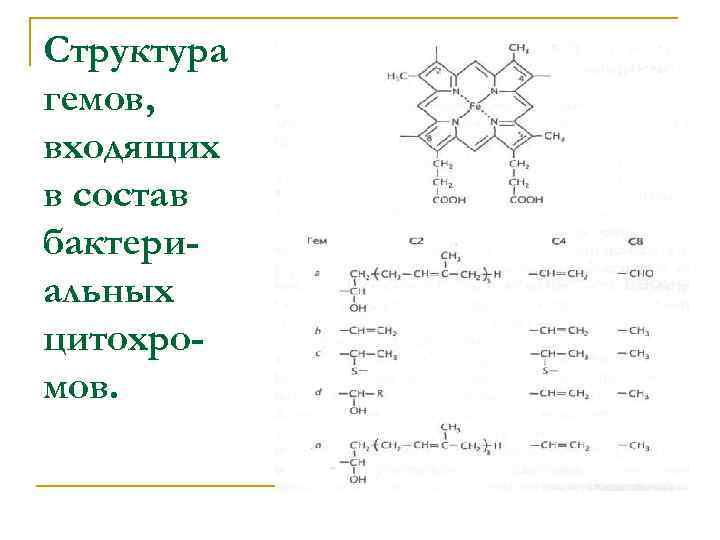
Структура гемов, входящих в состав бактериальных цитохромов.
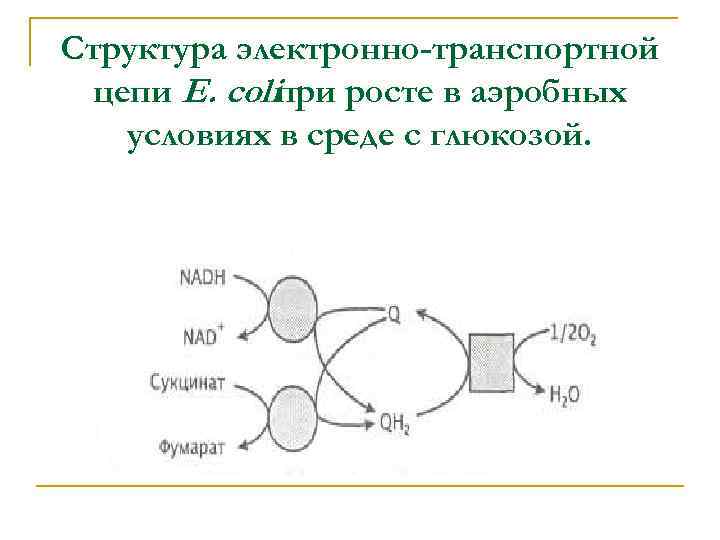
Структура электронно-транспортной цепи Е. coliпри росте в аэробных условиях в среде с глюкозой.

В зависимости от условий роста бактерии содержат различные дегидрогеназы и редуктазы. Перенос электронов от каждого из субстратовдоноров на субстрат-акцептор опосредует хинон. Функция хинонов в плазматической мембране аналогична функции NAD+ в цитоплазме - эти переносчики электронов передают восстановительные эквиваленты от субстратадонора на фермент, катализирующий восстановление субстрата-акцептора.

При аэробном окислении глюкозы функционирует дыхательная цепь, в которой донором водорода служит NADH или сукцинат:

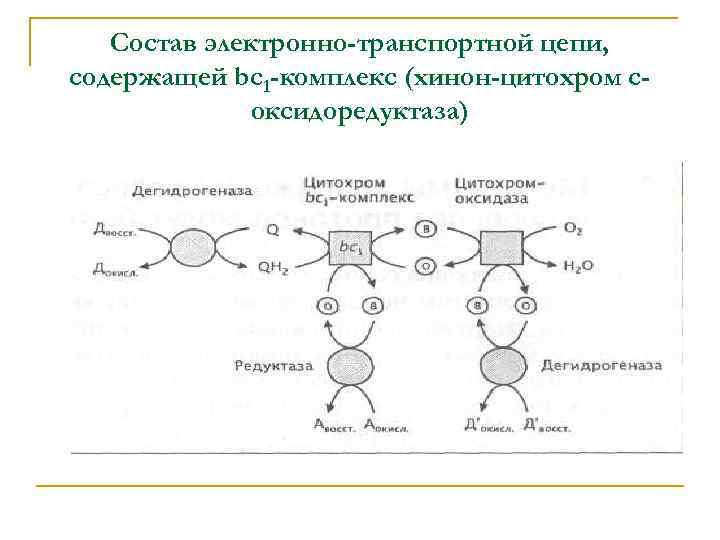
Состав электронно-транспортной цепи, содержащей bc 1 -комплекс (хинон-цитохром соксидоредуктаза)
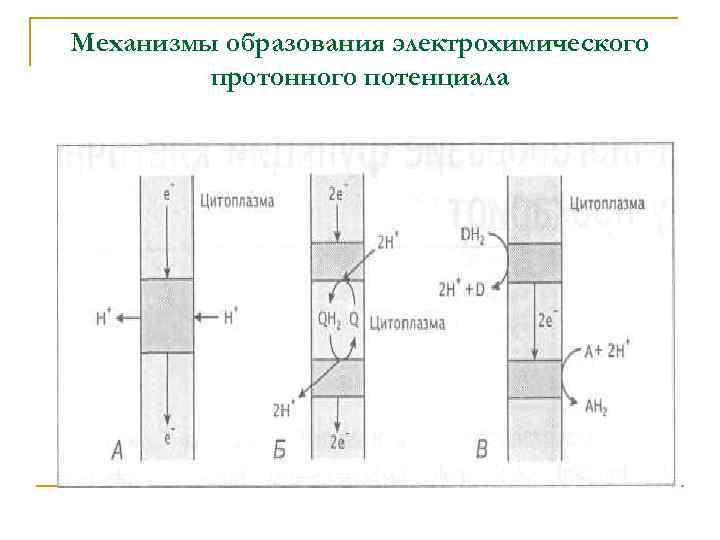
Механизмы образования электрохимического протонного потенциала




Группы первично анаэробных хемогетеротрофов не имеют развитой системы связанного с мембранами электронного транспорта. Полностью сформированной системой дыхательного электронного транспорта обладают фотосинтезирующие эубактерии: цианобактерии, многие пурпурные бактерии (в наибольшей степени дыхание развито у несерных пурпурных бактерий). Все облигатно и факультативно аэробные хемотрофы имеют дыхательные цепи.

У разных групп эубактерий дыхательные цепи значительно различаются по составу: - происходит замена одних переносчиков другими со сходными свойствами (убихинон — менахинон, цитохромы aa 3 — o и т. д. ); - добавление или удалении какого-либо переносчика (например, цитохрома c); - разветвление на уровне первичных дегидрогеназ, (это результат множества мест включения восстановительных эквивалентов с окисляемых субстратов в цепь), - ветвление, связанное с присутствием 2 или более цитохромоксидаз
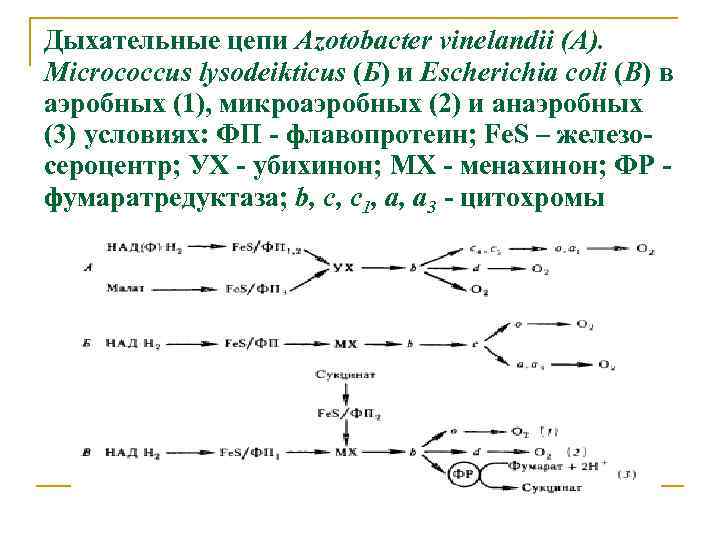
Дыхательные цепи Azotobacter vinelandii (A). Micrococcus lysodeikticus (Б) и Escherichia coli (В) в аэробных (1), микроаэробных (2) и анаэробных (3) условиях: ФП - флавопротеин; Fe. S – железосероцентр; УХ - убихинон; MX - менахинон; ФР фумаратредуктаза; b, c, c 1, a, a 3 - цитохромы


Все эубактерий, имеющие развитую систему электронного транспорта, сопряженного с генерированием энергии, можно разделить на две большие группы в зависимости от источника энергии (природы донора электронов). К первой группе относятся организмы, использующие в качестве источника энергии процессы окисления неорганических соединений. Вторую группу составляют организмы, у которых донорами электронов служат различные органические соединения.

Вместо O 2 некоторые эубактерии могут в качестве конечного акцептора электронов использовать ряд окисленных органических или неорганических соединений. Этот процесс получил название анаэробного дыхания. Анаэробные дыхательные цепи содержат те же типы переносчиков, что и аэробные, но цитохромоксидазы заменены соответствующими редуктазами.

Типы анаэробного дыхания у эубактерий Энергетический процесс Конечный акцептор электронов Продукты восстановления Нитратное дыхание и денитрификация NO 3–, NO 2–, NO, N 2 Сульфатное и серное дыхание SO 42–, S 0 H 2 S Карбонатное дыхание CO 2 ацетат Фумаратное дыхание фумарат сукцинат
тема_15 лекция_15 Цикл Кребса и ЭТЦ бактерий.ppt