 Тема 11 Генна інженерія 1. 2. 3. 4. 5. 6. 7. 8. План Генна інженерія Трансформація й генна інженерія Одержання генів Клонування генів. Вектори Трансформація еукаріот Генна інженерія рослин Структура і функції гена Аналіз тонкої структури гена
Тема 11 Генна інженерія 1. 2. 3. 4. 5. 6. 7. 8. План Генна інженерія Трансформація й генна інженерія Одержання генів Клонування генів. Вектори Трансформація еукаріот Генна інженерія рослин Структура і функції гена Аналіз тонкої структури гена
 Генна інженерія Поняття "генетична" та "генна" інженерія часто вживаються як синоніми, хоч перше з них є більш широким і передбачає способи маніпуляцій не тільки з окремими генами чи молекулами ДНК, але й з більш складними структурами, включаючи цілі хромосоми. Генетична інженерія не передбачає перебудови геномів звичайними генетичними методами, такими як штучний мутагенез та гібридизація. До сфери генетичної інженерії С. М. Гершензон відніс такі операції: 1. 2. 3. 4. 5. 6. синтез генів поза організмом; виділення із клітин окремих генів або генетичних структур (фрагментів хромосом, цілих хромосом або навіть клітинних ядер); спрямовану перебудову виділених структур; копіювання і розмноження виділених або синтезованих генів та інших генетичних структур; перенос і включення таких генів або генетичних структур у певний геном, що підлягає перебудові; експериментальне поєднання різних геномів в одній клітині. Методи генної інженерії дозволяють отримувати рекомбінантні ДНК із фрагментів геномів різних організмів, клонувати такі штуч ностворені молекули, вводити їх у клітину з допомогою векторів (плазмід, вірусних ДНК) або іншим способом, і створювати умови для експресії в клітині цих введених зовні, часто зовсім чужорідних генів.
Генна інженерія Поняття "генетична" та "генна" інженерія часто вживаються як синоніми, хоч перше з них є більш широким і передбачає способи маніпуляцій не тільки з окремими генами чи молекулами ДНК, але й з більш складними структурами, включаючи цілі хромосоми. Генетична інженерія не передбачає перебудови геномів звичайними генетичними методами, такими як штучний мутагенез та гібридизація. До сфери генетичної інженерії С. М. Гершензон відніс такі операції: 1. 2. 3. 4. 5. 6. синтез генів поза організмом; виділення із клітин окремих генів або генетичних структур (фрагментів хромосом, цілих хромосом або навіть клітинних ядер); спрямовану перебудову виділених структур; копіювання і розмноження виділених або синтезованих генів та інших генетичних структур; перенос і включення таких генів або генетичних структур у певний геном, що підлягає перебудові; експериментальне поєднання різних геномів в одній клітині. Методи генної інженерії дозволяють отримувати рекомбінантні ДНК із фрагментів геномів різних організмів, клонувати такі штуч ностворені молекули, вводити їх у клітину з допомогою векторів (плазмід, вірусних ДНК) або іншим способом, і створювати умови для експресії в клітині цих введених зовні, часто зовсім чужорідних генів.
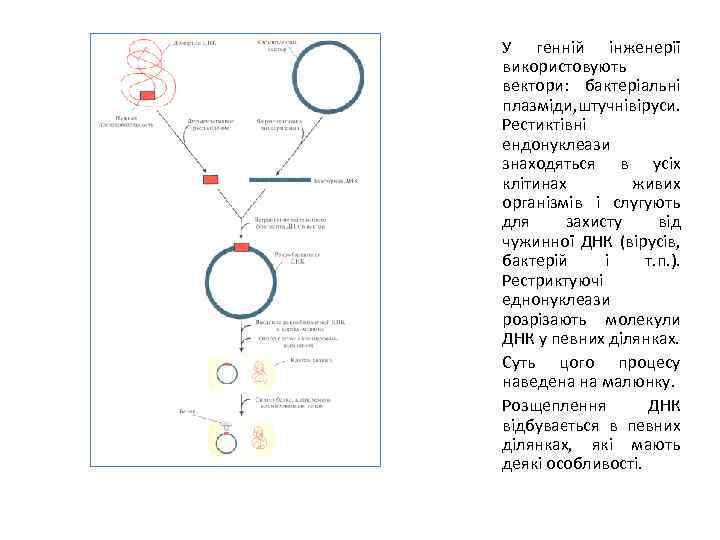 У генній інженерії використовують вектори: бактеріальні плазміди, штучнівіруси. Рестиктівні ендонуклеази знаходяться в усіх клітинах живих організмів і слугують для захисту від чужинної ДНК (вірусів, бактерій і т. п. ). Рестриктуючі еднонуклеази розрізають молекули ДНК у певних ділянках. Суть цого процесу наведена на малюнку. Розщеплення ДНК відбувається в певних ділянках, які мають деякі особливості.
У генній інженерії використовують вектори: бактеріальні плазміди, штучнівіруси. Рестиктівні ендонуклеази знаходяться в усіх клітинах живих організмів і слугують для захисту від чужинної ДНК (вірусів, бактерій і т. п. ). Рестриктуючі еднонуклеази розрізають молекули ДНК у певних ділянках. Суть цого процесу наведена на малюнку. Розщеплення ДНК відбувається в певних ділянках, які мають деякі особливості.
 Ферменти рестрикції Важливим класом ферментів, використовуваних у методі рекомбінантних ДНК, є ендонуклеази рестрикції. Ці ферменти були виділені з різних бактерій і названі так, тому що їхня функціональна роль руйнування чужорідної вірусної ДНК і, отже, обмеження (рестрикція) розвитку вірусної інфекції в бактерій. Ферменти рестрикції довідаються специфічні послідовності ДНК (сайти рестрикції) і розщеплюють у цьому місці обидві ланцюги молекули ДНК. В 1978 р. Вернер Арбер, Гамільтон Сміт і Даніел Натане одержали Нобелівську премію за роботу, пов'язану із цими ферментами. На сьогоднішній день відомо більш ніж 200 ендонуклеаз рестрикції. У методі клонування використовують здатність ендонуклеаз оборотно розрізати молекулу ДНК, утворюючі специфічні фрагменти.
Ферменти рестрикції Важливим класом ферментів, використовуваних у методі рекомбінантних ДНК, є ендонуклеази рестрикції. Ці ферменти були виділені з різних бактерій і названі так, тому що їхня функціональна роль руйнування чужорідної вірусної ДНК і, отже, обмеження (рестрикція) розвитку вірусної інфекції в бактерій. Ферменти рестрикції довідаються специфічні послідовності ДНК (сайти рестрикції) і розщеплюють у цьому місці обидві ланцюги молекули ДНК. В 1978 р. Вернер Арбер, Гамільтон Сміт і Даніел Натане одержали Нобелівську премію за роботу, пов'язану із цими ферментами. На сьогоднішній день відомо більш ніж 200 ендонуклеаз рестрикції. У методі клонування використовують здатність ендонуклеаз оборотно розрізати молекулу ДНК, утворюючі специфічні фрагменти.
 Трансформація й генна інженерія Відкриття трансформації в бактерій і особливо ідентифікація ДНК як агента, що трансформує, стимулювали спроби трансформації у тварин, рослин і еукаріотичних мікроорганізмів. При цьому спроби провести трансформацію за допомогою препаратів тотальної геномної ДНК привели до суперечливих результатів. Тільки наприкінці 70 х років були отримані відтворені результати із застосуванням так званої векторної трансформації. В основі цього підходу — використання векторних молекул, або векторів, у якості яких застосовували плазміди спочатку бактеріальних, а потім еукаріотичних клітин. Вектори — це молекули ДНК, здатні переносити включені в них гени в клітину, де ці молекули реплікуються автономно або після інтеграції з геномом. Вирішальну роль у цих експериментах зіграли також методи одержання індивідуальних генів, наробіток їхніх препаративних кількостей шляхом клонування, тобто практично необмеженого розмноження в бактеріальних клітинах. У ході розробки цих процедур була створена потужна техніка генної інженерії, що включає: виділення індивідуальних фрагментів ДНК будь якого походження, їхнє стабільне відтворення в складі векторів, ідентифікація функцій клонованих у такий спосіб генів, їхня зміна й введення в клітини вихідного або іншого організму. Ця техніка, що одержала також назву техніки рекомбинантної ДНК, у з'єднанні з методами розшифровки первинної структури генів, т. е, їх нуклеотидної послідовності, зробила можливими експерименти безпосередньо на генетичному матеріалі, маніпулювання генами в наукових і практичних цілях.
Трансформація й генна інженерія Відкриття трансформації в бактерій і особливо ідентифікація ДНК як агента, що трансформує, стимулювали спроби трансформації у тварин, рослин і еукаріотичних мікроорганізмів. При цьому спроби провести трансформацію за допомогою препаратів тотальної геномної ДНК привели до суперечливих результатів. Тільки наприкінці 70 х років були отримані відтворені результати із застосуванням так званої векторної трансформації. В основі цього підходу — використання векторних молекул, або векторів, у якості яких застосовували плазміди спочатку бактеріальних, а потім еукаріотичних клітин. Вектори — це молекули ДНК, здатні переносити включені в них гени в клітину, де ці молекули реплікуються автономно або після інтеграції з геномом. Вирішальну роль у цих експериментах зіграли також методи одержання індивідуальних генів, наробіток їхніх препаративних кількостей шляхом клонування, тобто практично необмеженого розмноження в бактеріальних клітинах. У ході розробки цих процедур була створена потужна техніка генної інженерії, що включає: виділення індивідуальних фрагментів ДНК будь якого походження, їхнє стабільне відтворення в складі векторів, ідентифікація функцій клонованих у такий спосіб генів, їхня зміна й введення в клітини вихідного або іншого організму. Ця техніка, що одержала також назву техніки рекомбинантної ДНК, у з'єднанні з методами розшифровки первинної структури генів, т. е, їх нуклеотидної послідовності, зробила можливими експерименти безпосередньо на генетичному матеріалі, маніпулювання генами в наукових і практичних цілях.
 Одержання генів Головну роль на першому етапі виділення гена відводять ендонуклеазам рестрикції, або рестриктазам. Ці ферменти розріжуть ДНК поблизу або усередині певних послідовностей нуклеотидів, які однакові на обох комплементарних ланцюгах. Два розриви в однакових позиціях комплементарних ланцюгів на кінцях фрагмента утворять так звані липкі кінці, які можуть знову замикатися завдяки компліментарності основ. Послідовності, які розпізнаються рестриктазами, статистично розкидані по геному. Чим послідовність коротша, тим частіше вона зустрічається й відповідно тим коротше фрагменти ДНК, що утворяться при рестрикції. Фрагменти рестрикції, або рестрикти, можна розділити по їхній молекулярній масі й заряду за допомогою електрофорезу в гелі. У цей час із різних мікроорганізмів виділено безліч рестриктаз із неоднаковою специфічністю до нуклеотидних послідовностей ДНК. Відшукання потрібного гена серед суміші рестрикційних фрагментів складає відомі складності. Поряд із цим найпоширенішим способом отримання генів існує також спосіб хімічного синтезу генів. Методологія синтезу ДНК із заданою послідовністю нуклеотидів була розроблена Г. Кораною у 60 х роках, ще задовго до настання ери генної інженерії. Після того як була розшифрована первинна структура першої індивідуальної нуклеїновой кислоти — алані нової т. РНК дріжджів, Г. Корана зі співробітниками синтезував хімічним шляхом частину гена, що кодує, для цієї РНК розміром в 77 п. н. Надалі в 1976 р. у тій же лабораторії був синтезований ген тирозинової т. РНК Е. colі, що працював, будучи уведеним у геном бактеріофага Т 4, у клітинах кишкової палички. Методологія, розроблена Г. Кораною, широко застосовується для синтезу цілих штучних генів, наприклад генів гормону інсуліну людини, що вводяться потім у бактеріальні або дріжджові клітини продуценти. У цей час існують автомати для синтезу ДНК заданої послідовності. Ті ж підходи застосовують для синтезу так званих ДНКзондів, тобто невеликих ділянок генів (20— 30 п. н. ). Це можливо, якщо відома хоча б частина первинної структури потрібного білка. Тоді, користуючись таблицею генетичного коду, можна вивести структуру відповідної ділянки гена. Такі зонди використовують для пошуків потрібної комплементарної їм іРНК. Виділену за допомогою зонда іРНК використовують потім для синтезу так званої к. ДНК (комплементарної ДНК) за допомогою ферменту зворотної транскріптази.
Одержання генів Головну роль на першому етапі виділення гена відводять ендонуклеазам рестрикції, або рестриктазам. Ці ферменти розріжуть ДНК поблизу або усередині певних послідовностей нуклеотидів, які однакові на обох комплементарних ланцюгах. Два розриви в однакових позиціях комплементарних ланцюгів на кінцях фрагмента утворять так звані липкі кінці, які можуть знову замикатися завдяки компліментарності основ. Послідовності, які розпізнаються рестриктазами, статистично розкидані по геному. Чим послідовність коротша, тим частіше вона зустрічається й відповідно тим коротше фрагменти ДНК, що утворяться при рестрикції. Фрагменти рестрикції, або рестрикти, можна розділити по їхній молекулярній масі й заряду за допомогою електрофорезу в гелі. У цей час із різних мікроорганізмів виділено безліч рестриктаз із неоднаковою специфічністю до нуклеотидних послідовностей ДНК. Відшукання потрібного гена серед суміші рестрикційних фрагментів складає відомі складності. Поряд із цим найпоширенішим способом отримання генів існує також спосіб хімічного синтезу генів. Методологія синтезу ДНК із заданою послідовністю нуклеотидів була розроблена Г. Кораною у 60 х роках, ще задовго до настання ери генної інженерії. Після того як була розшифрована первинна структура першої індивідуальної нуклеїновой кислоти — алані нової т. РНК дріжджів, Г. Корана зі співробітниками синтезував хімічним шляхом частину гена, що кодує, для цієї РНК розміром в 77 п. н. Надалі в 1976 р. у тій же лабораторії був синтезований ген тирозинової т. РНК Е. colі, що працював, будучи уведеним у геном бактеріофага Т 4, у клітинах кишкової палички. Методологія, розроблена Г. Кораною, широко застосовується для синтезу цілих штучних генів, наприклад генів гормону інсуліну людини, що вводяться потім у бактеріальні або дріжджові клітини продуценти. У цей час існують автомати для синтезу ДНК заданої послідовності. Ті ж підходи застосовують для синтезу так званих ДНКзондів, тобто невеликих ділянок генів (20— 30 п. н. ). Це можливо, якщо відома хоча б частина первинної структури потрібного білка. Тоді, користуючись таблицею генетичного коду, можна вивести структуру відповідної ділянки гена. Такі зонди використовують для пошуків потрібної комплементарної їм іРНК. Виділену за допомогою зонда іРНК використовують потім для синтезу так званої к. ДНК (комплементарної ДНК) за допомогою ферменту зворотної транскріптази.
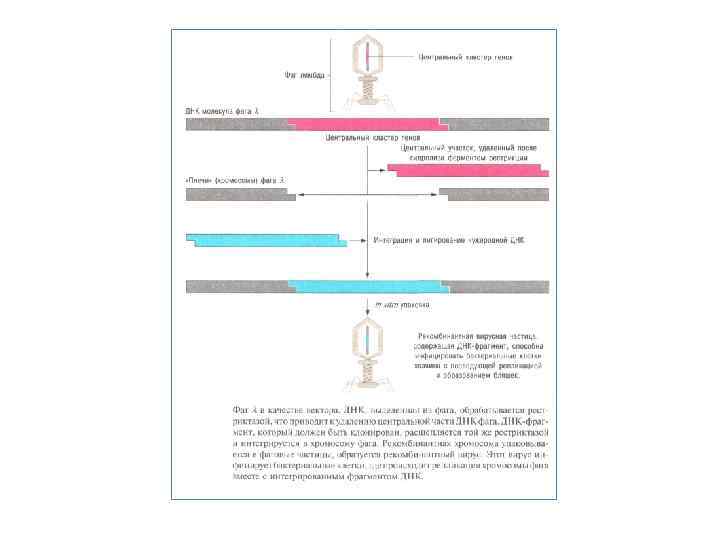
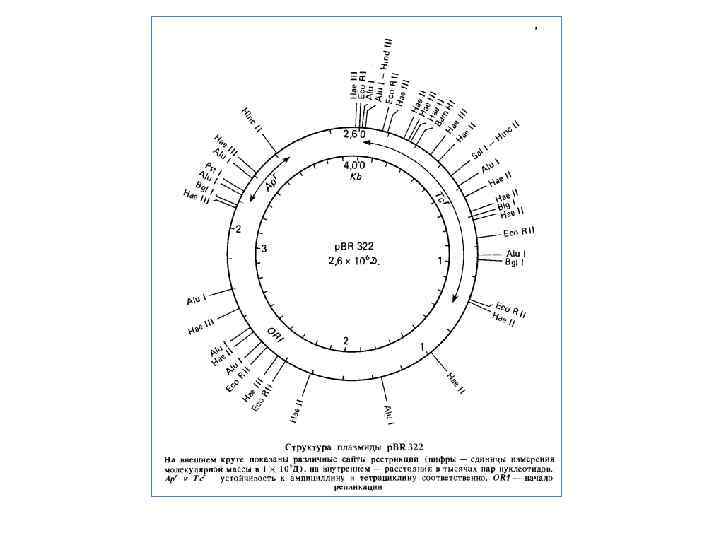
 Клонування генів. Вектори Для виділення потрібного фрагмента ДНК у препаративних кількостях його необхідно вмонтувати в плазміду — вектор, розкритий тією ж рестриктазою, що використовували для одержання рестриктів геномної ДНК. В якості векторів слугують плазміди, що несуть гени стійкості до антибіотиків. На перших етапах розвитку генної інженерії застосовували природні плазміди Е. coli, наприклад p. SI 101 або Col. El. У цей час працюють зі штучними рекомбінантними плазмідами, які несуть два або три гени стійкості, які містять по одному унікальному сайту рестрикції для який небудь рестриктази. Це плазмиди p. BR 322, 324, 325 і ін. Наприклад, широко розповсюджена плазміда p. BR 322 несе гени стійкості до ампіцилліну (Ар) і тетрацикліну (7 V). У гені Ар перебуває унікальний сайт для рестріктази Psll, а в гені Тс — для Bam. Hl. Розкриваючи вектор p. BR 322 по сайту Bam. Hl у гені 7 V, у нього можна вмонтувати фрагменти, отримані за допомогою тієї ж рестриктази за рахунок взаємодії липких кінців. Ковалентне з'єднання вектора і фрагмента, що клонується завершує полінуклеотидлігаза in vitro або in vivo. Якщо тепер трансформувати клітини компетентної культури Е. coli плазмидою p. BR 322 з убудованим у неї фрагментом, то трансформантів можна відібрати на середовищі з ампіцилліном. Далі необхідно перевірити їх по ознаці стійкості до тетрацикліну. Якщо вихідна клітина була трансформована інтактною плазмидою — без вставки фрагмента, то трансформант буде стійким до тетрацикліну так само, як і до ампіцилліну. Якщо ж трансформацію здійснила плазміда із вставкою фрагмента в ген 7 V, трансформант повинен бути чутливий до тетрацикліну, оскільки ген Тс' виявився розірваний і інактивований вставкою. Далі фрагмент ДНК, що клонується може бути необмежено розмножений у ході клітинних розподілів трансформанта. Вектори типу плазміди p. BR 322 називають векторами інактивації. Широко застосовують також вектори на основі бактеріофага λ. Відомо, що середня частина генома λ не суттєва для його літичного розмножения в Е. coli і може бути замінена на чужорідний фрагмент ДНК. Якщо розміри одержуваної при цьому ДНК не перевищують межі (не більше ніж на 10 %), припустимого для впакування в частку фага, то утворяться фаги із чужорідними фрагментами ДНК. У цьому випадку ділянку ДНК, що клонують, зберігають у вигляді часток бактеріофага або у вигляді клону бактерії з інтегрованими гібридними профагами. Існує безліч типів векторів, сконструйованих на основі різних плазмід і різних бактеріофагів. Не завжди вдається одержати фрагменти ДНК із липкими кінцями. Ці кінці можуть бути «пришиті» до фрагментів ДНК штучно, якщо ДНК отримана за допомогою рестриктази, що утворить «тупі» кінці, або в результаті гідродинамічної фрагментації. Один ланцюг таких молекул з тупими кінцями нарощують за рахунок олігодезоксі А, а іншу — за рахунок олігодезоксі Т за допомогою нуклеотиділтрансферази. Тупі кінці нарощують також за рахунок синтетичних лінкерів — послідовностей, «пізнаваних» певною рестриктазою або декількома з них. Після обробки відповідної рестриктазою кінці стають липкими й фрагмент можна вмонтувати у вектор, розкритий тією ж рестриктазою.
Клонування генів. Вектори Для виділення потрібного фрагмента ДНК у препаративних кількостях його необхідно вмонтувати в плазміду — вектор, розкритий тією ж рестриктазою, що використовували для одержання рестриктів геномної ДНК. В якості векторів слугують плазміди, що несуть гени стійкості до антибіотиків. На перших етапах розвитку генної інженерії застосовували природні плазміди Е. coli, наприклад p. SI 101 або Col. El. У цей час працюють зі штучними рекомбінантними плазмідами, які несуть два або три гени стійкості, які містять по одному унікальному сайту рестрикції для який небудь рестриктази. Це плазмиди p. BR 322, 324, 325 і ін. Наприклад, широко розповсюджена плазміда p. BR 322 несе гени стійкості до ампіцилліну (Ар) і тетрацикліну (7 V). У гені Ар перебуває унікальний сайт для рестріктази Psll, а в гені Тс — для Bam. Hl. Розкриваючи вектор p. BR 322 по сайту Bam. Hl у гені 7 V, у нього можна вмонтувати фрагменти, отримані за допомогою тієї ж рестриктази за рахунок взаємодії липких кінців. Ковалентне з'єднання вектора і фрагмента, що клонується завершує полінуклеотидлігаза in vitro або in vivo. Якщо тепер трансформувати клітини компетентної культури Е. coli плазмидою p. BR 322 з убудованим у неї фрагментом, то трансформантів можна відібрати на середовищі з ампіцилліном. Далі необхідно перевірити їх по ознаці стійкості до тетрацикліну. Якщо вихідна клітина була трансформована інтактною плазмидою — без вставки фрагмента, то трансформант буде стійким до тетрацикліну так само, як і до ампіцилліну. Якщо ж трансформацію здійснила плазміда із вставкою фрагмента в ген 7 V, трансформант повинен бути чутливий до тетрацикліну, оскільки ген Тс' виявився розірваний і інактивований вставкою. Далі фрагмент ДНК, що клонується може бути необмежено розмножений у ході клітинних розподілів трансформанта. Вектори типу плазміди p. BR 322 називають векторами інактивації. Широко застосовують також вектори на основі бактеріофага λ. Відомо, що середня частина генома λ не суттєва для його літичного розмножения в Е. coli і може бути замінена на чужорідний фрагмент ДНК. Якщо розміри одержуваної при цьому ДНК не перевищують межі (не більше ніж на 10 %), припустимого для впакування в частку фага, то утворяться фаги із чужорідними фрагментами ДНК. У цьому випадку ділянку ДНК, що клонують, зберігають у вигляді часток бактеріофага або у вигляді клону бактерії з інтегрованими гібридними профагами. Існує безліч типів векторів, сконструйованих на основі різних плазмід і різних бактеріофагів. Не завжди вдається одержати фрагменти ДНК із липкими кінцями. Ці кінці можуть бути «пришиті» до фрагментів ДНК штучно, якщо ДНК отримана за допомогою рестриктази, що утворить «тупі» кінці, або в результаті гідродинамічної фрагментації. Один ланцюг таких молекул з тупими кінцями нарощують за рахунок олігодезоксі А, а іншу — за рахунок олігодезоксі Т за допомогою нуклеотиділтрансферази. Тупі кінці нарощують також за рахунок синтетичних лінкерів — послідовностей, «пізнаваних» певною рестриктазою або декількома з них. Після обробки відповідної рестриктазою кінці стають липкими й фрагмент можна вмонтувати у вектор, розкритий тією ж рестриктазою.
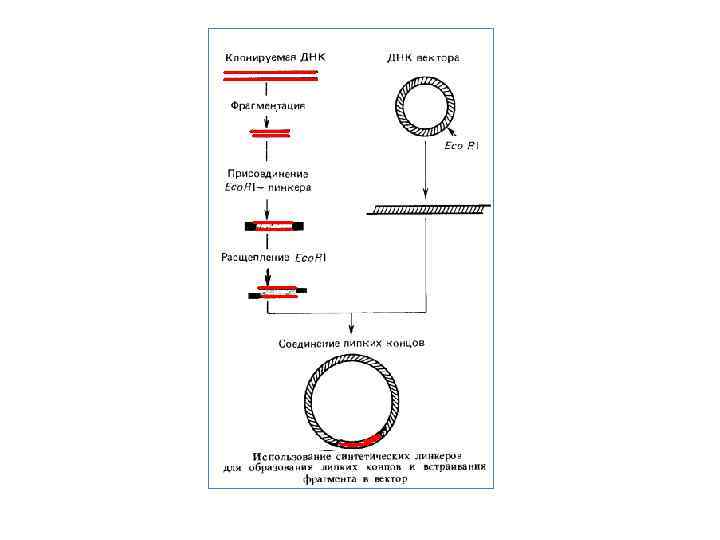
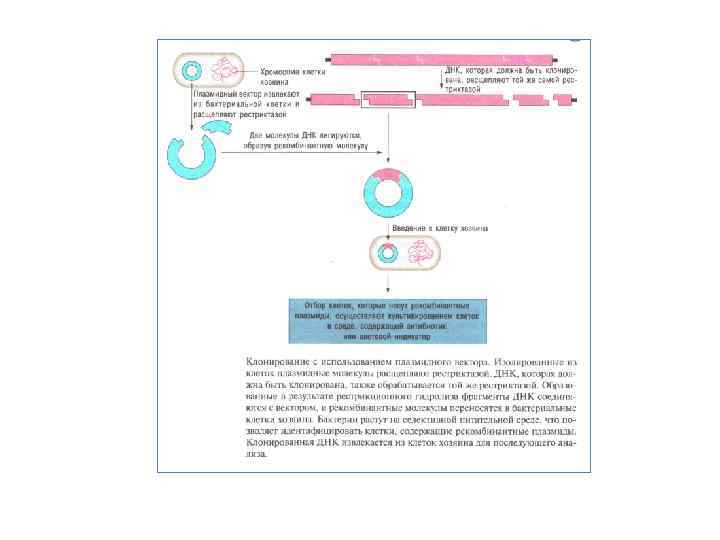
 Банки генів Розповідаючи про клонування фрагмента ДНК, малося на увазі, що є доступний шуканий ген або відомий молекулярна маса фрагмента, якомий можна витягти з електрофореграми рестриктів ДНК. У дійсності для одержання потрібного гена найчастіше необхідні пошуки, і часом досить складні. Для цього геномну ДНК, розрізану обраної рестриктазою, змішують із ДНК вектора, розкритого тією ж рестриктазою по унікальному сайту. У результаті взаємодії липких кінців і наступного лигування одержують суміш рекомбінантних ДНК. Після цього отримані плазміди із вставками різних ділянок ДНК необхідно розклонувати. Для цієї мети описаним способом проводять трансформацію Е. coli. Оскільки трансформацію здійснюють сумішшю плазмід з різними вставками, то різні клітини в результаті трансформації одержують різні фрагменти ДНК, що клонується. Отже, на цьому етапі потрібно зібрати якнайбільше клонів трансформантів, щоб бути впевненим у тому, що шуканий ген перебуває в одному із клонів. Так створюють банки генів, що часом складаються з десятків і сотень тисяч клонів трансформантів. Розміри банку, необхідні для повного клонування того або іншого геному, можна визначити, знаючи молекулярну масу генома (М), середній розмір фрагмента, що клонується (т) і задаючи певну ймовірність (Р) того, що клоновано весь геном. Тоді обсяг банку, тобто число клонів ( N), дорівнюватиме: Тепер можна приступати до пошуків гена, що цікавить. Якщо проклонований геном Е. coliy то процедура зводиться до «накопичення» клонованих фрагментів ДНК і перевірці їхньої здатності трансформувати відповідні мутанти Е. coli. При цьому необхідно мати досить стабільний реципієнт для трансформації, тобто частота його ревертування по заданому гену повинна бути значно нижче частоти трансформації. Крім того, використовувана в роботі рестриктаза могла інактивувати шуканий ген, якщо в ньому був відповідний сайт рестрикції. Тому може знадобитися повторення всієї процедури з іншою рестриктазою. На практиці застосовується неповне переварювання геномной ДНК однієї або сумішшю двох рестриктаз.
Банки генів Розповідаючи про клонування фрагмента ДНК, малося на увазі, що є доступний шуканий ген або відомий молекулярна маса фрагмента, якомий можна витягти з електрофореграми рестриктів ДНК. У дійсності для одержання потрібного гена найчастіше необхідні пошуки, і часом досить складні. Для цього геномну ДНК, розрізану обраної рестриктазою, змішують із ДНК вектора, розкритого тією ж рестриктазою по унікальному сайту. У результаті взаємодії липких кінців і наступного лигування одержують суміш рекомбінантних ДНК. Після цього отримані плазміди із вставками різних ділянок ДНК необхідно розклонувати. Для цієї мети описаним способом проводять трансформацію Е. coli. Оскільки трансформацію здійснюють сумішшю плазмід з різними вставками, то різні клітини в результаті трансформації одержують різні фрагменти ДНК, що клонується. Отже, на цьому етапі потрібно зібрати якнайбільше клонів трансформантів, щоб бути впевненим у тому, що шуканий ген перебуває в одному із клонів. Так створюють банки генів, що часом складаються з десятків і сотень тисяч клонів трансформантів. Розміри банку, необхідні для повного клонування того або іншого геному, можна визначити, знаючи молекулярну масу генома (М), середній розмір фрагмента, що клонується (т) і задаючи певну ймовірність (Р) того, що клоновано весь геном. Тоді обсяг банку, тобто число клонів ( N), дорівнюватиме: Тепер можна приступати до пошуків гена, що цікавить. Якщо проклонований геном Е. coliy то процедура зводиться до «накопичення» клонованих фрагментів ДНК і перевірці їхньої здатності трансформувати відповідні мутанти Е. coli. При цьому необхідно мати досить стабільний реципієнт для трансформації, тобто частота його ревертування по заданому гену повинна бути значно нижче частоти трансформації. Крім того, використовувана в роботі рестриктаза могла інактивувати шуканий ген, якщо в ньому був відповідний сайт рестрикції. Тому може знадобитися повторення всієї процедури з іншою рестриктазою. На практиці застосовується неповне переварювання геномной ДНК однієї або сумішшю двох рестриктаз.
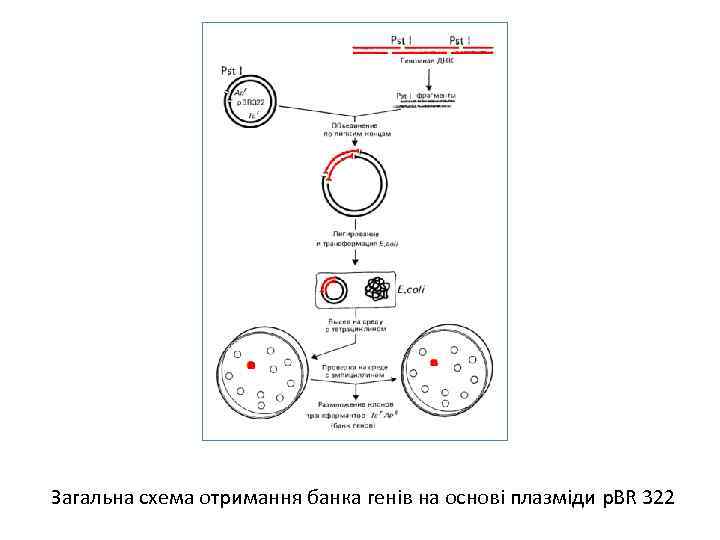 Загальна схема отримання банка генів на основі плазміди p. BR 322
Загальна схема отримання банка генів на основі плазміди p. BR 322
 Трансформація еукаріот Значно складніше відшукати який небудь ген у банку генів D. melanogaster. Для цього найкраще точно знати, що являє собою генний продукт. Якщо це фермент, то варто з'ясувати, яку реакцію він контролює. Якщо ген експресується в клітинах Е. coli, що малоймовірно, то можна вважати, що експериментаторові пощастило. У цьому випадку шуканий ген ідентифікують по здатності компенсувати відповідний дефект метаболізму в мутанта Е. coli. Оскільки гени еукаріот звичайно не експресується в клітинах прокаріот, прибігають до інших методів. Використовують імунохімічні методи, зокрема моноклональні антитіла, якщо білок (генний продукт) доступний і їм можна імунізувати тварин. Для ідентифікації несучіх ген клонів по гібридизації ДНК — РНК використовують також мічену радіоактивними ізотопами іРНК. При пошуках певного фрагмента в банку генів найкраще ідентифікувати його по здатності трансформувати відповідні мутанти того організму, геном якого був клонований. При трансформації еукаріот за допомогою ДНК бактеріальних плазмід необхідно враховувати, що реплікатори бактерій і їх плазмиди не працюють у клітинах еукаріот. Внаслідок цього така трансформація малоефективна. Для того щоб виник стабільний трансформант, необхідні дві послідовних події: проникнення ДНК у клітину і її рекомбінацію із хромосомною ДНК, тобто інтеграція. Таку інтегративну трансформацію легше провести в еукаріотичних мікроорганізмів, для яких доступні методи селективних середовищ, чим у багатоклітинних еукаріот. Саме так були проведені перші експерименти по трансформації дріжджів Sacch. cerevisiae. Для цього дріжджовий ген LEU 2, що кодує β ізопропілмалатдегідрогеназу, був вставлений у бактеріальну плазміду Col. E 1 і проклонований в E. coli. Цей ген Sacch. cerevisiae експресується в Е. coli, компенсуючи аналогічний метаболічний дефект бактерії. Сферопласти дріжджів (клітини, позбавлені оболонки) трансформували плазмидною ДНК. Реципієнтом служив штам, що несе стабільну мутацію Leu 2. Частота трансформації становила 1*10 6 на сферопласт, що регенерується , тобто на число клітин, які знову відновили свою оболонку. Підвищити ефективність трансформації на два порядки вдалося з використанням так званої човникової або гібридної плазміди, що має два реплікаториа: один — від Col. El (бактеріальний), а іншої — від дріжджовий плазміди розміром 2 мкм. Надалі в таких човникових векторах використовували репликаторы ДНК довжиною 3 мкм і ARS — послідовності, що забезпечують реплікацію хромосом. Такі вектори можуть реплікуватися як в Е. coli, так і в Sacch. cerevisiae. Підвищення ефективності трансформації такими епісомними векторами супроводжувалося високим рівнем нестабільності трансформантів. При клонуванні трансформантів у неселективних умовах 70— 80 % клітин втрачали плазміду й, відповідно, знову ставали ауксотрофними по лейцину. Перебуваючи в клітині, такі епісомні вектори можуть інтегрувати із хромосомною ДНК. Генно інженерне конструювання в дріжджів пішло по шляху створення кільцевих плазмід із центромерами, а потім штучних міні хромосом, що мають центромеру, теломери й реплікатори. Таким чином, трансформація еукаріот полегшується створенням векторів з реплікаторами, специфічними для об'єкта, що трансформується.
Трансформація еукаріот Значно складніше відшукати який небудь ген у банку генів D. melanogaster. Для цього найкраще точно знати, що являє собою генний продукт. Якщо це фермент, то варто з'ясувати, яку реакцію він контролює. Якщо ген експресується в клітинах Е. coli, що малоймовірно, то можна вважати, що експериментаторові пощастило. У цьому випадку шуканий ген ідентифікують по здатності компенсувати відповідний дефект метаболізму в мутанта Е. coli. Оскільки гени еукаріот звичайно не експресується в клітинах прокаріот, прибігають до інших методів. Використовують імунохімічні методи, зокрема моноклональні антитіла, якщо білок (генний продукт) доступний і їм можна імунізувати тварин. Для ідентифікації несучіх ген клонів по гібридизації ДНК — РНК використовують також мічену радіоактивними ізотопами іРНК. При пошуках певного фрагмента в банку генів найкраще ідентифікувати його по здатності трансформувати відповідні мутанти того організму, геном якого був клонований. При трансформації еукаріот за допомогою ДНК бактеріальних плазмід необхідно враховувати, що реплікатори бактерій і їх плазмиди не працюють у клітинах еукаріот. Внаслідок цього така трансформація малоефективна. Для того щоб виник стабільний трансформант, необхідні дві послідовних події: проникнення ДНК у клітину і її рекомбінацію із хромосомною ДНК, тобто інтеграція. Таку інтегративну трансформацію легше провести в еукаріотичних мікроорганізмів, для яких доступні методи селективних середовищ, чим у багатоклітинних еукаріот. Саме так були проведені перші експерименти по трансформації дріжджів Sacch. cerevisiae. Для цього дріжджовий ген LEU 2, що кодує β ізопропілмалатдегідрогеназу, був вставлений у бактеріальну плазміду Col. E 1 і проклонований в E. coli. Цей ген Sacch. cerevisiae експресується в Е. coli, компенсуючи аналогічний метаболічний дефект бактерії. Сферопласти дріжджів (клітини, позбавлені оболонки) трансформували плазмидною ДНК. Реципієнтом служив штам, що несе стабільну мутацію Leu 2. Частота трансформації становила 1*10 6 на сферопласт, що регенерується , тобто на число клітин, які знову відновили свою оболонку. Підвищити ефективність трансформації на два порядки вдалося з використанням так званої човникової або гібридної плазміди, що має два реплікаториа: один — від Col. El (бактеріальний), а іншої — від дріжджовий плазміди розміром 2 мкм. Надалі в таких човникових векторах використовували репликаторы ДНК довжиною 3 мкм і ARS — послідовності, що забезпечують реплікацію хромосом. Такі вектори можуть реплікуватися як в Е. coli, так і в Sacch. cerevisiae. Підвищення ефективності трансформації такими епісомними векторами супроводжувалося високим рівнем нестабільності трансформантів. При клонуванні трансформантів у неселективних умовах 70— 80 % клітин втрачали плазміду й, відповідно, знову ставали ауксотрофними по лейцину. Перебуваючи в клітині, такі епісомні вектори можуть інтегрувати із хромосомною ДНК. Генно інженерне конструювання в дріжджів пішло по шляху створення кільцевих плазмід із центромерами, а потім штучних міні хромосом, що мають центромеру, теломери й реплікатори. Таким чином, трансформація еукаріот полегшується створенням векторів з реплікаторами, специфічними для об'єкта, що трансформується.
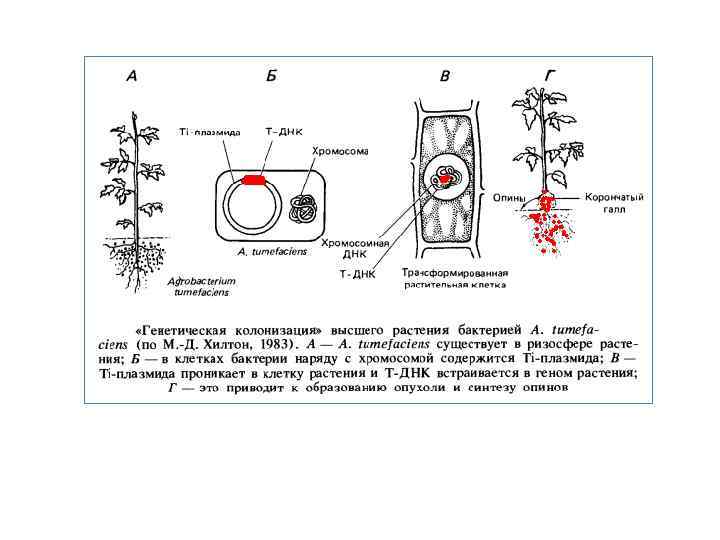
 Генна інженерія в природі й вектори для клонування генів рослин Пухлинне захворювання рослин, відоме як корончатий гал, описав ще Аристотель. На початку нашого століття Е. Смит і К. Таундсен (1907) показали, що викликає це захворювання ґрунтова бактерія. Виділена у вигляді чистої культури Agrobacterium tumefaciens здатна приводити до утворення пухлин у деяких представників голосім’яних і більшості двочасткових покритосім’яних рослин. Клітини рослинних пухлин інтенсивно ростуть на штучних середовищах і при цьому не мають потреби в додаванні фітогормонів на відміну від клітин нормальних тканин. В 70 х роках з'ясувалося, що причиною утворення пухлин є так звані Ti плазмиди, виявлені в клітинах деяких штамів A. tumefaciens. Ti плазмиды — це кільцеві молекули ДНК розміром 50— 80 мкм із молекулярною масою близько 1, 3* 108 Д довжиною до 200 тис. п. н. Ці плазміди проникають із бактерій у клітини рослини, і частина ДНК Ti плазмиди, так звана Т ДНК, ковалентно вбудовується в хромосоми рослини, яка інфікується. Будучи інтегрована із хромосомою, Т ДНК викликає утворення пухлини, гіперпродукцію фітогормонів: цитокинінів і індолілуксусної кислоти (ауксину) а також синтез ряду похідних амінокислот, поєднаних загальним терміном опіни. Пухлина виникає внаслідок порушення балансу фітогормонів, від якого залежить нормальний морфогенез рослини. Опіни, які виділються клітинами пухлини, бактерія використовує як джерела вуглецю й азоту, причому тільки в тому випадку, коли A. tumefaciens містить Ti плазмиду, що заразила клітини рослини. Ti плазмида ставиться до класу кон’югативних плазмід, тобто може передаватися в клітини A. tumefaciens, позбавлені її. Цей процес ефективно відбувається в зараженій рослині й стимулюється опінами. Описані тут взаємини A. tumefaciens і вищої рослини Дж. Шелл назвав генетичною колонізацією, що являє собою експеримент по генній інженерії, поставлений самою природою. Таким чином, Ti плазмида — це природний вектор для трансформації клітин вищих рослин. Як показав Дж. Шелл, якщо із клітин корінців тютюну з інтегрованої Т ДНК одержати культуру (калус) рослинної тканини, а потім цілі рослини регенеранти, то при наступному генетичному аналізі ознака «присутність Т ДНК» виявляє менделівське розщеплення.
Генна інженерія в природі й вектори для клонування генів рослин Пухлинне захворювання рослин, відоме як корончатий гал, описав ще Аристотель. На початку нашого століття Е. Смит і К. Таундсен (1907) показали, що викликає це захворювання ґрунтова бактерія. Виділена у вигляді чистої культури Agrobacterium tumefaciens здатна приводити до утворення пухлин у деяких представників голосім’яних і більшості двочасткових покритосім’яних рослин. Клітини рослинних пухлин інтенсивно ростуть на штучних середовищах і при цьому не мають потреби в додаванні фітогормонів на відміну від клітин нормальних тканин. В 70 х роках з'ясувалося, що причиною утворення пухлин є так звані Ti плазмиди, виявлені в клітинах деяких штамів A. tumefaciens. Ti плазмиды — це кільцеві молекули ДНК розміром 50— 80 мкм із молекулярною масою близько 1, 3* 108 Д довжиною до 200 тис. п. н. Ці плазміди проникають із бактерій у клітини рослини, і частина ДНК Ti плазмиди, так звана Т ДНК, ковалентно вбудовується в хромосоми рослини, яка інфікується. Будучи інтегрована із хромосомою, Т ДНК викликає утворення пухлини, гіперпродукцію фітогормонів: цитокинінів і індолілуксусної кислоти (ауксину) а також синтез ряду похідних амінокислот, поєднаних загальним терміном опіни. Пухлина виникає внаслідок порушення балансу фітогормонів, від якого залежить нормальний морфогенез рослини. Опіни, які виділються клітинами пухлини, бактерія використовує як джерела вуглецю й азоту, причому тільки в тому випадку, коли A. tumefaciens містить Ti плазмиду, що заразила клітини рослини. Ti плазмида ставиться до класу кон’югативних плазмід, тобто може передаватися в клітини A. tumefaciens, позбавлені її. Цей процес ефективно відбувається в зараженій рослині й стимулюється опінами. Описані тут взаємини A. tumefaciens і вищої рослини Дж. Шелл назвав генетичною колонізацією, що являє собою експеримент по генній інженерії, поставлений самою природою. Таким чином, Ti плазмида — це природний вектор для трансформації клітин вищих рослин. Як показав Дж. Шелл, якщо із клітин корінців тютюну з інтегрованої Т ДНК одержати культуру (калус) рослинної тканини, а потім цілі рослини регенеранти, то при наступному генетичному аналізі ознака «присутність Т ДНК» виявляє менделівське розщеплення.
 У цей час виділені й клоновані кілька десятків генів вищих рослин, у тому числі гени, що контролюють запасні білки: сої, ячменя, гороху, кукурудзи, а також деякі гени, що контролюють активність ферментів: алкогольдегідрогенази й каталази кукурудзи, α амілази ячменя; деякі гени хлоропласта пшениці, шпинату й ін. У клітини соняшника за допомогою Ti плазмиды був переданий ген фазеолина бобів. Фазеолин — це гликопротеин, що складає до 50% запасного білка бобів. Майбутня рослина, отримана спочатку у вигляді калусної маси, одержала найменування санбин (від об'єднання англ. назви соняшника — sunflower і бобів — bean). Той же ген фазеоліну введений у тютюн і отримані рослини регенеранти, що синтезують менш 1 % фазеоліну від загального білка рослини. Отримано рослини тютюну, які світяться в темряві завдяки експресії в них гена люцеферези світлячка.
У цей час виділені й клоновані кілька десятків генів вищих рослин, у тому числі гени, що контролюють запасні білки: сої, ячменя, гороху, кукурудзи, а також деякі гени, що контролюють активність ферментів: алкогольдегідрогенази й каталази кукурудзи, α амілази ячменя; деякі гени хлоропласта пшениці, шпинату й ін. У клітини соняшника за допомогою Ti плазмиды був переданий ген фазеолина бобів. Фазеолин — це гликопротеин, що складає до 50% запасного білка бобів. Майбутня рослина, отримана спочатку у вигляді калусної маси, одержала найменування санбин (від об'єднання англ. назви соняшника — sunflower і бобів — bean). Той же ген фазеоліну введений у тютюн і отримані рослини регенеранти, що синтезують менш 1 % фазеоліну від загального білка рослини. Отримано рослини тютюну, які світяться в темряві завдяки експресії в них гена люцеферези світлячка.
 Методи гібридизації соматичних клітин, або парасексуальну гібридизацію, усе ширше застосовують і в генетиці рослин. У цьому випадку зливають не соматичні клітини безпосередньо, а їхні протопласти, попередньо позбавлені оболонок, які Видаляють ферментативним шляхом. При цьому способі гібридизації також вдається переборювати не тільки міжвидові, але й межродові бар'єри несхрещуваності. Завдяки можливості одержання недиференційованої маси зростаючих клітин калусу і наступного його диференціювання одержують цілі гібридні рослини. Однак при цьому, як показав Ю. Ю. Гліба, віддалені гібриди не завжди здатні до нормального морфогенезу й часто виявляються стерильними. Успіх такого експерименту тим менш імовірний, чим далі в таксономічному відношенні відстоять друг від друга формы, що схрещуються. Соматична гібридизація відкриває більші перспективи для одержання нового вихідного матеріалу для селекції. У лабораторії Р. Г. Бутенко створені соматичні гібриди культурної й дикої картоплі (Solatium tuberosum * S. chacoense). Для декоративного квітництва становлять інтерес соматичні гібриди Дж. Пауэра між видами Petunia parodii і P. parviflora, які статевим шляхом не схрещуються. Цей прийом дозволив увести в селекцію ознака «розгалужений, сланкий пагін» від P. parviflora. X. Шенк одержав соматичний гібрид між капустою (Brassica oleracea) і турнепсом (В. campestris).
Методи гібридизації соматичних клітин, або парасексуальну гібридизацію, усе ширше застосовують і в генетиці рослин. У цьому випадку зливають не соматичні клітини безпосередньо, а їхні протопласти, попередньо позбавлені оболонок, які Видаляють ферментативним шляхом. При цьому способі гібридизації також вдається переборювати не тільки міжвидові, але й межродові бар'єри несхрещуваності. Завдяки можливості одержання недиференційованої маси зростаючих клітин калусу і наступного його диференціювання одержують цілі гібридні рослини. Однак при цьому, як показав Ю. Ю. Гліба, віддалені гібриди не завжди здатні до нормального морфогенезу й часто виявляються стерильними. Успіх такого експерименту тим менш імовірний, чим далі в таксономічному відношенні відстоять друг від друга формы, що схрещуються. Соматична гібридизація відкриває більші перспективи для одержання нового вихідного матеріалу для селекції. У лабораторії Р. Г. Бутенко створені соматичні гібриди культурної й дикої картоплі (Solatium tuberosum * S. chacoense). Для декоративного квітництва становлять інтерес соматичні гібриди Дж. Пауэра між видами Petunia parodii і P. parviflora, які статевим шляхом не схрещуються. Цей прийом дозволив увести в селекцію ознака «розгалужений, сланкий пагін» від P. parviflora. X. Шенк одержав соматичний гібрид між капустою (Brassica oleracea) і турнепсом (В. campestris).
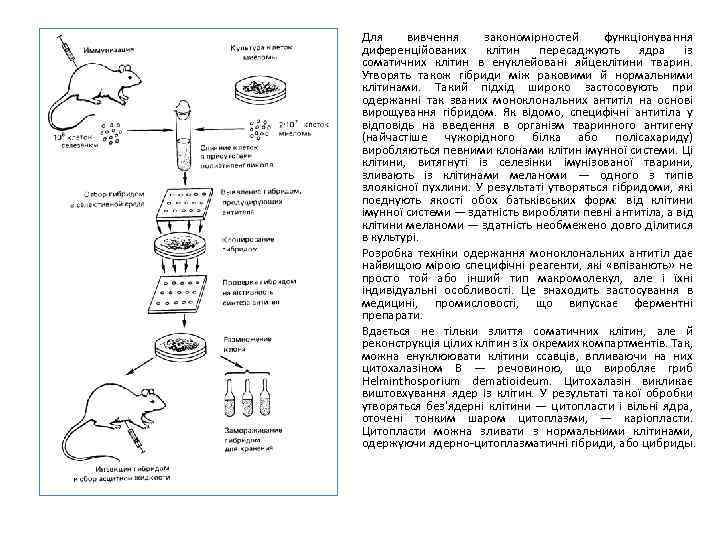 Для вивчення закономірностей функціонування диференційованих клітин пересаджують ядра із соматичних клітин в енуклейовані яйцеклітини тварин. Утворять також гібриди між раковими й нормальними клітинами. Такий підхід широко застосовують при одержанні так званих моноклональних антитіл на основі вирощування гібридом. Як відомо, специфічні антитіла у відповідь на введення в організм тваринного антигену (найчастіше чужорідного білка або полісахариду) виробляються певними клонами клітин імунної системи. Ці клітини, витягнуті із селезінки імунізованої тварини, зливають із клітинами меланоми — одного з типів злоякісної пухлини. У результаті утворяться гібридоми, які поєднують якості обох батьківських форм: від клітини імунної системи — здатність виробляти певні антитіла, а від клітини меланоми — здатність необмежено довго ділитися в культурі. Розробка техніки одержання моноклональних антитіл дає найвищою мірою специфічні реагенти, які «впізанють» не просто той або інший тип макромолекул, але і їхні індивідуальні особливості. Це знаходить застосування в медицині, промисловості, що випускає ферментні препарати. Вдається не тільки злиття соматичних клітин, але й реконструкція цілих клітин з їх окремих компартментів. Так, можна енуклюювати клітини ссавців, впливаючи на них цитохалазіном В — речовиною, що виробляє гриб Helminthosporium dematioideum. Цитохалазін викликає виштовхування ядер із клітин. У результаті такої обробки утворяться без'ядерні клітини — цитопласти і вільні ядра, оточені тонким шаром цитоплазми, — каріопласти. Цитопласти можна зливати з нормальними клітинами, одержуючи ядерно цитоплазматичні гібриди, або цибриды.
Для вивчення закономірностей функціонування диференційованих клітин пересаджують ядра із соматичних клітин в енуклейовані яйцеклітини тварин. Утворять також гібриди між раковими й нормальними клітинами. Такий підхід широко застосовують при одержанні так званих моноклональних антитіл на основі вирощування гібридом. Як відомо, специфічні антитіла у відповідь на введення в організм тваринного антигену (найчастіше чужорідного білка або полісахариду) виробляються певними клонами клітин імунної системи. Ці клітини, витягнуті із селезінки імунізованої тварини, зливають із клітинами меланоми — одного з типів злоякісної пухлини. У результаті утворяться гібридоми, які поєднують якості обох батьківських форм: від клітини імунної системи — здатність виробляти певні антитіла, а від клітини меланоми — здатність необмежено довго ділитися в культурі. Розробка техніки одержання моноклональних антитіл дає найвищою мірою специфічні реагенти, які «впізанють» не просто той або інший тип макромолекул, але і їхні індивідуальні особливості. Це знаходить застосування в медицині, промисловості, що випускає ферментні препарати. Вдається не тільки злиття соматичних клітин, але й реконструкція цілих клітин з їх окремих компартментів. Так, можна енуклюювати клітини ссавців, впливаючи на них цитохалазіном В — речовиною, що виробляє гриб Helminthosporium dematioideum. Цитохалазін викликає виштовхування ядер із клітин. У результаті такої обробки утворяться без'ядерні клітини — цитопласти і вільні ядра, оточені тонким шаром цитоплазми, — каріопласти. Цитопласти можна зливати з нормальними клітинами, одержуючи ядерно цитоплазматичні гібриди, або цибриды.
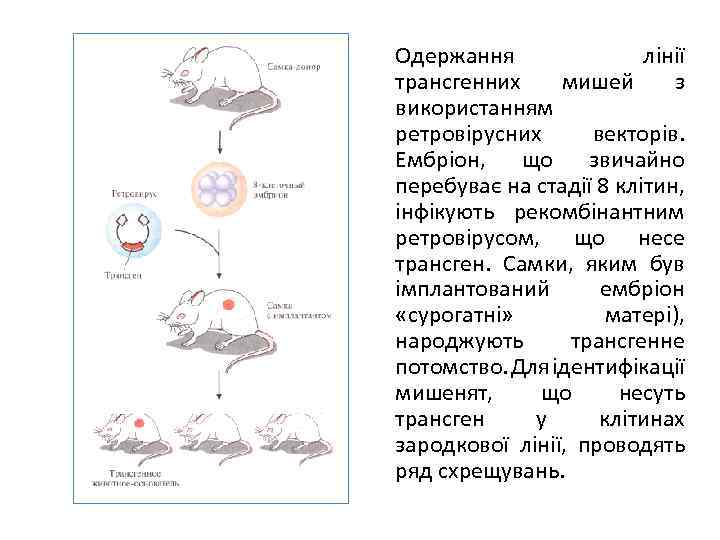 Одержання лінії трансгенних мишей з використанням ретровірусних векторів. Ембріон, що звичайно перебуває на стадії 8 клітин, інфікують рекомбінантним ретровірусом, що несе трансген. Самки, яким був імплантований ембріон «сурогатні» матері), народжують трансгенне потомство. Для ідентифікації мишенят, що несуть трансген у клітинах зародкової лінії, проводять ряд схрещувань.
Одержання лінії трансгенних мишей з використанням ретровірусних векторів. Ембріон, що звичайно перебуває на стадії 8 клітин, інфікують рекомбінантним ретровірусом, що несе трансген. Самки, яким був імплантований ембріон «сурогатні» матері), народжують трансгенне потомство. Для ідентифікації мишенят, що несуть трансген у клітинах зародкової лінії, проводять ряд схрещувань.
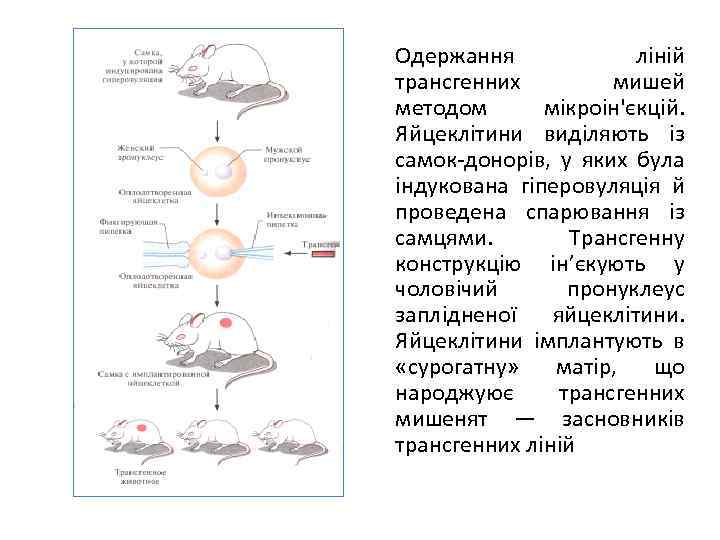 Одержання ліній трансгенних мишей методом мікроін'єкцій. Яйцеклітини виділяють із самок донорів, у яких була індукована гіперовуляція й проведена спарювання із самцями. Трансгенну конструкцію ін’єкують у чоловічий пронуклеус заплідненої яйцеклітини. Яйцеклітини імплантують в «сурогатну» матір, що народжуює трансгенних мишенят — засновників трансгенних ліній
Одержання ліній трансгенних мишей методом мікроін'єкцій. Яйцеклітини виділяють із самок донорів, у яких була індукована гіперовуляція й проведена спарювання із самцями. Трансгенну конструкцію ін’єкують у чоловічий пронуклеус заплідненої яйцеклітини. Яйцеклітини імплантують в «сурогатну» матір, що народжуює трансгенних мишенят — засновників трансгенних ліній
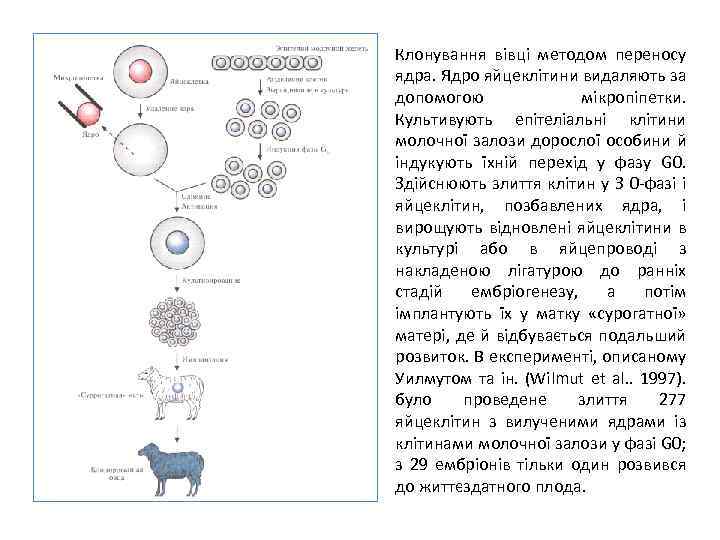 Клонування вівці методом переносу ядра. Ядро яйцеклітини видаляють за допомогою мікропіпетки. Культивують епітеліальні клітини молочної залози дорослої особини й індукують їхній перехід у фазу G 0. Здійснюють злиття клітин у З 0 фазі і яйцеклітин, позбавлених ядра, і вирощують відновлені яйцеклітини в культурі або в яйцепроводі з накладеною лігатурою до ранніх стадій ембріогенезу, а потім імплантують їх у матку «сурогатної» матері, де й відбувається подальший розвиток. В експерименті, описаному Уилмутом та ін. (Wilmut et al. . 1997). було проведене злиття 277 яйцеклітин з вилученими ядрами із клітинами молочної залози у фазі G 0; з 29 ембріонів тільки один розвився до життєздатного плода.
Клонування вівці методом переносу ядра. Ядро яйцеклітини видаляють за допомогою мікропіпетки. Культивують епітеліальні клітини молочної залози дорослої особини й індукують їхній перехід у фазу G 0. Здійснюють злиття клітин у З 0 фазі і яйцеклітин, позбавлених ядра, і вирощують відновлені яйцеклітини в культурі або в яйцепроводі з накладеною лігатурою до ранніх стадій ембріогенезу, а потім імплантують їх у матку «сурогатної» матері, де й відбувається подальший розвиток. В експерименті, описаному Уилмутом та ін. (Wilmut et al. . 1997). було проведене злиття 277 яйцеклітин з вилученими ядрами із клітинами молочної залози у фазі G 0; з 29 ембріонів тільки один розвився до життєздатного плода.
 Структура і функції гена Критерії алелізму У теперішній час ген визначають як структурну одиницю генетичної інформації, таку, що далі не ділиться у функціональному відношенні. Ген це ділянка молекули ДНК (рідше РНК). Перша вдала спроба конкретизації уявлень про ген належить Т. Х. Моргану, який одну із своїх класичних праць назвал “Теорія гена”. Уявлення школи Моргана про ген можна коротко резюмувати наступним чинм. Гени перебувають у хромосомах і являють собою далі неподільні одиниці мутації, рекомбінації й функції. Ген це: 1. одиниця мутації, тобто ген змінюється як ціле; 2. одиниця рекомбінації, тобто кросинговер ніколи не спостерігали в межах гена; 3. одиниця функції, тобто всі мутації одного гена порушують ту саму генетичну функцію, що виражається в їх некомпліментарності в особин F 1 при попарному схрещуванні мутантів. Гени контролюють елементарні менделівськи ознаки. В цих положеннях і були запропоновані основні критерії алелизму (рекомбінаційний і функціональний), за допомогою яких мутаційні зміні відносять до тому самому або до різних генів. Не слід забувати й про значення індукованого мутагенезу в підвищенні розв'язної здатності генетичного аналізу. Підвищення частоти мутацій гарантує можливість створення великих генетичних колекцій і тим самим збільшує ймовірність усе більше «щільного» маркірування хромосом, Тільки при цьому виникає можливість і необхідність вивчення рекомбінації й взаємодії між тісно зчепленими ділянками генетичного матеріалу. Рекомбінаційний критерій алелизму говорив: якщо мутатації не рекомбінують, то вони алельні, тобто зачіпають той самий ген.
Структура і функції гена Критерії алелізму У теперішній час ген визначають як структурну одиницю генетичної інформації, таку, що далі не ділиться у функціональному відношенні. Ген це ділянка молекули ДНК (рідше РНК). Перша вдала спроба конкретизації уявлень про ген належить Т. Х. Моргану, який одну із своїх класичних праць назвал “Теорія гена”. Уявлення школи Моргана про ген можна коротко резюмувати наступним чинм. Гени перебувають у хромосомах і являють собою далі неподільні одиниці мутації, рекомбінації й функції. Ген це: 1. одиниця мутації, тобто ген змінюється як ціле; 2. одиниця рекомбінації, тобто кросинговер ніколи не спостерігали в межах гена; 3. одиниця функції, тобто всі мутації одного гена порушують ту саму генетичну функцію, що виражається в їх некомпліментарності в особин F 1 при попарному схрещуванні мутантів. Гени контролюють елементарні менделівськи ознаки. В цих положеннях і були запропоновані основні критерії алелизму (рекомбінаційний і функціональний), за допомогою яких мутаційні зміні відносять до тому самому або до різних генів. Не слід забувати й про значення індукованого мутагенезу в підвищенні розв'язної здатності генетичного аналізу. Підвищення частоти мутацій гарантує можливість створення великих генетичних колекцій і тим самим збільшує ймовірність усе більше «щільного» маркірування хромосом, Тільки при цьому виникає можливість і необхідність вивчення рекомбінації й взаємодії між тісно зчепленими ділянками генетичного матеріалу. Рекомбінаційний критерій алелизму говорив: якщо мутатації не рекомбінують, то вони алельні, тобто зачіпають той самий ген.
 Функціональний критерій алелизму заснований на схрещуванні мутантів і з'ясуванні, чи порушують мутації ту саму функцію або різні функції. Функціональний критерій алелизму можно застосувати тільки до рецесивний мутацій. Відповідно до цього критерію якщо дві мутації поєднуються шляхом схрещування в F 1 і не ушкоджені мутаціями ділянки генетичного матеріалу взаємодіють комплементарно, тобто утвориться гібрид дикого типу, то мутації відносять до різних функціональних одиниць — різним генам. У цьому випадку має місце класична дигетерозигота. Якщо ж при об'єднанні в F 1 двох мутацій виникає гібрид мутантного фенотипу, це означає, що обидві мутації ушкоджують ту саму функціональну одиницю — той самий ген. У цьому випадку має місце гетероалельна комбінація, або компаунд. Рекомбінаційний і функціональний критерії алелизму збігалися в експериментах школи Т. X. Моргана, що цілком пояснюється рівнем розв'язної здатності генетичного аналізу того часу.
Функціональний критерій алелизму заснований на схрещуванні мутантів і з'ясуванні, чи порушують мутації ту саму функцію або різні функції. Функціональний критерій алелизму можно застосувати тільки до рецесивний мутацій. Відповідно до цього критерію якщо дві мутації поєднуються шляхом схрещування в F 1 і не ушкоджені мутаціями ділянки генетичного матеріалу взаємодіють комплементарно, тобто утвориться гібрид дикого типу, то мутації відносять до різних функціональних одиниць — різним генам. У цьому випадку має місце класична дигетерозигота. Якщо ж при об'єднанні в F 1 двох мутацій виникає гібрид мутантного фенотипу, це означає, що обидві мутації ушкоджують ту саму функціональну одиницю — той самий ген. У цьому випадку має місце гетероалельна комбінація, або компаунд. Рекомбінаційний і функціональний критерії алелизму збігалися в експериментах школи Т. X. Моргана, що цілком пояснюється рівнем розв'язної здатності генетичного аналізу того часу.
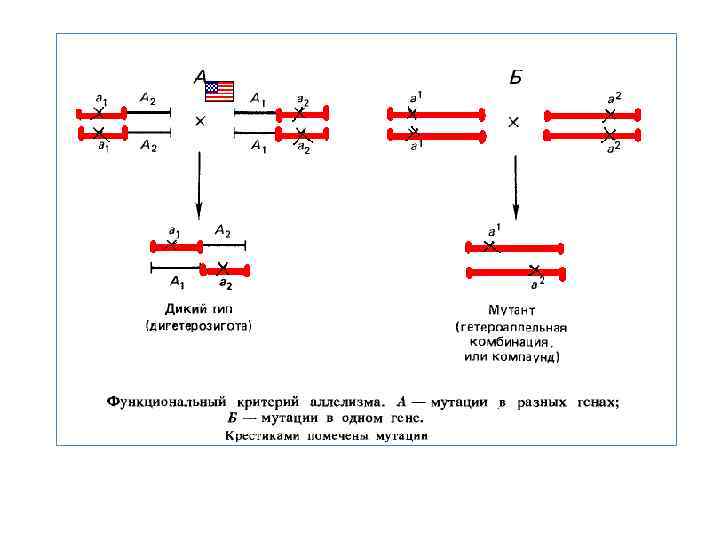
 Протиріччя критеріїв алелізму А. С. Серебровський і його молоді співробітники довели довжи нну й складну структуру гена в роботах з дослідження так званого східчастого алеломорфізму. Явище це було відкрито при вивченні локусу sc — ас (scute — achaete), що контролює розвиток щетинок в D, melanogaster: Його мутації приводять до редукції щетинок, а також до деяким додаткових фенотипічним ефектам. Різні мутантні алелі приводять до змін фенотипу, що розрізняються. Виявилося, що незалежно виниклі мутації в локусі sc — ac, отримані під дією Х променів, вступають у складні відносини алелизму. Дві аллели можуть мати як подібність, так і розходження у фенотипічному прояві: у редукції певних щетинок. При об'єднанні незалежно виниклих мутантних алелей у компаунді звичайно редукувалися лише ті щетинки, які були втрачені в обох батьків. При графічному зображенні взаємодії декількох пар алеломорфів у компаундах виходило щось начебто сходи, щаблями якої служили окремі алелі. Це явище одержало найменування східчастого алеломорфизму. На основі дослідження східчастого алеломорфизму вдалося побудувати лінійний план гена sc ac.
Протиріччя критеріїв алелізму А. С. Серебровський і його молоді співробітники довели довжи нну й складну структуру гена в роботах з дослідження так званого східчастого алеломорфізму. Явище це було відкрито при вивченні локусу sc — ас (scute — achaete), що контролює розвиток щетинок в D, melanogaster: Його мутації приводять до редукції щетинок, а також до деяким додаткових фенотипічним ефектам. Різні мутантні алелі приводять до змін фенотипу, що розрізняються. Виявилося, що незалежно виниклі мутації в локусі sc — ac, отримані під дією Х променів, вступають у складні відносини алелизму. Дві аллели можуть мати як подібність, так і розходження у фенотипічному прояві: у редукції певних щетинок. При об'єднанні незалежно виниклих мутантних алелей у компаунді звичайно редукувалися лише ті щетинки, які були втрачені в обох батьків. При графічному зображенні взаємодії декількох пар алеломорфів у компаундах виходило щось начебто сходи, щаблями якої служили окремі алелі. Це явище одержало найменування східчастого алеломорфизму. На основі дослідження східчастого алеломорфизму вдалося побудувати лінійний план гена sc ac.
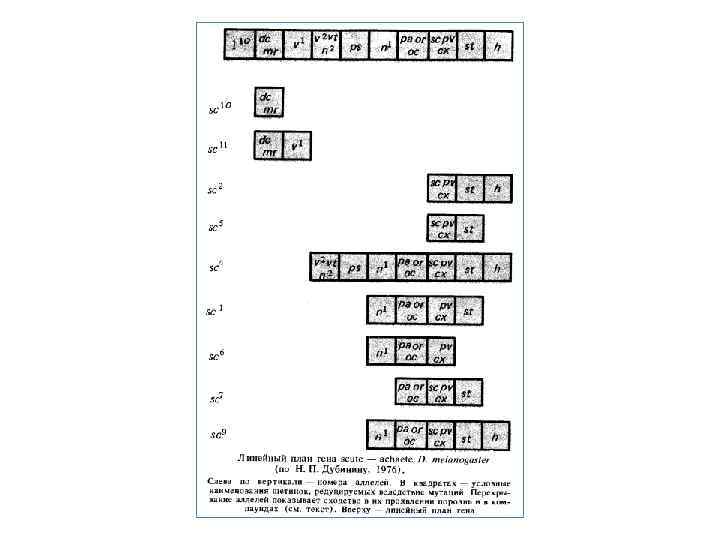
 Аналіз тонкої структури гена Величезний внесок у розуміння структури й функції гена внесли Дж. Бідл і Е. Тейтум, на початку 40 х років біохімічні мутації, що вперше досліджували, в N. crassa. Ці дослідження показали, що мутації ауксотрофності в нейроспори переривають ланцюг метаболізму на конкретних етапах. При цьому аллельные мутації завжди зачіпали той самий етап біосинтезу. На основі своїх результатів Дж. Бідл і Е. Тейтум сформулювали принцип «один ген — один фермент» , що означав, що кожний ген контролює синтез якого небудь ферменту. Цей принцип у готовому виді формулював подальшу методологію дослідження: необхідно вивчати не тільки мутанти й відповідні гени, але й контрольовані ними білки фермснти. Так народився цілий напрямок у генетику розробка систем «ген фермент» ; одержання й вивчення мутантів по одному або деякому генах, дослідження мутантних білків. Все це сприяло конкретизації подань про ген, його структурі й функції. Наприкінці 50 х — початку 60 х років структуру гена вивчали на основі рекомбінації алельних мутацій у цілого ряду об'єктів: еукаріотичних мікроорганізмів, бактерій, бактеріофагів, дрозофіли, мишей і вищих рослин. Вінцем цього періоду в раз витії теорії гена стали дослідження С. Бензера, що працювало з мутаціями в локусі rll (r — від англ. rapid lysis — швидкий лізис) бактеріофага Т 4 Е. coli. Мутанти типу rll утворять більші стерильні плями (у порівнянні з фагом дикого типу) на газоні Е. coli Мутації rll змінюють структуру деяких мембранних білків в інфікованих клітинах Е. coli. Особливість цих мутантів складається також у тім, що вони взагалі не можуть розмножуватися в клітинах штаму Е. col. ДО 12, лізогенного по фагу λ. Ці взаємини мутантів rll зі штамами Е. coli створюють можливість: 1) вирощувати тільки ревертанти й рекомбінанти r+ на штамі Е. coli К 12 (λ); 2) одночасно досліджувати мутанти rll і фаги дикого типу — г+ на штамі Е. coli В.
Аналіз тонкої структури гена Величезний внесок у розуміння структури й функції гена внесли Дж. Бідл і Е. Тейтум, на початку 40 х років біохімічні мутації, що вперше досліджували, в N. crassa. Ці дослідження показали, що мутації ауксотрофності в нейроспори переривають ланцюг метаболізму на конкретних етапах. При цьому аллельные мутації завжди зачіпали той самий етап біосинтезу. На основі своїх результатів Дж. Бідл і Е. Тейтум сформулювали принцип «один ген — один фермент» , що означав, що кожний ген контролює синтез якого небудь ферменту. Цей принцип у готовому виді формулював подальшу методологію дослідження: необхідно вивчати не тільки мутанти й відповідні гени, але й контрольовані ними білки фермснти. Так народився цілий напрямок у генетику розробка систем «ген фермент» ; одержання й вивчення мутантів по одному або деякому генах, дослідження мутантних білків. Все це сприяло конкретизації подань про ген, його структурі й функції. Наприкінці 50 х — початку 60 х років структуру гена вивчали на основі рекомбінації алельних мутацій у цілого ряду об'єктів: еукаріотичних мікроорганізмів, бактерій, бактеріофагів, дрозофіли, мишей і вищих рослин. Вінцем цього періоду в раз витії теорії гена стали дослідження С. Бензера, що працювало з мутаціями в локусі rll (r — від англ. rapid lysis — швидкий лізис) бактеріофага Т 4 Е. coli. Мутанти типу rll утворять більші стерильні плями (у порівнянні з фагом дикого типу) на газоні Е. coli Мутації rll змінюють структуру деяких мембранних білків в інфікованих клітинах Е. coli. Особливість цих мутантів складається також у тім, що вони взагалі не можуть розмножуватися в клітинах штаму Е. col. ДО 12, лізогенного по фагу λ. Ці взаємини мутантів rll зі штамами Е. coli створюють можливість: 1) вирощувати тільки ревертанти й рекомбінанти r+ на штамі Е. coli К 12 (λ); 2) одночасно досліджувати мутанти rll і фаги дикого типу — г+ на штамі Е. coli В.
 При зараженні бактеріальної клітини двома фаговыми частками між їх геномами виникають функціональні відносини, аналогічні відносинам між гомологичными хромосомами диплоїда. При цьому виявляється домінування ознак нормального фага, що виражається в утворенні дрібних стерильних плям як на штамі В, так і на штамі К 12 (λ). Таким чином, між різними мутаціями rll можливий функціональний тест на алелізм. На основі функціонального тесту на алелізм з'ясувалося, що локус rll включає два гени: А и В. У ході реплікації фагових геномів після інфекції бактеріального штаму двома мутантами rll можуть утворюватися ре комбінати дикого типу. Частота появи цих рекомбінантів пропорційна відстані між мутантними крапками в геноме бактеріофага. При попарному дослідженні здатності до рекомбінації трьох різних мутантів rll одержувані значення частот рекомбінації можуть бути використані для лінійного розташування мутацій на основі принципу аддитивності. У межах генів А и В локусу rll картовано більше 2000 мутацій. Легко підрахувати, що якби С. Бензер використовував тільки метод попарних схрещувань мутантів, то для точної локалізації мутацій, сполученої з їхнім випробуванням у всіляких комбінаціях, йому треба було б близько 2 млн. схрещувань. Навіть при роботі з таким об'єктом, як бактеріофаг, подібна перспектива виглядає дуже без. Загальна кількість необхідних схрещувань удалося різко скоротити завдяки методу що перекриваються делецій. Серед мутантів, досліджених С. Бензером, більшість було здатно ревертировувати до дикого типу, однак зустрічалися й стабільні мутанти. Вони ж не могли утворювати рекомбинантів при схрещуванні з декількома мутантами, рекомбінувавшими один з одним. С. Бензер вирішив, що такі «стабільні» мутанти виникли в результаті випадання цілих ділянок локусу rll. Справедливість цього висновку була підтверджена спочатку даними рекомбінаційного аналізу: стабільні мутації (делецій), уведені в схрещування, скорочували генетичні відстані між фланкуючими мутаціями, тобто розташованими праворуч і ліворуч від делецій. Надалі випадання ділянки ДНК продемонстрували на гетеродуплексах, отриманих шляхом гібридизації ДНК із фага дикого типу й з делеційного мутанта. При цьому в ділянці, що відповідає делецій rll, утворювалася однониткова петля за рахунок «зайвої» ДНК із дикого типу, добре видима в електронний мікроскоп. Використання делецій при картуванні дозволяє замінити кількісний облік частоти рекомбінації якісним тестом. При схрещуванні точкового й делеційного мутантів рекомбінанти можуть з'явитися, тільки якщо делеція не перекриває ділянку, у якій локалізована точкова мутація.
При зараженні бактеріальної клітини двома фаговыми частками між їх геномами виникають функціональні відносини, аналогічні відносинам між гомологичными хромосомами диплоїда. При цьому виявляється домінування ознак нормального фага, що виражається в утворенні дрібних стерильних плям як на штамі В, так і на штамі К 12 (λ). Таким чином, між різними мутаціями rll можливий функціональний тест на алелізм. На основі функціонального тесту на алелізм з'ясувалося, що локус rll включає два гени: А и В. У ході реплікації фагових геномів після інфекції бактеріального штаму двома мутантами rll можуть утворюватися ре комбінати дикого типу. Частота появи цих рекомбінантів пропорційна відстані між мутантними крапками в геноме бактеріофага. При попарному дослідженні здатності до рекомбінації трьох різних мутантів rll одержувані значення частот рекомбінації можуть бути використані для лінійного розташування мутацій на основі принципу аддитивності. У межах генів А и В локусу rll картовано більше 2000 мутацій. Легко підрахувати, що якби С. Бензер використовував тільки метод попарних схрещувань мутантів, то для точної локалізації мутацій, сполученої з їхнім випробуванням у всіляких комбінаціях, йому треба було б близько 2 млн. схрещувань. Навіть при роботі з таким об'єктом, як бактеріофаг, подібна перспектива виглядає дуже без. Загальна кількість необхідних схрещувань удалося різко скоротити завдяки методу що перекриваються делецій. Серед мутантів, досліджених С. Бензером, більшість було здатно ревертировувати до дикого типу, однак зустрічалися й стабільні мутанти. Вони ж не могли утворювати рекомбинантів при схрещуванні з декількома мутантами, рекомбінувавшими один з одним. С. Бензер вирішив, що такі «стабільні» мутанти виникли в результаті випадання цілих ділянок локусу rll. Справедливість цього висновку була підтверджена спочатку даними рекомбінаційного аналізу: стабільні мутації (делецій), уведені в схрещування, скорочували генетичні відстані між фланкуючими мутаціями, тобто розташованими праворуч і ліворуч від делецій. Надалі випадання ділянки ДНК продемонстрували на гетеродуплексах, отриманих шляхом гібридизації ДНК із фага дикого типу й з делеційного мутанта. При цьому в ділянці, що відповідає делецій rll, утворювалася однониткова петля за рахунок «зайвої» ДНК із дикого типу, добре видима в електронний мікроскоп. Використання делецій при картуванні дозволяє замінити кількісний облік частоти рекомбінації якісним тестом. При схрещуванні точкового й делеційного мутантів рекомбінанти можуть з'явитися, тільки якщо делеція не перекриває ділянку, у якій локалізована точкова мутація.
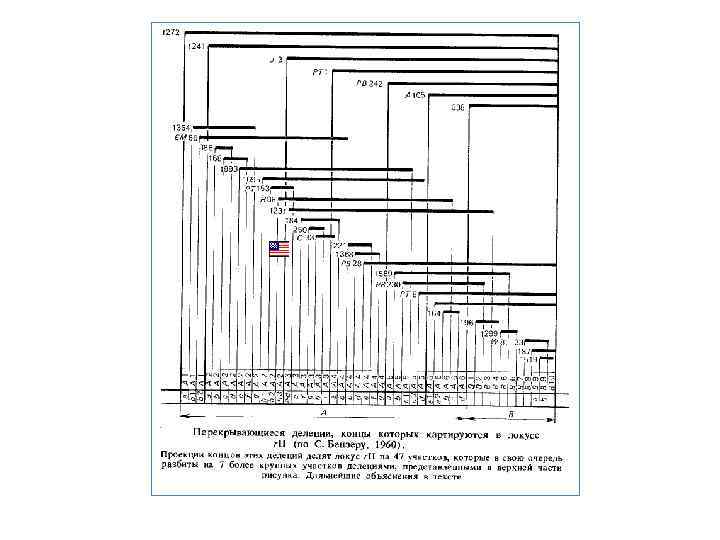
 С. Бензер спочатку картував кінці делецій rll стосовно деяких точкових мутацій, а потім використовував набір делеційних мутантів для попередньої грубої локалізації всіх знову одержуваних мутацій rll у тім або іншому з 47 сегментів ділянки rll. Надалі взаємне положення мутацій, які локалізувались в одному сегменті, визначали попарними схрещуваннями. У локусі rll удалося виявити 308 мутаційних крапок, або сайтів, розташованих у лінійній послідовності. На карті ген А займає ділянку приблизно в 2 рази більше, ніж ген В. Окремі крапки локусу rll володіють різної мутабільносттью. Найбільше мутабільні з них одержали найменування гарячих крапок. Одна гаряча крапка в гені В нараховує 500 спонтанних мутацій. У гені А також є одна гаряча точка спонтанної мутабільності, що нараховує близько 250 мутацій. При індукованому мутагенезі в локусі rll гарячі точки розподіляються характерно для кожного використаного мутагену, відмінно від розподілу, характерного для спонтанного мутування. В експериментах С. Бензера була зіставлена розмірність генетичної карти бактеріофага (частоти рекомбінації) з розмірністю молекулярних структур, відповідальних за зберігання й передачу спадкоємної інформації, тобто із числом нуклеотидних пар молекули ДНК. При цьому за основу були прийняті наступні дані. Як показали А. Херши й М. Чейз, при фаговій інфекції в бактеріальну клітину проникає майже чиста ДНК. Загальне число пар нуклеотидов у ДНК фага Т 4 становить 1, 8 8 105. Загальна довжина рекомбінаційної карти Т 4 дорівнює 1500 %. Мінімальна частота рекомбінації в досвідах С. Бензера становила 0, 02 % (при межі розв'язної здатності рекомбінаційного аналізу 0, 0001 %). Це відповідає приблизно 1, 3* 10– 5 від усього генома Т 4 (0, 02: 1500= 1, 3*10– 5). Таким чином, можна показати, що з мінімальною частотою рекомбінація відбувалася на відстані біля двох нуклеотидних пар (1, 8*105 п. н. — 1, 3*10– 5 = 2, 34).
С. Бензер спочатку картував кінці делецій rll стосовно деяких точкових мутацій, а потім використовував набір делеційних мутантів для попередньої грубої локалізації всіх знову одержуваних мутацій rll у тім або іншому з 47 сегментів ділянки rll. Надалі взаємне положення мутацій, які локалізувались в одному сегменті, визначали попарними схрещуваннями. У локусі rll удалося виявити 308 мутаційних крапок, або сайтів, розташованих у лінійній послідовності. На карті ген А займає ділянку приблизно в 2 рази більше, ніж ген В. Окремі крапки локусу rll володіють різної мутабільносттью. Найбільше мутабільні з них одержали найменування гарячих крапок. Одна гаряча крапка в гені В нараховує 500 спонтанних мутацій. У гені А також є одна гаряча точка спонтанної мутабільності, що нараховує близько 250 мутацій. При індукованому мутагенезі в локусі rll гарячі точки розподіляються характерно для кожного використаного мутагену, відмінно від розподілу, характерного для спонтанного мутування. В експериментах С. Бензера була зіставлена розмірність генетичної карти бактеріофага (частоти рекомбінації) з розмірністю молекулярних структур, відповідальних за зберігання й передачу спадкоємної інформації, тобто із числом нуклеотидних пар молекули ДНК. При цьому за основу були прийняті наступні дані. Як показали А. Херши й М. Чейз, при фаговій інфекції в бактеріальну клітину проникає майже чиста ДНК. Загальне число пар нуклеотидов у ДНК фага Т 4 становить 1, 8 8 105. Загальна довжина рекомбінаційної карти Т 4 дорівнює 1500 %. Мінімальна частота рекомбінації в досвідах С. Бензера становила 0, 02 % (при межі розв'язної здатності рекомбінаційного аналізу 0, 0001 %). Це відповідає приблизно 1, 3* 10– 5 від усього генома Т 4 (0, 02: 1500= 1, 3*10– 5). Таким чином, можна показати, що з мінімальною частотою рекомбінація відбувалася на відстані біля двох нуклеотидних пар (1, 8*105 п. н. — 1, 3*10– 5 = 2, 34).
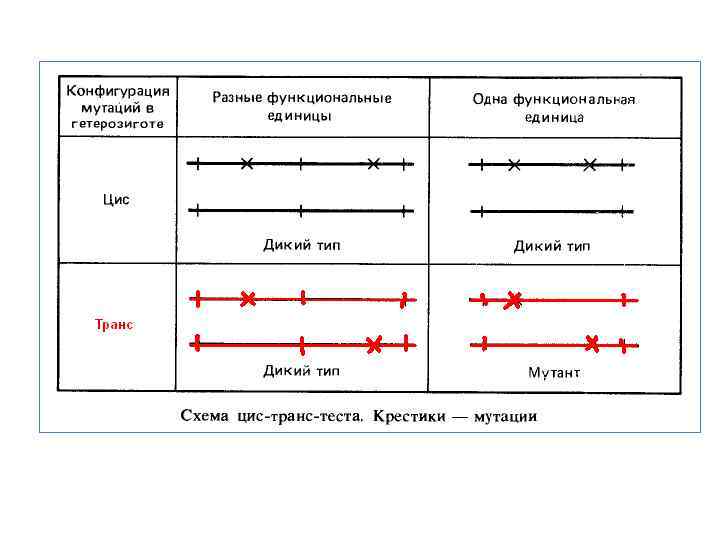
 У цьому випадку важлива не стільки конкретна цифра, отримана С. Бензером, скільки порядок величини декілька нуклеотидів. Надалі було показано, що рекомбінація може розділяти сусідні нуклеотидні пари. Провівши аналогічні розрахунки, С. Бензер показав, що й мінімальна ділянка, що змінюється в результаті мутації, виміряється деякими нуклеотидами. Зараз очевидно, що рекомбінація може розділяти сусідні пари нуклеотидів, що найменша ділянка ДНК, що змінюється при мутуванні, — це пари нуклеотидів. Очевидно, із цієї причини терміни, уведені С. Бензером для позначення одиниці мутації (мутон) і одиниці рекомбінації (рекон), не одержали широкого поширення. С. Бензер спробував ревізувати й поняття «ген» . Для віднесення двох мутацій до однієї або різним одиницям функції він запропонував використовувати так званий цис транс тест, винайдений Е. Льюисом. Відповідно до цього тесту мутації унарно випробовують у гетерозиготіу двох конфігураціях: цис — коли обидві мутації в гібриді походять від одного батька, і транс — коли вони надходять у гібрид від різних батьків. Згідно С. Бензеру, якщо цис і транс гетерозитота мають однаковий (дикий) фенотип, то мутації зачіпають різні одиниці функцій, а якщо цис і транс гетерозиготи різного фенотипу (цис — дикий, а транс — мутантний), те мутації зачіпають одну одиницю функції, що він запропонував називати цистроном. Безсумнівним досягненням у роботі С. Бензера була розробка методу делеций що перекриваються для внутрігенного картування, завдяки якому стало можливим «насичувати» генетичну карту мутаціями. Він уперше перевів величини, вимірювані в генетичному аналізі, у молекулярну розмірність: зіставив їх з мономерами молекули ДНК. Підсумком цієї роботи був дозвіл гаданих протиріч між критеріями алелизму. Стала очевидною їхня відносність, особливо відносно рекомбінаційного критерію аллелизма. Функціональний же критерій алелизму зберігає свою цінність із урахуванням можливості міжалельної компліментації, тобто він також відносний і в точному значенні повинен застосовуватися на досить великому статистичному матеріалі. Надалі буде показано, що відносність функціонального критерію алелизму виражається не тільки у випадку компліментарності алельних мутацій, але й у випадку некомплементарності мутацій різних генів в оперонах. Таким чином, від морганівських подань про однозначну відповідність результатів різних тестів (рекомбінаційного й функціонального) на алелизм ми приходимо до розуміння їхньої відносності й необхідності комплексного застосування.
У цьому випадку важлива не стільки конкретна цифра, отримана С. Бензером, скільки порядок величини декілька нуклеотидів. Надалі було показано, що рекомбінація може розділяти сусідні нуклеотидні пари. Провівши аналогічні розрахунки, С. Бензер показав, що й мінімальна ділянка, що змінюється в результаті мутації, виміряється деякими нуклеотидами. Зараз очевидно, що рекомбінація може розділяти сусідні пари нуклеотидів, що найменша ділянка ДНК, що змінюється при мутуванні, — це пари нуклеотидів. Очевидно, із цієї причини терміни, уведені С. Бензером для позначення одиниці мутації (мутон) і одиниці рекомбінації (рекон), не одержали широкого поширення. С. Бензер спробував ревізувати й поняття «ген» . Для віднесення двох мутацій до однієї або різним одиницям функції він запропонував використовувати так званий цис транс тест, винайдений Е. Льюисом. Відповідно до цього тесту мутації унарно випробовують у гетерозиготіу двох конфігураціях: цис — коли обидві мутації в гібриді походять від одного батька, і транс — коли вони надходять у гібрид від різних батьків. Згідно С. Бензеру, якщо цис і транс гетерозитота мають однаковий (дикий) фенотип, то мутації зачіпають різні одиниці функцій, а якщо цис і транс гетерозиготи різного фенотипу (цис — дикий, а транс — мутантний), те мутації зачіпають одну одиницю функції, що він запропонував називати цистроном. Безсумнівним досягненням у роботі С. Бензера була розробка методу делеций що перекриваються для внутрігенного картування, завдяки якому стало можливим «насичувати» генетичну карту мутаціями. Він уперше перевів величини, вимірювані в генетичному аналізі, у молекулярну розмірність: зіставив їх з мономерами молекули ДНК. Підсумком цієї роботи був дозвіл гаданих протиріч між критеріями алелизму. Стала очевидною їхня відносність, особливо відносно рекомбінаційного критерію аллелизма. Функціональний же критерій алелизму зберігає свою цінність із урахуванням можливості міжалельної компліментації, тобто він також відносний і в точному значенні повинен застосовуватися на досить великому статистичному матеріалі. Надалі буде показано, що відносність функціонального критерію алелизму виражається не тільки у випадку компліментарності алельних мутацій, але й у випадку некомплементарності мутацій різних генів в оперонах. Таким чином, від морганівських подань про однозначну відповідність результатів різних тестів (рекомбінаційного й функціонального) на алелизм ми приходимо до розуміння їхньої відносності й необхідності комплексного застосування.


