Тема 11. Цепная полимеризация
































11_Свободнорадикальная полимеризация.ppt
- Количество слайдов: 71
 Тема 11. Цепная полимеризация
Тема 11. Цепная полимеризация
 План лекции 1. Цепные реакции. Полимеризация как цепная реакция. Общие понятия. 2. Свободные радикалы. Основные стадии радикальной полимеризации. Механизм и кинетика. Методы инициирования. 3. Ионная (каталитическая) полимеризация. 4. Способы проведения полимеризации.
План лекции 1. Цепные реакции. Полимеризация как цепная реакция. Общие понятия. 2. Свободные радикалы. Основные стадии радикальной полимеризации. Механизм и кинетика. Методы инициирования. 3. Ионная (каталитическая) полимеризация. 4. Способы проведения полимеризации.
 Цепные реакции Цепная реакция – реакция, в которой реакционноспособные интермедиаты (часто радикалы) постоянно регенерируются, обычно путем повторяющегося цикла элементарных стадий (стадий «развития цепи» ). Пример: хлорирование метана Cl 2 2 Cl∙ CH 4 + Cl∙ CH 3∙ + HCl Стадии развития цепи CH 3∙ + Cl 2 CH 3 Cl + Cl∙
Цепные реакции Цепная реакция – реакция, в которой реакционноспособные интермедиаты (часто радикалы) постоянно регенерируются, обычно путем повторяющегося цикла элементарных стадий (стадий «развития цепи» ). Пример: хлорирование метана Cl 2 2 Cl∙ CH 4 + Cl∙ CH 3∙ + HCl Стадии развития цепи CH 3∙ + Cl 2 CH 3 Cl + Cl∙
 Полимеризация Определение IUPAC: Полимеризация – процесс превращения смеси мономеров в полимер. полимер Другой вариант определения: Полимеризация – процесс получения высокомолекулярных соединений, при котором молекула полимера (макромолекула) образуется путем последовательного присоединения молекул низкомолекулярного вещества (мономера) к активному центру, находящемуся на конце растущей цепи.
Полимеризация Определение IUPAC: Полимеризация – процесс превращения смеси мономеров в полимер. полимер Другой вариант определения: Полимеризация – процесс получения высокомолекулярных соединений, при котором молекула полимера (макромолекула) образуется путем последовательного присоединения молекул низкомолекулярного вещества (мономера) к активному центру, находящемуся на конце растущей цепи.
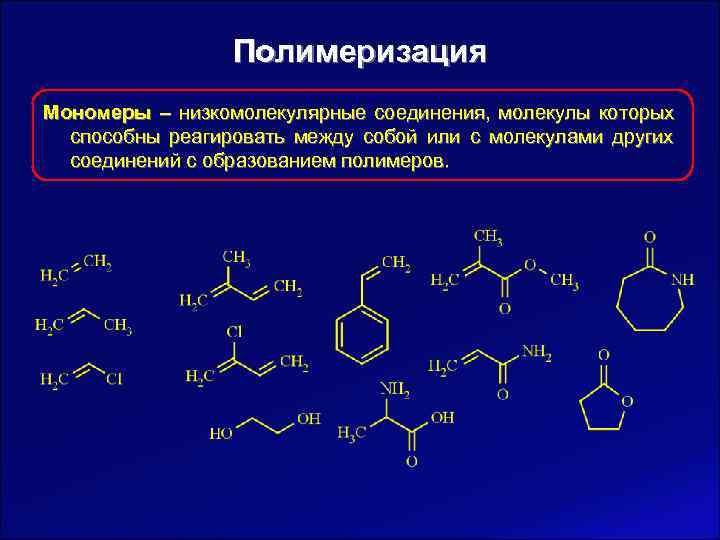
 Полимеризация Мономеры – низкомолекулярные соединения, молекулы которых способны реагировать между собой или с молекулами других соединений с образованием полимеров.
Полимеризация Мономеры – низкомолекулярные соединения, молекулы которых способны реагировать между собой или с молекулами других соединений с образованием полимеров.
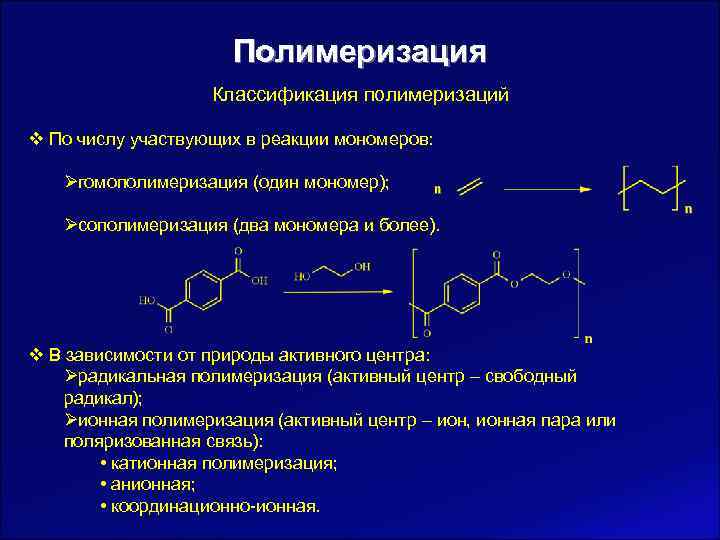
 Полимеризация Классификация полимеризаций v По числу участвующих в реакции мономеров: Øгомополимеризация (один мономер); Øсополимеризация (два мономера и более). v В зависимости от природы активного центра: Øрадикальная полимеризация (активный центр – свободный радикал); Øионная полимеризация (активный центр – ион, ионная пара или поляризованная связь): • катионная полимеризация; • анионная; • координационно-ионная.
Полимеризация Классификация полимеризаций v По числу участвующих в реакции мономеров: Øгомополимеризация (один мономер); Øсополимеризация (два мономера и более). v В зависимости от природы активного центра: Øрадикальная полимеризация (активный центр – свободный радикал); Øионная полимеризация (активный центр – ион, ионная пара или поляризованная связь): • катионная полимеризация; • анионная; • координационно-ионная.
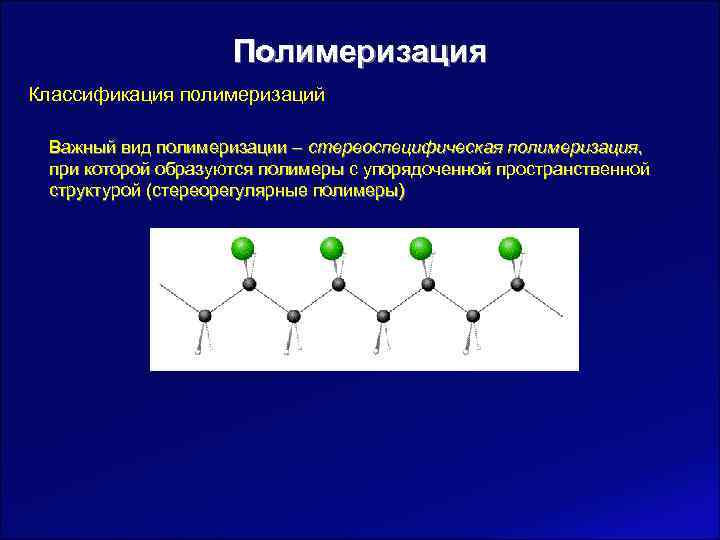
 Полимеризация Классификация полимеризаций Важный вид полимеризации – стереоспецифическая полимеризация, при которой образуются полимеры с упорядоченной пространственной структурой (стереорегулярные полимеры)
Полимеризация Классификация полимеризаций Важный вид полимеризации – стереоспецифическая полимеризация, при которой образуются полимеры с упорядоченной пространственной структурой (стереорегулярные полимеры)
 Полимеризация Немного термодинамики… Полимеризация большинства мономеров идет: • с выделением теплоты (ΔH 0 < 0); • с уменьшением энтропии (главным образом за счет потери поступательных степеней свободы молекулами мономера; ΔS 0 < 0). Полимеризация мономеров термодинамически возможна лишь ниже некоторой предельной температуры: ΔG = (ΔH − T ΔS) < 0 Тпр = ΔН 0 полим / ΔS 0 полим Выше Тпр термодинамически более выгодна деполимеризация (деструкция) полимера.
Полимеризация Немного термодинамики… Полимеризация большинства мономеров идет: • с выделением теплоты (ΔH 0 < 0); • с уменьшением энтропии (главным образом за счет потери поступательных степеней свободы молекулами мономера; ΔS 0 < 0). Полимеризация мономеров термодинамически возможна лишь ниже некоторой предельной температуры: ΔG = (ΔH − T ΔS) < 0 Тпр = ΔН 0 полим / ΔS 0 полим Выше Тпр термодинамически более выгодна деполимеризация (деструкция) полимера.
 Полимеризация Основные стадии полимеризации 1. Инициирование цепи – превращение небольшой доли молекул мономера в активные центры. 2. Рост цепи – последовательное присоединение молекул мономера (М) к активному центру (М*): М* + М → М 1* ; М 1* + М → М 2* ; … ; Мn* + М → Мn+1* 3. Передача цепи – переход активного центра на какую-либо другую частицу (мономер, растворитель, полимер и т. п. ), начинающую рост новой макромолекулы. 4. Обрыв цепи – гибель активного центра при его реакции с другим активным центром, каким-либо другим веществом или из-за изомеризации в неактивные продукты.
Полимеризация Основные стадии полимеризации 1. Инициирование цепи – превращение небольшой доли молекул мономера в активные центры. 2. Рост цепи – последовательное присоединение молекул мономера (М) к активному центру (М*): М* + М → М 1* ; М 1* + М → М 2* ; … ; Мn* + М → Мn+1* 3. Передача цепи – переход активного центра на какую-либо другую частицу (мономер, растворитель, полимер и т. п. ), начинающую рост новой макромолекулы. 4. Обрыв цепи – гибель активного центра при его реакции с другим активным центром, каким-либо другим веществом или из-за изомеризации в неактивные продукты.
 Полимеризация Немного кинетики… Вид кинетических уравнений полимеризации зависит от механизма конкретных процессов. При их выводе принимают, что активность растущих макромолекул не зависит от их длины и что общая скорость равна скорости реакции роста цепи (реакция обычно бимолекулярна): , где [M] и [М*] – концентрации мономера и активных центров соответственно; kp – константа скорости роста цепи.
Полимеризация Немного кинетики… Вид кинетических уравнений полимеризации зависит от механизма конкретных процессов. При их выводе принимают, что активность растущих макромолекул не зависит от их длины и что общая скорость равна скорости реакции роста цепи (реакция обычно бимолекулярна): , где [M] и [М*] – концентрации мономера и активных центров соответственно; kp – константа скорости роста цепи.
 Радикальная полимеризация – цепная реакция полимеризации, в которой реакционноспособными интермедиатами являются свободные радикалы.
Радикальная полимеризация – цепная реакция полимеризации, в которой реакционноспособными интермедиатами являются свободные радикалы.
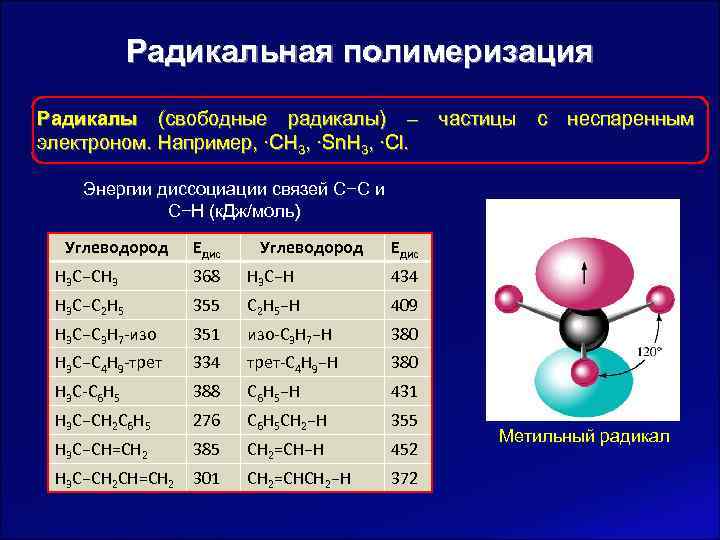
 Радикальная полимеризация Радикалы (свободные радикалы) – частицы с неспаренным электроном. Например, ∙CH 3, ∙Sn. H 3, ∙Cl. Энергии диссоциации связей С−С и С−Н (к. Дж/моль) Углеводород Едис H 3 C−CH 3 368 H 3 C−H 434 H 3 C−C 2 H 5 355 C 2 H 5−H 409 H 3 C−C 3 H 7 -изо 351 изо-C 3 H 7−H 380 H 3 C−C 4 H 9 -трет 334 трет-C 4 H 9−H 380 H 3 C-C 6 H 5 388 C 6 H 5−H 431 H 3 C−CH 2 C 6 H 5 276 C 6 H 5 CH 2−H 355 Метильный радикал H 3 C−CH=CH 2 385 CH 2=CH−H 452 H 3 C−CH 2 CH=CH 2 301 CH 2=CHCH 2−H 372
Радикальная полимеризация Радикалы (свободные радикалы) – частицы с неспаренным электроном. Например, ∙CH 3, ∙Sn. H 3, ∙Cl. Энергии диссоциации связей С−С и С−Н (к. Дж/моль) Углеводород Едис H 3 C−CH 3 368 H 3 C−H 434 H 3 C−C 2 H 5 355 C 2 H 5−H 409 H 3 C−C 3 H 7 -изо 351 изо-C 3 H 7−H 380 H 3 C−C 4 H 9 -трет 334 трет-C 4 H 9−H 380 H 3 C-C 6 H 5 388 C 6 H 5−H 431 H 3 C−CH 2 C 6 H 5 276 C 6 H 5 CH 2−H 355 Метильный радикал H 3 C−CH=CH 2 385 CH 2=CH−H 452 H 3 C−CH 2 CH=CH 2 301 CH 2=CHCH 2−H 372
 Радикальная полимеризация Реакции свободных радикалов: 1) рекомбинация 2) диспропорционирование Х∙ + Y∙ → X−Y X∙ + ∙Y−Z−W → X−Y + Z=W CH 3∙ + CH 3∙ → CH 3−CH 3 CH 3∙ + CH 3−CH 2∙ → CH 4 + CH 2=CH 2 3) фрагментация 4) перенос YZ∙ → Y∙ + Z X∙ + YZ → X−Y + Z∙ CH 3 CO∙ → CH 3∙ + CO CF 3∙ + CH 4 → CF 3 H + CH 3∙ 5) присоединение X∙ + Y=Z → X−Y−Z∙ CH 3∙ + CH 2=CH 2 → CH 3−CH 2∙
Радикальная полимеризация Реакции свободных радикалов: 1) рекомбинация 2) диспропорционирование Х∙ + Y∙ → X−Y X∙ + ∙Y−Z−W → X−Y + Z=W CH 3∙ + CH 3∙ → CH 3−CH 3 CH 3∙ + CH 3−CH 2∙ → CH 4 + CH 2=CH 2 3) фрагментация 4) перенос YZ∙ → Y∙ + Z X∙ + YZ → X−Y + Z∙ CH 3 CO∙ → CH 3∙ + CO CF 3∙ + CH 4 → CF 3 H + CH 3∙ 5) присоединение X∙ + Y=Z → X−Y−Z∙ CH 3∙ + CH 2=CH 2 → CH 3−CH 2∙
 Радикальная полимеризация Основные стадии радикальной полимеризации: 1. Инициирование. 2. Рост цепи. 3. Обрыв цепи. I. Инициирование цепи: k 0 I 2 R∙ I – молекула инициатора; ki R∙ − радикал, который R∙ + M R−M 1∙ образовался вследствие распада инициатора; II. Рост цепи: М – молекула мономера; kроста М 1∙ − радикал мономера; R−M 1∙ + M R−M 2∙ Mx, y – радикал олигомера kроста R−M 2∙ + (x − 2)M R−Mx∙
Радикальная полимеризация Основные стадии радикальной полимеризации: 1. Инициирование. 2. Рост цепи. 3. Обрыв цепи. I. Инициирование цепи: k 0 I 2 R∙ I – молекула инициатора; ki R∙ − радикал, который R∙ + M R−M 1∙ образовался вследствие распада инициатора; II. Рост цепи: М – молекула мономера; kроста М 1∙ − радикал мономера; R−M 1∙ + M R−M 2∙ Mx, y – радикал олигомера kроста R−M 2∙ + (x − 2)M R−Mx∙
 Радикальная полимеризация III. Обрыв цепи: а) рекомбинация макрорадикалов kрекомб Mx ∙ + M y ∙ M(x+y) б) рекомбинация макрорадикала с низкомолекулярным радикалом (инициатором) kрекомб Mx∙ + R∙ Mx R в) диспропорционирование kдиспр Mx ∙ + M y ∙ Mx + M y
Радикальная полимеризация III. Обрыв цепи: а) рекомбинация макрорадикалов kрекомб Mx ∙ + M y ∙ M(x+y) б) рекомбинация макрорадикала с низкомолекулярным радикалом (инициатором) kрекомб Mx∙ + R∙ Mx R в) диспропорционирование kдиспр Mx ∙ + M y ∙ Mx + M y
 Радикальная полимеризация III. Обрыв цепи: г) перенос атома водорода с: − растворителя kпер Mx∙ + SH Mx + S∙ − мономера kпер Mx∙ + MH Mx. H + M∙
Радикальная полимеризация III. Обрыв цепи: г) перенос атома водорода с: − растворителя kпер Mx∙ + SH Mx + S∙ − мономера kпер Mx∙ + MH Mx. H + M∙
 Радикальная полимеризация Инициирование цепи Для зарождения цепи используются как физические (фотолиз, радиолиз, термолиз), так и химические (разложение радикальных инициаторов) методы. Скорость стадии инициирования определяется уравнением: v = 2 k 0∙f∙[I] , где f – коэффициент эффективности инициирования; I – молярная концентрация инициатора. Коэффициент эффективности инициирования (f) – отношение числа радикалов, образовавшихся при распаде инициатора, к числу радикалов, вступивших в реакцию с мономером. f = 0. 6 − 0. 8
Радикальная полимеризация Инициирование цепи Для зарождения цепи используются как физические (фотолиз, радиолиз, термолиз), так и химические (разложение радикальных инициаторов) методы. Скорость стадии инициирования определяется уравнением: v = 2 k 0∙f∙[I] , где f – коэффициент эффективности инициирования; I – молярная концентрация инициатора. Коэффициент эффективности инициирования (f) – отношение числа радикалов, образовавшихся при распаде инициатора, к числу радикалов, вступивших в реакцию с мономером. f = 0. 6 − 0. 8
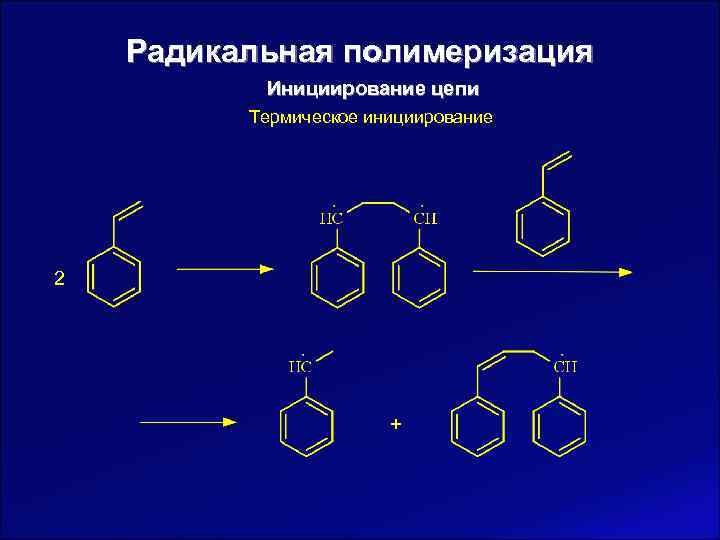
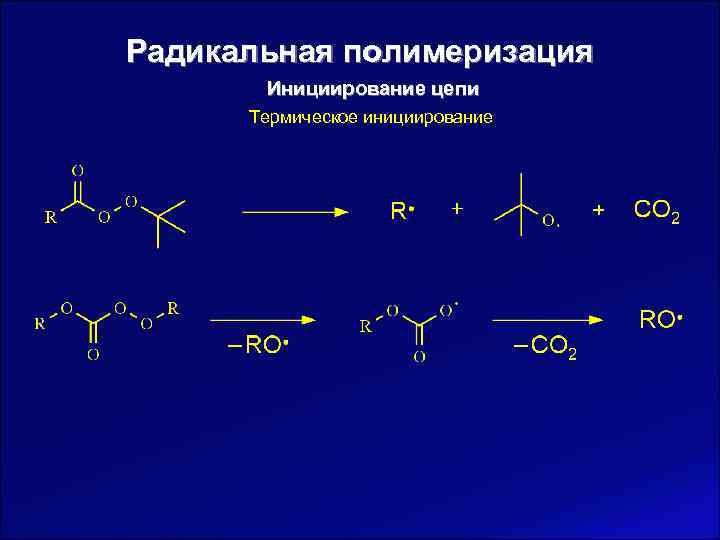
 Радикальная полимеризация Инициирование цепи Термическое инициирование 2
Радикальная полимеризация Инициирование цепи Термическое инициирование 2
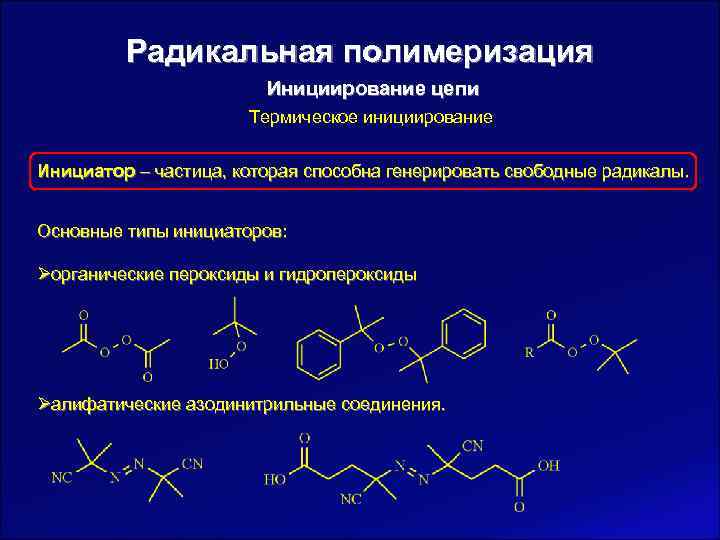
 Радикальная полимеризация Инициирование цепи Термическое инициирование Инициатор – частица, которая способна генерировать свободные радикалы. Основные типы инициаторов: Øорганические пероксиды и гидропероксиды Øалифатические азодинитрильные соединения.
Радикальная полимеризация Инициирование цепи Термическое инициирование Инициатор – частица, которая способна генерировать свободные радикалы. Основные типы инициаторов: Øорганические пероксиды и гидропероксиды Øалифатические азодинитрильные соединения.
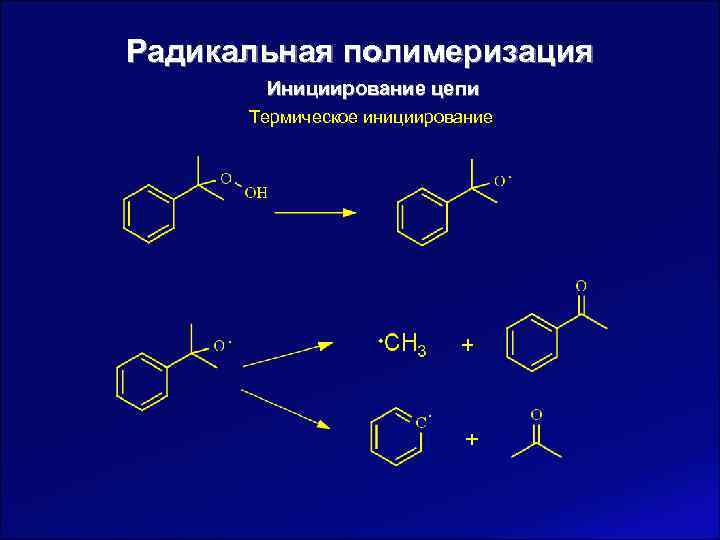
 Радикальная полимеризация Инициирование цепи Термическое инициирование
Радикальная полимеризация Инициирование цепи Термическое инициирование
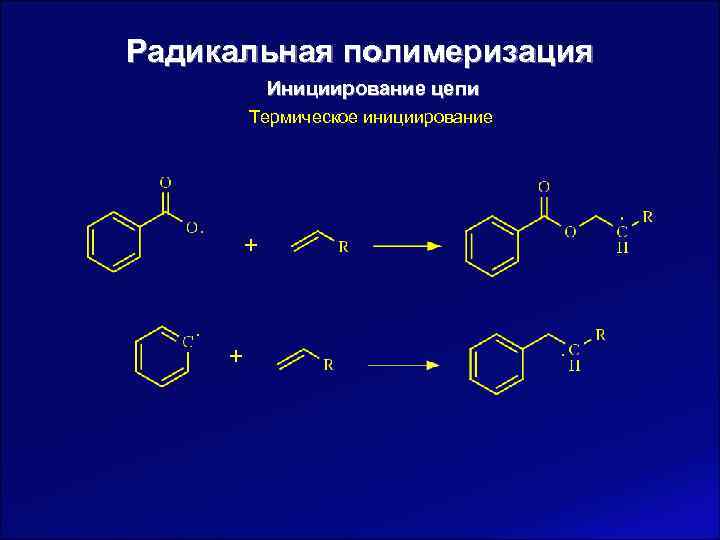
 Радикальная полимеризация Инициирование цепи Термическое инициирование
Радикальная полимеризация Инициирование цепи Термическое инициирование
 Радикальная полимеризация Инициирование цепи Термическое инициирование
Радикальная полимеризация Инициирование цепи Термическое инициирование
 Радикальная полимеризация Инициирование цепи Термическое инициирование
Радикальная полимеризация Инициирование цепи Термическое инициирование
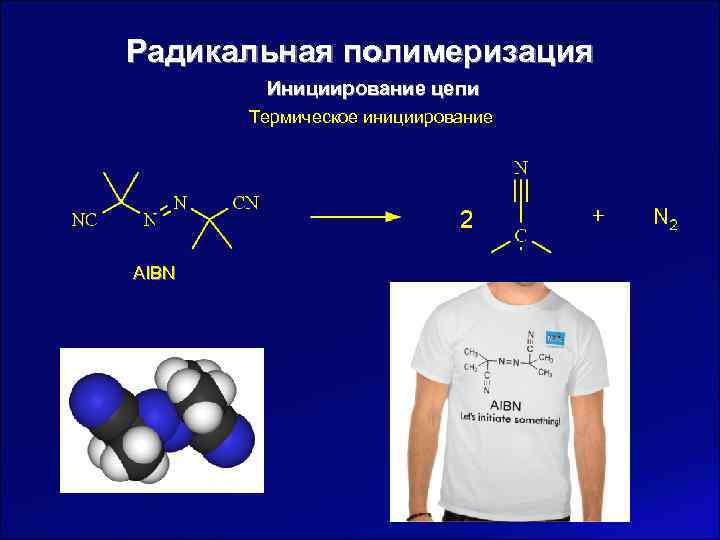
 Радикальная полимеризация Инициирование цепи Термическое инициирование AIBN
Радикальная полимеризация Инициирование цепи Термическое инициирование AIBN
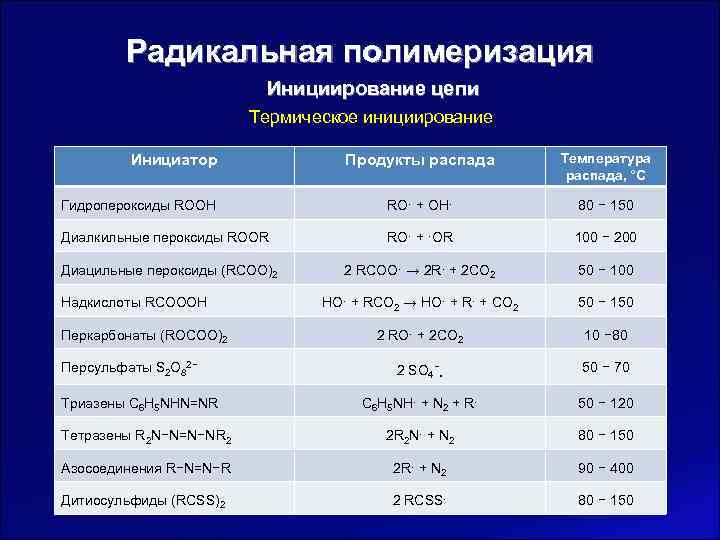
 Радикальная полимеризация Инициирование цепи Термическое инициирование Инициатор Продукты распада Температура распада, °С Гидропероксиды ROOH RO∙ + OH∙ 80 − 150 Диалкильные пероксиды ROOR RO∙ + ∙OR 100 − 200 Диацильные пероксиды (RCOO)2 2 RCOO∙ → 2 R∙ + 2 CO 2 50 − 100 Надкислоты RCOOOH HO∙ + RCO 2 → HO∙ + R∙ + CO 2 50 − 150 Перкарбонаты (ROCOO)2 2 RO∙ + 2 CO 2 10 − 80 Персульфаты S 2 O 82− 2 SO 4−∙ 50 − 70 Триазены C 6 H 5 NHN=NR C 6 H 5 NH∙ + N 2 + R∙ 50 − 120 Тетразены R 2 N−N=N−NR 2 2 R 2 N∙ + N 2 80 − 150 Азосоединения R−N=N−R 2 R∙ + N 2 90 − 400 Дитиосульфиды (RCSS)2 2 RCSS∙ 80 − 150
Радикальная полимеризация Инициирование цепи Термическое инициирование Инициатор Продукты распада Температура распада, °С Гидропероксиды ROOH RO∙ + OH∙ 80 − 150 Диалкильные пероксиды ROOR RO∙ + ∙OR 100 − 200 Диацильные пероксиды (RCOO)2 2 RCOO∙ → 2 R∙ + 2 CO 2 50 − 100 Надкислоты RCOOOH HO∙ + RCO 2 → HO∙ + R∙ + CO 2 50 − 150 Перкарбонаты (ROCOO)2 2 RO∙ + 2 CO 2 10 − 80 Персульфаты S 2 O 82− 2 SO 4−∙ 50 − 70 Триазены C 6 H 5 NHN=NR C 6 H 5 NH∙ + N 2 + R∙ 50 − 120 Тетразены R 2 N−N=N−NR 2 2 R 2 N∙ + N 2 80 − 150 Азосоединения R−N=N−R 2 R∙ + N 2 90 − 400 Дитиосульфиды (RCSS)2 2 RCSS∙ 80 − 150
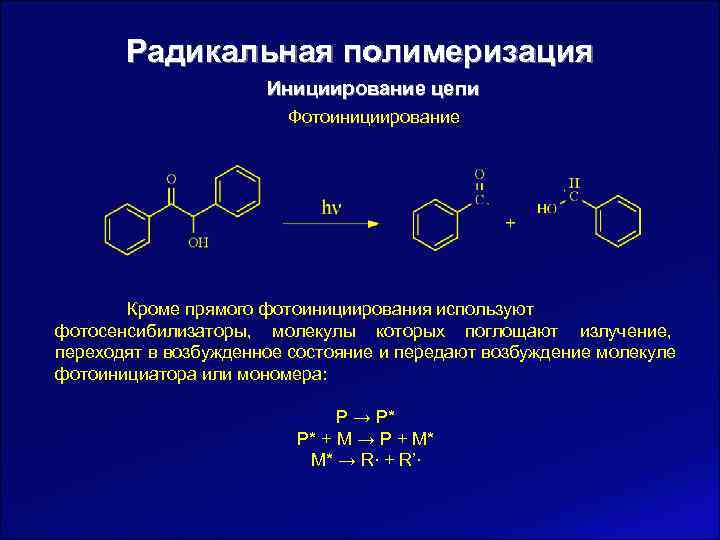
 Радикальная полимеризация Инициирование цепи Фотоинициирование Сущность процесса фотоинициирования полимеризации без использования инициаторов или фотосенсибилизаторов заключается в облучении реакционной массы ультрафиолетовым излучением с определенной длиной волны, зависящей от того, разрыва какой двойной связи необходимо добиться. При этом возможны два процесса: § возбуждение молекулы мономера при поглощении кванта света, столкновение с другой молекулой мономера и с определенной вероятностью образование бирадикала с последующим диспропорционированием на радикалы: hν CH 2=CH−R → CH 2=CH−R* + CH 2=CH−R* → ∙CH(R)CH 2 CH 2 CH(R)∙ → CH 3 CH(R)∙ + R−CH=CH∙
Радикальная полимеризация Инициирование цепи Фотоинициирование Сущность процесса фотоинициирования полимеризации без использования инициаторов или фотосенсибилизаторов заключается в облучении реакционной массы ультрафиолетовым излучением с определенной длиной волны, зависящей от того, разрыва какой двойной связи необходимо добиться. При этом возможны два процесса: § возбуждение молекулы мономера при поглощении кванта света, столкновение с другой молекулой мономера и с определенной вероятностью образование бирадикала с последующим диспропорционированием на радикалы: hν CH 2=CH−R → CH 2=CH−R* + CH 2=CH−R* → ∙CH(R)CH 2 CH 2 CH(R)∙ → CH 3 CH(R)∙ + R−CH=CH∙
 Радикальная полимеризация Инициирование цепи Фотоинициирование § распад возбужденной молекулы мономера на свободные радикалы: hνhν M → M* → R∙ + R’∙ C 6 H 5−CH=CH 2 → C 6 H 5∙ + CH 2=CH∙ C 6 H 5−CH=CH 2 → C 6 H 5−CH=CH∙ + H∙ Фотоинициирование вызывают не все поглощенные кванты света! Степень инициирования определяется квантовым выходом фотоинициирования β, который выводится из соотношения: vi = 2βIa где vi – скорость инициирования; Ia – интенсивность поглощенного света.
Радикальная полимеризация Инициирование цепи Фотоинициирование § распад возбужденной молекулы мономера на свободные радикалы: hνhν M → M* → R∙ + R’∙ C 6 H 5−CH=CH 2 → C 6 H 5∙ + CH 2=CH∙ C 6 H 5−CH=CH 2 → C 6 H 5−CH=CH∙ + H∙ Фотоинициирование вызывают не все поглощенные кванты света! Степень инициирования определяется квантовым выходом фотоинициирования β, который выводится из соотношения: vi = 2βIa где vi – скорость инициирования; Ia – интенсивность поглощенного света.
 Радикальная полимеризация Инициирование цепи Фотоинициирование Кроме прямого фотоинициирования используют фотосенсибилизаторы, молекулы которых поглощают излучение, переходят в возбужденное состояние и передают возбуждение молекуле фотоинициатора или мономера: P → P* P* + M → P + M* M* → R∙ + R’∙
Радикальная полимеризация Инициирование цепи Фотоинициирование Кроме прямого фотоинициирования используют фотосенсибилизаторы, молекулы которых поглощают излучение, переходят в возбужденное состояние и передают возбуждение молекуле фотоинициатора или мономера: P → P* P* + M → P + M* M* → R∙ + R’∙
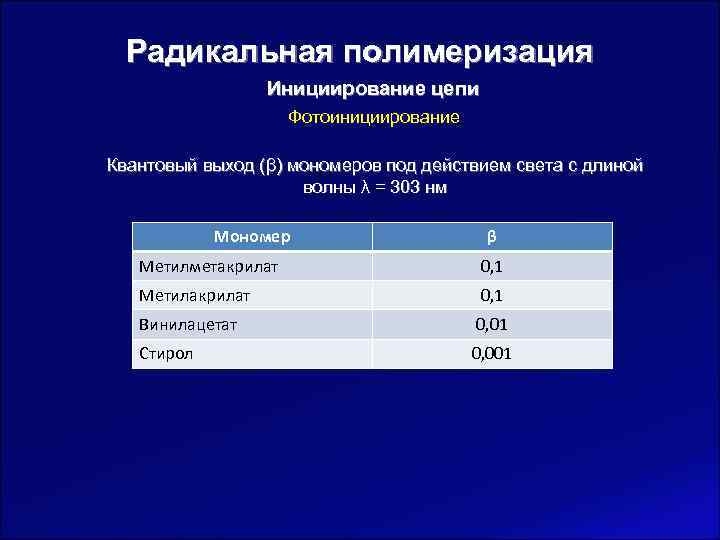
 Радикальная полимеризация Инициирование цепи Фотоинициирование Квантовый выход (β) мономеров под действием света с длиной волны λ = 303 нм Мономер β Метилметакрилат 0, 1 Метилакрилат 0, 1 Винилацетат 0, 01 Стирол 0, 001
Радикальная полимеризация Инициирование цепи Фотоинициирование Квантовый выход (β) мономеров под действием света с длиной волны λ = 303 нм Мономер β Метилметакрилат 0, 1 Метилакрилат 0, 1 Винилацетат 0, 01 Стирол 0, 001
 Радикальная полимеризация Инициирование цепи Радиационное инициирование Инициирование полимеризации может проводиться облучением ионизирующим излучением ( α -, β -, γ -лучи, ускоренные электроны, протоны и др. ). облучение CH 2=CHX ∙CH 2−CHX+ + e− ∙CH 2−CHX+ + CH 2=CHX ∙CH 2−CHX−CH 2−CHX+ e− + CH 2=CHX ∙CH 2−CHX−
Радикальная полимеризация Инициирование цепи Радиационное инициирование Инициирование полимеризации может проводиться облучением ионизирующим излучением ( α -, β -, γ -лучи, ускоренные электроны, протоны и др. ). облучение CH 2=CHX ∙CH 2−CHX+ + e− ∙CH 2−CHX+ + CH 2=CHX ∙CH 2−CHX−CH 2−CHX+ e− + CH 2=CHX ∙CH 2−CHX−
 Радикальная полимеризация Рост цепи k 2 RMn∙ + M RMn+1∙ Скорость реакции роста цепи выражается формулой: v = k 2[M]∙[Mn∙] При этом принимается, что константа k 2 не зависит от длины макрорадикала (это справедливо при n > 3 – 5). Величина k 2 зависит от реакционной способности мономера и макрорадикала.
Радикальная полимеризация Рост цепи k 2 RMn∙ + M RMn+1∙ Скорость реакции роста цепи выражается формулой: v = k 2[M]∙[Mn∙] При этом принимается, что константа k 2 не зависит от длины макрорадикала (это справедливо при n > 3 – 5). Величина k 2 зависит от реакционной способности мономера и макрорадикала.
 Радикальная полимеризация Рост цепи «Голова к хвосту» : k 2 ~CH 2−CHX∙ + CH 2=CHX ~CH 2−CHX−CH 2−CHX∙ «Голова к голове» : ~CH 2−CHX∙ + XCH=CH 2 ~CH 2−CHX−XCH−CH 2∙ «Хвост к хвосту» : ~CH 2−CH 2∙ + CH 2=CHX ~CHX−CH 2−CHX∙ «Хвост к голове» : ~CH 2−CH 2∙ + XCH=CH 2 ~CHX−CH 2−XCH−CH 2∙
Радикальная полимеризация Рост цепи «Голова к хвосту» : k 2 ~CH 2−CHX∙ + CH 2=CHX ~CH 2−CHX−CH 2−CHX∙ «Голова к голове» : ~CH 2−CHX∙ + XCH=CH 2 ~CH 2−CHX−XCH−CH 2∙ «Хвост к хвосту» : ~CH 2−CH 2∙ + CH 2=CHX ~CHX−CH 2−CHX∙ «Хвост к голове» : ~CH 2−CH 2∙ + XCH=CH 2 ~CHX−CH 2−XCH−CH 2∙
 Радикальная полимеризация Обрыв цепи при радикальной полимеризации заключается в бимолекулярном взаимодействии двух макрорадикалов. При этом могут протекать две реакции: диспропорционирование или рекомбинация. k'3 2 Mn. CH 2−CHX∙ Mn. CH 2−CH 2 X + Mn. CH=CHX k''3 2 Mn. CH 2−CHX∙ Mn. CH 2−CHX−CH 2 Mn Скорость реакции обрыва цепи определяется уравнением: v = k 3[M∙]2 (k 3 = k’ 3 + k’’ 3)
Радикальная полимеризация Обрыв цепи при радикальной полимеризации заключается в бимолекулярном взаимодействии двух макрорадикалов. При этом могут протекать две реакции: диспропорционирование или рекомбинация. k'3 2 Mn. CH 2−CHX∙ Mn. CH 2−CH 2 X + Mn. CH=CHX k''3 2 Mn. CH 2−CHX∙ Mn. CH 2−CHX−CH 2 Mn Скорость реакции обрыва цепи определяется уравнением: v = k 3[M∙]2 (k 3 = k’ 3 + k’’ 3)
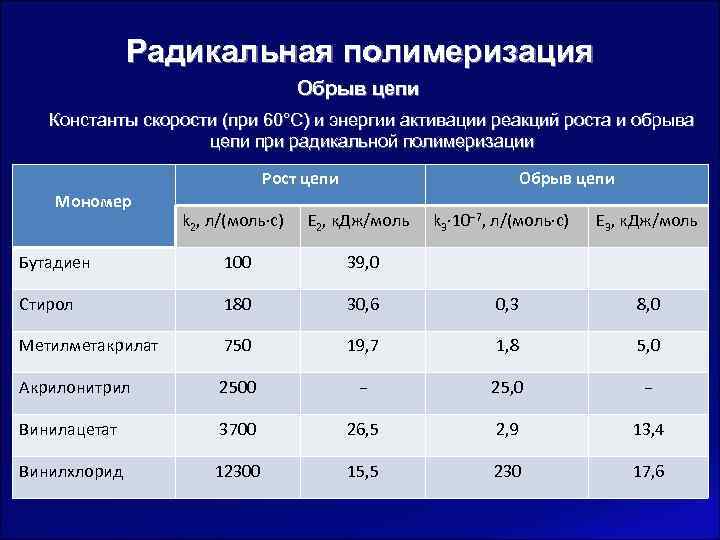
 Радикальная полимеризация Обрыв цепи Константы скорости (при 60°С) и энергии активации реакций роста и обрыва цепи при радикальной полимеризации Рост цепи Обрыв цепи Мономер k 2, л/(моль∙с) Е 2, к. Дж/моль k 3∙ 10− 7, л/(моль∙с) Е 3, к. Дж/моль Бутадиен 100 39, 0 Стирол 180 30, 6 0, 3 8, 0 Метилметакрилат 750 19, 7 1, 8 5, 0 Акрилонитрил 2500 − 25, 0 − Винилацетат 3700 26, 5 2, 9 13, 4 Винилхлорид 12300 15, 5 230 17, 6
Радикальная полимеризация Обрыв цепи Константы скорости (при 60°С) и энергии активации реакций роста и обрыва цепи при радикальной полимеризации Рост цепи Обрыв цепи Мономер k 2, л/(моль∙с) Е 2, к. Дж/моль k 3∙ 10− 7, л/(моль∙с) Е 3, к. Дж/моль Бутадиен 100 39, 0 Стирол 180 30, 6 0, 3 8, 0 Метилметакрилат 750 19, 7 1, 8 5, 0 Акрилонитрил 2500 − 25, 0 − Винилацетат 3700 26, 5 2, 9 13, 4 Винилхлорид 12300 15, 5 230 17, 6
 Радикальная полимеризация Передача цепи Стадия передачи цепи заключается в переносе активного центра макрорадикала на другую молекулу, присутствующую в растворе (мономер, полимер, инициатор, растворитель). При этом макромолекула теряет возможность дальнейшего роста. k 4 Mn ∙ + B Mn + B∙ В целом реакция передачи цепи приводит к образованию полимера с низкой степенью полимеризации. Передача цепи на макромолекулы приводит к образованию разветвленных, сшитых и привитых полимеров. Реакции роста цепи и передачи цепи конкурируют друг с другом! C = k 4/k 2
Радикальная полимеризация Передача цепи Стадия передачи цепи заключается в переносе активного центра макрорадикала на другую молекулу, присутствующую в растворе (мономер, полимер, инициатор, растворитель). При этом макромолекула теряет возможность дальнейшего роста. k 4 Mn ∙ + B Mn + B∙ В целом реакция передачи цепи приводит к образованию полимера с низкой степенью полимеризации. Передача цепи на макромолекулы приводит к образованию разветвленных, сшитых и привитых полимеров. Реакции роста цепи и передачи цепи конкурируют друг с другом! C = k 4/k 2
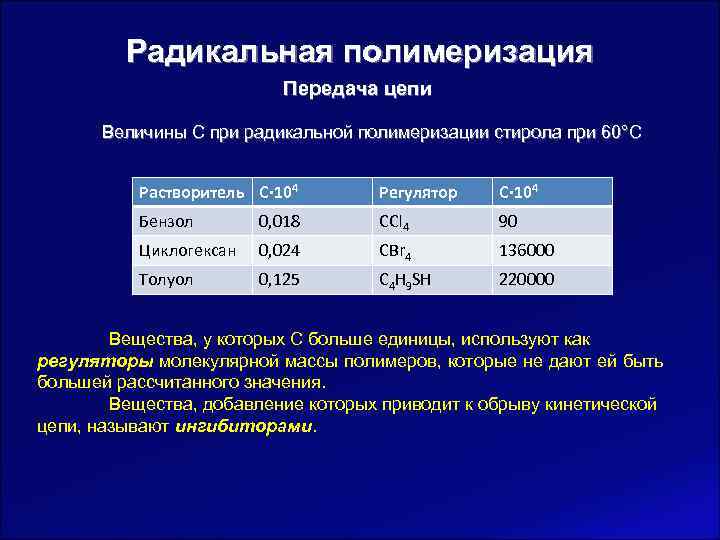
 Радикальная полимеризация Передача цепи Величины С при радикальной полимеризации стирола при 60°С Растворитель C∙ 104 Регулятор C∙ 104 Бензол 0, 018 CCl 4 90 Циклогексан 0, 024 CBr 4 136000 Толуол 0, 125 C 4 H 9 SH 220000 Вещества, у которых С больше единицы, используют как регуляторы молекулярной массы полимеров, которые не дают ей быть большей рассчитанного значения. Вещества, добавление которых приводит к обрыву кинетической цепи, называют ингибиторами.
Радикальная полимеризация Передача цепи Величины С при радикальной полимеризации стирола при 60°С Растворитель C∙ 104 Регулятор C∙ 104 Бензол 0, 018 CCl 4 90 Циклогексан 0, 024 CBr 4 136000 Толуол 0, 125 C 4 H 9 SH 220000 Вещества, у которых С больше единицы, используют как регуляторы молекулярной массы полимеров, которые не дают ей быть большей рассчитанного значения. Вещества, добавление которых приводит к обрыву кинетической цепи, называют ингибиторами.
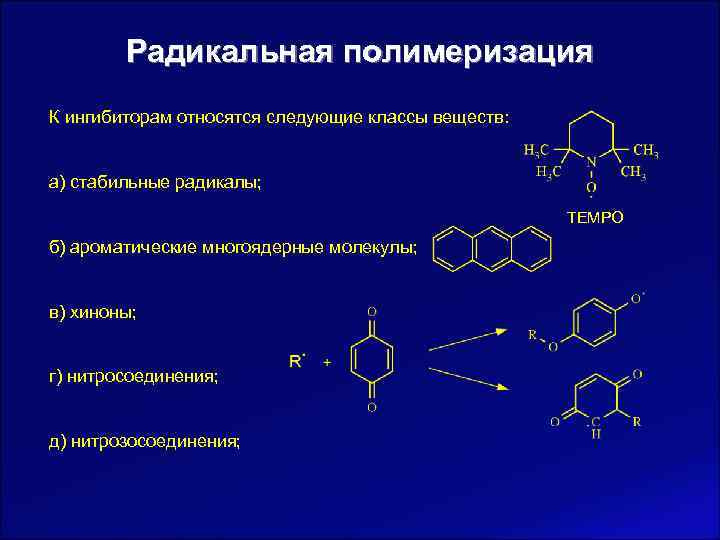
 Радикальная полимеризация К ингибиторам относятся следующие классы веществ: а) стабильные радикалы; TEMPO б) ароматические многоядерные молекулы; в) хиноны; г) нитросоединения; д) нитрозосоединения;
Радикальная полимеризация К ингибиторам относятся следующие классы веществ: а) стабильные радикалы; TEMPO б) ароматические многоядерные молекулы; в) хиноны; г) нитросоединения; д) нитрозосоединения;
 Радикальная полимеризация К ингибиторам относятся следующие классы веществ: е) высокозарядные ионы (Fe 3+, Cu 2+); Fe 3+ + R∙ + H 2 O → Fe 2+ + ROH + H+ ё) некоторые неметаллы (O 2, S, I 2). M R∙ + O 2 → R−O−O∙ → R−O−O−M∙
Радикальная полимеризация К ингибиторам относятся следующие классы веществ: е) высокозарядные ионы (Fe 3+, Cu 2+); Fe 3+ + R∙ + H 2 O → Fe 2+ + ROH + H+ ё) некоторые неметаллы (O 2, S, I 2). M R∙ + O 2 → R−O−O∙ → R−O−O−M∙
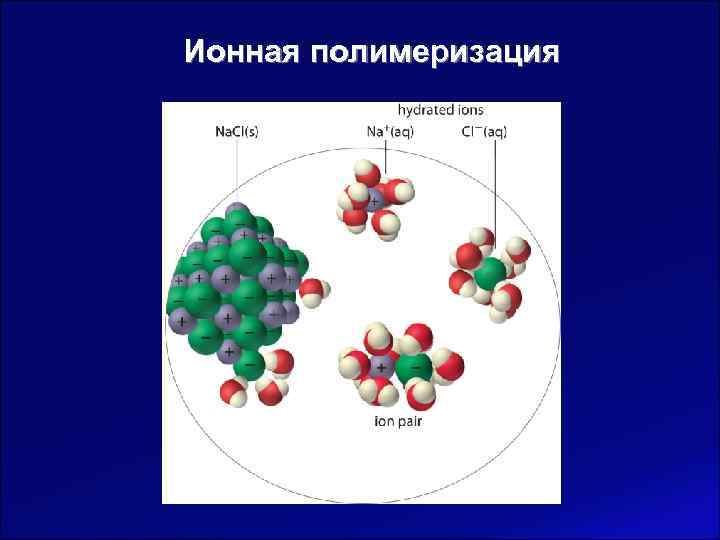
 Ионная полимеризация – цепная полимеризация, при которой активными центрами выступают ионы или ионные пары. Отличия от радикальной полимеризации Чувствительность к Более эффективная полярности растворителя регуляция структуры и массы полимера Невозможность бимолекулярного Более значительное обрыва цепи влияние инициаторов на процесс полимеризации
Ионная полимеризация – цепная полимеризация, при которой активными центрами выступают ионы или ионные пары. Отличия от радикальной полимеризации Чувствительность к Более эффективная полярности растворителя регуляция структуры и массы полимера Невозможность бимолекулярного Более значительное обрыва цепи влияние инициаторов на процесс полимеризации
 Ионная полимеризация радикал карбкатион карбанион Обычно существуют в виде тесной ионной пары
Ионная полимеризация радикал карбкатион карбанион Обычно существуют в виде тесной ионной пары
 Ионная полимеризация
Ионная полимеризация
 Ионная полимеризация Общий механизм k 1 1) Инициирование цепи: М М* ; k 2 2) рост цепи: Мn* + M M*n+1 ; k 3 3) обрыв цепи: Мn * [−M−]n ; k 4 4) передача цепи: Mn* + B [−M−]n + B*.
Ионная полимеризация Общий механизм k 1 1) Инициирование цепи: М М* ; k 2 2) рост цепи: Мn* + M M*n+1 ; k 3 3) обрыв цепи: Мn * [−M−]n ; k 4 4) передача цепи: Mn* + B [−M−]n + B*.
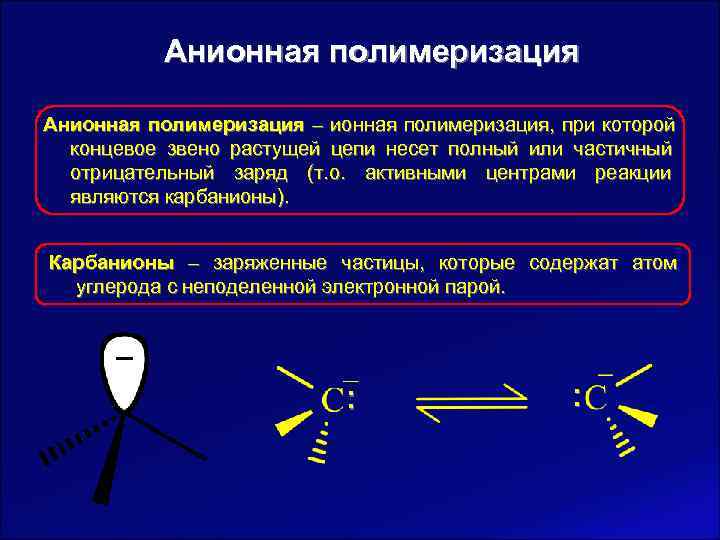
 Анионная полимеризация – ионная полимеризация, при которой концевое звено растущей цепи несет полный или частичный отрицательный заряд (т. о. активными центрами реакции являются карбанионы). Карбанионы – заряженные частицы, которые содержат атом углерода с неподеленной электронной парой. :
Анионная полимеризация – ионная полимеризация, при которой концевое звено растущей цепи несет полный или частичный отрицательный заряд (т. о. активными центрами реакции являются карбанионы). Карбанионы – заряженные частицы, которые содержат атом углерода с неподеленной электронной парой. :
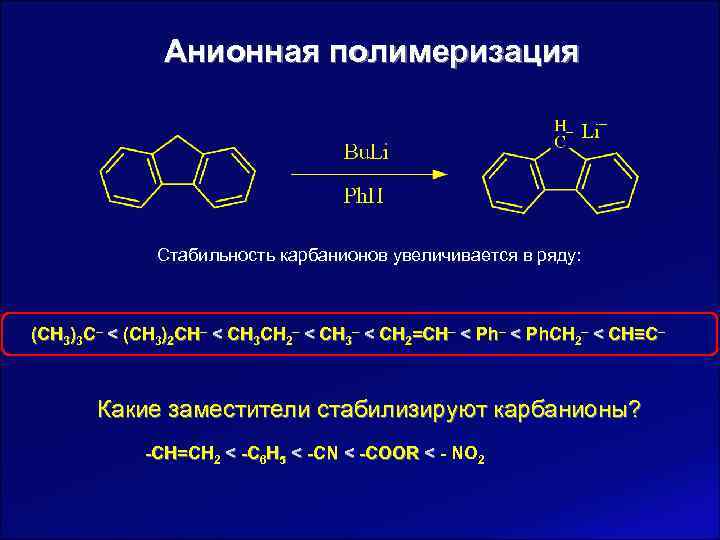
 Анионная полимеризация Стабильность карбанионов увеличивается в ряду: (CH 3)3 C‒ < (CH 3)2 CH‒ < CH 3 CH 2‒ < CH 3‒ < CH 2=CH‒ < Ph. CH 2‒ < CH≡C‒ Какие заместители стабилизируют карбанионы? -CH=CH 2 < -C 6 H 5 < -CN < -COOR < - NO 2
Анионная полимеризация Стабильность карбанионов увеличивается в ряду: (CH 3)3 C‒ < (CH 3)2 CH‒ < CH 3 CH 2‒ < CH 3‒ < CH 2=CH‒ < Ph. CH 2‒ < CH≡C‒ Какие заместители стабилизируют карбанионы? -CH=CH 2 < -C 6 H 5 < -CN < -COOR < - NO 2
 Анионная полимеризация В анионную полимеризацию легко вступают мономеры винилового и дивинилового рядов, содержащие электроноакцепторные заместители у двойной связи, например: нитроэтилен, акрилонитрил, метакрилонитрил, стирол, акриловые и метакриловые эстеры и др. Катализаторами анионной полимеризации служат электронодонорные соединения. Типичные катализаторы: щелочные металлы и их растворы в жидком аммиаке, амиды щелочных металлов, металлоорганические соединения щелочных металлов.
Анионная полимеризация В анионную полимеризацию легко вступают мономеры винилового и дивинилового рядов, содержащие электроноакцепторные заместители у двойной связи, например: нитроэтилен, акрилонитрил, метакрилонитрил, стирол, акриловые и метакриловые эстеры и др. Катализаторами анионной полимеризации служат электронодонорные соединения. Типичные катализаторы: щелочные металлы и их растворы в жидком аммиаке, амиды щелочных металлов, металлоорганические соединения щелочных металлов.
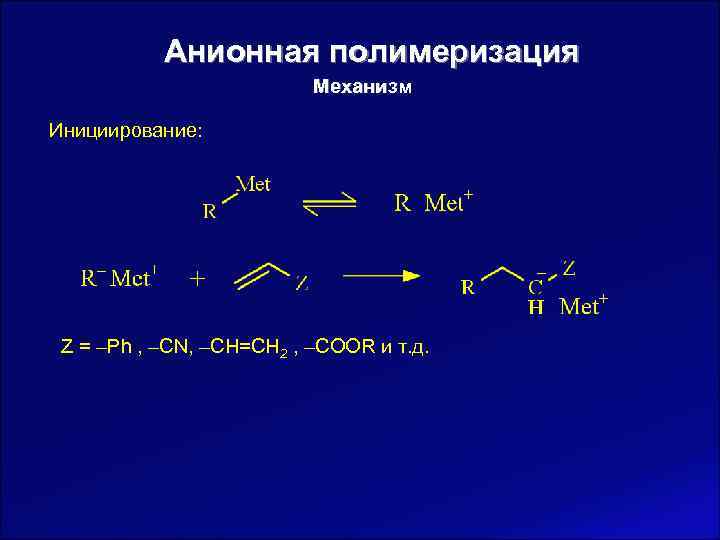
 Анионная полимеризация Механизм Инициирование: Z = ‒Ph , ‒CN, ‒CH=CH 2 , ‒COOR и т. д.
Анионная полимеризация Механизм Инициирование: Z = ‒Ph , ‒CN, ‒CH=CH 2 , ‒COOR и т. д.
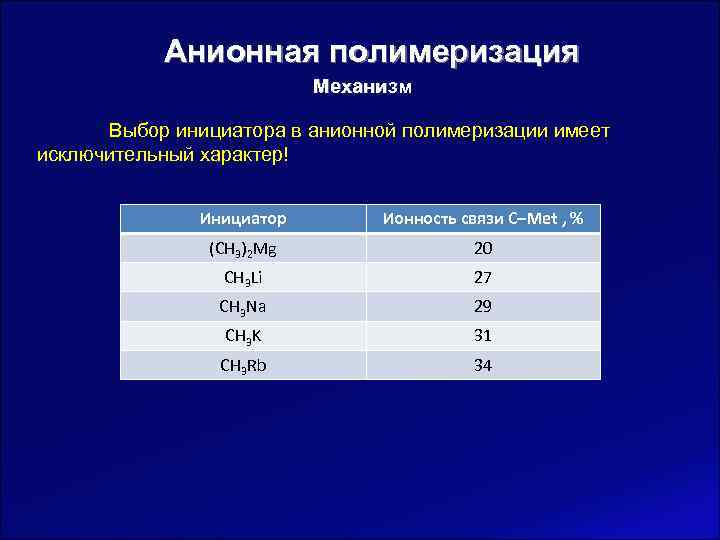
 Анионная полимеризация Механизм Выбор инициатора в анионной полимеризации имеет исключительный характер! Инициатор Ионность связи С‒Met , % (CH 3)2 Mg 20 CH 3 Li 27 CH 3 Na 29 CH 3 K 31 CH 3 Rb 34
Анионная полимеризация Механизм Выбор инициатора в анионной полимеризации имеет исключительный характер! Инициатор Ионность связи С‒Met , % (CH 3)2 Mg 20 CH 3 Li 27 CH 3 Na 29 CH 3 K 31 CH 3 Rb 34
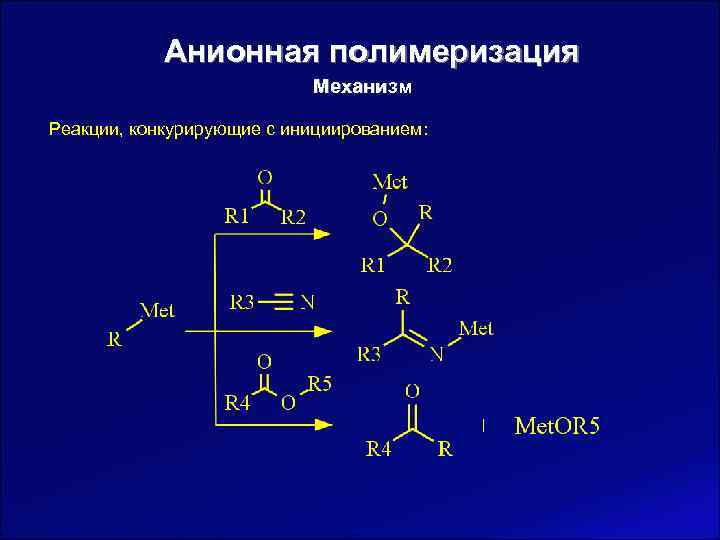
 Анионная полимеризация Механизм Реакции, конкурирующие с инициированием:
Анионная полимеризация Механизм Реакции, конкурирующие с инициированием:
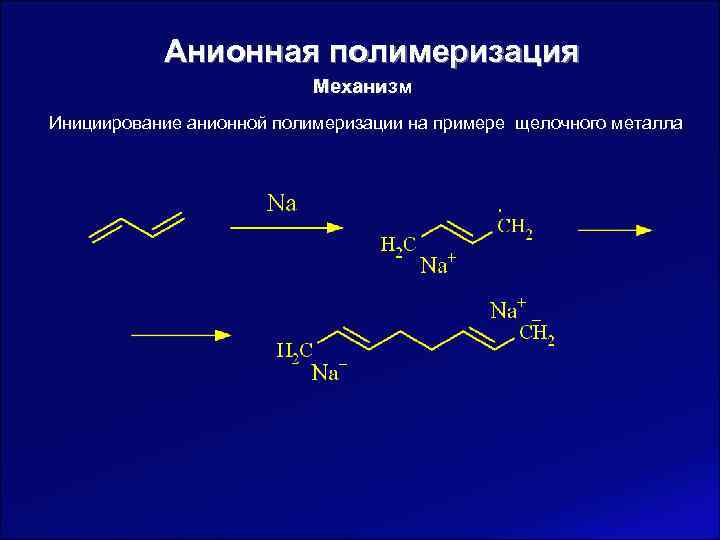
 Анионная полимеризация Механизм Инициирование анионной полимеризации на примере щелочного металла
Анионная полимеризация Механизм Инициирование анионной полимеризации на примере щелочного металла
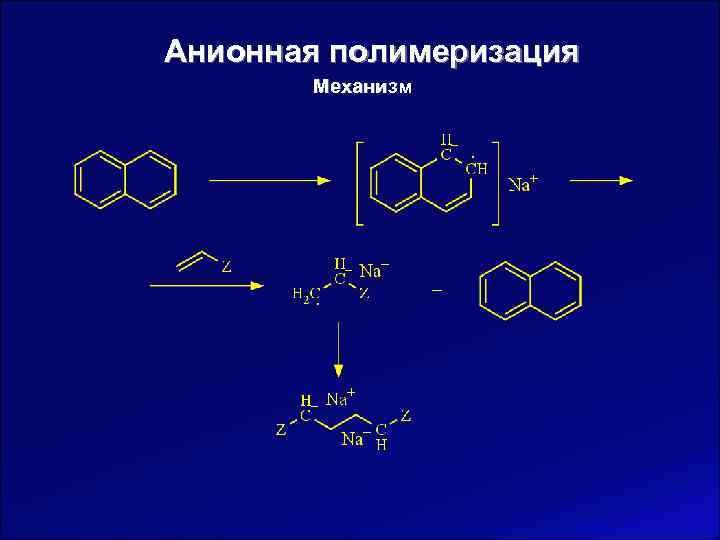
 Анионная полимеризация Механизм
Анионная полимеризация Механизм
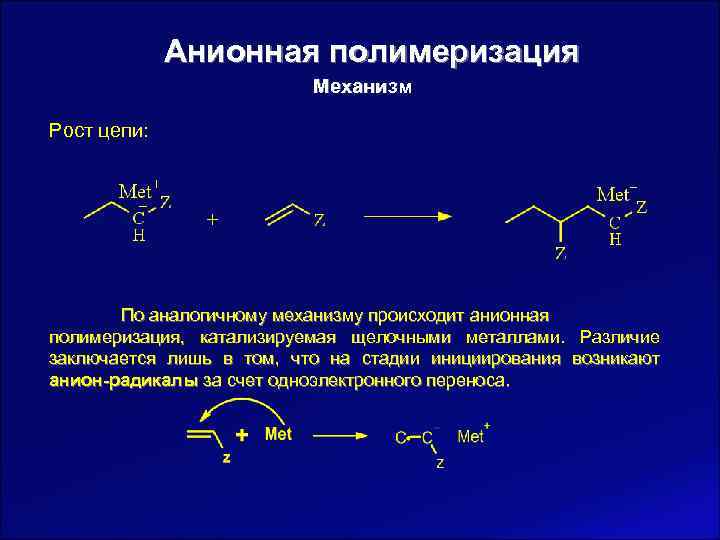
 Анионная полимеризация Механизм Рост цепи: По аналогичному механизму происходит анионная полимеризация, катализируемая щелочными металлами. Различие заключается лишь в том, что на стадии инициирования возникают анион-радикалы за счет одноэлектронного переноса.
Анионная полимеризация Механизм Рост цепи: По аналогичному механизму происходит анионная полимеризация, катализируемая щелочными металлами. Различие заключается лишь в том, что на стадии инициирования возникают анион-радикалы за счет одноэлектронного переноса.
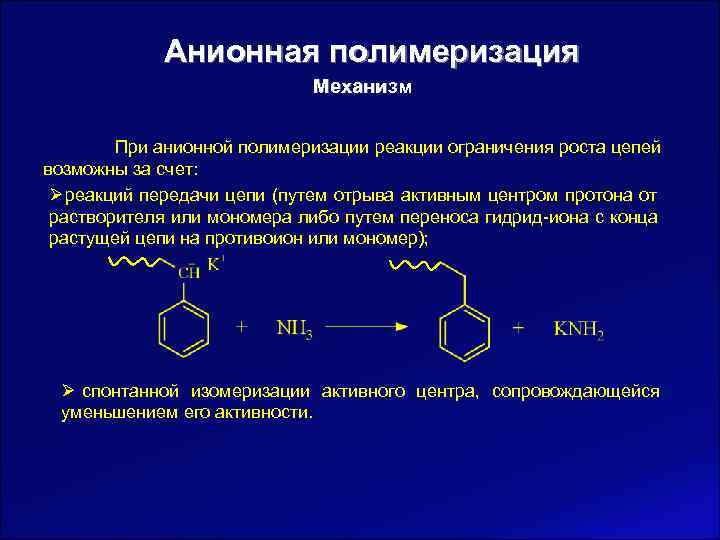
 Анионная полимеризация Механизм При анионной полимеризации реакции ограничения роста цепей возможны за счет: Ø реакций передачи цепи (путем отрыва активным центром протона от растворителя или мономера либо путем переноса гидрид-иона с конца растущей цепи на противоион или мономер); Ø спонтанной изомеризации активного центра, сопровождающейся уменьшением его активности.
Анионная полимеризация Механизм При анионной полимеризации реакции ограничения роста цепей возможны за счет: Ø реакций передачи цепи (путем отрыва активным центром протона от растворителя или мономера либо путем переноса гидрид-иона с конца растущей цепи на противоион или мономер); Ø спонтанной изомеризации активного центра, сопровождающейся уменьшением его активности.
 Анионная полимеризация Характер кинетики такого процесса определяется только отношением констант скорости инициирования (kин) и роста (kp). При kин >> kp для скорости реакции и молекулярной массы выполняются простые соотношения: Где: q – степень превращения Vp = kp[M][I 0] n = 1 или 2 [M 0] – исходная концентрация мономера [I 0] - исходная концентрация инициатора Pn = nq([M 0]/[I 0]) При kин >> kp , т. е. в условиях, когда все цепи начинают расти практически одновременно, возможно образование полимеров с узким молекулярно-массовым распределением. Мw / Мn < 1, 1
Анионная полимеризация Характер кинетики такого процесса определяется только отношением констант скорости инициирования (kин) и роста (kp). При kин >> kp для скорости реакции и молекулярной массы выполняются простые соотношения: Где: q – степень превращения Vp = kp[M][I 0] n = 1 или 2 [M 0] – исходная концентрация мономера [I 0] - исходная концентрация инициатора Pn = nq([M 0]/[I 0]) При kин >> kp , т. е. в условиях, когда все цепи начинают расти практически одновременно, возможно образование полимеров с узким молекулярно-массовым распределением. Мw / Мn < 1, 1
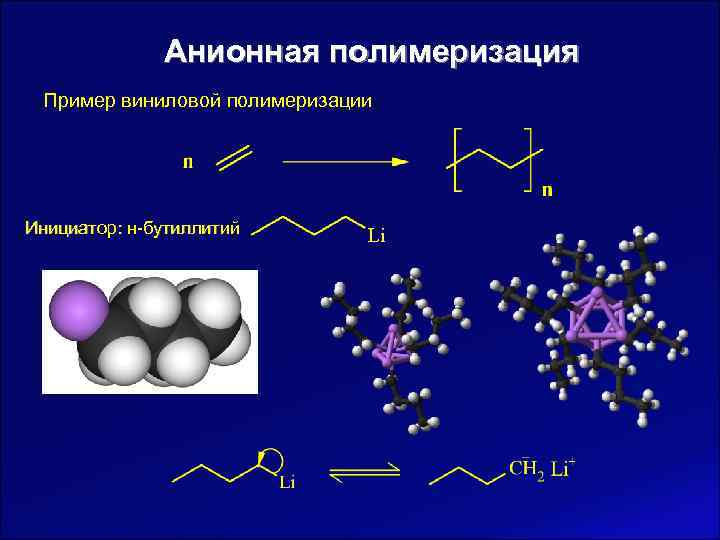
 Анионная полимеризация Пример виниловой полимеризации Инициатор: н-бутиллитий
Анионная полимеризация Пример виниловой полимеризации Инициатор: н-бутиллитий
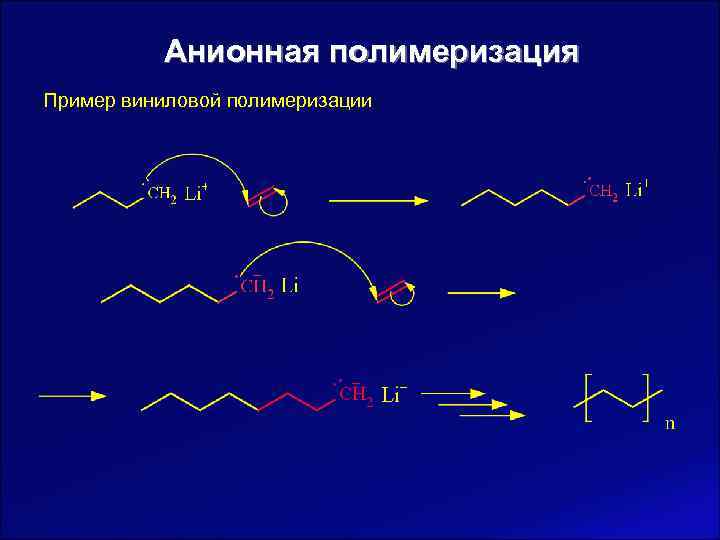
 Анионная полимеризация Пример виниловой полимеризации
Анионная полимеризация Пример виниловой полимеризации
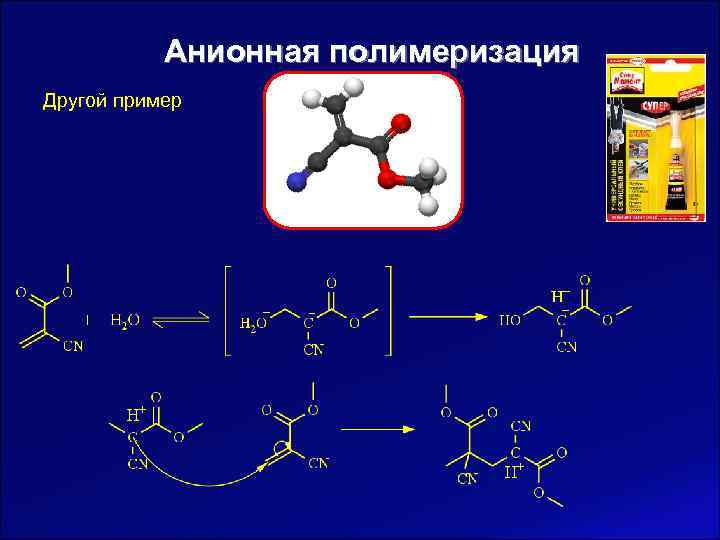
 Анионная полимеризация Другой пример
Анионная полимеризация Другой пример
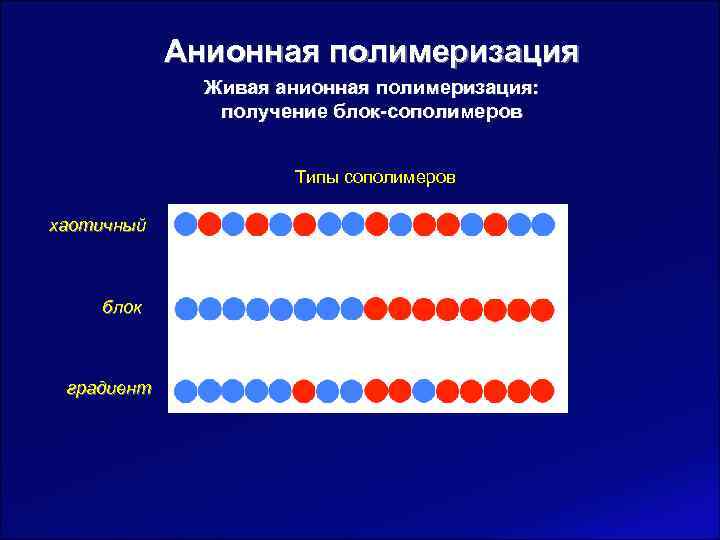
 Анионная полимеризация Живая анионная полимеризация: получение блок-сополимеров Типы сополимеров хаотичный блок градиент
Анионная полимеризация Живая анионная полимеризация: получение блок-сополимеров Типы сополимеров хаотичный блок градиент
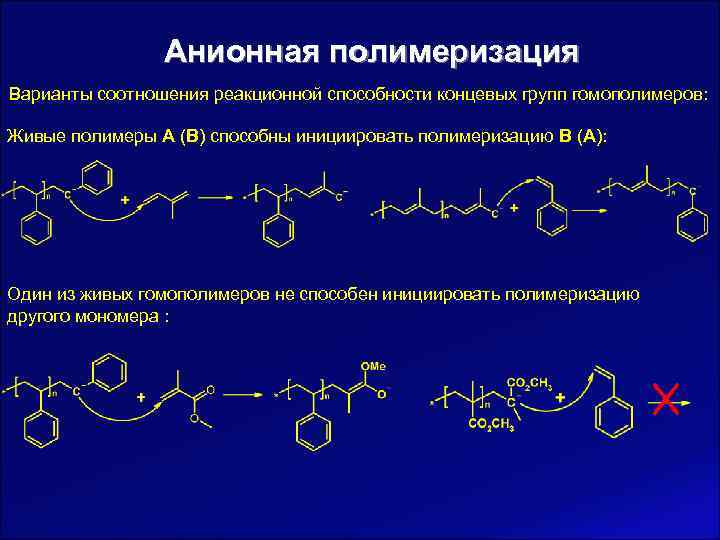
 Анионная полимеризация Варианты соотношения реакционной способности концевых групп гомополимеров: Живые полимеры А (В) способны инициировать полимеризацию В (А): Один из живых гомополимеров не способен инициировать полимеризацию другого мономера :
Анионная полимеризация Варианты соотношения реакционной способности концевых групп гомополимеров: Живые полимеры А (В) способны инициировать полимеризацию В (А): Один из живых гомополимеров не способен инициировать полимеризацию другого мономера :
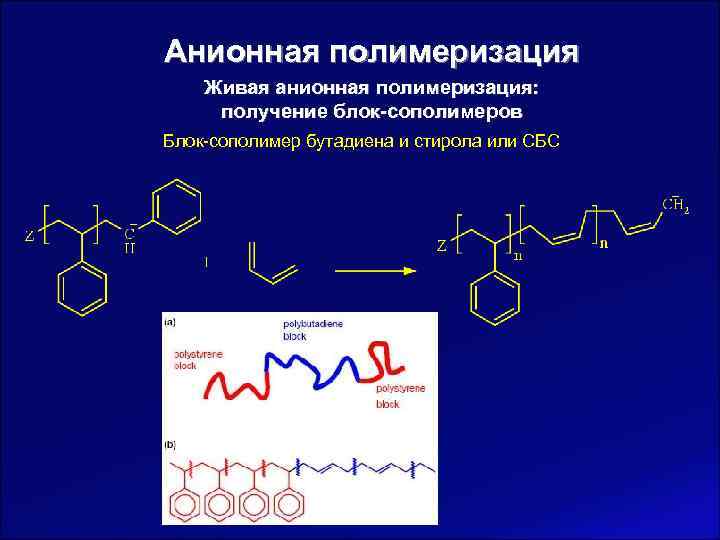
 Анионная полимеризация Живая анионная полимеризация: получение блок-сополимеров Блок-сополимер бутадиена и стирола или СБС
Анионная полимеризация Живая анионная полимеризация: получение блок-сополимеров Блок-сополимер бутадиена и стирола или СБС
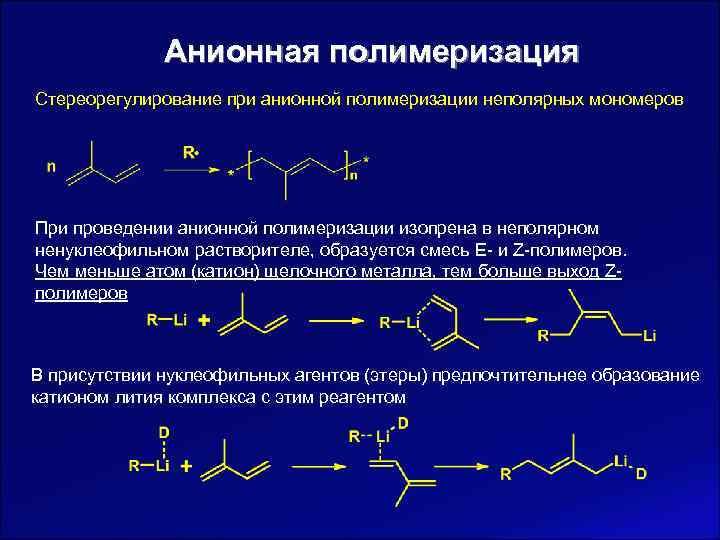
 Анионная полимеризация Стереорегулирование при анионной полимеризации неполярных мономеров При проведении анионной полимеризации изопрена в неполярном ненуклеофильном растворителе, образуется смесь E- и Z-полимеров. Чем меньше атом (катион) щелочного металла, тем больше выход Z- полимеров В присутствии нуклеофильных агентов (этеры) предпочтительнее образование катионом лития комплекса с этим реагентом
Анионная полимеризация Стереорегулирование при анионной полимеризации неполярных мономеров При проведении анионной полимеризации изопрена в неполярном ненуклеофильном растворителе, образуется смесь E- и Z-полимеров. Чем меньше атом (катион) щелочного металла, тем больше выход Z- полимеров В присутствии нуклеофильных агентов (этеры) предпочтительнее образование катионом лития комплекса с этим реагентом
 Анионная полимеризация Стереорегулирование при анионной полимеризации полярных мономеров В отличие от диеновых полимеров, для которых характерна E/Z – стереоизомерия, для виниловых полимеров возможна только оптическая изомерия ( в случае возникновения асимметрического центра) Изотактический Синдиотактический Атактический
Анионная полимеризация Стереорегулирование при анионной полимеризации полярных мономеров В отличие от диеновых полимеров, для которых характерна E/Z – стереоизомерия, для виниловых полимеров возможна только оптическая изомерия ( в случае возникновения асимметрического центра) Изотактический Синдиотактический Атактический
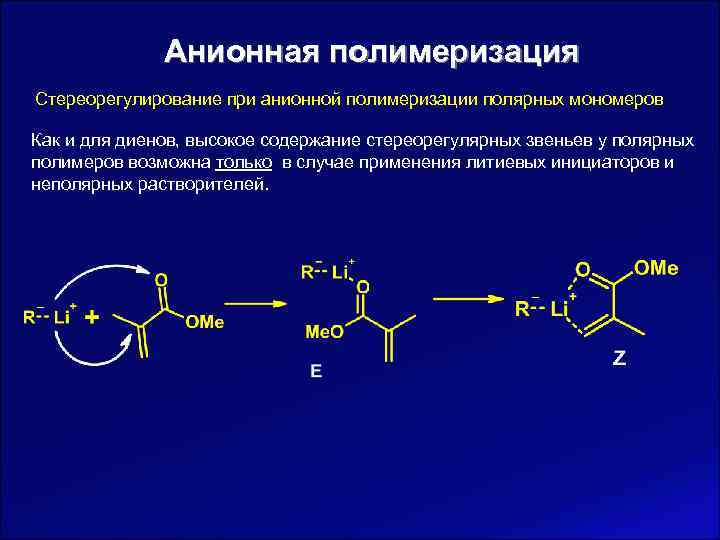
 Анионная полимеризация Стереорегулирование при анионной полимеризации полярных мономеров Как и для диенов, высокое содержание стереорегулярных звеньев у полярных полимеров возможна только в случае применения литиевых инициаторов и неполярных растворителей.
Анионная полимеризация Стереорегулирование при анионной полимеризации полярных мономеров Как и для диенов, высокое содержание стереорегулярных звеньев у полярных полимеров возможна только в случае применения литиевых инициаторов и неполярных растворителей.
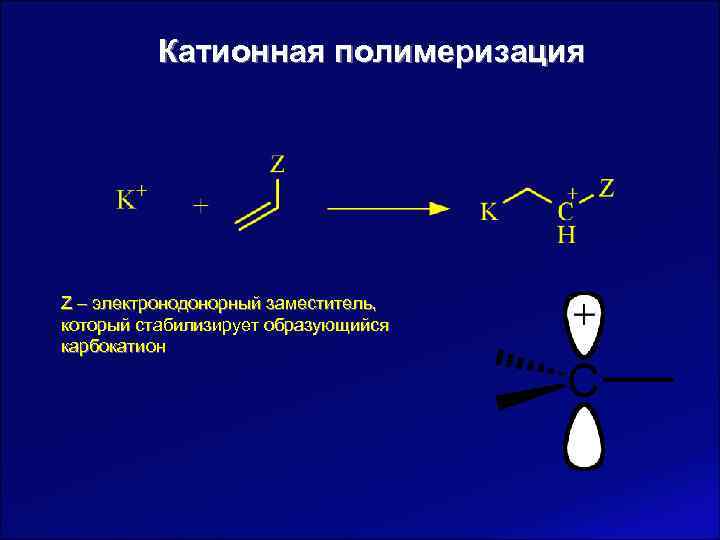
 Катионная полимеризация Z – электронодонорный заместитель, который стабилизирует образующийся карбокатион
Катионная полимеризация Z – электронодонорный заместитель, который стабилизирует образующийся карбокатион
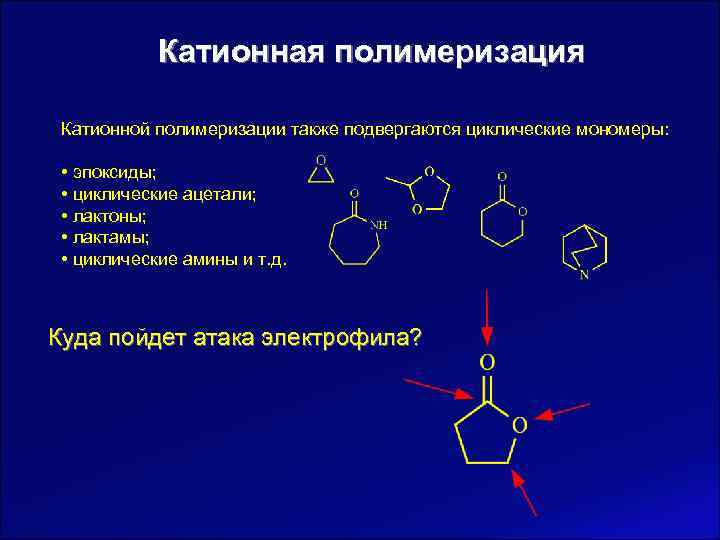
 Катионная полимеризация Катионной полимеризации также подвергаются циклические мономеры: • эпоксиды; • циклические ацетали; • лактоны; • лактамы; • циклические амины и т. д. Куда пойдет атака электрофила?
Катионная полимеризация Катионной полимеризации также подвергаются циклические мономеры: • эпоксиды; • циклические ацетали; • лактоны; • лактамы; • циклические амины и т. д. Куда пойдет атака электрофила?
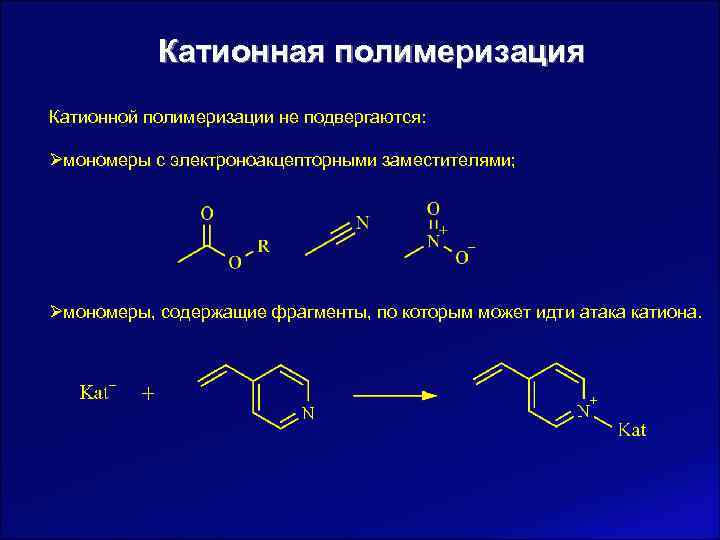
 Катионная полимеризация Катионной полимеризации не подвергаются: Øмономеры с электроноакцепторными заместителями; Øмономеры, содержащие фрагменты, по которым может идти атака катиона.
Катионная полимеризация Катионной полимеризации не подвергаются: Øмономеры с электроноакцепторными заместителями; Øмономеры, содержащие фрагменты, по которым может идти атака катиона.
 Катионная полимеризация Инициаторы (катализаторы) катионной полимеризации: Øкислоты Бренстеда; Øкислоты Льюиса; Øгалогены и интергалогениды; Øоксониевые соли.
Катионная полимеризация Инициаторы (катализаторы) катионной полимеризации: Øкислоты Бренстеда; Øкислоты Льюиса; Øгалогены и интергалогениды; Øоксониевые соли.
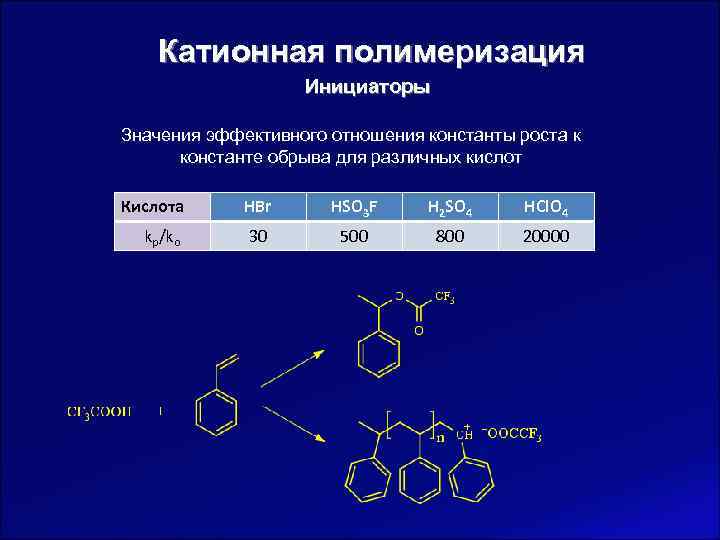
 Катионная полимеризация Инициаторы Значения эффективного отношения константы роста к константе обрыва для различных кислот Кислота HBr HSO 3 F H 2 SO 4 HCl. O 4 kp/ko 30 500 800 20000
Катионная полимеризация Инициаторы Значения эффективного отношения константы роста к константе обрыва для различных кислот Кислота HBr HSO 3 F H 2 SO 4 HCl. O 4 kp/ko 30 500 800 20000
 Катионная полимеризация Инициаторы Кислоты Льюиса (Al. Cl 3, BF 3, Sn. Cl 4, Ti. Cl 4 и др. ) становятся каталитически активными в присутствии протонодонорных соединений, галогеналканов или этеров, называемых сокатализаторами. Каталитические комплексы, непосредственно инициирующие полимеризацию, образуются при взаимодействии кислот Льюиса с сокатализаторами.
Катионная полимеризация Инициаторы Кислоты Льюиса (Al. Cl 3, BF 3, Sn. Cl 4, Ti. Cl 4 и др. ) становятся каталитически активными в присутствии протонодонорных соединений, галогеналканов или этеров, называемых сокатализаторами. Каталитические комплексы, непосредственно инициирующие полимеризацию, образуются при взаимодействии кислот Льюиса с сокатализаторами.
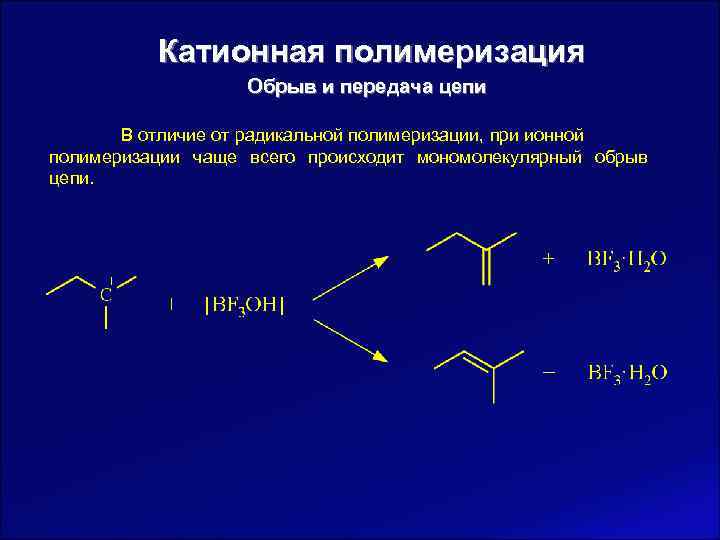
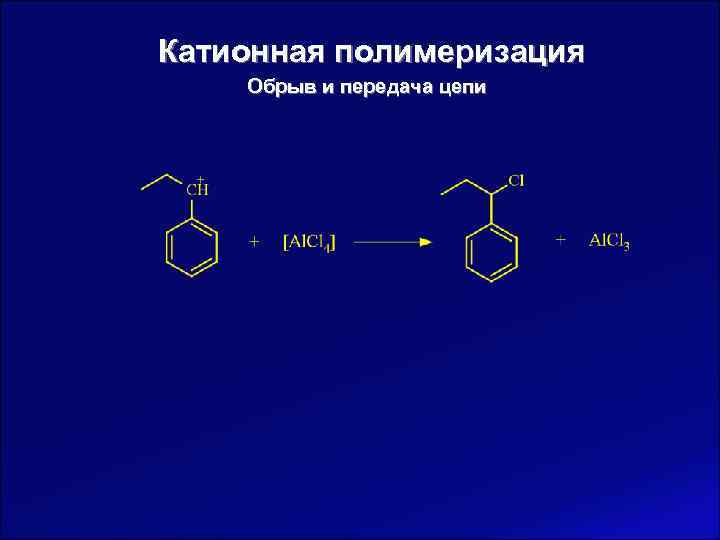
 Катионная полимеризация Обрыв и передача цепи В отличие от радикальной полимеризации, при ионной полимеризации чаще всего происходит мономолекулярный обрыв цепи.
Катионная полимеризация Обрыв и передача цепи В отличие от радикальной полимеризации, при ионной полимеризации чаще всего происходит мономолекулярный обрыв цепи.
 Катионная полимеризация Обрыв и передача цепи
Катионная полимеризация Обрыв и передача цепи
 Катионная полимеризация Кинетика Скорость инициирования зависит от концентрации инициатора: vи = kи [I] Скорость роста цепи пропорциональна концентрации активного карбокатиона и мономера: vр = kр[Pn+][M] Скорость обрыва цепи: vоб = kоб[Pn+]
Катионная полимеризация Кинетика Скорость инициирования зависит от концентрации инициатора: vи = kи [I] Скорость роста цепи пропорциональна концентрации активного карбокатиона и мономера: vр = kр[Pn+][M] Скорость обрыва цепи: vоб = kоб[Pn+]

