L_1_T_1__Vodorod.ppt
- Количество слайдов: 39
 ТЕМА № 1: Водород «Н» Атам вадароду, iзатопы. Распаўсюджанне вадароду ў прыродзе. Асаблiвасцi месцазнаходжання ў перыядычнай сiстэме. Характарыстыка малекулы вадароду з пунктаў погляду МВС i ММА: энергiя, даўжыня i кратнасць сувязi. Фiзiчныя i хiмiчныя ўласцiвасцi вадароду. Злучэннi вадароду з металамi i неметаламi: ступень акiслення атамаў элементаў у малекулах i прырода хiмiчнай сувязi ў iх, кiслотна-асноўныя i акiсляльнааднаўленчыя ўласцiвасцi. Прымяненне вадароду. Правілы бяспекі пры рабоце з 1 вадародам
ТЕМА № 1: Водород «Н» Атам вадароду, iзатопы. Распаўсюджанне вадароду ў прыродзе. Асаблiвасцi месцазнаходжання ў перыядычнай сiстэме. Характарыстыка малекулы вадароду з пунктаў погляду МВС i ММА: энергiя, даўжыня i кратнасць сувязi. Фiзiчныя i хiмiчныя ўласцiвасцi вадароду. Злучэннi вадароду з металамi i неметаламi: ступень акiслення атамаў элементаў у малекулах i прырода хiмiчнай сувязi ў iх, кiслотна-асноўныя i акiсляльнааднаўленчыя ўласцiвасцi. Прымяненне вадароду. Правілы бяспекі пры рабоце з 1 вадародам
 • Атом водорода «Н» по сравнению с атомами других элементов наиболее простой по структуре: 1 s 1. • Основная особенность атома водорода заключается в том что в отличие от всех других элементов (кроме гелия) его валентный электрон находится непосредственно в сфере действия атомного ядра у него нет промежуточного электронного слоя. Положительный ион водорода Н+ представляет собой элементарную частицу – протон. 2
• Атом водорода «Н» по сравнению с атомами других элементов наиболее простой по структуре: 1 s 1. • Основная особенность атома водорода заключается в том что в отличие от всех других элементов (кроме гелия) его валентный электрон находится непосредственно в сфере действия атомного ядра у него нет промежуточного электронного слоя. Положительный ион водорода Н+ представляет собой элементарную частицу – протон. 2
 • Если исходить из числа валентных электронов его атома, то водород должен находиться в I группе, что подтверждается также сходством спектров щелочных металлов и водорода. Со щелочными металлами сближает водород и его способность давать в растворах гидратированный положительно однозарядный ион Н+(р) (гидроксоний-катион Н 3 О+). Однако в состоянии свободного иона Н+(р) – протона – он не имеет ничего общего с ионами щелочных металлов. Кроме того, энергия ионизации атома водорода намного больше энергии ионизации 3 атомов щелочных металлов.
• Если исходить из числа валентных электронов его атома, то водород должен находиться в I группе, что подтверждается также сходством спектров щелочных металлов и водорода. Со щелочными металлами сближает водород и его способность давать в растворах гидратированный положительно однозарядный ион Н+(р) (гидроксоний-катион Н 3 О+). Однако в состоянии свободного иона Н+(р) – протона – он не имеет ничего общего с ионами щелочных металлов. Кроме того, энергия ионизации атома водорода намного больше энергии ионизации 3 атомов щелочных металлов.
 Если же исходить из того, что для завершения внешнего электронного слоя атому водорода не хватает одного электрона, то водород следует поместить в VII группе. Кроме того, как и атомы галогенов, атомы водорода характеризуются высокими значениями энергии ионизации. Многие ученые помещают водород в VII группу периодической системы. Вместе с тем водород элемент особый, и размещение его в той или иной группе таблицы в значительной мере условно. Можно даже предложить выделить для водорода объединенную «клетку» в I периоде от I до VII колонок включительно. 4
Если же исходить из того, что для завершения внешнего электронного слоя атому водорода не хватает одного электрона, то водород следует поместить в VII группе. Кроме того, как и атомы галогенов, атомы водорода характеризуются высокими значениями энергии ионизации. Многие ученые помещают водород в VII группу периодической системы. Вместе с тем водород элемент особый, и размещение его в той или иной группе таблицы в значительной мере условно. Можно даже предложить выделить для водорода объединенную «клетку» в I периоде от I до VII колонок включительно. 4
 • Энергия ионизации атома водорода (13, 6 э. В, 1312 к. Дж/моль) столь велика, что соединения водорода (I) даже с такими сильными окислителями, как фтор и кислород, не могут быть ионными. Если же допустить образование в соединениях ионов Н+ , их исключительно высокое поляризующее действие все равно привело бы к образованию ковалентной связи. По этим же причинам ионы Н+ не могут существовать в свободном состоянии при обычных химических явлениях. • В водных растворах он существует в виде ионагидроксония Н 3 О+. • Специфика строения атома водорода обусловливает особый, присущий - только соединениям водорода (I) 5 вид химической связи - водородную связь.
• Энергия ионизации атома водорода (13, 6 э. В, 1312 к. Дж/моль) столь велика, что соединения водорода (I) даже с такими сильными окислителями, как фтор и кислород, не могут быть ионными. Если же допустить образование в соединениях ионов Н+ , их исключительно высокое поляризующее действие все равно привело бы к образованию ковалентной связи. По этим же причинам ионы Н+ не могут существовать в свободном состоянии при обычных химических явлениях. • В водных растворах он существует в виде ионагидроксония Н 3 О+. • Специфика строения атома водорода обусловливает особый, присущий - только соединениям водорода (I) 5 вид химической связи - водородную связь.
 • Процесс образования отрицательного нона Н- из атома экзотермический (сродство к электрону 0, 75 э. В, невелико), для водорода в степени окисления -1 возможны ионные соединения. • Водород – неметаллический элемент. В соединениях он может иметь степени окисления -1 и +1. Для него, как и для галогенов, характерны ионные соединения, в которых он выступает в качестве простого иона Н-. • При положительной степени окисления водород образует только ковалентные соединения и может играть роль комплексообразователя в анионных комплексах. 6
• Процесс образования отрицательного нона Н- из атома экзотермический (сродство к электрону 0, 75 э. В, невелико), для водорода в степени окисления -1 возможны ионные соединения. • Водород – неметаллический элемент. В соединениях он может иметь степени окисления -1 и +1. Для него, как и для галогенов, характерны ионные соединения, в которых он выступает в качестве простого иона Н-. • При положительной степени окисления водород образует только ковалентные соединения и может играть роль комплексообразователя в анионных комплексах. 6
 Водород – самый распространенный элемент космоса: он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят их водорода. Там он присутствует, скорее всего в металлическом виде. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. • Водород широко распространен в природе. Содержание его в земной коре (атмосфера, литосфера и гидросфера) составляет 0, 88 % массы земной коры. Он входит в состав воды, глин, каменного и бурого угля, нефти и т. п. , а также во все животные и растительные организмы. • В свободном состоянии водород встречается крайне редко. tпл. = -259, 1 о. С; tкип. = -252, 6 о. С. 7
Водород – самый распространенный элемент космоса: он составляет до половины массы Солнца и большинства звезд. Гигантские планеты солнечной системы Юпитер и Сатурн в основном состоят их водорода. Там он присутствует, скорее всего в металлическом виде. Он присутствует в атмосфере ряда планет, в кометах, газовых туманностях и межзвездном газе. • Водород широко распространен в природе. Содержание его в земной коре (атмосфера, литосфера и гидросфера) составляет 0, 88 % массы земной коры. Он входит в состав воды, глин, каменного и бурого угля, нефти и т. п. , а также во все животные и растительные организмы. • В свободном состоянии водород встречается крайне редко. tпл. = -259, 1 о. С; tкип. = -252, 6 о. С. 7
 • • • Водород имеет три изотопа с массовыми числами соответственно 1, 2, 3: 1 Н р (e) протий 2 D (2 H) (p+n) (e) дейтерий 3 T (3 H) (p+2 n) (e) тритий Протий и дейтерий – стабильные изотопы. Простые вещества. Имея один электрон, водород образует лишь двухатомные молекулы с электронной конфигурацией невозбужденного состояния. 8
• • • Водород имеет три изотопа с массовыми числами соответственно 1, 2, 3: 1 Н р (e) протий 2 D (2 H) (p+n) (e) дейтерий 3 T (3 H) (p+2 n) (e) тритий Протий и дейтерий – стабильные изотопы. Простые вещества. Имея один электрон, водород образует лишь двухатомные молекулы с электронной конфигурацией невозбужденного состояния. 8
 • При этом возможны молекулы легкого водорода – протия Н 2, тяжелого водорода – дейтерия D 2, трития T 2, протодейтерия HD, прототрития HT, дейтеротрития DT. • Особенностью водорода является наличие двух сортов молекул: орто-формы о-Н 2 (спины протонов параллельны), пара-формы р-Н 2 (спины протонов антипараллельны). При комнатной температуре в равновесной смеси находится 75% о-Н 2. При температуре близкой к 0 К смесь содержит только р-Н 2. • Молекулы водорода отличаются большой прочностью и малой поляризуемостью, незначительными размерами и малой массой, а 9 следовательно, большой подвижностью.
• При этом возможны молекулы легкого водорода – протия Н 2, тяжелого водорода – дейтерия D 2, трития T 2, протодейтерия HD, прототрития HT, дейтеротрития DT. • Особенностью водорода является наличие двух сортов молекул: орто-формы о-Н 2 (спины протонов параллельны), пара-формы р-Н 2 (спины протонов антипараллельны). При комнатной температуре в равновесной смеси находится 75% о-Н 2. При температуре близкой к 0 К смесь содержит только р-Н 2. • Молекулы водорода отличаются большой прочностью и малой поляризуемостью, незначительными размерами и малой массой, а 9 следовательно, большой подвижностью.
 • Водород проявляет и восстановительные, и окислительные свойства. В обычных условиях благодаря прочности молекул он сравнительно мало активен и непосредственно взаимодействует лишь со фтором и на свету с хлором. При нагревании же вступает во взаимодействие с многими неметаллами — хлором, бромом, кислородом, азотом и пр. (С бором, алюминием, кремнием, фосфором - практически не взаимодействует. ) Восстановительная способность водорода используется для получения некоторых простых веществ из оксидов и галогенидов: Cu. O + H 2 = Cu + H 2 O • В качестве окислителя водород взаимодействует с активными металлами: 2 Na + H 2 = 2 Na. H 10
• Водород проявляет и восстановительные, и окислительные свойства. В обычных условиях благодаря прочности молекул он сравнительно мало активен и непосредственно взаимодействует лишь со фтором и на свету с хлором. При нагревании же вступает во взаимодействие с многими неметаллами — хлором, бромом, кислородом, азотом и пр. (С бором, алюминием, кремнием, фосфором - практически не взаимодействует. ) Восстановительная способность водорода используется для получения некоторых простых веществ из оксидов и галогенидов: Cu. O + H 2 = Cu + H 2 O • В качестве окислителя водород взаимодействует с активными металлами: 2 Na + H 2 = 2 Na. H 10
 • В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива (водяного и паровоздушного газов) и коксового газа. В основе производства водорода лежат каталитические (Fe 2 O 3 – Cr 2 O 3, Al 2 O 3, K 2 O…) реакции взаимодействия с водяным паром (конверсии) соответственно углеводородов (главным образом метана) и оксида (II) углерода, например: 800°С СН 4 + Н 2 О СО + 3 Н 2, Н 0298 = 206, 2 к. Дж; 600 °С, kat. СО + Н 2 О СО 2 + Н 2, Н 0298 = — 41, 2 к. Дж. • Водород получают также неполным окислением углеводородов, например: 2 СН 4 + О 2 = 2 СО + 4 Н 2, Но 298= — 71, 3 к. Дж. 11
• В промышленности водород получают главным образом из природных и попутных газов, продуктов газификации топлива (водяного и паровоздушного газов) и коксового газа. В основе производства водорода лежат каталитические (Fe 2 O 3 – Cr 2 O 3, Al 2 O 3, K 2 O…) реакции взаимодействия с водяным паром (конверсии) соответственно углеводородов (главным образом метана) и оксида (II) углерода, например: 800°С СН 4 + Н 2 О СО + 3 Н 2, Н 0298 = 206, 2 к. Дж; 600 °С, kat. СО + Н 2 О СО 2 + Н 2, Н 0298 = — 41, 2 к. Дж. • Водород получают также неполным окислением углеводородов, например: 2 СН 4 + О 2 = 2 СО + 4 Н 2, Но 298= — 71, 3 к. Дж. 11
 В связи с уменьшением запасов углеводородного сырья большой интерес приобретает метод получения водорода восстановлением водяного пара раскаленным углем: С + Н 2 О = СО + Н 2, Но 298 = 131, 3 к. Дж. • При этом образуется генераторный газ. Затраты энергии на его получение можно скомпенсировать за счет реакции неполного окисления угля: 2 С + О 2 = 2 СО, Но 298 = -221, 0 к. Дж. • При комбинировании этих двух процессов получается водяной газ, состоящий в основном из смеси Н 2 и СО. • 12
В связи с уменьшением запасов углеводородного сырья большой интерес приобретает метод получения водорода восстановлением водяного пара раскаленным углем: С + Н 2 О = СО + Н 2, Но 298 = 131, 3 к. Дж. • При этом образуется генераторный газ. Затраты энергии на его получение можно скомпенсировать за счет реакции неполного окисления угля: 2 С + О 2 = 2 СО, Но 298 = -221, 0 к. Дж. • При комбинировании этих двух процессов получается водяной газ, состоящий в основном из смеси Н 2 и СО. • 12
 Водород широко используется в химической промышленности для синтеза аммиака, метанола, хлорида водорода, для гидрогенизации твердого и жидкого тяжелого топлива, жиров и т. д. В смеси с СО (в виде водяного газа) применяется как топливо. При горении водорода в кислороде возникает высокая температура (до 2600 °С), используемая для сварки и резки тугоплавких металлов, кварца и др. Жидкий водород используют как одно из наиболее эффективных реактивных топлив. В атомной энергетике для осуществления ядерных реакций большое значение имеют изотопы водорода — тритий и дейтерий. 13
Водород широко используется в химической промышленности для синтеза аммиака, метанола, хлорида водорода, для гидрогенизации твердого и жидкого тяжелого топлива, жиров и т. д. В смеси с СО (в виде водяного газа) применяется как топливо. При горении водорода в кислороде возникает высокая температура (до 2600 °С), используемая для сварки и резки тугоплавких металлов, кварца и др. Жидкий водород используют как одно из наиболее эффективных реактивных топлив. В атомной энергетике для осуществления ядерных реакций большое значение имеют изотопы водорода — тритий и дейтерий. 13
 Соединения со степенью окисления водорода -1. В зависимости от природы связанного с ним элемента атомы водорода в соединениях могут быть поляризованы положительно (степень окисления +1 соединения элементов IVA-VIIA) или отрицательно (степень окисления -1 гидриды металлов IА-IIIА групп металлов ). • Кроме того, имеется группа соединений в которых связь Э — Н близка к неполярной. Эти соединения в соответствующих условиях можно рассматривать и как производные Н+1, и как производные Н-1. 14
Соединения со степенью окисления водорода -1. В зависимости от природы связанного с ним элемента атомы водорода в соединениях могут быть поляризованы положительно (степень окисления +1 соединения элементов IVA-VIIA) или отрицательно (степень окисления -1 гидриды металлов IА-IIIА групп металлов ). • Кроме того, имеется группа соединений в которых связь Э — Н близка к неполярной. Эти соединения в соответствующих условиях можно рассматривать и как производные Н+1, и как производные Н-1. 14
 В тех случаях, когда водород выступает в качестве окислителя, он ведет себя как галоген, образуя аналогичные галогенидам гидриды. Однако образование иона Н- из молекулы Н 2 – процесс эндотермический (энтальпия образования Н- составляет Но 298 = + 150, 5 к. Дж/моль): ½ H 2 (г) = Н (г), Но 298 = 217, 4 к. Дж/моль Н (г) + e- = Н- (г), Но 298 = -66, 9 к. Дж/моль ____________________ ½ H 2 (г) + e- = Н- (г), Но 298 = 150, 5 к. Дж/моль Поэтому по окислительной активности водород 15 существенно уступает галогенам.
В тех случаях, когда водород выступает в качестве окислителя, он ведет себя как галоген, образуя аналогичные галогенидам гидриды. Однако образование иона Н- из молекулы Н 2 – процесс эндотермический (энтальпия образования Н- составляет Но 298 = + 150, 5 к. Дж/моль): ½ H 2 (г) = Н (г), Но 298 = 217, 4 к. Дж/моль Н (г) + e- = Н- (г), Но 298 = -66, 9 к. Дж/моль ____________________ ½ H 2 (г) + e- = Н- (г), Но 298 = 150, 5 к. Дж/моль Поэтому по окислительной активности водород 15 существенно уступает галогенам.
 В зависимости от природы связанного с ним элемента атомы водорода могут быть поляризованы положительно или отрицательно. Li. H Be. H 2 B 2 H 6 CH 4 H 3 N H 2 O HF Na. H Mg. H 2 Al. H 3 Si. H 4 H 3 P H 2 S HCl KH Ca. H 2 Ga. H 3 Ge. H 4 As. H 3 H 2 Se HBr Rb. H Sr. H 2 соединения Н-1 In. H 3 Sn. H 4 Sb. H 3 промежуточные соединения H 2 Te HI соединения Н+1 Для р-элементов: в пределах каждого периода возрастает их прочность и кислотность. В пределах каждой подгруппы элементов обычно уменьшается прочность водородных 16 соединений.
В зависимости от природы связанного с ним элемента атомы водорода могут быть поляризованы положительно или отрицательно. Li. H Be. H 2 B 2 H 6 CH 4 H 3 N H 2 O HF Na. H Mg. H 2 Al. H 3 Si. H 4 H 3 P H 2 S HCl KH Ca. H 2 Ga. H 3 Ge. H 4 As. H 3 H 2 Se HBr Rb. H Sr. H 2 соединения Н-1 In. H 3 Sn. H 4 Sb. H 3 промежуточные соединения H 2 Te HI соединения Н+1 Для р-элементов: в пределах каждого периода возрастает их прочность и кислотность. В пределах каждой подгруппы элементов обычно уменьшается прочность водородных 16 соединений.
 Ясно выраженный ионный характер проявляют лишь гидриды щелочных и щелочноземельных металлов (KH, Ca. H 2). Ионные гидриды представляют собой белые кристаллические вещества с высокими температурами плавления, т. е. соли. Их расплавы характеризуются высокой электрической проводимостью, при электролизе расплавленных гидридов водород выделяется на аноде. Гидриды sэлементов I группы, как и большинство галогенидов этих элементов, имеют структуру типа Nа. Сl. В химическом отношении ионные гидриды ведут себя как основные соединения. 17
Ясно выраженный ионный характер проявляют лишь гидриды щелочных и щелочноземельных металлов (KH, Ca. H 2). Ионные гидриды представляют собой белые кристаллические вещества с высокими температурами плавления, т. е. соли. Их расплавы характеризуются высокой электрической проводимостью, при электролизе расплавленных гидридов водород выделяется на аноде. Гидриды sэлементов I группы, как и большинство галогенидов этих элементов, имеют структуру типа Nа. Сl. В химическом отношении ионные гидриды ведут себя как основные соединения. 17
 • Ряд гидридов существует в виде сложных структур с цепями и полиэдрами (Be. H 2)n, (Mg. H 2)n, (Al. H 3)n. Это твердые вещества, термически распадающиеся на элементы при температуре 100, 300, 100 о. С соответственно. • Наибольшей устойчивостью отличаются полимерные гидриды легких металлов. • К ковалентным относятся гидриды менее электроотрицательных, чем сам водород, неметаллических элементов, например, гидриды состава Si. Н 4 (Si 3 H 8 -Si 6 H 14) «силаны» и ВH 3 «борин» . ВH 3 в свободном виде не существует, реализуется димерная мостиковая структура В 2 H 6. • Bn. Hn+4 и Bn. Hn+6 - «бораны» соединения с 18 трехцентровыми (делоколизованными) связями.
• Ряд гидридов существует в виде сложных структур с цепями и полиэдрами (Be. H 2)n, (Mg. H 2)n, (Al. H 3)n. Это твердые вещества, термически распадающиеся на элементы при температуре 100, 300, 100 о. С соответственно. • Наибольшей устойчивостью отличаются полимерные гидриды легких металлов. • К ковалентным относятся гидриды менее электроотрицательных, чем сам водород, неметаллических элементов, например, гидриды состава Si. Н 4 (Si 3 H 8 -Si 6 H 14) «силаны» и ВH 3 «борин» . ВH 3 в свободном виде не существует, реализуется димерная мостиковая структура В 2 H 6. • Bn. Hn+4 и Bn. Hn+6 - «бораны» соединения с 18 трехцентровыми (делоколизованными) связями.
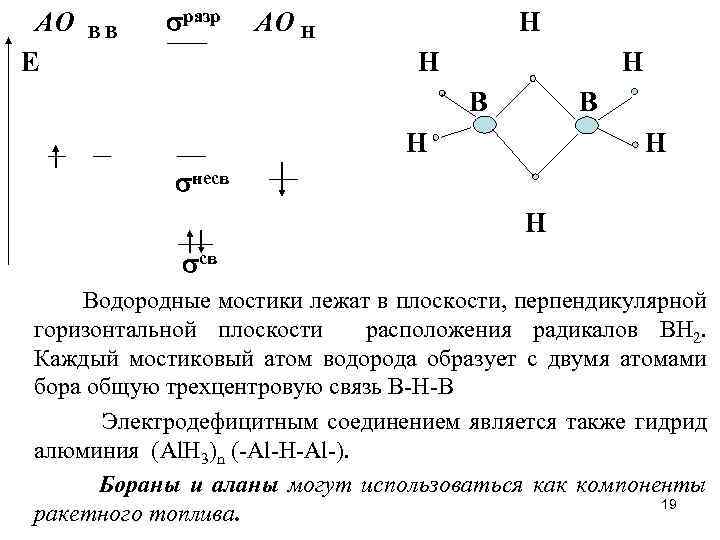 АО Е ВВ разр АО Н Н В В Н Н несв Н св Водородные мостики лежат в плоскости, перпендикулярной горизонтальной плоскости расположения радикалов ВН 2. Каждый мостиковый атом водорода образует с двумя атомами бора общую трехцентровую связь В-Н-В Электродефицитным соединением является также гидрид алюминия (Al. H 3)n (-Al-H-Al-). Бораны и аланы могут использоваться как компоненты 19 ракетного топлива.
АО Е ВВ разр АО Н Н В В Н Н несв Н св Водородные мостики лежат в плоскости, перпендикулярной горизонтальной плоскости расположения радикалов ВН 2. Каждый мостиковый атом водорода образует с двумя атомами бора общую трехцентровую связь В-Н-В Электродефицитным соединением является также гидрид алюминия (Al. H 3)n (-Al-H-Al-). Бораны и аланы могут использоваться как компоненты 19 ракетного топлива.
 • Соединения с преимущественно ковалентным типом связи образуют элементы IVA-VIIA -групп. • К ковалентным относятся также гидриды бора, алюминия, кремния. По химической природе гидриды неметаллов являются кислотными соединениями. • У водорода ОЭО принимается 2, 1. (2, 0 – 2, 2) Si. Н 4 -1 + 3 Н+1 ОН = H 2 Si. O 3 + 4 Н 2 о. (ОЭО Si 1, 74) • Водородные соединения С, Ge, Sn, P, As, Sb не реагируют с водой. 20
• Соединения с преимущественно ковалентным типом связи образуют элементы IVA-VIIA -групп. • К ковалентным относятся также гидриды бора, алюминия, кремния. По химической природе гидриды неметаллов являются кислотными соединениями. • У водорода ОЭО принимается 2, 1. (2, 0 – 2, 2) Si. Н 4 -1 + 3 Н+1 ОН = H 2 Si. O 3 + 4 Н 2 о. (ОЭО Si 1, 74) • Водородные соединения С, Ge, Sn, P, As, Sb не реагируют с водой. 20
 • Различие в химической природе гидридов можно легко установить по их поведению при гидролизе. Характерной особенностью гидролиза гидридов является выделение водорода. Реакция протекает по окислительновосстановительному механизму. Отрицательно поляризованный атом Н-1 в гидриде и положительно поляризованный атом Н+1 в воде переходят в состояние с нулевой степенью окисления: KH-1 + H+1 OH = KOH + H 2 о ; 21
• Различие в химической природе гидридов можно легко установить по их поведению при гидролизе. Характерной особенностью гидролиза гидридов является выделение водорода. Реакция протекает по окислительновосстановительному механизму. Отрицательно поляризованный атом Н-1 в гидриде и положительно поляризованный атом Н+1 в воде переходят в состояние с нулевой степенью окисления: KH-1 + H+1 OH = KOH + H 2 о ; 21
 Различие между основными и кислотными гидридами отчетливо проявляется также при их взаимодействии между собой, Например, по схеме Li. H + BH 3 = Li[BH 4] основной кислотный тетрагидридоборат лития Эта реакция может протекать только в неводных средах (эфире). 22
Различие между основными и кислотными гидридами отчетливо проявляется также при их взаимодействии между собой, Например, по схеме Li. H + BH 3 = Li[BH 4] основной кислотный тетрагидридоборат лития Эта реакция может протекать только в неводных средах (эфире). 22
 Пример амфотерного соединения Al. H 3 + 3 ВН 3 = Al ВH 4 3 (смешанный основный тетрагидридоборат Al гидрид) КН + Al. H 3 = К Al. H 4 основный кислотный тетрагидридоалюминат калия Комплексные гидриды термодинамически более стабильны по сравнению с простыми. Боро- и алюмогидриды щелочных и щелочноземельных металлов плавятся без заметного разложения, хорошо растворяются в органических растворителях. 2 Li Al. H 4 + 8 H 2 O = 2 Li. OH + 2 Al(OH)3 + 8 H 2 23
Пример амфотерного соединения Al. H 3 + 3 ВН 3 = Al ВH 4 3 (смешанный основный тетрагидридоборат Al гидрид) КН + Al. H 3 = К Al. H 4 основный кислотный тетрагидридоалюминат калия Комплексные гидриды термодинамически более стабильны по сравнению с простыми. Боро- и алюмогидриды щелочных и щелочноземельных металлов плавятся без заметного разложения, хорошо растворяются в органических растворителях. 2 Li Al. H 4 + 8 H 2 O = 2 Li. OH + 2 Al(OH)3 + 8 H 2 23
 Комплексные гидриды других металлов получают обменным разложением их галогенидов с боро- и алюмогидридами щелочных металлов, Li Al. H 4 + Sc. Cl 3 = Li Sc. H 4 + Al. Cl 3. ½ H 2/H-1 = -2, 23 В. Следовательно ион H-1 - один из самых сильных восстановителей. Поэтому ионные и комплексные гидриды – сильные восстановители. Находят применение в различных синтезах, для получения водорода, в химическом анализе. Са. Н 2 применяется в качестве осушителя. Стандартные потенциал системы 24
Комплексные гидриды других металлов получают обменным разложением их галогенидов с боро- и алюмогидридами щелочных металлов, Li Al. H 4 + Sc. Cl 3 = Li Sc. H 4 + Al. Cl 3. ½ H 2/H-1 = -2, 23 В. Следовательно ион H-1 - один из самых сильных восстановителей. Поэтому ионные и комплексные гидриды – сильные восстановители. Находят применение в различных синтезах, для получения водорода, в химическом анализе. Са. Н 2 применяется в качестве осушителя. Стандартные потенциал системы 24
 Соединения водорода (I). Положительная поляризация атомов водорода наблюдается в его многочисленных соединениях с ковалентной связью: при обычных условиях это газы (НСl, Н 2 S, Н 3 N), жидкости (Н 2 О, НF, Н 2 SO 4), твердые вещества (Н 3 РО 4, Н 2 Si. О 3). Свойства этих соединений сильно зависят от природы элемента, с которым непосредственно связан водород. 25
Соединения водорода (I). Положительная поляризация атомов водорода наблюдается в его многочисленных соединениях с ковалентной связью: при обычных условиях это газы (НСl, Н 2 S, Н 3 N), жидкости (Н 2 О, НF, Н 2 SO 4), твердые вещества (Н 3 РО 4, Н 2 Si. О 3). Свойства этих соединений сильно зависят от природы элемента, с которым непосредственно связан водород. 25
 Водород в соединениях с неметаллами поляризован положительно. Эти соединения сравнительно малополярны. Даже соединения с галогенами (HCl) представляют собой почти идеальную ковалентную молекулу. Прочность межатомных связей Н-Э и термическая устойчивость летучих гидридов зависит от ОЭО и размера второго элемента. Внутри группы прочность связей уменьшается сверху вниз, внутри периода возрастает слева направо (растет ОЭО, уменьшаются размера атомов). Если взять два элемента с одинаковой ОЭО, более тяжелый образует менее устойчивый летучий гидрид. (Устойчивость метана – СН 4 выше, чем сероводорода H 2 S, хотя ОЭО: сера – 2, 44, углерод 26 2, 50 имеют близкие. )
Водород в соединениях с неметаллами поляризован положительно. Эти соединения сравнительно малополярны. Даже соединения с галогенами (HCl) представляют собой почти идеальную ковалентную молекулу. Прочность межатомных связей Н-Э и термическая устойчивость летучих гидридов зависит от ОЭО и размера второго элемента. Внутри группы прочность связей уменьшается сверху вниз, внутри периода возрастает слева направо (растет ОЭО, уменьшаются размера атомов). Если взять два элемента с одинаковой ОЭО, более тяжелый образует менее устойчивый летучий гидрид. (Устойчивость метана – СН 4 выше, чем сероводорода H 2 S, хотя ОЭО: сера – 2, 44, углерод 26 2, 50 имеют близкие. )
 • Термическая устойчивость летучих водородных соединений уменьшается в группах сверху вниз вплоть до того, что Pb. H 4, Po. H 2 и At. H не получены, а Bi. H 3 разлагается в момент получения. • Чем менее прочна или более полярна связь летучих водородных соединений, тем легче происходит электролитическая ионизация по этой связи в водных растворах. 27
• Термическая устойчивость летучих водородных соединений уменьшается в группах сверху вниз вплоть до того, что Pb. H 4, Po. H 2 и At. H не получены, а Bi. H 3 разлагается в момент получения. • Чем менее прочна или более полярна связь летучих водородных соединений, тем легче происходит электролитическая ионизация по этой связи в водных растворах. 27
 • Для соединений, содержащих связи F – Н, О–Н и N–Н, особо характерна водородная связь. Вследствие этого НF, Н 2 O и Н 3 N проявляют аномально высокие температуры плавления и кипения по сравнению с однотипными бинарным соединениями водорода, образованными остальными элементам данной группы. Вследствие способности образовывать водородные связи и вступать в донорноакцепторное взаимодействие жидкие НF, Н 2 О и Н 3 N являются хорошими ионизирующими растворителями. 28
• Для соединений, содержащих связи F – Н, О–Н и N–Н, особо характерна водородная связь. Вследствие этого НF, Н 2 O и Н 3 N проявляют аномально высокие температуры плавления и кипения по сравнению с однотипными бинарным соединениями водорода, образованными остальными элементам данной группы. Вследствие способности образовывать водородные связи и вступать в донорноакцепторное взаимодействие жидкие НF, Н 2 О и Н 3 N являются хорошими ионизирующими растворителями. 28
 • Присущая водороду, как неметаллическому элементу, тенденция к образованию анионных комплексов — гидрогенатов реализуется, например, в следующих реакциях: KF + HF = K[HF 2]; дифторогидрогенат калия KNO 3 + HNO 3= K[H(NO 3)2] динитратогидрогенат калия 29
• Присущая водороду, как неметаллическому элементу, тенденция к образованию анионных комплексов — гидрогенатов реализуется, например, в следующих реакциях: KF + HF = K[HF 2]; дифторогидрогенат калия KNO 3 + HNO 3= K[H(NO 3)2] динитратогидрогенат калия 29
![• Гидрогенат-комплексы образуются за счет водородной связи: [F Н F]-; [O 2 NO • Гидрогенат-комплексы образуются за счет водородной связи: [F Н F]-; [O 2 NO](https://present5.com/presentation/179731412_176049566/image-30.jpg) • Гидрогенат-комплексы образуются за счет водородной связи: [F Н F]-; [O 2 NO Н ONO 2]-. Они имеют линейное строение. Их образование можно объяснить следующим образом. Орбитали иона НF 2 - возникают за счет линейной комбинации орбитали центрального атома s (1 s-орбиталь Н) и групповых орбиталей периферических атомов 1, 2 (2 рx – орбиталей двух атомов F). 30
• Гидрогенат-комплексы образуются за счет водородной связи: [F Н F]-; [O 2 NO Н ONO 2]-. Они имеют линейное строение. Их образование можно объяснить следующим образом. Орбитали иона НF 2 - возникают за счет линейной комбинации орбитали центрального атома s (1 s-орбиталь Н) и групповых орбиталей периферических атомов 1, 2 (2 рx – орбиталей двух атомов F). 30
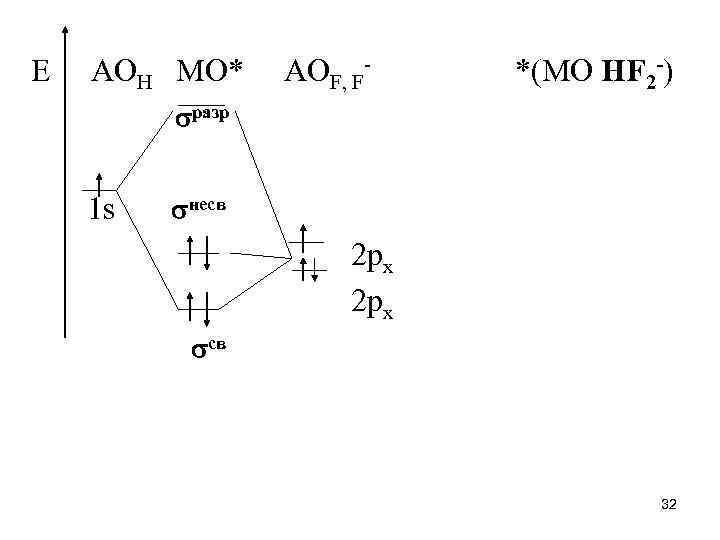
 • По условиям симметрии сочетание s и 1 орбиталей приводит к образованию связывающей sсв - и разрыхляющей sразр - МО иона НF 2 -. ( sсв) ~ s + 1; ( sразр) ~ s - 1. • Для групповой орбитали 2 подходящей по условиям симметрии орбитали центрального атома нет, поэтому в ионе НF 2 - орбиталь 2 играет роль несвязывающей. 31
• По условиям симметрии сочетание s и 1 орбиталей приводит к образованию связывающей sсв - и разрыхляющей sразр - МО иона НF 2 -. ( sсв) ~ s + 1; ( sразр) ~ s - 1. • Для групповой орбитали 2 подходящей по условиям симметрии орбитали центрального атома нет, поэтому в ионе НF 2 - орбиталь 2 играет роль несвязывающей. 31
 Е АОН МО* АОF, F- *(МО НF 2 -) разр 1 s несв 2 px св 32
Е АОН МО* АОF, F- *(МО НF 2 -) разр 1 s несв 2 px св 32
 • Четыре электрона (один от атома Н, два от двух атомов F и один за счет заряда иона) распределяются на связывающей s и несвязывающей молекулярных орбиталях. Нахождение электронов на молекулярной несвязывающей орбитали соответствует концентрации избыточного отрицательного заряда на концевых атомах. Следовательно, гидрогенат-ионы типа НХ 2 - должны быть наиболее стабильными в том случае, когда Х – наиболее электроотрицательные атомы или их группировки. Так, в ионе НF 2 - связь почти в три раза прочнее межмолекулярной водородной связи. • Большинство гидрогенатов может существовать лишь в неводных или насыщенных водных растворах, а также в твердом состоянии. 33
• Четыре электрона (один от атома Н, два от двух атомов F и один за счет заряда иона) распределяются на связывающей s и несвязывающей молекулярных орбиталях. Нахождение электронов на молекулярной несвязывающей орбитали соответствует концентрации избыточного отрицательного заряда на концевых атомах. Следовательно, гидрогенат-ионы типа НХ 2 - должны быть наиболее стабильными в том случае, когда Х – наиболее электроотрицательные атомы или их группировки. Так, в ионе НF 2 - связь почти в три раза прочнее межмолекулярной водородной связи. • Большинство гидрогенатов может существовать лишь в неводных или насыщенных водных растворах, а также в твердом состоянии. 33
 • Атомы водорода входят также в состав гидросолей типа Nа. НS, Nа. НСО 3, Nа. НSO 4. Группы НS-, НСО 3 -, НSO 4 - могут существовать в растворах в виде свободных ионов, называемых соответственно гидросульфид-, гидрокарбонат- и гидросульфат-ионами. 34
• Атомы водорода входят также в состав гидросолей типа Nа. НS, Nа. НСО 3, Nа. НSO 4. Группы НS-, НСО 3 -, НSO 4 - могут существовать в растворах в виде свободных ионов, называемых соответственно гидросульфид-, гидрокарбонат- и гидросульфат-ионами. 34
 • Металлические соединения водорода. Металлическими свойствами обладают водородные соединения d- и f-элементов. Эти соединения получаются в виде металлоподобных темных порошков или хрупкой массы, их электрическая проводимость и теплопроводность типичны для металлов. Это гидриды нестехиометрического состава. Идеализированный состав металлических гидридов чаще всего отвечает формулам МН (VН, Nb. Н, Та. Н), MН 2 (Тi. Н 2, Zг. Н 2, Нf. H 2, Sс. Н 2) и МН 3 (UН 3, Ра. Н 3). • Часто трудно решить, относить ли их к индивидуальным соединениям или к твердым растворам (Ti. H 1, 607 -2, 00). 35
• Металлические соединения водорода. Металлическими свойствами обладают водородные соединения d- и f-элементов. Эти соединения получаются в виде металлоподобных темных порошков или хрупкой массы, их электрическая проводимость и теплопроводность типичны для металлов. Это гидриды нестехиометрического состава. Идеализированный состав металлических гидридов чаще всего отвечает формулам МН (VН, Nb. Н, Та. Н), MН 2 (Тi. Н 2, Zг. Н 2, Нf. H 2, Sс. Н 2) и МН 3 (UН 3, Ра. Н 3). • Часто трудно решить, относить ли их к индивидуальным соединениям или к твердым растворам (Ti. H 1, 607 -2, 00). 35
 • О характере связи в гидридах d- и f-элементов существуют две теории. В соответствии с одной из них водород входит в решетку в виде иона Н+, а свой электрон отдает в зону проводимости металлической структуры. • Согласно другой теории атомы водорода берут электроны из зоны проводимости и находятся в кристаллической решетке гидрида в виде гидрид-ионов Н-. • Можно думать, что в периодической системе от I к V группе имеет место постепенный переход от ионных гидридов (типа солей) к гидридам, в которых водород находится в виде Н +. 36
• О характере связи в гидридах d- и f-элементов существуют две теории. В соответствии с одной из них водород входит в решетку в виде иона Н+, а свой электрон отдает в зону проводимости металлической структуры. • Согласно другой теории атомы водорода берут электроны из зоны проводимости и находятся в кристаллической решетке гидрида в виде гидрид-ионов Н-. • Можно думать, что в периодической системе от I к V группе имеет место постепенный переход от ионных гидридов (типа солей) к гидридам, в которых водород находится в виде Н +. 36
 • Гидриды образуются из простых веществ с понижением энтропии, так как исходные вещества твердое и газообразное, а конечный продукт твердый. Поэтому синтезом из водорода и металла можно получить только те соединения, образование которых сопровождается выделением большого количества теплоты, В противном случае гидриды d- и f-элементов можно получить лишь косвенным путем. 37
• Гидриды образуются из простых веществ с понижением энтропии, так как исходные вещества твердое и газообразное, а конечный продукт твердый. Поэтому синтезом из водорода и металла можно получить только те соединения, образование которых сопровождается выделением большого количества теплоты, В противном случае гидриды d- и f-элементов можно получить лишь косвенным путем. 37
 • Первые три металла каждого семейства dэлементов (т. е. Sc, Ti и V; Y, Zr и Nb; La, Hf и Ta) поглощают водород со значительным экзотермическим эффектом. • Металлы VI-VIII групп по отношению к водороду малоактивны. Так, f. Hо 298 Fe. H 2 = -0, 84 к. Дж/моль. Исключение составляет Pd (в несколько меньшей степени Pt), которые поглощают водород очень активно. (Растворяется до 900 объемов Н 2 на 1 объем Pd. Нагретая до 250 о. С палладиевая мембрана легко пропускает водород, другие же газы через нее не проходят. ) 38
• Первые три металла каждого семейства dэлементов (т. е. Sc, Ti и V; Y, Zr и Nb; La, Hf и Ta) поглощают водород со значительным экзотермическим эффектом. • Металлы VI-VIII групп по отношению к водороду малоактивны. Так, f. Hо 298 Fe. H 2 = -0, 84 к. Дж/моль. Исключение составляет Pd (в несколько меньшей степени Pt), которые поглощают водород очень активно. (Растворяется до 900 объемов Н 2 на 1 объем Pd. Нагретая до 250 о. С палладиевая мембрана легко пропускает водород, другие же газы через нее не проходят. ) 38
 • Металлические гидриды используются как восстановители для получения покрытия из соответствующего металла, а также для получения металлов в виде порошков. В последнем случае металл, например Тi или V, насыщают водородом, образовавшийся хрупкий гидрид растирают в порошок и нагревают в вакууме, в результате чего получают порошок металла. Вследствие пластичности чистых металлов получить их порошки простым растиранием металлов не удается. Гидриды используют также в реакциях гидрирования, синтеза многих соединений d- и fэлементов. Гидрид титана представляет интерес в качестве «хранилища» водорода. 39
• Металлические гидриды используются как восстановители для получения покрытия из соответствующего металла, а также для получения металлов в виде порошков. В последнем случае металл, например Тi или V, насыщают водородом, образовавшийся хрупкий гидрид растирают в порошок и нагревают в вакууме, в результате чего получают порошок металла. Вследствие пластичности чистых металлов получить их порошки простым растиранием металлов не удается. Гидриды используют также в реакциях гидрирования, синтеза многих соединений d- и fэлементов. Гидрид титана представляет интерес в качестве «хранилища» водорода. 39


