8 Электрохимия.pptx
- Количество слайдов: 24
 Тема 1. 8. Электрохимия
Тема 1. 8. Электрохимия
 Предмет изучения • Электрохимия – раздел ФХ, изучающий закономерности взаимных превращений электрической и химической энергии. • Электрохимия рассматривает: - электрическую проводимость растворов; - работу гальванических элементов; - процессы электролиза.
Предмет изучения • Электрохимия – раздел ФХ, изучающий закономерности взаимных превращений электрической и химической энергии. • Электрохимия рассматривает: - электрическую проводимость растворов; - работу гальванических элементов; - процессы электролиза.
 Классификация веществ в зависимости от проводимости электрического тока По электрической проводимости тока все вещества делят на: -проводники (I и II рода), -полупроводники -изоляторы (диэлектрики).
Классификация веществ в зависимости от проводимости электрического тока По электрической проводимости тока все вещества делят на: -проводники (I и II рода), -полупроводники -изоляторы (диэлектрики).
 Проводники I рода К проводникам I рода относят все металлы и сплавы, а также графит. Их электрическая проводимость обусловлена наличием в кристаллических решетках свободных и слабо связанных электронов (электронная проводимость), она не сопровождается переносом вещества и не влечет за собой химического превращения материала, из которого сделан проводник. При повышении температуры снижается.
Проводники I рода К проводникам I рода относят все металлы и сплавы, а также графит. Их электрическая проводимость обусловлена наличием в кристаллических решетках свободных и слабо связанных электронов (электронная проводимость), она не сопровождается переносом вещества и не влечет за собой химического превращения материала, из которого сделан проводник. При повышении температуры снижается.
 Проводники II рода К проводникам II рода относят растворы и расплавы электролитов. Перенос электричества в них осуществляется ионами электролита (ионная проводимость), в результате чего наблюдается химическое разложение вещества. С повышением температуры электрическая проводимость таких проводников увеличивается. Проводники II рода обладают намного меньшей проводимостью по сравнению с проводниками I рода.
Проводники II рода К проводникам II рода относят растворы и расплавы электролитов. Перенос электричества в них осуществляется ионами электролита (ионная проводимость), в результате чего наблюдается химическое разложение вещества. С повышением температуры электрическая проводимость таких проводников увеличивается. Проводники II рода обладают намного меньшей проводимостью по сравнению с проводниками I рода.
 Электрическая проводимость •
Электрическая проводимость •
 Удельная электрическая проводимость •
Удельная электрическая проводимость •
 Эквивалентная электрическая проводимость •
Эквивалентная электрическая проводимость •
 Отношение λv/λ∞, где λ∞ - эквивалентная электрическая проводимость бесконечно разбавленного раствора: - у сильных электролитов называют коэффициентом электрической проводимости fv (кажущейся степенью диссоциации); - у слабых электролитов – истинным значением степени диссоциации электролита в растворе .
Отношение λv/λ∞, где λ∞ - эквивалентная электрическая проводимость бесконечно разбавленного раствора: - у сильных электролитов называют коэффициентом электрической проводимости fv (кажущейся степенью диссоциации); - у слабых электролитов – истинным значением степени диссоциации электролита в растворе .
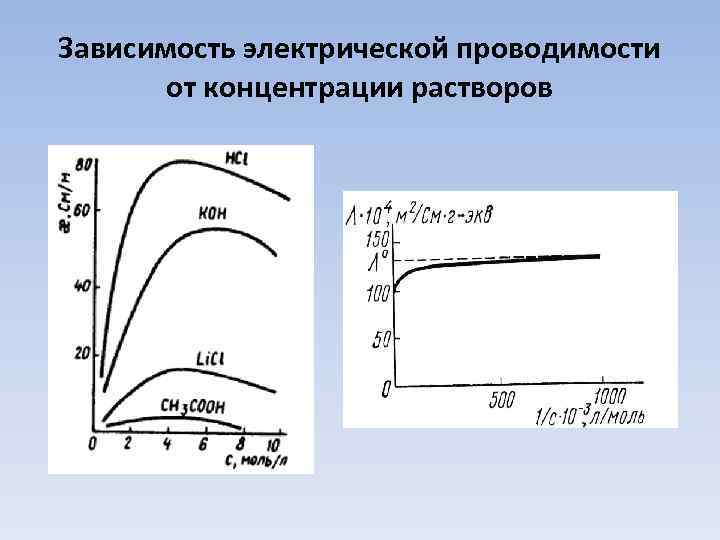 Зависимость электрической проводимости от концентрации растворов
Зависимость электрической проводимости от концентрации растворов
 Скорость и подвижность ионов Скорость перемещения ионов зависит от: - их природы; - природы растворителя; - температуры раствора; - концентрации раствора. Скорости движения ионов Uа и Uк чрезвычайно малы по сравнению со скоростями движения молекул в газах. Подвижность ионов: lк = FUк lа= FUа где F – постоянная Фарадея, F = 9, 65 107 Кл/кг-экв.
Скорость и подвижность ионов Скорость перемещения ионов зависит от: - их природы; - природы растворителя; - температуры раствора; - концентрации раствора. Скорости движения ионов Uа и Uк чрезвычайно малы по сравнению со скоростями движения молекул в газах. Подвижность ионов: lк = FUк lа= FUа где F – постоянная Фарадея, F = 9, 65 107 Кл/кг-экв.
 Закон Кольрауша Эквивалентная электрическая проводимость электролитов при бесконечно большом разбавлении при постоянной температуре определяется только суммой эквивалентных электрических проводимостей (подвижностей) катиона и аниона, т. е. λ∞ = λк + λа λ∞ = F(Uк + Uа) Закон неприменим к концентрированным растворам, перестает быть точным при концентрациях 0, 01 -0, 05 н.
Закон Кольрауша Эквивалентная электрическая проводимость электролитов при бесконечно большом разбавлении при постоянной температуре определяется только суммой эквивалентных электрических проводимостей (подвижностей) катиона и аниона, т. е. λ∞ = λк + λа λ∞ = F(Uк + Uа) Закон неприменим к концентрированным растворам, перестает быть точным при концентрациях 0, 01 -0, 05 н.
 Электролиз • Электролизом называют химическое разложение веществ под влиянием электрического тока, сопровождающееся выделением на электродах продуктов разложения и побочными явлениями. • Электролиз осуществляют в специальных сосудах – электролизерах, которые заполняют раствором или расплавом электролита. В электролит помещают два электрода, соединенные с положительным (анод) и отрицательным (катод) полюсами источника постоянного тока. • Катионы – положительно заряженные ионы металлов и водорода – передвигаются к катоду; анионы – отрицательно заряженные ионы кислотных остатков и ОН- - к аноду.
Электролиз • Электролизом называют химическое разложение веществ под влиянием электрического тока, сопровождающееся выделением на электродах продуктов разложения и побочными явлениями. • Электролиз осуществляют в специальных сосудах – электролизерах, которые заполняют раствором или расплавом электролита. В электролит помещают два электрода, соединенные с положительным (анод) и отрицательным (катод) полюсами источника постоянного тока. • Катионы – положительно заряженные ионы металлов и водорода – передвигаются к катоду; анионы – отрицательно заряженные ионы кислотных остатков и ОН- - к аноду.
 Электролиз безводного хлорида магния: • на катоде: Mg 2+ + 2 e- = Mg 0 • на аноде: 2 Cl- - 2 e- = 2 Cl 0 (первичный процесс) 2 Cl 0 = Cl 2 (вторичный процесс) Следовательно, электролиз представляет собой электронный процесс окисления – восстановления ионов электролита за счет электрической энергии с выделением на электродах электрически нейтральных частиц.
Электролиз безводного хлорида магния: • на катоде: Mg 2+ + 2 e- = Mg 0 • на аноде: 2 Cl- - 2 e- = 2 Cl 0 (первичный процесс) 2 Cl 0 = Cl 2 (вторичный процесс) Следовательно, электролиз представляет собой электронный процесс окисления – восстановления ионов электролита за счет электрической энергии с выделением на электродах электрически нейтральных частиц.
 Первый закон Фарадея Количество вещества (m), выделяющееся при электролизе на электроде, прямо пропорционально количеству электричества, прошедшего через электролит: m = kq k – электрохимический эквивалент – количество вещества (г), выделяемое на электроде при пропускании 1 Кл электричества. q = It m = k. It Количество электричества в кулонах (Кл) равно произведению силы тока (в амперах) на время (в секундах)
Первый закон Фарадея Количество вещества (m), выделяющееся при электролизе на электроде, прямо пропорционально количеству электричества, прошедшего через электролит: m = kq k – электрохимический эквивалент – количество вещества (г), выделяемое на электроде при пропускании 1 Кл электричества. q = It m = k. It Количество электричества в кулонах (Кл) равно произведению силы тока (в амперах) на время (в секундах)
 Второй закон Фарадея При пропускании одинаковых количеств электричества через растворы или расплавы различных электролитов на электродах выделяются количества веществ, пропорциональные их химическим эквивалентам. Для выделения 1 г-экв любого вещества (Э) требуется пропустить через электролит одно и то же количество электричества, равное приблизительно 96500 Кл (постоянная Фарадея). Из пропорции Э : 96500 = k : 1 можно определить величину k k = Э/96500
Второй закон Фарадея При пропускании одинаковых количеств электричества через растворы или расплавы различных электролитов на электродах выделяются количества веществ, пропорциональные их химическим эквивалентам. Для выделения 1 г-экв любого вещества (Э) требуется пропустить через электролит одно и то же количество электричества, равное приблизительно 96500 Кл (постоянная Фарадея). Из пропорции Э : 96500 = k : 1 можно определить величину k k = Э/96500
 Электродвижущие силы Причиной возникновения электрического тока является электродвижущая сила (ЭДС). За меру ЭДС принимают разность потенциалов соприкасающихся тел. Для возникновения ЭДС необходимо два электрода из различных металлов (гальваническая пара) погрузить в растворы солей тех же металлов и обеспечить контакт между электродами и растворами. При этом на границе каждого из электродов с раствором возникает двойной электрический слой. На границе металл – жидкость возникает равновесная разность потенциалов, называемая электродным потенциалом.
Электродвижущие силы Причиной возникновения электрического тока является электродвижущая сила (ЭДС). За меру ЭДС принимают разность потенциалов соприкасающихся тел. Для возникновения ЭДС необходимо два электрода из различных металлов (гальваническая пара) погрузить в растворы солей тех же металлов и обеспечить контакт между электродами и растворами. При этом на границе каждого из электродов с раствором возникает двойной электрический слой. На границе металл – жидкость возникает равновесная разность потенциалов, называемая электродным потенциалом.
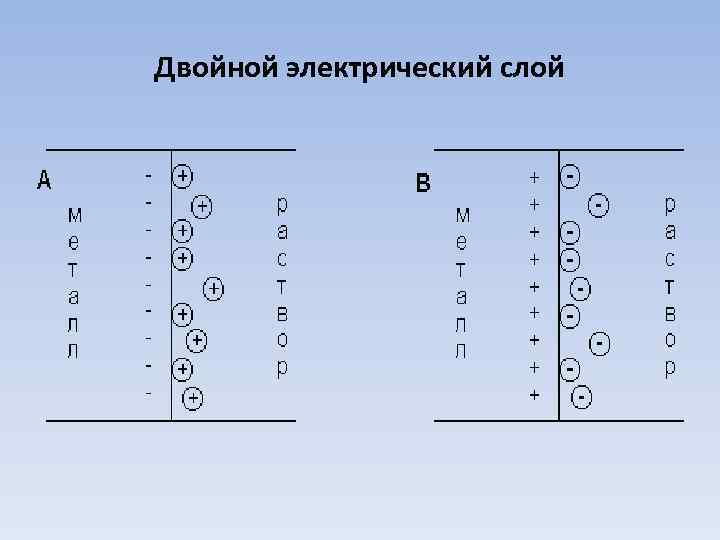 Двойной электрический слой
Двойной электрический слой
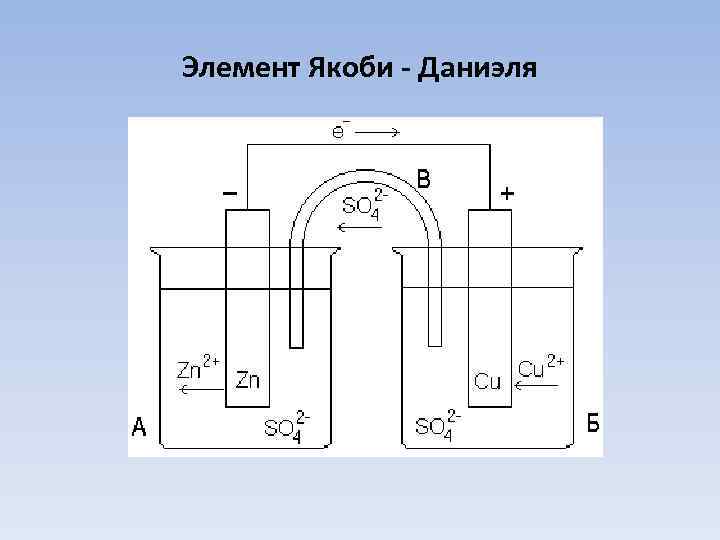 Элемент Якоби - Даниэля
Элемент Якоби - Даниэля
 Элемент Якоби – Даниэля состоит из цинкового и медного электродов, погруженных соответственно в растворы сульфата цинка и сульфата меди (+)Cu Cu. SO 4 Zn(-) Сu 2+ + 2 e- Cu 0 Zn 0 – 2 e- Zn 2+ Cуммарно Zn + Cu. SO 4 Cu + Zn. SO 4
Элемент Якоби – Даниэля состоит из цинкового и медного электродов, погруженных соответственно в растворы сульфата цинка и сульфата меди (+)Cu Cu. SO 4 Zn(-) Сu 2+ + 2 e- Cu 0 Zn 0 – 2 e- Zn 2+ Cуммарно Zn + Cu. SO 4 Cu + Zn. SO 4
 Уравнение Нернста •
Уравнение Нернста •
 Измерение стандартного электродного потенциала Составляют гальваническую цепь из исследуемого электрода и электрода сравнения, потенциал которого точно известен. Измеряют ЭДС составленной цепи. Она в основном определяется разностью электродных потенциалов: Е = Еисслед – Еэл. ср. В качестве электродов сравнения используют водородный или каломельный электроды.
Измерение стандартного электродного потенциала Составляют гальваническую цепь из исследуемого электрода и электрода сравнения, потенциал которого точно известен. Измеряют ЭДС составленной цепи. Она в основном определяется разностью электродных потенциалов: Е = Еисслед – Еэл. ср. В качестве электродов сравнения используют водородный или каломельный электроды.
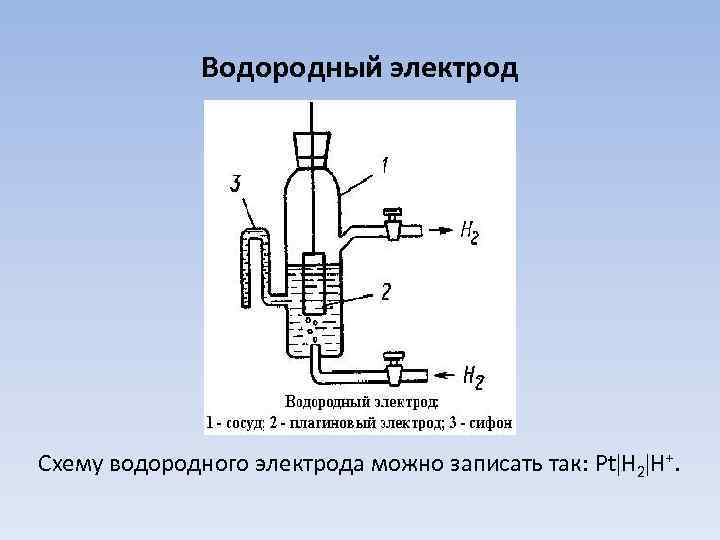 Водородный электрод Схему водородного электрода можно записать так: Pt Н 2 Н+.
Водородный электрод Схему водородного электрода можно записать так: Pt Н 2 Н+.
 Ряд напряжений • Стандартные потенциалы различных металлов, измеренные по отношению к водородному электроду, неодинаковы как по величине, так и по знаку. Если расположить металлы в порядке возрастания алгебраических величин их стандартных потенциалов, то получится так называемый ряд напряжений. • Металлы, стоящие в ряду напряжений до водорода, способны вытеснять водород из кислот; стоящие после водорода этой способностью не обладают.
Ряд напряжений • Стандартные потенциалы различных металлов, измеренные по отношению к водородному электроду, неодинаковы как по величине, так и по знаку. Если расположить металлы в порядке возрастания алгебраических величин их стандартных потенциалов, то получится так называемый ряд напряжений. • Металлы, стоящие в ряду напряжений до водорода, способны вытеснять водород из кислот; стоящие после водорода этой способностью не обладают.


