D--Users-CHELOMINA-Desktop-МАГИСТРЫ-2016-Теломеры и теломераза-1.ppt
- Количество слайдов: 50
 ТЕЛОМЕРЫ И ТЕЛОМЕРАЗА
ТЕЛОМЕРЫ И ТЕЛОМЕРАЗА
 В начале 1960 -х годов Леонард Хейфлик установил, что в клеточных культурах нормальные диплоидные (соматические) клетки человека способны делиться лишь ограниченное число раз. При этом предельное число делений (Ограничение на число клеточных делений и называют лимитом Хейфлика. ) сильно зависит от возраста индивидуума, которому эти клетки изначально принадлежали. Так, клетки, которые брали у новорожденных, делились в культуре 80 -90 раз, а у 70 -летнего человека - только 20 -30 раз. Достигнув "лимита Хейфлика", клетки переходят в состояние одряхления (которое в англоязычной, а теперь зачастую и в русской литературе называется сенесенсом, senescence), которое характеризуется резким изменением метаболизма, и в первую очередь нарушением репликации ДНК. Вслед за этим состоянием обычно следует гибель клеток.
В начале 1960 -х годов Леонард Хейфлик установил, что в клеточных культурах нормальные диплоидные (соматические) клетки человека способны делиться лишь ограниченное число раз. При этом предельное число делений (Ограничение на число клеточных делений и называют лимитом Хейфлика. ) сильно зависит от возраста индивидуума, которому эти клетки изначально принадлежали. Так, клетки, которые брали у новорожденных, делились в культуре 80 -90 раз, а у 70 -летнего человека - только 20 -30 раз. Достигнув "лимита Хейфлика", клетки переходят в состояние одряхления (которое в англоязычной, а теперь зачастую и в русской литературе называется сенесенсом, senescence), которое характеризуется резким изменением метаболизма, и в первую очередь нарушением репликации ДНК. Вслед за этим состоянием обычно следует гибель клеток.
 • В 1998 г. группе американских ученых удалось заставить нормальные клетки человека преодолеть "лимит Хейфлика" почти вдвое. • Ученые из лабораторий Джерри Шейя, Вудринга Райта, работающие под патронажем фирмы "Джерон корпорейшн" ("Geron Corporation"), с помощью изящных генетических манипуляций заставили в нормальных клетках человека работать фермент теломеразу, активность которой до этого была нулевой. Теломераза участвует в образовании теломер специальных структур, расположенных на концах линейных хромосом эукариот. Таким образом, обновление теломер и стало причиной спасения клеток от одряхления. • Появились статьи с заголовками вроде "Генетики уткнулись в бессмертие", "Лекарства от старения будут доступны, как аспирин", "Таблетки от старости становятся реальностью" и т. п
• В 1998 г. группе американских ученых удалось заставить нормальные клетки человека преодолеть "лимит Хейфлика" почти вдвое. • Ученые из лабораторий Джерри Шейя, Вудринга Райта, работающие под патронажем фирмы "Джерон корпорейшн" ("Geron Corporation"), с помощью изящных генетических манипуляций заставили в нормальных клетках человека работать фермент теломеразу, активность которой до этого была нулевой. Теломераза участвует в образовании теломер специальных структур, расположенных на концах линейных хромосом эукариот. Таким образом, обновление теломер и стало причиной спасения клеток от одряхления. • Появились статьи с заголовками вроде "Генетики уткнулись в бессмертие", "Лекарства от старения будут доступны, как аспирин", "Таблетки от старости становятся реальностью" и т. п
 • Теломеры – это • специализованные концевые районы линейной хромосомной ДНК, • состоят из многократно повторяющихся коротких нуклеотидных последовательностей, • - представляют комплексов ДНК с белками; • предотвращают деградацию и слияние хромосом, • - ответственны за прикрепление хромосом к специальной внутриядерной структуре, называемой ядерным матриксом; Таким образом, теломеры играют важную роль в создании специфической архитектуры и внутренней упорядоченности клеточного ядра. Наличие на концах хромосом специальной теломерной ДНК позволяет решить так называемую проблему концевой недорепликации ДНК. Существование таких участков было постулировано в 1938 году классиками генетики, лауреатами Нобелевской премии Барбарой Мак Клинток и Германом Мёллером. Г. Мёллер предложил называть их теломерами (от греч. телос - конец и мерос - часть); Первыми объектами исследования были одноклеточные простейшие
• Теломеры – это • специализованные концевые районы линейной хромосомной ДНК, • состоят из многократно повторяющихся коротких нуклеотидных последовательностей, • - представляют комплексов ДНК с белками; • предотвращают деградацию и слияние хромосом, • - ответственны за прикрепление хромосом к специальной внутриядерной структуре, называемой ядерным матриксом; Таким образом, теломеры играют важную роль в создании специфической архитектуры и внутренней упорядоченности клеточного ядра. Наличие на концах хромосом специальной теломерной ДНК позволяет решить так называемую проблему концевой недорепликации ДНК. Существование таких участков было постулировано в 1938 году классиками генетики, лауреатами Нобелевской премии Барбарой Мак Клинток и Германом Мёллером. Г. Мёллер предложил называть их теломерами (от греч. телос - конец и мерос - часть); Первыми объектами исследования были одноклеточные простейшие
 • Многократно повторяющиеся блоки в теломерной ДНК простейших состоят всего лишь из шести восьми нуклеотидных остатков. При этом одна цепь ДНК сильно обогащена остатками гуаниловой кислоты (G богатая цепь; у тетрахимены она построена из блоков TTGGGG), а комплементарная ей цепь ДНК соответственно обогащена остатками цитидиловой кислоты (С богатая цепь). • У дрожжей повторяющиеся блоки в теломерной ДНК заметно длиннее, чем у простейших, и зачастую не столь регулярные. • Теломерная ДНК человека построена из TTAGGG блоков, то есть отличается от простейших всего лишь одной буквой в повторе. Более того, из TTAGGG блоков построены теломерные ДНК (вернее, их G богатые цепи) всех млекопитающих, рептилий, амфибий, птиц и рыб. Столь же универсален теломерный ДНК повтор у растений: не только у всех наземных растений, но даже у их весьма отдаленных родственников морских водорослей он представлен последовательностью TTTAGGG
• Многократно повторяющиеся блоки в теломерной ДНК простейших состоят всего лишь из шести восьми нуклеотидных остатков. При этом одна цепь ДНК сильно обогащена остатками гуаниловой кислоты (G богатая цепь; у тетрахимены она построена из блоков TTGGGG), а комплементарная ей цепь ДНК соответственно обогащена остатками цитидиловой кислоты (С богатая цепь). • У дрожжей повторяющиеся блоки в теломерной ДНК заметно длиннее, чем у простейших, и зачастую не столь регулярные. • Теломерная ДНК человека построена из TTAGGG блоков, то есть отличается от простейших всего лишь одной буквой в повторе. Более того, из TTAGGG блоков построены теломерные ДНК (вернее, их G богатые цепи) всех млекопитающих, рептилий, амфибий, птиц и рыб. Столь же универсален теломерный ДНК повтор у растений: не только у всех наземных растений, но даже у их весьма отдаленных родственников морских водорослей он представлен последовательностью TTTAGGG
 • Чем можно объяснить такое сходство? В теломерной ДНК не закодировано • Очень важная характеристика теломерных ДНК их длина. У человека она колеблется от 2 до 20 тыс. пар оснований (т. п. о. ), а у некоторых видов мышей может достигать сотен т. п. о. • У многих видов двуспиральная теломерная ДНК на самом конце содержит однотяжевой "хвост, представленый ее G богатой цепью и заканчивающийся свободной 3' гидроксильной группой. Соответственно белки теломер принято подразделять на две группы: белки, которые связаны с однотяжевой теломерной ДНК, и белки, связанные с двутяжевой ДНК теломеры. Эти белки изучаются весьма интенсивно, но знаем мы о них еще мало. Нет сомнений в том, что теломерные белки участвуют во всех функциях теломер, поддерживая их структуру и регулируя длину теломерной ДНК (как мы увидим ниже, длина теломер чрезвычайно важный параметр). Установлено, что некоторые из белков, ассоциированных с двуспиральной теломерной ДНК, регулируют активность определенных генов, повышая или подавляя их экспрессию. Например, дрожжевой белок Rap 1 p. Это означает, что изменения или нарушения в структуре теломер могут затрагивать не только их собственные функции, но и экспрессию жизненно важных генов, находящихся в других районах хромосом. Кроме того, важные для поддержания общей структуры хромосом белки располагаются на ДНК, непосредственно примыкающей к теломерной (иногда ее называют субтеломерной ДНК). никаких белков (она не содержит генов), у всех организмов теломеры выполняют универсальные функции. Есть редкие, но важные исключения. Например, теломерная ДНК плодовой мухи дрозофилы представлена не короткими повторами, а ретротранспозонами подвижными генетическими элементами.
• Чем можно объяснить такое сходство? В теломерной ДНК не закодировано • Очень важная характеристика теломерных ДНК их длина. У человека она колеблется от 2 до 20 тыс. пар оснований (т. п. о. ), а у некоторых видов мышей может достигать сотен т. п. о. • У многих видов двуспиральная теломерная ДНК на самом конце содержит однотяжевой "хвост, представленый ее G богатой цепью и заканчивающийся свободной 3' гидроксильной группой. Соответственно белки теломер принято подразделять на две группы: белки, которые связаны с однотяжевой теломерной ДНК, и белки, связанные с двутяжевой ДНК теломеры. Эти белки изучаются весьма интенсивно, но знаем мы о них еще мало. Нет сомнений в том, что теломерные белки участвуют во всех функциях теломер, поддерживая их структуру и регулируя длину теломерной ДНК (как мы увидим ниже, длина теломер чрезвычайно важный параметр). Установлено, что некоторые из белков, ассоциированных с двуспиральной теломерной ДНК, регулируют активность определенных генов, повышая или подавляя их экспрессию. Например, дрожжевой белок Rap 1 p. Это означает, что изменения или нарушения в структуре теломер могут затрагивать не только их собственные функции, но и экспрессию жизненно важных генов, находящихся в других районах хромосом. Кроме того, важные для поддержания общей структуры хромосом белки располагаются на ДНК, непосредственно примыкающей к теломерной (иногда ее называют субтеломерной ДНК). никаких белков (она не содержит генов), у всех организмов теломеры выполняют универсальные функции. Есть редкие, но важные исключения. Например, теломерная ДНК плодовой мухи дрозофилы представлена не короткими повторами, а ретротранспозонами подвижными генетическими элементами.
 • Теломеры содержат ДНК связывающие белки, спе цифические для двойных теломерических ДНК, которые включают TRF 1 и TRF 2, и специфический белок для одиночного нитевидного выступа, который обычно присутствует на 3′ концах хромосом. • Известно также, что многие другие белки не напрямую связывают теломеры (через TRF 1 и TRF 2). Однонитевые выступы в 3’ конце теломеразных складок возвращаются к двойной теломерической ДНК, формируя защитную Т петлю. С теломерными повторами 3’ выступ связывается через TRF 1 путем, который еще не совсем понятен, но является важным для теломерной активности.
• Теломеры содержат ДНК связывающие белки, спе цифические для двойных теломерических ДНК, которые включают TRF 1 и TRF 2, и специфический белок для одиночного нитевидного выступа, который обычно присутствует на 3′ концах хромосом. • Известно также, что многие другие белки не напрямую связывают теломеры (через TRF 1 и TRF 2). Однонитевые выступы в 3’ конце теломеразных складок возвращаются к двойной теломерической ДНК, формируя защитную Т петлю. С теломерными повторами 3’ выступ связывается через TRF 1 путем, который еще не совсем понятен, но является важным для теломерной активности.
 • Утрата теломерной ДНК. Теломерная ДНК утрачивается в клетках человека в процессе репликации, репарации и ремоделирования ДНК. Причины утраты теломер включают «проблемы репликации конечных участков» , нуклеолитический процессинг 5′ конца цепи и ошибки в репарации повреждений теломерной ДНК, вызванных окислением. Относительный вклад каждого из этих механизмов в общее укорочение теломер с возрастом неизвестен и, скорее всего, варьирует в зависимости от типа клеток и возраста. Процесс укорочения теломер в связи с окислительными повреждениями был обнаружен совсем недавно. Известно, что теломерная ДНК, богатая G повторами, в 10 раз больше подвержена окислительным повреждениям, чем нетеломерная геномная ДНК. Восстановление окислительных повреждений происходит обычным путем, то есть вырезанием поврежденных нуклеотидов. Этот механизм может быть неэффективным для теломерных участков, так как при достижении репликационной вилкой конца хромосомы связь между матрицей и вновь синтезированной цепью ослабевает. В целом, вклад окислительных повреждений в укорачивание теломерных участков требует тщательных исследований.
• Утрата теломерной ДНК. Теломерная ДНК утрачивается в клетках человека в процессе репликации, репарации и ремоделирования ДНК. Причины утраты теломер включают «проблемы репликации конечных участков» , нуклеолитический процессинг 5′ конца цепи и ошибки в репарации повреждений теломерной ДНК, вызванных окислением. Относительный вклад каждого из этих механизмов в общее укорочение теломер с возрастом неизвестен и, скорее всего, варьирует в зависимости от типа клеток и возраста. Процесс укорочения теломер в связи с окислительными повреждениями был обнаружен совсем недавно. Известно, что теломерная ДНК, богатая G повторами, в 10 раз больше подвержена окислительным повреждениям, чем нетеломерная геномная ДНК. Восстановление окислительных повреждений происходит обычным путем, то есть вырезанием поврежденных нуклеотидов. Этот механизм может быть неэффективным для теломерных участков, так как при достижении репликационной вилкой конца хромосомы связь между матрицей и вновь синтезированной цепью ослабевает. В целом, вклад окислительных повреждений в укорачивание теломерных участков требует тщательных исследований.
 • Основные сигнальные пути теломер. • Механизм, посредством которого теломеры сигнализируют о повреждении ДНК, изучен крайне недостаточно. В настоящее время установлено, что индивидуальный теломерный участок может быть «включен» или «выключен» в плане сигнализации о повреждении. Представляется, что 3′ конец ДНК генерирует такие сигналы. В этот процесс включаются так же ATM и р53, остальные детали неизвестны. • На каком этапе клеточного цикла возникает сигнал? Репликация ДНК обязательно включает в себя процесс ремоделирования структуры теломер. Так как известно, что утрата теломер происходит во время репликации ДНК, то предполагается, что сигнал о повреждении ДНК возникает во вре мя S — или С 2 фаз клеточного цикла. Однако, когда в диплоидных фибробластах человека процессы репликации замедляются, их рост необратимо останавливается в фазе G. Было также показано, что теломеры постоянно «включены» или «выключены» , даже когда клетки находятся в фазе G 0/Gj. При этом предполагается, что включенное состояние обратно и непрямо коррелирует с длиной теломерных повторов. В соответствии с этим сила сигнала о повреждении ДНК, генерируемого теломерами, будет возрастать по мере укорочения теломер. С этой моделью согласуются антиапоптозный эффект длинных теломер, экспрессия теломеразы, повышение уровня р53 в стареющих клетках (с укороченными теломерами). Усложняют исследование длины теломер различия между организмами и клетками в длине теломер, необходимой для активации сигнальных процессов. Нет сомнений, что эти отличия частично объясняют выраженные различия в длине теломер у клеток одинаковых типов различных индивидуумов одного и того же воз раста.
• Основные сигнальные пути теломер. • Механизм, посредством которого теломеры сигнализируют о повреждении ДНК, изучен крайне недостаточно. В настоящее время установлено, что индивидуальный теломерный участок может быть «включен» или «выключен» в плане сигнализации о повреждении. Представляется, что 3′ конец ДНК генерирует такие сигналы. В этот процесс включаются так же ATM и р53, остальные детали неизвестны. • На каком этапе клеточного цикла возникает сигнал? Репликация ДНК обязательно включает в себя процесс ремоделирования структуры теломер. Так как известно, что утрата теломер происходит во время репликации ДНК, то предполагается, что сигнал о повреждении ДНК возникает во вре мя S — или С 2 фаз клеточного цикла. Однако, когда в диплоидных фибробластах человека процессы репликации замедляются, их рост необратимо останавливается в фазе G. Было также показано, что теломеры постоянно «включены» или «выключены» , даже когда клетки находятся в фазе G 0/Gj. При этом предполагается, что включенное состояние обратно и непрямо коррелирует с длиной теломерных повторов. В соответствии с этим сила сигнала о повреждении ДНК, генерируемого теломерами, будет возрастать по мере укорочения теломер. С этой моделью согласуются антиапоптозный эффект длинных теломер, экспрессия теломеразы, повышение уровня р53 в стареющих клетках (с укороченными теломерами). Усложняют исследование длины теломер различия между организмами и клетками в длине теломер, необходимой для активации сигнальных процессов. Нет сомнений, что эти отличия частично объясняют выраженные различия в длине теломер у клеток одинаковых типов различных индивидуумов одного и того же воз раста.
 • Теломераза • В 1984 году Э. Блэкберн и Э. Грайдер выделили фермент, который с помощью механизма, отличного от механизма реакций, лежащих в основе репликации ДНК, синтезирует теломерную ДНК. Этот фермент был назван теломеразой.
• Теломераза • В 1984 году Э. Блэкберн и Э. Грайдер выделили фермент, который с помощью механизма, отличного от механизма реакций, лежащих в основе репликации ДНК, синтезирует теломерную ДНК. Этот фермент был назван теломеразой.
 • Теломераза – это фермент‚ синтезирующий тандемно повторяющиеся сегменты ДНК, из которых состоит G цепь теломерной ДНК. Она относится к классу ДНК полимераз, это РНК зависимая ДНК полимераза или обратная транскриптаза. • Теломераза — рибонуклеопротеин, содержащий белок теломеразы обратной транскрипции (h. TERT) и теломеразную РНК матрицу (h. TR) в качестве обязательных компонентов. • Ферменты, синтезирующие ДНК на РНК матрицах, закодированы и содержатся в ретровирусах и служат для синтеза ДНК копий их геномов, который в ретровирусе представлен РНК. В клеточном геноме обратные транскриптазы закодированы в ретротранспозонах. • РНК, используемая теломеразой для синтеза теломерной ДНК в качестве матрицы, входит в состав этого фермента. В этом уникальность теломеразы: на сегодня это единственная известная РНК содержащая обратная транскриптаза.
• Теломераза – это фермент‚ синтезирующий тандемно повторяющиеся сегменты ДНК, из которых состоит G цепь теломерной ДНК. Она относится к классу ДНК полимераз, это РНК зависимая ДНК полимераза или обратная транскриптаза. • Теломераза — рибонуклеопротеин, содержащий белок теломеразы обратной транскрипции (h. TERT) и теломеразную РНК матрицу (h. TR) в качестве обязательных компонентов. • Ферменты, синтезирующие ДНК на РНК матрицах, закодированы и содержатся в ретровирусах и служат для синтеза ДНК копий их геномов, который в ретровирусе представлен РНК. В клеточном геноме обратные транскриптазы закодированы в ретротранспозонах. • РНК, используемая теломеразой для синтеза теломерной ДНК в качестве матрицы, входит в состав этого фермента. В этом уникальность теломеразы: на сегодня это единственная известная РНК содержащая обратная транскриптаза.
 • Теломеразные РНК у разных организмов сильно различаются по длине и структуре. у простейших РНК длиной в 150 200 нуклеотидных остатков (н. о. ), длина теломеразной РНК человека 450 н. о. , - теломераза дрожжей содержит аномально длинную РНК (около 1300 н. о. ). - теломеразная РНК обладает специфической вторичной и третичной структурой (вторичная структура изолированной теломеразной РНК достоверно установлена только для теломераз простейших, пространственная структура теломеразной РНК в составе ферментативного комплекса пока еще неизвестна). - Матричный участок представлен в теломеразной РНК только один раз. Его длина не превышает длину двух повторов в теломерной ДНК, которые он кодирует и которым он, разумеется, комплементарен. • Так как теломераза синтезирует сегменты ДНК, повторяющиеся много раз, используя только один сегмент своей РНК, она должна обладать способностью периодически (после завершения синтеза каждого повтора) перемещать (транслоцировать) матричный участок в район 3' конца синтезируемой теломерной ДНК. Источником энергии для такого перемещения, по видимому, служит сама реакция синтеза цепи теломерной ДНК, поскольку дезоксинуклеозидтрифосфаты субстраты этой реакции высокоэнергетические вещества.
• Теломеразные РНК у разных организмов сильно различаются по длине и структуре. у простейших РНК длиной в 150 200 нуклеотидных остатков (н. о. ), длина теломеразной РНК человека 450 н. о. , - теломераза дрожжей содержит аномально длинную РНК (около 1300 н. о. ). - теломеразная РНК обладает специфической вторичной и третичной структурой (вторичная структура изолированной теломеразной РНК достоверно установлена только для теломераз простейших, пространственная структура теломеразной РНК в составе ферментативного комплекса пока еще неизвестна). - Матричный участок представлен в теломеразной РНК только один раз. Его длина не превышает длину двух повторов в теломерной ДНК, которые он кодирует и которым он, разумеется, комплементарен. • Так как теломераза синтезирует сегменты ДНК, повторяющиеся много раз, используя только один сегмент своей РНК, она должна обладать способностью периодически (после завершения синтеза каждого повтора) перемещать (транслоцировать) матричный участок в район 3' конца синтезируемой теломерной ДНК. Источником энергии для такого перемещения, по видимому, служит сама реакция синтеза цепи теломерной ДНК, поскольку дезоксинуклеозидтрифосфаты субстраты этой реакции высокоэнергетические вещества.
 • Как работает теломераза? 1. На первой стадии теломераза находит 3' конец теломерной ДНК, с которым часть матричного участка теломеразной РНК образует комплементарный комплекс. При этом теломераза использует 3' конец хромосомной ДНК в качестве праймера. 2. Далее наступает очередь РНК зависимой ДНК полимеразной активности теломеразы. Она обеспечивается специальной субъединицей теломеразы, которая по устройству своего каталитического центра во многом сходна с обратными транскриптазами ретровирусов и ретротранспозонов. 3. Когда синтез ДНК повтора заканчивается, происходит транслокация, то есть перемещение матрицы и белковых субъединиц фермента на заново синтезированный конец теломерной ДНК, и весь цикл повторяется вновь. Знакомство даже с весьма схематичным описанием механизма теломеразной реакции приводит к заключению, что двумя компонентами обратной транскриптазой и теломеразной РНК для ее осуществления обойтись нельзя.
• Как работает теломераза? 1. На первой стадии теломераза находит 3' конец теломерной ДНК, с которым часть матричного участка теломеразной РНК образует комплементарный комплекс. При этом теломераза использует 3' конец хромосомной ДНК в качестве праймера. 2. Далее наступает очередь РНК зависимой ДНК полимеразной активности теломеразы. Она обеспечивается специальной субъединицей теломеразы, которая по устройству своего каталитического центра во многом сходна с обратными транскриптазами ретровирусов и ретротранспозонов. 3. Когда синтез ДНК повтора заканчивается, происходит транслокация, то есть перемещение матрицы и белковых субъединиц фермента на заново синтезированный конец теломерной ДНК, и весь цикл повторяется вновь. Знакомство даже с весьма схематичным описанием механизма теломеразной реакции приводит к заключению, что двумя компонентами обратной транскриптазой и теломеразной РНК для ее осуществления обойтись нельзя.
 • Нет сомнений в том, что в составе теломеразного комплекса должны быть субъединица, отвечающая за поиск и связывание 3' конца хромосомы (и выполняющая таким образом своеобразную якорную функцию); субъединица, ответственная за транслокацию; субъединицы, связывающие продукт реакции (однотяжевую ДНК). В составе теломеразы обычно обнаруживается и белковая субъединица с нуклеазной активностью, которая, по видимому, отщепляет от 3' конца теломерной ДНК один за другим несколько нуклеотидов до тех пор, пока на этом конце не окажется последовательность, комплементарная нужному участку матричного сегмента теломеразной РНК. • Нужно еще раз подчеркнуть, что полный белковый состав фермента не известен до сих пор ни в одном случае.
• Нет сомнений в том, что в составе теломеразного комплекса должны быть субъединица, отвечающая за поиск и связывание 3' конца хромосомы (и выполняющая таким образом своеобразную якорную функцию); субъединица, ответственная за транслокацию; субъединицы, связывающие продукт реакции (однотяжевую ДНК). В составе теломеразы обычно обнаруживается и белковая субъединица с нуклеазной активностью, которая, по видимому, отщепляет от 3' конца теломерной ДНК один за другим несколько нуклеотидов до тех пор, пока на этом конце не окажется последовательность, комплементарная нужному участку матричного сегмента теломеразной РНК. • Нужно еще раз подчеркнуть, что полный белковый состав фермента не известен до сих пор ни в одном случае.
 • Широкое распространение теломераз среди эукариот говорит о том, что механизм синтеза теломерной ДНК, который мы наблюдаем у современных организмов, возник очень давно. Более того, эволюционно-генетический сравнительный анализ нуклеотидных последовательностей генов каталитических субъединиц теломераз и других обратных транскриптаз показывает, что этот механизм мог существовать еще до появления первых эукариотических клеток. • С цепь теломерной ДНК синтезируется с помощью обычной ДНК полимеразы. Поэтому 3'-концевой участок G-цепи, на котором, повидимому, первоначально была РНК-затравка, в конечном итоге остается в однотяжевом состоянии (то есть в принципе он готов к тому, чтобы теломераза нарастила на нем новый повтор).
• Широкое распространение теломераз среди эукариот говорит о том, что механизм синтеза теломерной ДНК, который мы наблюдаем у современных организмов, возник очень давно. Более того, эволюционно-генетический сравнительный анализ нуклеотидных последовательностей генов каталитических субъединиц теломераз и других обратных транскриптаз показывает, что этот механизм мог существовать еще до появления первых эукариотических клеток. • С цепь теломерной ДНК синтезируется с помощью обычной ДНК полимеразы. Поэтому 3'-концевой участок G-цепи, на котором, повидимому, первоначально была РНК-затравка, в конечном итоге остается в однотяжевом состоянии (то есть в принципе он готов к тому, чтобы теломераза нарастила на нем новый повтор).
 • Активность теломеразы у высших эукариот обнаружена лишь в трех типах клеток: - генеративных, - раковых - линиях иммортализованных клеточных культур. - половых и стволовых клетках. В остальных типах клеток синтез этого фермента прекращается еще в эмбриональный период развития В организме при дифференцировке клеток теломераза репрессируется. Экспрессию теломеразы считают фактором иммортализации клеток.
• Активность теломеразы у высших эукариот обнаружена лишь в трех типах клеток: - генеративных, - раковых - линиях иммортализованных клеточных культур. - половых и стволовых клетках. В остальных типах клеток синтез этого фермента прекращается еще в эмбриональный период развития В организме при дифференцировке клеток теломераза репрессируется. Экспрессию теломеразы считают фактором иммортализации клеток.
 • В соматических клетках, культивируемых in vitro, теломераза не работает и теломеры постепенно укорачиваются. Длина теломер достоверно коррелирует с пролиферативным потенциалом (например, в фибробластах человека). Укорочение теломер может играть роль митотических часов, отсчитывающих число делений клетки. По достижении критической длины теломерной ДНК запускаются процессы остановки клеточного цикла. Блок клеточных делений наступает еще до того, как теломера исчезла вовсе. Существует некоторая минимальная длина теломеры, когда деление еще разрешено. Иными словами, прекращение деления наступает до того, как начал разрушаться смысловой текст генома. Таким способом эукариоты страхуют себя от появления монстров вследствие недорепликации ДНК.
• В соматических клетках, культивируемых in vitro, теломераза не работает и теломеры постепенно укорачиваются. Длина теломер достоверно коррелирует с пролиферативным потенциалом (например, в фибробластах человека). Укорочение теломер может играть роль митотических часов, отсчитывающих число делений клетки. По достижении критической длины теломерной ДНК запускаются процессы остановки клеточного цикла. Блок клеточных делений наступает еще до того, как теломера исчезла вовсе. Существует некоторая минимальная длина теломеры, когда деление еще разрешено. Иными словами, прекращение деления наступает до того, как начал разрушаться смысловой текст генома. Таким способом эукариоты страхуют себя от появления монстров вследствие недорепликации ДНК.
 • Опубликованная в 1998 году в журнале "Science" статья американских исследователей благодаря средствам массовой информации привлекла внимание не только ученых (а в первую очередь не ученых) в связи с проблемами старения и "клеточного бессмертия". В этой прекрасной работе коллектива, возглавляемого Джерри Шеем, удалось на 40% увеличить число делений нормальных соматических клеток человека в культуре. С помощью генно инженерных методов в клетки был введен ген каталитической белковой субъединицы теломеразы и прилегающий к нему участок ДНК, регулирующий его работу. При активной работе гена увеличивался как размер теломерной ДНК, так и продолжительность жизни клеточных культур. Сверх обычных 50 делений клетки прошли дополнительно 20 делений.
• Опубликованная в 1998 году в журнале "Science" статья американских исследователей благодаря средствам массовой информации привлекла внимание не только ученых (а в первую очередь не ученых) в связи с проблемами старения и "клеточного бессмертия". В этой прекрасной работе коллектива, возглавляемого Джерри Шеем, удалось на 40% увеличить число делений нормальных соматических клеток человека в культуре. С помощью генно инженерных методов в клетки был введен ген каталитической белковой субъединицы теломеразы и прилегающий к нему участок ДНК, регулирующий его работу. При активной работе гена увеличивался как размер теломерной ДНК, так и продолжительность жизни клеточных культур. Сверх обычных 50 делений клетки прошли дополнительно 20 делений.
 • Укорочение теломер можно рассматривать как молекулярный индикатор количества делений, но не старения клетки. Так, на культуре нормальных фибробластов человека, взятых от доноров в возрасте от 0 до 93 лет, выявили корреляцию между начальной длиной теломер и пролиферативной способностью клетки во всем диапазоне возрастов. А размер теломерной ДНК сперматозоидов не уменьшался в соответствии с возрастом мужчины, что говорит об экспрессии теломеразы в линии половых клеток. Прекращение работы теломеразы, отмечаемое в подавляющем большинстве дифференцированных соматических клеток животных, является свидетельством их зрелости, а стало быть, и неизбежно следующих затем процессов увядания и гибели.
• Укорочение теломер можно рассматривать как молекулярный индикатор количества делений, но не старения клетки. Так, на культуре нормальных фибробластов человека, взятых от доноров в возрасте от 0 до 93 лет, выявили корреляцию между начальной длиной теломер и пролиферативной способностью клетки во всем диапазоне возрастов. А размер теломерной ДНК сперматозоидов не уменьшался в соответствии с возрастом мужчины, что говорит об экспрессии теломеразы в линии половых клеток. Прекращение работы теломеразы, отмечаемое в подавляющем большинстве дифференцированных соматических клеток животных, является свидетельством их зрелости, а стало быть, и неизбежно следующих затем процессов увядания и гибели.
 • Старение особи это нормальная биологическая функция, способствующая прогрессивной эволюции вида, размножающегося половым путем. Давление естественного отбора ослабевает после достижения животным репродуктивного успеха, поскольку существование особи после этого имеет меньшее значение для вида. Смерть от старости удаляет из популяции выполнивших свою роль предков и дает простор потомкам носителям новых полезных признаков. Как любая важная биологическая функция, старение обусловлено параллельным действием нескольких молекулярных механизмов. Выключение теломеразы лишь один из них. • Не стоит рассматривать гены, кодирующие белковые субъединицы теломеразы и входящую в ее состав РНК, как "гены бессмертия". Поддержание длины теломерной ДНК на определенном уровне зависит не только от взаимодействия с ней теломеразы и теломерсвязывающих белков, но и некоторых, пока неизвестных факторов, регулирующих образование самих компонентов теломеробразующего комплекса. • Вряд ли бессмертие, достигнутое раковыми клетками, размножающимися в культуре десятилетиями без укорочения теломер, это то, к чему нужно стремиться. Лекарства от смерти нет. Но тот факт, что введение в такие клетки препаратов, связывающих РНК компонент теломеразы, приводит к укорочению теломер с последующей гибелью клеток, вселяет надежду на появление новых средств борьбы с раком. • Понимание механизма работы теломеразы, а главное, регуляции экспрессии ее в клетке приблизит нас к пониманию процессов и злокачественной трансформации и старения.
• Старение особи это нормальная биологическая функция, способствующая прогрессивной эволюции вида, размножающегося половым путем. Давление естественного отбора ослабевает после достижения животным репродуктивного успеха, поскольку существование особи после этого имеет меньшее значение для вида. Смерть от старости удаляет из популяции выполнивших свою роль предков и дает простор потомкам носителям новых полезных признаков. Как любая важная биологическая функция, старение обусловлено параллельным действием нескольких молекулярных механизмов. Выключение теломеразы лишь один из них. • Не стоит рассматривать гены, кодирующие белковые субъединицы теломеразы и входящую в ее состав РНК, как "гены бессмертия". Поддержание длины теломерной ДНК на определенном уровне зависит не только от взаимодействия с ней теломеразы и теломерсвязывающих белков, но и некоторых, пока неизвестных факторов, регулирующих образование самих компонентов теломеробразующего комплекса. • Вряд ли бессмертие, достигнутое раковыми клетками, размножающимися в культуре десятилетиями без укорочения теломер, это то, к чему нужно стремиться. Лекарства от смерти нет. Но тот факт, что введение в такие клетки препаратов, связывающих РНК компонент теломеразы, приводит к укорочению теломер с последующей гибелью клеток, вселяет надежду на появление новых средств борьбы с раком. • Понимание механизма работы теломеразы, а главное, регуляции экспрессии ее в клетке приблизит нас к пониманию процессов и злокачественной трансформации и старения.
 • ТЕЛОМЕРАЗА, РАК И СТАРЕНИЕ • Вопрос о том, в какой мере теломерный механизм участвует в старении многоклеточных организмов. Вполне возможно, что они изобрели совсем иные программы старческого феноптоза. Однако несомненно, что у людей рекордсменов по долгожительству уменьшение длины теломер уже приближается к той роковой черте, за которой наступает запрет на размножение клеток. Так, по данным группы К. Сасаджимы из Японии, теломеры в клетках печени стариков старше 80 лет оказываются почти вдвое короче, чем у детей до 8 лет. По-видимому, продлить жизнь тем, кому за 100, можно лишь при условии, что удастся нарастить их теломеры, включив на какое-то время теломеразу в печени и других тканях, где этот фермент выключился еще во время эмбрионального развития. • Однако и здесь есть редкие, но важные исключения: теломеразная активность обнаруживается в таких "смертных" клетках, как макрофаги и лейкоциты. • Недавно было установлено, что нормальные соматические клетки потому лишены теломеразной активности, что в них полностью подавлена экспрессия гена ее каталитической субъединицы (обратной транскриптазы). Другие же составляющие теломеразы, включая теломеразную РНК, образуются в этих клетках, хотя и в меньших количествах, чем в их "бессмертных" прародителях, но постоянно (или, как говорят, конститутивно). Открытие этого важного факта Дж. Шеем, В. Райтом и их сотрудниками и стало основой для той сенсационной работы по преодолению "лимита Хейфлика". Действительно, все остальное было уже делом техники (хотя и очень непростой).
• ТЕЛОМЕРАЗА, РАК И СТАРЕНИЕ • Вопрос о том, в какой мере теломерный механизм участвует в старении многоклеточных организмов. Вполне возможно, что они изобрели совсем иные программы старческого феноптоза. Однако несомненно, что у людей рекордсменов по долгожительству уменьшение длины теломер уже приближается к той роковой черте, за которой наступает запрет на размножение клеток. Так, по данным группы К. Сасаджимы из Японии, теломеры в клетках печени стариков старше 80 лет оказываются почти вдвое короче, чем у детей до 8 лет. По-видимому, продлить жизнь тем, кому за 100, можно лишь при условии, что удастся нарастить их теломеры, включив на какое-то время теломеразу в печени и других тканях, где этот фермент выключился еще во время эмбрионального развития. • Однако и здесь есть редкие, но важные исключения: теломеразная активность обнаруживается в таких "смертных" клетках, как макрофаги и лейкоциты. • Недавно было установлено, что нормальные соматические клетки потому лишены теломеразной активности, что в них полностью подавлена экспрессия гена ее каталитической субъединицы (обратной транскриптазы). Другие же составляющие теломеразы, включая теломеразную РНК, образуются в этих клетках, хотя и в меньших количествах, чем в их "бессмертных" прародителях, но постоянно (или, как говорят, конститутивно). Открытие этого важного факта Дж. Шеем, В. Райтом и их сотрудниками и стало основой для той сенсационной работы по преодолению "лимита Хейфлика". Действительно, все остальное было уже делом техники (хотя и очень непростой).
 • Легковесность первого вывода (а именно его подхватили средства массовой информации) очевидна: между культурой клеток и клеточной тканью, а тем более организмом дистанция огромного размера. В то же время существуют вполне реальные планы активировать теломеразу в клетках кожи. • Что же касается разработки методов избирательного подавления теломеразной активности в раковых опухолях, большинство работ связано с испытанием ингибиторов обратных транскриптаз (каталитических субъединиц теломераз). Главная трудность заключается в том, что каталитическая субъединица теломеразы это одна из ДНК полимераз и искомый ингибитор должен быть направлен именно на теломеразную ДНК синтезирующую активность. В противном случае он будет токсичен для нормальных клеток. • Изучение тонкой структуры теломер и механизма действия теломераз находится еще только в начальной стадии. Однако они привлекают к себе огромный интерес исследователей, работающих в самых разных областях биологии и медицины, и здесь уже в ближайшее время можно ждать новых интересных открытий.
• Легковесность первого вывода (а именно его подхватили средства массовой информации) очевидна: между культурой клеток и клеточной тканью, а тем более организмом дистанция огромного размера. В то же время существуют вполне реальные планы активировать теломеразу в клетках кожи. • Что же касается разработки методов избирательного подавления теломеразной активности в раковых опухолях, большинство работ связано с испытанием ингибиторов обратных транскриптаз (каталитических субъединиц теломераз). Главная трудность заключается в том, что каталитическая субъединица теломеразы это одна из ДНК полимераз и искомый ингибитор должен быть направлен именно на теломеразную ДНК синтезирующую активность. В противном случае он будет токсичен для нормальных клеток. • Изучение тонкой структуры теломер и механизма действия теломераз находится еще только в начальной стадии. Однако они привлекают к себе огромный интерес исследователей, работающих в самых разных областях биологии и медицины, и здесь уже в ближайшее время можно ждать новых интересных открытий.
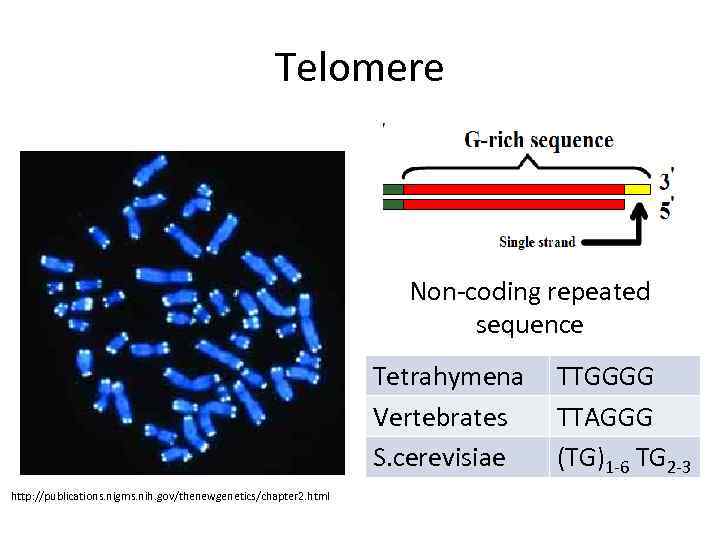 Telomere Non-coding repeated sequence Tetrahymena Vertebrates S. cerevisiae http: //publications. nigms. nih. gov/thenewgenetics/chapter 2. html TTGGGG TTAGGG (TG)1 -6 TG 2 -3
Telomere Non-coding repeated sequence Tetrahymena Vertebrates S. cerevisiae http: //publications. nigms. nih. gov/thenewgenetics/chapter 2. html TTGGGG TTAGGG (TG)1 -6 TG 2 -3
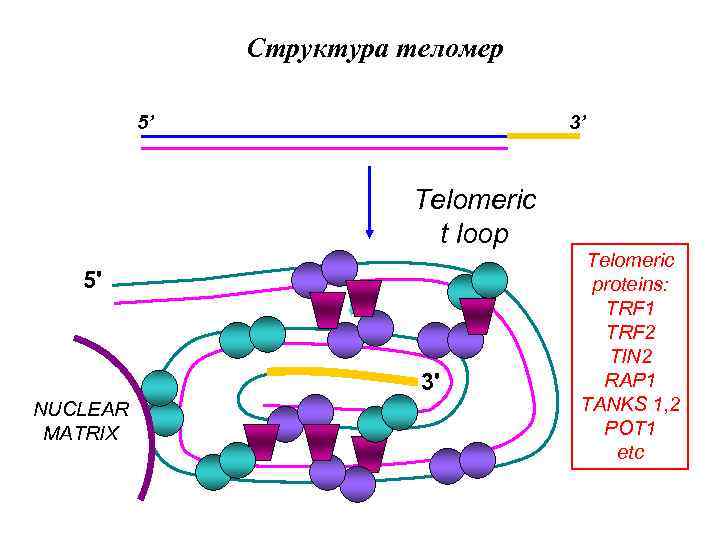 Структура теломер 5’ 3’ Telomeric t loop 5' 3' NUCLEAR MATRIX Telomeric proteins: TRF 1 TRF 2 TIN 2 RAP 1 TANKS 1, 2 POT 1 etc
Структура теломер 5’ 3’ Telomeric t loop 5' 3' NUCLEAR MATRIX Telomeric proteins: TRF 1 TRF 2 TIN 2 RAP 1 TANKS 1, 2 POT 1 etc
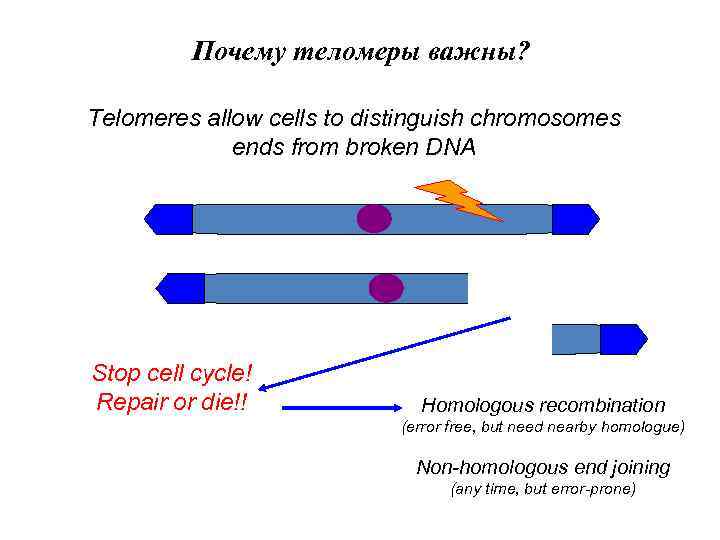 Почему теломеры важны? Telomeres allow cells to distinguish chromosomes ends from broken DNA Stop cell cycle! Repair or die!! Homologous recombination (error free, but need nearby homologue) Non-homologous end joining (any time, but error-prone)
Почему теломеры важны? Telomeres allow cells to distinguish chromosomes ends from broken DNA Stop cell cycle! Repair or die!! Homologous recombination (error free, but need nearby homologue) Non-homologous end joining (any time, but error-prone)
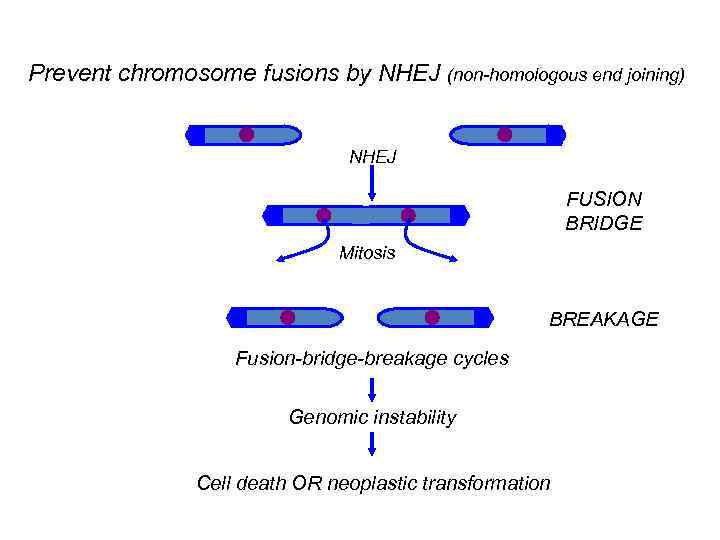 Prevent chromosome fusions by NHEJ (non-homologous end joining) NHEJ FUSION BRIDGE Mitosis BREAKAGE Fusion-bridge-breakage cycles Genomic instability Cell death OR neoplastic transformation
Prevent chromosome fusions by NHEJ (non-homologous end joining) NHEJ FUSION BRIDGE Mitosis BREAKAGE Fusion-bridge-breakage cycles Genomic instability Cell death OR neoplastic transformation
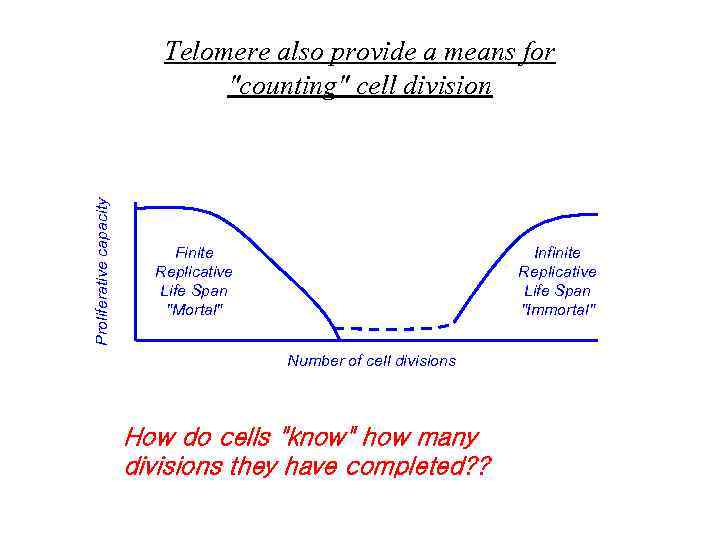 Proliferative capacity Telomere also provide a means for "counting" cell division Finite Replicative Life Span "Mortal" Infinite Replicative Life Span "Immortal" Number of cell divisions How do cells "know" how many divisions they have completed? ?
Proliferative capacity Telomere also provide a means for "counting" cell division Finite Replicative Life Span "Mortal" Infinite Replicative Life Span "Immortal" Number of cell divisions How do cells "know" how many divisions they have completed? ?
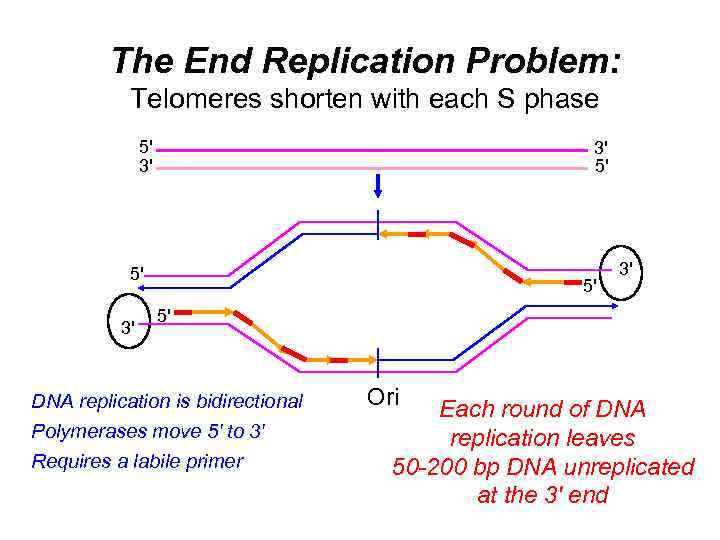 The End Replication Problem: Telomeres shorten with each S phase 5' 3' 3' 5' 5' 3' 5' DNA replication is bidirectional Polymerases move 5' to 3' Requires a labile primer Ori Each round of DNA replication leaves 50 -200 bp DNA unreplicated at the 3' end
The End Replication Problem: Telomeres shorten with each S phase 5' 3' 3' 5' 5' 3' 5' DNA replication is bidirectional Polymerases move 5' to 3' Requires a labile primer Ori Each round of DNA replication leaves 50 -200 bp DNA unreplicated at the 3' end
 Telomere also provide a means for "counting" cell division: telomeres shorten with each cycle Telomeres shorten from 10 -15 kb (germ line) to 3 -5 kb after 50 -60 doublings (average lengths of TRFs) Telomere Length (humans) 20 10 Cellular senescence is triggered when cells acquire one or a few critically short telomeres. Normal Somatic Cells (Telomerase Negative) Cellular (Replicative) Senescence Number of Doublings
Telomere also provide a means for "counting" cell division: telomeres shorten with each cycle Telomeres shorten from 10 -15 kb (germ line) to 3 -5 kb after 50 -60 doublings (average lengths of TRFs) Telomere Length (humans) 20 10 Cellular senescence is triggered when cells acquire one or a few critically short telomeres. Normal Somatic Cells (Telomerase Negative) Cellular (Replicative) Senescence Number of Doublings
 Теломераза: Ключ к репликативному бессмертию + TELOMERASE Overcomes telomere shortening and the endreplication problem Expressed by germ cells, early embryonic cells Not expressed by most somatic cells (human) May be expressed by some stem cells, but highly controlled Expressed by 80 -90% of cancer cells Remaining still need to overcome the end replication problem; do so by recombinational mechanisms -ALT (alternative lengthening of telomeres) mechanisms
Теломераза: Ключ к репликативному бессмертию + TELOMERASE Overcomes telomere shortening and the endreplication problem Expressed by germ cells, early embryonic cells Not expressed by most somatic cells (human) May be expressed by some stem cells, but highly controlled Expressed by 80 -90% of cancer cells Remaining still need to overcome the end replication problem; do so by recombinational mechanisms -ALT (alternative lengthening of telomeres) mechanisms
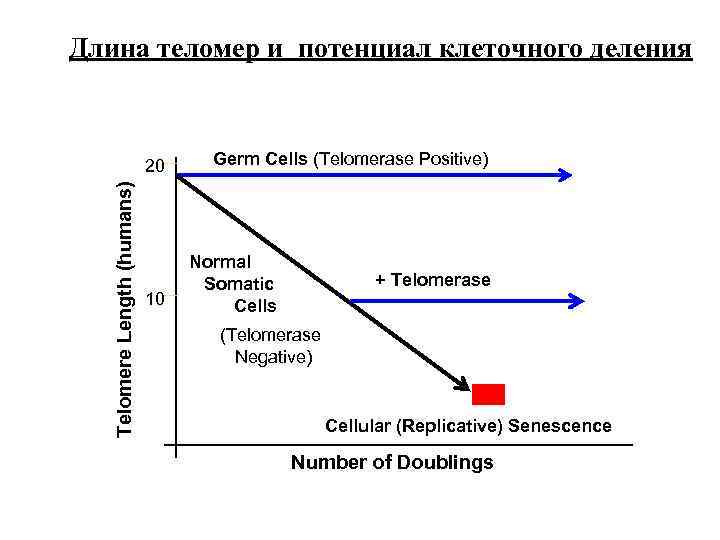 Длина теломер и потенциал клеточного деления Telomere Length (humans) 20 10 Germ Cells (Telomerase Positive) Normal Somatic Cells + Telomerase (Telomerase Negative) Cellular (Replicative) Senescence Number of Doublings
Длина теломер и потенциал клеточного деления Telomere Length (humans) 20 10 Germ Cells (Telomerase Positive) Normal Somatic Cells + Telomerase (Telomerase Negative) Cellular (Replicative) Senescence Number of Doublings
 HOWEVER, CELLS THAT EXPRESS TELOMERASE STILL UNDERGO SENESCENCE (E. G. , IN RESPONSE TO DNA DAMAGE, ONCOGENES, ETC. ) Inducers of cellular senescence Cell proliferation (short telomeres) DNA damage Oncogenes Strong mitogens/ stress Potential Cancer Causing Events
HOWEVER, CELLS THAT EXPRESS TELOMERASE STILL UNDERGO SENESCENCE (E. G. , IN RESPONSE TO DNA DAMAGE, ONCOGENES, ETC. ) Inducers of cellular senescence Cell proliferation (short telomeres) DNA damage Oncogenes Strong mitogens/ stress Potential Cancer Causing Events
 • Теломеразы: биомедицинское использование • Expand cells for replacement therapies • (burns, joint replacements, etc) • Telomerase inhibitors to selectively kill cancer cells
• Теломеразы: биомедицинское использование • Expand cells for replacement therapies • (burns, joint replacements, etc) • Telomerase inhibitors to selectively kill cancer cells
 Теломерная гипотеза старения • Telomeres shorten with each cell division and therefore with age TRUE • Short telomeres cause cell senescence and senescent cells may contribute to aging TRUE HYPOTHESIS: • Telomere shortening causes aging and telomerase will prevent aging TRUE OR FALSE? • Telomere length is not related to life span (mice vs human; M musculus vs M spretus) • Telomeres contribute to aging ONLY if senescent cells contribute to aging • Telomerase protects against replicative senescence but not senescence induce by other causes
Теломерная гипотеза старения • Telomeres shorten with each cell division and therefore with age TRUE • Short telomeres cause cell senescence and senescent cells may contribute to aging TRUE HYPOTHESIS: • Telomere shortening causes aging and telomerase will prevent aging TRUE OR FALSE? • Telomere length is not related to life span (mice vs human; M musculus vs M spretus) • Telomeres contribute to aging ONLY if senescent cells contribute to aging • Telomerase protects against replicative senescence but not senescence induce by other causes
 • SUMMARY • Telomeres are essential for chromosome stability • • Telomere shortening occurs owing to the biochemistry of DNA replication • • Short telomeres cause replicative senescence (other senescence causes are telomere-independent) • • Telomerase prevents telomere shortening and replicative senescence • • The telomere hypothesis of aging depends on the cellular senescence hypothesis of aging
• SUMMARY • Telomeres are essential for chromosome stability • • Telomere shortening occurs owing to the biochemistry of DNA replication • • Short telomeres cause replicative senescence (other senescence causes are telomere-independent) • • Telomerase prevents telomere shortening and replicative senescence • • The telomere hypothesis of aging depends on the cellular senescence hypothesis of aging
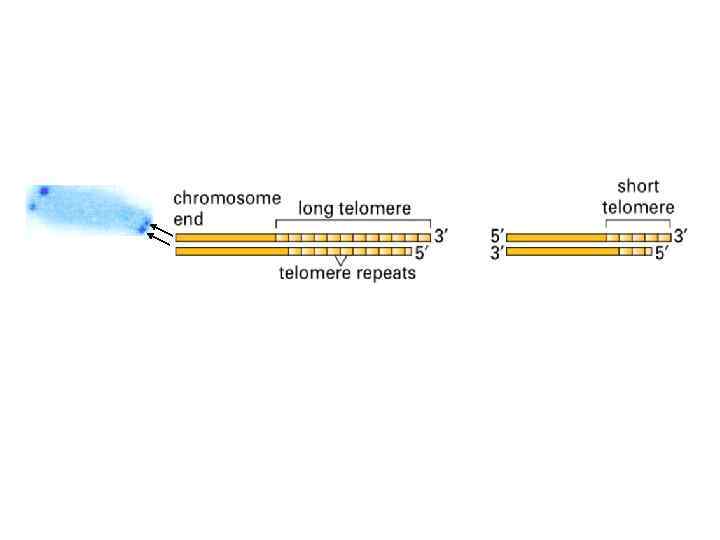
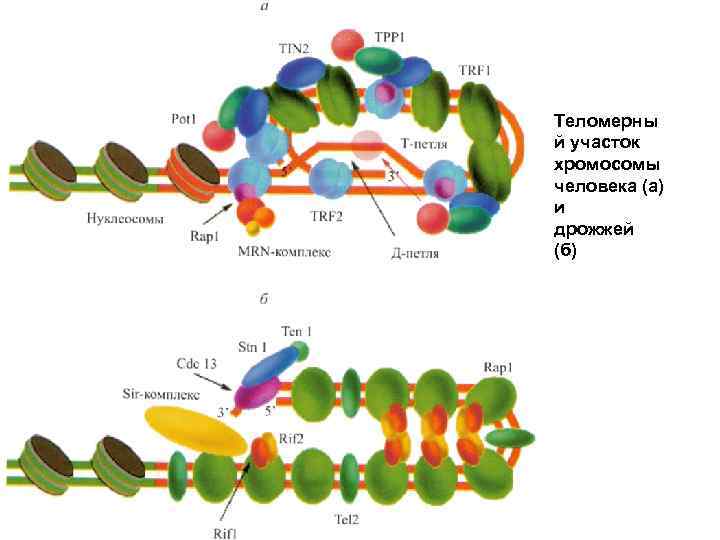 Теломерны й участок хромосомы человека (а) и дрожжей (б)
Теломерны й участок хромосомы человека (а) и дрожжей (б)
 Минина
Минина
 Herman Muller (1890 1967) 1946 Нобелевская премия по физиологии и медицине за исследование мутаций, индуцированных облучением Теломера: «телос» конец и «мерос» часть (с греческого) Barbara Mc. Clintock (1902– 1992) 1983 Нобелевская премия по физиологии и медицине за открытие мобильных генетических элементов Открытие теломер – 1932 г.
Herman Muller (1890 1967) 1946 Нобелевская премия по физиологии и медицине за исследование мутаций, индуцированных облучением Теломера: «телос» конец и «мерос» часть (с греческого) Barbara Mc. Clintock (1902– 1992) 1983 Нобелевская премия по физиологии и медицине за открытие мобильных генетических элементов Открытие теломер – 1932 г.
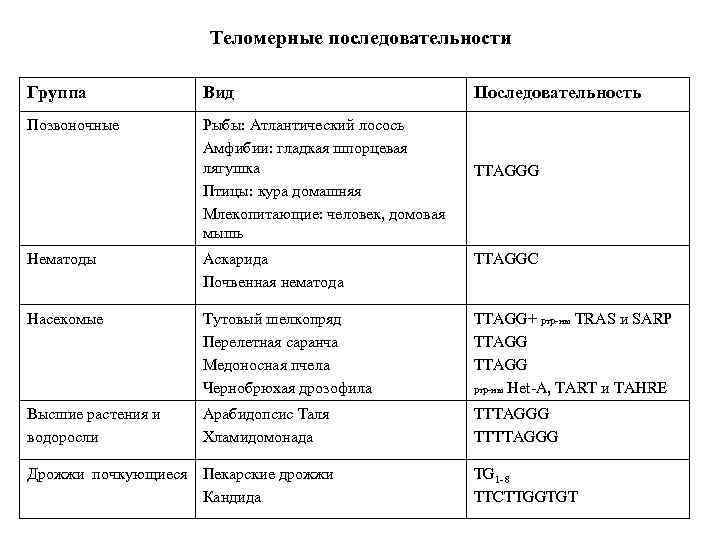 Теломерные последовательности Группа Вид Последовательность Позвоночные Рыбы: Атлантический лосось Амфибии: гладкая шпорцевая лягушка Птицы: кура домашняя Млекопитающие: человек, домовая мышь TTAGGG Нематоды Аскарида Почвенная нематода TTAGGC Насекомые Тутовый шелкопряд Перелетная саранча Медоносная пчела Чернобрюхая дрозофила TTAGG+ ртр-ны TRAS и SARP TTAGG ртр-ны Het-A, TART и TAHRE Высшие растения и водоросли Арабидопсис Таля Хламидомонада TTTAGGG TTTTAGGG Дрожжи почкующиеся Пекарские дрожжи Кандида TG 1 -8 TTCTTGGTGT
Теломерные последовательности Группа Вид Последовательность Позвоночные Рыбы: Атлантический лосось Амфибии: гладкая шпорцевая лягушка Птицы: кура домашняя Млекопитающие: человек, домовая мышь TTAGGG Нематоды Аскарида Почвенная нематода TTAGGC Насекомые Тутовый шелкопряд Перелетная саранча Медоносная пчела Чернобрюхая дрозофила TTAGG+ ртр-ны TRAS и SARP TTAGG ртр-ны Het-A, TART и TAHRE Высшие растения и водоросли Арабидопсис Таля Хламидомонада TTTAGGG TTTTAGGG Дрожжи почкующиеся Пекарские дрожжи Кандида TG 1 -8 TTCTTGGTGT
 Замена теломерных повторов на другие: 1. Саттелитная ДНК: Лук-батун (Аllium ßstulosum) 2. Ретротранспозоны: Дрозофила (Drosophila melanogaster) Тутовый шелкопряд (Bombyx mori) 3. Рибосомная ДНК и другие тандемные повторы: Лук репчатый (Allium сера) Хирономусы Москиты
Замена теломерных повторов на другие: 1. Саттелитная ДНК: Лук-батун (Аllium ßstulosum) 2. Ретротранспозоны: Дрозофила (Drosophila melanogaster) Тутовый шелкопряд (Bombyx mori) 3. Рибосомная ДНК и другие тандемные повторы: Лук репчатый (Allium сера) Хирономусы Москиты
 Прерывистые теломеры: Непрацентарные млекопитающие Бурозубка иберийская (Sorex granarius) Флуоресцентная гибридизация in situ на фибриллах S. granarius с 18 S рибосомной и PNA теломерной пробами
Прерывистые теломеры: Непрацентарные млекопитающие Бурозубка иберийская (Sorex granarius) Флуоресцентная гибридизация in situ на фибриллах S. granarius с 18 S рибосомной и PNA теломерной пробами
 Длина теломер Вид Инфузория ресничная Пекарские дрожжи Резуховидка Таля Нематода свободноживущая Мышь домовая (лаб) Мышь аборигенная Человек Бурозубка обыкновенная Бурозубка иберийская Дикая свинья Овца домашняя Кура домашняя Длина теломер, т. п. н. 0. 35 0. 3 2 4 2 9 20 100 5 25 5 15 6 15 213 300 и 3 4 До 18 До 25 10 − 2000 человек бурозубка
Длина теломер Вид Инфузория ресничная Пекарские дрожжи Резуховидка Таля Нематода свободноживущая Мышь домовая (лаб) Мышь аборигенная Человек Бурозубка обыкновенная Бурозубка иберийская Дикая свинья Овца домашняя Кура домашняя Длина теломер, т. п. н. 0. 35 0. 3 2 4 2 9 20 100 5 25 5 15 6 15 213 300 и 3 4 До 18 До 25 10 − 2000 человек бурозубка
 Структура теломеры: теломерная петля 50 200 п. н. электронная микрофотография
Структура теломеры: теломерная петля 50 200 п. н. электронная микрофотография
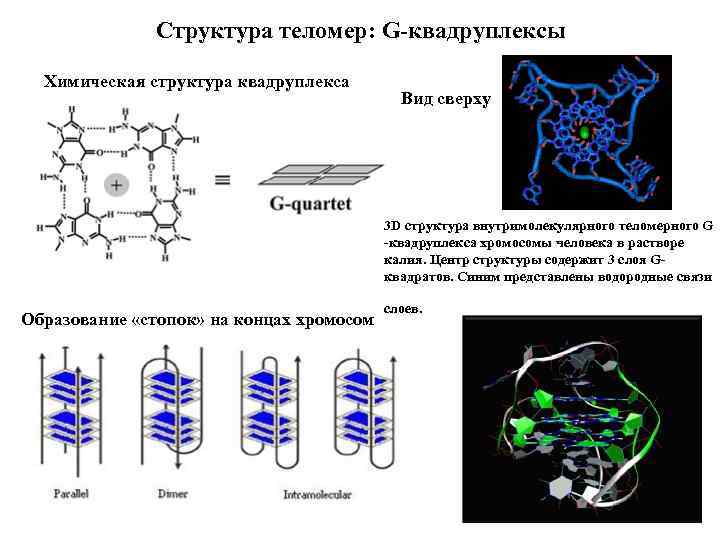 Структура теломер: G квадруплексы Химическая структура квадруплекса Вид сверху 3 D структура внутримолекулярного теломерного G квадруплекса хромосомы человека в растворе калия. Центр структуры содержит 3 слоя G квадратов. Синим представлены водородные связи Образование «стопок» на концах хромосом слоев.
Структура теломер: G квадруплексы Химическая структура квадруплекса Вид сверху 3 D структура внутримолекулярного теломерного G квадруплекса хромосомы человека в растворе калия. Центр структуры содержит 3 слоя G квадратов. Синим представлены водородные связи Образование «стопок» на концах хромосом слоев.
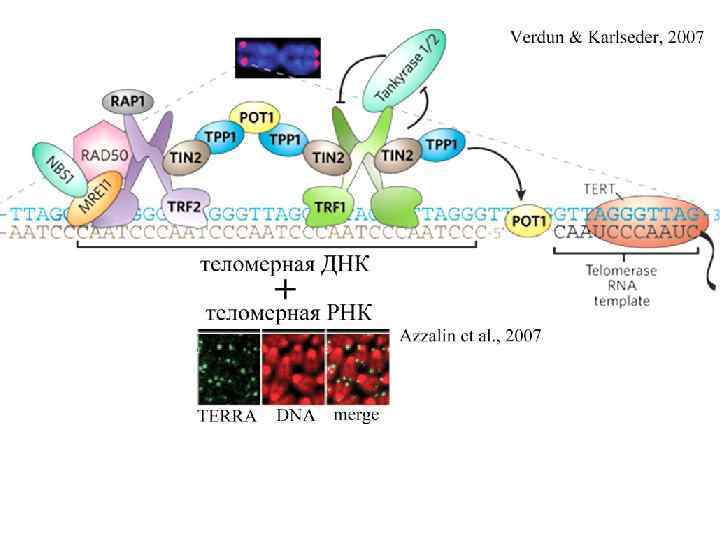
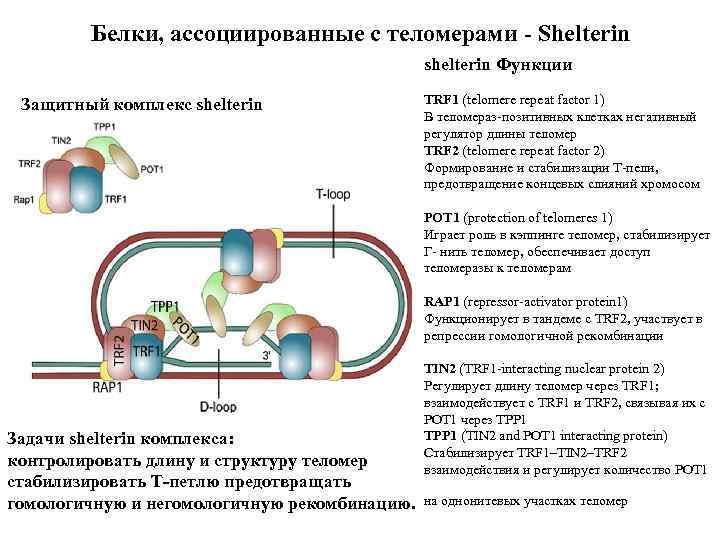 Белки, ассоциированные с теломерами Shelterin shelterin Функции Защитный комплекс shelterin TRF 1 (telomere repeat factor 1) В теломераз-позитивных клетках негативный регулятор длины теломер TRF 2 (telomere repeat factor 2) Формирование и стабилизации Т-пели, предотвращение концевых слияний хромосом POT 1 (protection of telomeres 1) Играет роль в кэппинге теломер, стабилизирует Г- нить теломер, обеспечивает доступ теломеразы к теломерам RAP 1 (repressor-activator protein 1) Функционирует в тандеме с TRF 2, участвует в репрессии гомологичной рекомбинации Задачи shelterin комплекса: контролировать длину и структуру теломер стабилизировать Т петлю предотвращать гомологичную и негомологичную рекомбинацию. TIN 2 (TRF 1 -interacting nuclear protein 2) Регулирует длину теломер через TRF 1; взаимодействует с TRF 1 и TRF 2, связывая их с POT 1 через TPP 1 (TIN 2 and POT 1 interacting protein) Стабилизирует TRF 1–TIN 2–TRF 2 взаимодействия и регулирует количество POT 1 на однонитевых участках теломер
Белки, ассоциированные с теломерами Shelterin shelterin Функции Защитный комплекс shelterin TRF 1 (telomere repeat factor 1) В теломераз-позитивных клетках негативный регулятор длины теломер TRF 2 (telomere repeat factor 2) Формирование и стабилизации Т-пели, предотвращение концевых слияний хромосом POT 1 (protection of telomeres 1) Играет роль в кэппинге теломер, стабилизирует Г- нить теломер, обеспечивает доступ теломеразы к теломерам RAP 1 (repressor-activator protein 1) Функционирует в тандеме с TRF 2, участвует в репрессии гомологичной рекомбинации Задачи shelterin комплекса: контролировать длину и структуру теломер стабилизировать Т петлю предотвращать гомологичную и негомологичную рекомбинацию. TIN 2 (TRF 1 -interacting nuclear protein 2) Регулирует длину теломер через TRF 1; взаимодействует с TRF 1 и TRF 2, связывая их с POT 1 через TPP 1 (TIN 2 and POT 1 interacting protein) Стабилизирует TRF 1–TIN 2–TRF 2 взаимодействия и регулирует количество POT 1 на однонитевых участках теломер
 shelterin Функции TRF 1 (telomere repeat factor 1) ый регулятор длины теломер В теломераз-позитивных клетках негативн TRF 2 (telomere repeat factor 2) Формирование и стабилизации Т-пели, предотвращение концевых слияний хромосом POT 1 (protection of telomeres 1) Играет роль в кэппинге теломер, стабилизирует Г- нить теломер, обеспечивает доступ теломеразы к теломерам RAP 1 (repressor-activator protein 1) Функционирует в тандеме с TRF 2, участвует в репрессии гомологичной рекомбинации TIN 2 (TRF 1 -interacting nuclear protein 2) Регулирует длину теломер через TRF 1; взаимодействует с TRF 1 и TRF 2, связывая их с POT 1 через TPP 1 (TIN 2 and POT 1 interacting protein) Стабилизирует TRF 1–TIN 2–TRF 2 взаимодействия и регулирует количество POT 1 на однонитевых участках теломер
shelterin Функции TRF 1 (telomere repeat factor 1) ый регулятор длины теломер В теломераз-позитивных клетках негативн TRF 2 (telomere repeat factor 2) Формирование и стабилизации Т-пели, предотвращение концевых слияний хромосом POT 1 (protection of telomeres 1) Играет роль в кэппинге теломер, стабилизирует Г- нить теломер, обеспечивает доступ теломеразы к теломерам RAP 1 (repressor-activator protein 1) Функционирует в тандеме с TRF 2, участвует в репрессии гомологичной рекомбинации TIN 2 (TRF 1 -interacting nuclear protein 2) Регулирует длину теломер через TRF 1; взаимодействует с TRF 1 и TRF 2, связывая их с POT 1 через TPP 1 (TIN 2 and POT 1 interacting protein) Стабилизирует TRF 1–TIN 2–TRF 2 взаимодействия и регулирует количество POT 1 на однонитевых участках теломер
 Белки, ассоциированные с теломерами – не Shelterin Белки, не входящие в Shelterin Функции Ku, связывается через TRF 1 Связывается с двунитевыми разрывами ДНК и регулирует репарациию ДНК путем негомологичной рекомбинации, регулирует количество теломеразы на теломерах. комплекс MRN (Mre 11 -Rad 50 -Nbs 1 ), связывается через TRF 2 Белки репарации путем рекомбинации, на теломерах участвуют в формировании Т-петли ATM, связывается через TRF 2 Является сигнальным белком на двунитевые разрывы ДНК при критическом укорочении теломер WRN helicases, связывается через TRF 2 Участвует в процессах репарации и репликации ДНК. Раскручивает Т-петли и Г-квадруплексы на теломерах, подавляет сестринские обмены хроматид BLM helicase участвует в репарации поврежденных репликативных вилок, облегчает репликацию теломер за счет раскручивания двунитевой ДНК впереди репликативной вилки Tankyrases, связывается через TRF 1 Позитивно регулируют длину теломеры путем ингибирования TRF 1 Rad 51 Участвует в рекомбинационной репарации двунитевых разрывов ДНК и в защите теломер за счет стабилизации T-петли
Белки, ассоциированные с теломерами – не Shelterin Белки, не входящие в Shelterin Функции Ku, связывается через TRF 1 Связывается с двунитевыми разрывами ДНК и регулирует репарациию ДНК путем негомологичной рекомбинации, регулирует количество теломеразы на теломерах. комплекс MRN (Mre 11 -Rad 50 -Nbs 1 ), связывается через TRF 2 Белки репарации путем рекомбинации, на теломерах участвуют в формировании Т-петли ATM, связывается через TRF 2 Является сигнальным белком на двунитевые разрывы ДНК при критическом укорочении теломер WRN helicases, связывается через TRF 2 Участвует в процессах репарации и репликации ДНК. Раскручивает Т-петли и Г-квадруплексы на теломерах, подавляет сестринские обмены хроматид BLM helicase участвует в репарации поврежденных репликативных вилок, облегчает репликацию теломер за счет раскручивания двунитевой ДНК впереди репликативной вилки Tankyrases, связывается через TRF 1 Позитивно регулируют длину теломеры путем ингибирования TRF 1 Rad 51 Участвует в рекомбинационной репарации двунитевых разрывов ДНК и в защите теломер за счет стабилизации T-петли
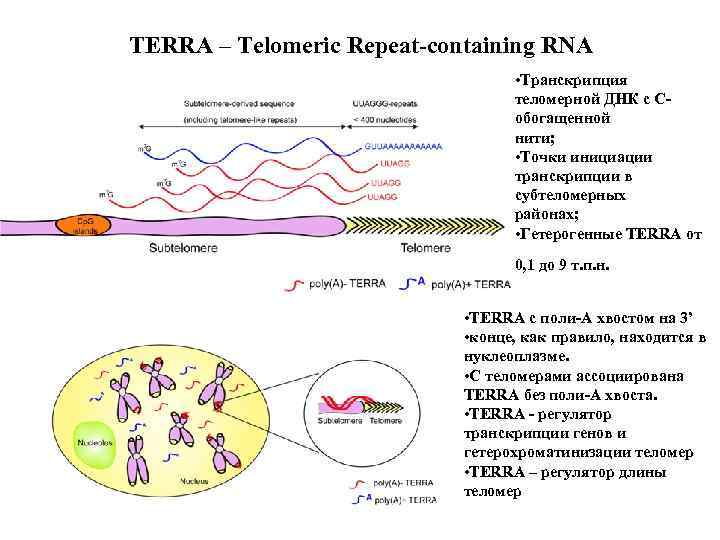 TERRA – Telomeric Repeat containing RNA • Транскрипция теломерной ДНК с C обогащенной нити; • Точки инициации транскрипции в субтеломерных районах; • Гетерогенные TERRA от 0, 1 до 9 т. п. н. • TERRA c поли А хвостом на 3’ • конце, как правило, находится в нуклеоплазме. • С теломерами ассоциирована TERRA без поли А хвоста. • TERRA регулятор транскрипции генов и гетерохроматинизации теломер • TERRA – регулятор длины теломер
TERRA – Telomeric Repeat containing RNA • Транскрипция теломерной ДНК с C обогащенной нити; • Точки инициации транскрипции в субтеломерных районах; • Гетерогенные TERRA от 0, 1 до 9 т. п. н. • TERRA c поли А хвостом на 3’ • конце, как правило, находится в нуклеоплазме. • С теломерами ассоциирована TERRA без поли А хвоста. • TERRA регулятор транскрипции генов и гетерохроматинизации теломер • TERRA – регулятор длины теломер


