ВИЧ онковирусы.ppt
- Количество слайдов: 24
 Таксономия ретровирусов Семейство Retroviridae Подсемейства: o - Oncovirinae (онковирусы), ; o - Lentivirinae (лентивирусы), o - Spumavirinae (спумавирусы, или пенящие вирусы). Рода: o Alpharetrovirus o Betaretrovirus o Gammaretrovirus o Deltaretrovirus o Epsilonretrovirus o Lentivirus семейство Retroviridae o Spumavirus
Таксономия ретровирусов Семейство Retroviridae Подсемейства: o - Oncovirinae (онковирусы), ; o - Lentivirinae (лентивирусы), o - Spumavirinae (спумавирусы, или пенящие вирусы). Рода: o Alpharetrovirus o Betaretrovirus o Gammaretrovirus o Deltaretrovirus o Epsilonretrovirus o Lentivirus семейство Retroviridae o Spumavirus
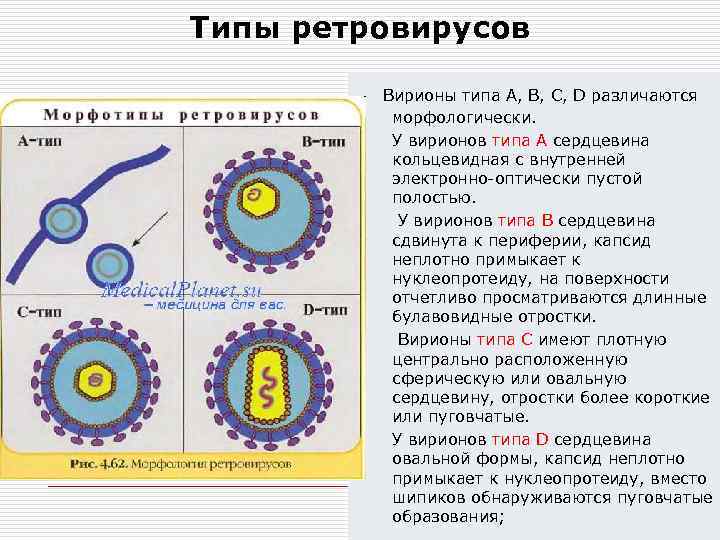 Типы ретровирусов o o Вирионы типа А, В, С, D различаются морфологически. У вирионов типа А сердцевина кольцевидная с внутренней электронно-оптически пустой полостью. У вирионов типа В сердцевина сдвинута к периферии, капсид неплотно примыкает к нуклеопротеиду, на поверхности отчетливо просматриваются длинные булавовидные отростки. Вирионы типа С имеют плотную центрально расположенную сферическую или овальную сердцевину, отростки более короткие или пуговчатые. У вирионов типа D сердцевина овальной формы, капсид неплотно примыкает к нуклеопротеиду, вместо шипиков обнаруживаются пуговчатые образования;
Типы ретровирусов o o Вирионы типа А, В, С, D различаются морфологически. У вирионов типа А сердцевина кольцевидная с внутренней электронно-оптически пустой полостью. У вирионов типа В сердцевина сдвинута к периферии, капсид неплотно примыкает к нуклеопротеиду, на поверхности отчетливо просматриваются длинные булавовидные отростки. Вирионы типа С имеют плотную центрально расположенную сферическую или овальную сердцевину, отростки более короткие или пуговчатые. У вирионов типа D сердцевина овальной формы, капсид неплотно примыкает к нуклеопротеиду, вместо шипиков обнаруживаются пуговчатые образования;
 Структура вириона n n n Вирионы имеют 6 структурных белков, из них 4 внутренних (капсидных) негликолизированных и 2 гликопротеина оболочки. Капсидные белки несут группоспецифические межвидовые антигены и являются основой для разделения вирусов на роды и подроды. Гликопротеиды являются типоспецифическими антигенами, участвуют в реакции нейтрализации. Геномы ретровирусов содержат три открытые считывающие рамки, которые кодируют белки, находящиеся в зрелых вирусах: - коды группоспецифического антигена (gag) для ядра и структурных белков вируса; - коды полимеразы (pol) для обратной транскриптазы и интегразы; - коды оболочки (env) для белков покрытия ретровируса. К регуляторным генам относятся: - tat (трансактиватор всех вирусных белков), - rev (регулятор экспрессии вирионных белков), - vif (вирионный инфекционный фактор), - vpr (функции остаются неясными), - nef (негативный фактор экспрессии), - vpx (функции неизвестны)
Структура вириона n n n Вирионы имеют 6 структурных белков, из них 4 внутренних (капсидных) негликолизированных и 2 гликопротеина оболочки. Капсидные белки несут группоспецифические межвидовые антигены и являются основой для разделения вирусов на роды и подроды. Гликопротеиды являются типоспецифическими антигенами, участвуют в реакции нейтрализации. Геномы ретровирусов содержат три открытые считывающие рамки, которые кодируют белки, находящиеся в зрелых вирусах: - коды группоспецифического антигена (gag) для ядра и структурных белков вируса; - коды полимеразы (pol) для обратной транскриптазы и интегразы; - коды оболочки (env) для белков покрытия ретровируса. К регуляторным генам относятся: - tat (трансактиватор всех вирусных белков), - rev (регулятор экспрессии вирионных белков), - vif (вирионный инфекционный фактор), - vpr (функции остаются неясными), - nef (негативный фактор экспрессии), - vpx (функции неизвестны)
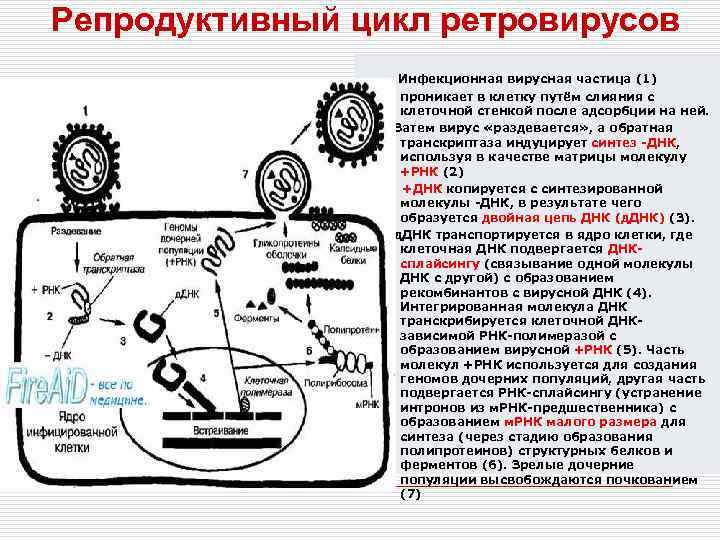 Репродуктивный цикл ретровирусов Инфекционная вирусная частица (1) проникает в клетку путём слияния с клеточной стенкой после адсорбции на ней. Затем вирус «раздевается» , а обратная транскриптаза индуцирует синтез -ДНК, используя в качестве матрицы молекулу +РНК (2) +ДНК копируется с синтезированной молекулы -ДНК, в результате чего образуется двойная цепь ДНК (д. ДНК) (3). д. ДНК транспортируется в ядро клетки, где клеточная ДНК подвергается ДНКсплайсингу (связывание одной молекулы ДНК с другой) с образованием рекомбинантов с вирусной ДНК (4). Интегрированная молекула ДНК транскрибируется клеточной ДНКзависимой РНК-полимеразой с образованием вирусной +РНК (5). Часть молекул +РНК используется для создания геномов дочерних популяций, другая часть подвергается РНК-сплайсингу (устранение интронов из м. РНК-предшественника) с образованием м. РНК малого размера для синтеза (через стадию образования полипротеинов) структурных белков и ферментов (6). Зрелые дочерние популяции высвобождаются почкованием (7)
Репродуктивный цикл ретровирусов Инфекционная вирусная частица (1) проникает в клетку путём слияния с клеточной стенкой после адсорбции на ней. Затем вирус «раздевается» , а обратная транскриптаза индуцирует синтез -ДНК, используя в качестве матрицы молекулу +РНК (2) +ДНК копируется с синтезированной молекулы -ДНК, в результате чего образуется двойная цепь ДНК (д. ДНК) (3). д. ДНК транспортируется в ядро клетки, где клеточная ДНК подвергается ДНКсплайсингу (связывание одной молекулы ДНК с другой) с образованием рекомбинантов с вирусной ДНК (4). Интегрированная молекула ДНК транскрибируется клеточной ДНКзависимой РНК-полимеразой с образованием вирусной +РНК (5). Часть молекул +РНК используется для создания геномов дочерних популяций, другая часть подвергается РНК-сплайсингу (устранение интронов из м. РНК-предшественника) с образованием м. РНК малого размера для синтеза (через стадию образования полипротеинов) структурных белков и ферментов (6). Зрелые дочерние популяции высвобождаются почкованием (7)
 семейство Retroviridae подсемейство Lentivirinae Вирус иммунодефицита человека
семейство Retroviridae подсемейство Lentivirinae Вирус иммунодефицита человека
 Изменчивость ретровирусов (ВИЧ) o o o Геном вирусов чрезвычайно вариабелен, что характерно для РНК содержащих вирусов и, в особенности, для ретровирусов. Скорость мутирования у HIV-1 в миллион раз выше, чем у млекопитающих, и составляет 10 -4 - 10 - 3 мутаций на одну пару оснований на один цикл репликации. Это означает, что в вирусном геноме, длина которого, как у всех ретровирусов примерно 10 000 пар оснований, за одну репликацию происходит от одной до десяти мутаций. Мутации происходят и в так называемой иммуннодоминантной петле V 3 вируса иммунодефицита. Эта петля входит в состав белка оболочки gp 120, имеет длину около 30 аминокислотных остатков и опосредует нейтрализацию вируса антителами. В частности благодаря быстрым мутационным изменениям в ней, вирус легко избегает уничтожения иммунной системой хозяина и образует варианты, устойчивые к нейтрализации антителами.
Изменчивость ретровирусов (ВИЧ) o o o Геном вирусов чрезвычайно вариабелен, что характерно для РНК содержащих вирусов и, в особенности, для ретровирусов. Скорость мутирования у HIV-1 в миллион раз выше, чем у млекопитающих, и составляет 10 -4 - 10 - 3 мутаций на одну пару оснований на один цикл репликации. Это означает, что в вирусном геноме, длина которого, как у всех ретровирусов примерно 10 000 пар оснований, за одну репликацию происходит от одной до десяти мутаций. Мутации происходят и в так называемой иммуннодоминантной петле V 3 вируса иммунодефицита. Эта петля входит в состав белка оболочки gp 120, имеет длину около 30 аминокислотных остатков и опосредует нейтрализацию вируса антителами. В частности благодаря быстрым мутационным изменениям в ней, вирус легко избегает уничтожения иммунной системой хозяина и образует варианты, устойчивые к нейтрализации антителами.
 Различия ВИЧ-1 и ВИЧ-2 o o В структуре геномов: у ВИЧ-2 имеется один ген, которого нет у ВИЧ-1 (ген vpx), и, наоборот, у ВИЧ-1 имеется ген, которого нет у ВИЧ-2 (ген vpu). Генетический аппарат двух типов вирусов схож между собой по последовательности нуклеотидов чуть более чем на 50%. В результате у ВИЧ-2, например, белки оболочки имеют меньшие размеры, чем у ВИЧ-1. Это приводит к тому, что тест-системы на ВИЧ-1 "не узнают" ВИЧ-2. По своей структуре ВИЧ-2 больше напоминает вирус иммунодефицита обезьян (ВИО) , чем ВИЧ-1. По имеющимся данным, ВИЧ-2 не так многолик, как ВИЧ-1. Возможно, это связано с более поздним его появлением на нашей планете. ВИЧ-1 распространен преимущественно в США, Европе и Центральной Африке, ВИЧ-2 - в Западной Африке и Индии. В США при общем числе ВИЧинфицированных в несколько сотен тысяч, было зарегистрировано всего лишь менее сотни случаев обнаружения ВИЧ-2. В России в основном встречается ВИЧ-1, а ВИЧ-2 обнаруживался пока очень редко.
Различия ВИЧ-1 и ВИЧ-2 o o В структуре геномов: у ВИЧ-2 имеется один ген, которого нет у ВИЧ-1 (ген vpx), и, наоборот, у ВИЧ-1 имеется ген, которого нет у ВИЧ-2 (ген vpu). Генетический аппарат двух типов вирусов схож между собой по последовательности нуклеотидов чуть более чем на 50%. В результате у ВИЧ-2, например, белки оболочки имеют меньшие размеры, чем у ВИЧ-1. Это приводит к тому, что тест-системы на ВИЧ-1 "не узнают" ВИЧ-2. По своей структуре ВИЧ-2 больше напоминает вирус иммунодефицита обезьян (ВИО) , чем ВИЧ-1. По имеющимся данным, ВИЧ-2 не так многолик, как ВИЧ-1. Возможно, это связано с более поздним его появлением на нашей планете. ВИЧ-1 распространен преимущественно в США, Европе и Центральной Африке, ВИЧ-2 - в Западной Африке и Индии. В США при общем числе ВИЧинфицированных в несколько сотен тысяч, было зарегистрировано всего лишь менее сотни случаев обнаружения ВИЧ-2. В России в основном встречается ВИЧ-1, а ВИЧ-2 обнаруживался пока очень редко.
 Названия и функции основных структурных белков ВИЧ-1 o o o gp 41 (TM, transmembrane) трансмембранный гликопротеин массой 41 к. Да. Располагается во внешнем слое липидной мембраны. Играет роль «якоря» , удерживающего молекулы другого белка — gp 120 (SU, surface) гликопротеин массой 120 к. Да. Наружный белок вириона. Нековалентно связан с трансмембранным белком gp 41. С одной молекулой gp 41 связаны 3 — 5 молекул gp 120. Способен связываться с CD 4 рецептором. Играет важную роль в процессе проникновения вируса в клетку. p 24 (CA, capsid). Белок массой 24 к. Да, белок, образующий оболочку нуклеотида (капсида) вируса p 17 (MA, matrix). Матриксный белок массой 17 к. Да. Около двух тысяч молекул этого белка образуют слой толщиной 5 — 7 нм, располагающийся между внешней оболочкой и нуклеотидом вируса. p 7 (NC, nucleocapsid). Нуклеокапсидный белок массой 7 к. Да. Белок, входящий в состав нуклеотида вируса. Образует комплекс с вирусной РНК.
Названия и функции основных структурных белков ВИЧ-1 o o o gp 41 (TM, transmembrane) трансмембранный гликопротеин массой 41 к. Да. Располагается во внешнем слое липидной мембраны. Играет роль «якоря» , удерживающего молекулы другого белка — gp 120 (SU, surface) гликопротеин массой 120 к. Да. Наружный белок вириона. Нековалентно связан с трансмембранным белком gp 41. С одной молекулой gp 41 связаны 3 — 5 молекул gp 120. Способен связываться с CD 4 рецептором. Играет важную роль в процессе проникновения вируса в клетку. p 24 (CA, capsid). Белок массой 24 к. Да, белок, образующий оболочку нуклеотида (капсида) вируса p 17 (MA, matrix). Матриксный белок массой 17 к. Да. Около двух тысяч молекул этого белка образуют слой толщиной 5 — 7 нм, располагающийся между внешней оболочкой и нуклеотидом вируса. p 7 (NC, nucleocapsid). Нуклеокапсидный белок массой 7 к. Да. Белок, входящий в состав нуклеотида вируса. Образует комплекс с вирусной РНК.
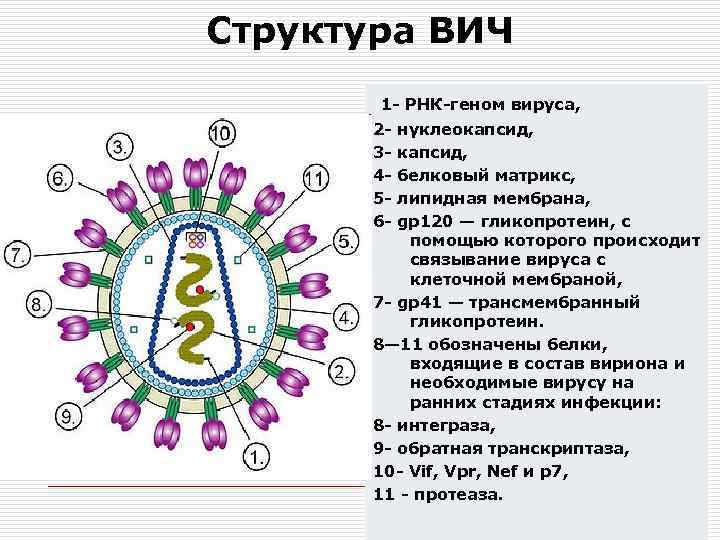 Структура ВИЧ 1 - РНК-геном вируса, 23456 - нуклеокапсид, белковый матрикс, липидная мембрана, gp 120 — гликопротеин, с помощью которого происходит связывание вируса с клеточной мембраной, 7 - gp 41 — трансмембранный гликопротеин. 8— 11 обозначены белки, входящие в состав вириона и необходимые вирусу на ранних стадиях инфекции: 8 - интеграза, 9 - обратная транскриптаза, 10 - Vif, Vpr, Nef и p 7, 11 - протеаза.
Структура ВИЧ 1 - РНК-геном вируса, 23456 - нуклеокапсид, белковый матрикс, липидная мембрана, gp 120 — гликопротеин, с помощью которого происходит связывание вируса с клеточной мембраной, 7 - gp 41 — трансмембранный гликопротеин. 8— 11 обозначены белки, входящие в состав вириона и необходимые вирусу на ранних стадиях инфекции: 8 - интеграза, 9 - обратная транскриптаза, 10 - Vif, Vpr, Nef и p 7, 11 - протеаза.
 Жизненный цикл ВИЧ o o o o o После проникновения в клетку вирусу, чтобы жить и развиваться, необходимо свою генетическую информацию, записанную в форме полимерной молекулы РНК, превратить в ДНКовую форму. Для этого клетка синтезирует белок-фермент, закодированный в вирусном геноме, под названием обратная транскриптаза. Этот фермент осуществляет образование на РНК однонитевой ДНК-копии. Затем с помощью того же фермента достраивается вторая нить ДНК. И, наконец, новоиспеченная двунитевая ДНК-копия вируса с помощью специального вирусного фермента интегразы встраивается внутрь ДНК клетки-хозяина. Такое состояние вируса получило название провируса. ДНК провируса имеет размер около 10 тыс. пар нуклеотидов (п. н. ) и окружена с обеих сторон одинаковыми последовательностями нуклеотидов, называемыми длинными концевыми повторами, размером по 600 -700 п. н. каждый. В этих длинных концевых повторах содержатся все необходимые для регуляции работы генов элементы, которые управляют работой вирусных генов в новом для них месте. После внедрения в ДНК клетки-хозяина провирус становится для клетки "родным", как и собственные гены. Считалось, что вирус, превратившись в провирус, успокаивается; эту форму иногда называют "покоящимся вирусом". Через некоторе время наступает активация провируса. Сначала происходит транскрипция провируса, в результате которой образуются новые вирусные РНК, т. е. новые геномы. Подчиняясь генетической программе ВИЧ, которая теперь стала по сути дела как собственная, клетка начинает синтезировать на вирусной РНК вирусные белки. Поскольку первоначально синтезируются большие молекулы-предшественники, другой вирусный белок - протеаза - разрезает их на строго определенные блоки. Клетка активно производит компоненты вируса, истощая себя. Затем на поверхности клеточной мембраны из этих компонентов происходит предварительная "сборка" новых вирусных частиц из синтезированных клеткой блоков. Новые вирусы "отпочковываются" от клетки, после чего вирусы становятся "зрелым", способными инфицировать новые клетки. Жизненный цикл вируса неизбежно заканчивается гибелью инфицированного Тхелпера. По времени этот цикл составляет менее суток (обычно от 15 до 20 часов).
Жизненный цикл ВИЧ o o o o o После проникновения в клетку вирусу, чтобы жить и развиваться, необходимо свою генетическую информацию, записанную в форме полимерной молекулы РНК, превратить в ДНКовую форму. Для этого клетка синтезирует белок-фермент, закодированный в вирусном геноме, под названием обратная транскриптаза. Этот фермент осуществляет образование на РНК однонитевой ДНК-копии. Затем с помощью того же фермента достраивается вторая нить ДНК. И, наконец, новоиспеченная двунитевая ДНК-копия вируса с помощью специального вирусного фермента интегразы встраивается внутрь ДНК клетки-хозяина. Такое состояние вируса получило название провируса. ДНК провируса имеет размер около 10 тыс. пар нуклеотидов (п. н. ) и окружена с обеих сторон одинаковыми последовательностями нуклеотидов, называемыми длинными концевыми повторами, размером по 600 -700 п. н. каждый. В этих длинных концевых повторах содержатся все необходимые для регуляции работы генов элементы, которые управляют работой вирусных генов в новом для них месте. После внедрения в ДНК клетки-хозяина провирус становится для клетки "родным", как и собственные гены. Считалось, что вирус, превратившись в провирус, успокаивается; эту форму иногда называют "покоящимся вирусом". Через некоторе время наступает активация провируса. Сначала происходит транскрипция провируса, в результате которой образуются новые вирусные РНК, т. е. новые геномы. Подчиняясь генетической программе ВИЧ, которая теперь стала по сути дела как собственная, клетка начинает синтезировать на вирусной РНК вирусные белки. Поскольку первоначально синтезируются большие молекулы-предшественники, другой вирусный белок - протеаза - разрезает их на строго определенные блоки. Клетка активно производит компоненты вируса, истощая себя. Затем на поверхности клеточной мембраны из этих компонентов происходит предварительная "сборка" новых вирусных частиц из синтезированных клеткой блоков. Новые вирусы "отпочковываются" от клетки, после чего вирусы становятся "зрелым", способными инфицировать новые клетки. Жизненный цикл вируса неизбежно заканчивается гибелью инфицированного Тхелпера. По времени этот цикл составляет менее суток (обычно от 15 до 20 часов).
 Активация провируса o o o В процессе активации провируса участвует множество разнообразных факторов: общее состояние иммунной системы до заражения ВИЧ, возраст, генетические особенности организма, образ жизни, другие вирусы, которые успели проникнуть в организм до появления в нем ВИЧ. Активирующими факторами могут выступать различные белки самой клетки, которые, продолжая выполнять свои основные функции в клетке, одновременно "будят" вирус. Эти белки носят различное название (антигены, цитокины, факторы транскрипции, трансактиваторы и др. ), и в норме они участвуют в регуляции работы собственных генов, определяющих правильное функционирование клетки, ее размножение и гибель(апоптоз).
Активация провируса o o o В процессе активации провируса участвует множество разнообразных факторов: общее состояние иммунной системы до заражения ВИЧ, возраст, генетические особенности организма, образ жизни, другие вирусы, которые успели проникнуть в организм до появления в нем ВИЧ. Активирующими факторами могут выступать различные белки самой клетки, которые, продолжая выполнять свои основные функции в клетке, одновременно "будят" вирус. Эти белки носят различное название (антигены, цитокины, факторы транскрипции, трансактиваторы и др. ), и в норме они участвуют в регуляции работы собственных генов, определяющих правильное функционирование клетки, ее размножение и гибель(апоптоз).
 Группы повышенного риска o o o лица, употребляющие инъекционные наркотики, использующие общую посуду для приготовления наркотика (распространение вируса через иглу шприца и общую посуду для растворов наркотиков); а также их половые партнёры. лица (независимо от сексуальной ориентации), практикующие незащищённый анальный секс (в частности, примерно 25 % случаев незащищённого анального секса среди серопозитивных геев составляют лица, сознательно избегающие использование презервативов, несмотря на свою осведомлённость о возможности заражения ВИЧ; небольшую долю лица, целенаправленно стремящиеся заразиться ВИЧ и выбирающие в качестве партнёров для секса ВИЧ-позитивных или потенциально позитивных индивидуумов. лица, которым сделали переливание непроверенной донорской крови; врачи; больные другими венерическими заболеваниями; коммерческие секс-работники и их клиенты.
Группы повышенного риска o o o лица, употребляющие инъекционные наркотики, использующие общую посуду для приготовления наркотика (распространение вируса через иглу шприца и общую посуду для растворов наркотиков); а также их половые партнёры. лица (независимо от сексуальной ориентации), практикующие незащищённый анальный секс (в частности, примерно 25 % случаев незащищённого анального секса среди серопозитивных геев составляют лица, сознательно избегающие использование презервативов, несмотря на свою осведомлённость о возможности заражения ВИЧ; небольшую долю лица, целенаправленно стремящиеся заразиться ВИЧ и выбирающие в качестве партнёров для секса ВИЧ-позитивных или потенциально позитивных индивидуумов. лица, которым сделали переливание непроверенной донорской крови; врачи; больные другими венерическими заболеваниями; коммерческие секс-работники и их клиенты.
 Патогенез Основа патогенеза ВИЧ до сих пор не очень ясна. o Одной из черт патогенеза является гибель CD 4+ Т клеток (Т хелперов), концентрация которых медленно, но неуклонно снижается. Также снижается количество дендритных клеток, профессиональных антиген презентирующих клеток, которые в основном и начинают иммунный ответ к патогену, что по важности последствий для иммунной системы является может даже более сильным фактором нежели гибель Т хелперов. Причины гибели дендритных клеток остаются неясными. Некоторые причины гибели хелперов: o Взрывная репродукция вируса. o Слияние мембран зараженных и не зараженных хелперов с образованием не жизнеспособных симпластов(хелперы становятся липкими). Симпласты были обнаружены только в лабораторных условиях в условиях культур клеток. o Атака зараженных клеток цитотоксичными лимфоцитами. o Адсорбция свободного gp 120 на CD 4+ незараженных хелперов с их последующей атакой цитотоксическими лимфоцитами. o Основной причиной гибели Т клеток при ВИЧ инфекции является программируемая клеточная гибель (апоптоз). Даже на стадии СПИДа уровень инфицированности Т 4 клеток составляет 1: 1000, что говорит о том, что вирус сам по себе не способен убить такое количество клеток, которое погибает при ВИЧ инфекции. Так же не объяснить столь массовую гибель Т клеток и цитотоксическим действием других клеток. o Системные нарушения в работе иммунной системы со временем нарастают вплоть до полной неспособности осуществлять свою основную функцию — защиту организма от болезнетворных организмов.
Патогенез Основа патогенеза ВИЧ до сих пор не очень ясна. o Одной из черт патогенеза является гибель CD 4+ Т клеток (Т хелперов), концентрация которых медленно, но неуклонно снижается. Также снижается количество дендритных клеток, профессиональных антиген презентирующих клеток, которые в основном и начинают иммунный ответ к патогену, что по важности последствий для иммунной системы является может даже более сильным фактором нежели гибель Т хелперов. Причины гибели дендритных клеток остаются неясными. Некоторые причины гибели хелперов: o Взрывная репродукция вируса. o Слияние мембран зараженных и не зараженных хелперов с образованием не жизнеспособных симпластов(хелперы становятся липкими). Симпласты были обнаружены только в лабораторных условиях в условиях культур клеток. o Атака зараженных клеток цитотоксичными лимфоцитами. o Адсорбция свободного gp 120 на CD 4+ незараженных хелперов с их последующей атакой цитотоксическими лимфоцитами. o Основной причиной гибели Т клеток при ВИЧ инфекции является программируемая клеточная гибель (апоптоз). Даже на стадии СПИДа уровень инфицированности Т 4 клеток составляет 1: 1000, что говорит о том, что вирус сам по себе не способен убить такое количество клеток, которое погибает при ВИЧ инфекции. Так же не объяснить столь массовую гибель Т клеток и цитотоксическим действием других клеток. o Системные нарушения в работе иммунной системы со временем нарастают вплоть до полной неспособности осуществлять свою основную функцию — защиту организма от болезнетворных организмов.
 Классификация ВИЧ-инфекции (В. И. Покровский, 1989) I. Стадия инкубации. o II. Стадия первичных проявлений: А — острая лихорадочная фаза; Б — бессимптомная фаза; В — персистирующая генерализованная лимфоаденопатия. o III. Стадия вторичных заболеваний: А — потеря массы тела менее 10%, поверхностные грибковые, бактериальные, вирусные поражения кожи и слизистых оболочек, опоясывающий лишай, повторные фарингиты, синуситы; Б — прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 месяца, волосатая лейкоплакия, туберкулез легких, повторные или стойкие бактериальные, грибковые, вирусные, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши; В — генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелегочный туберкулез, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии. o IV. Терминальная стадия. Выделяют три иммунологические категории в зависимости от уровня СД 4 лимфоцитов: 1) более 0, 5 х 109/л СД 4 -клеток в 1 мм 3 крови; 2) от 0, 2 до 0, 5 х 109/л в 1 мм 3; 3) менее 0, 2 х 109/л в 1 мм 3. o
Классификация ВИЧ-инфекции (В. И. Покровский, 1989) I. Стадия инкубации. o II. Стадия первичных проявлений: А — острая лихорадочная фаза; Б — бессимптомная фаза; В — персистирующая генерализованная лимфоаденопатия. o III. Стадия вторичных заболеваний: А — потеря массы тела менее 10%, поверхностные грибковые, бактериальные, вирусные поражения кожи и слизистых оболочек, опоясывающий лишай, повторные фарингиты, синуситы; Б — прогрессирующая потеря массы тела более 10%, необъяснимая диарея или лихорадка более 1 месяца, волосатая лейкоплакия, туберкулез легких, повторные или стойкие бактериальные, грибковые, вирусные, протозойные поражения внутренних органов (без диссеминации) или глубокие поражения кожи и слизистых оболочек, повторный или диссеминированный опоясывающий лишай, локализованная саркома Капоши; В — генерализованные бактериальные, вирусные, грибковые, протозойные и паразитарные заболевания, пневмоцистная пневмония, кандидоз пищевода, атипичный микобактериоз, внелегочный туберкулез, кахексия, диссеминированная саркома Капоши, поражения ЦНС различной этиологии. o IV. Терминальная стадия. Выделяют три иммунологические категории в зависимости от уровня СД 4 лимфоцитов: 1) более 0, 5 х 109/л СД 4 -клеток в 1 мм 3 крови; 2) от 0, 2 до 0, 5 х 109/л в 1 мм 3; 3) менее 0, 2 х 109/л в 1 мм 3. o
 Лечение Разработано 3 направления в лечении: 1. этиотропная терапия. Используют противовирусные препараты 2. Иммуностимуляция. Вводят интерлейкин -2, интерфероны и иммуноглобулины. 3. Лечение опухолей, вторичных инфекций и инвазий (применяют ацикловир и др). Современные антиретровирусные препараты можно разделить на три группы. o Нуклеозидные ингибиторы обратной транскриптазы вируса (зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абаковир). o Ненуклеозидные ингибиторы обратной транскриптазы (ифавиренц, делавирдин, невирапин). o Ингибиторы протеазы вируса (индинавир, саквинавир, ритонавир, нельфинавир).
Лечение Разработано 3 направления в лечении: 1. этиотропная терапия. Используют противовирусные препараты 2. Иммуностимуляция. Вводят интерлейкин -2, интерфероны и иммуноглобулины. 3. Лечение опухолей, вторичных инфекций и инвазий (применяют ацикловир и др). Современные антиретровирусные препараты можно разделить на три группы. o Нуклеозидные ингибиторы обратной транскриптазы вируса (зидовудин, диданозин, зальцитабин, ставудин, ламивудин, абаковир). o Ненуклеозидные ингибиторы обратной транскриптазы (ифавиренц, делавирдин, невирапин). o Ингибиторы протеазы вируса (индинавир, саквинавир, ритонавир, нельфинавир).
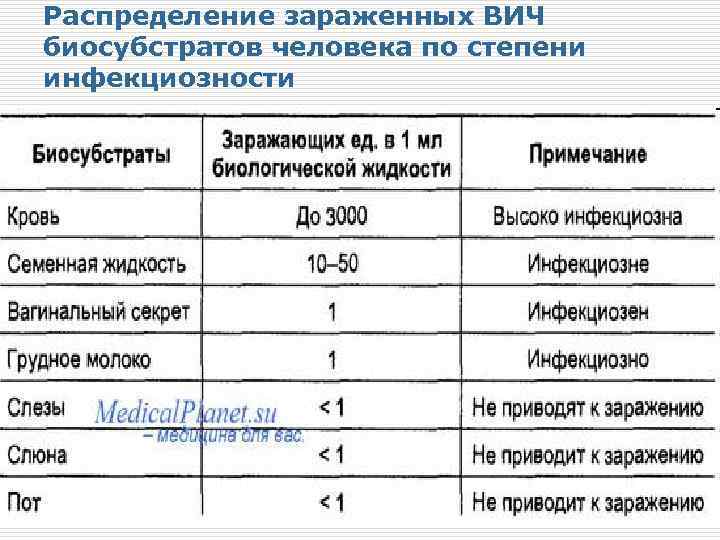 Распределение зараженных ВИЧ биосубстратов человека по степени инфекциозности
Распределение зараженных ВИЧ биосубстратов человека по степени инфекциозности
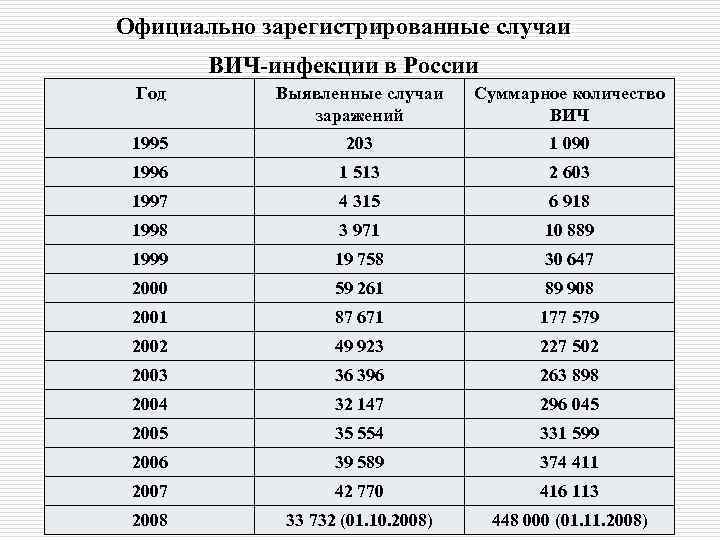 Официально зарегистрированные случаи ВИЧ-инфекции в России Год Выявленные случаи заражений Суммарное количество ВИЧ 1995 203 1 090 1996 1 513 2 603 1997 4 315 6 918 1998 3 971 10 889 1999 19 758 30 647 2000 59 261 89 908 2001 87 671 177 579 2002 49 923 227 502 2003 36 396 263 898 2004 32 147 296 045 2005 35 554 331 599 2006 39 589 374 411 2007 42 770 416 113 2008 33 732 (01. 10. 2008) 448 000 (01. 11. 2008)
Официально зарегистрированные случаи ВИЧ-инфекции в России Год Выявленные случаи заражений Суммарное количество ВИЧ 1995 203 1 090 1996 1 513 2 603 1997 4 315 6 918 1998 3 971 10 889 1999 19 758 30 647 2000 59 261 89 908 2001 87 671 177 579 2002 49 923 227 502 2003 36 396 263 898 2004 32 147 296 045 2005 35 554 331 599 2006 39 589 374 411 2007 42 770 416 113 2008 33 732 (01. 10. 2008) 448 000 (01. 11. 2008)
 Профилактика ВОЗ выделяет 4 основных направления деятельности, направленной на борьбу с эпидемией ВИЧ-инфекции и её последствиями: o o 1. Предупреждение половой передачи ВИЧ, включающее такие элементы, как обучение безопасному половому поведению, распространение презервативов, лечение других ЗППП, обучение поведению, направленному на сознательное лечение этих болезней; 2. Предупреждение передачи ВИЧ через кровь путем снабжения безопасными препаратами, приготовленными из крови. 3. Предупреждение перинатальной передачи ВИЧ методами распространения информации о предупреждении передачи ВИЧ путем обеспечения медицинской помощи, включая консультирование женщин, инфицированных ВИЧ, и проведение химиопрофилактики; 4. Организация медицинской помощи и социальной поддержки больным ВИЧ-инфекцией, их семьям и окружающим.
Профилактика ВОЗ выделяет 4 основных направления деятельности, направленной на борьбу с эпидемией ВИЧ-инфекции и её последствиями: o o 1. Предупреждение половой передачи ВИЧ, включающее такие элементы, как обучение безопасному половому поведению, распространение презервативов, лечение других ЗППП, обучение поведению, направленному на сознательное лечение этих болезней; 2. Предупреждение передачи ВИЧ через кровь путем снабжения безопасными препаратами, приготовленными из крови. 3. Предупреждение перинатальной передачи ВИЧ методами распространения информации о предупреждении передачи ВИЧ путем обеспечения медицинской помощи, включая консультирование женщин, инфицированных ВИЧ, и проведение химиопрофилактики; 4. Организация медицинской помощи и социальной поддержки больным ВИЧ-инфекцией, их семьям и окружающим.
 Алгоритм обследования пациентов (приказ МЗ № 170 от 16. 08. 94) o o o Первичное тестирование сывороток проводится в одной лунке скрининговой тест-системы и при отсутствии положительной реакции пациенту выдается заключение об отсутствии серологических данных инфицирования. При положительном результате теста - проводится дополнительное исследование в двух лунках той же тест-системы для исключения возможной технической ошибки, и только в случае выявления еще одного положительного результата сыворотка направляется на арбитражное исследование. Арбитражный этап обследования заключается в предварительном тестировании поступившей сыворотке в двух лунках "арбитражной" иммуноферментной тест-системы четвертого поколения - "Вироностика-IV" фирмы "Органонтехника", либо "Дженилавия" фирмы "Био. Рад-Санофи". При отрицательном результате, сыворотка считается серонегативной по ВИЧ, при положительном - относится к "ИФА - позитивной" и направляется для окончательного подтверждения серологического диагноза в реакцию иммунного блота (ИБ). При отрицательном и неопределенном результате в реакции ИБ сыворотка остается в группе "ИФА- позитивных" (осуществляется запрос дополнительной пробы), при положительной реакции в ИБ - диагноз ВИЧ- инфекции считается подтвержденным.
Алгоритм обследования пациентов (приказ МЗ № 170 от 16. 08. 94) o o o Первичное тестирование сывороток проводится в одной лунке скрининговой тест-системы и при отсутствии положительной реакции пациенту выдается заключение об отсутствии серологических данных инфицирования. При положительном результате теста - проводится дополнительное исследование в двух лунках той же тест-системы для исключения возможной технической ошибки, и только в случае выявления еще одного положительного результата сыворотка направляется на арбитражное исследование. Арбитражный этап обследования заключается в предварительном тестировании поступившей сыворотке в двух лунках "арбитражной" иммуноферментной тест-системы четвертого поколения - "Вироностика-IV" фирмы "Органонтехника", либо "Дженилавия" фирмы "Био. Рад-Санофи". При отрицательном результате, сыворотка считается серонегативной по ВИЧ, при положительном - относится к "ИФА - позитивной" и направляется для окончательного подтверждения серологического диагноза в реакцию иммунного блота (ИБ). При отрицательном и неопределенном результате в реакции ИБ сыворотка остается в группе "ИФА- позитивных" (осуществляется запрос дополнительной пробы), при положительной реакции в ИБ - диагноз ВИЧ- инфекции считается подтвержденным.
 Отличие ВИЧ от других ретровирусов o o Большинство ретровирусов вызывает неконтролируемый рост клеток хозяина. В то же время патогенетическое действие лентивирусов проявляется в разрушении клеток, которые они инфицируют.
Отличие ВИЧ от других ретровирусов o o Большинство ретровирусов вызывает неконтролируемый рост клеток хозяина. В то же время патогенетическое действие лентивирусов проявляется в разрушении клеток, которые они инфицируют.
 Подразделение ретровирусов по характеру распространения среди хозяев o Экзогенные ретровирусы распространяются горизонтально, и большинство из них не содержит ген onс. К o HTLV стали первыми вирусами, участие которых в развитии опухолей человека было более или менее достоверно доказано. HTLV-I вызывает Т-клеточные лимфомы и миелопатии (тропический спастический пара парез) у взрослого населения юго-запада Японии и стран Карибского бассейна. Эпидемиология инфекций, вызванных HTLV-I, напоминает эпидемиологию ВИЧ-инфекции, так как вирус передаётся половым путём и парентерально. Основные группы риска — наркоманы, пациенты с гемофилией, гомосексуалисты и лица, практикующие бисексуальные контакты. Прямых доказательств патогенного действия HTLV-II нет, однако инфицирование вирусом связывают с развитием волосатоклеточного лейкоза. o o экзогенным вирусам относят вирус саркомы Рауса, Т-лимфотропные вирусы человека и др. Т-лимфотропные вирусы человека I и II типов, или HTLV-II [от англ. human t-lymphotropic virus, Т-лимфотропный вирус человека], получили своё название из-за избирательной тропности к субпопуляции СD 4+-лимфоцитов. Т-лимфотропные вирусы обладают сравнительно низким онкогенным потенциалом и не проявляют непосредственного трансформирующего действия, так как не содержат ген onс. Вирусный геном интегрируется рядом с геном, кодирующим синтез ИЛ-2. Вирусный промотор активирует избыточную продукцию цитокина, усиливающего пролиферацию Т-лимфоцитов. Кроме генов gag, pol и env, общих для всех ретровирусов, HTLV имеют дополнительный ген р. Х. Продукты генов env, р. Х задействованы в индукции бесконтрольной пролиферации Т-клеток. Эндогенные ретровирусы o Часть ретровирусов приобрела способность передаваться вертикально, а их генетическая информация стала составной частью клеточного генома всех органов и тканей человека и животных. Интегрированный онкогенный провирус может содержать гены, необходимые для формирования полноценного вириона, но в большинстве случаев ведёт себя как группа генов, находящихся под регуляторным контролем клетки. Однако клеточный контроль обычно приводит к частичному или полному подавлению экспрессии вирусных генов. o Активация эндогенных ретровирусов может возникать спонтанно либо под воздействием внешних факторов. По своей организации (расположение кодирующих нуклеотидных последовательностей и др. ) эндогенные и экзогенные провирусы ретровирусов сходны; но эндогенные вирусы не патогенны для природных хозяев и редко инфекционны для родительских клеток. o В эксперименте онкогенный потенциал эндогенных ретровирусных последовательностей может реализоваться через трансформацию клеток (после захвата вирусами клеточных протоонкогенов) либо активацию клеточных протоонкогенов вирусными LTR.
Подразделение ретровирусов по характеру распространения среди хозяев o Экзогенные ретровирусы распространяются горизонтально, и большинство из них не содержит ген onс. К o HTLV стали первыми вирусами, участие которых в развитии опухолей человека было более или менее достоверно доказано. HTLV-I вызывает Т-клеточные лимфомы и миелопатии (тропический спастический пара парез) у взрослого населения юго-запада Японии и стран Карибского бассейна. Эпидемиология инфекций, вызванных HTLV-I, напоминает эпидемиологию ВИЧ-инфекции, так как вирус передаётся половым путём и парентерально. Основные группы риска — наркоманы, пациенты с гемофилией, гомосексуалисты и лица, практикующие бисексуальные контакты. Прямых доказательств патогенного действия HTLV-II нет, однако инфицирование вирусом связывают с развитием волосатоклеточного лейкоза. o o экзогенным вирусам относят вирус саркомы Рауса, Т-лимфотропные вирусы человека и др. Т-лимфотропные вирусы человека I и II типов, или HTLV-II [от англ. human t-lymphotropic virus, Т-лимфотропный вирус человека], получили своё название из-за избирательной тропности к субпопуляции СD 4+-лимфоцитов. Т-лимфотропные вирусы обладают сравнительно низким онкогенным потенциалом и не проявляют непосредственного трансформирующего действия, так как не содержат ген onс. Вирусный геном интегрируется рядом с геном, кодирующим синтез ИЛ-2. Вирусный промотор активирует избыточную продукцию цитокина, усиливающего пролиферацию Т-лимфоцитов. Кроме генов gag, pol и env, общих для всех ретровирусов, HTLV имеют дополнительный ген р. Х. Продукты генов env, р. Х задействованы в индукции бесконтрольной пролиферации Т-клеток. Эндогенные ретровирусы o Часть ретровирусов приобрела способность передаваться вертикально, а их генетическая информация стала составной частью клеточного генома всех органов и тканей человека и животных. Интегрированный онкогенный провирус может содержать гены, необходимые для формирования полноценного вириона, но в большинстве случаев ведёт себя как группа генов, находящихся под регуляторным контролем клетки. Однако клеточный контроль обычно приводит к частичному или полному подавлению экспрессии вирусных генов. o Активация эндогенных ретровирусов может возникать спонтанно либо под воздействием внешних факторов. По своей организации (расположение кодирующих нуклеотидных последовательностей и др. ) эндогенные и экзогенные провирусы ретровирусов сходны; но эндогенные вирусы не патогенны для природных хозяев и редко инфекционны для родительских клеток. o В эксперименте онкогенный потенциал эндогенных ретровирусных последовательностей может реализоваться через трансформацию клеток (после захвата вирусами клеточных протоонкогенов) либо активацию клеточных протоонкогенов вирусными LTR.
 Т-лимфотропный вирус человека
Т-лимфотропный вирус человека
 Механизм онкогенеза o o o o o 1. 2. o Онкогенные ретровирусы широко распространены в природе: они найдены как у различных позвоночных (птиц, человека), так и у беспозвоночных и способны вызвать развитие опухолей у своего хозяина. Их онкогенный потенциал обусловлен наличием обратной транскриптазы (РНК-зависимой ДНКполимеразы), обеспечивающей образование из вирусной РНК ДНК-геномного провируса. Первоначально под контролем обратной транскриптазы в цитоплазме клетки происходит превращение вирусного РНК-генома в неинтегрированную линейную ДНК. В ходе этого процесса происходит дупликация последовательностей РНК, после чего ДНК принимает кольцевую, замкнутую форму. Затем вирусная ДНК интегрируется в клеточный геном. После интеграции в хромосомы клетки вирусная ДНК становится матрицей для синтеза вирусного РНКгенома и вирусной и. РНК. В редких случаях может происходить случайный «захват» ретровирусом регуляторного клеточного протоонкогена. Сам ген не используется в жизненном цикле вируса, но может кардинально влиять на судьбу клетки. Вирус, захвативший клеточный протоонкоген, становится оnс+-вирусом, и его легко обнаружить по трансформирующему эффекту на инфицированные клетки, которые начинают бурно размножаться. Онкогенные ретровирусы вызывают развитие опухолей трёх групп: солидных опухолей (сарком и раков), острых лейкозов (лимфом, миелобластом) и хронического лимфоидного лейкоза. На основании морфологических и антигенных различий онкогенные ретровирусы разделены на пять типов: А, В, С, D и Т-лимфотропные вирусы. Наибольшее количество онкогенных вирусов относят к типу С (вызывают лимфоретикулярные новообразования). По своему онкогенному потенциалу все известные онкогенные ретровирусы разделяют на две разграниченные группы: Высокоактивные опухолеродные вирусы, индуцирующие неопластические заболевания с коротким инкубационным периодом (например, вирус саркомы Рауса). Вирусы с умеренной активностью, вызывающие развитие неоплазий после длительного латентного периода (например, HTLV). За редким исключением все вирусы первой группы — двухкомпонентны и состоят из вируса-помощника и дефектного вируса, ответственного за патогенность. Для большинства ретровирусов характерна высокая специфичность по отношению к чувствительным клеткам, и лишь некоторые из них могут инфицировать клетки разных видов животных.
Механизм онкогенеза o o o o o 1. 2. o Онкогенные ретровирусы широко распространены в природе: они найдены как у различных позвоночных (птиц, человека), так и у беспозвоночных и способны вызвать развитие опухолей у своего хозяина. Их онкогенный потенциал обусловлен наличием обратной транскриптазы (РНК-зависимой ДНКполимеразы), обеспечивающей образование из вирусной РНК ДНК-геномного провируса. Первоначально под контролем обратной транскриптазы в цитоплазме клетки происходит превращение вирусного РНК-генома в неинтегрированную линейную ДНК. В ходе этого процесса происходит дупликация последовательностей РНК, после чего ДНК принимает кольцевую, замкнутую форму. Затем вирусная ДНК интегрируется в клеточный геном. После интеграции в хромосомы клетки вирусная ДНК становится матрицей для синтеза вирусного РНКгенома и вирусной и. РНК. В редких случаях может происходить случайный «захват» ретровирусом регуляторного клеточного протоонкогена. Сам ген не используется в жизненном цикле вируса, но может кардинально влиять на судьбу клетки. Вирус, захвативший клеточный протоонкоген, становится оnс+-вирусом, и его легко обнаружить по трансформирующему эффекту на инфицированные клетки, которые начинают бурно размножаться. Онкогенные ретровирусы вызывают развитие опухолей трёх групп: солидных опухолей (сарком и раков), острых лейкозов (лимфом, миелобластом) и хронического лимфоидного лейкоза. На основании морфологических и антигенных различий онкогенные ретровирусы разделены на пять типов: А, В, С, D и Т-лимфотропные вирусы. Наибольшее количество онкогенных вирусов относят к типу С (вызывают лимфоретикулярные новообразования). По своему онкогенному потенциалу все известные онкогенные ретровирусы разделяют на две разграниченные группы: Высокоактивные опухолеродные вирусы, индуцирующие неопластические заболевания с коротким инкубационным периодом (например, вирус саркомы Рауса). Вирусы с умеренной активностью, вызывающие развитие неоплазий после длительного латентного периода (например, HTLV). За редким исключением все вирусы первой группы — двухкомпонентны и состоят из вируса-помощника и дефектного вируса, ответственного за патогенность. Для большинства ретровирусов характерна высокая специфичность по отношению к чувствительным клеткам, и лишь некоторые из них могут инфицировать клетки разных видов животных.
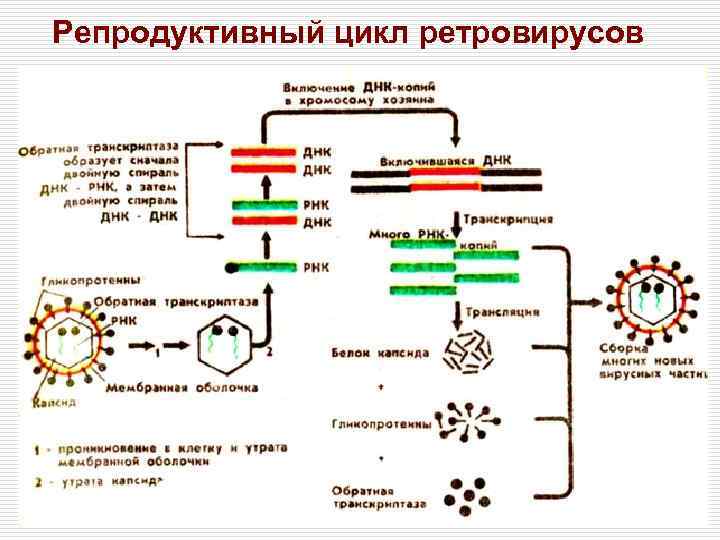 Репродуктивный цикл ретровирусов
Репродуктивный цикл ретровирусов


