Лекция 2 (22-10-2013).ppt
- Количество слайдов: 25
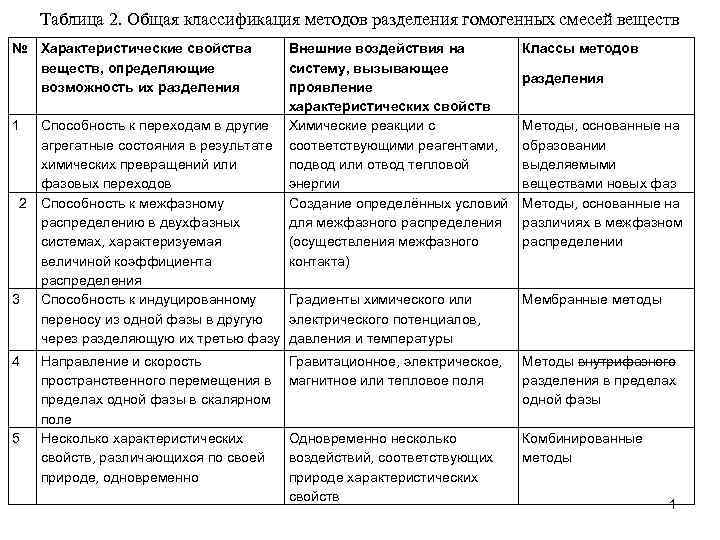
Таблица 2. Общая классификация методов разделения гомогенных смесей веществ № Характеристические свойства веществ, определяющие возможность их разделения 1 2 3 4 5 Внешние воздействия на систему, вызывающее проявление характеристических свойств Химические реакции с соответствующими реагентами, подвод или отвод тепловой энергии Создание определённых условий для межфазного распределения (осуществления межфазного контакта) Классы методов разделения Способность к переходам в другие агрегатные состояния в результате химических превращений или фазовых переходов Способность к межфазному распределению в двухфазных системах, характеризуемая величиной коэффициента распределения Способность к индуцированному Градиенты химического или переносу из одной фазы в другую электрического потенциалов, через разделяющую их третью фазу давления и температуры Методы, основанные на образовании выделяемыми веществами новых фаз Методы, основанные на различиях в межфазном распределении Направление и скорость пространственного перемещения в пределах одной фазы в скалярном поле Несколько характеристических свойств, различающихся по своей природе, одновременно Гравитационное, электрическое, магнитное или тепловое поля Методы внутрифазного разделения в пределах одной фазы Одновременно несколько воздействий, соответствующих природе характеристических свойств Комбинированные методы Мембранные методы 1

2. МЕТОДЫ РАЗДЕЛЕНИЯ, ОСНОВАННЫЕ НА РАЗЛИЧИЯХ В РАСПРЕДЕЛЕНИИ ВЕЩЕСТВ МЕЖДУ ФАЗАМИ 2. 1. ВНУТРИГРУППОВАЯ КЛАССИФИКАЦИЯ МЕТОДОВ И ИХ ОБЩИЕ ХАРАКТЕРИСТИКИ Среди методов разделения гомогенных смесей веществ важнейшее значение для аналитической химии имеют методы, основанные на различиях в распределении веществ между фазами. Характеристическими свойствами веществ, на проявлении которых основаны методы этой группы, является способность веществ к распределению между фазами, характеризуемая определенной величиной коэффициента межфазного распределения. Специфика методов, входящих в эту группу, помимо агрегатного состояния фаз, проявляется в способах осуществления процессов межфазного распределения, определяющих условия проявления присущих веществам характеристических свойств, а соответственно и достигаемый эффект. Поэтому основными классификационными признаками методов этой группы наряду с агрегатным состоянием фаз являются способы осуществления процессов межфазного распределения. Способы осуществления процессов межфазного распределения характеризуются наличием или отсутствием пространственного перемещения фаз относительное друга и зависящим от этого количеством актов перераспределения разделяемых веществ между фазами. 2
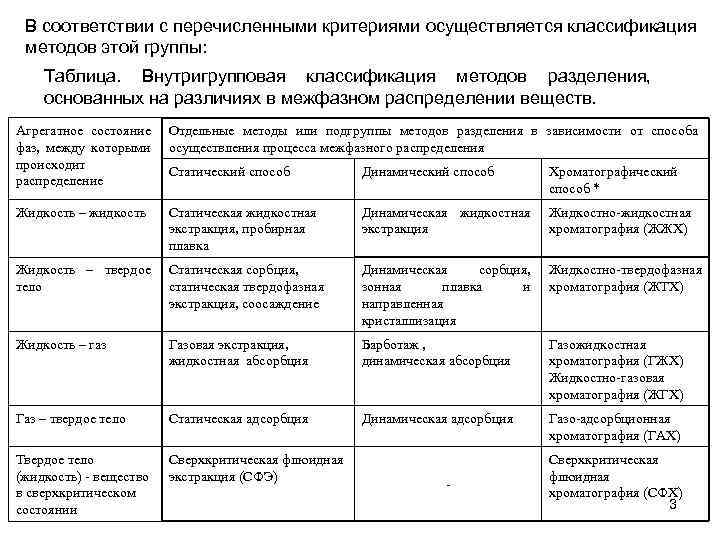
В соответствии с перечисленными критериями осуществляется классификация методов этой группы: Таблица. Внутригрупповая классификация методов разделения, основанных на различиях в межфазном распределении веществ. Агрегатное состояние фаз, между которыми происходит распределение Отдельные методы или подгруппы методов разделения в зависимости от способа осуществления процесса межфазного распределения Статический способ Динамический способ Хроматографический способ * Жидкость – жидкость Статическая жидкостная экстракция, пробирная плавка Динамическая жидкостная экстракция Жидкостно-жидкостная хроматография (ЖЖХ) Жидкость – твердое тело Статическая сорбция, статическая твердофазная экстракция, соосаждение Динамическая сорбция, зонная плавка и направленная кристаллизация Жидкостно-твердофазная хроматография (ЖТХ) Жидкость – газ Газовая экстракция, жидкостная абсорбция Барботаж , динамическая абсорбция Газожидкостная хроматография (ГЖХ) Жидкостно-газовая хроматография (ЖГХ) Газ – твердое тело Статическая адсорбция Динамическая адсорбция Газо-адсорбционная хроматография (ГАХ) Твердое тело (жидкость) - вещество в сверхкритическом состоянии Сверхкритическая флюидная экстракция (СФЭ) - Сверхкритическая флюидная хроматография (СФХ) 3

По первому признаку все способы осуществления межфазного распределения веществ подразделяются на 2 группы: статические и динамические с выделением в отдельную группу хроматографического способа с его собственной внутригрупповой классификацией. В статических способах отдающая и извлекающая фазы находятся в замкнутой массообменной системе и не перемещаются относительно друга, в динамических способах одна из фаз неподвижна и контактирует с другой фазой, которая перемещается через массообменную систему. По признаку числа актов межфазного распределения методы этой группы подразделяются на одноступенчатые, в которых реализуется всего один акт межфазного распределения, и многоступенчатые, в которых реализуется несколько актов межфазного распределения. При этом статические способы всегда являются одноступенчатыми, а динамические могут быть как одноступенчатыми, так и многоступенчатыми. 4

Важнейшей характеристикой методов этой группы является коэффициент распределения, обычно обозначаемый KD: KDi = (ci)изв/(ci)отд В качестве характеристики потенциальных возможностей той или иной системы фаз для разделения i и j веществ вводится понятие коэффициента селективности КС. КСi, j = КDi/KDj В частном случае методов этой группы, основанных на однократном равновесном распределении веществ между двумя фазами, практически достигаемая величина коэффициента разделения близка к величине коэффициента селективности. Поэтому достаточно часто отношение не очень корректно рассматривается как численная величина Кр Реально для методов этой группы: Kp из-за экспериментальных погрешностей. Kc, но практически никогда его не достигает 5

С точки зрения оценки возможных количеств разделяемых веществ важной характеристикой методов этой группы является изотерма межфазного распределения (рис. 2. 1). Известны два варианта представления влияния концентрации компонента на закономерности его межфазного распределения. В первом наиболее часто встречающемся случае на оси абсцисс откладывается равновесная концентрация компонента в отдающей фазе cотд, а на оси ординат – концентрация в извлекающей фазе cизв (рис. 2. 1 а). Подобные зависимости называются изотермами межфазного распределения. Во втором варианте представление изотерм в качестве аргумента выступает суммарная концентрация вещества в системе – (сотд + cизв), а в качестве функции – коэффициент межфазного распределения КD (рис. 2. 1 б). Можно отметить общую тенденцию. В области низких концентраций все изотермы линейны, т. е. KD не зависит л концентрации. 6 Рис. 2. 1. Изотермы межфазного распределения

Специфической особенностью некоторых процессов межфазного распределения в частном случае, когда межфазный переход связан с реакциями образования в извлекающей фазе прочных недиссоциирующих соединений, наблюдается необратимость перехода вещества из отдающей фазы в извлекающую. В этих случаях KD теряет смысл как характеристика процесса равновесного межфазного распределения вещества и в качестве адекватной характеристики вводится степень извлечения компонента Ri: (3. 1) где (qi)изв и (qi)отд – количества i-того компонента в извлекающей и отдающей фазе, соответственно. 7

2. 2. ЖИДКОСТНАЯ ЭКСТРАКЦИЯ 2. 2. 1. Общие представления Жидкостная экстракция - метод разделения веществ, основанный на различиях в распределении веществ между двумя жидкими фазами. В наиболее общем случае между водным раствором и органическим растворителем. Обратный процесс выделения веществ из органической фазы в водную называется реэкстракцией. Доказательством обратимости экстракционного процесса, т. е. возможности реэкстракции выделенного вещества из органической фазы в водный раствор, является равенство значений KD , полученных для прямого процесса экстракции и обратного процесса реэкстракции (KDэкс = KDреэкс) при концентрациях, соответствующих области линейности изотермы межфазного распределения. Все многообразие жидкостно-экстракционных систем, отличающихся механизмом межфазных переходов выделяемых веществ, подразделяется на две большие подгруппы: на экстракцию по механизму физического распределения и реакционную экстракцию. Во втором случае процесс экстракции включает стадию химического превращения выделяемого вещества в эктрагируемую форму. В первом – эта стадия отсутствует, т. е. из водного раствора в органическую фазу вещество переходит в той форме, в которой оно изначально присутствовало в водной фазе. Между извлекающей и отдающей фазой распределяется вещество в той исходной форме, в которой оно изначально находилась в отдающей фазе. 8

2. 2. 2. Экстракция по механизму физического распределения В случае физического распределения процесс перехода веществ из водной фазы в органическую вызван различиями энергий сольватации и гидратации их молекул. В этом случае процесс экстракции всегда обратим. По этому механизму в органические растворители хорошо экстрагируются большие неполярные или малополярные молекулы. В случае неорганических веществ это такие соединения как Ge. Cl 4, I 2, Os. O 4 и т. д. Учитывая, что число подобных неорганических соединений крайне невелико, основное применение экстракция по этому механизму находит для выделения из водных растворов растворенных примесей неполярных и слабополярных органических веществ, например, нефтепродуктов. В качестве экстрагентов для экстракции веществ по механизму физического распределения чаще всего применяются нейтральные органические растворители такие, как гексан, хлороформ и четыреххлористый углерод. Коэффициенты распределения органических веществ между водной фазой и неполярным экстрагентом закономерно уменьшаются по мере увеличения их растворимости в воде и, соответственно, увеличения энергии гидратации 9

При необходимости экстракционного выделения из водных растворов полярных органических веществ общим приемом является выбор экстрагентов по тому же принципу, по которому выбираются растворители: «Подобное растворяется в подобном» . Например, для экстракции фенола и его производных используются несмешивающиеся с водой высшие спирты. Для повышения экстрагируемости полярных органических веществ используется их конверсия в хорошо экстрагируемые менее полярные производные, значительно хуже растворимые в воде. Например, тот же фенол переводится в менее полярные галогенопроизводные, при экстракции которых KD на несколько порядков выше. 10

2. 2. 3. Реакционная экстракция Для экстракционного выделения неорганических веществ наибольшие возможности открывает реакционная экстракция, т. е. процесс, протекающий как гетерогенная химическая реакция, в результате которой образуется неполярное соединение, энергия сольватации которого превышает энергию гидратации выделяемого вещества в исходном состоянии : х. Аводн + y. Bорг = [Ax. By]орг, где Аводн - вещество, выделяемое из водного раствора, Bорг – органический экстрагент, [Ax. By]орг – соединение, в форме которого вещество А переходит в органическую фазу. Как любая химическая реакция, подобный процесс характеризуется константой, называемой в данном случае константой экстракции Kэкс: Именно реакция образования экстрагируемого соединения обеспечивает более высокую селективность реакционной экстракции по сравнению с физическим распределением. В случае реакционной экстракции далеко не всегда известно и сохраняет постоянную величину стехиометрическое соотношение выделяемого вещества и экстрагента в экстрагируемом соединении, поэтому для характеристики экстракционных процессов Кэкс используется сравнительно редко. Предпочтение отдается универсальной характеристике – коэффициенту распределения всех равновесных форм выделяемого вещества (А) - KD : : где индексы 1, 2. . . n - соответствуют различным равновесным формам выделяемого вещества А в водном растворе и образовавшимся из них соединениям в фазе экстрагента. 11

Учитывая большое разнообразие органических соединений, которые применяются и гипотетически могут применяться в качестве экстрагентов в процессах «реакционной экстракции» , предложен целый ряд принципов их внутригрупповой классификации. Чаще всего за основу классификации принимается тип экстрагента: нейтральный, кислотный, основный. Более информативной является классификация экстрагентов по природе донорных атомов, ответственных за образование химической связи с экстрагируемым веществом, и по структурному подобию их молекул. По этим признакам выделяются пять основных классов экстрагентов: кислород-, азоти серосодержащие, хелатообразующие и макроциклические. 12
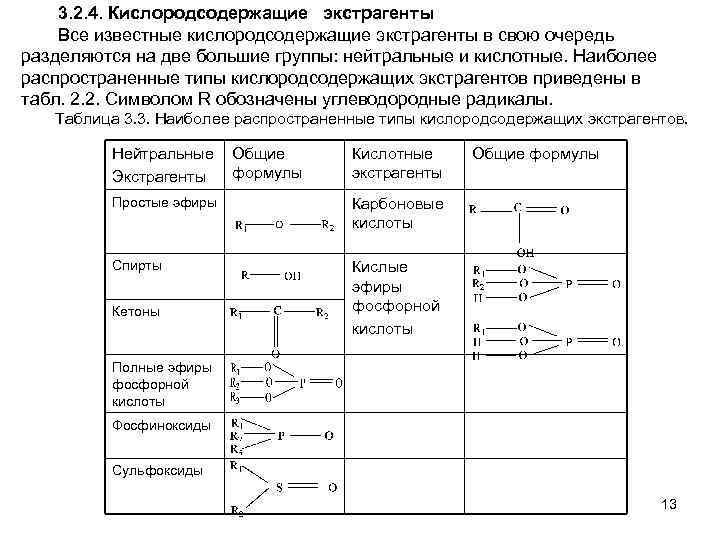
3. 2. 4. Кислородсодержащие экстрагенты Все известные кислородсодержащие экстрагенты в свою очередь разделяются на две большие группы: нейтральные и кислотные. Наиболее распространенные типы кислородсодержащих экстрагентов приведены в табл. 2. 2. Символом R обозначены углеводородные радикалы. Таблица 3. 3. Наиболее распространенные типы кислородсодержащих экстрагентов. Нейтральные Экстрагенты Общие формулы Кислотные экстрагенты Простые эфиры Карбоновые кислоты Спирты Общие формулы Кислые эфиры фосфорной кислоты Кетоны Полные эфиры фосфорной кислоты Фосфиноксиды Сульфоксиды 13

В зависимости от характера химической связи кислорода в молекуле экстрагента и свойств экстрагируемых веществ возможны три механизма образования экстрагируемых соединений с кислородсодержащими экстрагентами. Все рассматриваемые нейтральные экстрагенты при контакте с кислыми водными растворами способны к сольватации протонов с последующим образованием ионных ассоциатов сольватированного протона с анионными формами экстрагируемых соединений: анионами сильных минеральных кислот и ацидокомплексами металлов – гидратно-сольватный механизм. Общая схема экстракции по гидратно-сольватному механизму: (H+ + m. H 2 O + X-)водн + n(R=O)орг {[H(H 2 O)m(R=O)n] - X+}орг Переход экстрагируемого соединения [MXq]-(q-z) в органическую фазу можно рассматривать как реакцию ионного обмена: (q-z){[H(H 2 O)m(R=O)n] - X-}орг + {[MXq]-(q-z)}водн {[H(H 2 O)m(R=O)n] - (q-z)[MXq]-(q-z)}орг + (q-z)(X-)водн 14

Существующие представления о структуре катионной части образуемых ионных ассоциатов не однозначны. Гидратное число протона в водных растворах равно четырем, т. е. каждый ион гидроксония H 3 O+ гидратирован тремя молекулами воды. При взаимодействии гидратированного протона с молекулами кислородсодержащих экстрагентов последние координируются вокруг него с частичным замещением молекул воды на молекулы экстрагента. Соответствующие катионные образования с молекулами воды, частично замещенными на молекулы экстрагента, называются гидрато-сольватами, а механизм экстракции анионных форм элементов за счет образования ионных ассоциатов с гидрато-сольватами протонов получил название гидратно-сольватного. Гидратное число 4 не всегда выдерживается в катионной части гидрато-сольватов и варьирует в пределах от 1 до 12, т. е. гидратные и сольватные числа протона далеко не постоянны и могут изменяться в зависимости от состава фаз. С точки зрения образования экстрагируемой катионной части ионного ассоциата экстракционная способность кислородсодержащих экстрагентов определяется конкуренцией процессов гидратации и сольватации ионов гидроксония, а селективность экстракции – процессами образования ацидокомплексов металла в водной фазе и их структурой. 15

При экстракции по гидратно-сольватному механизму существенную роль играет форма существования экстрагируемого вещества в водном растворе. Экстрагируемость ацидокомплексов определяется их прочностью и различиями энергий их гидратации и гидратации ацидолиганда или других анионов, присутствующих в водном растворе. Экстрагируемость будет тем выше, чем меньше заряд и чем больше размеры ацидокомплекса, т. е. чем меньше он гидратирован. Характерные формы соединений, хорошо экстрагируемых кислородсодержащими экстрагентами по гидратносольватному механизму: [MX 4]- и [MX 6]- , где Х – галогенид-ион. Среди наиболее широко известных соединений – это [Fe. Cl 4]-, [Au. Cl 4]-, [Sb. Cl 6]-. Экстрагируемость анионов по гидратно-сольватному механизму увеличивается в ряду экстрагентов от простых эфиров к сульфоксидам. Этот ряд можно рассматривать как ряд основности кислородсодержащих экстрагентов, понимая под последней способность к сольватации протона. Экстракция по подобному механизму не исключена и для кислотных экстрагентов, таких, например, как алкилфосфорные кислоты, но она проявляется только как эффект, сопутствующий экстракции по ионообменному механизму, или является альтернативой ему при экстракции из сильнокислых растворов, когда диссоциация кислотных групп экстрагента практически подавлена. 16

Экстрагенты, имеющие кислотные группы (карбоновые и фосфорорганические кислоты), способны экстрагировать катионные формы по механизму ионообменного замещения протона в молекуле экстрагента на ион металла. Кислородсодержащие экстрагенты, имеющие кислотные группы, часто называют жидкими катионообменниками. Из широко распространенных кислотных экстрагентов наибольшей селективностью при экстракции катионных форм элементов обладают одноосновные фосфорорганические кислоты. Существенные различия в экстрагируемости в данном случае проявляются как для катионов с различной величиной заряда, так и для катионов, отличающихся при одинаковом заряде только размерами ионных радиусов. Например, типичный экстрагент этого класса – ди-2 -этилгексилортофософорная кислота (Д 2 ЭГФК) обеспечивает возможность разделения таких близких по химическим свойствам элементов, как лантаноиды и актиноиды. Среднее значение Kc для пары соседних элементов этих групп превышает 2. Селективность экстракции карбоновыми кислотами значительно ниже, поэтому в общем случае их применение ограничено суммарным концентрирования катионных форм элементов без их разделения. 17

Наконец, кислородсодержащие экстрагенты, являющиеся жесткими основаниями (по Пирсону), способны входить во внутреннюю сферу экстрагируемых ионов, являющихся «жесткой» кислотой. В последнем случае имеет место экстракция по механизму образования координационных соединений. Координационный механизм реализуется при экстракции кислородсодержащими экстрагентами из нейтральных и слабокислых растворов. Экстракционная способность кислородсодержащих экстрагентов, извлекающих металлы по координационному механизму увеличивается в ряду основности кислородсодержащих экстрагентов. Она определяется в первую очередь электронной плотностью на электронодонорном атоме молекулы экстрагента. В случае одинаковых функциональных групп последняя зависит от электроотрицательности других групп, входящих в состав экстрагента: чем она выше, тем меньше электронная плотность на электронодонорном атоме молекулы экстрагента, ответственном за образование химической связи с ионами металла. Так, при переходе в ряду: фосфаты, фосфонаты, фосфиноксиды – коэффициенты распределения возрастают из-за снижения суммарной электроотрицательности при замене групп R – O – на R –. На практике с координационным механизмом экстракции кислородсодержащими экстрагентами чаще всего приходится сталкиваться при выделении урана, тория, редкоземельных и трансурановых элементов из растворов нитратов. Процессы внутрисферного замещения лигандов в экстрагируемых соединениях часто замедлены во времени, но для кислородсодержщих экстрагентов при экстракции по механизму образования координационных соединений в общем случае 18 кинетические ограничения не характерны.

2. 2. 5. Азотсодержащие экстрагенты К классу азотсодержащих экстрагентов относят первичные (RNH 2), вторичные (R 2 NH), третичные (R 3 N) амины и соли четвертичных аммониевых оснований (R 4 NX), где R – алкильный или ароматический радикал, Х – гидроксил-ион или анион любой кислоты. Механизмы экстракции азотсодержащими экстрагентами: по реакции присоединения, ионообменный и координационный. По реакции присоединения аминами экстрагируются кислоты: (Н+)водн + (Х-)водн + (R 3 N)орг (R 3 NHX)орг. Ионообменный механизм экстракции характерен для солей аминов и четвертичных аммониевых оснований (ЧАО): (q-z)(R 4 NX)орг + [MXq]-(q-z)водн {(R 4 N)q-z[MXq]}орг + (q-z))(X-)водн. Аналогичная реакция может протекать с солью амина, образовавшейся в результате реакции присоединения. Отличия в случае экстракции ЧАО от экстракции аминами проявляются только в том, что для протекания реакции анионного обмена с ЧАО не требуется предварительная реакция присоединения молекул кислот к молекулам экстрагента, протекающая только при контакте с сильно кислыми средами. Поэтому ЧАО проявляют экстракционные свойства в нейтральных и даже слабощелочных растворах, в то время как амины только в сильнокислых. Причём экстрагируемость ацидокмплексов уменьшается в ряду третичные – вторичные – первичные амины 19

Возможности применения аминов для экстракции ацидокомплексов металлов по ионнообменному механизму ограничены из-за большой вероятности проявления третьего – координационного механизма экстракции. Это связано с тем, что особенно при экстракции платиновых металлов, азотсодержащие лиганды обычно входят во внутреннюю сферу комплексов необратимо или процесс их замещения замедлен во времени, что ограничивает возможности реэкстракции: [Pt. Cl 4]2 - + 2 R 2 NH [Pt(R 2 NH)2 Cl 2] + 2 Cl- 20

2. 2. 6. Серосодержащие экстрагенты представляют собой, как правило, аналоги кислородсодержащих экстрагентов, в которых атом кислорода замещен на атом серы. Из серосодержащих экстрагентов наибольшее распространение нашли тиоэфиры. В отличие от своих кислородсодержащих аналогов они практически не проявляют способности к сольватации протонов и, соответственно, для них не характерен гидратно-сольватный механизм экстракции. Экстракционные свойства серосодержащих экстрагентов определяются их склонностью к участию в гетерогенных реакциях внутрисферного замещения лигандов в комплексных соединениях, образованных халькофильными элементами. При этом наиболее вероятны две схемы образования экстрагируемых соединений: Образование смешанных комплексов с ацидолигандами и серосодержащими экстрагентами: [MXq]-(q-z)водн + (q-z)(R 2 S)орг [MXz(R 2 S)q-z]орг + (q-z)(X-)водн; Образование солей катионных комплексов с серосодержащими экстрагентами в качестве лигандов и ацидолигандами в качестве противоионов [MXq]-(q-z)водн + q(R 2 S)орг ([M(R 2 S)q]Xz)орг + (q-z)(X-)водн. 21
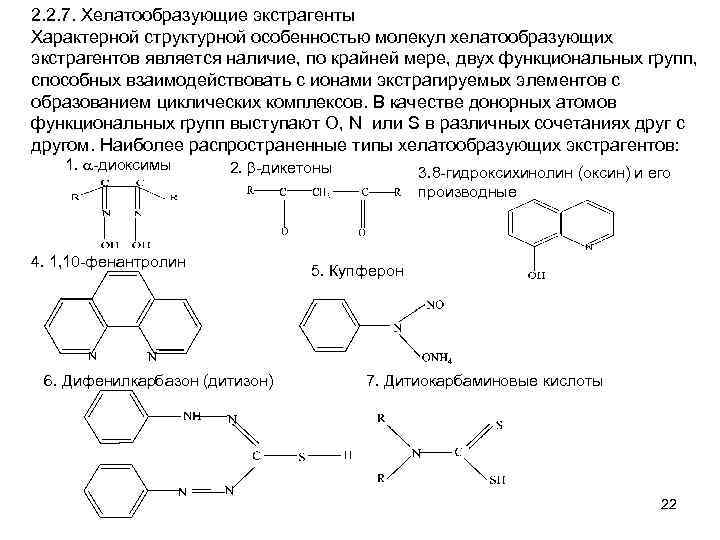
2. 2. 7. Хелатообразующие экстрагенты Характерной структурной особенностью молекул хелатообразующих экстрагентов является наличие, по крайней мере, двух функциональных групп, способных взаимодействовать с ионами экстрагируемых элементов с образованием циклических комплексов. В качестве донорных атомов функциональных групп выступают O, N или S в различных сочетаниях друг с другом. Наиболее распространенные типы хелатообразующих экстрагентов: 1. a-диоксимы 2. b-дикетоны 4. 1, 10 -фенантролин 6. Дифенилкарбазон (дитизон) 3. 8 -гидроксихинолин (оксин) и его производные 5. Купферон 7. Дитиокарбаминовые кислоты 22

Первым достоинством хелатообразующих экстрагентов является исключительная селективность образования координационных соединений с определенными элементами Периодической системы. При этом селективность их образования определяется как природой и строением функциональных групп, так и кислотностью среды, в которой происходит реакция, благодаря чему с помощью одного и того же хелатообразующего экстрагента можно за счет варьирования р. Н раствора извлекать различные элементы. Вторым достоинством хелатообразующих экстрагентов является образование широкого спектра прочных ярко окрашенных или способных к люминесценции соединений с ионами различных металлов, растворимых в различных неполярных или малополярных растворителях. Следствием последнего является возможность совмещения селективного экстракционного выделения этих элементов с последующим их фотометрическим или люминесцентным определением непосредственно в органической фазе, исключив стадию реэкстракции. На этом принципе основан метод экстракционной фотометрии. 23
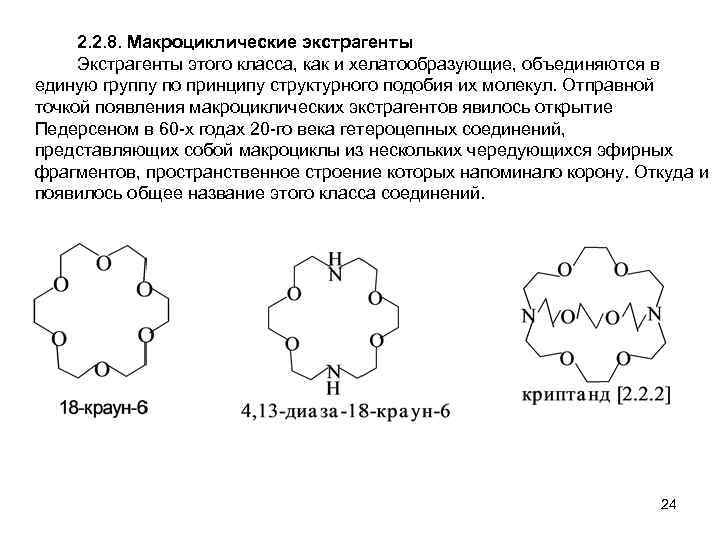
2. 2. 8. Макроциклические экстрагенты Экстрагенты этого класса, как и хелатообразующие, объединяются в единую группу по принципу структурного подобия их молекул. Отправной точкой появления макроциклических экстрагентов явилось открытие Педерсеном в 60 -х годах 20 -го века гетероцепных соединений, представляющих собой макроциклы из нескольких чередующихся эфирных фрагментов, пространственное строение которых напоминало корону. Откуда и появилось общее название этого класса соединений. 24

Конформационная гибкость полиэфирной молекулы позволяет атомам кислорода эфирных групп ориентироваться внутрь цикла, создавая тем самым полость определенного размера с высокой электронодонорной активностью. При этом липофильность молекул краун-эфиров, т. е. способность к сольватации органическими растворителями, регулируется за счет введения различных заместителей при углеродных атомах кольца. Кроме того, существует возможность замещения в краун-эфирах донорных атомов кислорода на другие донорные атомы (N и S), что позволяет варьировать экстракционные свойства краун соединений. С помощью краун-эфиров в органическую фазу предпочтительно извлекаются ионы тех металлов, радиусы которых в наибольшей степени соответствуют размеру полости макроцикла. Например, 18 -краун-6 с размером полости 0, 28 – 0, 32 нм по сравнению с ионами других щелочных металлов наиболее селективен к ионам калия и рубидия, ионные диаметры которых 0, 266 и 0, 294 нм, соответственно. 25
Лекция 2 (22-10-2013).ppt