Lektsia_10_2015_T-killer_i_tsitokiny.ppt
- Количество слайдов: 74
 Т-киллер Лекция 10
Т-киллер Лекция 10
 Инфицированная клетка Т клетка убивает инфицированую клетку
Инфицированная клетка Т клетка убивает инфицированую клетку

![CD 8 Т клетка контактирует с неинфицированной клеткой Т-клеточный рецептор (TCR) обнаруживает [MHC+ пептид]. CD 8 Т клетка контактирует с неинфицированной клеткой Т-клеточный рецептор (TCR) обнаруживает [MHC+ пептид].](https://present5.com/presentation/154229456_384997345/image-4.jpg) CD 8 Т клетка контактирует с неинфицированной клеткой Т-клеточный рецептор (TCR) обнаруживает [MHC+ пептид]. Т клетка активируется Нет активации, Т клетка уходит, клетка-мишень погибает
CD 8 Т клетка контактирует с неинфицированной клеткой Т-клеточный рецептор (TCR) обнаруживает [MHC+ пептид]. Т клетка активируется Нет активации, Т клетка уходит, клетка-мишень погибает
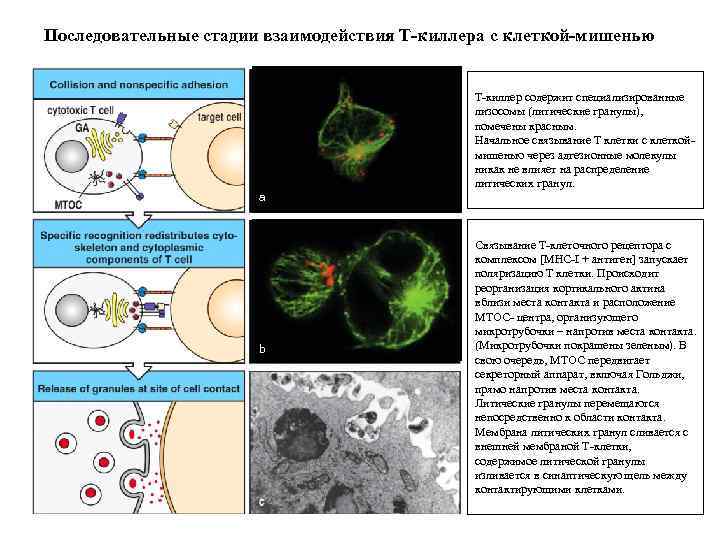 Последовательные стадии взаимодействия Т-киллера с клеткой-мишенью Т-киллер содержит специализированные лизосомы (литические гранулы), помечены красным. Начальное связывание Т клетки с клеткоймишенью через адгезионные молекулы никак не влияет на распределение литических гранул. a b Связывание Т-клеточного рецептора с комплексом [MHC-I + антиген] запускает поляризацию Т клетки. Происходит реорганизация кортикального актина вблизи места контакта и расположение MTOC- центра, организующего микротрубочки – напротив места контакта. (Микротрубочки покрашены зеленым). В свою очередь, MTOC передвигает секреторный аппарат, включая Гольджи, прямо напротив места контакта. Литические гранулы перемещаются непосредственно к области контакта. Мембрана литических гранул сливается с внешней мембраной Т-клетки, содержимое литической гранулы изливается в синаптическую щель между контактирующими клетками.
Последовательные стадии взаимодействия Т-киллера с клеткой-мишенью Т-киллер содержит специализированные лизосомы (литические гранулы), помечены красным. Начальное связывание Т клетки с клеткоймишенью через адгезионные молекулы никак не влияет на распределение литических гранул. a b Связывание Т-клеточного рецептора с комплексом [MHC-I + антиген] запускает поляризацию Т клетки. Происходит реорганизация кортикального актина вблизи места контакта и расположение MTOC- центра, организующего микротрубочки – напротив места контакта. (Микротрубочки покрашены зеленым). В свою очередь, MTOC передвигает секреторный аппарат, включая Гольджи, прямо напротив места контакта. Литические гранулы перемещаются непосредственно к области контакта. Мембрана литических гранул сливается с внешней мембраной Т-клетки, содержимое литической гранулы изливается в синаптическую щель между контактирующими клетками.
 Белки литических гранул Т-киллера Действие на клетку-мишень Перфорин Полимеризуется, образуя пору в мембране клетки-мишени Гранзим Сериновая протеаза, активирует апоптоз, оказавшись в цитозоле клетки-мишени Гранулизин Индуцирует апоптоз
Белки литических гранул Т-киллера Действие на клетку-мишень Перфорин Полимеризуется, образуя пору в мембране клетки-мишени Гранзим Сериновая протеаза, активирует апоптоз, оказавшись в цитозоле клетки-мишени Гранулизин Индуцирует апоптоз
 G – литические гранулы Т-киллера Go - Гольджи M – митохондрии N - ядро
G – литические гранулы Т-киллера Go - Гольджи M – митохондрии N - ядро
 Структура мономеров перфорина a, b, Entire monomer, rotated 90°. Red, central sheet of the MACPF domain; orange, CH 1 and CH 2; blue, the remainder of this domain. Dashed orange line, connectivity around the missing residue P 136 in CH 1. The perforin MACPF domain superposes with the C 8α MACPF with an r. m. s. d. of 4. 46 Å (230 Cα atoms; Supplementary Fig. 2 c). Green, EGF domain; yellow, C 2 domain; magenta, C-terminal region. Shelf region is boxed. Cyan sticks, disulphide bonds ( Supplementary Fig. 1); grey spheres, two Ca 2+ atoms. The MACPF domain contains three N-linked oligosaccharides, one of which (attached to N 204; in green stick) is visible in electron density (NAG). Green and purple spheres, positions of the two other oligosaccharides (attached to N 375 and N 548, respectively). In b, the position of the R 213 E mutation is shown in stick. c, Cartoon of the shelf region boxed in a, with unchanged colour coding, illustrating major interactions formed with the MACPF domain. The sidechains of two residues in the shelf (R 381 and Y 536) form polar interactions with CH 1 and CH 2. L 245, which is highly conserved, is located at the end of the first helix of CH 2 and packs into the shelf. The disulphide bond between the shelf and CH 2 (C 241/C 407) is shown in stick; grey spheres, positions of three residues mutated in human perforin (square bracket) in FHL (P 408[P 409], R 409[R 410] and R 239[R 240]). d, Base of the perforin C 2 domain. The three CBR loops are in yellow. Ca 2+ atom coordinating residues that are functionally important (as determined by mutagenesis studies 21) are shown in yellow/red stick. The site I Ca 2+ atom is coordinated by residues D 435 and D 483 as well as the carbonyl oxygen of A 484. A second Ca 2+ atom is located on the other side of CBR 3. D 429 is located ~8 Å away from the Ca 2+-binding site, but its position may be influenced by crystal contacts. Four aromatic residues (W 453, W 488, Y 430 and Y 486) are shown in grey stick form. RHP Law et al. Nature 000, 1 -5 (2010) doi: 10. 1038/nature 09518
Структура мономеров перфорина a, b, Entire monomer, rotated 90°. Red, central sheet of the MACPF domain; orange, CH 1 and CH 2; blue, the remainder of this domain. Dashed orange line, connectivity around the missing residue P 136 in CH 1. The perforin MACPF domain superposes with the C 8α MACPF with an r. m. s. d. of 4. 46 Å (230 Cα atoms; Supplementary Fig. 2 c). Green, EGF domain; yellow, C 2 domain; magenta, C-terminal region. Shelf region is boxed. Cyan sticks, disulphide bonds ( Supplementary Fig. 1); grey spheres, two Ca 2+ atoms. The MACPF domain contains three N-linked oligosaccharides, one of which (attached to N 204; in green stick) is visible in electron density (NAG). Green and purple spheres, positions of the two other oligosaccharides (attached to N 375 and N 548, respectively). In b, the position of the R 213 E mutation is shown in stick. c, Cartoon of the shelf region boxed in a, with unchanged colour coding, illustrating major interactions formed with the MACPF domain. The sidechains of two residues in the shelf (R 381 and Y 536) form polar interactions with CH 1 and CH 2. L 245, which is highly conserved, is located at the end of the first helix of CH 2 and packs into the shelf. The disulphide bond between the shelf and CH 2 (C 241/C 407) is shown in stick; grey spheres, positions of three residues mutated in human perforin (square bracket) in FHL (P 408[P 409], R 409[R 410] and R 239[R 240]). d, Base of the perforin C 2 domain. The three CBR loops are in yellow. Ca 2+ atom coordinating residues that are functionally important (as determined by mutagenesis studies 21) are shown in yellow/red stick. The site I Ca 2+ atom is coordinated by residues D 435 and D 483 as well as the carbonyl oxygen of A 484. A second Ca 2+ atom is located on the other side of CBR 3. D 429 is located ~8 Å away from the Ca 2+-binding site, but its position may be influenced by crystal contacts. Four aromatic residues (W 453, W 488, Y 430 and Y 486) are shown in grey stick form. RHP Law et al. Nature 000, 1 -5 (2010) doi: 10. 1038/nature 09518
 Электронная микроскопия мономеров перфорина a, Averaged images of perforin monomers obtained by classification of different conformations. Schematic views (left), negative stain (NS; middle) and cryo-electron microscopy (Cryo; right) of two conformations. b, c, Single-particle negative stain reconstructions of perforin monomer (grey surface), with the crystal structure docked in, showing rotation (arrow) of the C 2 domain relative to the ‘head’ domain. RHP Law et al. Nature 000, 1 -5 (2010) doi: 10. 1038/nature 09518
Электронная микроскопия мономеров перфорина a, Averaged images of perforin monomers obtained by classification of different conformations. Schematic views (left), negative stain (NS; middle) and cryo-electron microscopy (Cryo; right) of two conformations. b, c, Single-particle negative stain reconstructions of perforin monomer (grey surface), with the crystal structure docked in, showing rotation (arrow) of the C 2 domain relative to the ‘head’ domain. RHP Law et al. Nature 000, 1 -5 (2010) doi: 10. 1038/nature 09518
 Структура поры, собранной из молекул перфорина a, Negative stain and cryo-electron microscopy images of liposomes with perforin pores. b, c, Surface (b) and cut-away (c) views of a cryo-electron microscopy reconstruction of a perforin pore with 20 -fold symmetry. The cut surface is rainbow coloured by density, with red representing the high density regions. The map resolution is 28. 5 Å. d, Section of the pore map with the perforin crystal structure superposed. Although shown in the monomer conformation, the CH domains would be refolded in the pore conformation. The C 2 domain interacts with the upper leaflet of the membrane bilayer. The lipid bilayer is shown schematically. e, Negative stain electron microscopy of perforin pores inserted into lipid monolayers. Perforin is shown alone and with bound Con A, anti-histidine antibody and mixed with a perforin/C-terminal GFP fusion construct. Images of Con A and antibody alone are shown at the right. The labelling results show that both the C terminus and the glycosylation sites face into the pore lumen. RHP Law et al. Nature 000, 1 -5 (2010) doi: 10. 1038/nature 09518
Структура поры, собранной из молекул перфорина a, Negative stain and cryo-electron microscopy images of liposomes with perforin pores. b, c, Surface (b) and cut-away (c) views of a cryo-electron microscopy reconstruction of a perforin pore with 20 -fold symmetry. The cut surface is rainbow coloured by density, with red representing the high density regions. The map resolution is 28. 5 Å. d, Section of the pore map with the perforin crystal structure superposed. Although shown in the monomer conformation, the CH domains would be refolded in the pore conformation. The C 2 domain interacts with the upper leaflet of the membrane bilayer. The lipid bilayer is shown schematically. e, Negative stain electron microscopy of perforin pores inserted into lipid monolayers. Perforin is shown alone and with bound Con A, anti-histidine antibody and mixed with a perforin/C-terminal GFP fusion construct. Images of Con A and antibody alone are shown at the right. The labelling results show that both the C terminus and the glycosylation sites face into the pore lumen. RHP Law et al. Nature 000, 1 -5 (2010) doi: 10. 1038/nature 09518
 Клетка-мишень гибнет путем апоптоза Апоптоз – запрограммированная смерть клетки. Этот процесс должен запускаться, если клетка повреждена или инфицирована. Киллер включает машину апоптоза в клетке-мишени с помощью гранзима, который впрыскивается через поры, образованные перфорином Признаки апоптоза: • повышается проницаемость мембраны митохондрий, белки митохондрий выходят в цитозоль • повышается проницаемость внешней мембраны клетки для небольших молекул нарушается липидная асимметрия клеточной мембраны (на внешнем листке клеточной мембраны появляется фосфатидилсерин) биополимеры клетки перевариваются ферментами • • • клетка превращается в несколько пузырей, заполненных переваренным содержимым
Клетка-мишень гибнет путем апоптоза Апоптоз – запрограммированная смерть клетки. Этот процесс должен запускаться, если клетка повреждена или инфицирована. Киллер включает машину апоптоза в клетке-мишени с помощью гранзима, который впрыскивается через поры, образованные перфорином Признаки апоптоза: • повышается проницаемость мембраны митохондрий, белки митохондрий выходят в цитозоль • повышается проницаемость внешней мембраны клетки для небольших молекул нарушается липидная асимметрия клеточной мембраны (на внешнем листке клеточной мембраны появляется фосфатидилсерин) биополимеры клетки перевариваются ферментами • • • клетка превращается в несколько пузырей, заполненных переваренным содержимым
 Т киллер – серийный убийца (одна киллерная клетка последовательно убивает до 40 клеток-мишеней)
Т киллер – серийный убийца (одна киллерная клетка последовательно убивает до 40 клеток-мишеней)
 Т киллер очень точно убивает инфицированную клетку, не повреждая соседние здоровые клетки
Т киллер очень точно убивает инфицированную клетку, не повреждая соседние здоровые клетки
 Learn to kill
Learn to kill

 Цитокины
Цитокины
 ЦИТОКИНЫ – ХИМИЧЕСКИЕ СИГНАЛЫ ОТ ОДНОЙ КЛЕТКИ К ДРУГОЙ КЛЕТКЕ
ЦИТОКИНЫ – ХИМИЧЕСКИЕ СИГНАЛЫ ОТ ОДНОЙ КЛЕТКИ К ДРУГОЙ КЛЕТКЕ
 Бактерии Вирусы Грибы Простейшие Сигналы SOS: цитокины, интерфероны, факторы хемотаксиса, индукторы воспаления
Бактерии Вирусы Грибы Простейшие Сигналы SOS: цитокины, интерфероны, факторы хемотаксиса, индукторы воспаления
 НЕКОТОРЫЕ ФАКТОРЫ, СЕКРЕТИРУЮЩИЕСЯ МАКРОФАГАМИ ПОСЛЕ КОНТАКТА С МИКРОБАМИ • Индуцирует белки острой фазы • Активирует лимфоциты • Усиливает продукцию антител • Активирует NK • Активирует Th 0 --> Th 1 ИЛ-6 ИЛ-1 • Активирует эндотелий • Активирует лимфоциты ИЛ-8 ФНО-α ИЛ-12 • Хемотаксис нейтрофилов • Активирует нейтрофилы • Активирует эндотелий • Повышает проницаемость сосудов для белков и воды
НЕКОТОРЫЕ ФАКТОРЫ, СЕКРЕТИРУЮЩИЕСЯ МАКРОФАГАМИ ПОСЛЕ КОНТАКТА С МИКРОБАМИ • Индуцирует белки острой фазы • Активирует лимфоциты • Усиливает продукцию антител • Активирует NK • Активирует Th 0 --> Th 1 ИЛ-6 ИЛ-1 • Активирует эндотелий • Активирует лимфоциты ИЛ-8 ФНО-α ИЛ-12 • Хемотаксис нейтрофилов • Активирует нейтрофилы • Активирует эндотелий • Повышает проницаемость сосудов для белков и воды
 Тучная клетка Макрофаг NK клетка Эндотелий венулы Моноцит Нейтрофи л
Тучная клетка Макрофаг NK клетка Эндотелий венулы Моноцит Нейтрофи л
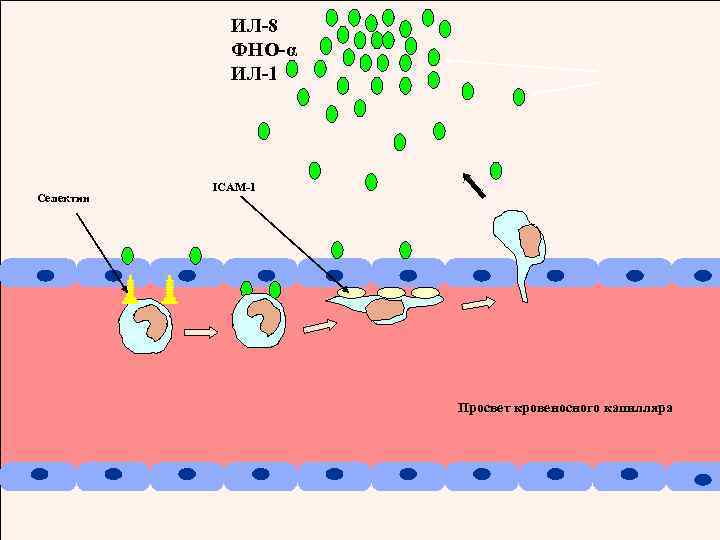 ИЛ-8 ФНО-α ИЛ-1 Селектин ICAM-1 Просвет кровеносного капилляра
ИЛ-8 ФНО-α ИЛ-1 Селектин ICAM-1 Просвет кровеносного капилляра
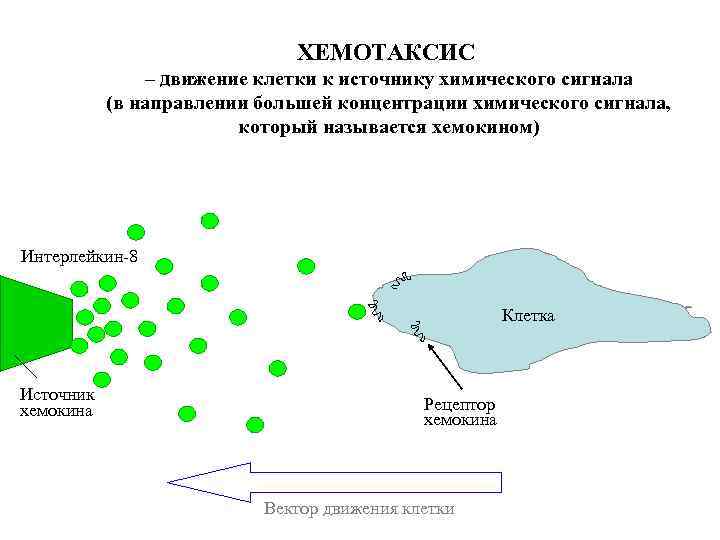 ХЕМОТАКСИС – движение клетки к источнику химического сигнала (в направлении большей концентрации химического сигнала, который называется хемокином) Интерлейкин-8 Клетка Источник хемокина Рецептор хемокина Вектор движения клетки
ХЕМОТАКСИС – движение клетки к источнику химического сигнала (в направлении большей концентрации химического сигнала, который называется хемокином) Интерлейкин-8 Клетка Источник хемокина Рецептор хемокина Вектор движения клетки
 Локальные и системные события при воспалении
Локальные и системные события при воспалении
 Дистантные (системные) эффекты воспалительных цитокинов
Дистантные (системные) эффекты воспалительных цитокинов
 Очаг инфекции Бронхиальные лимфатические узлы
Очаг инфекции Бронхиальные лимфатические узлы
 В гранулеме и Th 1 -клетки и макрофаги активированы, они выделяют многочисленные химические сигналы, которые влияют на события в очаге инфекции и далеко от него. Т клетка вырабатывает: IFN-γ , IL-2, IL-3 (GM-CSF), TNF-α, TNF-β, CCL 2 Макрофаг вырабатывает: ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α, ИЛ-12 Th 1 • • Mφ IFN-γ активирует макрофаги IL-2 активирует размножение Т клеток TNF-α и TNF-β активируют эндотелий Хемокины (CCL 2, Rantes, MCF) привлекают макрофагов в очаг воспаления
В гранулеме и Th 1 -клетки и макрофаги активированы, они выделяют многочисленные химические сигналы, которые влияют на события в очаге инфекции и далеко от него. Т клетка вырабатывает: IFN-γ , IL-2, IL-3 (GM-CSF), TNF-α, TNF-β, CCL 2 Макрофаг вырабатывает: ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α, ИЛ-12 Th 1 • • Mφ IFN-γ активирует макрофаги IL-2 активирует размножение Т клеток TNF-α и TNF-β активируют эндотелий Хемокины (CCL 2, Rantes, MCF) привлекают макрофагов в очаг воспаления
 Th 2 клетка стимулирует размножение и дифференцировку В клеток, связавших антиген Th 2 клетка Интерлейкин-4 Интерлейкин-5 В клетка, активированная антигеном
Th 2 клетка стимулирует размножение и дифференцировку В клеток, связавших антиген Th 2 клетка Интерлейкин-4 Интерлейкин-5 В клетка, активированная антигеном


 Селекция В клеток с лучшими Ig-рецепторами к данному антигену Интерлейкин-7
Селекция В клеток с лучшими Ig-рецепторами к данному антигену Интерлейкин-7
 Основные классы цитокинов 1. 2. 3. 4. 5. Гемопоэтины Интерфероны ФНО (семейство) ИЛ 10 (семейство) ИЛ 12 (семейство)
Основные классы цитокинов 1. 2. 3. 4. 5. Гемопоэтины Интерфероны ФНО (семейство) ИЛ 10 (семейство) ИЛ 12 (семейство)
 Все клетки крови образуются из стволовой кроветворной клетки
Все клетки крови образуются из стволовой кроветворной клетки
 Александрович Максимов (1874 -1928) — выдающийся российский учёный, гистолог и эмбриолог С 1903 г. - профессор кафедры гистологии и эмбриологии Императорской военно-медицинской академии С 1919 г. – профессор эмбриологии Петроградского университета С 1922 г. - профессор кафедры анатомии и руководитель лаборатории экспериментального исследования тканей в Чикагском университете • Описал строение и развитие соединительной и кроветворной тканей в эмбриональном периоде и в течение жизни. • Разработал методы культивирования соединительной и кроветворной тканей вне организма (in vitro). • На основании своих работ пришел к выводу о том, что все клетки крови образуются из одной клетки, похожей на малый лимфоцит. Назвал эту клетку «Stammzelle - стволовая кроветворная клетка» (1908 г, Берлин) • Предсказал, что соединительная ткань и, в частности, строма костного мозга образуется из другой стволовой клетки, которую он предложил называть «стволовая мезенхимальная клетка»
Александрович Максимов (1874 -1928) — выдающийся российский учёный, гистолог и эмбриолог С 1903 г. - профессор кафедры гистологии и эмбриологии Императорской военно-медицинской академии С 1919 г. – профессор эмбриологии Петроградского университета С 1922 г. - профессор кафедры анатомии и руководитель лаборатории экспериментального исследования тканей в Чикагском университете • Описал строение и развитие соединительной и кроветворной тканей в эмбриональном периоде и в течение жизни. • Разработал методы культивирования соединительной и кроветворной тканей вне организма (in vitro). • На основании своих работ пришел к выводу о том, что все клетки крови образуются из одной клетки, похожей на малый лимфоцит. Назвал эту клетку «Stammzelle - стволовая кроветворная клетка» (1908 г, Берлин) • Предсказал, что соединительная ткань и, в частности, строма костного мозга образуется из другой стволовой клетки, которую он предложил называть «стволовая мезенхимальная клетка»
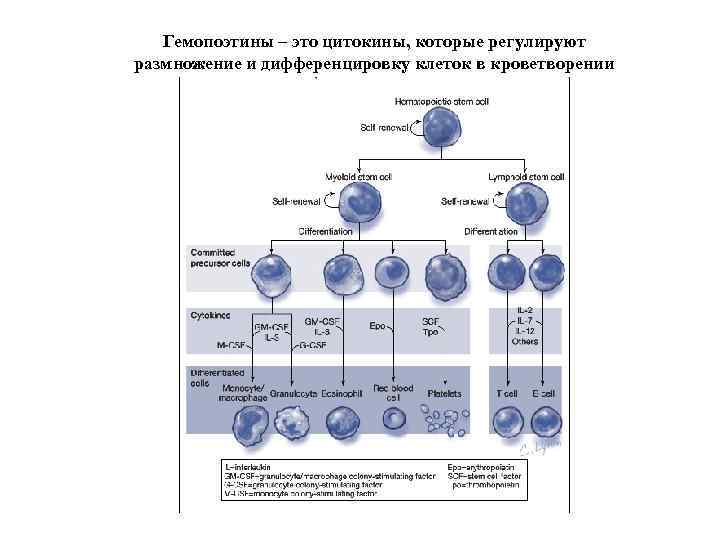 Гемопоэтины – это цитокины, которые регулируют размножение и дифференцировку клеток в кроветворении
Гемопоэтины – это цитокины, которые регулируют размножение и дифференцировку клеток в кроветворении
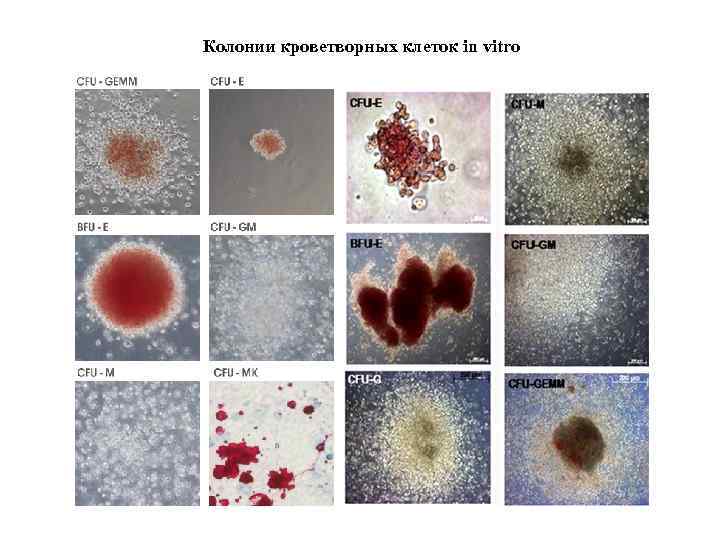 Колонии кроветворных клеток in vitro
Колонии кроветворных клеток in vitro
 Hematopoietins
Hematopoietins
 Hematopoietins (continuation)
Hematopoietins (continuation)
 Гемопоэтины Интерлейкин 4 Интерлейкин 2
Гемопоэтины Интерлейкин 4 Интерлейкин 2
 Interferons
Interferons
 Интерферон
Интерферон
 Tumor necrosis factor (TNF) family
Tumor necrosis factor (TNF) family
 Tumor necrosis factor (TNF)
Tumor necrosis factor (TNF)
 Interleukin-10 Family
Interleukin-10 Family
 IL-12 Family
IL-12 Family
 Undesigned
Undesigned
 ХЕМОКИНЫ N-конец Cys Cys X Cys C-конец C-хемокины Cys C-конец CC-хемокины C-конец CXC-хемокины
ХЕМОКИНЫ N-конец Cys Cys X Cys C-конец C-хемокины Cys C-конец CC-хемокины C-конец CXC-хемокины


 Интерлейкин 8 (хемокин CXCL 8)
Интерлейкин 8 (хемокин CXCL 8)
 Cytokines IL- 4 TNF-α IL- 8
Cytokines IL- 4 TNF-α IL- 8
 РЕЦЕПТОРЫ ЦИТОКИНОВ
РЕЦЕПТОРЫ ЦИТОКИНОВ
 G-CSF Interleukin 4 Receptor of G-CSF Receptor of Interleukin 4
G-CSF Interleukin 4 Receptor of G-CSF Receptor of Interleukin 4
 TNF-Receptor TNF-α мономер TNF-α тример TNF-α Receptor (мономер)
TNF-Receptor TNF-α мономер TNF-α тример TNF-α Receptor (мономер)
 Chemokine Receptor IL 8 Receptor Membrane
Chemokine Receptor IL 8 Receptor Membrane
 Рецептор хемокина CXCL 12 CXCR 4 Мембрана
Рецептор хемокина CXCL 12 CXCR 4 Мембрана
 IL 1 -receptor IL 1β English: Surface model of extracellular interleukin-1 receptor+interleukin-1 -beta complex (IL 1 R pink + IL 1 B cyan) after PDB 1 ITB. The receptor protein continues at the black rectangle into the membrane (grey). Ref. : Vigers GP, Anderson LJ, Caffes P, Brandhuber BJ (March 1997). "Crystal structure of the type-I interleukin-1 receptor complexed with interleukin-1 beta". Nature 386 (6621): 190– 4. DOI: 10. 1038/386190 a 0. PMID 9062193.
IL 1 -receptor IL 1β English: Surface model of extracellular interleukin-1 receptor+interleukin-1 -beta complex (IL 1 R pink + IL 1 B cyan) after PDB 1 ITB. The receptor protein continues at the black rectangle into the membrane (grey). Ref. : Vigers GP, Anderson LJ, Caffes P, Brandhuber BJ (March 1997). "Crystal structure of the type-I interleukin-1 receptor complexed with interleukin-1 beta". Nature 386 (6621): 190– 4. DOI: 10. 1038/386190 a 0. PMID 9062193.
 БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЦИТОКИНОВ (ПРИНЦИПИАЛЬНЫЕ ВАРИАНТЫ) Эффект Пример 1 АКТИВАЦИЯ ДЕЛЕНИЙ КЛЕТОК ИЛ 2 индуцирует переход G 1 --> S 2 АКТИВАЦИЯ ДИФФЕРЕНЦИРОВКИ КЛЕТОК ИЛ 12 индуцирует Th. O --> Th 1 ИЛ 4, ИЛ 5 индуцируют Th. O -->Th 2 3 АКТИВАЦИЯ ФУНКЦИИ КЛЕТОК Продукция радикалов в макрофагах Усиление киллерных свойств NK клеток 4 ИНДУКЦИЯ СИНТЕЗА КОНКРЕТНОГО БЕЛКА Один цитокин стимулирует синтез другого цитокина 5 ИНДУКЦИЯ ПЕРЕСТРОЙКИ В ГЕНОМЕ Переключение синтеза Ig. M на Ig. G 1, Ig. G 2, Ig. G 3, Ig. A или Ig. E 6 УСИЛЕНИЕ ЭКСПРЕССИИ КОНКРЕТНОГО БЕЛКА НА ПОВЕРХНОСТИ КЛЕТОК Интерферон-γ усиливает экспрессию МНС и Fc-рецепторов на макрофагах 7 ТОРМОЖЕНИЕ ДЕЛЕНИЙ И ДИФФЕРЕНЦИРОВКИ КЛЕТОК ИФН-γ тормозит дифференцировку Th 2 ИЛ 4 тормозит дифференцировку Th 1 8 ИЗМЕНЕНИЕ СОСТОЯНИЯ ОТДАЛЕННЫХ ОРГАНОВ ИЛ 6 индуцирует синтез белков острой фазы в печени ИЛ 1 –-> гипоталамус-->лихорадка
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ЦИТОКИНОВ (ПРИНЦИПИАЛЬНЫЕ ВАРИАНТЫ) Эффект Пример 1 АКТИВАЦИЯ ДЕЛЕНИЙ КЛЕТОК ИЛ 2 индуцирует переход G 1 --> S 2 АКТИВАЦИЯ ДИФФЕРЕНЦИРОВКИ КЛЕТОК ИЛ 12 индуцирует Th. O --> Th 1 ИЛ 4, ИЛ 5 индуцируют Th. O -->Th 2 3 АКТИВАЦИЯ ФУНКЦИИ КЛЕТОК Продукция радикалов в макрофагах Усиление киллерных свойств NK клеток 4 ИНДУКЦИЯ СИНТЕЗА КОНКРЕТНОГО БЕЛКА Один цитокин стимулирует синтез другого цитокина 5 ИНДУКЦИЯ ПЕРЕСТРОЙКИ В ГЕНОМЕ Переключение синтеза Ig. M на Ig. G 1, Ig. G 2, Ig. G 3, Ig. A или Ig. E 6 УСИЛЕНИЕ ЭКСПРЕССИИ КОНКРЕТНОГО БЕЛКА НА ПОВЕРХНОСТИ КЛЕТОК Интерферон-γ усиливает экспрессию МНС и Fc-рецепторов на макрофагах 7 ТОРМОЖЕНИЕ ДЕЛЕНИЙ И ДИФФЕРЕНЦИРОВКИ КЛЕТОК ИФН-γ тормозит дифференцировку Th 2 ИЛ 4 тормозит дифференцировку Th 1 8 ИЗМЕНЕНИЕ СОСТОЯНИЯ ОТДАЛЕННЫХ ОРГАНОВ ИЛ 6 индуцирует синтез белков острой фазы в печени ИЛ 1 –-> гипоталамус-->лихорадка
 Клетка, как правило, производит несколько цитокинов • одни - постоянно • другие – индукционно (в ответ на какие-то внешние воздействия)
Клетка, как правило, производит несколько цитокинов • одни - постоянно • другие – индукционно (в ответ на какие-то внешние воздействия)
 1 Цитокины 1, 2, 3 вырабатываются клеткой постоянно 2 3 1 2 3 Индуктор 4 Рецептор 5 Синтез цитокинов 4 и 5 включается (индуцируется) в ответ на какое-то воздействие на клетку
1 Цитокины 1, 2, 3 вырабатываются клеткой постоянно 2 3 1 2 3 Индуктор 4 Рецептор 5 Синтез цитокинов 4 и 5 включается (индуцируется) в ответ на какое-то воздействие на клетку
 Каждая клетка имеет рецепторы к различным цитокинам: - некоторые рецепторы представлены на клетке постоянно - другие рецепторы появляются в результате реакции клетки на какое-то воздействие
Каждая клетка имеет рецепторы к различным цитокинам: - некоторые рецепторы представлены на клетке постоянно - другие рецепторы появляются в результате реакции клетки на какое-то воздействие
 • Чувствительность клетки к внешним сигналам определяется наличием рецепторов, способных принимать эти сигналы • Клетка может менять набор своих рецепторов, это изменяет чувствительность клетки к внешним сигналам Постоянные рецепторы Индуцированные рецепторы
• Чувствительность клетки к внешним сигналам определяется наличием рецепторов, способных принимать эти сигналы • Клетка может менять набор своих рецепторов, это изменяет чувствительность клетки к внешним сигналам Постоянные рецепторы Индуцированные рецепторы
 Цитокин может быть иммобилизован, например, прикреплен к поверхности клеток эндотелия (ИЛ-8) или к поверхности Т клетки (Fas-лиганд) Fas-лиганд Макрофаг Th 1 ИЛ-8
Цитокин может быть иммобилизован, например, прикреплен к поверхности клеток эндотелия (ИЛ-8) или к поверхности Т клетки (Fas-лиганд) Fas-лиганд Макрофаг Th 1 ИЛ-8
 До сих пор не изучен язык сочетанных сигналов – двух или большего числа цитокинов, действующих на одну и ту же клетку одновременно или последовательно. Добро пожаловать! Вход воспрещен!
До сих пор не изучен язык сочетанных сигналов – двух или большего числа цитокинов, действующих на одну и ту же клетку одновременно или последовательно. Добро пожаловать! Вход воспрещен!
 РАЗЛИЧНЫЕ ФУНКЦИИ Th 1 и Th 2 Помощь макрофагу в элиминации внутриклеточной инфекции клеток Помощь В клетке, начавшей реагировать на чужеродный антиген
РАЗЛИЧНЫЕ ФУНКЦИИ Th 1 и Th 2 Помощь макрофагу в элиминации внутриклеточной инфекции клеток Помощь В клетке, начавшей реагировать на чужеродный антиген
 Th 1 и Th 2 клетки различаются цитокинами, которые они вырабатывают
Th 1 и Th 2 клетки различаются цитокинами, которые они вырабатывают
 Th 1 и Th 2 клетки возникают из одного предшественника – наивной CD 4+ T клетки
Th 1 и Th 2 клетки возникают из одного предшественника – наивной CD 4+ T клетки
 Кем стать, Th 1 - или Th 2 -хелпером, Т клетка решает уже в процессе начавшейся реакции Worm Virus Bacterium Dendritic cell
Кем стать, Th 1 - или Th 2 -хелпером, Т клетка решает уже в процессе начавшейся реакции Worm Virus Bacterium Dendritic cell
 Сигналы, способствующие превращению Th 0 в Th 1 или Th 2
Сигналы, способствующие превращению Th 0 в Th 1 или Th 2

 Бронхиальные лимфатические узлы Первичный очаг инфекции Дифференцировка Th 0 в Th 1 или Th 2 зависит от совокупности событий и факторов в первичном очаге инфекции: § свойства и количество инфекции § какие клетки с нею борются в очаге § какой набор цитокинов вырабатывается в первичном очаге и в лимфатическом узле
Бронхиальные лимфатические узлы Первичный очаг инфекции Дифференцировка Th 0 в Th 1 или Th 2 зависит от совокупности событий и факторов в первичном очаге инфекции: § свойства и количество инфекции § какие клетки с нею борются в очаге § какой набор цитокинов вырабатывается в первичном очаге и в лимфатическом узле






