Л 14 Т 8 Бор, Алюминий..ppt
- Количество слайдов: 56
 Т 8 Л 14 р- Элементы III группы Периодической системы К р-элементам III группы относятся типические элементы — бор и алюминий — и элементы подгруппы галлия — галлий, индий и таллий: В 1 s 22 p 1 Al 2 s 22 p 63 s 23 p 1 Ga 3 s 23 p 63 d 104 s 24 p 1 In 4 s 24 p 64 d 105 s 25 p 1 Tl 4 s 24 p 64 d 104 f 145 s 25 p 65 d 106 s 26 p 1 1
Т 8 Л 14 р- Элементы III группы Периодической системы К р-элементам III группы относятся типические элементы — бор и алюминий — и элементы подгруппы галлия — галлий, индий и таллий: В 1 s 22 p 1 Al 2 s 22 p 63 s 23 p 1 Ga 3 s 23 p 63 d 104 s 24 p 1 In 4 s 24 p 64 d 105 s 25 p 1 Tl 4 s 24 p 64 d 104 f 145 s 25 p 65 d 106 s 26 p 1 1
 Бор • По сравнению с ранее рассмотренными элементами 2 -го периода у бора наблюдается дальнейшее ослабление признаков неметаллического элемента. В этом отношении он напоминает кремний (диагональное сходство в периодической системе). Для бора наиболее характерны соединения, в которых его степень окисления равна +3. Отрицательные степени окисления бора проявляются редко; с металлами бор обычно образует нестехиометрические соединения. ОЭО=2, 01 • Бор в земной коре (6 10 -4 мол. доли, %) находится в виде двух изотопов: 10 В (19, 57 %) и 11 В (80, 43 %). • Основными его минералами являются бораты: Nа 2 В 4 О 7 10 Н 2 О - бура, Nа 2 В 4 О 7 4 Н 2 O - кернит, Н 3 ВО 3 сассолин (борная кислота, назван по месту Сассо). 2
Бор • По сравнению с ранее рассмотренными элементами 2 -го периода у бора наблюдается дальнейшее ослабление признаков неметаллического элемента. В этом отношении он напоминает кремний (диагональное сходство в периодической системе). Для бора наиболее характерны соединения, в которых его степень окисления равна +3. Отрицательные степени окисления бора проявляются редко; с металлами бор обычно образует нестехиометрические соединения. ОЭО=2, 01 • Бор в земной коре (6 10 -4 мол. доли, %) находится в виде двух изотопов: 10 В (19, 57 %) и 11 В (80, 43 %). • Основными его минералами являются бораты: Nа 2 В 4 О 7 10 Н 2 О - бура, Nа 2 В 4 О 7 4 Н 2 O - кернит, Н 3 ВО 3 сассолин (борная кислота, назван по месту Сассо). 2
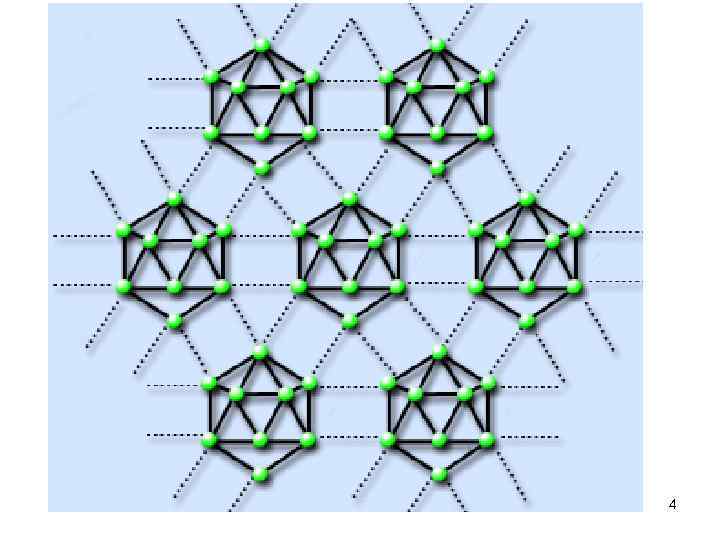
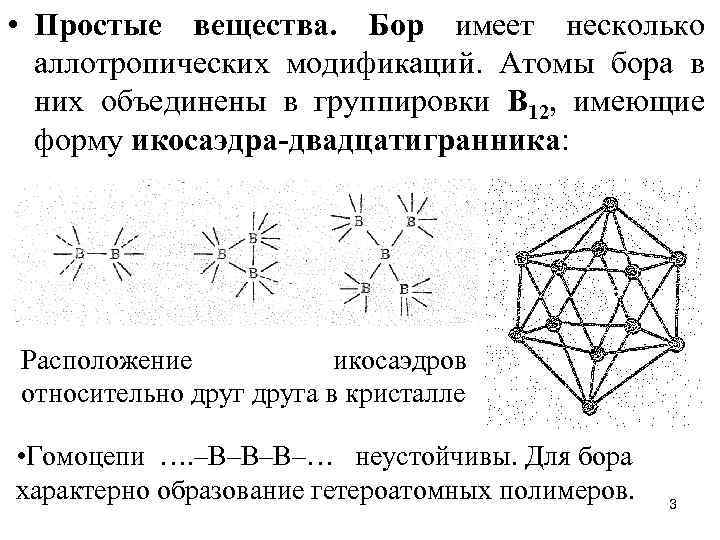 • Простые вещества. Бор имеет несколько аллотропических модификаций. Атомы бора в них объединены в группировки В 12, имеющие форму икосаэдра-двадцатигранника: Расположение икосаэдров относительно друга в кристалле • Гомоцепи …. –В–В–В–… неустойчивы. Для бора характерно образование гетероатомных полимеров. 3
• Простые вещества. Бор имеет несколько аллотропических модификаций. Атомы бора в них объединены в группировки В 12, имеющие форму икосаэдра-двадцатигранника: Расположение икосаэдров относительно друга в кристалле • Гомоцепи …. –В–В–В–… неустойчивы. Для бора характерно образование гетероатомных полимеров. 3
 4
4
 • Кристаллы бора черного цвета, тугоплавкие (Tпл. 2300 °С, Tкип. – 2550 o. С), диамагнитны, обладают полупроводниковыми свойствами ( Е = 1, 55 э. В). По твердости они уступает только алмазу и нитриду бора. • В обычных условиях кристаллический бор (подобно кремнию) весьма инертен и непосредственно взаимодействует только со фтором; при нагревании (400— 700 °С) окисляется кислородом, серой, хлором (и др. галогенами), и даже азотом (выше 1200 °С). 4 B (к) + 3 O 2 (г) = 2 B 2 O 3 (к), Hо = -2508 к. Дж 2 B + 3 Cl 2 = 2 BCl 3 (BГ 3 + Н 2 О = В(ОН)3 + 3 НГ). • С водородом бор не взаимодействует. • При сильном нагревании восстановительная активность бора проявляется и в отношении таких устойчивых оксидов, как Si. O 2, Р 2 O 5 и др. : 3 Si. O 2 + 4 В = 3 Si + 2 В 2 O 3 5
• Кристаллы бора черного цвета, тугоплавкие (Tпл. 2300 °С, Tкип. – 2550 o. С), диамагнитны, обладают полупроводниковыми свойствами ( Е = 1, 55 э. В). По твердости они уступает только алмазу и нитриду бора. • В обычных условиях кристаллический бор (подобно кремнию) весьма инертен и непосредственно взаимодействует только со фтором; при нагревании (400— 700 °С) окисляется кислородом, серой, хлором (и др. галогенами), и даже азотом (выше 1200 °С). 4 B (к) + 3 O 2 (г) = 2 B 2 O 3 (к), Hо = -2508 к. Дж 2 B + 3 Cl 2 = 2 BCl 3 (BГ 3 + Н 2 О = В(ОН)3 + 3 НГ). • С водородом бор не взаимодействует. • При сильном нагревании восстановительная активность бора проявляется и в отношении таких устойчивых оксидов, как Si. O 2, Р 2 O 5 и др. : 3 Si. O 2 + 4 В = 3 Si + 2 В 2 O 3 5
 • На бор действуют лишь горячие концентрированные азотная и серная кислоты, а также царская водка, переводя его в Н 3 ВО 3. Щелочи при отсутствии окислителей на бор не действуют. B + 3 HNO 3 = H 3 BO 3 + 3 NO 2 • Вследствие высокой энергии Гиббса образования большинства соединений бора его получение в свободном состоянии производится обычно методами металлотермии (чаще всего восстановлением магнием или натрием) (получают аморфныйкоричн. бор): B 2 O 3 + 3 Mg = 3 Mg. O + 2 B, Go = -525 к. Дж/моль KBF 4 + 3 Na = 3 Na. F + KF + B, Go = -377 к. Дж/моль Чистый кристаллический бор получают разложением или 6 восстановлением 2 BCl 3 + 3 H 2 = 2 B + 6 HCl.
• На бор действуют лишь горячие концентрированные азотная и серная кислоты, а также царская водка, переводя его в Н 3 ВО 3. Щелочи при отсутствии окислителей на бор не действуют. B + 3 HNO 3 = H 3 BO 3 + 3 NO 2 • Вследствие высокой энергии Гиббса образования большинства соединений бора его получение в свободном состоянии производится обычно методами металлотермии (чаще всего восстановлением магнием или натрием) (получают аморфныйкоричн. бор): B 2 O 3 + 3 Mg = 3 Mg. O + 2 B, Go = -525 к. Дж/моль KBF 4 + 3 Na = 3 Na. F + KF + B, Go = -377 к. Дж/моль Чистый кристаллический бор получают разложением или 6 восстановлением 2 BCl 3 + 3 H 2 = 2 B + 6 HCl.
 • Металлические соединения бора. С металлами бор образует бориды среднего состава М 4 В, М 2 В, М 3 В 4, МВ 2, МВ 6. • В зависимости от условий один и тот же элемент образует бориды разного состава, например Nb 2 В, Nb 3 В 2, NВ, Nb 3 В 4, NВ 2, Сr 4 В, Сr 2 В, Сr 3 В 4, Сr. В 2. По мере увеличения содержания бора структура боридов существенно усложняется. В боридах типа М 4 В и М 2 В атомы бора изолированы друг от друга. В боридах типа М 3 В 2 атомы бора связаны попарно, в МВ — в цепи, в М 3 В 4— в сдвоенные цепи, в МВ 2 — в сетки из шестичленных колец и, наконец, в боридах состава МВ 6 и МВ 12 — в трехмерные каркасы соответственно в виде октаэдрических и икосаэдрических группировок атомов. 7
• Металлические соединения бора. С металлами бор образует бориды среднего состава М 4 В, М 2 В, М 3 В 4, МВ 2, МВ 6. • В зависимости от условий один и тот же элемент образует бориды разного состава, например Nb 2 В, Nb 3 В 2, NВ, Nb 3 В 4, NВ 2, Сr 4 В, Сr 2 В, Сr 3 В 4, Сr. В 2. По мере увеличения содержания бора структура боридов существенно усложняется. В боридах типа М 4 В и М 2 В атомы бора изолированы друг от друга. В боридах типа М 3 В 2 атомы бора связаны попарно, в МВ — в цепи, в М 3 В 4— в сдвоенные цепи, в МВ 2 — в сетки из шестичленных колец и, наконец, в боридах состава МВ 6 и МВ 12 — в трехмерные каркасы соответственно в виде октаэдрических и икосаэдрических группировок атомов. 7
 • Большинство боридов d- и f-элементов очень тверды, жаростойки (2000— 3000 °С) и химически устойчивы. Бориды s-элементов химически активны, в частности, разлагаются под действием кислот, образуя смеси бороводородов (боранов) Вn. Hn+4, Вn. Hn+6. • Жаропрочные и жаростойкие бориды dэлементов (Сr, Zr, Тi, Nb , Та) и их сплавы применяются для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр. Некоторые бориды используются как катализаторы, в качестве материалов для катодов электронных приборов и т. д. 8
• Большинство боридов d- и f-элементов очень тверды, жаростойки (2000— 3000 °С) и химически устойчивы. Бориды s-элементов химически активны, в частности, разлагаются под действием кислот, образуя смеси бороводородов (боранов) Вn. Hn+4, Вn. Hn+6. • Жаропрочные и жаростойкие бориды dэлементов (Сr, Zr, Тi, Nb , Та) и их сплавы применяются для изготовления деталей реактивных двигателей, лопаток газовых турбин и пр. Некоторые бориды используются как катализаторы, в качестве материалов для катодов электронных приборов и т. д. 8
 • Соединения бора (III). Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными (2, 01), чем он сам, элементами, т. е. в галогенидах, оксиде, сульфиде, нитриде, гидридах и в соответствующих анионных борат-комплексах, простейшие из которых приведены ниже: BF 3 B 2 O 3 BH 3 BF 4 BO 2 BH 4 В отличие от остальных элементов III группы, соли, диссоциирующие в растворах с образованием катиона В 3+, неизвестны. Для бора типичны соединения, в которых он входит в состав комплексного аниона [(BO 2)nn-, B 4 O 72 -, BF 4 9 -, BH - и др. ] 4
• Соединения бора (III). Степень окисления +3 у бора проявляется в соединениях с более электроотрицательными (2, 01), чем он сам, элементами, т. е. в галогенидах, оксиде, сульфиде, нитриде, гидридах и в соответствующих анионных борат-комплексах, простейшие из которых приведены ниже: BF 3 B 2 O 3 BH 3 BF 4 BO 2 BH 4 В отличие от остальных элементов III группы, соли, диссоциирующие в растворах с образованием катиона В 3+, неизвестны. Для бора типичны соединения, в которых он входит в состав комплексного аниона [(BO 2)nn-, B 4 O 72 -, BF 4 9 -, BH - и др. ] 4
 • В зависимости от числа -связей координационное число бора (III) равно 4 или 3, что соответствует sр3 - или sр2 -гибридизации его валентных орбиталей. 10
• В зависимости от числа -связей координационное число бора (III) равно 4 или 3, что соответствует sр3 - или sр2 -гибридизации его валентных орбиталей. 10
 • sр2 -Гибридизация валентных орбиталей бора определяет плоское треугольное строение молекул, комплексов и структурных единиц его соединений. Как и в случае углерода, sр2 -гибридное состояние стабилизируется за счет нелокализованной р -р связи. Последняя образуется при участии свободной 2 р -орбитали атома бора и неподеленной пары электронов связанных с ним атомов: В результате возникает частичная двоесвязанность, упрочняется связь и уменьшается межъядерное расстояние. боразин HN BH (Боразол) 11
• sр2 -Гибридизация валентных орбиталей бора определяет плоское треугольное строение молекул, комплексов и структурных единиц его соединений. Как и в случае углерода, sр2 -гибридное состояние стабилизируется за счет нелокализованной р -р связи. Последняя образуется при участии свободной 2 р -орбитали атома бора и неподеленной пары электронов связанных с ним атомов: В результате возникает частичная двоесвязанность, упрочняется связь и уменьшается межъядерное расстояние. боразин HN BH (Боразол) 11
 • В соответствии с устойчивыми координационными числами бора (III) из бинарных соединений галогениды ВНаl 3 мономолекулярны, а оксид В 2 О 3, сульфид B 2 S 3, нитрид ВN — полимерны. Весьма своеобразна структура гидридов бора (боранов). • Бинарные соединения бора (III) кислотные. Об этом, в частности, свидетельствует характер их сольволиза (гидролиза) и взаимодействия с основными соединениями. • Галогениды типа ВНаl 3 известны для всех галогенов. Могут быть получены из простых веществ при нагревании. Все они бесцветны. Молекулы ВНаl 3 имеют форму плоского треугольника с атомом бора в центре (sр2 -гибридное состояние бора). В обычных условиях ВF 3 — газ, ВСl 3 и ВВr 3 — жидкости, ВI 3 — твердое вещество. 12
• В соответствии с устойчивыми координационными числами бора (III) из бинарных соединений галогениды ВНаl 3 мономолекулярны, а оксид В 2 О 3, сульфид B 2 S 3, нитрид ВN — полимерны. Весьма своеобразна структура гидридов бора (боранов). • Бинарные соединения бора (III) кислотные. Об этом, в частности, свидетельствует характер их сольволиза (гидролиза) и взаимодействия с основными соединениями. • Галогениды типа ВНаl 3 известны для всех галогенов. Могут быть получены из простых веществ при нагревании. Все они бесцветны. Молекулы ВНаl 3 имеют форму плоского треугольника с атомом бора в центре (sр2 -гибридное состояние бора). В обычных условиях ВF 3 — газ, ВСl 3 и ВВr 3 — жидкости, ВI 3 — твердое вещество. 12
 • Наибольшее применение имеют ВF 3 и ВСl 3. Трифторид получают нагреванием В 2 О 3 с Сa. F 2 в присутствии концентрированной Н 2 SO 4 (похоже на получение Si. F 4). В 2 О 3 + 3 Са. F 2 + 3 Н 2 SO 4 2 ВF 3 + 3 Са. SО 4 + 3 Н 2 O • Получение трихлорида бора (как и Si. Сl 3 ) основано на хлорировании раскаленной смеси оксида и угля: В 2 O 3 + 3 Сl 2 = 2 ВСl 3 + 3 СО • Тригалогениды бора — сильные акцепторы электронной пары; ВF 3, например, присоединяет молекулу воды, аммиака, эфира, спирта и пр. • При взаимодействии с водой ВF 3 дает ВF 3 Н 2 O (Tпл. 10, 2 °С, Tразл. 20 °С). С аммиаком образует твердое вещество ВF 3 NН 3 (Tпл. 163 °С). 13
• Наибольшее применение имеют ВF 3 и ВСl 3. Трифторид получают нагреванием В 2 О 3 с Сa. F 2 в присутствии концентрированной Н 2 SO 4 (похоже на получение Si. F 4). В 2 О 3 + 3 Са. F 2 + 3 Н 2 SO 4 2 ВF 3 + 3 Са. SО 4 + 3 Н 2 O • Получение трихлорида бора (как и Si. Сl 3 ) основано на хлорировании раскаленной смеси оксида и угля: В 2 O 3 + 3 Сl 2 = 2 ВСl 3 + 3 СО • Тригалогениды бора — сильные акцепторы электронной пары; ВF 3, например, присоединяет молекулу воды, аммиака, эфира, спирта и пр. • При взаимодействии с водой ВF 3 дает ВF 3 Н 2 O (Tпл. 10, 2 °С, Tразл. 20 °С). С аммиаком образует твердое вещество ВF 3 NН 3 (Tпл. 163 °С). 13
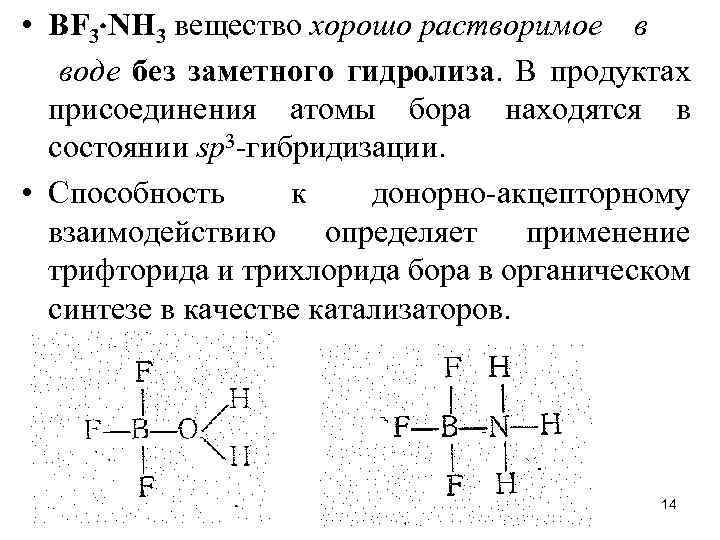 • ВF 3 NН 3 вещество хорошо растворимое в воде без заметного гидролиза. В продуктах присоединения атомы бора находятся в состоянии sр3 -гибридизации. • Способность к донорно-акцепторному взаимодействию определяет применение трифторида и трихлорида бора в органическом синтезе в качестве катализаторов. 14
• ВF 3 NН 3 вещество хорошо растворимое в воде без заметного гидролиза. В продуктах присоединения атомы бора находятся в состоянии sр3 -гибридизации. • Способность к донорно-акцепторному взаимодействию определяет применение трифторида и трихлорида бора в органическом синтезе в качестве катализаторов. 14
 • Оксид бора (III) В 2 O 3 существует в виде нескольких модификаций. В кристаллах В 2 O 3 атомы бора находятся внутри равностороннего треугольника ВО 3 либо тетраэдра ВО 4 из атомов кислорода. В 2 O 3 очень огнестоек и не восстанавливается углеродом даже при белом калении. Кристаллический В 2 O 3 (Тпл. 450 °С и Ткип. 2250 °С). Он легко переходит в стеклообразное состояние и очень трудно кристаллизируется. Можно получать оксид В 2 О 3 обезвоживанием Н 3 ВО 3. В отличие от цепи Si—О—Si цепь В—О—В относительно легко разрывается при гидратации; в этом отношении кислородные соединения бора (III) сходны с таковыми фосфора. Как кислотный оксид В 2 O 3 энергично взаимодействует с водой с образованием борной кислоты Н 3 ВO 3. В 2 O 3 + 3 Н 2 О = 2 Н 3 ВO 3 В 2 О 3 кислотный ангидрид, но слабо амфотерен, при нагревании 2 В 2 О 3 + Р 4 О 10 = 4 ВРО 4 15
• Оксид бора (III) В 2 O 3 существует в виде нескольких модификаций. В кристаллах В 2 O 3 атомы бора находятся внутри равностороннего треугольника ВО 3 либо тетраэдра ВО 4 из атомов кислорода. В 2 O 3 очень огнестоек и не восстанавливается углеродом даже при белом калении. Кристаллический В 2 O 3 (Тпл. 450 °С и Ткип. 2250 °С). Он легко переходит в стеклообразное состояние и очень трудно кристаллизируется. Можно получать оксид В 2 О 3 обезвоживанием Н 3 ВО 3. В отличие от цепи Si—О—Si цепь В—О—В относительно легко разрывается при гидратации; в этом отношении кислородные соединения бора (III) сходны с таковыми фосфора. Как кислотный оксид В 2 O 3 энергично взаимодействует с водой с образованием борной кислоты Н 3 ВO 3. В 2 O 3 + 3 Н 2 О = 2 Н 3 ВO 3 В 2 О 3 кислотный ангидрид, но слабо амфотерен, при нагревании 2 В 2 О 3 + Р 4 О 10 = 4 ВРО 4 15
 • В соответствии с устойчивыми координационными числами бора 3 и 4 нитрид бора ВN существует в виде двух модификаций. При взаимодействии простых веществ образуется модификация с гексагональной атомно-слоистой структурой типа графита. Гексагональные кольца в нитриде бора содержат чередующиеся атомы В и N (на расстоянии 0, 145 нм с углами 120 o). Это соответствует sр2 -гибридизации валентных орбиталей атомов бора и азота. (Расстояние между слоями в нитриде бора равно 0, 334 им, т. е. короче, чем в графите — 0, 340 им. ) В отличие от графита ВN - белого цвета ( «белый графит» ) полупроводник ( Е = 4, 6— 3, 6 э. В), легко расслаивается на чешуйки, огнеупорен (Тпл. - 3000 °С). Водой разлагается очень медленно при нагревании. Разложение усиливается при действии разбавленных 16 кислот.
• В соответствии с устойчивыми координационными числами бора 3 и 4 нитрид бора ВN существует в виде двух модификаций. При взаимодействии простых веществ образуется модификация с гексагональной атомно-слоистой структурой типа графита. Гексагональные кольца в нитриде бора содержат чередующиеся атомы В и N (на расстоянии 0, 145 нм с углами 120 o). Это соответствует sр2 -гибридизации валентных орбиталей атомов бора и азота. (Расстояние между слоями в нитриде бора равно 0, 334 им, т. е. короче, чем в графите — 0, 340 им. ) В отличие от графита ВN - белого цвета ( «белый графит» ) полупроводник ( Е = 4, 6— 3, 6 э. В), легко расслаивается на чешуйки, огнеупорен (Тпл. - 3000 °С). Водой разлагается очень медленно при нагревании. Разложение усиливается при действии разбавленных 16 кислот.
 • В другой модификации нитрида бора (боразон или эльбор) атомы бора и азота находятся в состоянии sр3 гибридизации. Эта модификация имеет кристаллическую решетку типа алмаза. Она образуется из гексагональной при высоком давлении порядка 6— 8 ГПа и нагревании (1800 °С). Превращение гексагонального нитрида бора в боразон аналогично превращению графита в алмаз. • Кристаллы боразона окрашены в цвета от желтого до черного или бесцветны. Боразон очень твердый и в этом отношении почти не уступает алмазу (некоторые образцы боразона даже царапают алмаз). К тому же в отличие от последнего он механически более прочен и термически более стоек, выдерживает нагревание на воздухе до 2000 о. С, а алмаз сгорает при 800 о. С. 17
• В другой модификации нитрида бора (боразон или эльбор) атомы бора и азота находятся в состоянии sр3 гибридизации. Эта модификация имеет кристаллическую решетку типа алмаза. Она образуется из гексагональной при высоком давлении порядка 6— 8 ГПа и нагревании (1800 °С). Превращение гексагонального нитрида бора в боразон аналогично превращению графита в алмаз. • Кристаллы боразона окрашены в цвета от желтого до черного или бесцветны. Боразон очень твердый и в этом отношении почти не уступает алмазу (некоторые образцы боразона даже царапают алмаз). К тому же в отличие от последнего он механически более прочен и термически более стоек, выдерживает нагревание на воздухе до 2000 о. С, а алмаз сгорает при 800 о. С. 17
 • Гидриды бора (бораны) по способу получения и по свойствам напоминают силаны. Обычно смесь боранов с водородом получается действием кислот на некоторые химически активные бориды, например: 6 Мg. В 2 + 12 НСl = Н 2 + В 4 Н 10 + 6 Мg. Сl 2 + 8 В 3 Na[BH 4] + 4 BF 3 = 2 B 2 H 6 + 3 Na[BF 4] (в эфире) 6 H 2 (г) + 2 BCl 3 (г) = B 2 H 6 (г) + 6 HCl (г) • Простейшее водородное соединение бора BH 3 в обычных условиях не существует. Это объясняется его координационной ненасыщенностью и невозможностью образования делокализованной -связи, которая стабилизировала бы sр2 -гибридное состояние атома бора. Координационное насыщение атома бора возникает при сочетании этих молекул-радикалов друг с другом: ВH 3 (г) + ВН 3 (г) = В 2 Н 6 (г), Go 298= — 127 к. Дж/моль. 18
• Гидриды бора (бораны) по способу получения и по свойствам напоминают силаны. Обычно смесь боранов с водородом получается действием кислот на некоторые химически активные бориды, например: 6 Мg. В 2 + 12 НСl = Н 2 + В 4 Н 10 + 6 Мg. Сl 2 + 8 В 3 Na[BH 4] + 4 BF 3 = 2 B 2 H 6 + 3 Na[BF 4] (в эфире) 6 H 2 (г) + 2 BCl 3 (г) = B 2 H 6 (г) + 6 HCl (г) • Простейшее водородное соединение бора BH 3 в обычных условиях не существует. Это объясняется его координационной ненасыщенностью и невозможностью образования делокализованной -связи, которая стабилизировала бы sр2 -гибридное состояние атома бора. Координационное насыщение атома бора возникает при сочетании этих молекул-радикалов друг с другом: ВH 3 (г) + ВН 3 (г) = В 2 Н 6 (г), Go 298= — 127 к. Дж/моль. 18
 • Нетрудно видеть, бороводороды — соединения с дефицитом электронов. Например, в В 2 Н 6 общее число валентных электронов равно 12; т. е. их не хватает для образования восьми обычных двухэлектронных двухцентровых связей. В диборане В 2 Н 6 имеют место двух- и трехцентровые связи. Две концевые группы ВН 2 лежат в одной плоскости, а атомы водорода и бора связаны двухцентровыми двухэлектронными связями. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора трехцентровой двухэлектронной связью. 19
• Нетрудно видеть, бороводороды — соединения с дефицитом электронов. Например, в В 2 Н 6 общее число валентных электронов равно 12; т. е. их не хватает для образования восьми обычных двухэлектронных двухцентровых связей. В диборане В 2 Н 6 имеют место двух- и трехцентровые связи. Две концевые группы ВН 2 лежат в одной плоскости, а атомы водорода и бора связаны двухцентровыми двухэлектронными связями. Два же центральных атома водорода расположены симметрично над этой плоскостью и под нею и объединены с атомами бора трехцентровой двухэлектронной связью. 19
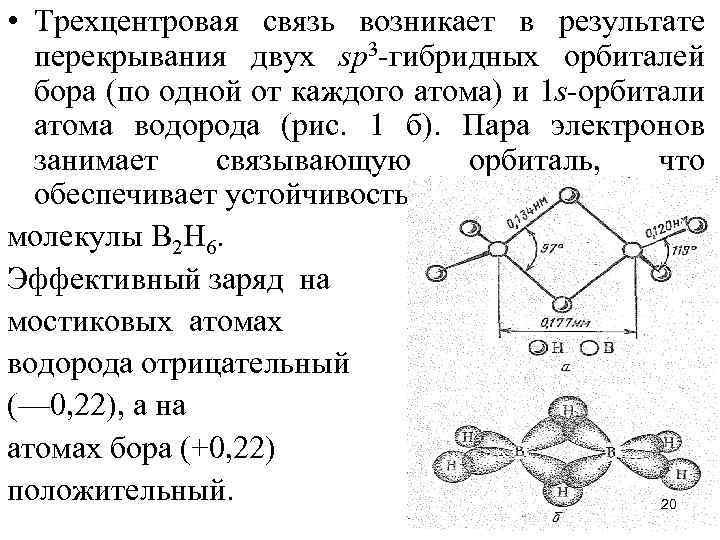 • Трехцентровая связь возникает в результате перекрывания двух sр3 -гибридных орбиталей бора (по одной от каждого атома) и 1 s-орбитали атома водорода (рис. 1 б). Пара электронов занимает связывающую орбиталь, что обеспечивает устойчивость молекулы В 2 Н 6. Эффективный заряд на мостиковых атомах водорода отрицательный (— 0, 22), а на атомах бора (+0, 22) положительный. 20
• Трехцентровая связь возникает в результате перекрывания двух sр3 -гибридных орбиталей бора (по одной от каждого атома) и 1 s-орбитали атома водорода (рис. 1 б). Пара электронов занимает связывающую орбиталь, что обеспечивает устойчивость молекулы В 2 Н 6. Эффективный заряд на мостиковых атомах водорода отрицательный (— 0, 22), а на атомах бора (+0, 22) положительный. 20
 • В молекулах других боранов помимо двухцентровых (внешних) связей В—Н и трехцентровых (мостиковых) связей В- - -Н- - -В проявляются также связи В—В. В результате возникают довольно сложные структуры. 21
• В молекулах других боранов помимо двухцентровых (внешних) связей В—Н и трехцентровых (мостиковых) связей В- - -Н- - -В проявляются также связи В—В. В результате возникают довольно сложные структуры. 21
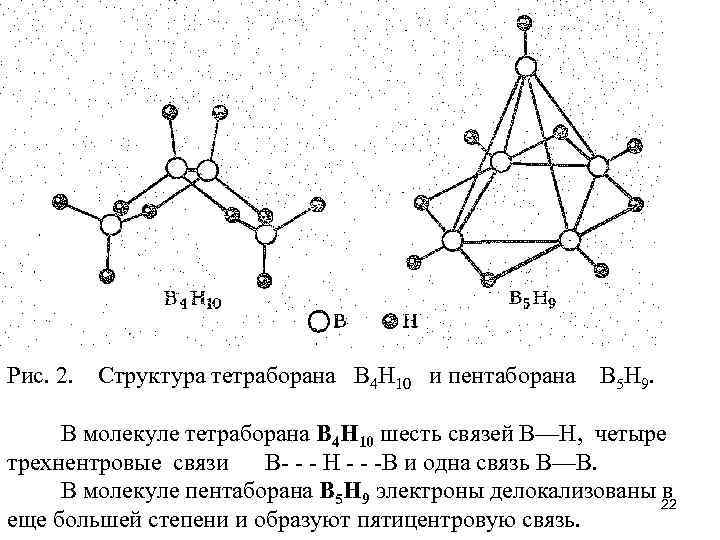 Рис. 2. Структура тетраборана В 4 Н 10 и пентаборана В 5 Н 9. В молекуле тетраборана В 4 Н 10 шесть связей В—Н, четыре трехнентровые связи В- - - Н - - -В и одна связь В—В. В молекуле пентаборана В 5 Н 9 электроны делокализованы 22 в еще большей степени и образуют пятицентровую связь.
Рис. 2. Структура тетраборана В 4 Н 10 и пентаборана В 5 Н 9. В молекуле тетраборана В 4 Н 10 шесть связей В—Н, четыре трехнентровые связи В- - - Н - - -В и одна связь В—В. В молекуле пентаборана В 5 Н 9 электроны делокализованы 22 в еще большей степени и образуют пятицентровую связь.
 • Бороводороды химически весьма активны (относительно менее активен В 10 Н 14 — декаборан). Так, большинство боранов на воздухе самовоспламеняются и сгорают с выделением очень большого количества тепла (например, для В 2 Н 6 - 2025 к. Дж/моль, тогда как для С 2 Н 6 = 1425 к. Дж/моль). Это позволяет использовать их в качестве ракетного топлива. В 2 Н 6 + 3 О 2 = В 2 О 3 + 3 Н 2 О • Гидриды бора разлагаются водой, спиртами и щелочами с выделением водорода. Наиболее активно гидролизуется диборан: В 2 Н 6 + 6 Н 2 О = 2 Н 3 ВО 3 + 6 Н 2 • Большинство боранов имеет отвратительный запах 23 и очень ядовиты!
• Бороводороды химически весьма активны (относительно менее активен В 10 Н 14 — декаборан). Так, большинство боранов на воздухе самовоспламеняются и сгорают с выделением очень большого количества тепла (например, для В 2 Н 6 - 2025 к. Дж/моль, тогда как для С 2 Н 6 = 1425 к. Дж/моль). Это позволяет использовать их в качестве ракетного топлива. В 2 Н 6 + 3 О 2 = В 2 О 3 + 3 Н 2 О • Гидриды бора разлагаются водой, спиртами и щелочами с выделением водорода. Наиболее активно гидролизуется диборан: В 2 Н 6 + 6 Н 2 О = 2 Н 3 ВО 3 + 6 Н 2 • Большинство боранов имеет отвратительный запах 23 и очень ядовиты!
 • Будучи кислотными, бинарные соединения бора (III) при взаимодействии с основными соединениями образуют анионные комплексы, например: 2 KOH + B 2 O 3 = 2 KBO 2 + H 2 O 2 Li. H + (BH 3)2 = 2 Li[BH 4] (в эфире) Na. H + BF 3 = Na[BF 3 H] (в эфире) 24
• Будучи кислотными, бинарные соединения бора (III) при взаимодействии с основными соединениями образуют анионные комплексы, например: 2 KOH + B 2 O 3 = 2 KBO 2 + H 2 O 2 Li. H + (BH 3)2 = 2 Li[BH 4] (в эфире) Na. H + BF 3 = Na[BF 3 H] (в эфире) 24
 • Гидридобораты известны для многих элементов. Тетрагидридобораты щелочных и щелочноземельньх металлов являются преимущественно ионными соединениями, т. е. типичными солями, анионом которых является прочный комплексный ион [ВН 4]-. В твердом состоянии они вполне устойчивы (Тразл. 250 -500 °С). В практике чаще всего используется Nа[ВН 4] — бесцветная соль, хорошо растворимая в воде. При обычных температурах гидролизуется очень медленно. Эта соль вполне устойчива, ее можно перекристаллизовать из водного раствора. • Гидридобораты щелочных металлов можно получить взаимодействием соответствующего гидрида с дибораном в эфирном растворе. Для получения Nа[ВН 4] обычно используется реакция между гидридом натрия и метиловым эфиром ортоборной кислоты: 4 Nа. Н + В(ОСН 3)3 = Nа[BН 4] + 3 СН 3 ОNа • Тетрагидридобораты других металлов обычно получают обменной реакцией между Nа[ВН 4] и соответствующим галогенидом, например: 3 Nа[ВН 4] + Аl. Сl 3 = Аl[ВН 4]3 + 3 Nа. Сl 25
• Гидридобораты известны для многих элементов. Тетрагидридобораты щелочных и щелочноземельньх металлов являются преимущественно ионными соединениями, т. е. типичными солями, анионом которых является прочный комплексный ион [ВН 4]-. В твердом состоянии они вполне устойчивы (Тразл. 250 -500 °С). В практике чаще всего используется Nа[ВН 4] — бесцветная соль, хорошо растворимая в воде. При обычных температурах гидролизуется очень медленно. Эта соль вполне устойчива, ее можно перекристаллизовать из водного раствора. • Гидридобораты щелочных металлов можно получить взаимодействием соответствующего гидрида с дибораном в эфирном растворе. Для получения Nа[ВН 4] обычно используется реакция между гидридом натрия и метиловым эфиром ортоборной кислоты: 4 Nа. Н + В(ОСН 3)3 = Nа[BН 4] + 3 СН 3 ОNа • Тетрагидридобораты других металлов обычно получают обменной реакцией между Nа[ВН 4] и соответствующим галогенидом, например: 3 Nа[ВН 4] + Аl. Сl 3 = Аl[ВН 4]3 + 3 Nа. Сl 25
 • В противоположность ионным ковалентные тетрагидридобораты типа Аl(ВН 4)3 (Tпл. — 64, 5 °С, Tкип. 44, 5 °С), Ве(ВН 4)2 (Tвозг. 91 °С) летучи, легкоплавки. В этих гидридоборатах (из-за дефицита электронов) связь между внешней и внутренней сферами осуществляется за счет трехцентровых связей. Т. е. , эти соединения являются смешанными гидридами. В гидридоборатах же щелочных и щелочноземельных металлов (низкие энергии ионизации) дефицит электронов устраняется за счет перехода электронов атома металла к радикалу ВН 4, т. е. в этом случае связь между внешней и внутренней сферами становится преимущественно ионной: • В отличие от ионных ковалентные гидридобораты (смешанные гидриды) так же реакционноспособны, как и гидриды бора, например взрывают на воздухе. • Гидридобораты—сильные восстановители. Они широко используются для проведения различных синтезов, применяются как исходные вещества для получения различных гидридов и в особенности диборана: 3 Nа[ВН 4] + 4 ВF 3 = 2 В 2 Н 6 + 3 Nа[BF 4] • Эту реакцию, протекающую в эфирной среде, можно рассматривать как реакцию вытеснения одним кислотным соединением (ВF 3) другого 26 (ВН 3)2.
• В противоположность ионным ковалентные тетрагидридобораты типа Аl(ВН 4)3 (Tпл. — 64, 5 °С, Tкип. 44, 5 °С), Ве(ВН 4)2 (Tвозг. 91 °С) летучи, легкоплавки. В этих гидридоборатах (из-за дефицита электронов) связь между внешней и внутренней сферами осуществляется за счет трехцентровых связей. Т. е. , эти соединения являются смешанными гидридами. В гидридоборатах же щелочных и щелочноземельных металлов (низкие энергии ионизации) дефицит электронов устраняется за счет перехода электронов атома металла к радикалу ВН 4, т. е. в этом случае связь между внешней и внутренней сферами становится преимущественно ионной: • В отличие от ионных ковалентные гидридобораты (смешанные гидриды) так же реакционноспособны, как и гидриды бора, например взрывают на воздухе. • Гидридобораты—сильные восстановители. Они широко используются для проведения различных синтезов, применяются как исходные вещества для получения различных гидридов и в особенности диборана: 3 Nа[ВН 4] + 4 ВF 3 = 2 В 2 Н 6 + 3 Nа[BF 4] • Эту реакцию, протекающую в эфирной среде, можно рассматривать как реакцию вытеснения одним кислотным соединением (ВF 3) другого 26 (ВН 3)2.
 • Тетрафторобораты очень разнообразны. По кристаллической структуре и растворимости они очень близки к соответствующим перхлоратам. Относительно мало растворимы К[ВF 4], Rb[ВF 4] и Сs[ВF 4]; соли почти всех остальных металлов хорошо растворимы в воде. • Фтороборат водорода НВF 4 в свободном состоянии не получен. Его водный раствор — очень сильная кислота, сильнее H 2 SO 4, HNO 3. • Получают ее растворением Н 3 ВО 3 в плавиковой кислоте: Н 3 ВО 3 + 4 HF = OH 3+ + BF 4 - + 2 Н 2 О 27
• Тетрафторобораты очень разнообразны. По кристаллической структуре и растворимости они очень близки к соответствующим перхлоратам. Относительно мало растворимы К[ВF 4], Rb[ВF 4] и Сs[ВF 4]; соли почти всех остальных металлов хорошо растворимы в воде. • Фтороборат водорода НВF 4 в свободном состоянии не получен. Его водный раствор — очень сильная кислота, сильнее H 2 SO 4, HNO 3. • Получают ее растворением Н 3 ВО 3 в плавиковой кислоте: Н 3 ВО 3 + 4 HF = OH 3+ + BF 4 - + 2 Н 2 О 27
 • Тетрафтороборная кислота НВF 4 образуется наряду с ортоборной кислотой при гидролизе трифторида бора: BF 3 + 3 H 2 O = H 3 BO 3 + 3 HF + 3 BF 3 + 3 H 2 O = 3 OH 3+ + 3 BF 44 BF 3 + 6 H 2 O = 3 OH 3+ + 3 BF 4 - + H 3 BO 3 HBF 4 + Na. OH = Nа[ВF 4] + H 2 O Nа[ВF 4] компонент флюсов дл сварки и пайки металлов, смазочно-охлаждающих жидкостей, консервант древесины. 28
• Тетрафтороборная кислота НВF 4 образуется наряду с ортоборной кислотой при гидролизе трифторида бора: BF 3 + 3 H 2 O = H 3 BO 3 + 3 HF + 3 BF 3 + 3 H 2 O = 3 OH 3+ + 3 BF 44 BF 3 + 6 H 2 O = 3 OH 3+ + 3 BF 4 - + H 3 BO 3 HBF 4 + Na. OH = Nа[ВF 4] + H 2 O Nа[ВF 4] компонент флюсов дл сварки и пайки металлов, смазочно-охлаждающих жидкостей, консервант древесины. 28
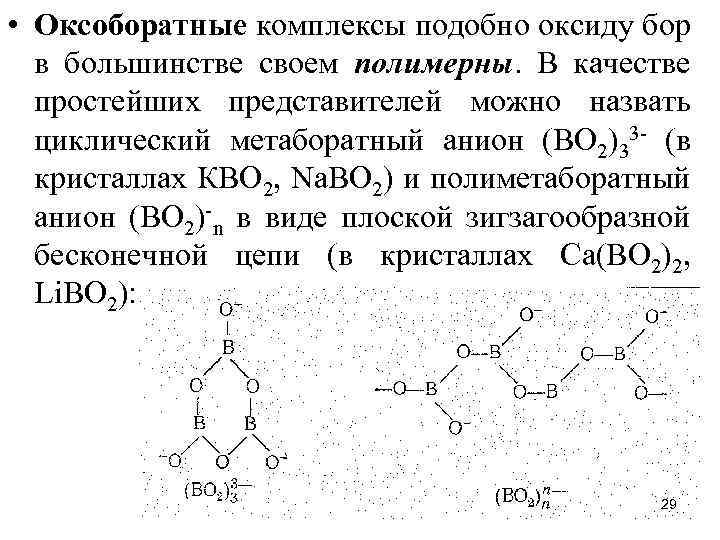 • Оксоборатные комплексы подобно оксиду бор в большинстве своем полимерны. В качестве простейших представителей можно назвать циклический метаборатный анион (ВО 2)33 - (в кристаллах КВО 2, Nа. ВО 2) и полиметаборатный анион (ВО 2)-n в виде плоской зигзагообразной бесконечной цепи (в кристаллах Са(ВО 2)2, Li. ВО 2): 29
• Оксоборатные комплексы подобно оксиду бор в большинстве своем полимерны. В качестве простейших представителей можно назвать циклический метаборатный анион (ВО 2)33 - (в кристаллах КВО 2, Nа. ВО 2) и полиметаборатный анион (ВО 2)-n в виде плоской зигзагообразной бесконечной цепи (в кристаллах Са(ВО 2)2, Li. ВО 2): 29
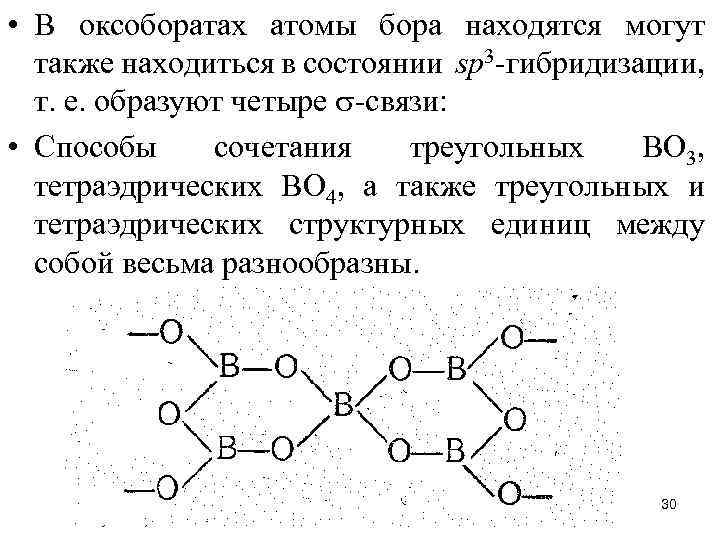 • В оксоборатах атомы бора находятся могут также находиться в состоянии sр3 -гибридизации, т. е. образуют четыре -связи: • Способы сочетания треугольных ВО 3, тетраэдрических ВО 4, а также треугольных и тетраэдрических структурных единиц между собой весьма разнообразны. 30
• В оксоборатах атомы бора находятся могут также находиться в состоянии sр3 -гибридизации, т. е. образуют четыре -связи: • Способы сочетания треугольных ВО 3, тетраэдрических ВО 4, а также треугольных и тетраэдрических структурных единиц между собой весьма разнообразны. 30
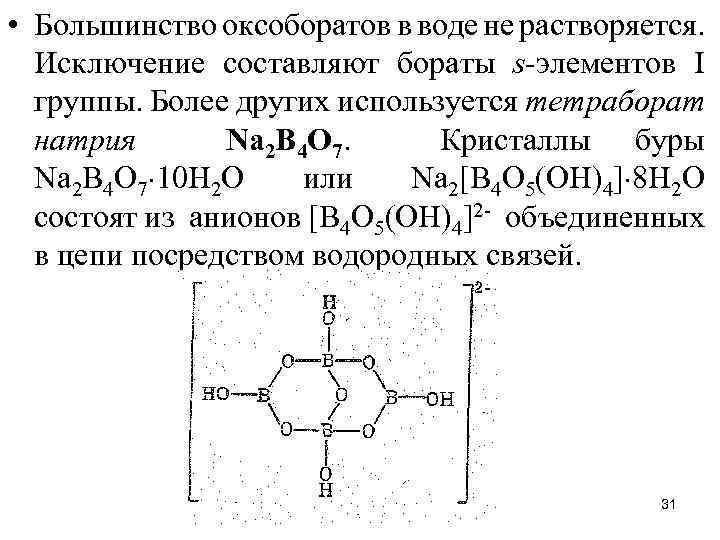 • Большинство оксоборатов в воде не растворяется. Исключение составляют бораты s-элементов I группы. Более других используется тетраборат натрия Nа 2 В 4 О 7. Кристаллы буры Nа 2 В 4 O 7 10 Н 2 O или Nа 2[В 4 O 5(ОН)4] 8 Н 2 O состоят из анионов [В 4 O 5(OH)4]2 - объединенных в цепи посредством водородных связей. 31
• Большинство оксоборатов в воде не растворяется. Исключение составляют бораты s-элементов I группы. Более других используется тетраборат натрия Nа 2 В 4 О 7. Кристаллы буры Nа 2 В 4 O 7 10 Н 2 O или Nа 2[В 4 O 5(ОН)4] 8 Н 2 O состоят из анионов [В 4 O 5(OH)4]2 - объединенных в цепи посредством водородных связей. 31
 • Оксобораты водорода — белые кристаллические вещества. Ортоборат водорода (в растворе ортоборная кислота) имеет слоистую решетку, в которой молекулы Н 3 ВО 3 связаны в плоские слои за счет водородных связей, а сами слои соединены друг с другом межмолекулярными силами. Поэтому в твердом состоянии Н 3 ВО 3 — чешуйки, жирные на ощупь. Ортоборная кислота — очень слабая, одноосновная. Не смотря на это, как и кремниевая к -та H 4 Si. O 4, в отличие от Al(OH)3, не проявляет амфотерных свойств. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединению ОН--ионов: B(OH)3 + HOH = [B(OH)4]- + H+, р. К = 32 9, 0
• Оксобораты водорода — белые кристаллические вещества. Ортоборат водорода (в растворе ортоборная кислота) имеет слоистую решетку, в которой молекулы Н 3 ВО 3 связаны в плоские слои за счет водородных связей, а сами слои соединены друг с другом межмолекулярными силами. Поэтому в твердом состоянии Н 3 ВО 3 — чешуйки, жирные на ощупь. Ортоборная кислота — очень слабая, одноосновная. Не смотря на это, как и кремниевая к -та H 4 Si. O 4, в отличие от Al(OH)3, не проявляет амфотерных свойств. В отличие от обычных кислот ее кислотные свойства обязаны не отщеплению протона, а присоединению ОН--ионов: B(OH)3 + HOH = [B(OH)4]- + H+, р. К = 32 9, 0
 • Полибораты водорода в растворе легко гидратируются, поэтому при действии на них кислот обычно выделяется ортоборная кислота, например: Nа 2 В 4 О 7 + Н 2 SO 4 = Nа 2 SО 4 + Н 2 В 4 О 7 Н 2 В 4 O 7 + 5 Н 2 O = 4 Н 3 ВO 3 • Наоборот, при нейтрализации Н 3 ВO 3 избытком щелочи (т. е. при выделении воды) характерные для бора связи В—О—В возникают снова и опять образуются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например: 4 Н 3 ВО 3 + 2 Nа. ОН + 3 Н 2 O = Nа 2 В 4 О 7 10 Н 2 O 33 H 3 BO 3 + Na. OH = Na. BO 2 + 2 H 2 O
• Полибораты водорода в растворе легко гидратируются, поэтому при действии на них кислот обычно выделяется ортоборная кислота, например: Nа 2 В 4 О 7 + Н 2 SO 4 = Nа 2 SО 4 + Н 2 В 4 О 7 Н 2 В 4 O 7 + 5 Н 2 O = 4 Н 3 ВO 3 • Наоборот, при нейтрализации Н 3 ВO 3 избытком щелочи (т. е. при выделении воды) характерные для бора связи В—О—В возникают снова и опять образуются полибораты, выделяющиеся из растворов в виде кристаллогидратов, например: 4 Н 3 ВО 3 + 2 Nа. ОН + 3 Н 2 O = Nа 2 В 4 О 7 10 Н 2 O 33 H 3 BO 3 + Na. OH = Na. BO 2 + 2 H 2 O
 • Безводные оксобораты получают сплавлением В 2 O 3 или Н 3 ВO 3 с оксидами металлов: Са. О + В 2 O 3 = Са(ВО 2)2 • Подобно силикатам (IV) и фосфатам (V) полибораты легко переходят в стеклообразное состояние. • Так, при прокаливании буры совместно с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты — стекла, часто окрашенные в характерные цвета, например: Nа. ВО 2 Сr(ВО 2)3 — зеленый, 2 Nа. ВО 2 Со(ВО 2)2 — синий: Nа 2 В 4 О 7 + Со. О = 2 Nа. ВО 2 Со(ВO 2)2 • На свойстве буры растворять оксиды металлов основано применение ее для образования эмалей, при пайке металлов, в аналитической практике для 34 открытия ряда d-элементов.
• Безводные оксобораты получают сплавлением В 2 O 3 или Н 3 ВO 3 с оксидами металлов: Са. О + В 2 O 3 = Са(ВО 2)2 • Подобно силикатам (IV) и фосфатам (V) полибораты легко переходят в стеклообразное состояние. • Так, при прокаливании буры совместно с солями некоторых металлов образуются двойные высокомолекулярные полиметабораты — стекла, часто окрашенные в характерные цвета, например: Nа. ВО 2 Сr(ВО 2)3 — зеленый, 2 Nа. ВО 2 Со(ВО 2)2 — синий: Nа 2 В 4 О 7 + Со. О = 2 Nа. ВО 2 Со(ВO 2)2 • На свойстве буры растворять оксиды металлов основано применение ее для образования эмалей, при пайке металлов, в аналитической практике для 34 открытия ряда d-элементов.
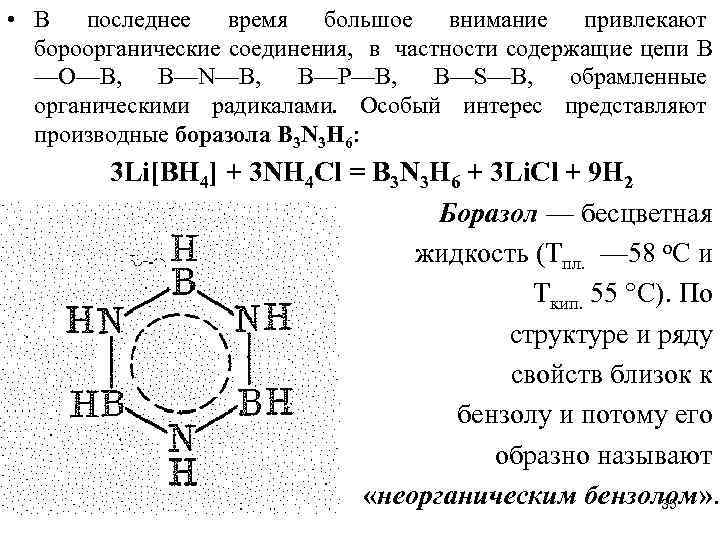 • В последнее время большое внимание привлекают бороорганические соединения, в частности содержащие цепи В —О—В, В—N—В, В—Р—В, В—S—В, обрамленные органическими радикалами. Особый интерес представляют производные боразола В 3 N 3 Н 6: 3 Li[BH 4] + 3 NH 4 Cl = B 3 N 3 H 6 + 3 Li. Cl + 9 H 2 Боразол — бесцветная жидкость (Tпл. — 58 о. С и Tкип. 55 °С). По структуре и ряду свойств близок к бензолу и потому его образно называют «неорганическим бензолом» . 35
• В последнее время большое внимание привлекают бороорганические соединения, в частности содержащие цепи В —О—В, В—N—В, В—Р—В, В—S—В, обрамленные органическими радикалами. Особый интерес представляют производные боразола В 3 N 3 Н 6: 3 Li[BH 4] + 3 NH 4 Cl = B 3 N 3 H 6 + 3 Li. Cl + 9 H 2 Боразол — бесцветная жидкость (Tпл. — 58 о. С и Tкип. 55 °С). По структуре и ряду свойств близок к бензолу и потому его образно называют «неорганическим бензолом» . 35
 Боразол (боразин) похож на бензол по растворяющей способности и даже запаху. Получены различные производные B 3 N 3 H 6. Межатомные расстояния С-С в бензоле и B-N в боразоле равны (140 и 139 пм соотв. ) Он отличается от бензола большей реакционной способностью вследствие полярности связей. Боразол окисляется на воздухе, растворим в воде (гидролизуется). Менее термически устойчив (Ткип. 55, бензола - 80, 1 о. С). B 3 N 3 H 6 + 9 H 2 O = 3 Н 3 ВО 3 + 3 NH 3 + 3 H 2 При нагревании с углеродом до ~2500 о. С бор образует карбид В 4 С. 7 С + 2 В 2 О 3 = 6 СО + В 4 С Карбид бора представляет собой черные блестящие кристаллы с полимерной структурой, обладающие очень высокой твердостью, термостойкостью (Тпл. 2350 о. С), химической устойчивостью к различным химическим воздействиям. 36
Боразол (боразин) похож на бензол по растворяющей способности и даже запаху. Получены различные производные B 3 N 3 H 6. Межатомные расстояния С-С в бензоле и B-N в боразоле равны (140 и 139 пм соотв. ) Он отличается от бензола большей реакционной способностью вследствие полярности связей. Боразол окисляется на воздухе, растворим в воде (гидролизуется). Менее термически устойчив (Ткип. 55, бензола - 80, 1 о. С). B 3 N 3 H 6 + 9 H 2 O = 3 Н 3 ВО 3 + 3 NH 3 + 3 H 2 При нагревании с углеродом до ~2500 о. С бор образует карбид В 4 С. 7 С + 2 В 2 О 3 = 6 СО + В 4 С Карбид бора представляет собой черные блестящие кристаллы с полимерной структурой, обладающие очень высокой твердостью, термостойкостью (Тпл. 2350 о. С), химической устойчивостью к различным химическим воздействиям. 36
 • В последнее время химия бора обогатилась новым классом соединений — так называемыми карборанами (бороуглеродоми). Один из представителей карборанов имеет состав В 10 С 2 Н 12 (барен). Это кристаллическое вещество (Тпл. 300 °С), его молекула имеет структуру икосаэдра, в котором атомы углерода аналогичны атомам бора и принимают участие в трехцентровых связях с ближайшими атомами бора. Барен растворим в органических растворителях. Бареновое ядро очень устойчиво по отношению к окислителям, щелочам. Атомы водорода, наоборот, легко замещаются. На основе карборанов получены многочисленные производные, в том числе карборановые полимеры. Многие из них обладают ценными физико-химическими и физико-механическими свойствами (высокая термическая стабильность, механическая прочность, высокие диэлектрические свойства и пр. ). Химия карборанов в настоящее время интенсивно изучается. 37
• В последнее время химия бора обогатилась новым классом соединений — так называемыми карборанами (бороуглеродоми). Один из представителей карборанов имеет состав В 10 С 2 Н 12 (барен). Это кристаллическое вещество (Тпл. 300 °С), его молекула имеет структуру икосаэдра, в котором атомы углерода аналогичны атомам бора и принимают участие в трехцентровых связях с ближайшими атомами бора. Барен растворим в органических растворителях. Бареновое ядро очень устойчиво по отношению к окислителям, щелочам. Атомы водорода, наоборот, легко замещаются. На основе карборанов получены многочисленные производные, в том числе карборановые полимеры. Многие из них обладают ценными физико-химическими и физико-механическими свойствами (высокая термическая стабильность, механическая прочность, высокие диэлектрические свойства и пр. ). Химия карборанов в настоящее время интенсивно изучается. 37
 Алюминий • Атом алюминия (1 s 22 р63 s 23 р1) больше по размеру, чем атом бора, и обладает меньшей энергией ионизации. Следовательно, неметаллические признаки химического элемента алюминия выражены в меньшей степени, чем химического элемента бора. Для алюминия, как и для бора, наиболее характерна степень окисления +3. Отрицательная поляризация атомов алюминия проявляется еще реже. ОЭО – 1, 47. 38
Алюминий • Атом алюминия (1 s 22 р63 s 23 р1) больше по размеру, чем атом бора, и обладает меньшей энергией ионизации. Следовательно, неметаллические признаки химического элемента алюминия выражены в меньшей степени, чем химического элемента бора. Для алюминия, как и для бора, наиболее характерна степень окисления +3. Отрицательная поляризация атомов алюминия проявляется еще реже. ОЭО – 1, 47. 38
 • Алюминий — типичный амфотерный элемент, в отличие от бора для него типичны не только анионные, но и катионные комплексы. • По распространенности на Земле (6, 6 мол. доли, %) алюминий занимает четвертое место (после О, Н, Si), состоит из одного стабильного изотопа 27 А 1. Основная масса алюминия сосредоточена в алюмосиликатах. Из других минералов наибольшее промышленное значение имеют боксит Аl 2 О 3 n. Н 2 О и криолит Nа 3 Аl. F 6. Распространенным продуктом разрушения горных пород является каолин, состоящий в основном из глинистого минерала каолинита Аl 4[Si 4 О 10](ОН)8 (Аl 2 О 3 Si. О 2 2 Н 2 О). 39
• Алюминий — типичный амфотерный элемент, в отличие от бора для него типичны не только анионные, но и катионные комплексы. • По распространенности на Земле (6, 6 мол. доли, %) алюминий занимает четвертое место (после О, Н, Si), состоит из одного стабильного изотопа 27 А 1. Основная масса алюминия сосредоточена в алюмосиликатах. Из других минералов наибольшее промышленное значение имеют боксит Аl 2 О 3 n. Н 2 О и криолит Nа 3 Аl. F 6. Распространенным продуктом разрушения горных пород является каолин, состоящий в основном из глинистого минерала каолинита Аl 4[Si 4 О 10](ОН)8 (Аl 2 О 3 Si. О 2 2 Н 2 О). 39
 • Простое вещество. В виде простого вещества алюминий — серебристо-белый металл (Tпл. 660 °С, Tкип. 2500 °С). Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью, исключительно пластичен. • Алюминий химически активен; даже в обычных условиях покрывается очень прочной тончайшей (0, 00001 мм) оксидной пленкой. Последняя несколько ослабляет металлический блеск алюминия и определяет его довольно высокую коррозионную стойкость. Так, алюминий горит в кислороде лишь при высокой температуре и притом в мелкораздробленном состоянии. Взаимодействие сопровождается большим выделением тепла ( Нof = -1650 к. Дж/моль) и получается Аl 2 О 3. 40
• Простое вещество. В виде простого вещества алюминий — серебристо-белый металл (Tпл. 660 °С, Tкип. 2500 °С). Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью, исключительно пластичен. • Алюминий химически активен; даже в обычных условиях покрывается очень прочной тончайшей (0, 00001 мм) оксидной пленкой. Последняя несколько ослабляет металлический блеск алюминия и определяет его довольно высокую коррозионную стойкость. Так, алюминий горит в кислороде лишь при высокой температуре и притом в мелкораздробленном состоянии. Взаимодействие сопровождается большим выделением тепла ( Нof = -1650 к. Дж/моль) и получается Аl 2 О 3. 40
 • Подобным же образом протекает взаимодействие алюминия с серой. С хлором и бромом он реагирует при обычной температуре, а с иодом при нагревании или в присутствии воды как катализатора. При сильном нагревании реагирует с азотом (800 °С) и углеродом (выше 1200 °С). С водородом непосредственно не взаимодействует. Al 2 S 3, Al. Г 3, Al. N, Al 4 C 3 … • Нитрид алюминия Al. N кислото-, щелочеустойчивое вещество (при комн. темп. ). Окисляется на воздухе выше 900 о. С. Применяется как огнеупорный материал, коррозионностойкое и износостойкое покрытие. 2 Al + NH 3 (t) = 2 Al. N + 3 H 2 • Вследствие высокого сродства к кислороду ( Go 298 = — 1582 к. Дж/моль Аl 2 O 3) алюминий активно восстанавливает многие металлы из оксидов (алюмотермия [1]). При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200 — 3000 о. С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов. [1] Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, применяется алюминий, то 41 процесс называется алюмотермией (могут применяться магний, кремний…).
• Подобным же образом протекает взаимодействие алюминия с серой. С хлором и бромом он реагирует при обычной температуре, а с иодом при нагревании или в присутствии воды как катализатора. При сильном нагревании реагирует с азотом (800 °С) и углеродом (выше 1200 °С). С водородом непосредственно не взаимодействует. Al 2 S 3, Al. Г 3, Al. N, Al 4 C 3 … • Нитрид алюминия Al. N кислото-, щелочеустойчивое вещество (при комн. темп. ). Окисляется на воздухе выше 900 о. С. Применяется как огнеупорный материал, коррозионностойкое и износостойкое покрытие. 2 Al + NH 3 (t) = 2 Al. N + 3 H 2 • Вследствие высокого сродства к кислороду ( Go 298 = — 1582 к. Дж/моль Аl 2 O 3) алюминий активно восстанавливает многие металлы из оксидов (алюмотермия [1]). При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200 — 3000 о. С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов. [1] Восстановление металла из его оксида с помощью другого металла называется металлотермией. Если, в частности, применяется алюминий, то 41 процесс называется алюмотермией (могут применяться магний, кремний…).
 • О высокой химической (восстановительной) активности алюминия свидетельствуют также значения его стандартного электродного потенциала в кислой и щелочной среде: • Будучи амфотерным, алюминий растворяется в растворах кислот и щелочей, образуя соответственно катионные и анионные комплексы: 2 Al + 6 OH 3+ + 6 H 2 O = 3 H 2 + 2[Al(OH 2)6]3+ 2 Al + 6 H 2 O + 6 OH- = 3 H 2 + 2[Al(OH)6]342
• О высокой химической (восстановительной) активности алюминия свидетельствуют также значения его стандартного электродного потенциала в кислой и щелочной среде: • Будучи амфотерным, алюминий растворяется в растворах кислот и щелочей, образуя соответственно катионные и анионные комплексы: 2 Al + 6 OH 3+ + 6 H 2 O = 3 H 2 + 2[Al(OH 2)6]3+ 2 Al + 6 H 2 O + 6 OH- = 3 H 2 + 2[Al(OH)6]342
 • Как в том, так и в другом случае окисление алюминия сопровождается выделением водорода. Если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то алюминий энергично взаимодействует с водой: 2 Al + 6 H 2 O = 2 Al(OН)3 + 3 Н 2 • Вследствие образования защитной пленки алюминий устойчив в очень разбавленной НNO 3 и концентрированных растворах НNO 3 и Н 2 SO 4 на холоду. Склонность к пассивированию позволяет повысить коррозионную стойкость алюминия обработкой его поверхности соответствующими окислителями (конц. НNO 3, К 2 Сr 2 O 7) или анодным окислением. При этом толщина защитной пленки возрастает. Устойчивость алюминия позволяет использовать его для изготовления емкостей для хранения и транспортировки азотной кислоты. • С растворами щелочей Al взаимодействует (растворяют Al 2 O 3): 2 Al + 6 Na. OH + 6 H 2 O = 2 Na 3[Al(OH)6] + 3 H 2 43
• Как в том, так и в другом случае окисление алюминия сопровождается выделением водорода. Если механическим путем или амальгамированием снять предохраняющее действие оксидной пленки, то алюминий энергично взаимодействует с водой: 2 Al + 6 H 2 O = 2 Al(OН)3 + 3 Н 2 • Вследствие образования защитной пленки алюминий устойчив в очень разбавленной НNO 3 и концентрированных растворах НNO 3 и Н 2 SO 4 на холоду. Склонность к пассивированию позволяет повысить коррозионную стойкость алюминия обработкой его поверхности соответствующими окислителями (конц. НNO 3, К 2 Сr 2 O 7) или анодным окислением. При этом толщина защитной пленки возрастает. Устойчивость алюминия позволяет использовать его для изготовления емкостей для хранения и транспортировки азотной кислоты. • С растворами щелочей Al взаимодействует (растворяют Al 2 O 3): 2 Al + 6 Na. OH + 6 H 2 O = 2 Na 3[Al(OH)6] + 3 H 2 43
 • По применению алюминий занимает одно из первых мест среди металлов, Из него изготовляется химическая аппаратура, электрические провода, конденсаторы и др. Алюминиевая фольга (толщиной 0, 005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов. Основная масса алюминия используется для получения легких сплавов — дюралюмина (94 % Аl, 4 % Сu, по 0, 5 % Mg, Мn, Fе и Si), силумина (85— 90 % Аl, 10— 14 % Si, 0, 1 % Nа) и др. Сплавы алюминия широко используются в автомобилестроении, судостроении, авиационной технике и пр. 44
• По применению алюминий занимает одно из первых мест среди металлов, Из него изготовляется химическая аппаратура, электрические провода, конденсаторы и др. Алюминиевая фольга (толщиной 0, 005 мм) применяется в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов. Основная масса алюминия используется для получения легких сплавов — дюралюмина (94 % Аl, 4 % Сu, по 0, 5 % Mg, Мn, Fе и Si), силумина (85— 90 % Аl, 10— 14 % Si, 0, 1 % Nа) и др. Сплавы алюминия широко используются в автомобилестроении, судостроении, авиационной технике и пр. 44
 • Алюминий применяется, кроме того, как легирующая добавка ко многим сплавам для придания им жаростойкости. Соединения алюминия с d-элементами — алюминиды и их сплавы используются в качестве жаропрочных (до 1200 °С) материалов (Ni. Аl, Ni 3 Аl, Со. Al, Тi 3 АI, Тi. Аl и др. ). • В промышленности алюминий получают электролизом раствора глинозема Al 2 О 3 в расплавленном криолите Nа 3 Аl. F 6. Концентрации Nа 3 Аl. F 6 (92— 94 %) и А 12 O 3 в смеси отвечают эвтектическому состоянию. Это позволяет вести процесс электролиза при сравнительно низкой температуре (800— 1000 °С). На корпусе электролизера, который служит катодом, выделяется жидкий алюминий. На угольном аноде выделяется кислород, который взаимодействует с углем. Поскольку расплав имеет сравнительно низкую плотность, алюминий погружается на дно электролизера. • Особо чистый Al получают нагревая его в парах Al. F 3, образующийся Al. F переносится не в виде пара, а соединения; в более холодом месте реакция протекает в обратном направлении: o 1050 C 2 Al (ж) + Al. F 3 (г) o 750 C 3 Al. F (г) 45
• Алюминий применяется, кроме того, как легирующая добавка ко многим сплавам для придания им жаростойкости. Соединения алюминия с d-элементами — алюминиды и их сплавы используются в качестве жаропрочных (до 1200 °С) материалов (Ni. Аl, Ni 3 Аl, Со. Al, Тi 3 АI, Тi. Аl и др. ). • В промышленности алюминий получают электролизом раствора глинозема Al 2 О 3 в расплавленном криолите Nа 3 Аl. F 6. Концентрации Nа 3 Аl. F 6 (92— 94 %) и А 12 O 3 в смеси отвечают эвтектическому состоянию. Это позволяет вести процесс электролиза при сравнительно низкой температуре (800— 1000 °С). На корпусе электролизера, который служит катодом, выделяется жидкий алюминий. На угольном аноде выделяется кислород, который взаимодействует с углем. Поскольку расплав имеет сравнительно низкую плотность, алюминий погружается на дно электролизера. • Особо чистый Al получают нагревая его в парах Al. F 3, образующийся Al. F переносится не в виде пара, а соединения; в более холодом месте реакция протекает в обратном направлении: o 1050 C 2 Al (ж) + Al. F 3 (г) o 750 C 3 Al. F (г) 45
 • Соединения алюминия (III). Бинарные соединения алюминия в обычных условиях полимерны в представляют собой твердые вещества белого цвета. • Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой кристаллической формой является -Аl 2 O 3 (ромбоэдрическая решетка). В его кристаллах проявляется октаэдро-тетраэдрическая координация атомов (к. ч. Al=6, к. ч. О=4). Эта модификация встречается в земной коре в виде минерала корунда, который часто содержит примеси, придающие ему окраску. Прозрачные окрашенные кристаллы корунда — рубин (красный — примесь Сr+3) и сапфир (синий — примесь Тi+4, Fе+2, Fе+3) — драгоценные камни. Их получают также в искусственно. • Кристаллические модификации Аl 2 О 3 химически очень стойки, не взаимодействуют с водой и кислотами. Щелочами разрушаются лишь при длительном нагревании. 46
• Соединения алюминия (III). Бинарные соединения алюминия в обычных условиях полимерны в представляют собой твердые вещества белого цвета. • Оксид алюминия известен в виде нескольких модификаций. Наиболее устойчивой кристаллической формой является -Аl 2 O 3 (ромбоэдрическая решетка). В его кристаллах проявляется октаэдро-тетраэдрическая координация атомов (к. ч. Al=6, к. ч. О=4). Эта модификация встречается в земной коре в виде минерала корунда, который часто содержит примеси, придающие ему окраску. Прозрачные окрашенные кристаллы корунда — рубин (красный — примесь Сr+3) и сапфир (синий — примесь Тi+4, Fе+2, Fе+3) — драгоценные камни. Их получают также в искусственно. • Кристаллические модификации Аl 2 О 3 химически очень стойки, не взаимодействуют с водой и кислотами. Щелочами разрушаются лишь при длительном нагревании. 46
 • Высокая прочность связи Аl—О—Al, плотная кристаллическая структура предопределяют большую энтальпию образования, высокую температуру плавления (порядка 2050 °С), твердость и огнеупорность - оксида алюминия. Так, корунд по твердости уступает лишь алмазу (а также карборунду и эльбору[1]) и применяется в качестве абразивного материала в виде корундовых кругов и наждака. В качестве абразивного и огнеупорного материала широко используется также искусственно получаемый из бокситов сильно прокаленный Аl 2 О 3, называемый алундом. Благодаря высокой твердости искусственно получаемые монокристаллы корунда (в частности, рубины) используют как опорные камни в точных механизмах. [1] Карборунд Si. C – кубическая (алмазоподобная) и тригональная модификации. Эльбор BN 47 кристаллическая решетка типа алмаза.
• Высокая прочность связи Аl—О—Al, плотная кристаллическая структура предопределяют большую энтальпию образования, высокую температуру плавления (порядка 2050 °С), твердость и огнеупорность - оксида алюминия. Так, корунд по твердости уступает лишь алмазу (а также карборунду и эльбору[1]) и применяется в качестве абразивного материала в виде корундовых кругов и наждака. В качестве абразивного и огнеупорного материала широко используется также искусственно получаемый из бокситов сильно прокаленный Аl 2 О 3, называемый алундом. Благодаря высокой твердости искусственно получаемые монокристаллы корунда (в частности, рубины) используют как опорные камни в точных механизмах. [1] Карборунд Si. C – кубическая (алмазоподобная) и тригональная модификации. Эльбор BN 47 кристаллическая решетка типа алмаза.
 • Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит) имеет слоистую кристаллическую решетку. Слои состоят из октаэдров Аl(ОН)6; между слоями действует водородная связь. Получаемый по обменной реакции гидроксид – студенистый белый осадок. Состав и структура осадка существенно зависят от условий получения и хранения. Обычно приводимое уравнение реакции получения гидроксида не раскрывает всей сложности механизма его образования. Аl 3+ + 3 ОН- = Аl(ОН)3 48
• Гидроксид алюминия Аl(ОН)3 — полимерное соединение. Так, природный гидроксид (минерал гидраргиллит) имеет слоистую кристаллическую решетку. Слои состоят из октаэдров Аl(ОН)6; между слоями действует водородная связь. Получаемый по обменной реакции гидроксид – студенистый белый осадок. Состав и структура осадка существенно зависят от условий получения и хранения. Обычно приводимое уравнение реакции получения гидроксида не раскрывает всей сложности механизма его образования. Аl 3+ + 3 ОН- = Аl(ОН)3 48
 • Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами ОН- постепенно замещаются в аквокомплексах [Аl(ОН 2)6]3+ молекулы воды: 49
• Получение гидроксида можно представить в виде следующей схемы. При действии щелочей ионами ОН- постепенно замещаются в аквокомплексах [Аl(ОН 2)6]3+ молекулы воды: 49
 • Одновременно происходит полимеризация с образованием многоядерных комплексов и в конечном итоге — выпадение осадка переменного состава А 12 О 3 n. Н 2 О. При стоянии осадок постепенно (с выделением воды) переходит в кристаллический Аl(ОН)3 и теряет свою активность — «стареет» . • Кристаллический Аl(ОН)3 получают при пропускании СО 2 в щелочной раствор алюмината. 50
• Одновременно происходит полимеризация с образованием многоядерных комплексов и в конечном итоге — выпадение осадка переменного состава А 12 О 3 n. Н 2 О. При стоянии осадок постепенно (с выделением воды) переходит в кристаллический Аl(ОН)3 и теряет свою активность — «стареет» . • Кристаллический Аl(ОН)3 получают при пропускании СО 2 в щелочной раствор алюмината. 50
 • При прокаливании А 12 О 3 n. Н 2 О постепенно теряет воду, превращаясь в конечном счете в А 12 О 3. Механизм дегидратации достаточно сложен, и получаемые промежуточные продукты в зависимости от исходного вещества и условий обезвоживания имеют различные свойства. Некоторые из них химически активны (преобладание ОН-мостиков) и легко растворяются в кислотах и щелочах, другие — химически неактивны (ОН-группы замещены на атомы О) и взаимодействуют лишь при сплавлении со щелочами. Одна из форм дегидратированного гидроксида — алюмогель используется в технике, как и силикагель, в 51 качестве адсорбента.
• При прокаливании А 12 О 3 n. Н 2 О постепенно теряет воду, превращаясь в конечном счете в А 12 О 3. Механизм дегидратации достаточно сложен, и получаемые промежуточные продукты в зависимости от исходного вещества и условий обезвоживания имеют различные свойства. Некоторые из них химически активны (преобладание ОН-мостиков) и легко растворяются в кислотах и щелочах, другие — химически неактивны (ОН-группы замещены на атомы О) и взаимодействуют лишь при сплавлении со щелочами. Одна из форм дегидратированного гидроксида — алюмогель используется в технике, как и силикагель, в 51 качестве адсорбента.
 • Гидроксид алюминия — типичное амфотерное соединение; свежеполученный продукт легко растворяется и в кислотах, и в щелочах. При этом разрушается высокомолекулярный гидроксид. В зависимости от среды образуются комплексные либо катионы, либо анионы: • 2 Al(OH)3 + 12 HF + 3 Na 2 CO 3=2 Na 3 Al. F 6 + 2 CO 2 + 9 H 2 O • Фтороалюминат натрия труднорастворим (исп. для получения Al, F 2, эмалей, стекла). 52
• Гидроксид алюминия — типичное амфотерное соединение; свежеполученный продукт легко растворяется и в кислотах, и в щелочах. При этом разрушается высокомолекулярный гидроксид. В зависимости от среды образуются комплексные либо катионы, либо анионы: • 2 Al(OH)3 + 12 HF + 3 Na 2 CO 3=2 Na 3 Al. F 6 + 2 CO 2 + 9 H 2 O • Фтороалюминат натрия труднорастворим (исп. для получения Al, F 2, эмалей, стекла). 52
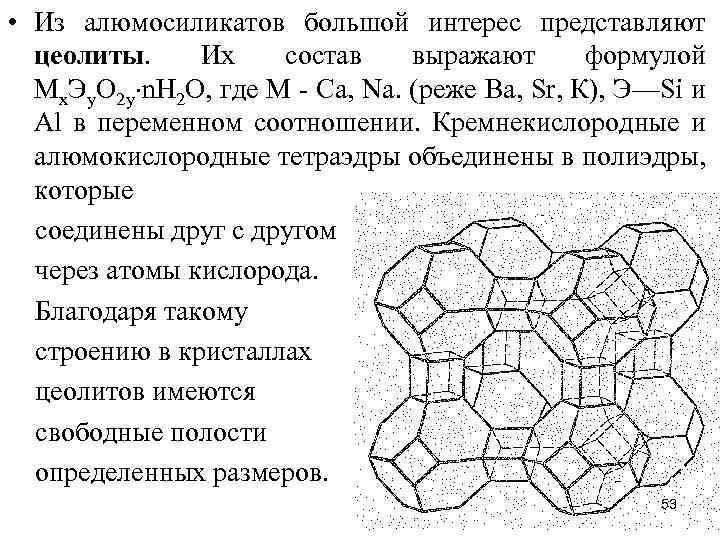 • Из алюмосиликатов большой интерес представляют цеолиты. Их состав выражают формулой Мx. Эy. О 2 y n. Н 2 О, где М - Са, Na. (реже Ва, Sr, К), Э—Si и Аl в переменном соотношении. Кремнекислородные и алюмокислородные тетраэдры объединены в полиэдры, которые соединены друг с другом через атомы кислорода. Благодаря такому строению в кристаллах цеолитов имеются свободные полости определенных размеров. 53
• Из алюмосиликатов большой интерес представляют цеолиты. Их состав выражают формулой Мx. Эy. О 2 y n. Н 2 О, где М - Са, Na. (реже Ва, Sr, К), Э—Si и Аl в переменном соотношении. Кремнекислородные и алюмокислородные тетраэдры объединены в полиэдры, которые соединены друг с другом через атомы кислорода. Благодаря такому строению в кристаллах цеолитов имеются свободные полости определенных размеров. 53
 • Ряд искусственных цеолитов используется в качестве так называемых молекулярных сит. Молекулярные сита поглощают вещества, молекулы которых могут войти в их полости (диаметром 0, 3— 1 , 3 нм), Например, одно из молекулярных сит (с диаметром отверстия 0, 35 им) может поглотить молекулы Н 2, О 2, N 2, но практически не поглощает более крупные молекулы типа СН 4 или атомы Аr. Молекулярные сита используются для разделения углеводородов, осушки газов и жидкостей. • В цеолитах одни катионы могут замещаться другими. На этом свойстве основано применение цеолитов в качестве ионообменников (катионитов). Цеолиты с внедренными в них ионами ряда d-элементов являются катализаторами. 54
• Ряд искусственных цеолитов используется в качестве так называемых молекулярных сит. Молекулярные сита поглощают вещества, молекулы которых могут войти в их полости (диаметром 0, 3— 1 , 3 нм), Например, одно из молекулярных сит (с диаметром отверстия 0, 35 им) может поглотить молекулы Н 2, О 2, N 2, но практически не поглощает более крупные молекулы типа СН 4 или атомы Аr. Молекулярные сита используются для разделения углеводородов, осушки газов и жидкостей. • В цеолитах одни катионы могут замещаться другими. На этом свойстве основано применение цеолитов в качестве ионообменников (катионитов). Цеолиты с внедренными в них ионами ряда d-элементов являются катализаторами. 54
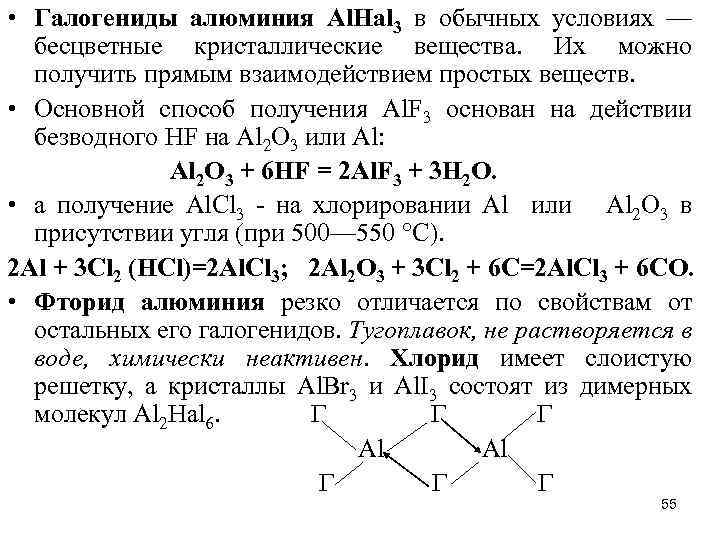 • Галогениды алюминия Аl. Наl 3 в обычных условиях — бесцветные кристаллические вещества. Их можно получить прямым взаимодействием простых веществ. • Основной способ получения Аl. F 3 основан на действии безводного HF на Аl 2 O 3 или Аl: Аl 2 O 3 + 6 НF = 2 Аl. F 3 + 3 H 2 O. • а получение Аl. Сl 3 - на хлорировании Al или Аl 2 O 3 в присутствии угля (при 500— 550 °С). 2 Al + 3 Cl 2 (HCl)=2 Al. Cl 3; 2 Al 2 O 3 + 3 Cl 2 + 6 C=2 Al. Cl 3 + 6 CO. • Фторид алюминия резко отличается по свойствам от остальных его галогенидов. Тугоплавок, не растворяется в воде, химически неактивен. Хлорид имеет слоистую решетку, а кристаллы Аl. Вr 3 и Аl. I 3 состоят из димерных молекул Аl 2 Наl 6. Г Г Г Al Al Г Г Г 55
• Галогениды алюминия Аl. Наl 3 в обычных условиях — бесцветные кристаллические вещества. Их можно получить прямым взаимодействием простых веществ. • Основной способ получения Аl. F 3 основан на действии безводного HF на Аl 2 O 3 или Аl: Аl 2 O 3 + 6 НF = 2 Аl. F 3 + 3 H 2 O. • а получение Аl. Сl 3 - на хлорировании Al или Аl 2 O 3 в присутствии угля (при 500— 550 °С). 2 Al + 3 Cl 2 (HCl)=2 Al. Cl 3; 2 Al 2 O 3 + 3 Cl 2 + 6 C=2 Al. Cl 3 + 6 CO. • Фторид алюминия резко отличается по свойствам от остальных его галогенидов. Тугоплавок, не растворяется в воде, химически неактивен. Хлорид имеет слоистую решетку, а кристаллы Аl. Вr 3 и Аl. I 3 состоят из димерных молекул Аl 2 Наl 6. Г Г Г Al Al Г Г Г 55
 • В отличие от типичных солей галогениды алюминия (кроме Аl. F 3) — весьма реакционноспособные вещества. Взаимодействие Аl. Наl 3 с водой сопровождается значительным выделением тепла. При этом они сильно гидролизуются, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый: Al. Cl 3 + 3 H 2 O = Al(OH)Cl 2 + HCl • Алюминий не вступает в реакцию с водородом, его получают косвенным путем в эфирном растворе Аl. Сl 3: Аl. Сl 3 +3 Li. H = Al. H 3 + 3 Li. Cl Гидрид алюминия Al. H 3 – белый. Это полимерное соединение (Al. H 3)n, в котором атомы Al связаны с атомами Н аналогично связям в бороводородах. Аl. Сl 3 +4 Li. H = Li[Al. H 4] + 3 Li. Cl Алюмогидрид лития Li[Al. H 4] – устойчивое солеподобное соединение. Сильный восстановитель: Li[Al. H 4] + Н 2 О = Li. OH + Al(OH)3 + 4 H 2 56
• В отличие от типичных солей галогениды алюминия (кроме Аl. F 3) — весьма реакционноспособные вещества. Взаимодействие Аl. Наl 3 с водой сопровождается значительным выделением тепла. При этом они сильно гидролизуются, но в отличие от типичных кислотных галогенидов неметаллов их гидролиз неполный и обратимый: Al. Cl 3 + 3 H 2 O = Al(OH)Cl 2 + HCl • Алюминий не вступает в реакцию с водородом, его получают косвенным путем в эфирном растворе Аl. Сl 3: Аl. Сl 3 +3 Li. H = Al. H 3 + 3 Li. Cl Гидрид алюминия Al. H 3 – белый. Это полимерное соединение (Al. H 3)n, в котором атомы Al связаны с атомами Н аналогично связям в бороводородах. Аl. Сl 3 +4 Li. H = Li[Al. H 4] + 3 Li. Cl Алюмогидрид лития Li[Al. H 4] – устойчивое солеподобное соединение. Сильный восстановитель: Li[Al. H 4] + Н 2 О = Li. OH + Al(OH)3 + 4 H 2 56


