 Т 5 Л 12 Кремний Si (1 s 22 р63 s 23 р23 d 0) по числу валентных электронов является аналогом углерода. Однако у кремния больший размер атома, меньшая энергия ионизации, большее сродство к электрону и большая поляризуемость атома. Поэтому кремний — элемент 3 го периода — по структуре и свойствам однотипных соединений существенно отличается от углерода — элемента 2 -го периода. Максимальное координационное число кремния равно шести, а наиболее характерное — четырем. Как и для других элементов 3 -го периода, р -р -связывание для кремния менее характерно и потому в отличие от углерода sр- и sр2 -состояния для него неустойчивы. Кремний в соединениях имеет степени окисления +4 и — 4. 1
Т 5 Л 12 Кремний Si (1 s 22 р63 s 23 р23 d 0) по числу валентных электронов является аналогом углерода. Однако у кремния больший размер атома, меньшая энергия ионизации, большее сродство к электрону и большая поляризуемость атома. Поэтому кремний — элемент 3 го периода — по структуре и свойствам однотипных соединений существенно отличается от углерода — элемента 2 -го периода. Максимальное координационное число кремния равно шести, а наиболее характерное — четырем. Как и для других элементов 3 -го периода, р -р -связывание для кремния менее характерно и потому в отличие от углерода sр- и sр2 -состояния для него неустойчивы. Кремний в соединениях имеет степени окисления +4 и — 4. 1
 • Согласно другой точке зрения различие свойств кремния и углерода объясняется наличием в атоме кремния вакантных 3 d-орбиталей. • Для кремния наиболее характерны связи Si–F и Si–О. Кремний на Земле находится в виде кислородных соединений. • Природный кремний состоит из трех стабильных изотопов: 28 Si (92, 27%), 29 Si (4, 68%) и 30 Si (3, 05%). По распространенности на Земле (20 мол, доли, %) кремний уступает только кислороду. Земная кора более чем наполовину состоит из кремнезема Si. O 2, силикатных и 2 алюмосиликатных пород.
• Согласно другой точке зрения различие свойств кремния и углерода объясняется наличием в атоме кремния вакантных 3 d-орбиталей. • Для кремния наиболее характерны связи Si–F и Si–О. Кремний на Земле находится в виде кислородных соединений. • Природный кремний состоит из трех стабильных изотопов: 28 Si (92, 27%), 29 Si (4, 68%) и 30 Si (3, 05%). По распространенности на Земле (20 мол, доли, %) кремний уступает только кислороду. Земная кора более чем наполовину состоит из кремнезема Si. O 2, силикатных и 2 алюмосиликатных пород.
 • Простое вещество. В соответствии с характерным типом гибридизации валентных орбиталей (sр3) у кремния наиболее устойчива «алмазоподобная» (кубическая) модификация. Как и алмаз, она тугоплавка (Тпл. 1412 °С) и отличается высокой твердостью. Вследствие частичной делокализации связи эта модификация имеет темно-серый цвет и металлический вид. При комнатной температуре кремний является полупроводником ( Е = 1, 12 э. В). Гексагональная ( «графитоподобная» ) модификация кремния неустойчива. 3
• Простое вещество. В соответствии с характерным типом гибридизации валентных орбиталей (sр3) у кремния наиболее устойчива «алмазоподобная» (кубическая) модификация. Как и алмаз, она тугоплавка (Тпл. 1412 °С) и отличается высокой твердостью. Вследствие частичной делокализации связи эта модификация имеет темно-серый цвет и металлический вид. При комнатной температуре кремний является полупроводником ( Е = 1, 12 э. В). Гексагональная ( «графитоподобная» ) модификация кремния неустойчива. 3
 • Химическая активность кремния зависит от состояния его поверхности. • Аморфный кремний значительно легче вступает в химическое взаимодействие. Исключительно реакционноспособен расплавленный кремний (Тпл. 1412 °С). • В обычных условиях – с простыми веществами (кроме фтора) взаимодействует лишь при нагревании, проявляя чаще всего восстановительные свойства. Так, он окисляется хлором выше 300 °С, кислородом - выше 400 о. С; серой – выше 600 °С, с азотом взаимодействует лишь при 1000 °С, а с углеродом при 2000 °С, образуя соответственно Si 3 N 4 и Si. С. Si + 2 F 2 = Si. F 4(г); Si + 2 Cl 2 = Si. Cl 4(ж) (Si. Br 4(ж), Si. I 4(тв)). Si + 2 S = Si. S 2(тв). 4
• Химическая активность кремния зависит от состояния его поверхности. • Аморфный кремний значительно легче вступает в химическое взаимодействие. Исключительно реакционноспособен расплавленный кремний (Тпл. 1412 °С). • В обычных условиях – с простыми веществами (кроме фтора) взаимодействует лишь при нагревании, проявляя чаще всего восстановительные свойства. Так, он окисляется хлором выше 300 °С, кислородом - выше 400 о. С; серой – выше 600 °С, с азотом взаимодействует лишь при 1000 °С, а с углеродом при 2000 °С, образуя соответственно Si 3 N 4 и Si. С. Si + 2 F 2 = Si. F 4(г); Si + 2 Cl 2 = Si. Cl 4(ж) (Si. Br 4(ж), Si. I 4(тв)). Si + 2 S = Si. S 2(тв). 4
 • Впервые кремний был получен металлотермическим восстановлением кремнезема: Si. O 2 + 2 Mg = Si + 2 Mg. O. Продукт восстановления представляет собой мягкий коричневый порошок (аморфный кремень). В кислородсодержащих кислотах окислителях кремний пассивируется и растворяется лишь в смеси плавиковой и азотной кислот : 3 Si 0 + 4 НN+5 О 3 + 18 НF = 3 Н 2 Si+4 F 6 + 4 N+2 О + 8 Н 2 O. • В этой реакции НNО 3 играет роль окислителя, а НF комплексообразующей среды. В результате реакции кремний переходит в устойчивую степень окислений +4; входит в состав устойчивого фторокомплекса Si. F 62 -. 5
• Впервые кремний был получен металлотермическим восстановлением кремнезема: Si. O 2 + 2 Mg = Si + 2 Mg. O. Продукт восстановления представляет собой мягкий коричневый порошок (аморфный кремень). В кислородсодержащих кислотах окислителях кремний пассивируется и растворяется лишь в смеси плавиковой и азотной кислот : 3 Si 0 + 4 НN+5 О 3 + 18 НF = 3 Н 2 Si+4 F 6 + 4 N+2 О + 8 Н 2 O. • В этой реакции НNО 3 играет роль окислителя, а НF комплексообразующей среды. В результате реакции кремний переходит в устойчивую степень окислений +4; входит в состав устойчивого фторокомплекса Si. F 62 -. 5
 • Кремний энергично растворяется в щелочах с выделением водорода: Si 0 + H 2+1 O + KOH = K 2 Si+4 O 3 + 2 H 20. • При этом роль окислителя выполняет вода, а комплексообразующей среды — ОН- -ионы. • С водой в обычных условиях кремний не реагирует, но при высоких температурах происходит процесс Si + 3 H 2 O(г) = H 2 Si. O 3 + 2 H 2 (г). 6
• Кремний энергично растворяется в щелочах с выделением водорода: Si 0 + H 2+1 O + KOH = K 2 Si+4 O 3 + 2 H 20. • При этом роль окислителя выполняет вода, а комплексообразующей среды — ОН- -ионы. • С водой в обычных условиях кремний не реагирует, но при высоких температурах происходит процесс Si + 3 H 2 O(г) = H 2 Si. O 3 + 2 H 2 (г). 6
 • Окислительная активность кремния проявляется лишь по отношению к некоторым металлам, например: 2 Mg + Si 0 = Mg 2 Si-4. • Кремний технической чистоты (95— 98 %) получают в электропечах восстановлением Si. О 2 с помощью кокса. Si. O 2 + 2 C = Si + 2 CO (t~1500 -1750 o. C) • В лаборатории в качестве восстановителя применяют магний. При этом образуется сильно загрязненный примесями коричневый порошок кремния. Последний перекристаллизацией из металлических расплавов (Zn, Аl и др. ) можно 7 перевести в кристаллическое состояние.
• Окислительная активность кремния проявляется лишь по отношению к некоторым металлам, например: 2 Mg + Si 0 = Mg 2 Si-4. • Кремний технической чистоты (95— 98 %) получают в электропечах восстановлением Si. О 2 с помощью кокса. Si. O 2 + 2 C = Si + 2 CO (t~1500 -1750 o. C) • В лаборатории в качестве восстановителя применяют магний. При этом образуется сильно загрязненный примесями коричневый порошок кремния. Последний перекристаллизацией из металлических расплавов (Zn, Аl и др. ) можно 7 перевести в кристаллическое состояние.
 • Необходимый для полупроводниковой техники кремний особой чистоты получают восстановлением Si. Сl 4 цинком или водородом при высокой температуре: Si. Cl 4 + 2 Zn = Si + 2 Zn. Cl 2; Si. Cl 4 + 2 Н 2 = Si + 4 НCl, Si. НCl 3 + Н 2 = Si + 3 НCl. • А также термическим разложением его летучих (водородных) соединений или Si. I 4: Si. H 4 = Si + 2 H 2; Si. I 4 = Si + 2 I 2; • Дополнительно очищают кремний зонной плавкой. Путь от первого порошкообразного кремния до особо чистого монокристалла с ничтожной концентрацией дефектов – это революция в гомоатомных соединениях кремния, стимулированная развитием техники (что в свою очередь стимулирует развитие техники). 8
• Необходимый для полупроводниковой техники кремний особой чистоты получают восстановлением Si. Сl 4 цинком или водородом при высокой температуре: Si. Cl 4 + 2 Zn = Si + 2 Zn. Cl 2; Si. Cl 4 + 2 Н 2 = Si + 4 НCl, Si. НCl 3 + Н 2 = Si + 3 НCl. • А также термическим разложением его летучих (водородных) соединений или Si. I 4: Si. H 4 = Si + 2 H 2; Si. I 4 = Si + 2 I 2; • Дополнительно очищают кремний зонной плавкой. Путь от первого порошкообразного кремния до особо чистого монокристалла с ничтожной концентрацией дефектов – это революция в гомоатомных соединениях кремния, стимулированная развитием техники (что в свою очередь стимулирует развитие техники). 8
 • Монокристаллы кремния с соответствующими добавками служат для изготовления различных полупроводниковых устройств (выпрямителей переменного тока, фотоэлементов и пр. ). Из кремниевых фотоэлементов (преобразователи световой энергии в электрическую), в частности, построены солнечные батареи, обеспечивающие питание радиоаппаратуры на космических аппаратах. • Кроме полупроводниковой техники кремний широко применяется в металлургии для «раскисления» сталей и придания им повышенной коррозионной стойкости. Для этих целей используется сплав кремния с железом (ферросилиций), получаемый при совместном восстановлении коксом железной руды и кремнезема. Ферросилиций очень устойчив к действию кислот и потому используется для изготовления кислотоупорных 9 изделий.
• Монокристаллы кремния с соответствующими добавками служат для изготовления различных полупроводниковых устройств (выпрямителей переменного тока, фотоэлементов и пр. ). Из кремниевых фотоэлементов (преобразователи световой энергии в электрическую), в частности, построены солнечные батареи, обеспечивающие питание радиоаппаратуры на космических аппаратах. • Кроме полупроводниковой техники кремний широко применяется в металлургии для «раскисления» сталей и придания им повышенной коррозионной стойкости. Для этих целей используется сплав кремния с железом (ферросилиций), получаемый при совместном восстановлении коксом железной руды и кремнезема. Ферросилиций очень устойчив к действию кислот и потому используется для изготовления кислотоупорных 9 изделий.
 • Соединения с отрицательной степенью окисления кремния. При окислении металлов кремнием (700— 1200 °С) или при нагревании смеси соответствующих оксидов и кремния в инертной атмосфере образуются силициды (но в большинстве случаев валентные соотношения остаются неясными): 2 Mn + Si = Mn 2 Si; 6 Mn. O + 5 Si = 2 Mn 3 Si + 3 Si. O 2. • Силициды применяют для получения жаростойких и кислотоупорных сплавов и в качестве высокотемпературных полупроводниковых материалов. Из дисилицида молибдена Мо. Si 2, выдерживающего нагрев до 1600— 1700 °С в агрессивной атмосфере, изготовляют нагреватели электропечей. Ряд силицидов f -элементов применяется в атомной энергетике в 10 качестве поглотителя нейтронов и т. д.
• Соединения с отрицательной степенью окисления кремния. При окислении металлов кремнием (700— 1200 °С) или при нагревании смеси соответствующих оксидов и кремния в инертной атмосфере образуются силициды (но в большинстве случаев валентные соотношения остаются неясными): 2 Mn + Si = Mn 2 Si; 6 Mn. O + 5 Si = 2 Mn 3 Si + 3 Si. O 2. • Силициды применяют для получения жаростойких и кислотоупорных сплавов и в качестве высокотемпературных полупроводниковых материалов. Из дисилицида молибдена Мо. Si 2, выдерживающего нагрев до 1600— 1700 °С в агрессивной атмосфере, изготовляют нагреватели электропечей. Ряд силицидов f -элементов применяется в атомной энергетике в 10 качестве поглотителя нейтронов и т. д.
 • В зависимости от элемента, для элементов менее электроотрицательных, чем кремний, тип связи в силицидах изменяется от ионно-ковалентного до металлического. • Силициды s и d-элементов I и II групп, Ca 2 Si, Ca. Si 2 – полупроводники. В химическом отношении силициды этого типа неустойчивы. Они более-менее легко разлагаются водой и особенно кислотами. Mg 2 Si + 2 H 2 SO 4 = Si. H 4 + 2 Mg. SO 4 (в воде); • Силициды d и f-элементов обычно имеют сложный состав (Mo 3 Si, Mo 5 Si 3, Mo. Si 2), часто не отвечающий целочисленным степеням окисления элементов. В зависимости от преимущественного проявления того или иного типа связи среди силицидов встречаются как металлические соединения, так и полупроводники. Силициды с высоким содержанием кремния весьма кислотоупорны и стойки против окисления при нагревании. 11
• В зависимости от элемента, для элементов менее электроотрицательных, чем кремний, тип связи в силицидах изменяется от ионно-ковалентного до металлического. • Силициды s и d-элементов I и II групп, Ca 2 Si, Ca. Si 2 – полупроводники. В химическом отношении силициды этого типа неустойчивы. Они более-менее легко разлагаются водой и особенно кислотами. Mg 2 Si + 2 H 2 SO 4 = Si. H 4 + 2 Mg. SO 4 (в воде); • Силициды d и f-элементов обычно имеют сложный состав (Mo 3 Si, Mo 5 Si 3, Mo. Si 2), часто не отвечающий целочисленным степеням окисления элементов. В зависимости от преимущественного проявления того или иного типа связи среди силицидов встречаются как металлические соединения, так и полупроводники. Силициды с высоким содержанием кремния весьма кислотоупорны и стойки против окисления при нагревании. 11
 • Соединения кремния (IV). Кремний находится в степени окисления +4 в соединениях с галогенами, кислородом и серой, азотом, углеродом, водородом. Некоторые его бинарные соединения: Si. Наl 4, Si. O 2, Si. S 2, Si 3 N 4, Si. С, Si. Н 4. Поскольку устойчивое координационное число кремния 4, мономерными являются лишь Si. Наl 4 и Si. Н 4, остальные соединения полимерны. Структурной единицей подавляющего большинства соединений Si (IV) являются тетраэдры из более электроотрицательных атомов (Si. O 4, Si. S 4, Si. N 4, Si. С 4) с атомом Si в центре. 12
• Соединения кремния (IV). Кремний находится в степени окисления +4 в соединениях с галогенами, кислородом и серой, азотом, углеродом, водородом. Некоторые его бинарные соединения: Si. Наl 4, Si. O 2, Si. S 2, Si 3 N 4, Si. С, Si. Н 4. Поскольку устойчивое координационное число кремния 4, мономерными являются лишь Si. Наl 4 и Si. Н 4, остальные соединения полимерны. Структурной единицей подавляющего большинства соединений Si (IV) являются тетраэдры из более электроотрицательных атомов (Si. O 4, Si. S 4, Si. N 4, Si. С 4) с атомом Si в центре. 12
 • В плоскостном изображении показаны структуры Si. Наl 4 и Si. S 2 • Полимерные соединения с координационной решеткой (Si. O 2, Si. С) характеризуются высокой температурой плавления и химической устойчивостью. Мономерные соединения, наоборот, легкоплавки, химически активны. Промежуточное положение занимают соединения с цепной структурой (Si. S 2). 13
• В плоскостном изображении показаны структуры Si. Наl 4 и Si. S 2 • Полимерные соединения с координационной решеткой (Si. O 2, Si. С) характеризуются высокой температурой плавления и химической устойчивостью. Мономерные соединения, наоборот, легкоплавки, химически активны. Промежуточное положение занимают соединения с цепной структурой (Si. S 2). 13
 • Отвечающие бинарным соединениям анионные комплексы кремния (IV) Si. O 32 -, Si. S 32 -, Si. N 22 - в отличие от таковых углерода (IV) в подавляющем большинстве также полимерны. • Таким образом, имея одинаковое число валентных электронов, углерод и кремний образуют соединения одинакового состава. Однако по строению, а следовательно, и по химической активности однотипные соединения углерода и кремния существенно отличаются. 14
• Отвечающие бинарным соединениям анионные комплексы кремния (IV) Si. O 32 -, Si. S 32 -, Si. N 22 - в отличие от таковых углерода (IV) в подавляющем большинстве также полимерны. • Таким образом, имея одинаковое число валентных электронов, углерод и кремний образуют соединения одинакового состава. Однако по строению, а следовательно, и по химической активности однотипные соединения углерода и кремния существенно отличаются. 14
 • По химической природе бинарные соединения Si (IV) являются кислотными. Так, большинство из них взаимодействует со щелочами (в растворах и особенно при сплавлении): Si. O 2 + Ca(OH)2 = Ca. Si. O 3 + H 2 O (сплавление); Si. H 4 -1 + 2 KOH+1 + H 2+1 O = K 2 Si. O 3 + 2 H 20. • и с другими основными соединениями: Ca. S + Si. S 2 = Ca. Si. S 3. 15
• По химической природе бинарные соединения Si (IV) являются кислотными. Так, большинство из них взаимодействует со щелочами (в растворах и особенно при сплавлении): Si. O 2 + Ca(OH)2 = Ca. Si. O 3 + H 2 O (сплавление); Si. H 4 -1 + 2 KOH+1 + H 2+1 O = K 2 Si. O 3 + 2 H 20. • и с другими основными соединениями: Ca. S + Si. S 2 = Ca. Si. S 3. 15
 • При гидролизе они образуют кислоты: Si. Cl 4 + 3 H 2 O = H 2 Si. O 3 + 4 HCl Si. S 2 + 3 H 2 O = H 2 Si. O 3 + 2 H 2 S • Галогениды Si. Наl 4 можно получить непосредственным взаимодействием простых веществ. Тетрафторид получают действием концентрированной серной кислоты на смесь Si. O 2 + Са. F 2: • Si. O 2 + Ca. F 2 + H 2 SO 4 = Si. F 4 + 2 H 2 O. Ca. F 2 + H 2 SO 4 = Ca. SO 4 + HF Si. O 2 + HF = Si. F 4 + 2 H 2 O. (H 2[Si. F 6]) • а тетрахлорид - при нагревании смеси Si. O 2 и углерода в атмосфере хлора: Si. O 2(г) + 2 C(тв) + 2 Cl 2(г) = Si. Cl 4(г) + 2 CO(г). 16
• При гидролизе они образуют кислоты: Si. Cl 4 + 3 H 2 O = H 2 Si. O 3 + 4 HCl Si. S 2 + 3 H 2 O = H 2 Si. O 3 + 2 H 2 S • Галогениды Si. Наl 4 можно получить непосредственным взаимодействием простых веществ. Тетрафторид получают действием концентрированной серной кислоты на смесь Si. O 2 + Са. F 2: • Si. O 2 + Ca. F 2 + H 2 SO 4 = Si. F 4 + 2 H 2 O. Ca. F 2 + H 2 SO 4 = Ca. SO 4 + HF Si. O 2 + HF = Si. F 4 + 2 H 2 O. (H 2[Si. F 6]) • а тетрахлорид - при нагревании смеси Si. O 2 и углерода в атмосфере хлора: Si. O 2(г) + 2 C(тв) + 2 Cl 2(г) = Si. Cl 4(г) + 2 CO(г). 16
 • Значительные количества Si. F 4 получаются как побочный продукт суперфосфатного производства. • В обычных условиях Si. F 4 — газ, Si. Сl 4 и Si. Вr 4 — жидкости, Si. I 4 — твердое вещество. Все они бесцветны. • В противоположность тетрагалогенидам углерода тетрагалогениды кремния гидролизуются очень легко. Гидролиз протекает по ассоциативному механизму за счет последовательного присоединения молекул воды и отщепления молекул ННаl, вплоть до образования Si(ОН)4. • Молекулы Н 4 Si. O 4 далее полимеризуются с образованием продукта условного состава Н 2 Si. O 3. Вследствие гидролиза тетрагалогениды кремния во 17 влажном воздухе дымят.
• Значительные количества Si. F 4 получаются как побочный продукт суперфосфатного производства. • В обычных условиях Si. F 4 — газ, Si. Сl 4 и Si. Вr 4 — жидкости, Si. I 4 — твердое вещество. Все они бесцветны. • В противоположность тетрагалогенидам углерода тетрагалогениды кремния гидролизуются очень легко. Гидролиз протекает по ассоциативному механизму за счет последовательного присоединения молекул воды и отщепления молекул ННаl, вплоть до образования Si(ОН)4. • Молекулы Н 4 Si. O 4 далее полимеризуются с образованием продукта условного состава Н 2 Si. O 3. Вследствие гидролиза тетрагалогениды кремния во 17 влажном воздухе дымят.
 • Так, гидролиз Si. Сl 4 Si. Cl 4 (ж) + 3 H 2 O (ж) = H 2 Si. O 3 (тв) + 4 HCl (ж), Go 298 = -238, 3 к. Дж/моль. можно представить следующей схемой: 18
• Так, гидролиз Si. Сl 4 Si. Cl 4 (ж) + 3 H 2 O (ж) = H 2 Si. O 3 (тв) + 4 HCl (ж), Go 298 = -238, 3 к. Дж/моль. можно представить следующей схемой: 18
 • Повышение координационного числа кремния (IV) с 4 до 5 в промежуточном соединении можно объяснить возникновением трехцентровой связи. Так, в Si. Сl 4 Н 2 O три атома хлора связаны с атомом кремния посредством двухцентровых связей, а один атом хлора и молекула воды посредством трехцентровой связи. • В отличие от других галогенидов Si (IV) кислотная природа Si. F 4 проявляется не только при гидролизе, но и при взаимодействии с основными фторидами, например: 2 KF + Si. F 4 = K 2 Si. F 6. 19
• Повышение координационного числа кремния (IV) с 4 до 5 в промежуточном соединении можно объяснить возникновением трехцентровой связи. Так, в Si. Сl 4 Н 2 O три атома хлора связаны с атомом кремния посредством двухцентровых связей, а один атом хлора и молекула воды посредством трехцентровой связи. • В отличие от других галогенидов Si (IV) кислотная природа Si. F 4 проявляется не только при гидролизе, но и при взаимодействии с основными фторидами, например: 2 KF + Si. F 4 = K 2 Si. F 6. 19
 • Вследствие устойчивости, гексафторосиликатиона Si. F 62 гидролиз Si. F 4 выражается уравнениями: Si. F 4 + 3 H 2 O = H 2 Si. O 3 + 4 HF, 4 HF + 2 Si. F 4 = 2 H 2 Si. F 6 3 Si. F 4 + 3 H 2 O = H 2 Si. O 3 + 2 H 2 Si. F 6. Гексафторосиликат водорода Н 2 Si. F 6 в свободном состоянии не выделен. В водном растворе Н 2 Si. F 6 — сильная (типа Н 2 SО 4) гексафторокремневая кислота. 20
• Вследствие устойчивости, гексафторосиликатиона Si. F 62 гидролиз Si. F 4 выражается уравнениями: Si. F 4 + 3 H 2 O = H 2 Si. O 3 + 4 HF, 4 HF + 2 Si. F 4 = 2 H 2 Si. F 6 3 Si. F 4 + 3 H 2 O = H 2 Si. O 3 + 2 H 2 Si. F 6. Гексафторосиликат водорода Н 2 Si. F 6 в свободном состоянии не выделен. В водном растворе Н 2 Si. F 6 — сильная (типа Н 2 SО 4) гексафторокремневая кислота. 20
 • Фторосиликаты металлов получают действием плавиковой кислоты на смесь кремнезема и соответствующего фторида: M+2 F 2 + Si. O 2 + 4 HF = M+2 Si. F 6 + 2 H 2 O • Большинство фторосиликатов растворимо в воде. Малорастворимы производные щелочных металлов (кроме лития) и бария. Наибольшее значение имеет Nа 2 Si. F 6. Применяют его для фторирования воды, как инсектицид, в производстве кислотоупорных цементов, эмалей и пр. • Тетрафторид кремния и все фторосиликаты 21 ядовиты.
• Фторосиликаты металлов получают действием плавиковой кислоты на смесь кремнезема и соответствующего фторида: M+2 F 2 + Si. O 2 + 4 HF = M+2 Si. F 6 + 2 H 2 O • Большинство фторосиликатов растворимо в воде. Малорастворимы производные щелочных металлов (кроме лития) и бария. Наибольшее значение имеет Nа 2 Si. F 6. Применяют его для фторирования воды, как инсектицид, в производстве кислотоупорных цементов, эмалей и пр. • Тетрафторид кремния и все фторосиликаты 21 ядовиты.
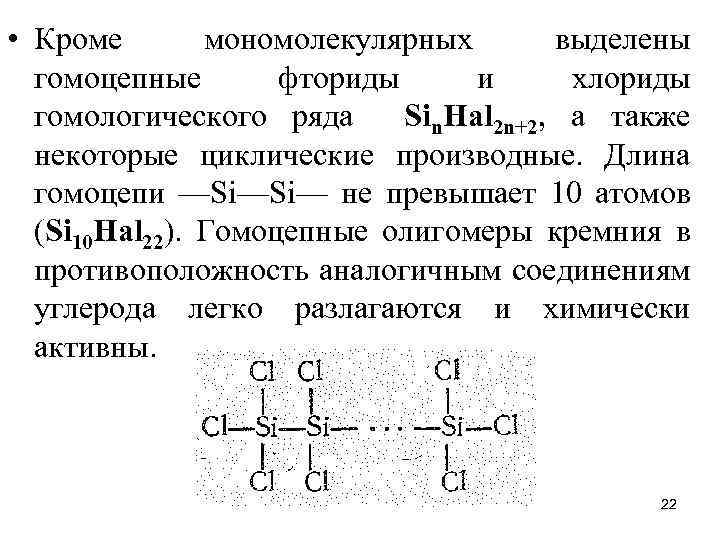 • Кроме мономолекулярных выделены гомоцепные фториды и хлориды гомологического ряда Sin. Наl 2 n+2, а также некоторые циклические производные. Длина гомоцепи —Si—Si— не превышает 10 атомов (Si 10 Нal 22). Гомоцепные олигомеры кремния в противоположность аналогичным соединениям углерода легко разлагаются и химически активны. 22
• Кроме мономолекулярных выделены гомоцепные фториды и хлориды гомологического ряда Sin. Наl 2 n+2, а также некоторые циклические производные. Длина гомоцепи —Si—Si— не превышает 10 атомов (Si 10 Нal 22). Гомоцепные олигомеры кремния в противоположность аналогичным соединениям углерода легко разлагаются и химически активны. 22
 • Гомоцепи —Si—Si— обнаруживаются в гидридах кремния (силанах) гомологического ряда Sin. Н 2 n+2. • По составу (Si. Н 4, Si 2 Н 6, Si 3 Н 8, Si 4 Н 10 до Si 6 Н 14) и физическим свойствам силаны сходны с соответствующими углеводородами. В обычных условиях моносилан Si. Н 4 и дисилан Si 2 Н 6 газообразны, трисилан Si 3 Н 8 — жидкость, высшие представители гомологического ряда — твердые вещества. 23
• Гомоцепи —Si—Si— обнаруживаются в гидридах кремния (силанах) гомологического ряда Sin. Н 2 n+2. • По составу (Si. Н 4, Si 2 Н 6, Si 3 Н 8, Si 4 Н 10 до Si 6 Н 14) и физическим свойствам силаны сходны с соответствующими углеводородами. В обычных условиях моносилан Si. Н 4 и дисилан Si 2 Н 6 газообразны, трисилан Si 3 Н 8 — жидкость, высшие представители гомологического ряда — твердые вещества. 23
 • Поскольку связи Si—Н и Si—Si слабее связей С —Н и С—С, кремневодороды несравненно менее устойчивы и более реакционноспособны, чем соответствующие углеводороды. Большинство из них на воздухе самовоспламеняется. Сгорают силаны с большим выделением тепла, например: Si. H 4 + 2 O 2=Si. O 2 + 2 H 2 O, Ho 298 = -1288 к. Дж/моль. С галогенами силаны взаимодействуют со взрывом. Si. H 4 + 4 Cl 2=Si. Cl 4 + 4 HCl. Силаны — кислотные гидриды, о чем свидетельствует характер их взаимодействия со щелочами. При этом разложение силанов происходит активно даже в присутствии следов щелочи. В кислой среде кремневодороды довольно устойчивы. Si. H 4 + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 4 H 2 Si. H 4 + 3 Н 2 О = H 2 Si. O 3 (Si. O 2 x. H 2 O) + 4 H 2 24
• Поскольку связи Si—Н и Si—Si слабее связей С —Н и С—С, кремневодороды несравненно менее устойчивы и более реакционноспособны, чем соответствующие углеводороды. Большинство из них на воздухе самовоспламеняется. Сгорают силаны с большим выделением тепла, например: Si. H 4 + 2 O 2=Si. O 2 + 2 H 2 O, Ho 298 = -1288 к. Дж/моль. С галогенами силаны взаимодействуют со взрывом. Si. H 4 + 4 Cl 2=Si. Cl 4 + 4 HCl. Силаны — кислотные гидриды, о чем свидетельствует характер их взаимодействия со щелочами. При этом разложение силанов происходит активно даже в присутствии следов щелочи. В кислой среде кремневодороды довольно устойчивы. Si. H 4 + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 4 H 2 Si. H 4 + 3 Н 2 О = H 2 Si. O 3 (Si. O 2 x. H 2 O) + 4 H 2 24
 • С водородом кремний непосредственно не взаимодействует. Силаны получают косвенным путем, например действием кислот на некоторые силициды: Mg 2 Si + 2 H 2 SO 4 = Si. H 4 + 2 Mg. SO 4 (в воде); Mg 2 Si + 4 NH 4 Br = Si. H 4 + 2 Mg. Br 2 + 4 H 3 N (в жидком аммиаке). • В последнем случае роль кислоты играет NН 4 Вr. Разложение силицидов кислотами в жидком аммиаке приводит к большему выходу продуктов, чем при разложении в водной среде. • Поскольку связи типа р — р для кремния не характерны, гидриды с двойными и тройными связями между атомами кремния — аналоги этилена, ацетилена и бензола неизвестны. 25
• С водородом кремний непосредственно не взаимодействует. Силаны получают косвенным путем, например действием кислот на некоторые силициды: Mg 2 Si + 2 H 2 SO 4 = Si. H 4 + 2 Mg. SO 4 (в воде); Mg 2 Si + 4 NH 4 Br = Si. H 4 + 2 Mg. Br 2 + 4 H 3 N (в жидком аммиаке). • В последнем случае роль кислоты играет NН 4 Вr. Разложение силицидов кислотами в жидком аммиаке приводит к большему выходу продуктов, чем при разложении в водной среде. • Поскольку связи типа р — р для кремния не характерны, гидриды с двойными и тройными связями между атомами кремния — аналоги этилена, ацетилена и бензола неизвестны. 25
 • Диоксид кремния Si. O 2 (кремнезем, кремний) имеет несколько модификаций. В природе он встречается главным образом виде минерала кварца (гексагональная структура), а также кристобалита (кубическая структура) и тридимита (гексагональная структура). Модификации Si. O 2 отличаются характером расположения кремнекислородных тетраэдров Si. O 4 в пространстве. Кремнезем тугоплавок (Тпл. 1713 °С, Ткип. 2590 °С), очень тверд и химически стоек. На него действует лишь фтор, плавиковая кислота и газообразный НF, а также растворы щелочей и фосфорная кислота. В воде в обычных условиях Si. О 2 не растворяется, но начиная со 150 °С его растворимость возрастает, достигая 0, 25 % при 500 °С. Si. O 2 + 2 F 2 = Si. F 4 + O 2; Si. O 2 + 4 HF = Si. F 4 + H 2 O Si. O 2 + 2 Na. OH (раствор) = Na 2 Si. O 3 + H 2 O. Обычно реакцию получения силикатов проводят путем спекания со щелочами, карбонатами и оксидами металлов: 26 Si. O 2 + Na 2 СO 3 = Na 2 Si. O 3 + СO 2, Si. O 2 + Pb. O = Pb. Si. O 3.
• Диоксид кремния Si. O 2 (кремнезем, кремний) имеет несколько модификаций. В природе он встречается главным образом виде минерала кварца (гексагональная структура), а также кристобалита (кубическая структура) и тридимита (гексагональная структура). Модификации Si. O 2 отличаются характером расположения кремнекислородных тетраэдров Si. O 4 в пространстве. Кремнезем тугоплавок (Тпл. 1713 °С, Ткип. 2590 °С), очень тверд и химически стоек. На него действует лишь фтор, плавиковая кислота и газообразный НF, а также растворы щелочей и фосфорная кислота. В воде в обычных условиях Si. О 2 не растворяется, но начиная со 150 °С его растворимость возрастает, достигая 0, 25 % при 500 °С. Si. O 2 + 2 F 2 = Si. F 4 + O 2; Si. O 2 + 4 HF = Si. F 4 + H 2 O Si. O 2 + 2 Na. OH (раствор) = Na 2 Si. O 3 + H 2 O. Обычно реакцию получения силикатов проводят путем спекания со щелочами, карбонатами и оксидами металлов: 26 Si. O 2 + Na 2 СO 3 = Na 2 Si. O 3 + СO 2, Si. O 2 + Pb. O = Pb. Si. O 3.
 • Кремнезем легко переходит в стеклообразное состояние. В отличие от кристаллических модификаций Si. О 2 в кварцевом стекле тетраэдрические структурные единицы Si. O 4 расположены неупорядоченно. Кварцевое стекло химически и термически весьма стойко. Его применяют для изготовления химической аппаратуры и в оптических приборах. • Аморфный кремнезем является также основой ряда минералов: халцедона, опала, агата и др. Кварцевый песок в огромных количествах используется в производстве стекла, цемента, фарфора и пр. 27
• Кремнезем легко переходит в стеклообразное состояние. В отличие от кристаллических модификаций Si. О 2 в кварцевом стекле тетраэдрические структурные единицы Si. O 4 расположены неупорядоченно. Кварцевое стекло химически и термически весьма стойко. Его применяют для изготовления химической аппаратуры и в оптических приборах. • Аморфный кремнезем является также основой ряда минералов: халцедона, опала, агата и др. Кварцевый песок в огромных количествах используется в производстве стекла, цемента, фарфора и пр. 27
 • При сверхвысоком давлении и нагревании (~1, 2 I 010 Па; ~1300 °С) была получена особая модификация Si. О 2, названная стишовитом. Его плотность на 60% выше плотности кварца. Это объясняется тем, что стишовит имеет в нем координационное число 6. Благодаря плотной структуре стишовит еще менее активен, чем кварц. Он устойчив даже к концентрированному раствору плавиковой кислоты. • Существует также монооксид кремния – Si. O. Монооксид в природе не встречается. Его можно получить восстановлением Si. О 2 при 1350 -1500 о. С: Si. О 2 + С = Si. O + CO. 2 Si. O = Si + Si. O 2. Быстрым охлаждением (закалкой) паров Si. О получают его в твердом состоянии (порошок темно-желтого цвета). При медленном охлаждении Si. O диспропорционирует. Прекрасный изолятор. Si. O медленно окисляется кислородом воздуха, легко растворяется в щелочах. 28 Si. O + 2 Na. OH = Na 2 Si. O 3 + H 2.
• При сверхвысоком давлении и нагревании (~1, 2 I 010 Па; ~1300 °С) была получена особая модификация Si. О 2, названная стишовитом. Его плотность на 60% выше плотности кварца. Это объясняется тем, что стишовит имеет в нем координационное число 6. Благодаря плотной структуре стишовит еще менее активен, чем кварц. Он устойчив даже к концентрированному раствору плавиковой кислоты. • Существует также монооксид кремния – Si. O. Монооксид в природе не встречается. Его можно получить восстановлением Si. О 2 при 1350 -1500 о. С: Si. О 2 + С = Si. O + CO. 2 Si. O = Si + Si. O 2. Быстрым охлаждением (закалкой) паров Si. О получают его в твердом состоянии (порошок темно-желтого цвета). При медленном охлаждении Si. O диспропорционирует. Прекрасный изолятор. Si. O медленно окисляется кислородом воздуха, легко растворяется в щелочах. 28 Si. O + 2 Na. OH = Na 2 Si. O 3 + H 2.
 • Структурной единицей оксосиликатов, как и Si. О 2, является тетраэдрическая группировка атомов Si. О 4. Два соседних кремнекислородных тетраэдра Si. О 4 соединены друг с другом только через один атом кислорода. Если в кристаллах Si. О 2 (координационная решетка) каждый Si. О 4 –тетраэдр дает на образование связей Si—О— Si четыре вершины, то в оксосиликатах могут давать три, две или одну вершину: 29
• Структурной единицей оксосиликатов, как и Si. О 2, является тетраэдрическая группировка атомов Si. О 4. Два соседних кремнекислородных тетраэдра Si. О 4 соединены друг с другом только через один атом кислорода. Если в кристаллах Si. О 2 (координационная решетка) каждый Si. О 4 –тетраэдр дает на образование связей Si—О— Si четыре вершины, то в оксосиликатах могут давать три, две или одну вершину: 29
 • Этим объясняется большое разнообразие возможных способов сочетаний друг с другом Si. О 4–тетраэдров, структур и типов оксосиликатов. Так, в системе Са. О—Si. О 2 возможны следующие соединения: Са 2 Si. О 4, Са 3 Si 2 О 7, Са. Si. О 3. • При нагревании эквимолярной смеси Са. О + Si. O 2 при 1000 — 1200 °С вначале образуется Са 2 Si. О 4, затем Са 3 Si 2 О 7 и, наконец, Са. Si. O 3. 30
• Этим объясняется большое разнообразие возможных способов сочетаний друг с другом Si. О 4–тетраэдров, структур и типов оксосиликатов. Так, в системе Са. О—Si. О 2 возможны следующие соединения: Са 2 Si. О 4, Са 3 Si 2 О 7, Са. Si. О 3. • При нагревании эквимолярной смеси Са. О + Si. O 2 при 1000 — 1200 °С вначале образуется Са 2 Si. О 4, затем Са 3 Si 2 О 7 и, наконец, Са. Si. O 3. 30
 • Тетраэдры Si. О 4, как и РО 4, могут объединяться попарно (Si 2 О 76 -), в замкнутые кольца из трех (Si 3 O 96 -), четырех (Si 4 О 128 -), шести (Si 6 О 1812 -) тетраэдров. • Эти относительно простые структурные единицы в свою очередь могут объединяться в полимерные цепочки, ленты, сетки. • Цепи, ленты и слои связаны между собой расположенными между ними катионами. В зависимости от типа оксосиликатных анионов силикаты имеют волокнистую (асбест), слоистую (слюда) структуру. • Кроме силикатов в природе широко распространены алюмосиликаты, в образовании которых наряду с тетраэдрами Si. O 4 принимают участие тетраэдры Аl. O 4. 31
• Тетраэдры Si. О 4, как и РО 4, могут объединяться попарно (Si 2 О 76 -), в замкнутые кольца из трех (Si 3 O 96 -), четырех (Si 4 О 128 -), шести (Si 6 О 1812 -) тетраэдров. • Эти относительно простые структурные единицы в свою очередь могут объединяться в полимерные цепочки, ленты, сетки. • Цепи, ленты и слои связаны между собой расположенными между ними катионами. В зависимости от типа оксосиликатных анионов силикаты имеют волокнистую (асбест), слоистую (слюда) структуру. • Кроме силикатов в природе широко распространены алюмосиликаты, в образовании которых наряду с тетраэдрами Si. O 4 принимают участие тетраэдры Аl. O 4. 31
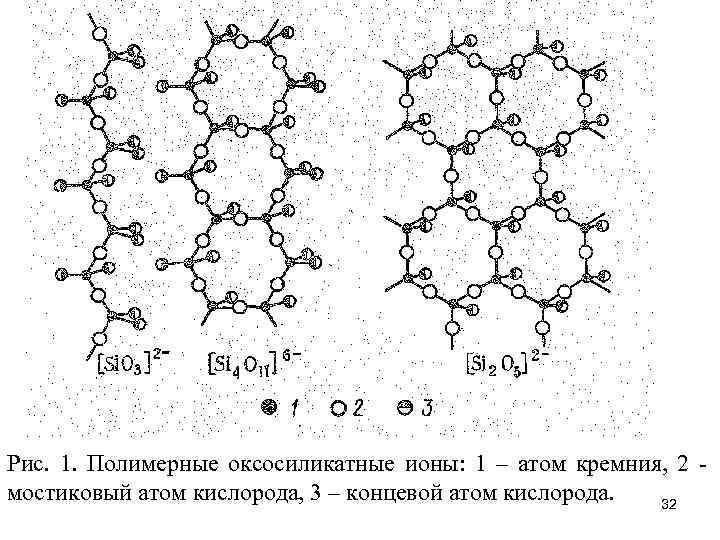 Рис. 1. Полимерные оксосиликатные ионы: 1 – атом кремния, 2 мостиковый атом кислорода, 3 – концевой атом кислорода. 32
Рис. 1. Полимерные оксосиликатные ионы: 1 – атом кремния, 2 мостиковый атом кислорода, 3 – концевой атом кислорода. 32
 • Большинство оксосиликатов нерастворимо в воде. Исключение составляют силикаты sэлементов I группы. Силикаты натрия и калия получают кипячением Si. О 2 в растворе щелочи. При этом образуется смесь оксосиликатов, которой приписывается общая формула Nа 2 Si. O 3 или К 2 Si. О 3. • Концентрированный раствор силиката натрия, называемый жидким (или растворимым) стеклом, применяется в производстве негорючих тканей, для пропитки древесины, в качестве клея и т. д. 33
• Большинство оксосиликатов нерастворимо в воде. Исключение составляют силикаты sэлементов I группы. Силикаты натрия и калия получают кипячением Si. О 2 в растворе щелочи. При этом образуется смесь оксосиликатов, которой приписывается общая формула Nа 2 Si. O 3 или К 2 Si. О 3. • Концентрированный раствор силиката натрия, называемый жидким (или растворимым) стеклом, применяется в производстве негорючих тканей, для пропитки древесины, в качестве клея и т. д. 33
 • Для оксосиликатов, как и для Si. O 2, очень характерно стеклообразное состояние. Обычное стекло получают сплавлением смеси соды (или Nа 2 SО 4), известняка и кварцевого песка. При этом образуется стекло приблизительного состава Nа 2 О Са. О 6 Si. O 2, состоящее из больших полимерных анионов; оно нерастворимо, химически неактивно. Обыкновенное стекло в той или иной степени окрашено в зеленый цвет содержащимися в нем силикатами железа. Na 2 CO 3+ Ca. CO 3 + 6 Si. O 2=Na 2 O Ca. O 6 Si. O 2 + 2 CO 2 Вместо соды можно использовать смесь сульфата натрия и угля: Na 2 SO 4 + C + 6 Si. O 2 = Na 2 O Ca. O 6 Si. O 2 + 34 SO 2 + CO 2 + CO.
• Для оксосиликатов, как и для Si. O 2, очень характерно стеклообразное состояние. Обычное стекло получают сплавлением смеси соды (или Nа 2 SО 4), известняка и кварцевого песка. При этом образуется стекло приблизительного состава Nа 2 О Са. О 6 Si. O 2, состоящее из больших полимерных анионов; оно нерастворимо, химически неактивно. Обыкновенное стекло в той или иной степени окрашено в зеленый цвет содержащимися в нем силикатами железа. Na 2 CO 3+ Ca. CO 3 + 6 Si. O 2=Na 2 O Ca. O 6 Si. O 2 + 2 CO 2 Вместо соды можно использовать смесь сульфата натрия и угля: Na 2 SO 4 + C + 6 Si. O 2 = Na 2 O Ca. O 6 Si. O 2 + 34 SO 2 + CO 2 + CO.
 • Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр. ) вводятся соответствующие добавки, изменяющие состав и структуру стекол, Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натриевого стекла, поэтому оно используется для изготовления специальных лабораторных приборов. Замена кальция на свинец, а натрия на калий придает стеклу повышенный показатель преломления, большую плотность. Из свинцового стекла (хрусталя) изготовляют вазы, фужеры и пр. добавление к стеклу соединений кобальта придает им синюю окраску, Сr 2 О 3 — изумрудно-зеленую, соединений марганца фиолетовую окраску и т. д. Существенно изменяются свойства стекол, содержащих 35 В 2 О 3.
• Для придания стеклу тех или иных физико-химических свойств (прозрачности, химической, термической и механической прочности и пр. ) вводятся соответствующие добавки, изменяющие состав и структуру стекол, Так, у стекла, содержащего вместо натрия калий (калиевое стекло), температура размягчения выше, чем у обычного натриевого стекла, поэтому оно используется для изготовления специальных лабораторных приборов. Замена кальция на свинец, а натрия на калий придает стеклу повышенный показатель преломления, большую плотность. Из свинцового стекла (хрусталя) изготовляют вазы, фужеры и пр. добавление к стеклу соединений кобальта придает им синюю окраску, Сr 2 О 3 — изумрудно-зеленую, соединений марганца фиолетовую окраску и т. д. Существенно изменяются свойства стекол, содержащих 35 В 2 О 3.
 • Стекло химически очень стойко, но хрупко, что препятствует широкому применению его для изготовления труб и аппаратуры химический производств. • В последнее время прочность стекол повышают, придавая им мелкокристаллическую структуру. В результате управляемой кристаллизации расплавленных стекол удается получить очень мелкокристаллические однородные материалы — ситаллы (стеклокристаллы), прочность которых иногда более чем в 5 раз превышает прочность исходных стекол и приближается к прочности чугуна. 36
• Стекло химически очень стойко, но хрупко, что препятствует широкому применению его для изготовления труб и аппаратуры химический производств. • В последнее время прочность стекол повышают, придавая им мелкокристаллическую структуру. В результате управляемой кристаллизации расплавленных стекол удается получить очень мелкокристаллические однородные материалы — ситаллы (стеклокристаллы), прочность которых иногда более чем в 5 раз превышает прочность исходных стекол и приближается к прочности чугуна. 36
 • Поскольку Si. O 2 с водой практически не взаимодействует, кремневые кислоты могут быть получены только косвенным путем: действием кислот на растворы оксосиликатов или гидролизом некоторых соединений Si+4 (галогенидов, сульфида, эфиров ортокремневой кислоты и др. ). При гидролизе, например, Si. S 2 вначале получается ортокремневая кислота Н 4 Si. О 4 (К 1 = 2 10 -10, К 2 = 2 10 -12): Si. S 2 + 4 H 2 O = H 4 Si. O 4 + 2 H 2 S. Поскольку кремниевые кислоты слабые, все растворимые в воде силикаты сильно гидролизованы: Na 2 Si. O 3 + 2 H 2 O = 2 Na. OH + H 2 Si. O 3. 37
• Поскольку Si. O 2 с водой практически не взаимодействует, кремневые кислоты могут быть получены только косвенным путем: действием кислот на растворы оксосиликатов или гидролизом некоторых соединений Si+4 (галогенидов, сульфида, эфиров ортокремневой кислоты и др. ). При гидролизе, например, Si. S 2 вначале получается ортокремневая кислота Н 4 Si. О 4 (К 1 = 2 10 -10, К 2 = 2 10 -12): Si. S 2 + 4 H 2 O = H 4 Si. O 4 + 2 H 2 S. Поскольку кремниевые кислоты слабые, все растворимые в воде силикаты сильно гидролизованы: Na 2 Si. O 3 + 2 H 2 O = 2 Na. OH + H 2 Si. O 3. 37
 • Oртокремневая кислота Н 4 Si. О 4 растворима в воде, но при стоянии более или менее быстро полимеризуется: • Подобным же образом могут взаимодействовать срединные группы ОH, образуя разветвленные и трехмерные макромолекулы. 38
• Oртокремневая кислота Н 4 Si. О 4 растворима в воде, но при стоянии более или менее быстро полимеризуется: • Подобным же образом могут взаимодействовать срединные группы ОH, образуя разветвленные и трехмерные макромолекулы. 38
 • Переход ортокремневой кислоты в поликислоты сопровождается превращением молекулярного раствора Н 4 Si. О 4 в коллоидные растворы — золи. Золи в свою очередь либо застудневают целиком, т. е. превращаются в гель, либо выпадают в виде объемистых осадков, включающих большое количество воды. Состав получаемых кремневых кислот сильно зависит от исходных веществ и условий проведения реакций. • Нагревая осадки поликремневых кислот, постепенно их обезвоживая, можно получить тонкодисперсный Si. O 2 — силикагель, который применяется в качестве адсорбента. 39
• Переход ортокремневой кислоты в поликислоты сопровождается превращением молекулярного раствора Н 4 Si. О 4 в коллоидные растворы — золи. Золи в свою очередь либо застудневают целиком, т. е. превращаются в гель, либо выпадают в виде объемистых осадков, включающих большое количество воды. Состав получаемых кремневых кислот сильно зависит от исходных веществ и условий проведения реакций. • Нагревая осадки поликремневых кислот, постепенно их обезвоживая, можно получить тонкодисперсный Si. O 2 — силикагель, который применяется в качестве адсорбента. 39
 • Карбид кремния Si. С (карборунд), подобно углероду и кремнию, существует в виде кубической (алмазоподобной) и гексагональной модификаций. • В чистом виде алмазоподобный Si. С — диэлектрик, но с примесями становится полупроводником ( Е 1, 5— 3, 5 э. В) с n- или р-проводимостью. Он тугоплавок (Тпл. 2830 °С), по твердости близок к алмазу, химически весьма стоек. Разрушается лишь при нагревании в смеси НF + НNО 3 и при сплавлении со щелочами в присутствии окислителя, например: Si. C-4 + 2 KOH + 2 O 20 = K 2 Si. O 3 + C+4 O 2. Si. C + 2 Cl 2 = Si. Cl 4 + C (~600 o. C). Si. C + 2 H 2 O = Si. O 2 + CH 4 (~1300 o. C). 40
• Карбид кремния Si. С (карборунд), подобно углероду и кремнию, существует в виде кубической (алмазоподобной) и гексагональной модификаций. • В чистом виде алмазоподобный Si. С — диэлектрик, но с примесями становится полупроводником ( Е 1, 5— 3, 5 э. В) с n- или р-проводимостью. Он тугоплавок (Тпл. 2830 °С), по твердости близок к алмазу, химически весьма стоек. Разрушается лишь при нагревании в смеси НF + НNО 3 и при сплавлении со щелочами в присутствии окислителя, например: Si. C-4 + 2 KOH + 2 O 20 = K 2 Si. O 3 + C+4 O 2. Si. C + 2 Cl 2 = Si. Cl 4 + C (~600 o. C). Si. C + 2 H 2 O = Si. O 2 + CH 4 (~1300 o. C). 40
 • Карбид кремния получают в дуговых электропечах (при 2000— 2200 °С) из смеси кварцевого песка и кокса. Si. С широко применяется как абразивный и огнеупорный материал, его кристаллы используются в радиотехнике. 3 C + Si. O 2 = Si. C + 2 CO (~2300 o. C). Большой химической стойкостью и жаропрочностью обладает также нитрид кремния Si 3 N 4 (получают из простых веществ при Т 1300 o. C). Это твердый тугоплавкий белый порошок (Твозг. ~1900 °С). Он очень устойчив к химическим воздействиям НF, растворов щелочей, металлов. Кристаллы Si 3 N 4 бесцветны, проявляют полупроводниковые свойства ( Е = 3, 9 э. В). Нитрид кремния используют в качестве химически стойкого и огнеупорного материала, в создании коррозионностойких и тугоплавких сплавов, в качестве высокотемпературного полупроводника. Si 3 N 4 + 12 Na. OH = 3 Na 4 Si. O 4 + 4 NH 3↑ (в расплаве) 41 Si 3 N 4 + 16 HF (горячий конц. р-р) = 2(NH 4)2 Si. F 6 + Si. F 4
• Карбид кремния получают в дуговых электропечах (при 2000— 2200 °С) из смеси кварцевого песка и кокса. Si. С широко применяется как абразивный и огнеупорный материал, его кристаллы используются в радиотехнике. 3 C + Si. O 2 = Si. C + 2 CO (~2300 o. C). Большой химической стойкостью и жаропрочностью обладает также нитрид кремния Si 3 N 4 (получают из простых веществ при Т 1300 o. C). Это твердый тугоплавкий белый порошок (Твозг. ~1900 °С). Он очень устойчив к химическим воздействиям НF, растворов щелочей, металлов. Кристаллы Si 3 N 4 бесцветны, проявляют полупроводниковые свойства ( Е = 3, 9 э. В). Нитрид кремния используют в качестве химически стойкого и огнеупорного материала, в создании коррозионностойких и тугоплавких сплавов, в качестве высокотемпературного полупроводника. Si 3 N 4 + 12 Na. OH = 3 Na 4 Si. O 4 + 4 NH 3↑ (в расплаве) 41 Si 3 N 4 + 16 HF (горячий конц. р-р) = 2(NH 4)2 Si. F 6 + Si. F 4
 • Кроме неорганических соединений кремния большое значение имеют кремнийорганические соединения. Кремнийорганические соединения — представители более широкого класса так называемых элементоорганических соединений. Полимерные элементоорганические соединения сочетают термическую стойкость, присущую неорганическим материалам, с рядом свойств полимерных органических веществ. 42
• Кроме неорганических соединений кремния большое значение имеют кремнийорганические соединения. Кремнийорганические соединения — представители более широкого класса так называемых элементоорганических соединений. Полимерные элементоорганические соединения сочетают термическую стойкость, присущую неорганическим материалам, с рядом свойств полимерных органических веществ. 42
 Реакции с простыми веществами C, Si, Ge, Sn, Pb 43
Реакции с простыми веществами C, Si, Ge, Sn, Pb 43
 44
44


