L_11_T_5__Uglerod.ppt
- Количество слайдов: 54
 Т 5 Л 11 р-ЭЛЕМЕНТЫ IV ГРУППЫ ПЕРИОДИЧЕСКОИ СИСТЕМЫ К р-элементам IV группы относятся углерод С, кремний Si, германий Gе, олово Sn и свинец Рb. Углерод существенно отличается от других рэлементов группы высоким значением энергии ионизации. Углерод типичный неметаллический элемент. В ряду С — Si — Gе — Sn — Рb энергия ионизации уменьшается, а следовательно, неметаллические признаки элементов ослабевают, металлические 1 усиливаются.
Т 5 Л 11 р-ЭЛЕМЕНТЫ IV ГРУППЫ ПЕРИОДИЧЕСКОИ СИСТЕМЫ К р-элементам IV группы относятся углерод С, кремний Si, германий Gе, олово Sn и свинец Рb. Углерод существенно отличается от других рэлементов группы высоким значением энергии ионизации. Углерод типичный неметаллический элемент. В ряду С — Si — Gе — Sn — Рb энергия ионизации уменьшается, а следовательно, неметаллические признаки элементов ослабевают, металлические 1 усиливаются.
 Углерод 1 s 22 p 2 • В зависимости от числа -связей координационное число углерода равно 4 (sр3 гибридизация), 3 (sр2 -гибридизация) или 2 (sргибридизация валентных орбиталей). В большинстве соединений углерод четырехвалентен, ему приписывают степени окисления -4, +2. • В атоме углерода в отличие от всех других элементов число валентных электронов равно числу валентных орбиталей. Это одна из основных причин большой устойчивости связи С—С и исключительной склонности 2 углерода к образованию гомоцепей.
Углерод 1 s 22 p 2 • В зависимости от числа -связей координационное число углерода равно 4 (sр3 гибридизация), 3 (sр2 -гибридизация) или 2 (sргибридизация валентных орбиталей). В большинстве соединений углерод четырехвалентен, ему приписывают степени окисления -4, +2. • В атоме углерода в отличие от всех других элементов число валентных электронов равно числу валентных орбиталей. Это одна из основных причин большой устойчивости связи С—С и исключительной склонности 2 углерода к образованию гомоцепей.
 • Наблюдается резкое уменьшение энергии связей от углерода к фтору: • что объясняют отталкиванием несвязывающих электронных пар атомов азота и др. Гомоцепные молекулы, содержащие связь С—С, бывают самых разнообразных типов: линейные, разветвленные, сшитые, циклические. Эти многочисленные соединения углерода изучаются в органической химии. 3
• Наблюдается резкое уменьшение энергии связей от углерода к фтору: • что объясняют отталкиванием несвязывающих электронных пар атомов азота и др. Гомоцепные молекулы, содержащие связь С—С, бывают самых разнообразных типов: линейные, разветвленные, сшитые, циклические. Эти многочисленные соединения углерода изучаются в органической химии. 3
 • В природе углерод находится в виде двух стабильных изотопов: 12 С (98, 892 %) и 13 С (1, 108 %). Под действием космических лучей в земной атмосфере образуется некоторое количество -радиоактивного изотопа 14 С: 147 N + 10 n = 146 C + 11 H • По содержанию 14 С в растительных остатках судят об их возрасте. Получены также радиоактивные изотопы с массовыми числами от 10 до 16. В земной коре углерод находится в составе карбонатных минералов (прежде всего Са. СО 3 и Мg. СО 3), каменного угля, нефти, а также в виде графита и реже алмаза. Углерод главная составная часть животного и растительного мира. 4
• В природе углерод находится в виде двух стабильных изотопов: 12 С (98, 892 %) и 13 С (1, 108 %). Под действием космических лучей в земной атмосфере образуется некоторое количество -радиоактивного изотопа 14 С: 147 N + 10 n = 146 C + 11 H • По содержанию 14 С в растительных остатках судят об их возрасте. Получены также радиоактивные изотопы с массовыми числами от 10 до 16. В земной коре углерод находится в составе карбонатных минералов (прежде всего Са. СО 3 и Мg. СО 3), каменного угля, нефти, а также в виде графита и реже алмаза. Углерод главная составная часть животного и растительного мира. 4
 • Простые вещества. В отличие от уже рассмотренных элементов 2 -го периода, простые вещества которых имеют молекулярное строение F 2, O 2, N 2, простые вещества элемента углерода имеют полимерное строение. • Электронная конфигурация двухатомной молекулы С 2: ( sсв)2( sразр)2( y, zсв)4 свидетельствует о том, что в ней атомы связаны посредством двух связей. • Связь в молекуле С 2 оказывается менее прочной, чем две -связи в гомоцепях (к. Дж/моль): 5
• Простые вещества. В отличие от уже рассмотренных элементов 2 -го периода, простые вещества которых имеют молекулярное строение F 2, O 2, N 2, простые вещества элемента углерода имеют полимерное строение. • Электронная конфигурация двухатомной молекулы С 2: ( sсв)2( sразр)2( y, zсв)4 свидетельствует о том, что в ней атомы связаны посредством двух связей. • Связь в молекуле С 2 оказывается менее прочной, чем две -связи в гомоцепях (к. Дж/моль): 5
 • В соответствии с характерными гибридными состояниями орбиталей атомы углерода могут объединяться в полимерные образования координационной (sр3), слоистой (sр2) и линейной структуры (sр). Этому соответствуют три типа простых веществ: алмаз, графит, карбин, фуллерен, графен. • Алмаз (а) – кристаллическое вещество с атомной координационной гранецентрированной кубической решеткой. Вследствие sp 3 -гибридизации каждый атом в алмазе образует равноценные прочные -связи с четырьмя соседними. Это обусловливает исключительную твердость и отсутствие электронной проводимости в обычных условиях. • Лонсдейлит - алмаз гексагональный, на 58 процентов 6 тверже алмаза.
• В соответствии с характерными гибридными состояниями орбиталей атомы углерода могут объединяться в полимерные образования координационной (sр3), слоистой (sр2) и линейной структуры (sр). Этому соответствуют три типа простых веществ: алмаз, графит, карбин, фуллерен, графен. • Алмаз (а) – кристаллическое вещество с атомной координационной гранецентрированной кубической решеткой. Вследствие sp 3 -гибридизации каждый атом в алмазе образует равноценные прочные -связи с четырьмя соседними. Это обусловливает исключительную твердость и отсутствие электронной проводимости в обычных условиях. • Лонсдейлит - алмаз гексагональный, на 58 процентов 6 тверже алмаза.
 • Графит (б) — слоистое кристаллическое вещество с гексагональной структурой. В соответствии с sр2 гибридизацией атомы углерода объединяются в макромолекулы С 2∞, представляющие собой бесконечные слои из шестичленных колец. 7
• Графит (б) — слоистое кристаллическое вещество с гексагональной структурой. В соответствии с sр2 гибридизацией атомы углерода объединяются в макромолекулы С 2∞, представляющие собой бесконечные слои из шестичленных колец. 7
 • sр2 -Гибридное состояние в этом случае стабилизируется делокализованной -связью, образованной за счет четвертого электрона каждого из атомов макромолекулы. -Связь в графите делокализована в пределах всей макро-молекулы. Этим определяются его электрическая проводимость, серый цвет и металлический блеск. Углеродные слои объединяются в кристаллическую решетку в основном за счет межмолекулярных сил. Прочность химических связей в плоскости макромолекулы (716 к. Дж/моль) значительно больше, чем между слоями (всего 17 к. Дж/моль). • Поэтому графит довольно мягок, легко расслаивается, химически несколько активнее алмаза. Плотность графита (2, 1— 2, 5 г/см 3) ниже, чем алмаза (3, 5 г/см 3). 8
• sр2 -Гибридное состояние в этом случае стабилизируется делокализованной -связью, образованной за счет четвертого электрона каждого из атомов макромолекулы. -Связь в графите делокализована в пределах всей макро-молекулы. Этим определяются его электрическая проводимость, серый цвет и металлический блеск. Углеродные слои объединяются в кристаллическую решетку в основном за счет межмолекулярных сил. Прочность химических связей в плоскости макромолекулы (716 к. Дж/моль) значительно больше, чем между слоями (всего 17 к. Дж/моль). • Поэтому графит довольно мягок, легко расслаивается, химически несколько активнее алмаза. Плотность графита (2, 1— 2, 5 г/см 3) ниже, чем алмаза (3, 5 г/см 3). 8
 • Графе н - двумерная аллотропная модификация углерода Образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp 2 -гибридизированных связей в гексагональную двумерную кристаллическую решетку. Его можно представить как одну плоскость графита, отделённую от объемного кристалла. Графен обладает большой механической прочностью и теплопроводностью. Высокая подвижность носителей заряда делает его перспективным материалом для использования в наноэлектронике. 9
• Графе н - двумерная аллотропная модификация углерода Образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp 2 -гибридизированных связей в гексагональную двумерную кристаллическую решетку. Его можно представить как одну плоскость графита, отделённую от объемного кристалла. Графен обладает большой механической прочностью и теплопроводностью. Высокая подвижность носителей заряда делает его перспективным материалом для использования в наноэлектронике. 9
 • Карбин — черный порошок (пл. 1, 9— 2 г/см 3); его решетка гексагональная, построена из прямолинейных цепочек С∞, в которых каждый атом образует по две – и -связи. sргибридизация орбиталей углерода отвечает объединению атомов в цепи вида • (в частности, при озонировании полиин превращается в щавелевую кислоту НООССООН, а поликумулен — в угольную кислоту Н 2 СО 3) 10
• Карбин — черный порошок (пл. 1, 9— 2 г/см 3); его решетка гексагональная, построена из прямолинейных цепочек С∞, в которых каждый атом образует по две – и -связи. sргибридизация орбиталей углерода отвечает объединению атомов в цепи вида • (в частности, при озонировании полиин превращается в щавелевую кислоту НООССООН, а поликумулен — в угольную кислоту Н 2 СО 3) 10
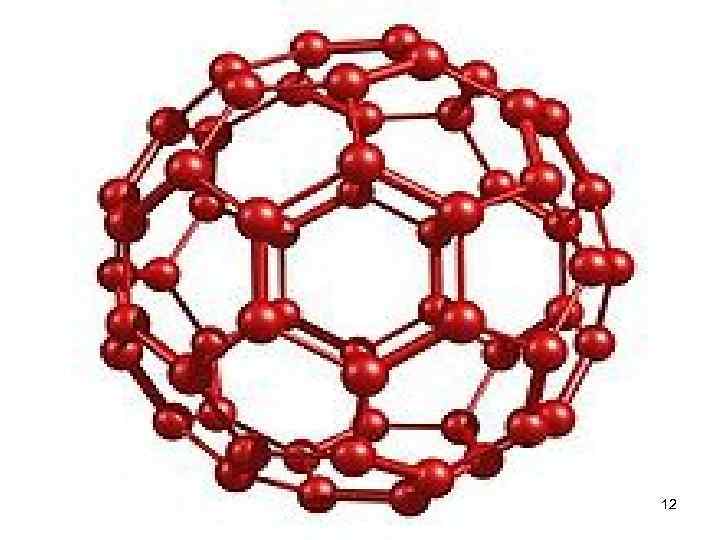
 • Фуллерены - это совершенно новый (были в 1985 году) тип молекулярной формы углерода. Атомы углерода расположены в вершинах правильных шести- и пятиугольников, покрывающих поверхность сферы или сфероида. Такие молекулы могут содержать 28, 32, 50, 60, 76 и т. д. молекул. • Первой была открыта молекула с магическим числом атомов C 60. Что бы понять как выглядит фулерен, достаточно взять в руки футбольный мяч - он состоит из «заплаток» 5 и 6 угольной формы. Теперь, если представить что в вершинах этих многоугольников сидят атомы углерода, то мы получим самый стабильный фулерен C 60 11 (фуллерит).
• Фуллерены - это совершенно новый (были в 1985 году) тип молекулярной формы углерода. Атомы углерода расположены в вершинах правильных шести- и пятиугольников, покрывающих поверхность сферы или сфероида. Такие молекулы могут содержать 28, 32, 50, 60, 76 и т. д. молекул. • Первой была открыта молекула с магическим числом атомов C 60. Что бы понять как выглядит фулерен, достаточно взять в руки футбольный мяч - он состоит из «заплаток» 5 и 6 угольной формы. Теперь, если представить что в вершинах этих многоугольников сидят атомы углерода, то мы получим самый стабильный фулерен C 60 11 (фуллерит).
 12
12
 a: алмаз (АВСАВС…), b: графит, c: лонсдейлит (АВАВ…. . ) d: фуллерен — букибол C 60, e: фуллерен C 540, f: фуллерен C 70 g: аморфный углерод, 13 h: углеродная
a: алмаз (АВСАВС…), b: графит, c: лонсдейлит (АВАВ…. . ) d: фуллерен — букибол C 60, e: фуллерен C 540, f: фуллерен C 70 g: аморфный углерод, 13 h: углеродная
 • Получаемый при термическом разложении органических соединений черный графит, или уголь, представляет собой тонкоизмельченный графит. Технически наиболее важными сортами черного графита являются кокс, древесный уголь, животный уголь и сажа. Все разновидности углерода тугоплавки. • При обычной температуре элементарный углерод весьма инертен. При высоких же температурах он непосредственно взаимодействует с многими металлами и неметаллами. Углерод проявляет восстановительные свойства, что широко используется в металлургии. Окислительные свойства углерода выражены слабо. • Вследствие различия в структуре алмаз, графит, карбин и фуллерен по-разному ведут себя в химических реакциях. • Для графита характерны реакции образования кристаллических соединений, в которых макромолекулярные слои С 2 играют роль самостоятельных 14 радикалов.
• Получаемый при термическом разложении органических соединений черный графит, или уголь, представляет собой тонкоизмельченный графит. Технически наиболее важными сортами черного графита являются кокс, древесный уголь, животный уголь и сажа. Все разновидности углерода тугоплавки. • При обычной температуре элементарный углерод весьма инертен. При высоких же температурах он непосредственно взаимодействует с многими металлами и неметаллами. Углерод проявляет восстановительные свойства, что широко используется в металлургии. Окислительные свойства углерода выражены слабо. • Вследствие различия в структуре алмаз, графит, карбин и фуллерен по-разному ведут себя в химических реакциях. • Для графита характерны реакции образования кристаллических соединений, в которых макромолекулярные слои С 2 играют роль самостоятельных 14 радикалов.
 • При взаимодействии с фтором нелокализованная -связь графита разрывается и возникают двухэлектронные -связи С—F. В пределе образуется фторид графита состава СF. При этом углерод переходит из sр2 - в sр3 -гибридное состояние. Поскольку во фториде графита все связи локализованные, он диэлектрик. Фторид графита бесцветное, прозрачное, химически инертное вещество. Не реагирует даже с концентрированными кислотами и щелочами. Используется как смазочный материал. При дальнейшем окислении фтором превращается в СF 4. Алмаз окисляется фтором при нагревании непосредственно до СF 4. На различном отношении ко фтору основан один из способов отделения графита от алмаза, полученного синтезом. 15
• При взаимодействии с фтором нелокализованная -связь графита разрывается и возникают двухэлектронные -связи С—F. В пределе образуется фторид графита состава СF. При этом углерод переходит из sр2 - в sр3 -гибридное состояние. Поскольку во фториде графита все связи локализованные, он диэлектрик. Фторид графита бесцветное, прозрачное, химически инертное вещество. Не реагирует даже с концентрированными кислотами и щелочами. Используется как смазочный материал. При дальнейшем окислении фтором превращается в СF 4. Алмаз окисляется фтором при нагревании непосредственно до СF 4. На различном отношении ко фтору основан один из способов отделения графита от алмаза, полученного синтезом. 15
 • При нагревании графита в парах или в расплаве щелочного металла (Са, Rb или К) образуются соединения включения — графитиды щелочных металлов (КС 8), в которых роль аниона играют гексагональные сетки С 2∞. Графитиды МС 8 — весьма реакционноспособные вещества меднокрасного цвета. Самовоспламеняются на воздухе, а с водой взаимодействуют со взрывом. • Из графита изготовляют электроды, плавильные тигли, футеровку электрических печей и промышленных электролизных ванн и др. В ядерных реакторах его используют в качестве замедлителя нейтронов. Графит применяется также как смазочный материал и т. д. 16
• При нагревании графита в парах или в расплаве щелочного металла (Са, Rb или К) образуются соединения включения — графитиды щелочных металлов (КС 8), в которых роль аниона играют гексагональные сетки С 2∞. Графитиды МС 8 — весьма реакционноспособные вещества меднокрасного цвета. Самовоспламеняются на воздухе, а с водой взаимодействуют со взрывом. • Из графита изготовляют электроды, плавильные тигли, футеровку электрических печей и промышленных электролизных ванн и др. В ядерных реакторах его используют в качестве замедлителя нейтронов. Графит применяется также как смазочный материал и т. д. 16
 • Благодаря большой адсорбционной способности древесного и животного углей они применяются для очистки веществ от примесей. Сажа используется в производстве черной резины, для изготовления красок, туши и т. д. • Сочетание атомов углерода разных гибридных состояний в единой полимерной структуре порождает множество аморфных форм углерода. Типичным примером аморфного углерода является так называемый стеклоуглерод. В нем беспорядочно связаны между собой структурные фрагменты алмаза, графита и карбина. 17
• Благодаря большой адсорбционной способности древесного и животного углей они применяются для очистки веществ от примесей. Сажа используется в производстве черной резины, для изготовления красок, туши и т. д. • Сочетание атомов углерода разных гибридных состояний в единой полимерной структуре порождает множество аморфных форм углерода. Типичным примером аморфного углерода является так называемый стеклоуглерод. В нем беспорядочно связаны между собой структурные фрагменты алмаза, графита и карбина. 17
 • Стеклоуглерод — конструкционный материал с уникальными свойствами, не присущими обычным модификациям углерода, его получают термическим разложением некоторых углеродистых веществ. Стеклоуглерод тугоплавок (остается в твердом состоянии вплоть до 3700 о. С). , по сравнению с большинством других тугоплавких материалов имеет небольшую плотность (до 1, 5 г/см 3), обладает высокой механической прочностью, электропроводен. • Стеклоуглерод весьма устойчив во многих агрессивных средах (расплавленных щелочах и солях, кислотах, окислителях и др. ). Изделия из стеклоуглерода самой различной формы (трубки, цилиндры, стаканы и пр. ) получают при термическом разложении углеродистых веществ или прессованием стеклоуглерода. 18
• Стеклоуглерод — конструкционный материал с уникальными свойствами, не присущими обычным модификациям углерода, его получают термическим разложением некоторых углеродистых веществ. Стеклоуглерод тугоплавок (остается в твердом состоянии вплоть до 3700 о. С). , по сравнению с большинством других тугоплавких материалов имеет небольшую плотность (до 1, 5 г/см 3), обладает высокой механической прочностью, электропроводен. • Стеклоуглерод весьма устойчив во многих агрессивных средах (расплавленных щелочах и солях, кислотах, окислителях и др. ). Изделия из стеклоуглерода самой различной формы (трубки, цилиндры, стаканы и пр. ) получают при термическом разложении углеродистых веществ или прессованием стеклоуглерода. 18
 • Соединения с отрицательной степенью окисления углерода. С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода -4. По типу химической связи можно выделить ковалентные, ионноковалентные и металлические карбиды. • Ковалентные карбиды кремния Si. С и бора В 4 С полимерные вещества. Они характеризуются очень высокой твердостью, тугоплавкостью и химической инертностью. 19
• Соединения с отрицательной степенью окисления углерода. С менее электроотрицательными, чем он сам, элементами углерод дает карбиды. Поскольку для углерода характерно образовывать гомоцепи, состав большинства карбидов не отвечает степени окисления углерода -4. По типу химической связи можно выделить ковалентные, ионноковалентные и металлические карбиды. • Ковалентные карбиды кремния Si. С и бора В 4 С полимерные вещества. Они характеризуются очень высокой твердостью, тугоплавкостью и химической инертностью. 19
 • В качестве простейшего ковалентного карбида можно рассматривать метан СН 4. Его молекула имеет тетраэдрическую форму, что отвечает электронной конфигурации E C CH 4 H ( sсв)2( xсв)2( yсв)2( zсв)2 В обычных условиях водород 1 s(A, B, C, D) с углеродом не реагирует. Синтез метана идет только при высокой температуре и в присутствии кат. (мелкораздробленный никель). В природе метан получается при разложении орг. в-в без доступа возд. 2 p В лаб. его можно получить разложением карбида алюминия водой. xсв yсв zсв 2 s sсв 20
• В качестве простейшего ковалентного карбида можно рассматривать метан СН 4. Его молекула имеет тетраэдрическую форму, что отвечает электронной конфигурации E C CH 4 H ( sсв)2( xсв)2( yсв)2( zсв)2 В обычных условиях водород 1 s(A, B, C, D) с углеродом не реагирует. Синтез метана идет только при высокой температуре и в присутствии кат. (мелкораздробленный никель). В природе метан получается при разложении орг. в-в без доступа возд. 2 p В лаб. его можно получить разложением карбида алюминия водой. xсв yсв zсв 2 s sсв 20
 • Метан — бесцветный, без запаха газ (Тпл. -182, 48 °С, Ткип. -161, 49 °С), химически весьма инертен вследствие валентной и координационной насыщенности молекулы. На него не действуют кислоты и щелочи. Однако он легко загорается; его смеси с воздухом чрезвычайно взрывоопасны. Метан — основной компонент природного, рудничного и болотного газа. 800°С СН 4 + Н 2 О СО + 3 Н 2 , Н 0298 = 206, 2 к. Дж/моль; 600 °С СО + Н 2 О СО 2 + Н 2 , Н 0298 = - 41, 2 к. Дж/моль. • неполным окислением углеводородов можно получить водород, например: 2 СН 4 + О 2 = 2 СО + 4 Н 2 , Но 298= -71, 3 к. Дж/моль. Пиролиз (~1000 о. С) СН 4 = С + 2 Н 2 21
• Метан — бесцветный, без запаха газ (Тпл. -182, 48 °С, Ткип. -161, 49 °С), химически весьма инертен вследствие валентной и координационной насыщенности молекулы. На него не действуют кислоты и щелочи. Однако он легко загорается; его смеси с воздухом чрезвычайно взрывоопасны. Метан — основной компонент природного, рудничного и болотного газа. 800°С СН 4 + Н 2 О СО + 3 Н 2 , Н 0298 = 206, 2 к. Дж/моль; 600 °С СО + Н 2 О СО 2 + Н 2 , Н 0298 = - 41, 2 к. Дж/моль. • неполным окислением углеводородов можно получить водород, например: 2 СН 4 + О 2 = 2 СО + 4 Н 2 , Но 298= -71, 3 к. Дж/моль. Пиролиз (~1000 о. С) СН 4 = С + 2 Н 2 21
 • Углерод образует многообразные перкарбиды. Вследствие высокой прочности гомоцепей из атомов углерода перкарбиды многообразнее пероксидов и пернитридов. В качестве простейших представителей перкарбидов можно формально рассматривать некоторые простейшие углеводороды изоэлектронные аналоги пероксида и пернитридов водорода: 22
• Углерод образует многообразные перкарбиды. Вследствие высокой прочности гомоцепей из атомов углерода перкарбиды многообразнее пероксидов и пернитридов. В качестве простейших представителей перкарбидов можно формально рассматривать некоторые простейшие углеводороды изоэлектронные аналоги пероксида и пернитридов водорода: 22
 • Ионно-ковалентные карбиды —это бесцветные прозрачные кристаллические солеподобные вещества. При действии воды или разбавленной кислоты они разрушаются с выделением углеводородов. Поэтому карбиды подобного типа можно рассматривать как производные соответствующих углеводородов. • В качестве производных метана – метанидов – можно рассматривать карбиды Ве 2 С (Тпл. 2150 о. С) и Al 4 C 3 (Тпл. 2800 °С). Это тугоплавкие кристаллические вещества. Согласно рентгеноструктурным исследованиям в их кристаллах атомы углерода между собой не связаны. Метаниды водой разлагаются, выделяя метан: Аl 4 С 3 (к) + 12 Н 2 О (ж) = 4 Аl(ОН)3 (к) + 3 СН 4 (г), 23 Go 298 = -1770 к. Дж/моль.
• Ионно-ковалентные карбиды —это бесцветные прозрачные кристаллические солеподобные вещества. При действии воды или разбавленной кислоты они разрушаются с выделением углеводородов. Поэтому карбиды подобного типа можно рассматривать как производные соответствующих углеводородов. • В качестве производных метана – метанидов – можно рассматривать карбиды Ве 2 С (Тпл. 2150 о. С) и Al 4 C 3 (Тпл. 2800 °С). Это тугоплавкие кристаллические вещества. Согласно рентгеноструктурным исследованиям в их кристаллах атомы углерода между собой не связаны. Метаниды водой разлагаются, выделяя метан: Аl 4 С 3 (к) + 12 Н 2 О (ж) = 4 Аl(ОН)3 (к) + 3 СН 4 (г), 23 Go 298 = -1770 к. Дж/моль.
 • Из солеподобных перкарбидов относительно лучше изучены ацетилиды типа М+12 С 2, М+2 С 2 и М+32(С 2)3. Ацетилиды наиболее характерны для s и d-элементов I и II групп, а также для алюминия. • Ацетилиды образуются по обменным реакциям в растворах 2 Аg. NО 3 + С 2 Н 2 = Аg 2 С 2 + 2 НNO 3 или непосредственным взаимодействием С 2 Н 2 с некоторыми металлами при нагревании: 2 Аl + 3 С 2 Н 2 = Аl 2(С 2)3 + 3 Н 2 ; Zn + С 2 Н 2 = Zn. С 2 + Н 2. • Имеющий наибольшее значение ацетилид кальция Са. С 2 (обычно называемый карбидом кальция) получают нагреванием Са. О с углем в электропечах: Са. О + 3 С = Са. С 2 + СО, Нo 298 = 468 к. Дж/моль. Ацетилиды более или менее легко разлагаются водой: Са. С 2 + 2 Н 2 О = Са(ОН)2 + С 2 Н 2. с образованием ацетилена. 24
• Из солеподобных перкарбидов относительно лучше изучены ацетилиды типа М+12 С 2, М+2 С 2 и М+32(С 2)3. Ацетилиды наиболее характерны для s и d-элементов I и II групп, а также для алюминия. • Ацетилиды образуются по обменным реакциям в растворах 2 Аg. NО 3 + С 2 Н 2 = Аg 2 С 2 + 2 НNO 3 или непосредственным взаимодействием С 2 Н 2 с некоторыми металлами при нагревании: 2 Аl + 3 С 2 Н 2 = Аl 2(С 2)3 + 3 Н 2 ; Zn + С 2 Н 2 = Zn. С 2 + Н 2. • Имеющий наибольшее значение ацетилид кальция Са. С 2 (обычно называемый карбидом кальция) получают нагреванием Са. О с углем в электропечах: Са. О + 3 С = Са. С 2 + СО, Нo 298 = 468 к. Дж/моль. Ацетилиды более или менее легко разлагаются водой: Са. С 2 + 2 Н 2 О = Са(ОН)2 + С 2 Н 2. с образованием ацетилена. 24
 • В ряду F–О–N–C повышается способность к образованию соединений с делокализованной связью, вплоть до металлической. Металлическими являются карбиды d-элементов IV—VIII групп. Карбиды этого типа представляют собой соединения включения; в них атомы углерода занимают октаэдрические пустоты в плотноупакованных структурах атомов металлов. • Металлические карбиды весьма разнообразны. Чаще всего встречаются карбиды среднего состава МС (Тi. С, Zr. С, Нf. С, VС, Nb. С, Tа. С), М 2 С (Мo 2 С, W 2 С), М 3 С (Мn 3 С, Fе 3 С, Со 3 С). Эти карбиды проявляют металлические признаки: металлический блеск, высокую электрическую проводимость, уменьшающуюся с повышением температуры, легкость образования твердых растворов с металлами и др. Состав карбидов d-элементов изменяется в широких 25 пределах.
• В ряду F–О–N–C повышается способность к образованию соединений с делокализованной связью, вплоть до металлической. Металлическими являются карбиды d-элементов IV—VIII групп. Карбиды этого типа представляют собой соединения включения; в них атомы углерода занимают октаэдрические пустоты в плотноупакованных структурах атомов металлов. • Металлические карбиды весьма разнообразны. Чаще всего встречаются карбиды среднего состава МС (Тi. С, Zr. С, Нf. С, VС, Nb. С, Tа. С), М 2 С (Мo 2 С, W 2 С), М 3 С (Мn 3 С, Fе 3 С, Со 3 С). Эти карбиды проявляют металлические признаки: металлический блеск, высокую электрическую проводимость, уменьшающуюся с повышением температуры, легкость образования твердых растворов с металлами и др. Состав карбидов d-элементов изменяется в широких 25 пределах.
 • Карбиды d-элементов обладают высокой твердостью, жаропрочностью, обычно более высокой температурой плавления, чем исходные металлы. • Карбиды состава МС (Тi. С, VС, Nb. С) и М 2 С (Мо 2 С, W 2 С) наряду с исключительной жаростойкостью и тугоплавкостью (2000— 3500 °С) характеризуются высокой коррозионной стойкостью. • Карбиды состава М 3 С (Мn 3 С, Fе 3 С, Со 3 С) термически и химически менее устойчивы. Так, они разлагаются разбавленными кислотами, выделяя смесь углеводородов. • Карбиды получают прокаливанием при высоких температурах смеси порошков металлов или их оксидов с углем в электрических печах: 26 V 2 O 5 + 7 С = 2 VС + 5 СО.
• Карбиды d-элементов обладают высокой твердостью, жаропрочностью, обычно более высокой температурой плавления, чем исходные металлы. • Карбиды состава МС (Тi. С, VС, Nb. С) и М 2 С (Мо 2 С, W 2 С) наряду с исключительной жаростойкостью и тугоплавкостью (2000— 3500 °С) характеризуются высокой коррозионной стойкостью. • Карбиды состава М 3 С (Мn 3 С, Fе 3 С, Со 3 С) термически и химически менее устойчивы. Так, они разлагаются разбавленными кислотами, выделяя смесь углеводородов. • Карбиды получают прокаливанием при высоких температурах смеси порошков металлов или их оксидов с углем в электрических печах: 26 V 2 O 5 + 7 С = 2 VС + 5 СО.
 • Металлические карбиды входят в состав чугунов и сталей, придавая им твердость, износоустойчивость и другие ценные качества, На основе карбидов вольфрама, титана и тантала производят сверхтвердые и тугоплавкие сплавы, применяемые для скоростной обработки металлов. Такие сплавы изготовляют методами порошковой металлургии (спрессовыванием составных частей при нагревании); в качестве цементирующего материала чаще всего используют кобальт и никель. • Сплав, состоящий из 20% Нf. С и 80% Та. С, — самый тугоплавкий из известных веществ (Tпл. 4400 °С). (не реагирует с царской водкой, растворяется в смеси HF и HNO 3). 27
• Металлические карбиды входят в состав чугунов и сталей, придавая им твердость, износоустойчивость и другие ценные качества, На основе карбидов вольфрама, титана и тантала производят сверхтвердые и тугоплавкие сплавы, применяемые для скоростной обработки металлов. Такие сплавы изготовляют методами порошковой металлургии (спрессовыванием составных частей при нагревании); в качестве цементирующего материала чаще всего используют кобальт и никель. • Сплав, состоящий из 20% Нf. С и 80% Та. С, — самый тугоплавкий из известных веществ (Tпл. 4400 °С). (не реагирует с царской водкой, растворяется в смеси HF и HNO 3). 27
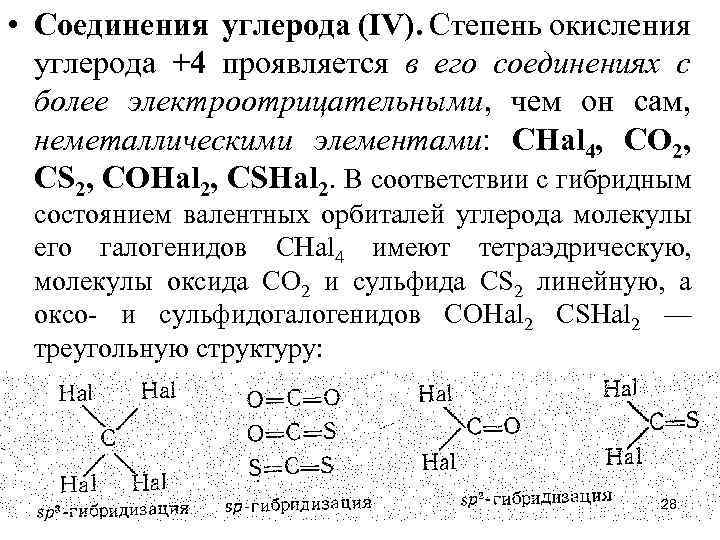 • Соединения углерода (IV). Степень окисления углерода +4 проявляется в его соединениях с более электроотрицательными, чем он сам, неметаллическими элементами: СНаl 4, СО 2, СS 2, СОНаl 2, СSНаl 2. В соответствии с гибридным состоянием валентных орбиталей углерода молекулы его галогенидов СНаl 4 имеют тетраэдрическую, молекулы оксида СО 2 и сульфида СS 2 линейную, а оксо- и сульфидогалогенидов СОНаl 2 СSНаl 2 — треугольную структуру: 28
• Соединения углерода (IV). Степень окисления углерода +4 проявляется в его соединениях с более электроотрицательными, чем он сам, неметаллическими элементами: СНаl 4, СО 2, СS 2, СОНаl 2, СSНаl 2. В соответствии с гибридным состоянием валентных орбиталей углерода молекулы его галогенидов СНаl 4 имеют тетраэдрическую, молекулы оксида СО 2 и сульфида СS 2 линейную, а оксо- и сульфидогалогенидов СОНаl 2 СSНаl 2 — треугольную структуру: 28
 • В обычных условиях некоторые из указанных соединений газы (СF 4, СО 2, СОS, СОСl 2), другие — жидкости (ССl 4, СS 2) или легкоплавкие твердые вещества (СВr 4, CI 4). • В твердом состоянии все они имеют молекулярные решетки. Первые два галогенида бесцветны, СВr 4 — бледно-желтое и СI 4 — светло-красное вещества. Все эти соединения практически в воде нерастворимы, но растворяются в органических растворителях. • Тетрафторид углерода чрезвычайно устойчив к нагреванию и химическим реагентам, тетрахлорид несколько менее устойчив, однако не разлагается щелочами и кислотами. Его гидролиз протекает лишь при высокой температуре в присутствии катализаторов (металлов). Изменение энергии Гиббса в реакции отрицательное, СНаl 4 (г) + 2 Н 2 O (г) = СО 2 (г) + 4 ННаl (г) а отсутствие гидролиза при обычных условиях обусловливается кинетическим фактором. CS 2 + 2 Cl 2 = CCl 4 + 2 S CS 2 + 2 S 2 Cl 2 = CCl 4 + 6 S 29
• В обычных условиях некоторые из указанных соединений газы (СF 4, СО 2, СОS, СОСl 2), другие — жидкости (ССl 4, СS 2) или легкоплавкие твердые вещества (СВr 4, CI 4). • В твердом состоянии все они имеют молекулярные решетки. Первые два галогенида бесцветны, СВr 4 — бледно-желтое и СI 4 — светло-красное вещества. Все эти соединения практически в воде нерастворимы, но растворяются в органических растворителях. • Тетрафторид углерода чрезвычайно устойчив к нагреванию и химическим реагентам, тетрахлорид несколько менее устойчив, однако не разлагается щелочами и кислотами. Его гидролиз протекает лишь при высокой температуре в присутствии катализаторов (металлов). Изменение энергии Гиббса в реакции отрицательное, СНаl 4 (г) + 2 Н 2 O (г) = СО 2 (г) + 4 ННаl (г) а отсутствие гидролиза при обычных условиях обусловливается кинетическим фактором. CS 2 + 2 Cl 2 = CCl 4 + 2 S CS 2 + 2 S 2 Cl 2 = CCl 4 + 6 S 29
 По химической природе эти соединения углерода (IV) являются кислотными. Некоторые из них довольно легко взаимодействуют с водой, образуя кислоты: СО 2 + Н 2 О = Н 2 СО 3; СОСl 2 + 2 H 2 O = H 2 CO 3 + 2 HCl и с основными соединениями, образуя соли: 2 KOH + CO 2 = K 2 CO 3 + H 2 O Ca. S + CS 2 = Ca. CS 3 (сульфидокарбонат Са) • Дисульфид углерода CS 2 (сероуглерод) в обычных условиях – летучая бесцветная жидкость. Получают его взаимодействием паров серы с раскаленным углем. • C + 2 S = CS 2 (750 -1000 o. C) CH 4 + 4 S = CS 2 + 2 H 2 S (500 -700 o. C) • Легко окисляется кислородом (при небольшом нагревании). CS 2 + О 2 = СО 2 + 2 SО 2 • В воде не растворяется, при нагревании (150 о. С) гидролизуется на СО 2 и Н 2 S. CS 2 + 2 H 2 О = СО 2 + 2 H 2 S • Хороший растворитель. Сероуглерод используется как хороший растворитель органических веществ, фосфора, серы, иода. Основная масса СS 2 применяется в производстве вискозного шелка, а также в качестве средства для борьбы с вредителями сельского хозяйства. Сероуглерод 30 ядовит!
По химической природе эти соединения углерода (IV) являются кислотными. Некоторые из них довольно легко взаимодействуют с водой, образуя кислоты: СО 2 + Н 2 О = Н 2 СО 3; СОСl 2 + 2 H 2 O = H 2 CO 3 + 2 HCl и с основными соединениями, образуя соли: 2 KOH + CO 2 = K 2 CO 3 + H 2 O Ca. S + CS 2 = Ca. CS 3 (сульфидокарбонат Са) • Дисульфид углерода CS 2 (сероуглерод) в обычных условиях – летучая бесцветная жидкость. Получают его взаимодействием паров серы с раскаленным углем. • C + 2 S = CS 2 (750 -1000 o. C) CH 4 + 4 S = CS 2 + 2 H 2 S (500 -700 o. C) • Легко окисляется кислородом (при небольшом нагревании). CS 2 + О 2 = СО 2 + 2 SО 2 • В воде не растворяется, при нагревании (150 о. С) гидролизуется на СО 2 и Н 2 S. CS 2 + 2 H 2 О = СО 2 + 2 H 2 S • Хороший растворитель. Сероуглерод используется как хороший растворитель органических веществ, фосфора, серы, иода. Основная масса СS 2 применяется в производстве вискозного шелка, а также в качестве средства для борьбы с вредителями сельского хозяйства. Сероуглерод 30 ядовит!
 • Молекула диоксида углерода СО 2 имеет линейную форму (d. CO = 0, 1162 нм, = 0). Это отвечает электронной конфигурации (ММО): Распределение валентных электронов (четыре от углерода и восемь от двух атомов кислорода). Связи в молекуле СО 2 осуществляются за счет четырех электронных пар на четырех трехцентровых орбиталях (по ММО). 31
• Молекула диоксида углерода СО 2 имеет линейную форму (d. CO = 0, 1162 нм, = 0). Это отвечает электронной конфигурации (ММО): Распределение валентных электронов (четыре от углерода и восемь от двух атомов кислорода). Связи в молекуле СО 2 осуществляются за счет четырех электронных пар на четырех трехцентровых орбиталях (по ММО). 31
 • В представлениях теории локализованных связей (МВС) это отвечает расположению четырех электронных пар на четырех двухцентровых орбиталях: две из которых -типа и возникают за счет перекрывания двух sр-гибридных орбиталей С и двух 2 рx-орбиталей О. Две другие локализованные орбитали -типа возникают при перекрывании 2 рy и 2 рzорбиталей С с 2 рy- и 2 рz-орбиталями О. Роль неподеленных электронных пар атомов кислорода играют несвязывающие 2 sа-, 2 sb- и y, z-электроны. 32
• В представлениях теории локализованных связей (МВС) это отвечает расположению четырех электронных пар на четырех двухцентровых орбиталях: две из которых -типа и возникают за счет перекрывания двух sр-гибридных орбиталей С и двух 2 рx-орбиталей О. Две другие локализованные орбитали -типа возникают при перекрывании 2 рy и 2 рzорбиталей С с 2 рy- и 2 рz-орбиталями О. Роль неподеленных электронных пар атомов кислорода играют несвязывающие 2 sа-, 2 sb- и y, z-электроны. 32
 • Диоксид углерода СО 2 (Т субл. -78, 5 °С, Тпл. -56, 5 °С при 5 I 05 Па) в технике обычно получают термическим разложением Са. СО 3, а в лаборатории — действием на Са. СО 3 соляной кислотой. • Растворимость СО 2 в воде невелика (при 0 °С составляет 1, 7 л СО 2, при 15 °С — 1 л СО 2 в 1 л воды). Некоторая часть растворенного СО 2 взаимодействует с водой с образованием угольной кислоты Н 2 СО 3. 33
• Диоксид углерода СО 2 (Т субл. -78, 5 °С, Тпл. -56, 5 °С при 5 I 05 Па) в технике обычно получают термическим разложением Са. СО 3, а в лаборатории — действием на Са. СО 3 соляной кислотой. • Растворимость СО 2 в воде невелика (при 0 °С составляет 1, 7 л СО 2, при 15 °С — 1 л СО 2 в 1 л воды). Некоторая часть растворенного СО 2 взаимодействует с водой с образованием угольной кислоты Н 2 СО 3. 33
 • Диоксид очень легко поглощается растворами щелочей; при этом образуется соответствующий карбонат, а при избытке СО 2 — гидрокарбонат: 2 ОН- + СО 2 = СО 32 - + Н 2 О; ОН- + СО 2 = НСО 3 -. • Диоксид углерода используют в производстве соды, для тушения пожаров, приготовления минеральной воды, как инертную среду при проведении различных синтезов. • Большее значение имеет мочевина (карбамид, амид угольной к-ты) СО(NН 2)2 — белое кристаллическое вещество (Tпл. 132, 7°С). Ее получают действием СО 2 на водный раствор H 3 N при 130 °С и 1 107 Па: СО 2 + 2 Н 3 N = СО(NH 2)2 + Н 2 O • Мочевина применяется в качестве удобрения и для подкормки скота. Это исходный продукт для получения пластических масс, фармацевтических препаратов 34 (веронала, люминала и др. ) и пр.
• Диоксид очень легко поглощается растворами щелочей; при этом образуется соответствующий карбонат, а при избытке СО 2 — гидрокарбонат: 2 ОН- + СО 2 = СО 32 - + Н 2 О; ОН- + СО 2 = НСО 3 -. • Диоксид углерода используют в производстве соды, для тушения пожаров, приготовления минеральной воды, как инертную среду при проведении различных синтезов. • Большее значение имеет мочевина (карбамид, амид угольной к-ты) СО(NН 2)2 — белое кристаллическое вещество (Tпл. 132, 7°С). Ее получают действием СО 2 на водный раствор H 3 N при 130 °С и 1 107 Па: СО 2 + 2 Н 3 N = СО(NH 2)2 + Н 2 O • Мочевина применяется в качестве удобрения и для подкормки скота. Это исходный продукт для получения пластических масс, фармацевтических препаратов 34 (веронала, люминала и др. ) и пр.
 • СО 2 при комнатной температуре под давлением 60, 6 105 Па переходит в бесцветную жидкость. При ее охлаждении в результате испарения СО 2 частично превращается в твердую снегоподобную массу ( «сухой лед» ). Во всех агрегатных состояниях диоксид углерода состоит из линейных, неассоциированных молекул. Степень окисления углерода в СО 2 максимальная (+4), поэтому диоксид не может быть восстановителем, не горит и не поддерживает горения обычного топлива. 35
• СО 2 при комнатной температуре под давлением 60, 6 105 Па переходит в бесцветную жидкость. При ее охлаждении в результате испарения СО 2 частично превращается в твердую снегоподобную массу ( «сухой лед» ). Во всех агрегатных состояниях диоксид углерода состоит из линейных, неассоциированных молекул. Степень окисления углерода в СО 2 максимальная (+4), поэтому диоксид не может быть восстановителем, не горит и не поддерживает горения обычного топлива. 35
 • Но в его атмосфере горят простые вещества, атомы которых обладают большим сродством к электрону, чем углерод. Так зажженная в воздухе лента магния продолжает гореть в атмосфере СО 2 (Al, P): 2 Mg + СО 2 = 2 Mg. O + C, Go 298 = -349, 8 к. Дж. 2 Na 2 O 2 + CO 2 = 2 Na 2 CO 3 + O 2↑ 4 KO 2 + 2 CO 2 = 2 K 2 CO 3 + 3 O 2↑ В водном растворе СО 2 существует равновесие: СО 2 +Н 2 О Н 2 СО 3 Н+ + НСО 3 - 2 Н+ + СО 32 Оно сильно сдвинуто влево, поэтому концентрация ионов СО 32 - мала. Большая часть СО 2 находится в растворенной форме и не вступает во взаимодействие с водой. Нагревание еще больше смещает равновесие влево. При длительном кипячении СО 2 полностью удаляется из воды. 36
• Но в его атмосфере горят простые вещества, атомы которых обладают большим сродством к электрону, чем углерод. Так зажженная в воздухе лента магния продолжает гореть в атмосфере СО 2 (Al, P): 2 Mg + СО 2 = 2 Mg. O + C, Go 298 = -349, 8 к. Дж. 2 Na 2 O 2 + CO 2 = 2 Na 2 CO 3 + O 2↑ 4 KO 2 + 2 CO 2 = 2 K 2 CO 3 + 3 O 2↑ В водном растворе СО 2 существует равновесие: СО 2 +Н 2 О Н 2 СО 3 Н+ + НСО 3 - 2 Н+ + СО 32 Оно сильно сдвинуто влево, поэтому концентрация ионов СО 32 - мала. Большая часть СО 2 находится в растворенной форме и не вступает во взаимодействие с водой. Нагревание еще больше смещает равновесие влево. При длительном кипячении СО 2 полностью удаляется из воды. 36
 • Угольная кислота является кислотой довольно слабой. (К 1=4, 27 10 -7) Она не выделена в свободном виде. • За исключением карбонатов щелочных металлов, большинство средних углекислых солей плохо растворимы в воде. • Гидрокарбонаты характеризуются значительно большей растворимостью. • В водном растворе карбонаты подвергаются гидролизу, (р. Н > 7): Na 2 CO 3 + H 2 O = Na. HCO 3 + Na. OH • Гидрокарбонаты гидролизуются слабее, и реакция раствора, например гидрокарбоната 37 натрия, близка к нейтральной.
• Угольная кислота является кислотой довольно слабой. (К 1=4, 27 10 -7) Она не выделена в свободном виде. • За исключением карбонатов щелочных металлов, большинство средних углекислых солей плохо растворимы в воде. • Гидрокарбонаты характеризуются значительно большей растворимостью. • В водном растворе карбонаты подвергаются гидролизу, (р. Н > 7): Na 2 CO 3 + H 2 O = Na. HCO 3 + Na. OH • Гидрокарбонаты гидролизуются слабее, и реакция раствора, например гидрокарбоната 37 натрия, близка к нейтральной.
 • Получают соду аммиачно-хлоридным способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе. • Концентрированный раствор Na. Cl насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка. При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония NH 3 + CO 2 + H 2 O = NH 4 HCO 3 который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия: NH 4 HCO 3 + Na. Cl = Na. HCO 3 + NH 4 Cl. • Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают. • При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь вступающий в производство: 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + 2 H 2 O • Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак, который также возвращается в производство: 2 NH 4 Cl + Сa(OH)2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O. • Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение (получение Са, для осушки газов и жидкостей, для ускорения твердения бетона). Полученный по аммиачно-хлоридному способу карбонат натрия не содержит кристаллизационной воды и называется кальцинированной содой. 38
• Получают соду аммиачно-хлоридным способом, основанным на образовании гидрокарбоната натрия при реакции между хлоридом натрия и гидрокарбонатом аммония в водном растворе. • Концентрированный раствор Na. Cl насыщают аммиаком, а затем пропускают в него под давлением диоксид углерода, получаемый обжигом известняка. При взаимодействии аммиака, диоксида углерода и воды образуется гидрокарбонат аммония NH 3 + CO 2 + H 2 O = NH 4 HCO 3 который, вступая в обменную реакцию с хлоридом натрия, образует хлорид аммония и гидрокарбонат натрия: NH 4 HCO 3 + Na. Cl = Na. HCO 3 + NH 4 Cl. • Гидрокарбонат натрия сравнительно мало растворим в холодной воде и выделяется в виде осадка, который отфильтровывают. • При прокаливании гидрокарбонат натрия разлагается на карбонат, воду и диоксид углерода, вновь вступающий в производство: 2 Na. HCO 3 = Na 2 CO 3 + CO 2 + 2 H 2 O • Нагревая раствор, содержащий хлорид аммония, с гашеной известью, выделяют аммиак, который также возвращается в производство: 2 NH 4 Cl + Сa(OH)2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O. • Таким образом, единственным отходом производства является хлорид кальция, остающийся в растворе после выделения аммиака и имеющий ограниченное применение (получение Са, для осушки газов и жидкостей, для ускорения твердения бетона). Полученный по аммиачно-хлоридному способу карбонат натрия не содержит кристаллизационной воды и называется кальцинированной содой. 38
 • Соединения углерода (II). Производные углерода (II) это СО, СS, НСN. В молекуле оксида углерода (II) СО, как и в изоэлектронной ей молекуле N 2, имеется тройная связь. В интерпретации теории валентных связей две связи образованы за счет спаривания 2 р-электронов атомов С и О, третья — по донорно-акцепторному механизму за счет свободной 2 р-орбитали углерода и 2 р-электронной пары кислорода. • Согласно теории молекулярных орбиталей это отвечает следующей электронной конфигурации невозбужденной молекулы СО: ( sсв)2( sразр)2( y, zсв)4( xсв)2. 39
• Соединения углерода (II). Производные углерода (II) это СО, СS, НСN. В молекуле оксида углерода (II) СО, как и в изоэлектронной ей молекуле N 2, имеется тройная связь. В интерпретации теории валентных связей две связи образованы за счет спаривания 2 р-электронов атомов С и О, третья — по донорно-акцепторному механизму за счет свободной 2 р-орбитали углерода и 2 р-электронной пары кислорода. • Согласно теории молекулярных орбиталей это отвечает следующей электронной конфигурации невозбужденной молекулы СО: ( sсв)2( sразр)2( y, zсв)4( xсв)2. 39
 Е АО(С) МО(СО) АО(О) ( sсв)2( sразр)2( y, zсв)4( xсв)2 4 * 2 р (2 р)* 3 2 р (2 р) 2 s 2 * 1 2 s Схема молекулярных орбиталей молекулы СО, предполагающая смешивание орбиталей. 40
Е АО(С) МО(СО) АО(О) ( sсв)2( sразр)2( y, zсв)4( xсв)2 4 * 2 р (2 р)* 3 2 р (2 р) 2 s 2 * 1 2 s Схема молекулярных орбиталей молекулы СО, предполагающая смешивание орбиталей. 40
 • Молекула СО характеризуется очень большой энергией диссоциации (1069 к. Дж/моль) и малым межъядерным расстоянием (0, 1128 нм). • Оксид углерода (II) очень ядовит, и особенно опасен тем, что не имеет запаха и цвета. Ядовитое действие СО объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшийся карбоксигемоглобин постепенно разрушается и гемоглобин восстанавливает способность поглощать кислород. 41
• Молекула СО характеризуется очень большой энергией диссоциации (1069 к. Дж/моль) и малым межъядерным расстоянием (0, 1128 нм). • Оксид углерода (II) очень ядовит, и особенно опасен тем, что не имеет запаха и цвета. Ядовитое действие СО объясняется тем, что СО легко соединяется с гемоглобином крови и делает его неспособным переносить кислород от легких к тканям. При вдыхании свежего воздуха образовавшийся карбоксигемоглобин постепенно разрушается и гемоглобин восстанавливает способность поглощать кислород. 41
 • Оксид углерода (II) образуется при сгорании углерода или его соединений в недостатке кислорода, а также в результате взаимодействия оксида углерода (IV) с раскаленным углем: СО 2 (г) + С (тв) 2 СО (г) - Q, Н = 120 к. Дж, S = 176 Дж/(моль град) • Эта реакция обратима, ее протекание вправо определяет энтропийный фактор, протекание влево — энтальпийный фактор. Равновесие этой реакции ниже 400 °С практически смещено в сторону образования СО 2, выше 1000 °С — в сторону образования СО. Скорость реакции при низкой температуре незначительна, поэтому в обычных условиях оксид углерода (II) не диспропорционирует, т. е. вполне устойчив. 42
• Оксид углерода (II) образуется при сгорании углерода или его соединений в недостатке кислорода, а также в результате взаимодействия оксида углерода (IV) с раскаленным углем: СО 2 (г) + С (тв) 2 СО (г) - Q, Н = 120 к. Дж, S = 176 Дж/(моль град) • Эта реакция обратима, ее протекание вправо определяет энтропийный фактор, протекание влево — энтальпийный фактор. Равновесие этой реакции ниже 400 °С практически смещено в сторону образования СО 2, выше 1000 °С — в сторону образования СО. Скорость реакции при низкой температуре незначительна, поэтому в обычных условиях оксид углерода (II) не диспропорционирует, т. е. вполне устойчив. 42
 • В обычных условиях оксид углерода (II) химически весьма инертен. При нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии. При 700 o. С оксид углерода сгорает синим пламенем, выделяя большое количество тепла (282 к. Дж/моль): СО (г) + 1/2 О 2 (г) = СО 2, Gо 298= -256, 97 к. Дж/моль; So 298 = -82, 19 Дж/(град моль). 43
• В обычных условиях оксид углерода (II) химически весьма инертен. При нагревании проявляет восстановительные свойства, что широко используется в пирометаллургии. При 700 o. С оксид углерода сгорает синим пламенем, выделяя большое количество тепла (282 к. Дж/моль): СО (г) + 1/2 О 2 (г) = СО 2, Gо 298= -256, 97 к. Дж/моль; So 298 = -82, 19 Дж/(град моль). 43
 • Еще одно характеристическое соединение диоксид триуглерода С 3 О 2 (недоокись). Этот оксид – бесцветный и удушливый (зловонный), легко сжимаемый газ. Имеет неполярное строение О=С=С=С=О, атомы углерода находятся в состоянии sp–гибридизации. Помимо s, p-связей возникают p-pсвязи, плоскости симметрии р-облаков которых расположены взаимно перпендикулярно. При хранении или нагревании С 3 О 2 полимеризуется с образованием полимера (С 3 О 2)n красного цвета. Одновременно с полимеризацией повышение температуры вызывает реакцию диспропорционирования: С 3 О 2 = СО 2 + 2 С • С 3 О 2 неустойчив и практического применения не имеет. 44
• Еще одно характеристическое соединение диоксид триуглерода С 3 О 2 (недоокись). Этот оксид – бесцветный и удушливый (зловонный), легко сжимаемый газ. Имеет неполярное строение О=С=С=С=О, атомы углерода находятся в состоянии sp–гибридизации. Помимо s, p-связей возникают p-pсвязи, плоскости симметрии р-облаков которых расположены взаимно перпендикулярно. При хранении или нагревании С 3 О 2 полимеризуется с образованием полимера (С 3 О 2)n красного цвета. Одновременно с полимеризацией повышение температуры вызывает реакцию диспропорционирования: С 3 О 2 = СО 2 + 2 С • С 3 О 2 неустойчив и практического применения не имеет. 44
 • • При облучении или в присутствии катализатора СО взаимодействует с хлором, образуя оксохлорид СОСl 2 (фосген – чрезвычайно ядовитый газ) и т. д. Фосген важный промышленный продукт, он применяется при синтезе ряда органических и неорганических веществ, например красителей. h , кат. СО + Cl 2 = COCl 2 - фосген, хлористый карбонил • CO + S (t) = COS (сульфоксид углерода) • CO + 2 H 2 (P, t) = CH 3 OH (метиловый спирт) • Аналогично молекуле СО построен изоэлектронный ей цианид-ион СN-. • В технике НСN получают при нагревании смеси СО и Н 3 N под давлением в присутствии катализатора (Тh. O 2): CO + H 2 NH = HCN + H 2 O • Цианид водорода применяют в органическом синтезе, Nа. СN и КСN — при добыче золота, для получения комплексных цианидов и т. д. Цианиды чрезвычайно ядовиты! 45
• • При облучении или в присутствии катализатора СО взаимодействует с хлором, образуя оксохлорид СОСl 2 (фосген – чрезвычайно ядовитый газ) и т. д. Фосген важный промышленный продукт, он применяется при синтезе ряда органических и неорганических веществ, например красителей. h , кат. СО + Cl 2 = COCl 2 - фосген, хлористый карбонил • CO + S (t) = COS (сульфоксид углерода) • CO + 2 H 2 (P, t) = CH 3 OH (метиловый спирт) • Аналогично молекуле СО построен изоэлектронный ей цианид-ион СN-. • В технике НСN получают при нагревании смеси СО и Н 3 N под давлением в присутствии катализатора (Тh. O 2): CO + H 2 NH = HCN + H 2 O • Цианид водорода применяют в органическом синтезе, Nа. СN и КСN — при добыче золота, для получения комплексных цианидов и т. д. Цианиды чрезвычайно ядовиты! 45
 • Цианиды можно получать восстановлением углеродом карбонатов (IV) при нагревании: Na 2 C+4 O 3 + C 0 +2 H 3 N = 2 Na. C+2 N + 3 H 2 O Na 2 CO 3 + C 0 + Ca. C+4 N 2 = Ca. CO 3 + 2 Na. C+2 N По химической природе цианиды могут быть основными и кислотными. Так, при гидролизе ионный цианид Nа. СN образует щелочную среду, а ковалентный IСN — две кислоты: • Nа. СN + НОН Nа. ОН + НСN; основный • IСN + НОН = НIО+ НСN 46 кислотный
• Цианиды можно получать восстановлением углеродом карбонатов (IV) при нагревании: Na 2 C+4 O 3 + C 0 +2 H 3 N = 2 Na. C+2 N + 3 H 2 O Na 2 CO 3 + C 0 + Ca. C+4 N 2 = Ca. CO 3 + 2 Na. C+2 N По химической природе цианиды могут быть основными и кислотными. Так, при гидролизе ионный цианид Nа. СN образует щелочную среду, а ковалентный IСN — две кислоты: • Nа. СN + НОН Nа. ОН + НСN; основный • IСN + НОН = НIО+ НСN 46 кислотный
 • Молекула цианида водорода НСN имеет линейную структуру (d. CH = 0, 106 нм, d. CN = 0, 116 нм) (а). Существует также ее таутомерная форма (изоцианид водорода) (б). • а • б 47
• Молекула цианида водорода НСN имеет линейную структуру (d. CH = 0, 106 нм, d. CN = 0, 116 нм) (а). Существует также ее таутомерная форма (изоцианид водорода) (б). • а • б 47
 • Молекулы НСN обладают высокой полярностью ( =0, 9 10 -29 Кл м), за счет водородной связи они ассоциируются в бесцветную жидкость (Тпл. — 13, 3 °С, Ткип. 25, 7 °С). Цианид водорода смешивается с водой в любых отношениях. • Его водный раствор очень слабая кислота (К = 7, 9 10 -10), называемая синильной или цианистоводородной. • Будучи производными углерода (II), цианиды проявляют восстановительные свойства. 48
• Молекулы НСN обладают высокой полярностью ( =0, 9 10 -29 Кл м), за счет водородной связи они ассоциируются в бесцветную жидкость (Тпл. — 13, 3 °С, Ткип. 25, 7 °С). Цианид водорода смешивается с водой в любых отношениях. • Его водный раствор очень слабая кислота (К = 7, 9 10 -10), называемая синильной или цианистоводородной. • Будучи производными углерода (II), цианиды проявляют восстановительные свойства. 48
 • Так, при нагревании их растворов они постепенно окисляются кислородом воздуха, образуя цианаты: +2 +4 2 CN- + O 2 = 2 СNО-, • а при кипячении растворов цианидов с серой образуются роданиды, +2 +4 СN- + S = СNS • На последней реакции основано получение роданидов: KCN + S (t) = KCNS. • 2 NH 3 + CS 2 + Ca(OH)2 = NH 4 NCS + Ca. S + H 2 O 49
• Так, при нагревании их растворов они постепенно окисляются кислородом воздуха, образуя цианаты: +2 +4 2 CN- + O 2 = 2 СNО-, • а при кипячении растворов цианидов с серой образуются роданиды, +2 +4 СN- + S = СNS • На последней реакции основано получение роданидов: KCN + S (t) = KCNS. • 2 NH 3 + CS 2 + Ca(OH)2 = NH 4 NCS + Ca. S + H 2 O 49
 Производные СNО- и СNS- называют соответственно цианатами и роданидами. Оксонитридокарбонат (IV) водорода НСNO в водном растворе (циановая кислота, К = 1, 2 10 -4) существует в виде таутомерных форм: . . H—O—C N O=C=N—Н изоциановая • Изомером является гремучая кислота H–C N O Сульфидонитридокарбонат (IV) водорода НNСS (роданид водорода H—S—С N — бесцветная очень неустойчивая маслянистая жидкость (Tпл. 5 °С). С водой смешивается в любых соотношениях, образуя сильную (типа НСl) роданистоводородную кислоту (К = 0, 14). Pb(CNS)2 + H 2 S (t) = Pb. S↓ + 2 HSCN • Роданиды в основном применяют при крашении тканей; 50 3+. NН 4 СNS используют как реактив на ноны Fе
Производные СNО- и СNS- называют соответственно цианатами и роданидами. Оксонитридокарбонат (IV) водорода НСNO в водном растворе (циановая кислота, К = 1, 2 10 -4) существует в виде таутомерных форм: . . H—O—C N O=C=N—Н изоциановая • Изомером является гремучая кислота H–C N O Сульфидонитридокарбонат (IV) водорода НNСS (роданид водорода H—S—С N — бесцветная очень неустойчивая маслянистая жидкость (Tпл. 5 °С). С водой смешивается в любых соотношениях, образуя сильную (типа НСl) роданистоводородную кислоту (К = 0, 14). Pb(CNS)2 + H 2 S (t) = Pb. S↓ + 2 HSCN • Роданиды в основном применяют при крашении тканей; 50 3+. NН 4 СNS используют как реактив на ноны Fе
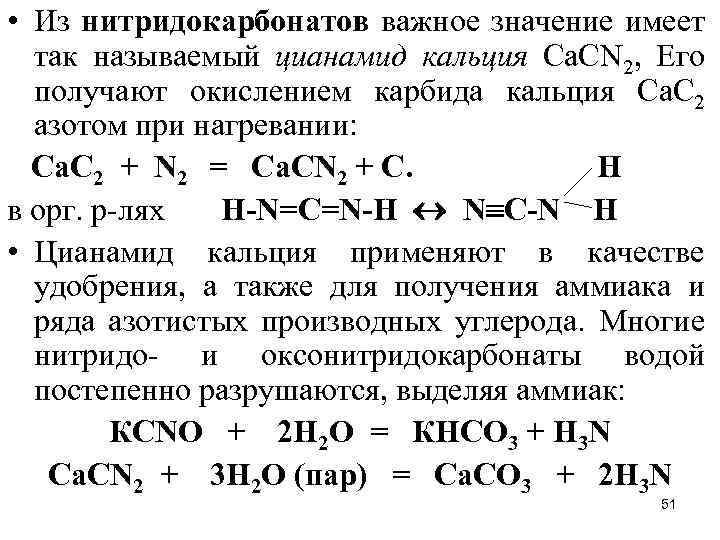 • Из нитридокарбонатов важное значение имеет так называемый цианамид кальция Са. СN 2, Его получают окислением карбида кальция Са. С 2 азотом при нагревании: Са. С 2 + N 2 = Са. СN 2 + С. H в орг. р-лях H-N=C=N-H N C-N H • Цианамид кальция применяют в качестве удобрения, а также для получения аммиака и ряда азотистых производных углерода. Многие нитридо- и оксонитридокарбонаты водой постепенно разрушаются, выделяя аммиак: КСNO + 2 Н 2 О = КНСО 3 + Н 3 N Са. СN 2 + 3 Н 2 О (пар) = Са. СО 3 + 2 Н 3 N 51
• Из нитридокарбонатов важное значение имеет так называемый цианамид кальция Са. СN 2, Его получают окислением карбида кальция Са. С 2 азотом при нагревании: Са. С 2 + N 2 = Са. СN 2 + С. H в орг. р-лях H-N=C=N-H N C-N H • Цианамид кальция применяют в качестве удобрения, а также для получения аммиака и ряда азотистых производных углерода. Многие нитридо- и оксонитридокарбонаты водой постепенно разрушаются, выделяя аммиак: КСNO + 2 Н 2 О = КНСО 3 + Н 3 N Са. СN 2 + 3 Н 2 О (пар) = Са. СО 3 + 2 Н 3 N 51
 • Четыреххлористый углерод (тетрахлорметан) CCl 4. Бесцветная жидкость с характерным запахом. Ткип. 76, 5 о. С, Тплав. – 23 о. С, d 20= 1, 524 г/см 3. Не растворим в воде. Очень хороший растворитель каучука, жиров, масел, смол и других веществ. Применяется как средство для выведения пятен с тканей. Так как тетрахлорметан негорюч, его используют в специальных огнетушителях для гашения пламени в тех случаях, когда применение обычных щелочнокислотных огнетушителей может вызвать порчу ценной аппаратуры, приборов и т. п. 52
• Четыреххлористый углерод (тетрахлорметан) CCl 4. Бесцветная жидкость с характерным запахом. Ткип. 76, 5 о. С, Тплав. – 23 о. С, d 20= 1, 524 г/см 3. Не растворим в воде. Очень хороший растворитель каучука, жиров, масел, смол и других веществ. Применяется как средство для выведения пятен с тканей. Так как тетрахлорметан негорюч, его используют в специальных огнетушителях для гашения пламени в тех случаях, когда применение обычных щелочнокислотных огнетушителей может вызвать порчу ценной аппаратуры, приборов и т. п. 52
 • Дифтордихлорметан (фреон-12) CF 2 Cl 2. Представитель смешанных полигалогенпроизводных. В обычных условиях представляет собой бесцветный газ, не имеющий запаха и вкуса. Легко сгущается в жидкость с Ткип. -30 о. С, Тплав. -155 о. С. Относится к группе так называемых хладонов (фреонов), которые в технике используют в качестве хладагентов в холодильных машинах вместо аммиака, в бытовых холодильниках. 53
• Дифтордихлорметан (фреон-12) CF 2 Cl 2. Представитель смешанных полигалогенпроизводных. В обычных условиях представляет собой бесцветный газ, не имеющий запаха и вкуса. Легко сгущается в жидкость с Ткип. -30 о. С, Тплав. -155 о. С. Относится к группе так называемых хладонов (фреонов), которые в технике используют в качестве хладагентов в холодильных машинах вместо аммиака, в бытовых холодильниках. 53
 • Преимуществом фреонов является их нетоксичность. Как уже указано, два атома фтора при одном углеродном атоме весьма неактивны, причем под их влиянием теряют активность и находящиеся при этом же углероде атомы другого галогена, в данном случае хлора. Дифтордихлорметан получают из черыреххлористого углерода при действии на него трехфтористой сурьмы: 3 CCl 4 + 2 Sb. F 3 → 3 CF 2 Cl 2 + 2 Sb. Cl 3 54
• Преимуществом фреонов является их нетоксичность. Как уже указано, два атома фтора при одном углеродном атоме весьма неактивны, причем под их влиянием теряют активность и находящиеся при этом же углероде атомы другого галогена, в данном случае хлора. Дифтордихлорметан получают из черыреххлористого углерода при действии на него трехфтористой сурьмы: 3 CCl 4 + 2 Sb. F 3 → 3 CF 2 Cl 2 + 2 Sb. Cl 3 54


