Л 8 Т 4 Азот.ppt
- Количество слайдов: 50
 Т 4 Л 8 p-ЭЛЕМЕНТЫ V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Элементы главной подгруппы V группы — азот N, фосфор Р, мышьяк Аs; сурьма Sb, висмут Вi. Их электронные конфигурации: N 1 s 22 p 3 P 2 s 22 p 63 s 23 p 3 As 3 s 23 p 63 d 104 s 24 p 3 Sb 4 s 24 p 64 d 105 s 25 p 3 Bi 5 s 25 p 65 d 106 s 26 p 3 1
Т 4 Л 8 p-ЭЛЕМЕНТЫ V ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Элементы главной подгруппы V группы — азот N, фосфор Р, мышьяк Аs; сурьма Sb, висмут Вi. Их электронные конфигурации: N 1 s 22 p 3 P 2 s 22 p 63 s 23 p 3 As 3 s 23 p 63 d 104 s 24 p 3 Sb 4 s 24 p 64 d 105 s 25 p 3 Bi 5 s 25 p 65 d 106 s 26 p 3 1
 Азот • Азот (Is 22 р3) типичный неметаллический элемент, по электроотрицательности (3, 0) уступает лишь фтору(4, 0) и кислороду(3, 5). • Как и у других р-элементов 2 -го периода, у азота четыре валентные орбитали могут находиться в состоянии sр, sр2 или sр3 -гибридизации. При первых двух гибридных состояниях возможно образование соответственно и одной или двух -связей. Степени окисления азота в соединениях – 3, – 1, +3, +5, а также +2 и +4. 2
Азот • Азот (Is 22 р3) типичный неметаллический элемент, по электроотрицательности (3, 0) уступает лишь фтору(4, 0) и кислороду(3, 5). • Как и у других р-элементов 2 -го периода, у азота четыре валентные орбитали могут находиться в состоянии sр, sр2 или sр3 -гибридизации. При первых двух гибридных состояниях возможно образование соответственно и одной или двух -связей. Степени окисления азота в соединениях – 3, – 1, +3, +5, а также +2 и +4. 2
 • Природный азот состоит из двух устойчивых изотопов: 14 N (99, 635 %) и 15 N (0, 365 %). Основная масса его входит в состав атмосферы (78, об. долей, %) в виде простого вещества. Из минералов промышленное значение имеют чилийская Nа. NО 3 и индийская КNО 3 селитры. Азот входит в состав белковых тел всех растительных и животных организмов, обнаружен в газовых туманностях и солнечной атмосфере, на Уране и Нептуне и др. 3
• Природный азот состоит из двух устойчивых изотопов: 14 N (99, 635 %) и 15 N (0, 365 %). Основная масса его входит в состав атмосферы (78, об. долей, %) в виде простого вещества. Из минералов промышленное значение имеют чилийская Nа. NО 3 и индийская КNО 3 селитры. Азот входит в состав белковых тел всех растительных и животных организмов, обнаружен в газовых туманностях и солнечной атмосфере, на Уране и Нептуне и др. 3
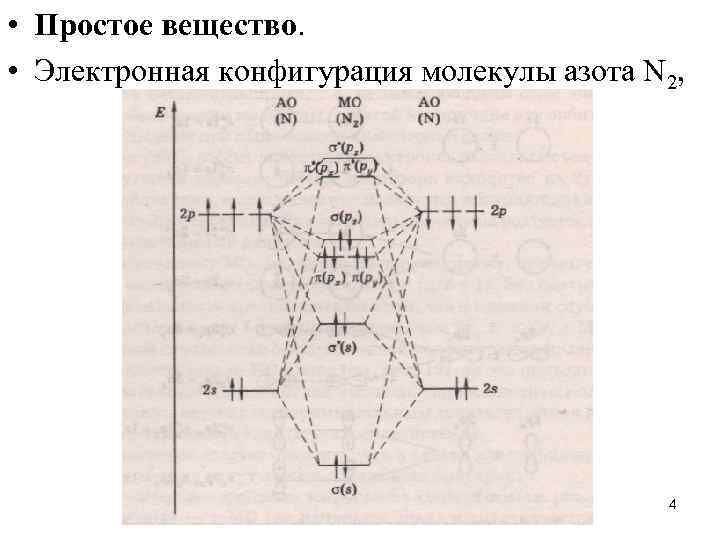 • Простое вещество. • Электронная конфигурация молекулы азота N 2, 4
• Простое вещество. • Электронная конфигурация молекулы азота N 2, 4
 • Вследствие прочности молекулы N 2 многие соединения азота эндотермичны. Кроме того, энтропия их образования отрицательна (N 2 - газ). Отсюда молекулярный азот химически малоактивен, а соединения азота термически малоустойчивы и относительно легко разлагаются при нагревании. Поэтому азот на Земле находится главным образом в свободном состоянии. • Основная масса получаемого азота используется для синтеза аммиака; азот применяют также для создания инертной атмосферы в химических и других производствах. 5
• Вследствие прочности молекулы N 2 многие соединения азота эндотермичны. Кроме того, энтропия их образования отрицательна (N 2 - газ). Отсюда молекулярный азот химически малоактивен, а соединения азота термически малоустойчивы и относительно легко разлагаются при нагревании. Поэтому азот на Земле находится главным образом в свободном состоянии. • Основная масса получаемого азота используется для синтеза аммиака; азот применяют также для создания инертной атмосферы в химических и других производствах. 5
 • N 2 - Тпл. (-210, 0 °С), Ткип. (-195, 8 °С); он плохо растворяется в воде и других растворителях. • В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li 3 N. При активации молекул N 2 (нагреванием, действием электроразряда или ионизирующих излучений) азот обычно выступает как окислитель и лишь при взаимодействии с фтором и кислородом — как восстановитель. • В промышленности азот получают фракционированной перегонкой жидкого воздуха, в лаборатории — термическим разложением соединений, чаще всего NH 4 NO 2; N-3 H 4 N+3 O 2 = N 20 + 2 H 2 O 6
• N 2 - Тпл. (-210, 0 °С), Ткип. (-195, 8 °С); он плохо растворяется в воде и других растворителях. • В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием Li 3 N. При активации молекул N 2 (нагреванием, действием электроразряда или ионизирующих излучений) азот обычно выступает как окислитель и лишь при взаимодействии с фтором и кислородом — как восстановитель. • В промышленности азот получают фракционированной перегонкой жидкого воздуха, в лаборатории — термическим разложением соединений, чаще всего NH 4 NO 2; N-3 H 4 N+3 O 2 = N 20 + 2 H 2 O 6
 • Точнее смешением растворов NH 4 Сl и Na. NO 2 при нагревании: NH 4 Сl + Na. NO 2 = NH 4 NO 2 + Na. Сl t NH 4 NO 2 = N 2 + 2 H 2 O Особо чистый азот получают термическим разложением азида натрия 2 Na. N 3 = 2 Na + 3 N 2 • А также при нагревании в реакциях: (NH 4)2 Cr 2 O 3 = N 2 + Cr 2 O 3 + 4 H 2 O; 2 N 2 O = 2 N 2 + O 2; 3 Cu. O + 2 NH 3 = N 2 + 3 Cu + 3 H 2 O. 7
• Точнее смешением растворов NH 4 Сl и Na. NO 2 при нагревании: NH 4 Сl + Na. NO 2 = NH 4 NO 2 + Na. Сl t NH 4 NO 2 = N 2 + 2 H 2 O Особо чистый азот получают термическим разложением азида натрия 2 Na. N 3 = 2 Na + 3 N 2 • А также при нагревании в реакциях: (NH 4)2 Cr 2 O 3 = N 2 + Cr 2 O 3 + 4 H 2 O; 2 N 2 O = 2 N 2 + O 2; 3 Cu. O + 2 NH 3 = N 2 + 3 Cu + 3 H 2 O. 7
 Соединения со степенью окисления азота — 3. При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды: 3 Mg + N 2 = Mg 3 N 2; 2 B + N 2 = 2 BN; 3 H 2 + N 2 = 2 H 3 N. Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Например, в малых периодах наблюдается переход от основных нитридов к кислотным: Na 3 N Mg 3 N 2 Al. N Si 3 N 4 P 3 N 5 S 4 N 4 Cl 3 N 8 основные амфотерные кислотные
Соединения со степенью окисления азота — 3. При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды: 3 Mg + N 2 = Mg 3 N 2; 2 B + N 2 = 2 BN; 3 H 2 + N 2 = 2 H 3 N. Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Например, в малых периодах наблюдается переход от основных нитридов к кислотным: Na 3 N Mg 3 N 2 Al. N Si 3 N 4 P 3 N 5 S 4 N 4 Cl 3 N 8 основные амфотерные кислотные
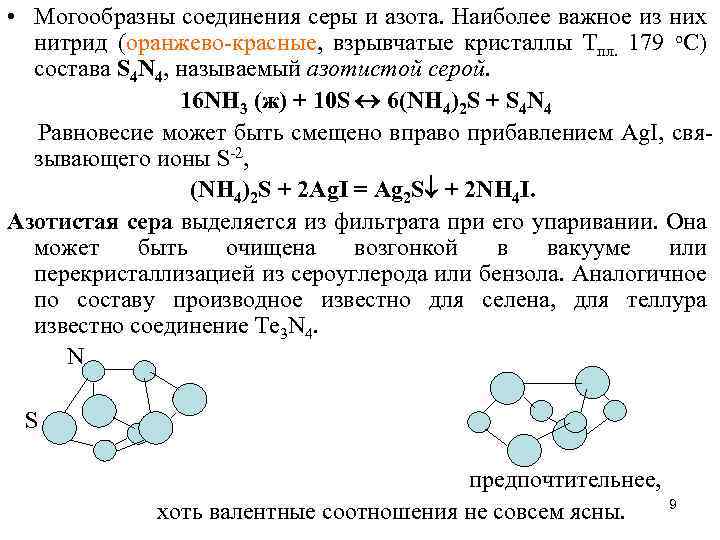 • Могообразны соединения серы и азота. Наиболее важное из них нитрид (оранжево-красные, взрывчатые кристаллы Тпл. 179 о. С) состава S 4 N 4, называемый азотистой серой. 16 NH 3 (ж) + 10 S 6(NH 4)2 S + S 4 N 4 Равновесие может быть смещено вправо прибавлением Ag. I, связывающего ионы S-2, (NH 4)2 S + 2 Ag. I = Ag 2 S + 2 NH 4 I. Азотистая сера выделяется из фильтрата при его упаривании. Она может быть очищена возгонкой в вакууме или перекристаллизацией из сероуглерода или бензола. Аналогичное по составу производное известно для селена, для теллура известно соединение Te 3 N 4. N S предпочтительнее, хоть валентные соотношения не совсем ясны. 9
• Могообразны соединения серы и азота. Наиболее важное из них нитрид (оранжево-красные, взрывчатые кристаллы Тпл. 179 о. С) состава S 4 N 4, называемый азотистой серой. 16 NH 3 (ж) + 10 S 6(NH 4)2 S + S 4 N 4 Равновесие может быть смещено вправо прибавлением Ag. I, связывающего ионы S-2, (NH 4)2 S + 2 Ag. I = Ag 2 S + 2 NH 4 I. Азотистая сера выделяется из фильтрата при его упаривании. Она может быть очищена возгонкой в вакууме или перекристаллизацией из сероуглерода или бензола. Аналогичное по составу производное известно для селена, для теллура известно соединение Te 3 N 4. N S предпочтительнее, хоть валентные соотношения не совсем ясны. 9
 • Нитриды s-элементов I и II групп, например Li 3 N и Мg 3 N 2 — кристаллические вещества. При температуре выше 300 o. С разлагаются. Нитриды этого типа химически довольно активны. Они, например, легко разлагаются водой, образуя щелочь и аммиак: Li 3 N + 3 HOH = 3 Li. OH + H 3 N основный • Нитриды BN, Al. N и Si 3 N 4, Gе 3 N 4 — твердые полимерные вещества с высокими температурами плавления (2000— 3000 °С); они либо диэлектрики, либо полупроводники. Устойчивы 10 к действию воды и кислот.
• Нитриды s-элементов I и II групп, например Li 3 N и Мg 3 N 2 — кристаллические вещества. При температуре выше 300 o. С разлагаются. Нитриды этого типа химически довольно активны. Они, например, легко разлагаются водой, образуя щелочь и аммиак: Li 3 N + 3 HOH = 3 Li. OH + H 3 N основный • Нитриды BN, Al. N и Si 3 N 4, Gе 3 N 4 — твердые полимерные вещества с высокими температурами плавления (2000— 3000 °С); они либо диэлектрики, либо полупроводники. Устойчивы 10 к действию воды и кислот.
 • Соединения азота с галогенами NГ 3, за исключением NF 3, нестойкие, разлагаются со взрывом (нитриды галогенов — эндотермические соединения). В свободном состоянии выделен лишь жидкий Сl 3 N (Тпл. -27 о. С) легко разлагающийся со взрывом. NH 4 Cl + 3 Cl 2 = 4 HCl + NCl 3 По химической природе это кислотное соединение: Cl 3 N + H 2 O = 3 HCl. O + H 3 N кислотный Фторид азота получают электролизом расплава NH 4 HF 2 или: 4 NH 3 + 3 F 2 = 3 NH 4 F + NF 3 – бесцветный газ (Ткип. -129 о. С), с водой при комнатной температуре не реагирует, при нагревании взаимодействует NF 3 + 3 Н 2 = 6 НF + N 2 11
• Соединения азота с галогенами NГ 3, за исключением NF 3, нестойкие, разлагаются со взрывом (нитриды галогенов — эндотермические соединения). В свободном состоянии выделен лишь жидкий Сl 3 N (Тпл. -27 о. С) легко разлагающийся со взрывом. NH 4 Cl + 3 Cl 2 = 4 HCl + NCl 3 По химической природе это кислотное соединение: Cl 3 N + H 2 O = 3 HCl. O + H 3 N кислотный Фторид азота получают электролизом расплава NH 4 HF 2 или: 4 NH 3 + 3 F 2 = 3 NH 4 F + NF 3 – бесцветный газ (Ткип. -129 о. С), с водой при комнатной температуре не реагирует, при нагревании взаимодействует NF 3 + 3 Н 2 = 6 НF + N 2 11
 • Весьма разнообразны нитриды d-элементов, Это кристаллические вещества переменного состава. Чаще всего встречаются нитриды типа МN (Тi. N, VN, Сr. N), М 2 N (Nb. N, Сr 2 N, Мо 2 N). Они проявляют металлические свойства: имеют металлический блеск и электронную проводимость. Нитриды этого типа отличаются высокой твердостью и тугоплавкостью часто превышающей тугоплавкость исходного металла. Большинство из нитридов d-элементов химически очень стойки: не разрушаются водой, растворами кислот, расплавлёнными металлами, устойчивы против окисления на воздухе. Перечисленные особенности позволяют использовать нитриды в качестве высокопрочных материалов. • Получены также бинарные нитриды d-элементов, по составу отвечающие обычным степеням окисления 12 элементов, например Zr 3 N 4, Та 3 N 5.
• Весьма разнообразны нитриды d-элементов, Это кристаллические вещества переменного состава. Чаще всего встречаются нитриды типа МN (Тi. N, VN, Сr. N), М 2 N (Nb. N, Сr 2 N, Мо 2 N). Они проявляют металлические свойства: имеют металлический блеск и электронную проводимость. Нитриды этого типа отличаются высокой твердостью и тугоплавкостью часто превышающей тугоплавкость исходного металла. Большинство из нитридов d-элементов химически очень стойки: не разрушаются водой, растворами кислот, расплавлёнными металлами, устойчивы против окисления на воздухе. Перечисленные особенности позволяют использовать нитриды в качестве высокопрочных материалов. • Получены также бинарные нитриды d-элементов, по составу отвечающие обычным степеням окисления 12 элементов, например Zr 3 N 4, Та 3 N 5.
 • Взаимодействие основного и кислотного нитридов приводит к образованию смешанных нитридов, например Li 3 Аl. N 2, Li 5 Gе. N 3, Li 5 Тi. N 3, Li 9 WN 5: • Li 3 N + Al. N = Li. Al. N 2 • 5 Li 3 N + Ge 3 N 4 = 3 Li 3 Ge. N 2 основный кислотный 13
• Взаимодействие основного и кислотного нитридов приводит к образованию смешанных нитридов, например Li 3 Аl. N 2, Li 5 Gе. N 3, Li 5 Тi. N 3, Li 9 WN 5: • Li 3 N + Al. N = Li. Al. N 2 • 5 Li 3 N + Ge 3 N 4 = 3 Li 3 Ge. N 2 основный кислотный 13
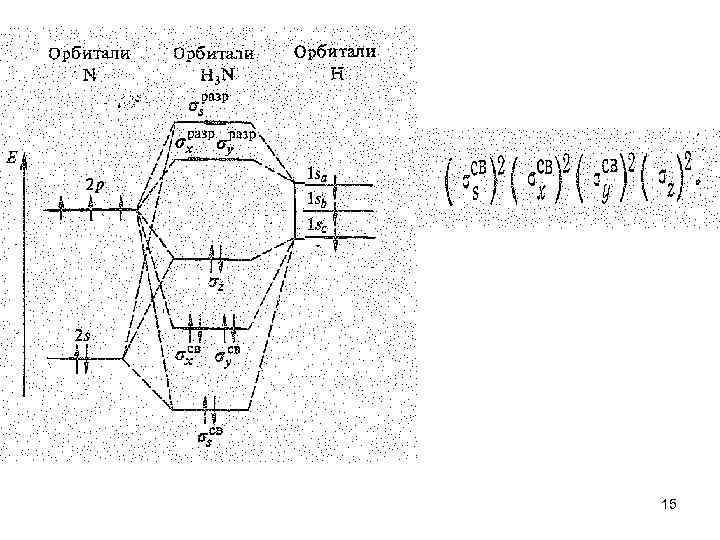
 • Из ковалентных нитридов наибольшее практическое значение имеет нитрид водорода Н 3 N — аммиак. В обычных условиях это бесцветный газ с резким удушающим запахом. Молекула Н 3 N имеет форму тригональной пирамиды. Согласно теории валентных связей атом азота в молекуле Н 3 N находится в состоянии sр3 -гибридизации. Из четырех sр3 -гибридных орбиталей азота три участвуют в образовании трех -связей N—Н, а четвертую орбиталь занимает несвязывающая электронная пара. В терминах орбиталей теории молекулярных орбиталей это соответствует заполнению трех связывающих и одной почти несвязывающей 14 молекулярной -орбитали:
• Из ковалентных нитридов наибольшее практическое значение имеет нитрид водорода Н 3 N — аммиак. В обычных условиях это бесцветный газ с резким удушающим запахом. Молекула Н 3 N имеет форму тригональной пирамиды. Согласно теории валентных связей атом азота в молекуле Н 3 N находится в состоянии sр3 -гибридизации. Из четырех sр3 -гибридных орбиталей азота три участвуют в образовании трех -связей N—Н, а четвертую орбиталь занимает несвязывающая электронная пара. В терминах орбиталей теории молекулярных орбиталей это соответствует заполнению трех связывающих и одной почти несвязывающей 14 молекулярной -орбитали:
 15
15
 • Поэтому молекула Н 3 N — резко выраженный донор электронной пары и обладает высокой полярностью ( = 0, 49 10 -29 Кл м). • Полярность связи N–Н обусловливает между молекулами Н 3 N водородную связь. Поэтому температуры плавления (-77, 75 °С) и кипения ( -33, 42 °С) аммиака довольно высоки, он характеризуется значительной энтальпией испарения и легко сжижается. На этом основано его применение в холодильных машинах. Жидкий аммиак хранят в стальных баллонах. 16
• Поэтому молекула Н 3 N — резко выраженный донор электронной пары и обладает высокой полярностью ( = 0, 49 10 -29 Кл м). • Полярность связи N–Н обусловливает между молекулами Н 3 N водородную связь. Поэтому температуры плавления (-77, 75 °С) и кипения ( -33, 42 °С) аммиака довольно высоки, он характеризуется значительной энтальпией испарения и легко сжижается. На этом основано его применение в холодильных машинах. Жидкий аммиак хранят в стальных баллонах. 16
![• Собственная ионизация аммиака ничтожно мала, и ионное произведение аммиака [NН 4+] [NН • Собственная ионизация аммиака ничтожно мала, и ионное произведение аммиака [NН 4+] [NН](https://present5.com/presentation/33311487_173390720/image-17.jpg) • Собственная ионизация аммиака ничтожно мала, и ионное произведение аммиака [NН 4+] [NН 2 -] составляет всего лишь 2 10 -33 (при -50 °С). 17
• Собственная ионизация аммиака ничтожно мала, и ионное произведение аммиака [NН 4+] [NН 2 -] составляет всего лишь 2 10 -33 (при -50 °С). 17
 • Жидкий аммиак, как и вода, сильный ионизирующий растворитель. При этом производные NН 4+ в жидком аммиаке (подобно производным ОН 3+ в воде) ведут себя как кислоты – аммонокислоты), а производные NН 2(подобно производным ОН- в воде) — как основания (аммонооснования). Например, сильными кислотами в жидком аммиаке являются NН 4 Сl, NН 4 NO 3, а основаниями КNН 2 Ва(NН 2)2. Дигидронитриды Zn(NН 2)2, А 1(NН 2)3 ведут себя как амфотерные соединения. • Производные NН 2 - называются также амидами, а производные NН 2 - — имидами, N 3 - – нитридами. • Жидкий аммиак как растворитель широко применяется для проведения различных синтезов. 18
• Жидкий аммиак, как и вода, сильный ионизирующий растворитель. При этом производные NН 4+ в жидком аммиаке (подобно производным ОН 3+ в воде) ведут себя как кислоты – аммонокислоты), а производные NН 2(подобно производным ОН- в воде) — как основания (аммонооснования). Например, сильными кислотами в жидком аммиаке являются NН 4 Сl, NН 4 NO 3, а основаниями КNН 2 Ва(NН 2)2. Дигидронитриды Zn(NН 2)2, А 1(NН 2)3 ведут себя как амфотерные соединения. • Производные NН 2 - называются также амидами, а производные NН 2 - — имидами, N 3 - – нитридами. • Жидкий аммиак как растворитель широко применяется для проведения различных синтезов. 18
 • Жидкий H 3 N уникальный растворитель. В нем растворяется ряд активных металлов – щелочные, щелочноземельные, Mg, Al, Eu и Yb, а так же некоторые интерметаллиды, содержащие щелочные металлы (Na 4 Pb 9). Разбавленные растворы металлов в H 3 N имеют синию окраску, концентрированные р-ры обладают металлической проводимостью, металлическим блеском и бронзовой окраской. При испарении H 3 N щелочные металлы выделяются снова в чистом виде, а щелочноземельные в виде комплексов [Э(NH 3)6]0 (обладают металлической проводимостью и по внешнему виду похожи на бронзу). При слабом нагревании эти комплексы также разлагаются на металл и H 3 N. • Растворенный в H 3 N металл постепенно реагирует с образованием амида: 2 Na + 2 NH 3 = 2 Na. NH 2 + H 2. Взаимодействие с аммонокислотой: 19 Mg + 2 NH 4 Cl + 4 H 3 N = [Mg(NH 3)6]Cl 2 + H 2
• Жидкий H 3 N уникальный растворитель. В нем растворяется ряд активных металлов – щелочные, щелочноземельные, Mg, Al, Eu и Yb, а так же некоторые интерметаллиды, содержащие щелочные металлы (Na 4 Pb 9). Разбавленные растворы металлов в H 3 N имеют синию окраску, концентрированные р-ры обладают металлической проводимостью, металлическим блеском и бронзовой окраской. При испарении H 3 N щелочные металлы выделяются снова в чистом виде, а щелочноземельные в виде комплексов [Э(NH 3)6]0 (обладают металлической проводимостью и по внешнему виду похожи на бронзу). При слабом нагревании эти комплексы также разлагаются на металл и H 3 N. • Растворенный в H 3 N металл постепенно реагирует с образованием амида: 2 Na + 2 NH 3 = 2 Na. NH 2 + H 2. Взаимодействие с аммонокислотой: 19 Mg + 2 NH 4 Cl + 4 H 3 N = [Mg(NH 3)6]Cl 2 + H 2
 Na. NH 2 + H 2 O = Na. OH + NH 3. (Tпл. 210 о. С, Тисп. 400 о. С ) • Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и электроны, причем и те и другие сольватированы молекулами H 3 N. Часть атомов остается в недиссоциированном состоянии. • Na Na+ + e K 1 = 9, 9 10 -3 • Na + e Na- K 2 = 9, 7 10 -4 • Электрон, находящийся в жидком H 3 N являясь, согласно соотношению неопределенностей, нелокализуемой частицей, образует вокруг себя полость радиусом ~300 пм. Этот факт установлен различными независимыми методами (измерение плотности растворов, ЭПР). • Металлоаммиачные растворы, в которых «плавают» несвязанные с атомами электроны, являются сильнейшими восстановителями. 20
Na. NH 2 + H 2 O = Na. OH + NH 3. (Tпл. 210 о. С, Тисп. 400 о. С ) • Металлоаммиачные растворы обладают металлической электропроводностью, в них происходит распад атомов металла на положительные ионы и электроны, причем и те и другие сольватированы молекулами H 3 N. Часть атомов остается в недиссоциированном состоянии. • Na Na+ + e K 1 = 9, 9 10 -3 • Na + e Na- K 2 = 9, 7 10 -4 • Электрон, находящийся в жидком H 3 N являясь, согласно соотношению неопределенностей, нелокализуемой частицей, образует вокруг себя полость радиусом ~300 пм. Этот факт установлен различными независимыми методами (измерение плотности растворов, ЭПР). • Металлоаммиачные растворы, в которых «плавают» несвязанные с атомами электроны, являются сильнейшими восстановителями. 20
 • Аммиак очень хорошо растворяется в воде (при 20 °С в одном объеме Н 2 О растворяется около 700 объемов Н 3 N). Хорошая растворимость объясняется образованием водородной связи между молекулами Н 3 N и Н 2 О. Поскольку молекула Н 3 N — лучший акцептор протона, чем Н 2 О, то в растворе имеет место ионизация: • Появление ионов ОН- создает щелочную среду раствора. Но, как видно из константы ионизации реакция протекает в незначительной степени. • В 1 М р-ре ионизируется всего лишь 0, 4% молекул Н 3 N и Н 2 О 21
• Аммиак очень хорошо растворяется в воде (при 20 °С в одном объеме Н 2 О растворяется около 700 объемов Н 3 N). Хорошая растворимость объясняется образованием водородной связи между молекулами Н 3 N и Н 2 О. Поскольку молекула Н 3 N — лучший акцептор протона, чем Н 2 О, то в растворе имеет место ионизация: • Появление ионов ОН- создает щелочную среду раствора. Но, как видно из константы ионизации реакция протекает в незначительной степени. • В 1 М р-ре ионизируется всего лишь 0, 4% молекул Н 3 N и Н 2 О 21
 При взаимодействии ионов NН 4+ и ОН- вновь образуются молекулы Н 3 N и Н 2 O, между которыми имеет место водородная связь. Следовательно, ионное соединение NН 4 ОН (гидроксид аммония) не существует, как не существуют гидроксид оксония ОН 3 ОН и дигидронитрид аммония NН 4 NН 2. Почти все соли аммония хорошо растворимы и полностью диссоциируют в воде. При нагревании разлагаются, выделяя аммиак, если кислотный остаток не окислитель: t N-3 H 4 Cl = N-3 H 3 + HCl (N-3 H 4)2 CO 3 = 2 N-3 H 3 + CO 2 + H 2 O (N-3 H 4)2 HPO 4 = 2 N-3 H 3 + H 3 PO 4 (N-3 H 4)2 SO 4 = N-3 H 3 + N-3 H 4 HSO 4 (360 о. С) 22
При взаимодействии ионов NН 4+ и ОН- вновь образуются молекулы Н 3 N и Н 2 O, между которыми имеет место водородная связь. Следовательно, ионное соединение NН 4 ОН (гидроксид аммония) не существует, как не существуют гидроксид оксония ОН 3 ОН и дигидронитрид аммония NН 4 NН 2. Почти все соли аммония хорошо растворимы и полностью диссоциируют в воде. При нагревании разлагаются, выделяя аммиак, если кислотный остаток не окислитель: t N-3 H 4 Cl = N-3 H 3 + HCl (N-3 H 4)2 CO 3 = 2 N-3 H 3 + CO 2 + H 2 O (N-3 H 4)2 HPO 4 = 2 N-3 H 3 + H 3 PO 4 (N-3 H 4)2 SO 4 = N-3 H 3 + N-3 H 4 HSO 4 (360 о. С) 22
 Если анионы кислотного остатка окислители, то при сильном нагревании: N-3 H 4 N+3 O 2 = N 20 + 2 H 2 O; N-3 H 4 N+5 O 3 = N 2+1 O + 2 H 2 O (170 о. С) или 2 N-3 H 4 N+5 O 3 = 2 N 2 + O 2 + 4 H 2 O (210 о. С); 3(N-3 H 4)2 S+6 O 4 = 4 NH 3 + 3 S+4 O 2 + N 2 + 6 H 2 O. (N-3 H 4)2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4 H 2 O. 23
Если анионы кислотного остатка окислители, то при сильном нагревании: N-3 H 4 N+3 O 2 = N 20 + 2 H 2 O; N-3 H 4 N+5 O 3 = N 2+1 O + 2 H 2 O (170 о. С) или 2 N-3 H 4 N+5 O 3 = 2 N 2 + O 2 + 4 H 2 O (210 о. С); 3(N-3 H 4)2 S+6 O 4 = 4 NH 3 + 3 S+4 O 2 + N 2 + 6 H 2 O. (N-3 H 4)2 Cr 2 O 7 = N 2 + Cr 2 O 3 + 4 H 2 O. 23
 • При нагревании аммиак проявляет восстановительные свойства, окисляясь (горит в кислороде) обычно до свободного азота: 4 H 3 N-3 + 3 O 2 = 2 N 20 + 6 H 2 O • На воздухе зажечь струю Н 3 N невозможно, однако каталитическое окисление аммиака кислородом воздуха происходит и используется в производстве HNO 3 Pt 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O • Аммиак взаимодействует с хлором: 4 H 3 N + 3 Cl 2 = 2 N 2 + 6 HCl (при избытке NH 3 образуется не HCl, а NH 4 Cl). NH 3 имеет производные, в которых атомы водорода заменены на металл, галоген или группу ОН. Известны амиды (NH 2 -), имиды (NH-2), нитриды (N-3). Многие нитриды получают нагреванием металлов в атмосфере азота. 24
• При нагревании аммиак проявляет восстановительные свойства, окисляясь (горит в кислороде) обычно до свободного азота: 4 H 3 N-3 + 3 O 2 = 2 N 20 + 6 H 2 O • На воздухе зажечь струю Н 3 N невозможно, однако каталитическое окисление аммиака кислородом воздуха происходит и используется в производстве HNO 3 Pt 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O • Аммиак взаимодействует с хлором: 4 H 3 N + 3 Cl 2 = 2 N 2 + 6 HCl (при избытке NH 3 образуется не HCl, а NH 4 Cl). NH 3 имеет производные, в которых атомы водорода заменены на металл, галоген или группу ОН. Известны амиды (NH 2 -), имиды (NH-2), нитриды (N-3). Многие нитриды получают нагреванием металлов в атмосфере азота. 24
 • В промышленности аммиак получают синтезом из простых веществ: 1/2 N 2 (г) + 3/2 H 2 (г) H 3 N (г) H 0298 = -46, 19 к. Дж/моль S 0298 = -398, 9 Дж/моль град. • Поскольку энтальпия образования аммиака невелика, а его синтез сопровождается уменьшением энтропии в соответствии с принципом Ле Шателье, процесс проводят при высоком давлении (107 108 Па). Для ускорения реакции применяют катализатор. В качества катализатора наибольшую активность проявляют простые вещества элементов подгруппы железа. В технике обычно применяют железный катализатор (с добавлением активаторов). Процесс ведут при 400 — 500 °С. 25
• В промышленности аммиак получают синтезом из простых веществ: 1/2 N 2 (г) + 3/2 H 2 (г) H 3 N (г) H 0298 = -46, 19 к. Дж/моль S 0298 = -398, 9 Дж/моль град. • Поскольку энтальпия образования аммиака невелика, а его синтез сопровождается уменьшением энтропии в соответствии с принципом Ле Шателье, процесс проводят при высоком давлении (107 108 Па). Для ускорения реакции применяют катализатор. В качества катализатора наибольшую активность проявляют простые вещества элементов подгруппы железа. В технике обычно применяют железный катализатор (с добавлением активаторов). Процесс ведут при 400 — 500 °С. 25
 • Аммиак выделяется также при коксовании каменного угля. В лаборатории его получают действием щелочей на аммонийные соли. t 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + NH 3 + 2 H 2 O • Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений – жидкого аммиака, его водных растворов, NН 4 NО 3, (NН 4)2 SО 4 и др. Водный раствор аммиака (аммиачная вода) — важный реактив для проведения различных реакций. 26
• Аммиак выделяется также при коксовании каменного угля. В лаборатории его получают действием щелочей на аммонийные соли. t 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + NH 3 + 2 H 2 O • Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений – жидкого аммиака, его водных растворов, NН 4 NО 3, (NН 4)2 SО 4 и др. Водный раствор аммиака (аммиачная вода) — важный реактив для проведения различных реакций. 26
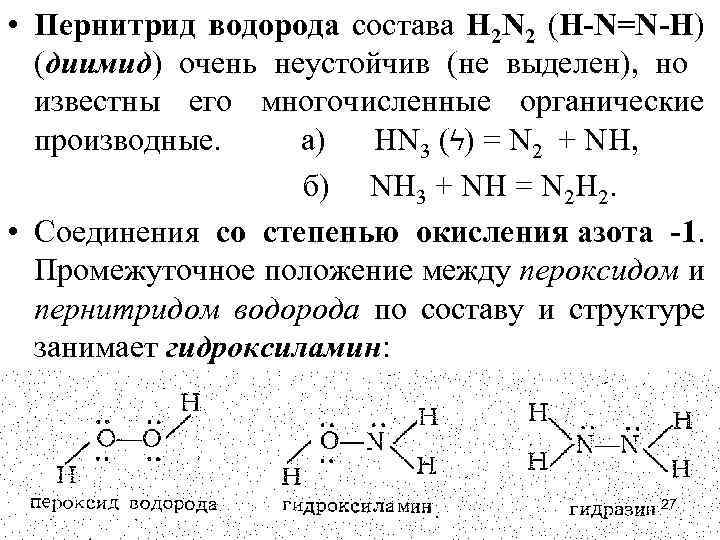 • Пернитрид водорода состава Н 2 N 2 (H-N=N-H) (диимид) очень неустойчив (не выделен), но известны его многочисленные органические производные. а) HN 3 (ϟ) = N 2 + NH, б) NH 3 + NH = N 2 H 2. • Соединения со степенью окисления азота -1. Промежуточное положение между пероксидом и пернитридом водорода по составу и структуре занимает гидроксиламин: • 27
• Пернитрид водорода состава Н 2 N 2 (H-N=N-H) (диимид) очень неустойчив (не выделен), но известны его многочисленные органические производные. а) HN 3 (ϟ) = N 2 + NH, б) NH 3 + NH = N 2 H 2. • Соединения со степенью окисления азота -1. Промежуточное положение между пероксидом и пернитридом водорода по составу и структуре занимает гидроксиламин: • 27
 • В ряду Н 2 О 2—NН 2 OН—Н 4 N 2 окислительная активность падает, а восстановительная возрастает. Так, если для Н 2 O 2 наиболее характерны окислительные свойства, а для Н 4 N 2 — восстановительные, то NН 2 OН в щелочной среде является сильным восстановителем (N 2, N 2 O), а в кислой среде отчетливо проявляет окислительные свойства (NH 3, NH 4+). Получают гидроксиламин электролизом HNO 3 (свинцовый катод). HNO 3 + 6 H+ + 6 e- = NH 2 OH + 2 H 2 O. • Как и пероксид водорода, NН 2 OН легко разлагается (в особенности при нагревании) по механизму диспропорционирования: 3 N-1 H 2 OH = H 3 N-3 + N 20 + 3 H 2 O Подобно NH 3 гидроксиламин реагирует с кислотами, образуя соли гидроксиламмония: NН 2 OН + HCl = [NH 3 OH]Cl (NH 2 OH HCl ) 28
• В ряду Н 2 О 2—NН 2 OН—Н 4 N 2 окислительная активность падает, а восстановительная возрастает. Так, если для Н 2 O 2 наиболее характерны окислительные свойства, а для Н 4 N 2 — восстановительные, то NН 2 OН в щелочной среде является сильным восстановителем (N 2, N 2 O), а в кислой среде отчетливо проявляет окислительные свойства (NH 3, NH 4+). Получают гидроксиламин электролизом HNO 3 (свинцовый катод). HNO 3 + 6 H+ + 6 e- = NH 2 OH + 2 H 2 O. • Как и пероксид водорода, NН 2 OН легко разлагается (в особенности при нагревании) по механизму диспропорционирования: 3 N-1 H 2 OH = H 3 N-3 + N 20 + 3 H 2 O Подобно NH 3 гидроксиламин реагирует с кислотами, образуя соли гидроксиламмония: NН 2 OН + HCl = [NH 3 OH]Cl (NH 2 OH HCl ) 28
 • Гидроксиламин может быть и восстановителем (выделяется N 2 или N 2 O) и окислителем, когда он восстанавливается до NН 3 или NH 4+: 2 N-1 Н 2 OН + I 02 + 2 KOH = N 02 + 2 KI-1 + 4 H 2 O; 2 N-1 Н 2 OН + 4 Fe+2 SO 4 + 3 H 2 SO 4 = 2 Fe+32(SO 4)3 + (N-3 H 4)2 SO 4 + 2 H 2 O. 29
• Гидроксиламин может быть и восстановителем (выделяется N 2 или N 2 O) и окислителем, когда он восстанавливается до NН 3 или NH 4+: 2 N-1 Н 2 OН + I 02 + 2 KOH = N 02 + 2 KI-1 + 4 H 2 O; 2 N-1 Н 2 OН + 4 Fe+2 SO 4 + 3 H 2 SO 4 = 2 Fe+32(SO 4)3 + (N-3 H 4)2 SO 4 + 2 H 2 O. 29
 • Устойчивый представитель пернитридов водорода Н 4 N 2 - гидразин или диамид. Молекула гидразина полярна ( = 0, 62 10 -29 Кл м). • Гидразин бесцветная жидкость (Тпл. 2 °С, Ткип. 113, 5 °С), молекулы которой соединены водородной связью. • Получают гидразин (метод Рашига): 2 NH 3 + Na. Cl. O = N 2 H 4 + Na. Cl + H 2 O. Гидразин и производные гидразоний-ионов (N 2 H 5+) менее устойчивы ([N 2 H 5]Cl), чем аммиак 30 и производные аммония.
• Устойчивый представитель пернитридов водорода Н 4 N 2 - гидразин или диамид. Молекула гидразина полярна ( = 0, 62 10 -29 Кл м). • Гидразин бесцветная жидкость (Тпл. 2 °С, Ткип. 113, 5 °С), молекулы которой соединены водородной связью. • Получают гидразин (метод Рашига): 2 NH 3 + Na. Cl. O = N 2 H 4 + Na. Cl + H 2 O. Гидразин и производные гидразоний-ионов (N 2 H 5+) менее устойчивы ([N 2 H 5]Cl), чем аммиак 30 и производные аммония.
 • Гидразин сильный восстановитель 4 KMn. O 4 +5 H 4 N 2 +6 H 2 SO 4 = 5 N 2 +4 Mn. SO 4 +2 K 2 SO 4 +16 H 2 O • Гидразин горит на воздухе: N 2 H 4(ж) + О 2(г) = N 2(г) + 2 H 2 O(г), Gо= - 607 к. Дж. Восстановить его можно только сильными восстановителями (Sn 2+; Ti 3+; Zn): N 2 H 4 + Zn + 4 HCl = 2 NH 4 Cl + Zn. Cl 2 • Гидразин-дисульфат N 2 H 5 HSO 4 = N 2 H 4 H 2 SO 4 ( «сигразин» ) применяется для лечения больных раком. Он способствует улучшению углеводного обмена раковых клеток, задерживает рост и вызывает распад некоторых опухолей. • Но, гидразин и его производные сильно ядовиты, могут вызывать образование сарком и лейкемий. 31
• Гидразин сильный восстановитель 4 KMn. O 4 +5 H 4 N 2 +6 H 2 SO 4 = 5 N 2 +4 Mn. SO 4 +2 K 2 SO 4 +16 H 2 O • Гидразин горит на воздухе: N 2 H 4(ж) + О 2(г) = N 2(г) + 2 H 2 O(г), Gо= - 607 к. Дж. Восстановить его можно только сильными восстановителями (Sn 2+; Ti 3+; Zn): N 2 H 4 + Zn + 4 HCl = 2 NH 4 Cl + Zn. Cl 2 • Гидразин-дисульфат N 2 H 5 HSO 4 = N 2 H 4 H 2 SO 4 ( «сигразин» ) применяется для лечения больных раком. Он способствует улучшению углеводного обмена раковых клеток, задерживает рост и вызывает распад некоторых опухолей. • Но, гидразин и его производные сильно ядовиты, могут вызывать образование сарком и лейкемий. 31
 Соединения азота (III). Для азота в степени окисления +3 известны фторид NF 3, оксид N 2 O 3, оксогалогениды NОНаl, фторохлорид NF 2 Сl, а также производные аниона NO 2 -. • Оксид азота (III) N 2 О 3 существует только в твердом состоянии при низких температурах. В виде жидкости и пара в значительной степени диссоциирован: N 2 O 3 NO 2 + NO G 0298 = -14 к. Дж/моль 32
Соединения азота (III). Для азота в степени окисления +3 известны фторид NF 3, оксид N 2 O 3, оксогалогениды NОНаl, фторохлорид NF 2 Сl, а также производные аниона NO 2 -. • Оксид азота (III) N 2 О 3 существует только в твердом состоянии при низких температурах. В виде жидкости и пара в значительной степени диссоциирован: N 2 O 3 NO 2 + NO G 0298 = -14 к. Дж/моль 32
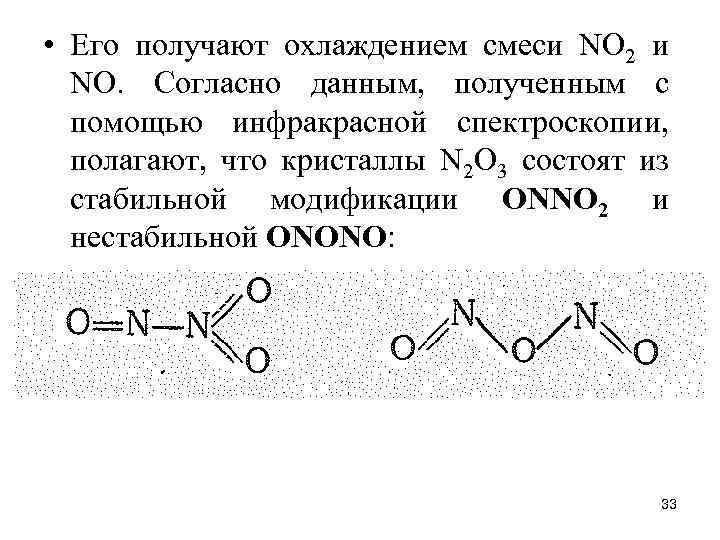 • Его получают охлаждением смеси NO 2 и NО. Согласно данным, полученным с помощью инфракрасной спектроскопии, полагают, что кристаллы N 2 О 3 состоят из стабильной модификации ОNNO 2 и нестабильной ОNОNО: 33
• Его получают охлаждением смеси NO 2 и NО. Согласно данным, полученным с помощью инфракрасной спектроскопии, полагают, что кристаллы N 2 О 3 состоят из стабильной модификации ОNNO 2 и нестабильной ОNОNО: 33
 • Жидкий N 2 O 3 интенсивно синего цвета, (при -100 °С), образуя кристаллы светло-синей окраски. • Оксид азота (III) — кислотный оксид, легко поглощается щелочами, образуя нитриты: N 2 O 3 + 2 Na. OH = 2 Na. NO 2 + H 2 O • Диоксонитрат (III) водорода НNO 2 известен лишь в водном растворе, который является кислотой (К = 4 10 -4), называемой азотистой. Для НNО 2 вероятны две таутомерные структуры: 34
• Жидкий N 2 O 3 интенсивно синего цвета, (при -100 °С), образуя кристаллы светло-синей окраски. • Оксид азота (III) — кислотный оксид, легко поглощается щелочами, образуя нитриты: N 2 O 3 + 2 Na. OH = 2 Na. NO 2 + H 2 O • Диоксонитрат (III) водорода НNO 2 известен лишь в водном растворе, который является кислотой (К = 4 10 -4), называемой азотистой. Для НNО 2 вероятны две таутомерные структуры: 34
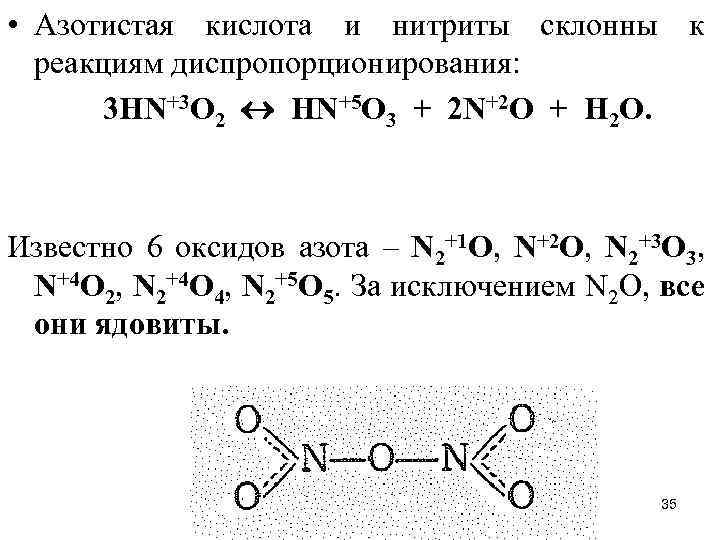 • Азотистая кислота и нитриты склонны к реакциям диспропорционирования: 3 HN+3 O 2 HN+5 O 3 + 2 N+2 O + H 2 O. Известно 6 оксидов азота – N 2+1 O, N+2 O, N 2+3 O 3, N+4 O 2, N 2+4 O 4, N 2+5 O 5. За исключением N 2 O, все они ядовиты. 35
• Азотистая кислота и нитриты склонны к реакциям диспропорционирования: 3 HN+3 O 2 HN+5 O 3 + 2 N+2 O + H 2 O. Известно 6 оксидов азота – N 2+1 O, N+2 O, N 2+3 O 3, N+4 O 2, N 2+4 O 4, N 2+5 O 5. За исключением N 2 O, все они ядовиты. 35
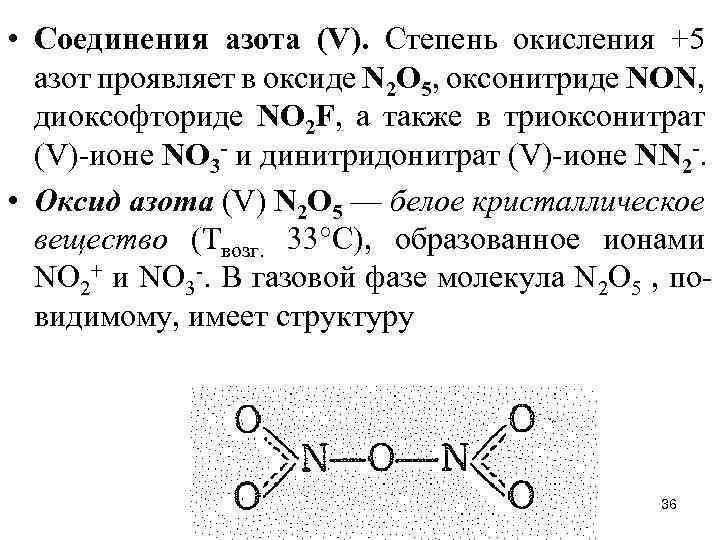 • Соединения азота (V). Степень окисления +5 азот проявляет в оксиде N 2 О 5, оксонитриде NON, диоксофториде NО 2 F, а также в триоксонитрат (V)-ионе NO 3 - и динитридонитрат (V)-ионе NN 2 -. • Оксид азота (V) N 2 O 5 — белое кристаллическое вещество (Твозг. 33°С), образованное ионами NО 2+ и NО 3 -. В газовой фазе молекула N 2 O 5 , повидимому, имеет структуру 36
• Соединения азота (V). Степень окисления +5 азот проявляет в оксиде N 2 О 5, оксонитриде NON, диоксофториде NО 2 F, а также в триоксонитрат (V)-ионе NO 3 - и динитридонитрат (V)-ионе NN 2 -. • Оксид азота (V) N 2 O 5 — белое кристаллическое вещество (Твозг. 33°С), образованное ионами NО 2+ и NО 3 -. В газовой фазе молекула N 2 O 5 , повидимому, имеет структуру 36
 • Его получают осторожным обезвоживанием НNО 3 (например, с помощью Р 2 О 5) или окислением NO 2 озоном. В обычных условиях N 2 О 5 ( G = +114, 1 к. Дж/моль) постепенно разлагается на NO 2 и O 2, при нагревании взрывается. • Оксонитрид азота (V) NNО (закись азота N 2 О, «веселящий газ» ) получается разложением аммиачной селитры (при 250 °С): NН 4 NО 3 = N 2 О + 2 Н 2 О • Это бесцветный газ (Тпл. -91, 0 °С, Ткип. -88, 5 °С) со слабым приятным запахом. 37
• Его получают осторожным обезвоживанием НNО 3 (например, с помощью Р 2 О 5) или окислением NO 2 озоном. В обычных условиях N 2 О 5 ( G = +114, 1 к. Дж/моль) постепенно разлагается на NO 2 и O 2, при нагревании взрывается. • Оксонитрид азота (V) NNО (закись азота N 2 О, «веселящий газ» ) получается разложением аммиачной селитры (при 250 °С): NН 4 NО 3 = N 2 О + 2 Н 2 О • Это бесцветный газ (Тпл. -91, 0 °С, Ткип. -88, 5 °С) со слабым приятным запахом. 37
 • В соответствии с sр-гибридизацией валентных орбиталей молекула имеет линейное строение которое может быть передано наложением валентных схем: • Уже при слабом нагревании N 2 О ( Go = + 104, 1 к. Дж/моль) распадается, выделяя кислород. Поэтому в нем могут гореть углеродистые вещества, а его смеси с водородом и аммиаком взрываются. Оксонитрид азота (V) растворяется в воде, но устойчивых соединений не образует. 38
• В соответствии с sр-гибридизацией валентных орбиталей молекула имеет линейное строение которое может быть передано наложением валентных схем: • Уже при слабом нагревании N 2 О ( Go = + 104, 1 к. Дж/моль) распадается, выделяя кислород. Поэтому в нем могут гореть углеродистые вещества, а его смеси с водородом и аммиаком взрываются. Оксонитрид азота (V) растворяется в воде, но устойчивых соединений не образует. 38
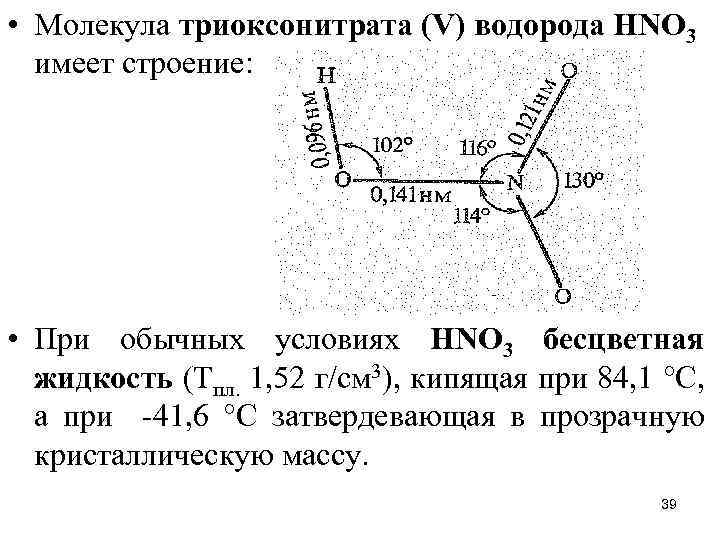 • Молекула триоксонитрата (V) водорода НNО 3 имеет строение: • При обычных условиях НNО 3 бесцветная жидкость (Тпл. 1, 52 г/см 3), кипящая при 84, 1 °С, а при -41, 6 °С затвердевающая в прозрачную кристаллическую массу. 39
• Молекула триоксонитрата (V) водорода НNО 3 имеет строение: • При обычных условиях НNО 3 бесцветная жидкость (Тпл. 1, 52 г/см 3), кипящая при 84, 1 °С, а при -41, 6 °С затвердевающая в прозрачную кристаллическую массу. 39
 • Его растворы — сильная кислота, называемая азотной. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитрат натрия. Промышленное производство НNO 3 осуществляется по стадиям: окисление Н 3 N в NО кислородом воздуха на платиновом катализаторе: 4 H 3 N + 5 O 2 = 4 NO + 6 H 2 O • окисление NО в NO 2: • 2 NO + O 2 = 2 NO 2 • и взаимодействие последнего с водой: 2 NO 2 + H 2 O = НNО 3 + НNО 2 40
• Его растворы — сильная кислота, называемая азотной. В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитрат натрия. Промышленное производство НNO 3 осуществляется по стадиям: окисление Н 3 N в NО кислородом воздуха на платиновом катализаторе: 4 H 3 N + 5 O 2 = 4 NO + 6 H 2 O • окисление NО в NO 2: • 2 NO + O 2 = 2 NO 2 • и взаимодействие последнего с водой: 2 NO 2 + H 2 O = НNО 3 + НNО 2 40
 2 НNО 2 = НNО 3 + 2 NO + H 2 O • Азотная кислота обладает сильно выраженными окислительными свойствами. Она разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. При этом выделяется не водород, а выделяются оксиды азота, N 2 или NH 3. • Образование тех или иных продуктов взаимодействия зависит от концентрации НNО 3, активности простого вещества и температуры. • Достаточно разбавленная кислота в основном восстанавливается до NН 4 NO 3 с повышением ее концентрации становится более характерным образование NO; концентрированная НNО 3 восстанавливается до NO 2. 41
2 НNО 2 = НNО 3 + 2 NO + H 2 O • Азотная кислота обладает сильно выраженными окислительными свойствами. Она разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. При этом выделяется не водород, а выделяются оксиды азота, N 2 или NH 3. • Образование тех или иных продуктов взаимодействия зависит от концентрации НNО 3, активности простого вещества и температуры. • Достаточно разбавленная кислота в основном восстанавливается до NН 4 NO 3 с повышением ее концентрации становится более характерным образование NO; концентрированная НNО 3 восстанавливается до NO 2. 41
 • Смесь одного объема НNО 3 и трех объемов НСl называют царской водкой. Она растворяет платину, золото и другие неактивные металлы, переводя их в комплексные хлориды. Нитрат-ион NО 3 - в нейтральной среде окислительные свойства практически не проявляет. • Au + HNO 3 + 3 HCl = Au. Cl 3 + NO + 2 H 2 O; HCl + Au. Cl 3 = H[Au. Cl 4]. Au + HNO 3 + 4 HCl = H[Au. Cl 4] + NO + 2 H 2 O Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора, при этом образуется также хлористый нитрозил - NOCl, который также разлагается с выделением хлора: HNO 3 + 3 HCl = Cl 2 + 2 Н 2 О + NOCl; 2 NOCl = 2 NO + Cl 2. • Триоксонитрат (V) водорода при нагревании и освещении легко разлагается: 4 НNО 3 = 4 NO 2 + 2 H 2 O 42
• Смесь одного объема НNО 3 и трех объемов НСl называют царской водкой. Она растворяет платину, золото и другие неактивные металлы, переводя их в комплексные хлориды. Нитрат-ион NО 3 - в нейтральной среде окислительные свойства практически не проявляет. • Au + HNO 3 + 3 HCl = Au. Cl 3 + NO + 2 H 2 O; HCl + Au. Cl 3 = H[Au. Cl 4]. Au + HNO 3 + 4 HCl = H[Au. Cl 4] + NO + 2 H 2 O Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора, при этом образуется также хлористый нитрозил - NOCl, который также разлагается с выделением хлора: HNO 3 + 3 HCl = Cl 2 + 2 Н 2 О + NOCl; 2 NOCl = 2 NO + Cl 2. • Триоксонитрат (V) водорода при нагревании и освещении легко разлагается: 4 НNО 3 = 4 NO 2 + 2 H 2 O 42
 • 6 НNО 3 конц. + S = 6 NO 2 + H 2 SO 4 + 2 H 2 O. • 5 НNО 3 разб. + 3 P + 2 H 2 O = 5 NO + 3 H 3 PO 4. • 4 НNО 3 разб. + 3 C = 4 NO + 3 CO 2 + 2 H 2 O. • 4 НNО 3 конц. + Сu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O • 8 НNО 3 разб. + 3 Сu = Cu(NO 3)2 + 2 NO + 4 H 2 O 10 НNО 3 р-р. + 4 Mg = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O В зависимости от разбавления кислоты при взаимодействии с одним и тем же металлом НNО 3 может восстанавливаться до различных продуктов (для Zn – до N 2 O, N 2 или NH 3). Fe, Cr, Al, Ni, Pb концентрированная азотная кислота пассивирует (также не действует на Au, Pt, Os и др). 43
• 6 НNО 3 конц. + S = 6 NO 2 + H 2 SO 4 + 2 H 2 O. • 5 НNО 3 разб. + 3 P + 2 H 2 O = 5 NO + 3 H 3 PO 4. • 4 НNО 3 разб. + 3 C = 4 NO + 3 CO 2 + 2 H 2 O. • 4 НNО 3 конц. + Сu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O • 8 НNО 3 разб. + 3 Сu = Cu(NO 3)2 + 2 NO + 4 H 2 O 10 НNО 3 р-р. + 4 Mg = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O В зависимости от разбавления кислоты при взаимодействии с одним и тем же металлом НNО 3 может восстанавливаться до различных продуктов (для Zn – до N 2 O, N 2 или NH 3). Fe, Cr, Al, Ni, Pb концентрированная азотная кислота пассивирует (также не действует на Au, Pt, Os и др). 43
 • Нитраты большинства других элементов устойчивы. Нитраты металлов растворимы в воде. Нитраты имеют большое значение как удобрения (особенно калийная и аммонийная селитры). Азотная кислота применяется для получения минеральных удобрений, взрывчатых веществ, органических красителей, пластических масс и в других многочисленных производствах. • Разложение нитратов: • До Mg 2 ЭNO 3 = 2 ЭNO 2 + O 2; • Mg-Cu 2 Э(NO 3) = 2 ЭO + 4 NO 2 + O 2; • после Cu 2 Ag. NO 3 = 2 Ag + + 2 NO 2 + O 2. • но 4 Li. NO 3 → 2 Li 2 O + 4 NO 2 + O 2. 44
• Нитраты большинства других элементов устойчивы. Нитраты металлов растворимы в воде. Нитраты имеют большое значение как удобрения (особенно калийная и аммонийная селитры). Азотная кислота применяется для получения минеральных удобрений, взрывчатых веществ, органических красителей, пластических масс и в других многочисленных производствах. • Разложение нитратов: • До Mg 2 ЭNO 3 = 2 ЭNO 2 + O 2; • Mg-Cu 2 Э(NO 3) = 2 ЭO + 4 NO 2 + O 2; • после Cu 2 Ag. NO 3 = 2 Ag + + 2 NO 2 + O 2. • но 4 Li. NO 3 → 2 Li 2 O + 4 NO 2 + O 2. 44
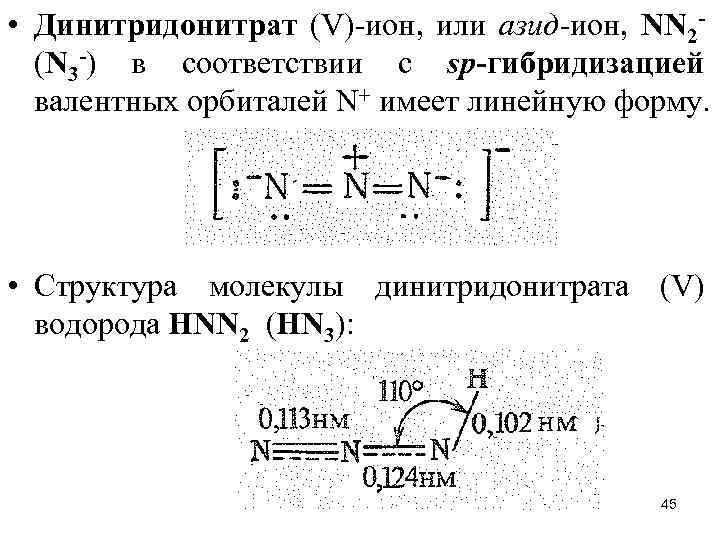 • Динитридонитрат (V)-ион, или азид-ион, NN 2(N 3 -) в соответствии с sр-гибридизацией валентных орбиталей N+ имеет линейную форму. • Структура молекулы динитридонитрата (V) водорода НNN 2 (НN 3): 45
• Динитридонитрат (V)-ион, или азид-ион, NN 2(N 3 -) в соответствии с sр-гибридизацией валентных орбиталей N+ имеет линейную форму. • Структура молекулы динитридонитрата (V) водорода НNN 2 (НN 3): 45
 • В обычных условиях НNN 2 — бесцветная летучая жидкость (Тпл. — 80 о. С, Ткип, 37 °С) с резким запахом. При ударе или нагревании НNN 2 и ряд других азидов распадаются со взрывом. На этом основано применение азида свинца Рb(N 3)2 в качестве детонатора. • Водный раствор НNN 2 — азотистоводородная кислота (К = 2, 6 10 -5), по силе близкая к уксусной. В разбавленных растворах НNN 2 практически устойчива. Ее получают взаимодействием гидразина и азотистой кислоты: Н 4 N 2 + НNО 2 = НNN 2 + 2 Н 2 O. t 2 Na. NH 2 + N 2 O = 2 Na. N 3 + Na. OH + NH 3, 2 Na. N 3 + H 2 SO 4 = 2 HN 3 + Na 2 SO 4. 46
• В обычных условиях НNN 2 — бесцветная летучая жидкость (Тпл. — 80 о. С, Ткип, 37 °С) с резким запахом. При ударе или нагревании НNN 2 и ряд других азидов распадаются со взрывом. На этом основано применение азида свинца Рb(N 3)2 в качестве детонатора. • Водный раствор НNN 2 — азотистоводородная кислота (К = 2, 6 10 -5), по силе близкая к уксусной. В разбавленных растворах НNN 2 практически устойчива. Ее получают взаимодействием гидразина и азотистой кислоты: Н 4 N 2 + НNО 2 = НNN 2 + 2 Н 2 O. t 2 Na. NH 2 + N 2 O = 2 Na. N 3 + Na. OH + NH 3, 2 Na. N 3 + H 2 SO 4 = 2 HN 3 + Na 2 SO 4. 46
 • Соединения азота (I), азота (II) и азота (IV). Для азота, как и для хлора, характерны достаточно устойчивые оксиды с нечетным числом электронов NO и NО 2. Их можно рассматривать как устойчивые свободные радикалы. • В обычных условиях оксид азота (II) NО бесцветный газ (Тпл. -163, 7 °С, Ткип. -151, 7 °С). В промышленности получают окислением Н 3 N на платиновом катализаторе. В отличие от всех остальных оксидов азота NО образуется также прямым взаимодействием простых веществ. В лаборатории получают: 3 Cu + 8 HNO 3 разб. = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O Na. NO 2 + Fe. Cl 2 = Fe. Cl 3 + NO + Na. Cl + H 2 O 2 NO ↔ (NO)2 + Q (при Т не выше ~150 о. С) 47
• Соединения азота (I), азота (II) и азота (IV). Для азота, как и для хлора, характерны достаточно устойчивые оксиды с нечетным числом электронов NO и NО 2. Их можно рассматривать как устойчивые свободные радикалы. • В обычных условиях оксид азота (II) NО бесцветный газ (Тпл. -163, 7 °С, Ткип. -151, 7 °С). В промышленности получают окислением Н 3 N на платиновом катализаторе. В отличие от всех остальных оксидов азота NО образуется также прямым взаимодействием простых веществ. В лаборатории получают: 3 Cu + 8 HNO 3 разб. = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O Na. NO 2 + Fe. Cl 2 = Fe. Cl 3 + NO + Na. Cl + H 2 O 2 NO ↔ (NO)2 + Q (при Т не выше ~150 о. С) 47
 • Диоксид азота NО 2 газ бурого цвета (Тпл. -11, 2 °С, Ткип. 21 °С), токсичен. Его молекула парамагнитна имеет угловую форму: • Длина связи d. NO (0, 120 нм) имеет промежуточное значение между длиной одинарной (0, 143 нм) и двойной (0, 118 нм) связи. Это отвечает порядку связи 1, 5. Молекулы NО 2 даже в парах частично димеризованы (N 2 О 4). Cu + 8 HNO 3 конц. = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O 2 Pb(NO 3)2 = 2 Pb. O + 4 NO 2 + O 2 48
• Диоксид азота NО 2 газ бурого цвета (Тпл. -11, 2 °С, Ткип. 21 °С), токсичен. Его молекула парамагнитна имеет угловую форму: • Длина связи d. NO (0, 120 нм) имеет промежуточное значение между длиной одинарной (0, 143 нм) и двойной (0, 118 нм) связи. Это отвечает порядку связи 1, 5. Молекулы NО 2 даже в парах частично димеризованы (N 2 О 4). Cu + 8 HNO 3 конц. = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O 2 Pb(NO 3)2 = 2 Pb. O + 4 NO 2 + O 2 48
 • Жидкий и твердый диоксид азота бесцветен, состоит из плоских молекул N 2 O 4: • Диоксид азота химически активен; в его атмосфере горят уголь, сера, фосфор. В лаборатории NO 2 получают взаимодействием меди с концентрированной азотной кислотой, Термическим разложением ряда оксонитратов (V). Оксид азота применяется как нитрирующий агент, в частности для получения безводных нитратов. 49
• Жидкий и твердый диоксид азота бесцветен, состоит из плоских молекул N 2 O 4: • Диоксид азота химически активен; в его атмосфере горят уголь, сера, фосфор. В лаборатории NO 2 получают взаимодействием меди с концентрированной азотной кислотой, Термическим разложением ряда оксонитратов (V). Оксид азота применяется как нитрирующий агент, в частности для получения безводных нитратов. 49
 Способы получения оксидов азота: N 2 O (г) – NН 4 NО 3 (t)= N 2 О + 2 Н 2 О. NO (г) – N 2 + O 2 = 2 NO (3000 -4000 o. C); 8 НNО 3 разб. + 3 Сu = Cu(NO 3)2 + 2 NO + 4 H 2 O; Na. NO 2 +Fe. Cl 2 +2 HCl =Fe. Cl 3 + NO +Na. Cl +H 2 O; NH 3 + O 2 = 4 NO + 6 H 2 O (600 o. C, кат. -Pt). N 2 O 3 (ж) – NO + NO 2 = N 2 O 3. NO 2 (г) – 2 NO + O 2 = 2 NO 2; 4 НNО 3 конц. + Сu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O; 2 Na. NO 2 + H 2 SO 4 = Na 2 SO 4 + NO 2 + H 2 O. N 2 O 5 (кр) – 2 HNO 3 + P 2 O 5 = 2 HPO 3 + N 2 O 5; N 2 O 3 + O 3 = N 2 O 5 + 2 O 2. 50
Способы получения оксидов азота: N 2 O (г) – NН 4 NО 3 (t)= N 2 О + 2 Н 2 О. NO (г) – N 2 + O 2 = 2 NO (3000 -4000 o. C); 8 НNО 3 разб. + 3 Сu = Cu(NO 3)2 + 2 NO + 4 H 2 O; Na. NO 2 +Fe. Cl 2 +2 HCl =Fe. Cl 3 + NO +Na. Cl +H 2 O; NH 3 + O 2 = 4 NO + 6 H 2 O (600 o. C, кат. -Pt). N 2 O 3 (ж) – NO + NO 2 = N 2 O 3. NO 2 (г) – 2 NO + O 2 = 2 NO 2; 4 НNО 3 конц. + Сu = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O; 2 Na. NO 2 + H 2 SO 4 = Na 2 SO 4 + NO 2 + H 2 O. N 2 O 5 (кр) – 2 HNO 3 + P 2 O 5 = 2 HPO 3 + N 2 O 5; N 2 O 3 + O 3 = N 2 O 5 + 2 O 2. 50


