 Т. 3 Л. 6 СЕРА Атом серы S; как и атом кислорода, имеет шесть валентных электронов (3 s 23 p 43 d 0). Сера — типичный неметаллический элемент. По электроотрицательности (ЭО ≈ 2, 5) она уступает только галогенам, кислороду, азоту. Наиболее устойчивы четные степени окисления серы (– 2, +4 и +6), что объясняется участием в образовании химических связей двух неспаренных электронов, а также одной или двух электронных пар. 1
Т. 3 Л. 6 СЕРА Атом серы S; как и атом кислорода, имеет шесть валентных электронов (3 s 23 p 43 d 0). Сера — типичный неметаллический элемент. По электроотрицательности (ЭО ≈ 2, 5) она уступает только галогенам, кислороду, азоту. Наиболее устойчивы четные степени окисления серы (– 2, +4 и +6), что объясняется участием в образовании химических связей двух неспаренных электронов, а также одной или двух электронных пар. 1
 • Наиболее характерны для серы низшая и высшая степени окисления. Как и у других рэлементов 3 -го периода, максимальное координационное число серы равно шести, а ее наиболее устойчивое координационное число 4 (sp 3 -гибридное состояние орбиталей). Известны соединения серы почти со всеми элементами. • Сера является весьма распространенным на Земле элементом. В природе она находится в виде четырех изотопов: 32 S (95, 084%), 33 S (0, 74%), 34 S (4, 16%) и 36 S (0, 016%); Искусственно получены также ( радиоактивные) изотопы 31 S и 37 S. 2
• Наиболее характерны для серы низшая и высшая степени окисления. Как и у других рэлементов 3 -го периода, максимальное координационное число серы равно шести, а ее наиболее устойчивое координационное число 4 (sp 3 -гибридное состояние орбиталей). Известны соединения серы почти со всеми элементами. • Сера является весьма распространенным на Земле элементом. В природе она находится в виде четырех изотопов: 32 S (95, 084%), 33 S (0, 74%), 34 S (4, 16%) и 36 S (0, 016%); Искусственно получены также ( радиоактивные) изотопы 31 S и 37 S. 2
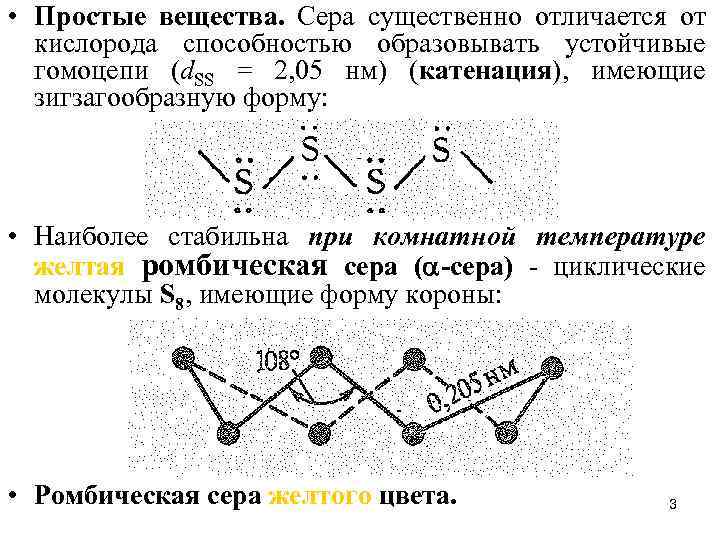 • Простые вещества. Сера существенно отличается от кислорода способностью образовывать устойчивые гомоцепи (d. SS = 2, 05 нм) (катенация), имеющие зигзагообразную форму: • Наиболее стабильна при комнатной температуре желтая ромбическая сера ( -сера) - циклические молекулы S 8, имеющие форму короны: • Ромбическая сера желтого цвета. 3
• Простые вещества. Сера существенно отличается от кислорода способностью образовывать устойчивые гомоцепи (d. SS = 2, 05 нм) (катенация), имеющие зигзагообразную форму: • Наиболее стабильна при комнатной температуре желтая ромбическая сера ( -сера) - циклические молекулы S 8, имеющие форму короны: • Ромбическая сера желтого цвета. 3
 В интервале от 95, 4 о. С до плавления (119, 3 о. С) более устойчива моноклинная сера ( -сера) бледно-желтого цвета (также состоит из молекул S 8). В обычных условиях устойчивы ромбическая ( -сера) ( = 2, 07 г/см 3) и частично моноклинная сера ( -сера) ( = 1, 96 г/см 3). Их кристаллы отличаются взаимной ориентацией молекул S 8. Кроме того, возможны молекулы с замкнутыми (S 6, S 4) и открытыми цепями S∞. Малоустойчивая в обычных условиях пластическая сера состоит из нерегулярно расположенных зигзагообразных цепочек S∞ (где ∞ достигает нескольких тысяч). Другие неустойчивые модификации серы построены из молекул S 2 (пурпурная), S 6 (оранжево-желтая) и др. 4
В интервале от 95, 4 о. С до плавления (119, 3 о. С) более устойчива моноклинная сера ( -сера) бледно-желтого цвета (также состоит из молекул S 8). В обычных условиях устойчивы ромбическая ( -сера) ( = 2, 07 г/см 3) и частично моноклинная сера ( -сера) ( = 1, 96 г/см 3). Их кристаллы отличаются взаимной ориентацией молекул S 8. Кроме того, возможны молекулы с замкнутыми (S 6, S 4) и открытыми цепями S∞. Малоустойчивая в обычных условиях пластическая сера состоит из нерегулярно расположенных зигзагообразных цепочек S∞ (где ∞ достигает нескольких тысяч). Другие неустойчивые модификации серы построены из молекул S 2 (пурпурная), S 6 (оранжево-желтая) и др. 4
 Ромбическая сера плавится при 112, 8 °С а, моноклинная при – 119, 3 °С, образуя легкоподвижную жидкость желтого цвета, которая при 160 °С темнеет, ее вязкость повышается и при 200 °С становится темно-коричневой и вязкой, как смола. Это объясняется разрушением кольцевых молекул S 8 и образованием молекул в виде длинных цепей S∞ из нескольких сотен тысяч атомов. Дальнейшее нагревание (выше 250 °С) ведет к разрыву цепей, и жидкость снова становится более подвижной. 5
Ромбическая сера плавится при 112, 8 °С а, моноклинная при – 119, 3 °С, образуя легкоподвижную жидкость желтого цвета, которая при 160 °С темнеет, ее вязкость повышается и при 200 °С становится темно-коричневой и вязкой, как смола. Это объясняется разрушением кольцевых молекул S 8 и образованием молекул в виде длинных цепей S∞ из нескольких сотен тысяч атомов. Дальнейшее нагревание (выше 250 °С) ведет к разрыву цепей, и жидкость снова становится более подвижной. 5
 • При 444, 6 °С сера закипает. В зависимости от температуры в ее парах обнаружены молекулы S 8, S 6, S 4, S 2. Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого цвета. При температуре выше 1500 °С молекулы серы диссоциируют на атомы. • Молекулы S 2 парамагнитны и построены аналогично молекуле О 2. Во всех других состояниях сера диамагнитна. • В воде сера практически нерастворима; некоторые ее модификации растворяются в органических жидкостях и в особенности в сероуглероде. 6
• При 444, 6 °С сера закипает. В зависимости от температуры в ее парах обнаружены молекулы S 8, S 6, S 4, S 2. Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого цвета. При температуре выше 1500 °С молекулы серы диссоциируют на атомы. • Молекулы S 2 парамагнитны и построены аналогично молекуле О 2. Во всех других состояниях сера диамагнитна. • В воде сера практически нерастворима; некоторые ее модификации растворяются в органических жидкостях и в особенности в сероуглероде. 6
 • Сера достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами. • При нагревании в кипящей воде и значительно лучше в кипящих растворах щелочей сера диспропорционирует: 0 – 2 +4 • 3 S + 6 Nа. ОН 2 Nа 2 S + Nа 2 SО 3 + 3 Н 2 O • Серу получают главным образом выплавкой самородной серы непосредственно в местах ее залегания под землей. Она применяется в производстве серной кислоты, для вулканизации каучука, как инсектицид в сельском хозяйстве и т. д. 7
• Сера достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами. • При нагревании в кипящей воде и значительно лучше в кипящих растворах щелочей сера диспропорционирует: 0 – 2 +4 • 3 S + 6 Nа. ОН 2 Nа 2 S + Nа 2 SО 3 + 3 Н 2 O • Серу получают главным образом выплавкой самородной серы непосредственно в местах ее залегания под землей. Она применяется в производстве серной кислоты, для вулканизации каучука, как инсектицид в сельском хозяйстве и т. д. 7
 Соединения со степенью окисления серы — 2. Наиболее заметно сходство серы и кислорода в соединениях, в которых они проявляют степень окисления — 2. Оксидам отвечают сульфиды, гидроксидам — гидросульфиды, оксокислотам — сульфидокислоты (тиокислоты), например: Если сначала смесь нагреть, то далее реакция идет сама с большим выделением тепла 8 Fe + S = Fe. S f. H 0298 = -100 к. Дж/моль
Соединения со степенью окисления серы — 2. Наиболее заметно сходство серы и кислорода в соединениях, в которых они проявляют степень окисления — 2. Оксидам отвечают сульфиды, гидроксидам — гидросульфиды, оксокислотам — сульфидокислоты (тиокислоты), например: Если сначала смесь нагреть, то далее реакция идет сама с большим выделением тепла 8 Fe + S = Fe. S f. H 0298 = -100 к. Дж/моль
 C + 2 S = CS 2 (750 -1000 о. С) жидкость Ткип. 46 о. С; СН 4 + 4 S = CS 2 + 2 Н 2 S (500 -700 о. С). N 2 + S ≠ • 4 P + 3 S = P 4 S 3 (≈100 о. С) (P 4 S 5 P 4 S 7 P 4 S 10); P 4 S 3 растворяется в бензоле, сероуглероде, используется в производстве спичек. Сера более слабый окислитель, чем кислород. Однако скорость взаимодействия многих веществ с серой значительно выше, чем с кислородом. Так, Pb, Cu, Fe и др. медленно окисляемые металлы реагируют с серой при нагревании почти мгновенно. Одна из причин – меньшая прочность молекул S 8 по сравнению с О 2. Химическая природа однотипных сульфидов и оксидов, гидросульфидов и гидроксидов закономерно изменяется в пределах периода. Сульфиды, как и оксиды, бывают основными, кислотными и амфотерными. Основные свойства проявляют сульфиды наиболее типичных металлических элементов, 9 кислотные — сульфиды неметаллических элементов.
C + 2 S = CS 2 (750 -1000 о. С) жидкость Ткип. 46 о. С; СН 4 + 4 S = CS 2 + 2 Н 2 S (500 -700 о. С). N 2 + S ≠ • 4 P + 3 S = P 4 S 3 (≈100 о. С) (P 4 S 5 P 4 S 7 P 4 S 10); P 4 S 3 растворяется в бензоле, сероуглероде, используется в производстве спичек. Сера более слабый окислитель, чем кислород. Однако скорость взаимодействия многих веществ с серой значительно выше, чем с кислородом. Так, Pb, Cu, Fe и др. медленно окисляемые металлы реагируют с серой при нагревании почти мгновенно. Одна из причин – меньшая прочность молекул S 8 по сравнению с О 2. Химическая природа однотипных сульфидов и оксидов, гидросульфидов и гидроксидов закономерно изменяется в пределах периода. Сульфиды, как и оксиды, бывают основными, кислотными и амфотерными. Основные свойства проявляют сульфиды наиболее типичных металлических элементов, 9 кислотные — сульфиды неметаллических элементов.
 • Различие химической природы сульфидов проявляется в реакциях гидролиза и при взаимодействии сульфидов разной химической природы между собой. Так, сульфиды s-элементов I группы (как и их оксиды) растворимы в воде и при гидролизе образуют щелочную среду: Nа 2 S + HOH Na. HS + Nа. ОН • Сульфиды неметаллических элементов обычно гидролизуются с образованием соответствующих кислот: Si. S 2 + 3 Н 2 O = Н 2 Si. O 3 + 2 Н 2 S • Амфотерные сульфиды (как и оксиды) в воде нерастворимы, но некоторые из них, например сульфиды Аl (III), Fе (III), Сr (III), полностью гидролизуются: Аl 2 S 3 + 6 Н 2 O = 2 Аl(ОН)3↓ + 3 Н 2 S↑ • При взаимодействии основных и образуются соли (тиосоли), например: Nа 2 S + СS 2 = Na 2 CS 3 кислотных сульфидов трисульфидокарбонат (IV) 10 натрия
• Различие химической природы сульфидов проявляется в реакциях гидролиза и при взаимодействии сульфидов разной химической природы между собой. Так, сульфиды s-элементов I группы (как и их оксиды) растворимы в воде и при гидролизе образуют щелочную среду: Nа 2 S + HOH Na. HS + Nа. ОН • Сульфиды неметаллических элементов обычно гидролизуются с образованием соответствующих кислот: Si. S 2 + 3 Н 2 O = Н 2 Si. O 3 + 2 Н 2 S • Амфотерные сульфиды (как и оксиды) в воде нерастворимы, но некоторые из них, например сульфиды Аl (III), Fе (III), Сr (III), полностью гидролизуются: Аl 2 S 3 + 6 Н 2 O = 2 Аl(ОН)3↓ + 3 Н 2 S↑ • При взаимодействии основных и образуются соли (тиосоли), например: Nа 2 S + СS 2 = Na 2 CS 3 кислотных сульфидов трисульфидокарбонат (IV) 10 натрия
 • Отвечающие тиосолям тиокислоты обычно неустойчивы и необратимо разлагаются на Н 2 S и соответствующий сульфид. Так, при действии кислоты на сульфидокарбонат образующаяся кислота разлагается Nа 2 СS 3 + Н 2 SO 4 = Nа 2 SО 4 + Н 2 СS 3 = Н 2 S + СS 2 • Этот распад аналогичен разложению кислородсодержащих кислот на кислотный оксид и воду: Н 2 СО 3 = Н 2 О + СО 2 • Сульфиды имеют характерную окраску, например Сu. S, Ni. S, Рb. S – черные, Mn. S — телесного цвета, Zn. S — белый. Различие в окраске и растворимости сульфидов в разных средах используется в аналитической практике для обнаружения и разделения катионов. 11
• Отвечающие тиосолям тиокислоты обычно неустойчивы и необратимо разлагаются на Н 2 S и соответствующий сульфид. Так, при действии кислоты на сульфидокарбонат образующаяся кислота разлагается Nа 2 СS 3 + Н 2 SO 4 = Nа 2 SО 4 + Н 2 СS 3 = Н 2 S + СS 2 • Этот распад аналогичен разложению кислородсодержащих кислот на кислотный оксид и воду: Н 2 СО 3 = Н 2 О + СО 2 • Сульфиды имеют характерную окраску, например Сu. S, Ni. S, Рb. S – черные, Mn. S — телесного цвета, Zn. S — белый. Различие в окраске и растворимости сульфидов в разных средах используется в аналитической практике для обнаружения и разделения катионов. 11
 • Важнейшее соединение серы с водородом сероводород - Н 2 S. Он образуется при взаимодействии серы с Н 2 при повышенной температуре (600 о. С). Н 2 + S = H 2 S • Молекула сульфида водорода Н 2 S имеет угловую форму ( НSН = 92°, d. SH = 0, 133 нм), поэтому она полярна ( = 0, 34 10 -29 Кл м). Способность образовывать водородные связи у Н 2 S выражена слабее, чем у Н 2 O. Сероводород в н. у. - газ (Тпл. – 85, 6 °С, Ткип. – 60, 75 °С). • Его водный раствор (0, 38% Н 2 S по массе – 3 объема на 1 объем воды) - слабая кислота (К 1 = 6 10 -8), называемая сероводородной. Сульфид водорода имеет неприятный запах и очень 12 ядовит.
• Важнейшее соединение серы с водородом сероводород - Н 2 S. Он образуется при взаимодействии серы с Н 2 при повышенной температуре (600 о. С). Н 2 + S = H 2 S • Молекула сульфида водорода Н 2 S имеет угловую форму ( НSН = 92°, d. SH = 0, 133 нм), поэтому она полярна ( = 0, 34 10 -29 Кл м). Способность образовывать водородные связи у Н 2 S выражена слабее, чем у Н 2 O. Сероводород в н. у. - газ (Тпл. – 85, 6 °С, Ткип. – 60, 75 °С). • Его водный раствор (0, 38% Н 2 S по массе – 3 объема на 1 объем воды) - слабая кислота (К 1 = 6 10 -8), называемая сероводородной. Сульфид водорода имеет неприятный запах и очень 12 ядовит.
 • Обычно Н 2 S получают действием разбавленной НСl на Fе. S. Fe. S + 2 HCl = H 2 S + Fe. Cl 2 • Нерастворимые сульфиды получают по обменным реакциям: Мn. SО 4 (р) + Nа 2 S (р) = Мn. S (т) + Nа 2 SO 4 (р) Сu. SO 4 (р) + Н 2 S (р) = Сu. S (т) + Н 2 SO 4 (р) Сульфиды металлических элементов, как и их оксиды, имеют переменный состав, например Fе. S 1, 01 - Fе. S 1, 14 (сравните Fе. O 1, 04 - Fе. O 1, 12). Физические св-ва сульфидов разнообразны: Ti. S 2 – обладает металлической проводимостью, Zn. S 2 –полупроводник, Hf. S 2 – диэлектрик. 13
• Обычно Н 2 S получают действием разбавленной НСl на Fе. S. Fe. S + 2 HCl = H 2 S + Fe. Cl 2 • Нерастворимые сульфиды получают по обменным реакциям: Мn. SО 4 (р) + Nа 2 S (р) = Мn. S (т) + Nа 2 SO 4 (р) Сu. SO 4 (р) + Н 2 S (р) = Сu. S (т) + Н 2 SO 4 (р) Сульфиды металлических элементов, как и их оксиды, имеют переменный состав, например Fе. S 1, 01 - Fе. S 1, 14 (сравните Fе. O 1, 04 - Fе. O 1, 12). Физические св-ва сульфидов разнообразны: Ti. S 2 – обладает металлической проводимостью, Zn. S 2 –полупроводник, Hf. S 2 – диэлектрик. 13
 • Сульфиды в растворах восстановители: S + 2 е- = S 2 -, Еo = – 0, 48 В; • В зависимости от условий продуктами окисления сульфидов могут быть S, SO 2 и Н 2 SO 4. 2 КМn +7 О 4 + 5 Н 2 S– 2 + 3 Н 2 SO 4 = 2 Мn+2 SO 4 + 5 S 0 + К 2 SO 4 + 8 Н 2 O; Н 2 S– 2 + 4 Вr 20 + 4 H 2 О = Н 2 S+6 O 4 + 8 НВr– 1. 14
• Сульфиды в растворах восстановители: S + 2 е- = S 2 -, Еo = – 0, 48 В; • В зависимости от условий продуктами окисления сульфидов могут быть S, SO 2 и Н 2 SO 4. 2 КМn +7 О 4 + 5 Н 2 S– 2 + 3 Н 2 SO 4 = 2 Мn+2 SO 4 + 5 S 0 + К 2 SO 4 + 8 Н 2 O; Н 2 S– 2 + 4 Вr 20 + 4 H 2 О = Н 2 S+6 O 4 + 8 НВr– 1. 14
 • Персульфиды. Тенденция серы образовывать гомоцепи (катенация) реализуется в многочисленных персульфидах (полисульфидах) типа M 2+1 Sn n=2 8. Последние получаются при взаимодействии серы с концентрированными растворами основного сульфида: Nа 2 S + (n— 1) S = Nа 2 Sn • Персульфид-ионы имеют цепочечное строение: 15
• Персульфиды. Тенденция серы образовывать гомоцепи (катенация) реализуется в многочисленных персульфидах (полисульфидах) типа M 2+1 Sn n=2 8. Последние получаются при взаимодействии серы с концентрированными растворами основного сульфида: Nа 2 S + (n— 1) S = Nа 2 Sn • Персульфид-ионы имеют цепочечное строение: 15
 • Получены многочисленные персульфиды водорода типа Н 2 Sn (где n = 2 23), называемые многосернистыми водородами или сульфанами. Это — желтые маслянистые жидкости (Tпл. -50 -90 °С). • По мере увеличения содержания серы окраска персульфидов меняется от желтой (S 22 --радикал) до красной (S 92 --радикал). Смесь сульфанов образуется при действии кислот на полисульфиды аммония или натрия: Nа 2 Sn + 2 НСl = Н 2 Sn + 2 Nа. Сl 16
• Получены многочисленные персульфиды водорода типа Н 2 Sn (где n = 2 23), называемые многосернистыми водородами или сульфанами. Это — желтые маслянистые жидкости (Tпл. -50 -90 °С). • По мере увеличения содержания серы окраска персульфидов меняется от желтой (S 22 --радикал) до красной (S 92 --радикал). Смесь сульфанов образуется при действии кислот на полисульфиды аммония или натрия: Nа 2 Sn + 2 НСl = Н 2 Sn + 2 Nа. Сl 16
 • Персульфид водорода Н 2 Sn — аналог пероксида водорода. Персульфиды встречаются в природе. Например, широко распространенный минерал пирит Fе. S 2 представляет собой персульфид железа (II). • S – S Fe 17
• Персульфид водорода Н 2 Sn — аналог пероксида водорода. Персульфиды встречаются в природе. Например, широко распространенный минерал пирит Fе. S 2 представляет собой персульфид железа (II). • S – S Fe 17
 • Персульфиды, подобно пероксидам, проявляют восстановительные и окислительные свойства, а также вступают в реакции диспропорционирования: (S 2)2 - - окислитель Na 2 S 2(-2) + Sn+2 S = Sn+4 S 2 + Na 2 S-2; (S 2)2 - - восстановитель 4 Fe+2 S 2(-2) + 11 O 20 = 2 Fe 2+3 O 3 -2 + 8 S+4 O 2 -2; (S 2)2 - -окислитель-восстановитель Na 2 S 2(-2) = Na 2 S-2 + S 0. 18
• Персульфиды, подобно пероксидам, проявляют восстановительные и окислительные свойства, а также вступают в реакции диспропорционирования: (S 2)2 - - окислитель Na 2 S 2(-2) + Sn+2 S = Sn+4 S 2 + Na 2 S-2; (S 2)2 - - восстановитель 4 Fe+2 S 2(-2) + 11 O 20 = 2 Fe 2+3 O 3 -2 + 8 S+4 O 2 -2; (S 2)2 - -окислитель-восстановитель Na 2 S 2(-2) = Na 2 S-2 + S 0. 18
 • Соединения серы (II). Степень окисления +2 для серы малохарактерна, но все же она устойчивее, чем для кислорода. Из производных со степенью окисления серы +2 известны малоустойчивые галогениды SНаl 2. Дихлорид серы SСl 2 - темнокрасная жидкость, постепенно разлагается; гидролизуется: S + Cl 2 = SCl 2; 2 SCl 2 S 2 Cl 2 + Cl 2 2 SCl 2 + H 2 O = H 2 SO 3 + S + 4 HCl Длина зигзагообразной цепочки в Sn. Cl 2 галогенидах может быть довольно большой, до n=100. Хлорид S 2 Cl 2 зеленовато-желтая жидкость, Ткип. 137, 1 о. С, применяется в качестве растворителя многих соединений и серы. Получают его хлорированием расплавленной серы. S F S S Cl F S Cl S S S 2 F 2 (на холоде) S 4 Cl 2 S 2 Cl 2 + 2 H 2 O = H 2 S + 2 HCl; 2 SCl 2 + 2 H 2 O = H 2 SО 3 + S + 4 HCl 19
• Соединения серы (II). Степень окисления +2 для серы малохарактерна, но все же она устойчивее, чем для кислорода. Из производных со степенью окисления серы +2 известны малоустойчивые галогениды SНаl 2. Дихлорид серы SСl 2 - темнокрасная жидкость, постепенно разлагается; гидролизуется: S + Cl 2 = SCl 2; 2 SCl 2 S 2 Cl 2 + Cl 2 2 SCl 2 + H 2 O = H 2 SO 3 + S + 4 HCl Длина зигзагообразной цепочки в Sn. Cl 2 галогенидах может быть довольно большой, до n=100. Хлорид S 2 Cl 2 зеленовато-желтая жидкость, Ткип. 137, 1 о. С, применяется в качестве растворителя многих соединений и серы. Получают его хлорированием расплавленной серы. S F S S Cl F S Cl S S S 2 F 2 (на холоде) S 4 Cl 2 S 2 Cl 2 + 2 H 2 O = H 2 S + 2 HCl; 2 SCl 2 + 2 H 2 O = H 2 SО 3 + S + 4 HCl 19
 • Соединения серы (IV). Степень окисления +4 у серы проявляется в ее тетрагалогенидах SНаl 4, оксодигалогенидах SОНаl 2, диоксиде SО 2, а также в отвечающих им анионах. SF 4 SCl 4 SOHal 2 SO 2 [SF 5]- [SO 2 F]- [SO 3]2 - • Во всех приведенных молекулах, а также в анионных комплексах серы (IV) у атома серы имеется неподеленная (несвязывающая) электронная пара. 20
• Соединения серы (IV). Степень окисления +4 у серы проявляется в ее тетрагалогенидах SНаl 4, оксодигалогенидах SОНаl 2, диоксиде SО 2, а также в отвечающих им анионах. SF 4 SCl 4 SOHal 2 SO 2 [SF 5]- [SO 2 F]- [SO 3]2 - • Во всех приведенных молекулах, а также в анионных комплексах серы (IV) у атома серы имеется неподеленная (несвязывающая) электронная пара. 20
 • Химический характер бинарных соединений серы (IV) является кислотным, о чем, в частности, свидетельствует их отношение к воде. SO 2 + H 2 O = H 2 SO 3 • При гидролизе все соединения дают сернистую кислоту (точнее анионы НSO 3 - и SО 32 -) или SO 2. SF 4 + 3 H 2 O = H 2 SO 3 + 4 HF SCl 4 + 3 H 2 O = H 2 SO 3 + 4 HCl 21
• Химический характер бинарных соединений серы (IV) является кислотным, о чем, в частности, свидетельствует их отношение к воде. SO 2 + H 2 O = H 2 SO 3 • При гидролизе все соединения дают сернистую кислоту (точнее анионы НSO 3 - и SО 32 -) или SO 2. SF 4 + 3 H 2 O = H 2 SO 3 + 4 HF SCl 4 + 3 H 2 O = H 2 SO 3 + 4 HCl 21
 • Из соединений серы (IV) наибольшее значение имеет диоксид серы SO 2 (сернистый ангидрид = сернистый газ). Строение молекулы SO 2 аналогично строению молекулы озона O 3 (OO 2), но молекула отличается высокой термической устойчивостью. В обычных условиях диоксид серы — бесцветный газ с характерным резким запахом. В технике его получают сжиганием серы и обжигом сульфидных руд: • S + O 2 = SO 2 • 4 Fе. S 2 + 11 O 2 = 8 SO 2 + 2 Fе 2 О 3 22
• Из соединений серы (IV) наибольшее значение имеет диоксид серы SO 2 (сернистый ангидрид = сернистый газ). Строение молекулы SO 2 аналогично строению молекулы озона O 3 (OO 2), но молекула отличается высокой термической устойчивостью. В обычных условиях диоксид серы — бесцветный газ с характерным резким запахом. В технике его получают сжиганием серы и обжигом сульфидных руд: • S + O 2 = SO 2 • 4 Fе. S 2 + 11 O 2 = 8 SO 2 + 2 Fе 2 О 3 22
 • Растворимость диоксида серы в воде весьма велика (при обычных условиях около 40 объемов SO 2 на один объем Н 2 O). Водный раствор SO 2 называется сернистой кислотой. Основная масса растворенного SO 2 находится в растворе в гидратированной форме SO 2 n. Н 2 О. (К 1=1, 4 10 -2; К 2=6, 2 10 -8) • Лишь небольшая часть растворенных молекул взаимодействует с водой по схеме SO 2 + Н 2 O Н 2 SO 3 Н+ +НSO 3 - 2 Н+ + SO 3223
• Растворимость диоксида серы в воде весьма велика (при обычных условиях около 40 объемов SO 2 на один объем Н 2 O). Водный раствор SO 2 называется сернистой кислотой. Основная масса растворенного SO 2 находится в растворе в гидратированной форме SO 2 n. Н 2 О. (К 1=1, 4 10 -2; К 2=6, 2 10 -8) • Лишь небольшая часть растворенных молекул взаимодействует с водой по схеме SO 2 + Н 2 O Н 2 SO 3 Н+ +НSO 3 - 2 Н+ + SO 3223
 • Указанное равновесие легко смещается в сторону образования анионов НSO 3 - и SO 32 в присутствии щелочи. При этом образуются триоксосульфаты (IV) двух типов М 2+1 SO 3 (сульфиты) и М+1 НSO 3 (гидросульфиты). • Вследствие неустойчивости Н 2 SO 3 действие кислот на сульфиты сопровождается выделением SO 2. На этом основано получение SO 2 в лаборатории. • Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 SO 3 (H 2 O + SO 2↑). Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + SO 2↑. • 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + 8 SO 2↑ + Q. 24
• Указанное равновесие легко смещается в сторону образования анионов НSO 3 - и SO 32 в присутствии щелочи. При этом образуются триоксосульфаты (IV) двух типов М 2+1 SO 3 (сульфиты) и М+1 НSO 3 (гидросульфиты). • Вследствие неустойчивости Н 2 SO 3 действие кислот на сульфиты сопровождается выделением SO 2. На этом основано получение SO 2 в лаборатории. • Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 SO 3 (H 2 O + SO 2↑). Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + SO 2↑. • 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + 8 SO 2↑ + Q. 24
 Значительное применение имеют оксогалогениды серы – хлористый тионил S+4 OCl 2 (Ткип. 76 о. С) и хлористый сульфурил S+6 O 2 Cl 2 (Ткип. 69 о. С). Это ядовитые жидкости, с удушающим запахом. Их получают: SO 2 + PCl 5 = SOCl 2 + POCl 3; SO 3 + SCl 2 = SOCl 2 + SO 2; SO 2 + Cl 2 = SO 2 Cl 2. В воде они полностью гидролизуются: SOCl 2 + 2 H 2 O = H 2 SO 3 + 2 HCl; 25 SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl.
Значительное применение имеют оксогалогениды серы – хлористый тионил S+4 OCl 2 (Ткип. 76 о. С) и хлористый сульфурил S+6 O 2 Cl 2 (Ткип. 69 о. С). Это ядовитые жидкости, с удушающим запахом. Их получают: SO 2 + PCl 5 = SOCl 2 + POCl 3; SO 3 + SCl 2 = SOCl 2 + SO 2; SO 2 + Cl 2 = SO 2 Cl 2. В воде они полностью гидролизуются: SOCl 2 + 2 H 2 O = H 2 SO 3 + 2 HCl; 25 SO 2 Cl 2 + 2 H 2 O = H 2 SO 4 + 2 HCl.
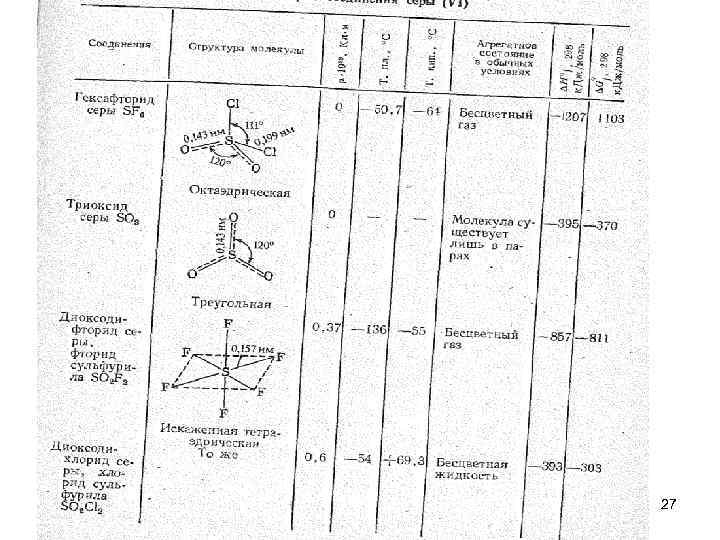
 • Соединения серы (VI). • Степень окисления серы +6 проявляется в гексафториде SF 6, триоксиде SO 3, диоксодигалогенидах SО 2 Наl 2, а также в отвечающих им анионных комплексах типа [SO 4]2 -, [SО 3 Наl]- и некоторых других. • Гексафтород серы SF 6 (элегаз) отличается большой химической инертостью, при комнатной температуре он не взаимодействует ни с кислотами, ни со щелочами, ни с водой. o -190 C S + 3 F 2 = SF 6 26
• Соединения серы (VI). • Степень окисления серы +6 проявляется в гексафториде SF 6, триоксиде SO 3, диоксодигалогенидах SО 2 Наl 2, а также в отвечающих им анионных комплексах типа [SO 4]2 -, [SО 3 Наl]- и некоторых других. • Гексафтород серы SF 6 (элегаз) отличается большой химической инертостью, при комнатной температуре он не взаимодействует ни с кислотами, ни со щелочами, ни с водой. o -190 C S + 3 F 2 = SF 6 26
 27
27
 • Триоксид серы SO 3 – бесцветная легкоподвижная жидкость ( =1, 92 г/см 3, Ткип. = 44, 9 о. С), кристаллизуется при 16, 8 о. С. • В молекуле SО 3, атом серы находится в состоянии sp 2 -гибридизации (в газ. сост. ). Атом серы в молекуле SО 3 связан с атомами кислорода тремя двухцентровыми связями, одной двухцентровой -связью и одной трехцентровой -связью. Кроме того, за счет неподеленных 2 р-электронных пар атомов кислорода и свободных 3 dорбиталей атома серы здесь возможно образование дополнительных ковалентных связей, подобно тому, как это имеет место в 28 молекуле Cl 2.
• Триоксид серы SO 3 – бесцветная легкоподвижная жидкость ( =1, 92 г/см 3, Ткип. = 44, 9 о. С), кристаллизуется при 16, 8 о. С. • В молекуле SО 3, атом серы находится в состоянии sp 2 -гибридизации (в газ. сост. ). Атом серы в молекуле SО 3 связан с атомами кислорода тремя двухцентровыми связями, одной двухцентровой -связью и одной трехцентровой -связью. Кроме того, за счет неподеленных 2 р-электронных пар атомов кислорода и свободных 3 dорбиталей атома серы здесь возможно образование дополнительных ковалентных связей, подобно тому, как это имеет место в 28 молекуле Cl 2.
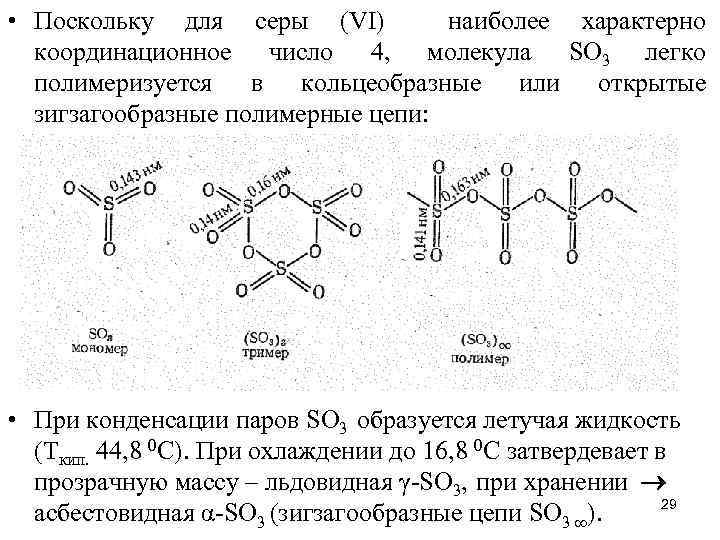 • Поскольку для серы (VI) наиболее характерно координационное число 4, молекула SО 3 легко полимеризуется в кольцеобразные или открытые зигзагообразные полимерные цепи: • При конденсации паров SО 3 образуется летучая жидкость (Ткип. 44, 8 0 С). При охлаждении до 16, 8 0 С затвердевает в прозрачную массу – льдовидная γ-SО 3, при хранении 29 асбестовидная α-SО 3 (зигзагообразные цепи SО 3 ).
• Поскольку для серы (VI) наиболее характерно координационное число 4, молекула SО 3 легко полимеризуется в кольцеобразные или открытые зигзагообразные полимерные цепи: • При конденсации паров SО 3 образуется летучая жидкость (Ткип. 44, 8 0 С). При охлаждении до 16, 8 0 С затвердевает в прозрачную массу – льдовидная γ-SО 3, при хранении 29 асбестовидная α-SО 3 (зигзагообразные цепи SО 3 ).
 • В технике оксид серы (VI) SO 3 получают окислением SO 2 в присутствии катализатора (Pt или V 2 O 5). • Триоксид серы (VI) – ангидрид серной кислоты; последняя образуется при взаимодействии SO 3 с водой: SO 3 + Н 2 О = Н 2 SO 4 + 87, 864 к. Дж • Структура молекул серной кислоты соответствует формуле: Н – О S Н – О О • В водных растворах Н 2 SO 4 — сильная двухосновная кислота (К 1 = 1 103, K 2 = 1, 2 10 -2). 30
• В технике оксид серы (VI) SO 3 получают окислением SO 2 в присутствии катализатора (Pt или V 2 O 5). • Триоксид серы (VI) – ангидрид серной кислоты; последняя образуется при взаимодействии SO 3 с водой: SO 3 + Н 2 О = Н 2 SO 4 + 87, 864 к. Дж • Структура молекул серной кислоты соответствует формуле: Н – О S Н – О О • В водных растворах Н 2 SO 4 — сильная двухосновная кислота (К 1 = 1 103, K 2 = 1, 2 10 -2). 30
 • Безводная Н 2 SO 4 – бесцветная маслянистая жидкость, кристаллизующаяся при 10, 4 о. С. • При получении серной кислоты SO 2 окисляют двумя методами контактным и нитрозным. 2 SO 2 + O 2 = 2 SO 3 • Контактный метод – основан на присоединении кислорода к диоксиду серы при соприкосновении (контакте) этих газов с катализатором. Обязательным условием успешного протекания процесса является тщательное удаление примесей из реакционных газов, так как даже ничтожные следы примесей (например соединений мышьяка, фосфора и др. ) «отравляют» катализатор (V 2 O 5), вызывая быструю потерю им своей активности. • Для поглощения SO 3 используют конц. Н 2 SO 4, т. к. газообразный SO 3 реагирует сначала с водяным паром и значительная часть Н 2 SO 4 получается в виде трудноуловимого тумана. Раствор SO 3 в Н 2 SO 4 имеет техническое название олеум (это подчеркивает его большую вязкость). Получают олеум с 31 содержанием SO 3 20 -65%.
• Безводная Н 2 SO 4 – бесцветная маслянистая жидкость, кристаллизующаяся при 10, 4 о. С. • При получении серной кислоты SO 2 окисляют двумя методами контактным и нитрозным. 2 SO 2 + O 2 = 2 SO 3 • Контактный метод – основан на присоединении кислорода к диоксиду серы при соприкосновении (контакте) этих газов с катализатором. Обязательным условием успешного протекания процесса является тщательное удаление примесей из реакционных газов, так как даже ничтожные следы примесей (например соединений мышьяка, фосфора и др. ) «отравляют» катализатор (V 2 O 5), вызывая быструю потерю им своей активности. • Для поглощения SO 3 используют конц. Н 2 SO 4, т. к. газообразный SO 3 реагирует сначала с водяным паром и значительная часть Н 2 SO 4 получается в виде трудноуловимого тумана. Раствор SO 3 в Н 2 SO 4 имеет техническое название олеум (это подчеркивает его большую вязкость). Получают олеум с 31 содержанием SO 3 20 -65%.
 • Ранее серную кислоту получали нитрозным методом, сущность которого заключается в окислении диоксида серы диоксидом азота в присутствии воды. SO 2 + NO 2 + H 2 O = Н 2 SO 4 + NO • Отдавая диоксиду серы часть кислорода, NO 2 превращается в другой газ – оксид азота (II) NO. Последний соединяется с кислородом воздуха и снова превращается в диоксид азота 2 NO + О 2 = 2 NO 2 который идет на окисление новых порций SO 2. 32
• Ранее серную кислоту получали нитрозным методом, сущность которого заключается в окислении диоксида серы диоксидом азота в присутствии воды. SO 2 + NO 2 + H 2 O = Н 2 SO 4 + NO • Отдавая диоксиду серы часть кислорода, NO 2 превращается в другой газ – оксид азота (II) NO. Последний соединяется с кислородом воздуха и снова превращается в диоксид азота 2 NO + О 2 = 2 NO 2 который идет на окисление новых порций SO 2. 32
 • Разбавленная серная кислота окисляет ионом водорода, поэтому взаимодействует только с металлами стоящими в ряду активности металлов до водорода. Однако свинец не растворяется в H 2 SO 4 разб. , т. к. образующуюся соль Pb. SO 4 нерастворима. • Галогены, азот, фосфор не реагируют с H 2 SO 4. • Золото и платина не реагируют с разбавл. и конц. H 2 SO 4. • Концентрированная серная кислота, особенно горячая, энергичный окислитель. Она окисляет HI и HBr (но не HCl), H 2 S до свободных галогенов и серы, серу до SO 2, уголь до СО 2, от углеводов отнимает водород и кислород (воду), а углерод выделяется в виде угля. 2 HBr(г) + H 2 SO 4(конц. ) = Br 2(г) + SO 2(г) + 2 H 2 O(ж) 8 HI (г) + H 2 SO 4 (конц. ) = 4 I 2 (г) + H 2 S (г) + 4 H 2 O (ж) • Концентрированная серная кислота может окислять металлы стоящие в ряду напряжений до серебра включительно, при нагревании (т. к. окислителем является сера IV). (При комнатной температуре H 2 SO 4 конц. пассивирует железо алюминий, хром). Продуктами восстановления могут быть SO 2, S, S-2. Чем разбавленнее кислота, ниже температура и активнее металл, тем выше глубина восстановления кислоты, т. е. 33 тем
• Разбавленная серная кислота окисляет ионом водорода, поэтому взаимодействует только с металлами стоящими в ряду активности металлов до водорода. Однако свинец не растворяется в H 2 SO 4 разб. , т. к. образующуюся соль Pb. SO 4 нерастворима. • Галогены, азот, фосфор не реагируют с H 2 SO 4. • Золото и платина не реагируют с разбавл. и конц. H 2 SO 4. • Концентрированная серная кислота, особенно горячая, энергичный окислитель. Она окисляет HI и HBr (но не HCl), H 2 S до свободных галогенов и серы, серу до SO 2, уголь до СО 2, от углеводов отнимает водород и кислород (воду), а углерод выделяется в виде угля. 2 HBr(г) + H 2 SO 4(конц. ) = Br 2(г) + SO 2(г) + 2 H 2 O(ж) 8 HI (г) + H 2 SO 4 (конц. ) = 4 I 2 (г) + H 2 S (г) + 4 H 2 O (ж) • Концентрированная серная кислота может окислять металлы стоящие в ряду напряжений до серебра включительно, при нагревании (т. к. окислителем является сера IV). (При комнатной температуре H 2 SO 4 конц. пассивирует железо алюминий, хром). Продуктами восстановления могут быть SO 2, S, S-2. Чем разбавленнее кислота, ниже температура и активнее металл, тем выше глубина восстановления кислоты, т. е. 33 тем
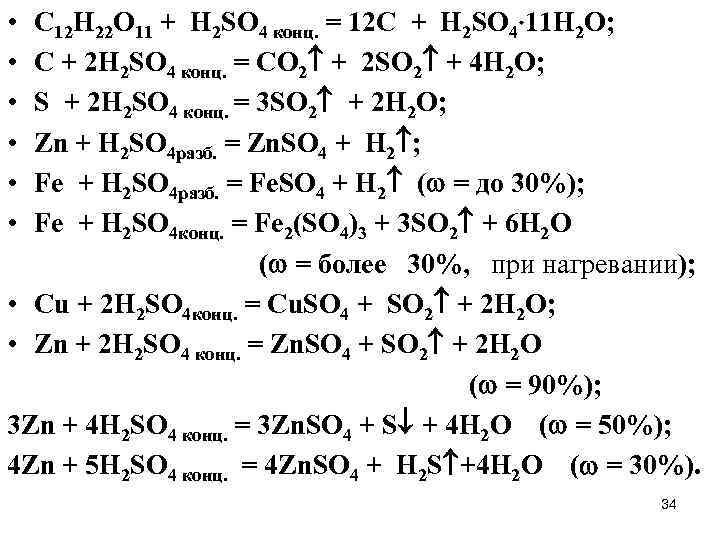 • C 12 H 22 O 11 + H 2 SO 4 конц. = 12 C + H 2 SO 4 11 H 2 O; • C + 2 H 2 SO 4 конц. = CO 2 + 2 SO 2 + 4 H 2 O; • S + 2 H 2 SO 4 конц. = 3 SO 2 + 2 H 2 O; • Zn + H 2 SO 4 разб. = Zn. SO 4 + H 2 ; • Fe + H 2 SO 4 разб. = Fe. SO 4 + H 2 ( = до 30%); • Fe + H 2 SO 4 конц. = Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O ( = более 30%, при нагревании); • Cu + 2 H 2 SO 4 конц. = Cu. SO 4 + SO 2 + 2 H 2 O; • Zn + 2 H 2 SO 4 конц. = Zn. SO 4 + SO 2 + 2 H 2 O ( = 90%); 3 Zn + 4 H 2 SO 4 конц. = 3 Zn. SO 4 + S + 4 H 2 O ( = 50%); 4 Zn + 5 H 2 SO 4 конц. = 4 Zn. SO 4 + H 2 S +4 H 2 O ( = 30%). 34
• C 12 H 22 O 11 + H 2 SO 4 конц. = 12 C + H 2 SO 4 11 H 2 O; • C + 2 H 2 SO 4 конц. = CO 2 + 2 SO 2 + 4 H 2 O; • S + 2 H 2 SO 4 конц. = 3 SO 2 + 2 H 2 O; • Zn + H 2 SO 4 разб. = Zn. SO 4 + H 2 ; • Fe + H 2 SO 4 разб. = Fe. SO 4 + H 2 ( = до 30%); • Fe + H 2 SO 4 конц. = Fe 2(SO 4)3 + 3 SO 2 + 6 H 2 O ( = более 30%, при нагревании); • Cu + 2 H 2 SO 4 конц. = Cu. SO 4 + SO 2 + 2 H 2 O; • Zn + 2 H 2 SO 4 конц. = Zn. SO 4 + SO 2 + 2 H 2 O ( = 90%); 3 Zn + 4 H 2 SO 4 конц. = 3 Zn. SO 4 + S + 4 H 2 O ( = 50%); 4 Zn + 5 H 2 SO 4 конц. = 4 Zn. SO 4 + H 2 S +4 H 2 O ( = 30%). 34
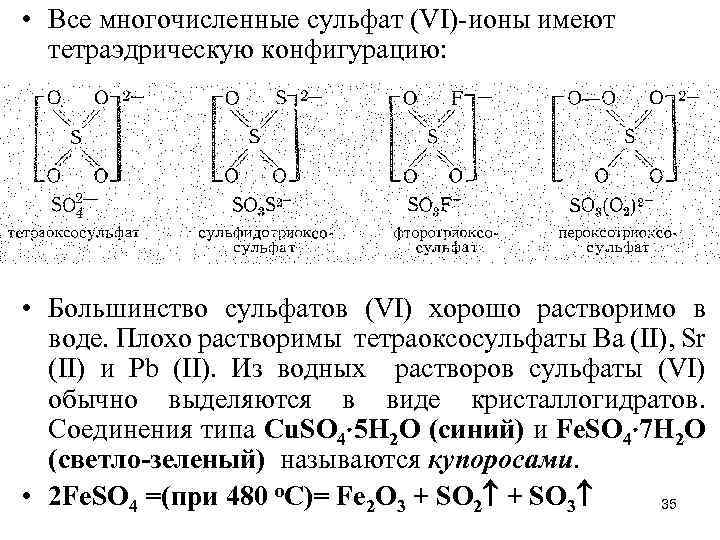 • Все многочисленные сульфат (VI)-ионы имеют тетраэдрическую конфигурацию: • Большинство сульфатов (VI) хорошо растворимо в воде. Плохо растворимы тетраоксосульфаты Ва (II), Sr (II) и Рb (II). Из водных растворов сульфаты (VI) обычно выделяются в виде кристаллогидратов. Соединения типа Cu. SO 4 5 H 2 O (синий) и Fe. SO 4 7 H 2 O (светло-зеленый) называются купоросами. • 2 Fe. SO 4 =(при 480 о. С)= Fe 2 O 3 + SO 2 + SO 3 35
• Все многочисленные сульфат (VI)-ионы имеют тетраэдрическую конфигурацию: • Большинство сульфатов (VI) хорошо растворимо в воде. Плохо растворимы тетраоксосульфаты Ва (II), Sr (II) и Рb (II). Из водных растворов сульфаты (VI) обычно выделяются в виде кристаллогидратов. Соединения типа Cu. SO 4 5 H 2 O (синий) и Fe. SO 4 7 H 2 O (светло-зеленый) называются купоросами. • 2 Fe. SO 4 =(при 480 о. С)= Fe 2 O 3 + SO 2 + SO 3 35
 При нагревании выше 600 о. С 2 SO 3 = 2 SO 2 + O 2. SO 3 + HCl = HSO 3 Cl Триоксофторсульфат водорода Н[SО 3 F] (фторсульфоновая кислота) и триоксохлорсульфонат водорода Н[SО 3 Сl] (хлорсульфоновая кислота) жидкости (Tкип. 152 о. С с разложением). В водном растворе Н[SО F] 3 очень сильная кислота (подобна НСl. О 4) и гидролизуется медленно, тогда как гидролиз H[SO 3 Cl] (тоже сильная кислота) протекает очень энергично. H[SO 3 Cl] + H 2 O = HCl + H 2 SO 4 36
При нагревании выше 600 о. С 2 SO 3 = 2 SO 2 + O 2. SO 3 + HCl = HSO 3 Cl Триоксофторсульфат водорода Н[SО 3 F] (фторсульфоновая кислота) и триоксохлорсульфонат водорода Н[SО 3 Сl] (хлорсульфоновая кислота) жидкости (Tкип. 152 о. С с разложением). В водном растворе Н[SО F] 3 очень сильная кислота (подобна НСl. О 4) и гидролизуется медленно, тогда как гидролиз H[SO 3 Cl] (тоже сильная кислота) протекает очень энергично. H[SO 3 Cl] + H 2 O = HCl + H 2 SO 4 36
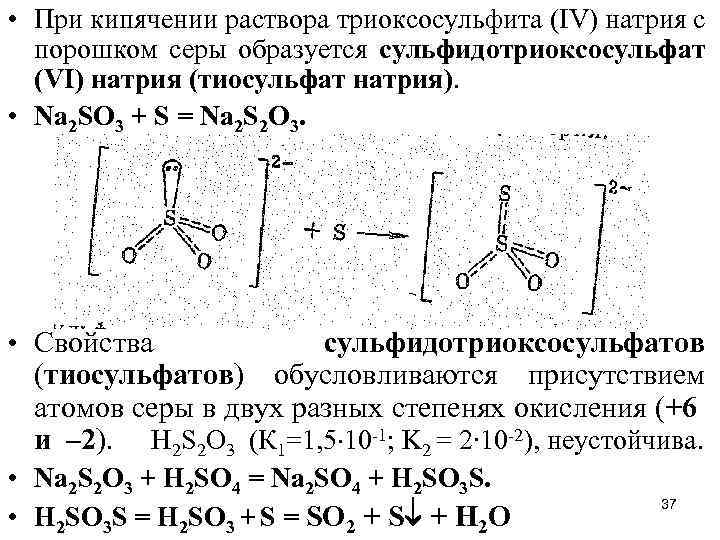 • При кипячении раствора триоксосульфита (IV) натрия с порошком серы образуется сульфидотриоксосульфат (VI) натрия (тиосульфат натрия). • Na 2 SO 3 + S = Na 2 S 2 O 3. • Свойства сульфидотриоксосульфатов (тиосульфатов) обусловливаются присутствием атомов серы в двух разных степенях окисления (+6 и – 2). Н 2 S 2 O 3 (К 1=1, 5 10 -1; K 2 = 2∙ 10 -2), неустойчива. • Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + Н 2 SO 3 S. • Н 2 SO 3 S = Н 2 SO 3 + S = SO 2 + S + H 2 O 37
• При кипячении раствора триоксосульфита (IV) натрия с порошком серы образуется сульфидотриоксосульфат (VI) натрия (тиосульфат натрия). • Na 2 SO 3 + S = Na 2 S 2 O 3. • Свойства сульфидотриоксосульфатов (тиосульфатов) обусловливаются присутствием атомов серы в двух разных степенях окисления (+6 и – 2). Н 2 S 2 O 3 (К 1=1, 5 10 -1; K 2 = 2∙ 10 -2), неустойчива. • Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + Н 2 SO 3 S. • Н 2 SO 3 S = Н 2 SO 3 + S = SO 2 + S + H 2 O 37
 Тиосульфат натрия – сильный восстановитель (наличие S 2 -), его реакция с хлором протекает – Na 2 S 2 O 3 + 4 Cl 2 + 5 H 2 O = 2 H 2 SO 4 + Na. Cl + 6 HCl; Если Na 2 S 2 O 3 взят в избытке, то образовавшиеся кислоты реагируют с ним Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 +SO 2 + S + H 2 O. Иначе протекает взаимодействие с иодом 2 Na 2 S 2 O 3 + I 2 = 2 Na. I + Na 2 S 4 O 6, тетратионат натрия является солью тетратионовой кислоты (одной из политионовых кислот). Данная реакция протекает строго количественно и лежит в основе иодометрического титрования. Этим методом можно определять содержание разнообразных окислителей. К анализируемому веществу добавляют избыток раствора KI и выделившийся при действии окислителей I 2 оттитровывают раствором Na 2 S 2 O 3, используя в качестве индикатора крахмал. • Из тиосульфатов наибольшее применение имеет гипосульфит Na 2 S 2 O 3 3 H 2 O (в медицине). 38
Тиосульфат натрия – сильный восстановитель (наличие S 2 -), его реакция с хлором протекает – Na 2 S 2 O 3 + 4 Cl 2 + 5 H 2 O = 2 H 2 SO 4 + Na. Cl + 6 HCl; Если Na 2 S 2 O 3 взят в избытке, то образовавшиеся кислоты реагируют с ним Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 +SO 2 + S + H 2 O. Иначе протекает взаимодействие с иодом 2 Na 2 S 2 O 3 + I 2 = 2 Na. I + Na 2 S 4 O 6, тетратионат натрия является солью тетратионовой кислоты (одной из политионовых кислот). Данная реакция протекает строго количественно и лежит в основе иодометрического титрования. Этим методом можно определять содержание разнообразных окислителей. К анализируемому веществу добавляют избыток раствора KI и выделившийся при действии окислителей I 2 оттитровывают раствором Na 2 S 2 O 3, используя в качестве индикатора крахмал. • Из тиосульфатов наибольшее применение имеет гипосульфит Na 2 S 2 O 3 3 H 2 O (в медицине). 38
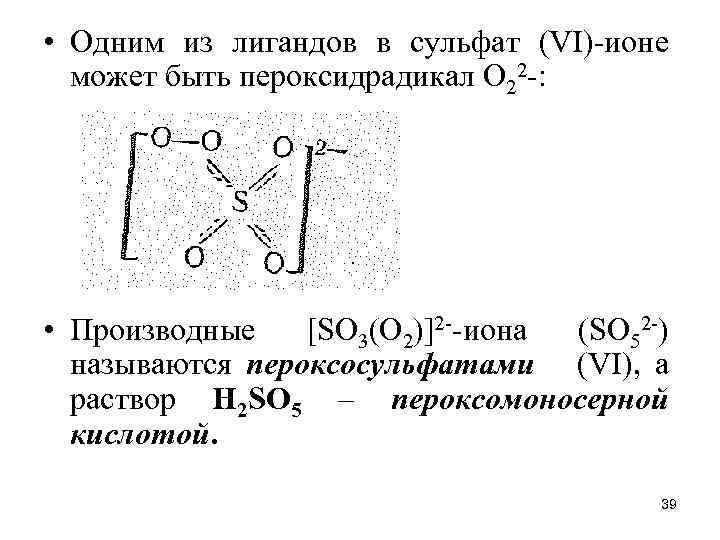 • Одним из лигандов в сульфат (VI)-ионе может быть пероксидрадикал О 22 -: • Производные [SО 3(O 2)]2 --иона (SО 52 -) называются пероксосульфатами (VI), а раствор Н 2 SО 5 – пероксомоносерной кислотой. 39
• Одним из лигандов в сульфат (VI)-ионе может быть пероксидрадикал О 22 -: • Производные [SО 3(O 2)]2 --иона (SО 52 -) называются пероксосульфатами (VI), а раствор Н 2 SО 5 – пероксомоносерной кислотой. 39
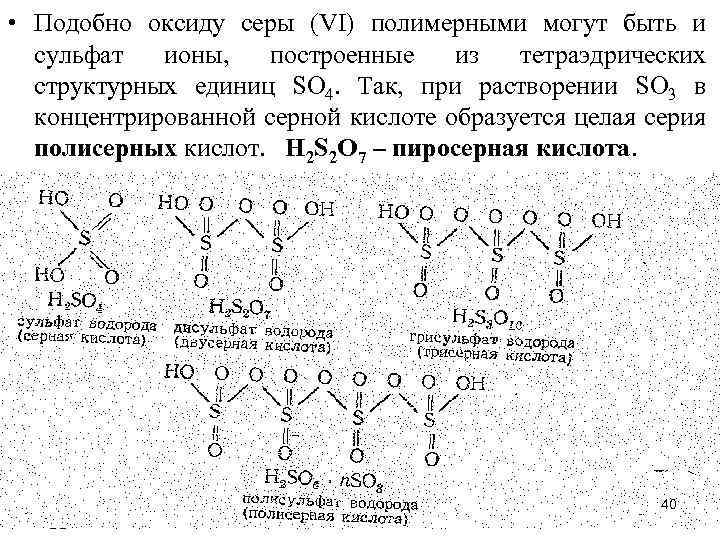 • Подобно оксиду серы (VI) полимерными могут быть и сульфат ионы, построенные из тетраэдрических структурных единиц SO 4. Так, при растворении SO 3 в концентрированной серной кислоте образуется целая серия полисерных кислот. H 2 S 2 O 7 – пиросерная кислота. 40
• Подобно оксиду серы (VI) полимерными могут быть и сульфат ионы, построенные из тетраэдрических структурных единиц SO 4. Так, при растворении SO 3 в концентрированной серной кислоте образуется целая серия полисерных кислот. H 2 S 2 O 7 – пиросерная кислота. 40
 • Смесь Н 2 SO 4, Н 2 S 2 О 7, Н 2 S 3 О 10, Н 2 S 4 O 13 густая маслянистая дымящая на воздухе жидкость (олеум) широко используется в промышленности. Под действием воды связи S—О—S разрываются и полисерные кислоты превращаются в серную. 41
• Смесь Н 2 SO 4, Н 2 S 2 О 7, Н 2 S 3 О 10, Н 2 S 4 O 13 густая маслянистая дымящая на воздухе жидкость (олеум) широко используется в промышленности. Под действием воды связи S—О—S разрываются и полисерные кислоты превращаются в серную. 41
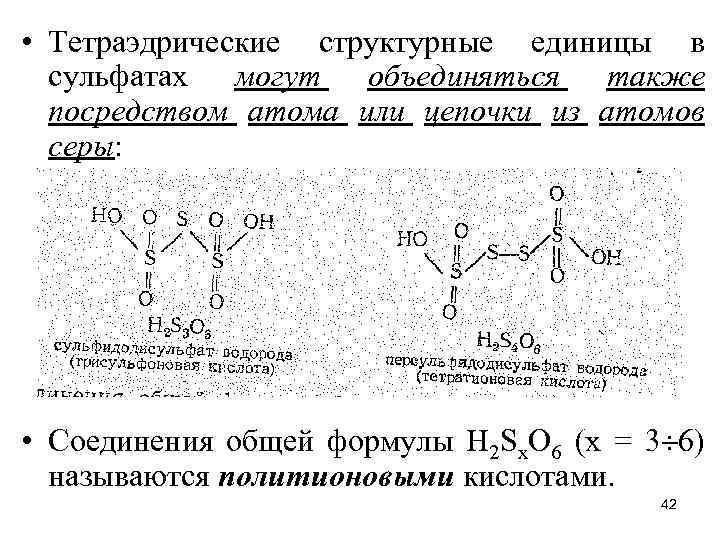 • Тетраэдрические структурные единицы в сульфатах могут объединяться также посредством атома или цепочки из атомов серы: • Соединения общей формулы Н 2 Sx. O 6 (х = 3 6) называются политионовыми кислотами. 42
• Тетраэдрические структурные единицы в сульфатах могут объединяться также посредством атома или цепочки из атомов серы: • Соединения общей формулы Н 2 Sx. O 6 (х = 3 6) называются политионовыми кислотами. 42
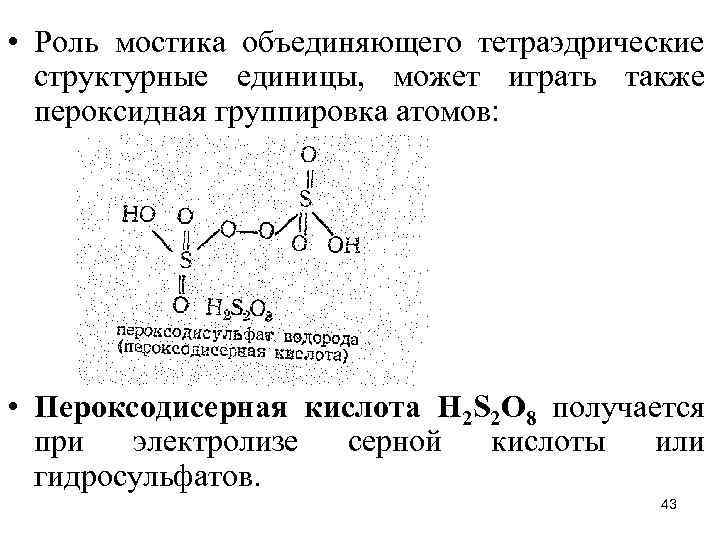 • Роль мостика объединяющего тетраэдрические структурные единицы, может играть также пероксидная группировка атомов: • Пероксодисерная кислота Н 2 S 2 О 8 получается при электролизе серной кислоты или гидросульфатов. 43
• Роль мостика объединяющего тетраэдрические структурные единицы, может играть также пероксидная группировка атомов: • Пероксодисерная кислота Н 2 S 2 О 8 получается при электролизе серной кислоты или гидросульфатов. 43
 • Пероксодисерная кислота Н 2 S 2 О 8, как и пероксомоносерная Н 2 SО 5 гидролизуется с образованием пероксида водорода: Н 2 S 2 O 8 + 2 Н 2 О = 2 Н 2 SО 4 + H 2 O 2 Н 2 SO 5 + Н 2 O = Н 2 SО 4 + Н 2 O 2 • Этим пользуются для получения перекиси водорода в технике. • Пероксосульфаты (VI) — сильные окислители, используются при проведении химического анализа и синтеза. Пероксосерные кислоты обугливают бумагу, сахар и даже парафин. 44
• Пероксодисерная кислота Н 2 S 2 О 8, как и пероксомоносерная Н 2 SО 5 гидролизуется с образованием пероксида водорода: Н 2 S 2 O 8 + 2 Н 2 О = 2 Н 2 SО 4 + H 2 O 2 Н 2 SO 5 + Н 2 O = Н 2 SО 4 + Н 2 O 2 • Этим пользуются для получения перекиси водорода в технике. • Пероксосульфаты (VI) — сильные окислители, используются при проведении химического анализа и синтеза. Пероксосерные кислоты обугливают бумагу, сахар и даже парафин. 44
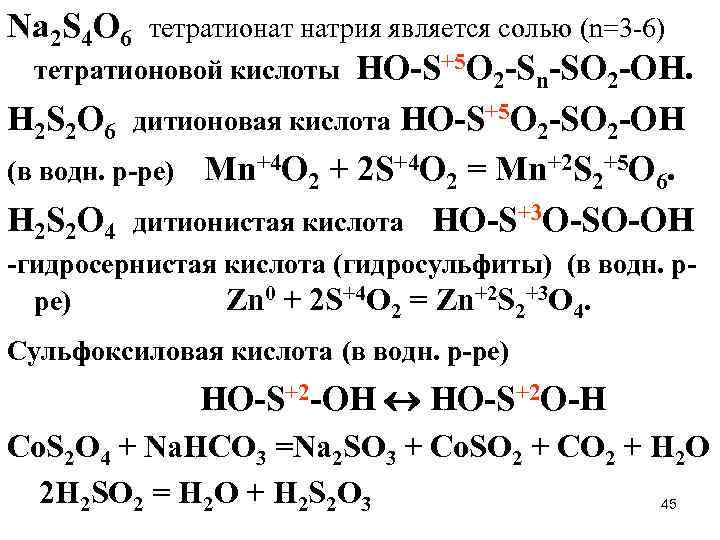 Na 2 S 4 O 6 тетратионат натрия является солью (n=3 -6) тетратионовой кислоты HO-S+5 O 2 -Sn-SO 2 -OH. H 2 S 2 O 6 дитионовая кислота HO-S+5 O 2 -SO 2 -OH (в водн. р-ре) Mn+4 O 2 + 2 S+4 O 2 = Mn+2 S 2+5 O 6. H 2 S 2 O 4 дитионистая кислота HO-S+3 O-SO-OH -гидросернистая кислота (гидросульфиты) (в водн. рре) Zn 0 + 2 S+4 O 2 = Zn+2 S 2+3 O 4. Сульфоксиловая кислота (в водн. р-ре) HO-S+2 -OH HO-S+2 O-H Co. S 2 O 4 + Na. HCO 3 =Na 2 SO 3 + Co. SO 2 + CO 2 + H 2 O 2 H 2 SO 2 = H 2 O + H 2 S 2 O 3 45
Na 2 S 4 O 6 тетратионат натрия является солью (n=3 -6) тетратионовой кислоты HO-S+5 O 2 -Sn-SO 2 -OH. H 2 S 2 O 6 дитионовая кислота HO-S+5 O 2 -SO 2 -OH (в водн. р-ре) Mn+4 O 2 + 2 S+4 O 2 = Mn+2 S 2+5 O 6. H 2 S 2 O 4 дитионистая кислота HO-S+3 O-SO-OH -гидросернистая кислота (гидросульфиты) (в водн. рре) Zn 0 + 2 S+4 O 2 = Zn+2 S 2+3 O 4. Сульфоксиловая кислота (в водн. р-ре) HO-S+2 -OH HO-S+2 O-H Co. S 2 O 4 + Na. HCO 3 =Na 2 SO 3 + Co. SO 2 + CO 2 + H 2 O 2 H 2 SO 2 = H 2 O + H 2 S 2 O 3 45
 • Ст. ок. +4 желтый Тпл. о. С (разлаг. ) SO 2 Se. O 2 Te. O 2 Po. O 2 газ тв. в-во. крист. бесцв. белый -75 (возг. ) 733 337 уменьшение растворимости в воде ослабление кислотных свойств рост восстановительной активности Ст. ок. +6 Тпл. о. С SO 3 Se. O 3 Te. O 3 бесц. белое желтое летуч. тв. в-во. 16, 8 121 разлаг. 400 500 46
• Ст. ок. +4 желтый Тпл. о. С (разлаг. ) SO 2 Se. O 2 Te. O 2 Po. O 2 газ тв. в-во. крист. бесцв. белый -75 (возг. ) 733 337 уменьшение растворимости в воде ослабление кислотных свойств рост восстановительной активности Ст. ок. +6 Тпл. о. С SO 3 Se. O 3 Te. O 3 бесц. белое желтое летуч. тв. в-во. 16, 8 121 разлаг. 400 500 46
 Ст. ок. +4 Н 2 SO 3 Н 2 Sе. O 3 Н 2 Те. O 3 неустойч. в раств. сернистая Ст. ок. +6 в раств. полимеризуется теллуристая к-та ослабление кислотных свойств 2 10 -2 2 10 -3 3 10 -6 Н 2 SO 4 Н 2 Sе. O 4 Н 6 Те. O 6 бесцв. Тпл. тв. в-во белое селенистая маслянистая ж. 10, 3 серная белое крист. в-во 62, 4 селеновая 1 103 белое крист. в-во 136 теллуровая 2 10 -8 рост окислительной активности 47
Ст. ок. +4 Н 2 SO 3 Н 2 Sе. O 3 Н 2 Те. O 3 неустойч. в раств. сернистая Ст. ок. +6 в раств. полимеризуется теллуристая к-та ослабление кислотных свойств 2 10 -2 2 10 -3 3 10 -6 Н 2 SO 4 Н 2 Sе. O 4 Н 6 Те. O 6 бесцв. Тпл. тв. в-во белое селенистая маслянистая ж. 10, 3 серная белое крист. в-во 62, 4 селеновая 1 103 белое крист. в-во 136 теллуровая 2 10 -8 рост окислительной активности 47
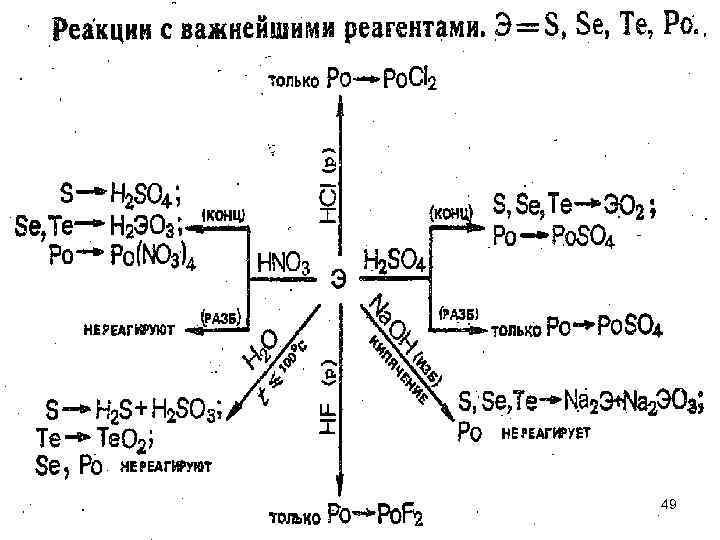
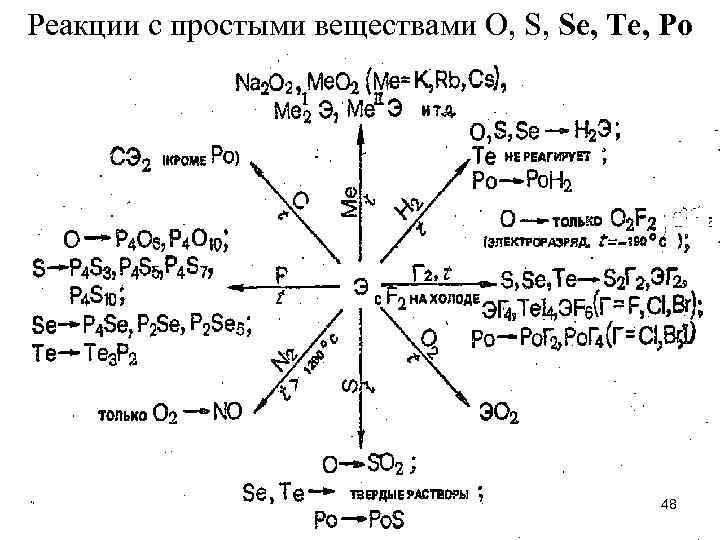 Реакции с простыми веществами O, S, Se, Te, Po 48
Реакции с простыми веществами O, S, Se, Te, Po 48
 49
49


