L_19_T_12_13_Elementy_VIV_i_VIIV__grupp.ppt
- Количество слайдов: 62
 Т 12, 13 Л 19 d-ЭЛЕМЕНТЫ VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Хром Сr, молибден Мо и вольфрам W— dэлементы VI группы — образуют подгруппу хрома. [(n-1)d 5 s 1 для Сr и Мо; (n-1)d 4 s 2 для W]. В ряду Сr—Мо—W увеличивается энергия ионизации, т. е. уплотняются электронные оболочки атомов, в особенности сильно при переходе от Мо к W. Последний вследствие лантаноидного сжатия имеет атомный и ионный радиусы, близкие к таковым у Мо. Поэтому молибден и вольфрам по свойствам ближе друг к 1 другу, чем к хрому.
Т 12, 13 Л 19 d-ЭЛЕМЕНТЫ VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Хром Сr, молибден Мо и вольфрам W— dэлементы VI группы — образуют подгруппу хрома. [(n-1)d 5 s 1 для Сr и Мо; (n-1)d 4 s 2 для W]. В ряду Сr—Мо—W увеличивается энергия ионизации, т. е. уплотняются электронные оболочки атомов, в особенности сильно при переходе от Мо к W. Последний вследствие лантаноидного сжатия имеет атомный и ионный радиусы, близкие к таковым у Мо. Поэтому молибден и вольфрам по свойствам ближе друг к 1 другу, чем к хрому.
 • Характерные степени окисления хрома +3 и в меньшей мере +6. У молибдена и вольфрама, как и у других 4 d- и 5 d-элементов, наиболее характерна высшая степень окисления, т. е. +6. Возможны также соединения, где хром и его аналоги проявляют степени окисления 0, +1, +2, +4 и +5. • Как и для других s-элементов, для Сr, Мо и W при низких степенях окисления более характерны катионные комплексы, а при высоких — анионные комплексы. • Так, для Сr (III) возможны и катионные и анионные комплексы, тогда как для Сr (VI), Мо (VI) и W (VI) типичны анионные комплексы. В соответствии с этим, в частности, Сr. О основной оксид, Сr 2 O 3 — 2 амфотерный, а Сr. О 3 — кислотный.
• Характерные степени окисления хрома +3 и в меньшей мере +6. У молибдена и вольфрама, как и у других 4 d- и 5 d-элементов, наиболее характерна высшая степень окисления, т. е. +6. Возможны также соединения, где хром и его аналоги проявляют степени окисления 0, +1, +2, +4 и +5. • Как и для других s-элементов, для Сr, Мо и W при низких степенях окисления более характерны катионные комплексы, а при высоких — анионные комплексы. • Так, для Сr (III) возможны и катионные и анионные комплексы, тогда как для Сr (VI), Мо (VI) и W (VI) типичны анионные комплексы. В соответствии с этим, в частности, Сr. О основной оксид, Сr 2 O 3 — 2 амфотерный, а Сr. О 3 — кислотный.
 Подгруппа хрома • Природный хром состоит из четырех стабильных изотопов, молибден — из семи, вольфрам — из пяти. Большое число радиоактивных изотопов получено искусственно. Из минералов наибольшее значение имеют Fе(Сr. О 2)2 хромистый железняк; Мо. S 2 — молибденит, Са. WO 4 – шеелит, (Fе, Мn)WO 4 — вольфрамит. • Наличие в почве следов молибдена необходимо для нормального развития растительных организмов. Особенно это относится к растениям семейства бобовых. Соединения молибдена, повидимому, играют роль катализаторов процесса фиксации атмосферного азота. 3
Подгруппа хрома • Природный хром состоит из четырех стабильных изотопов, молибден — из семи, вольфрам — из пяти. Большое число радиоактивных изотопов получено искусственно. Из минералов наибольшее значение имеют Fе(Сr. О 2)2 хромистый железняк; Мо. S 2 — молибденит, Са. WO 4 – шеелит, (Fе, Мn)WO 4 — вольфрамит. • Наличие в почве следов молибдена необходимо для нормального развития растительных организмов. Особенно это относится к растениям семейства бобовых. Соединения молибдена, повидимому, играют роль катализаторов процесса фиксации атмосферного азота. 3
 • Простые вещества. В виде простых веществ хром, молибден и вольфрам — серовато-белые блестящие металлы. Устойчивые в обычных условиях модификации Сr, Мо и W имеют структуру объемноцентрированного куба. Сплав электрон - плотность (1, 8 г/см 3) 4
• Простые вещества. В виде простых веществ хром, молибден и вольфрам — серовато-белые блестящие металлы. Устойчивые в обычных условиях модификации Сr, Мо и W имеют структуру объемноцентрированного куба. Сплав электрон - плотность (1, 8 г/см 3) 4
 • Вольфрам является самым тугоплавким из металлов. В ряду Сr—Мо—W наблюдается повышение температуры плавления и теплоты атомизации (возгонки), что объясняют усилением в металлическом кристалле ковалентной связи, возникающей за счет d-электронов. • На свойства металлов в большой степени влияют примеси. • Так, технический хром — один из самых твердых металлов, в то время как чистый хром пластичен. 5
• Вольфрам является самым тугоплавким из металлов. В ряду Сr—Мо—W наблюдается повышение температуры плавления и теплоты атомизации (возгонки), что объясняют усилением в металлическом кристалле ковалентной связи, возникающей за счет d-электронов. • На свойства металлов в большой степени влияют примеси. • Так, технический хром — один из самых твердых металлов, в то время как чистый хром пластичен. 5
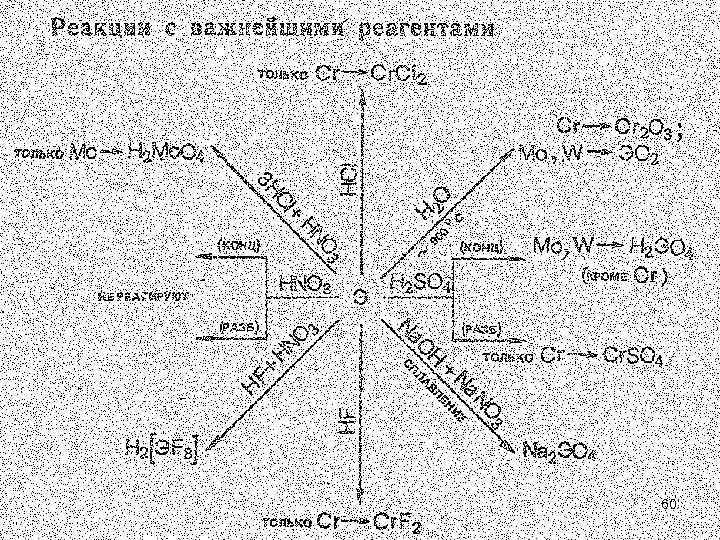
 • Как и в других подгруппах d-элементов, с ростом порядкового номера элемента в ряду Сr—Мо—W химическая активность заметно понижается. Так, хром вытесняет водород из разбавленных НСl и Н 2 SO 4, Cr + H 2 SO 4 (разб) Cr. SO 4 + H 2 (в конц. пассивир. ); тогда как вольфрам растворяется лишь в горячей смеси плавиковой и азотной кислот (как и Cr, Mo) : Э 0+ 2 НNO 3 + 8 НF = Н 2[Э+6 F 8] + 2 NO + 4 Н 2 O. 2 Cr (Mo, W) + 3 H 2 O –t Cr 2 O 3 (Mo. O 2, WO 2) (~900 о. С). • За счет образования анионных комплексов ЭО 42 - молибден и вольфрам взаимодействуют также при сплавлении со щелочами в присутствии окислителя: Э 0 + 3 Nа. N+5 О 3 + 2 Na. OH = 6 Nа 2 Э+6 O 4 + Na. N+3 O 2 + Н 2 O
• Как и в других подгруппах d-элементов, с ростом порядкового номера элемента в ряду Сr—Мо—W химическая активность заметно понижается. Так, хром вытесняет водород из разбавленных НСl и Н 2 SO 4, Cr + H 2 SO 4 (разб) Cr. SO 4 + H 2 (в конц. пассивир. ); тогда как вольфрам растворяется лишь в горячей смеси плавиковой и азотной кислот (как и Cr, Mo) : Э 0+ 2 НNO 3 + 8 НF = Н 2[Э+6 F 8] + 2 NO + 4 Н 2 O. 2 Cr (Mo, W) + 3 H 2 O –t Cr 2 O 3 (Mo. O 2, WO 2) (~900 о. С). • За счет образования анионных комплексов ЭО 42 - молибден и вольфрам взаимодействуют также при сплавлении со щелочами в присутствии окислителя: Э 0 + 3 Nа. N+5 О 3 + 2 Na. OH = 6 Nа 2 Э+6 O 4 + Na. N+3 O 2 + Н 2 O
 • В разбавленной и концентрированной НNO 3 Сr, Мо, W пассивируются. • При нагревании, в особенности в мелкораздробленном состоянии, Сr, Мо и W довольно легко окисляются многими неметаллами, например сгорают в кислороде: 2 Сr (к) + 3/2 О 2 (г) = Сr 2 O 3 (к), Go 298 = -1058 к. Дж/моль; Мо (к) (W) + 3/2 O 2 (г) = Мо. O 3 (к) (WO 3), Go 298 = -677 к. Дж/моль. При этом образуются оксид хрома (III) и оксиды молибдена (VI) в вольфрама (VI), что соответствует устойчивым степеням окисления Сr и Мо, W. Образование Сr. О 3 термодинамически менее выгодно, чем Сr 2 O 3 (значение Go 298 Сr 2 O 3 в расчете на 1 моль О почти в два раза больше, чем у Сr. О 3, Go 298 (Сr. O 3) = -506 к. Дж/моль). 7
• В разбавленной и концентрированной НNO 3 Сr, Мо, W пассивируются. • При нагревании, в особенности в мелкораздробленном состоянии, Сr, Мо и W довольно легко окисляются многими неметаллами, например сгорают в кислороде: 2 Сr (к) + 3/2 О 2 (г) = Сr 2 O 3 (к), Go 298 = -1058 к. Дж/моль; Мо (к) (W) + 3/2 O 2 (г) = Мо. O 3 (к) (WO 3), Go 298 = -677 к. Дж/моль. При этом образуются оксид хрома (III) и оксиды молибдена (VI) в вольфрама (VI), что соответствует устойчивым степеням окисления Сr и Мо, W. Образование Сr. О 3 термодинамически менее выгодно, чем Сr 2 O 3 (значение Go 298 Сr 2 O 3 в расчете на 1 моль О почти в два раза больше, чем у Сr. О 3, Go 298 (Сr. O 3) = -506 к. Дж/моль). 7
 • Хром легко пассивируется, поэтому широко используется в качестве гальванических защитных покрытий и для получения коррозионностойких сталей. Молибден применяется для изготовления химической аппаратуры, вольфрам - в электротехнической промышленности (в частности, для производства ламп накаливания). Молибден и вольфрам применяются в качестве катализаторов. • Относительно чистый хром получают методом алюмотермии: Сr 2 O 3 (к) + 2 Аl (к) = 2 Сr (к) + Аl 2 O 3 (к), Go 298 = — 510 к. Дж/моль, • а молибден и вольфрам — восстановлением их оксидов водородом: Мо. О 3 + 3 Н 2 = Мо + 3 Н 2 О. 8
• Хром легко пассивируется, поэтому широко используется в качестве гальванических защитных покрытий и для получения коррозионностойких сталей. Молибден применяется для изготовления химической аппаратуры, вольфрам - в электротехнической промышленности (в частности, для производства ламп накаливания). Молибден и вольфрам применяются в качестве катализаторов. • Относительно чистый хром получают методом алюмотермии: Сr 2 O 3 (к) + 2 Аl (к) = 2 Сr (к) + Аl 2 O 3 (к), Go 298 = — 510 к. Дж/моль, • а молибден и вольфрам — восстановлением их оксидов водородом: Мо. О 3 + 3 Н 2 = Мо + 3 Н 2 О. 8
 • Для металлургии хром получают в виде сплава с железом (феррохром, содержащий до 60 % Сr) восстановлением хромистого железняка углем в электрической печи: Fе+2(Сr+3 О 2)2 + 4 С 0 = Fе 0 + 2 Сr 0 + 4 С+2 O • Выплавляют также ферромолибден и ферровольфрам, которые используются для получения высококачественных специальных сталей. 9
• Для металлургии хром получают в виде сплава с железом (феррохром, содержащий до 60 % Сr) восстановлением хромистого железняка углем в электрической печи: Fе+2(Сr+3 О 2)2 + 4 С 0 = Fе 0 + 2 Сr 0 + 4 С+2 O • Выплавляют также ферромолибден и ферровольфрам, которые используются для получения высококачественных специальных сталей. 9
 Соединения Сr(0), Мо(0), W(0). Нулевая степень окисления у элементов проявляется в соединениях с донорными и -акцепторными лигандами, например с молекулами СО. Для хрома и его аналогов известны гексакарбонилы Э(СО)6, Это — бесцветные легко возгоняющиеся твердые вещества (Тпл. 150— 170 °С). Их молекулы диамагнитны (нет неспаренных электронов), имеют форму октаэдра с атомом dэлемента в центре. В нулевой степени окисления атомам хрома и его аналогов можно приписать электронную конфигурацию d 6: 10
Соединения Сr(0), Мо(0), W(0). Нулевая степень окисления у элементов проявляется в соединениях с донорными и -акцепторными лигандами, например с молекулами СО. Для хрома и его аналогов известны гексакарбонилы Э(СО)6, Это — бесцветные легко возгоняющиеся твердые вещества (Тпл. 150— 170 °С). Их молекулы диамагнитны (нет неспаренных электронов), имеют форму октаэдра с атомом dэлемента в центре. В нулевой степени окисления атомам хрома и его аналогов можно приписать электронную конфигурацию d 6: 10
 • За счет шести свободных 3 d 2 4 s 4 p 3 -орбиталей Сr(0) присоединяет шесть молекул СО. Стабилизация молекулы Сr(СО)6 достигается за счет -дативного взаимодействия Сr СО, в котором принимают участие 3 d -электронные пары атома хрома и свободные pазp-орбитали молекул СО. Вследствие переноса заряда от СО к атому Сr (при -донорно-акцепторном взаимодействии) и от атома Сr к молекуле СО (при -дативном взаимодействии) результирующий заряд на атоме хрома оказывается положительным = 0, 4+. 11
• За счет шести свободных 3 d 2 4 s 4 p 3 -орбиталей Сr(0) присоединяет шесть молекул СО. Стабилизация молекулы Сr(СО)6 достигается за счет -дативного взаимодействия Сr СО, в котором принимают участие 3 d -электронные пары атома хрома и свободные pазp-орбитали молекул СО. Вследствие переноса заряда от СО к атому Сr (при -донорно-акцепторном взаимодействии) и от атома Сr к молекуле СО (при -дативном взаимодействии) результирующий заряд на атоме хрома оказывается положительным = 0, 4+. 11
 • Карбонилы d-элементов жидкости или кристаллические вещества, хорошо растворимые в органических растворителях. Как и СО, они чрезвычайно токсичны. Термическим разложением карбонилов получают чистейшие металлы. Кроме того, их используют в химическом синтезе. Карбонилы металлов синтезируют различными способами. Никель, железо и кобальт непосредственно реагируют с оксидом углерода (II), давая карбонилы. Обычно же их получают восстановлением соответствующих солей или комплексов металлов в присутствии СО. Карбонилы могут быть одно-, двух- и многоядерными (кластерные соединения). Одноядерные карбонилы образуют dэлементы с четным числом валентных электронов. d -Элементы с нечетным числом валентных электронов образуют двухъядерные карбонилы 12 кластерного типа со связью М—М.
• Карбонилы d-элементов жидкости или кристаллические вещества, хорошо растворимые в органических растворителях. Как и СО, они чрезвычайно токсичны. Термическим разложением карбонилов получают чистейшие металлы. Кроме того, их используют в химическом синтезе. Карбонилы металлов синтезируют различными способами. Никель, железо и кобальт непосредственно реагируют с оксидом углерода (II), давая карбонилы. Обычно же их получают восстановлением соответствующих солей или комплексов металлов в присутствии СО. Карбонилы могут быть одно-, двух- и многоядерными (кластерные соединения). Одноядерные карбонилы образуют dэлементы с четным числом валентных электронов. d -Элементы с нечетным числом валентных электронов образуют двухъядерные карбонилы 12 кластерного типа со связью М—М.
 • Кластерные соединения. Для d-элементов характерны соединения, в которых содержатся группировки из двух и большего числа непосредственно связанных друг с другом атомов d-элементов. Такие группировки называются кластерами. Известные в настоящее время кластерные соединения распадаются на два больших класса: • 1) низшие галогениды и оксиды и 2) многоядерные карбонилы. • Кластеры первого типа в основном образуются 4 d- и 5 d-элементами V—VII групп (Nb и Та, Мо и W, Тс и Rе). Среди галогенидов и оксидов найдены двух-, трех- и шестиядерные кластеры. 13
• Кластерные соединения. Для d-элементов характерны соединения, в которых содержатся группировки из двух и большего числа непосредственно связанных друг с другом атомов d-элементов. Такие группировки называются кластерами. Известные в настоящее время кластерные соединения распадаются на два больших класса: • 1) низшие галогениды и оксиды и 2) многоядерные карбонилы. • Кластеры первого типа в основном образуются 4 d- и 5 d-элементами V—VII групп (Nb и Та, Мо и W, Тс и Rе). Среди галогенидов и оксидов найдены двух-, трех- и шестиядерные кластеры. 13
 • Примером шестиядерного (октаэдрического) кластерного соединения является дихлорид молибдена Мо. Сl 2 (желтого цвета). По данным рентгеноструктурного анализа, Мо. Сl 2 отвечает формула [Мо 6 Сl 8]Сl 4. Комплекс [Мо 6 Сl 8]Сl 4 диамагнитен. Шесть атомов молибдена находятся в центрах граней куба, образуя октаэдр Мо 6; восемь атомов хлора расположены в вершинах куба, каждый атом Сl связан с тремя атомами Мо. Внешнесферные ионы Сl выполняют роль мостиков, объединяющих кластеры [Мо 6 Сl 8]4+ между собой. 14
• Примером шестиядерного (октаэдрического) кластерного соединения является дихлорид молибдена Мо. Сl 2 (желтого цвета). По данным рентгеноструктурного анализа, Мо. Сl 2 отвечает формула [Мо 6 Сl 8]Сl 4. Комплекс [Мо 6 Сl 8]Сl 4 диамагнитен. Шесть атомов молибдена находятся в центрах граней куба, образуя октаэдр Мо 6; восемь атомов хлора расположены в вершинах куба, каждый атом Сl связан с тремя атомами Мо. Внешнесферные ионы Сl выполняют роль мостиков, объединяющих кластеры [Мо 6 Сl 8]4+ между собой. 14
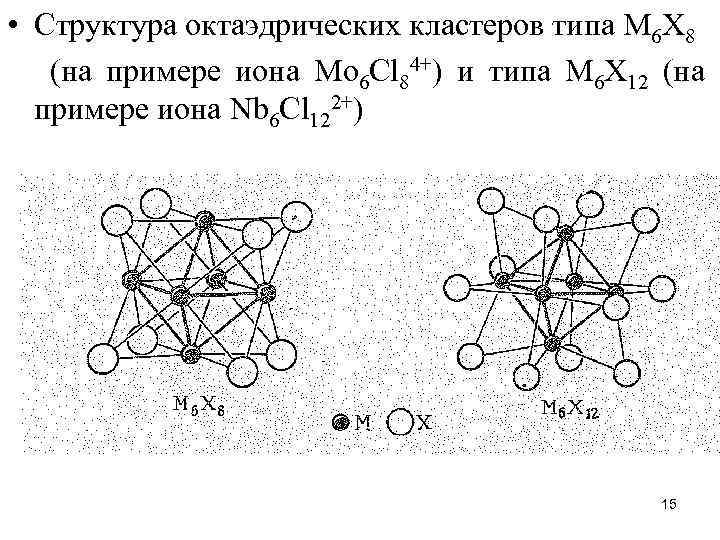 • Структура октаэдрических кластеров типа М 6 Х 8 (на примере иона Мо 6 Сl 84+) и типа М 6 Х 12 (на примере иона Nb 6 Cl 122+) 15
• Структура октаэдрических кластеров типа М 6 Х 8 (на примере иона Мо 6 Сl 84+) и типа М 6 Х 12 (на примере иона Nb 6 Cl 122+) 15
 • Соединения Сr (II), Мо (II), W (II). Для хрома в степени окисления +2 характерно координационное число 6. Это соответствует образованию, как правило, высокоспиновых комплексов (и структурных единиц) электронной конфигурацией (а) • а) • б) 16
• Соединения Сr (II), Мо (II), W (II). Для хрома в степени окисления +2 характерно координационное число 6. Это соответствует образованию, как правило, высокоспиновых комплексов (и структурных единиц) электронной конфигурацией (а) • а) • б) 16
 • Поскольку из двух орбиталей dразр-уровня занята только одна орбиталь (б) высокоспиновые октаэдрические комплексы геометрически искажены: два лиганда находятся на большем расстоянии, чем четыре остальных. Так, в кристалле Сr. Сl 2 четыре атома хлора удалены от Сr (II) на 0, 239 нм, а два других — на 0, 290 нм. • При удалении электрона с разрыхляющей орбитали возникает особо устойчивая конфигурация ( св)I 2( d)3: 17
• Поскольку из двух орбиталей dразр-уровня занята только одна орбиталь (б) высокоспиновые октаэдрические комплексы геометрически искажены: два лиганда находятся на большем расстоянии, чем четыре остальных. Так, в кристалле Сr. Сl 2 четыре атома хлора удалены от Сr (II) на 0, 239 нм, а два других — на 0, 290 нм. • При удалении электрона с разрыхляющей орбитали возникает особо устойчивая конфигурация ( св)I 2( d)3: 17
 • Соединения хрома (II) — сильные восстановители. Для хрома (II) известно лишь небольшое число бинарных соединений, в частности дигалогениды Сr. Наl 2, гидроксид Сr(ОН)2. Оксид хрома (II) Сr. О (черный) получить очень трудно, и факт его существования подвергается сомнению. • Бинарные соединения хрома (II), а также Сr(ОН)2 проявляют практически лишь основные свойства. Например, Сr(ОН)2 (желтый) взаимодействует только с кислотами: Сr(ОН)2 + 2 ОН 3+ + 2 Н 2 O = [Сr(OН 2)6]2+ (синего цвета) 18
• Соединения хрома (II) — сильные восстановители. Для хрома (II) известно лишь небольшое число бинарных соединений, в частности дигалогениды Сr. Наl 2, гидроксид Сr(ОН)2. Оксид хрома (II) Сr. О (черный) получить очень трудно, и факт его существования подвергается сомнению. • Бинарные соединения хрома (II), а также Сr(ОН)2 проявляют практически лишь основные свойства. Например, Сr(ОН)2 (желтый) взаимодействует только с кислотами: Сr(ОН)2 + 2 ОН 3+ + 2 Н 2 O = [Сr(OН 2)6]2+ (синего цвета) 18
 • Соединения Сr (III), Мо (III), W (III). У хрома степень окисления +3 является наиболее устойчивой. Координационное число хрома (III) равно шести, поэтому его комплексы (структурные единицы) имеют форму октаэдра. Валентные электроны в октаэдрических комплексах Сr (III) располагаются только на связывающих и несвязывающих орбиталях: (σсв)12(πd)2. 19
• Соединения Сr (III), Мо (III), W (III). У хрома степень окисления +3 является наиболее устойчивой. Координационное число хрома (III) равно шести, поэтому его комплексы (структурные единицы) имеют форму октаэдра. Валентные электроны в октаэдрических комплексах Сr (III) располагаются только на связывающих и несвязывающих орбиталях: (σсв)12(πd)2. 19
 • Оксид хрома (III) Сr 2 O 3 темно-зеленый порошок. Оксид хрома (III) тугоплавок (Tпл. 2265 °С), химически инертен. • В воде, кислотах и щелочах не растворяется. • Его амфотерная природа проявляется при сплавлении с соответствующими соединениями. Так, при сплавлении Сr 2 O 3 с дисульфатом калия образуется сульфат хрома (III): 3 K 2 S 2 O 7 = 3 K 2 SO 4 + 3 SO 3 Cr 2 O 3 + 3 SO 3 = Cr 2(SO 4)3 Cr 2 O 3 + 3 K 2 S 2 O 7 = Cr 2(SO 4)3 + 3 K 2 SO 4 основный 20
• Оксид хрома (III) Сr 2 O 3 темно-зеленый порошок. Оксид хрома (III) тугоплавок (Tпл. 2265 °С), химически инертен. • В воде, кислотах и щелочах не растворяется. • Его амфотерная природа проявляется при сплавлении с соответствующими соединениями. Так, при сплавлении Сr 2 O 3 с дисульфатом калия образуется сульфат хрома (III): 3 K 2 S 2 O 7 = 3 K 2 SO 4 + 3 SO 3 Cr 2 O 3 + 3 SO 3 = Cr 2(SO 4)3 Cr 2 O 3 + 3 K 2 S 2 O 7 = Cr 2(SO 4)3 + 3 K 2 SO 4 основный 20
 • А при сплавлении Сr 2 О 3 со щелочами и соответствующими основными оксидами образуются оксохроматы (III), называемые хромитами: 2 КОН + Сr 2 O 3 = 2 КСr. О 2 + Н 2 O кислотный • Оксохроматы (III) d-элементов типа M+2(Сr. О 2)2 являются координационными полимерами, т. е. смешанными оксидами (типа шпинели). В их кристаллах атомы М(II) находятся в тетраэдрическом, а атомы Сr(III) в октаэдрическом окружении атомов кислорода. Смешанным оксидом Сr(III) и Fе(II) является природный хромит — хромистый железняк Fе. Сr 2 О 4. 21
• А при сплавлении Сr 2 О 3 со щелочами и соответствующими основными оксидами образуются оксохроматы (III), называемые хромитами: 2 КОН + Сr 2 O 3 = 2 КСr. О 2 + Н 2 O кислотный • Оксохроматы (III) d-элементов типа M+2(Сr. О 2)2 являются координационными полимерами, т. е. смешанными оксидами (типа шпинели). В их кристаллах атомы М(II) находятся в тетраэдрическом, а атомы Сr(III) в октаэдрическом окружении атомов кислорода. Смешанным оксидом Сr(III) и Fе(II) является природный хромит — хромистый железняк Fе. Сr 2 О 4. 21
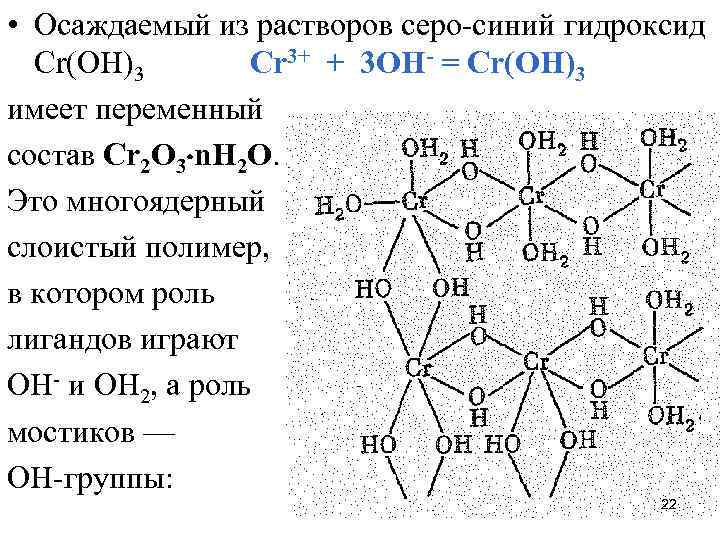 • Осаждаемый из растворов серо-синий гидроксид Сr(ОН)3 Сr 3+ + 3 OН- = Сr(ОН)3 имеет переменный состав Сr 2 О 3 n. Н 2 О. Это многоядерный слоистый полимер, в котором роль лигандов играют ОН- и ОН 2, а роль мостиков — ОН-группы: 22
• Осаждаемый из растворов серо-синий гидроксид Сr(ОН)3 Сr 3+ + 3 OН- = Сr(ОН)3 имеет переменный состав Сr 2 О 3 n. Н 2 О. Это многоядерный слоистый полимер, в котором роль лигандов играют ОН- и ОН 2, а роль мостиков — ОН-группы: 22
 • Его состав и структура зависят от условий получения. При стоянии и в особенности при нагревании Сr 2 O 3 n. Н 2 O вследствие замены связей Сr—ОН—Сr (оловые производные) на связи Сr—О—Сr (оксоловые производные) теряет активность. • Свежеполученный Сr(ОН)3 (т. е. Сr 2 O 3 n. Н 2 O ) хорошо растворяется в присутствии кислот и щелочей, которые вызывают разрыв связей в слоистом полимере: Сr(ОН)3 + 3 ОН 3+ = [Сr(ОН 2)6]3+ основный Сr(ОН)3 + 3 OН- = [Сr(ОН)6]3 - кислотный 23
• Его состав и структура зависят от условий получения. При стоянии и в особенности при нагревании Сr 2 O 3 n. Н 2 O вследствие замены связей Сr—ОН—Сr (оловые производные) на связи Сr—О—Сr (оксоловые производные) теряет активность. • Свежеполученный Сr(ОН)3 (т. е. Сr 2 O 3 n. Н 2 O ) хорошо растворяется в присутствии кислот и щелочей, которые вызывают разрыв связей в слоистом полимере: Сr(ОН)3 + 3 ОН 3+ = [Сr(ОН 2)6]3+ основный Сr(ОН)3 + 3 OН- = [Сr(ОН)6]3 - кислотный 23
![• Получение гидроксида хрома (III) и его переход в катионные [Сr(ОН 2)6]3+ и • Получение гидроксида хрома (III) и его переход в катионные [Сr(ОН 2)6]3+ и](https://present5.com/presentation/179731412_176052086/image-24.jpg) • Получение гидроксида хрома (III) и его переход в катионные [Сr(ОН 2)6]3+ и анионные [Сr(ОН)6]3 - комплексы можно выразить следующим суммарным уравнением: OH- OH[Cr(OH 2)6]3+ Cr(OH)3 [Cr(OH)6]3 OH 3+ • В растворе соли Сr(III) в большей или меньшей степени гидролизуются. Как первую стадию гидролиза галогенидов, сульфата, нитрата Сr(III) можно рассматривать образование гидроксопентааквокомплекса [Сr(ОН)(ОН 2)5]2+ ([Cr(OH 2)6]3+ сине-фиолет. ): [Cr(OH 2)6]3+ + HOH [Cr(OH)(OH 2)5]2+ + OH 3+ Cr 3+ + HOH Cr(OH)2+ + H+. • Далее может происходить полимеризация этих 24 комплексов.
• Получение гидроксида хрома (III) и его переход в катионные [Сr(ОН 2)6]3+ и анионные [Сr(ОН)6]3 - комплексы можно выразить следующим суммарным уравнением: OH- OH[Cr(OH 2)6]3+ Cr(OH)3 [Cr(OH)6]3 OH 3+ • В растворе соли Сr(III) в большей или меньшей степени гидролизуются. Как первую стадию гидролиза галогенидов, сульфата, нитрата Сr(III) можно рассматривать образование гидроксопентааквокомплекса [Сr(ОН)(ОН 2)5]2+ ([Cr(OH 2)6]3+ сине-фиолет. ): [Cr(OH 2)6]3+ + HOH [Cr(OH)(OH 2)5]2+ + OH 3+ Cr 3+ + HOH Cr(OH)2+ + H+. • Далее может происходить полимеризация этих 24 комплексов.
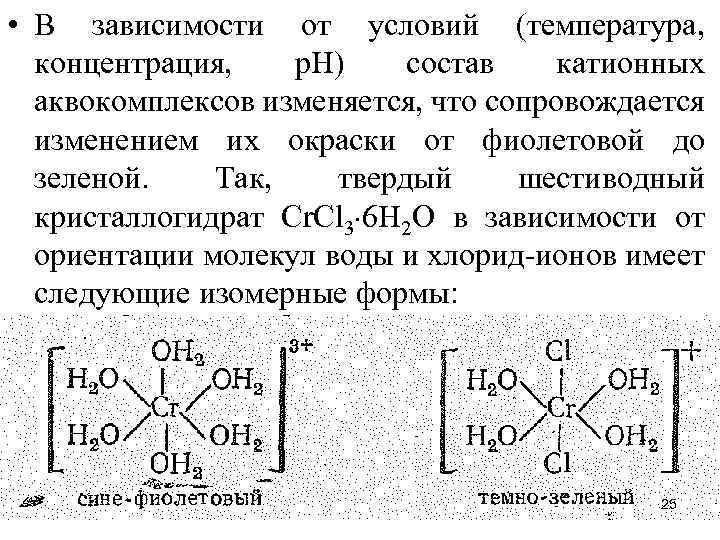 • В зависимости от условий (температура, концентрация, р. Н) состав катионных аквокомплексов изменяется, что сопровождается изменением их окраски от фиолетовой до зеленой. Так, твердый шестиводный кристаллогидрат Сr. Сl 3 6 H 2 O в зависимости от ориентации молекул воды и хлорид-ионов имеет следующие изомерные формы: 25
• В зависимости от условий (температура, концентрация, р. Н) состав катионных аквокомплексов изменяется, что сопровождается изменением их окраски от фиолетовой до зеленой. Так, твердый шестиводный кристаллогидрат Сr. Сl 3 6 H 2 O в зависимости от ориентации молекул воды и хлорид-ионов имеет следующие изомерные формы: 25
 • Трихлорид хрома Сr. Сl 3 красно-фиолетового цвета. Его получают при пропускании хлора над раскаленным металлом или нагретой докрасна смесью Сr 2 O 3 и древесного угля: Сr 2 O 3 + 3 Сl 2 = 2 Сr. Сl 3 + 3 СО • Производные анионных комплексов хрома (III) — хроматы (III) весьма разнообразны: KOH + Cr(OH)3 = K 3[Cr(OH)6] гексагидроксохромат (III) (зеленый) 3 KCl + Cr. Cl 3 = K 3[Cr. Cl 6] гексахлорохромат(III) (розово-красный) 3 К 2 SO 4 + Cr 2(SO 4)3 = 2 K 3[Cr(SO 4)3] основное кислотное трисульфатохромат (III) (желт. ) 26
• Трихлорид хрома Сr. Сl 3 красно-фиолетового цвета. Его получают при пропускании хлора над раскаленным металлом или нагретой докрасна смесью Сr 2 O 3 и древесного угля: Сr 2 O 3 + 3 Сl 2 = 2 Сr. Сl 3 + 3 СО • Производные анионных комплексов хрома (III) — хроматы (III) весьма разнообразны: KOH + Cr(OH)3 = K 3[Cr(OH)6] гексагидроксохромат (III) (зеленый) 3 KCl + Cr. Cl 3 = K 3[Cr. Cl 6] гексахлорохромат(III) (розово-красный) 3 К 2 SO 4 + Cr 2(SO 4)3 = 2 K 3[Cr(SO 4)3] основное кислотное трисульфатохромат (III) (желт. ) 26
 • Соединения Сr (VI), Мо (VI), W (VI). Степень окисления +6 хрома, молибдена и вольфрама проявляется в галогенидах, оксогалогенидах, оксидах и отвечающих им анионных комплексах: • В ряду однотипных производных Сr(VI)—Мо(VI)— W(VI) устойчивость заметно повышается. • Для хрома (VI) характерно координационное число 4, что отвечает тетраэдрическому строению его анионных комплексов и структурных единиц. Координационные числа молибдена (VI) и вольфрама (VI) разнообразнее; относительно более устойчивы 4 и 6. 27
• Соединения Сr (VI), Мо (VI), W (VI). Степень окисления +6 хрома, молибдена и вольфрама проявляется в галогенидах, оксогалогенидах, оксидах и отвечающих им анионных комплексах: • В ряду однотипных производных Сr(VI)—Мо(VI)— W(VI) устойчивость заметно повышается. • Для хрома (VI) характерно координационное число 4, что отвечает тетраэдрическому строению его анионных комплексов и структурных единиц. Координационные числа молибдена (VI) и вольфрама (VI) разнообразнее; относительно более устойчивы 4 и 6. 27
 • Молибденовая синь, молибденсодержащее вещество ярко-синего цвета; образуется при действии восстановителей (SO 2, H 2 S, Zn, глюкоза и др. ) на растворы молибденовой кислоты или кислые растворы молибдатов. Под названием «молибденовая синь» объединяют различные соединения, в которых Mo находится в степени окисления между +5 и +6. Получают молибденовую синь в виде аморфных осадков различного состава, например - Mo 4 O 14 (3 Мо. О 3 Мо 2 О 5), Mo 9 O 26, Mo 8 O 23 8 H 2 O, Mo 5 O 13 2 H 2 O и др. • Из коллоидных растворов молибденовая синь легко адсорбируется растительными и животными волокнами, окрашивая их в синий цвет; на этом основано, в частности, крашение шёлка. • Реакции образования молибденовой сини широко 28 применяются в аналитической химии.
• Молибденовая синь, молибденсодержащее вещество ярко-синего цвета; образуется при действии восстановителей (SO 2, H 2 S, Zn, глюкоза и др. ) на растворы молибденовой кислоты или кислые растворы молибдатов. Под названием «молибденовая синь» объединяют различные соединения, в которых Mo находится в степени окисления между +5 и +6. Получают молибденовую синь в виде аморфных осадков различного состава, например - Mo 4 O 14 (3 Мо. О 3 Мо 2 О 5), Mo 9 O 26, Mo 8 O 23 8 H 2 O, Mo 5 O 13 2 H 2 O и др. • Из коллоидных растворов молибденовая синь легко адсорбируется растительными и животными волокнами, окрашивая их в синий цвет; на этом основано, в частности, крашение шёлка. • Реакции образования молибденовой сини широко 28 применяются в аналитической химии.
 • Триоксиды — кристаллические вещества: Сr. О 3 темнокрасный, Мо. О 3 — белый и WО 3 — желтый. Мо. O 3 имеет слоистую, а WО 3 координационную решетку, структурной единицей которых являются октаэдры ЭО 6. Сr. О 3 имеет цепочечную структуру образованную тетраэдрами Сr. О 4. • При нагревании Сr. О 3 (Tпл. 197 °С) довольно легко разлагается, выделяя кислород, а Мо. O 3 (Tпл. 801 °С) и WО 3 (Tпл. 1473 °С) в газовую фазу переходят без разложения. Триоксид хрома — энергичный окислитель. Со многими окисляющимися веществами он реагирует со взрывом. Сr. О 3 ядовит! 29
• Триоксиды — кристаллические вещества: Сr. О 3 темнокрасный, Мо. О 3 — белый и WО 3 — желтый. Мо. O 3 имеет слоистую, а WО 3 координационную решетку, структурной единицей которых являются октаэдры ЭО 6. Сr. О 3 имеет цепочечную структуру образованную тетраэдрами Сr. О 4. • При нагревании Сr. О 3 (Tпл. 197 °С) довольно легко разлагается, выделяя кислород, а Мо. O 3 (Tпл. 801 °С) и WО 3 (Tпл. 1473 °С) в газовую фазу переходят без разложения. Триоксид хрома — энергичный окислитель. Со многими окисляющимися веществами он реагирует со взрывом. Сr. О 3 ядовит! 29
 • Триоксид хрома Сr. О 3 в отличие от Мо. О 3 и WO 3 легко растворяется в воде, образуя хромовую кислоту, т. е. является кислотным оксидом: Н 2 О + Сr. О 3 = Н 2 Сr. О 4 • Кислотная природа Мо. O 3 и WО 3 проявляется при растворении в щелочах: 2 КОН + ЭО 3 = К 2 ЭO 4 + Н 2 O Тетраоксохромат (VI) водорода Н 2 Сr. О 4 в свободном состоянии не выделен. В водном растворе — это кислота средней силы, называется хромовой. Ион Сr. О 42 - имеют желтую окраску 30
• Триоксид хрома Сr. О 3 в отличие от Мо. О 3 и WO 3 легко растворяется в воде, образуя хромовую кислоту, т. е. является кислотным оксидом: Н 2 О + Сr. О 3 = Н 2 Сr. О 4 • Кислотная природа Мо. O 3 и WО 3 проявляется при растворении в щелочах: 2 КОН + ЭО 3 = К 2 ЭO 4 + Н 2 O Тетраоксохромат (VI) водорода Н 2 Сr. О 4 в свободном состоянии не выделен. В водном растворе — это кислота средней силы, называется хромовой. Ион Сr. О 42 - имеют желтую окраску 30
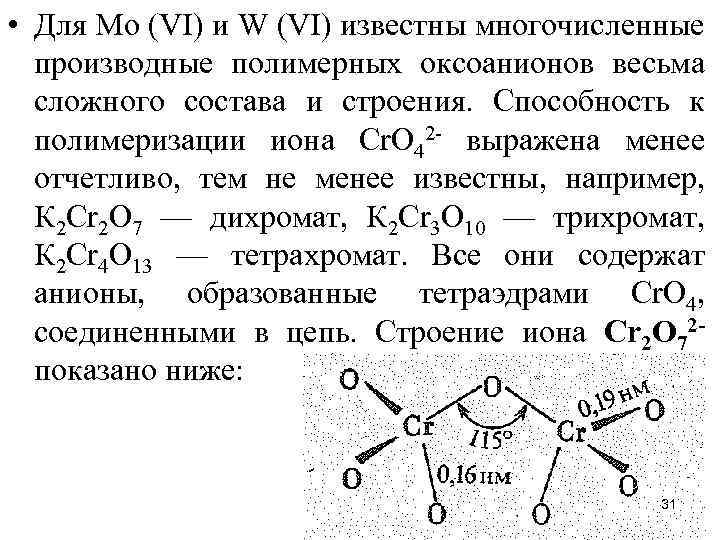 • Для Мо (VI) и W (VI) известны многочисленные производные полимерных оксоанионов весьма сложного состава и строения. Способность к полимеризации иона Сr. О 42 - выражена менее отчетливо, тем не менее известны, например, К 2 Сr 2 О 7 — дихромат, К 2 Сr 3 O 10 — трихромат, К 2 Сr 4 O 13 — тетрахромат. Все они содержат анионы, образованные тетраэдрами Сr. О 4, соединенными в цепь. Строение иона Сr 2 O 72 - показано ниже: 31
• Для Мо (VI) и W (VI) известны многочисленные производные полимерных оксоанионов весьма сложного состава и строения. Способность к полимеризации иона Сr. О 42 - выражена менее отчетливо, тем не менее известны, например, К 2 Сr 2 О 7 — дихромат, К 2 Сr 3 O 10 — трихромат, К 2 Сr 4 O 13 — тетрахромат. Все они содержат анионы, образованные тетраэдрами Сr. О 4, соединенными в цепь. Строение иона Сr 2 O 72 - показано ниже: 31
 • Полихроматы образуются при действии кислот на хроматы. Так если на крепкий раствор хромата калия подействовать кислотой, то его окраска сначала станет красно—оранжевой, потом изменится до более темной за счет образования дихроматов, затем трихроматов и т. д. : 2 Сr. О 42 - + 2 Н+ = Сr 2 О 72 - + Н 2 O 3 Сr 2 О 72 - + 2 Н+ = 2 Сr 3 О 102 - + Н 2 O и т. д. • В результате дальнейшего подкисления раствора концентрированной серной кислотой при охлаждении выделяются темно—красные кристаллы триоксида: К 2 Сr. O 4 + Н 2 SO 4 = Сr. O 3 + К 2 SO 4 + Н 2 O 32
• Полихроматы образуются при действии кислот на хроматы. Так если на крепкий раствор хромата калия подействовать кислотой, то его окраска сначала станет красно—оранжевой, потом изменится до более темной за счет образования дихроматов, затем трихроматов и т. д. : 2 Сr. О 42 - + 2 Н+ = Сr 2 О 72 - + Н 2 O 3 Сr 2 О 72 - + 2 Н+ = 2 Сr 3 О 102 - + Н 2 O и т. д. • В результате дальнейшего подкисления раствора концентрированной серной кислотой при охлаждении выделяются темно—красные кристаллы триоксида: К 2 Сr. O 4 + Н 2 SO 4 = Сr. O 3 + К 2 SO 4 + Н 2 O 32
 • Если же действовать на растворы полихроматов щелочью, процесс идет в обратном направлении и в конечном счете получается снова хромат. Взаимные переходы хромата и дихромата можно выразить уравнением обратимой реакции: 2 Сr. О 42– + 2 Н+ 2 НСr. O 4– Сr 2 О 72– + Н 2 O • Это равновесие очень подвижно. Его можно сместить изменением характера среды, осаждением нерастворимых хроматов Ва 2+, Рb 2+, Аg+, у которых произведение растворимости меньше, чем у соответствующих дихроматов. Из оксохроматов (VI) наибольшее значение имеют соли Na+ и К+, которые получают сплавлением Сr 2 O 3 или хромистого железняка с соответствующими карбонатами при 1000— 1300 °С на воздухе. При этом Сr (III) окисляется до Сr (VI): 4 Fе(Сr+3 O 2)2 + 8 Nа 2 СO 3 + 7 O 2 = =8 Nа 2 Сr+6 О 4 + 2 Fе 2 O 3 + 8 СO 2 33
• Если же действовать на растворы полихроматов щелочью, процесс идет в обратном направлении и в конечном счете получается снова хромат. Взаимные переходы хромата и дихромата можно выразить уравнением обратимой реакции: 2 Сr. О 42– + 2 Н+ 2 НСr. O 4– Сr 2 О 72– + Н 2 O • Это равновесие очень подвижно. Его можно сместить изменением характера среды, осаждением нерастворимых хроматов Ва 2+, Рb 2+, Аg+, у которых произведение растворимости меньше, чем у соответствующих дихроматов. Из оксохроматов (VI) наибольшее значение имеют соли Na+ и К+, которые получают сплавлением Сr 2 O 3 или хромистого железняка с соответствующими карбонатами при 1000— 1300 °С на воздухе. При этом Сr (III) окисляется до Сr (VI): 4 Fе(Сr+3 O 2)2 + 8 Nа 2 СO 3 + 7 O 2 = =8 Nа 2 Сr+6 О 4 + 2 Fе 2 O 3 + 8 СO 2 33
 • Дихромат натрия Nа 2 Сr 2 O 7 2 Н 2 O выделяют из подкисленных растворов Nа 2 Сr. О 4. Из раствора Nа 2 Сr 2 O 7 осаждением при помощи КСl получают менее растворимый К 2 Сr 2 O 7. • Соединения хрома (VI) — сильные окислители, переходят в окислительно-восстановительных процессах в производные Сr (III). В нейтральной среде образуется гидроксид хрома (III): Сr 2 О 72 - + 3(NН 4)2 S +H 2 O=2 Сr(ОН)3 +3 S +6 Н 3 N+ 2 OН • в кислой — производные катионного комплекса [Сr(ОН 2)6]3+ Сr 2 O 72 - + 3 SO 32 - + 8 Н+ = 2 Сr 3+ + 3 SO 42 - + 4 Н 2 O • в щелочной производные анионного комплекса [Сr(ОН)6]3 - : 2 Сr. O 42 - +3(NН 4)2 S +2 OН- +2 Н 2 O=2[Сr(OН)6]3 - +S+6 Н 3 N 34
• Дихромат натрия Nа 2 Сr 2 O 7 2 Н 2 O выделяют из подкисленных растворов Nа 2 Сr. О 4. Из раствора Nа 2 Сr 2 O 7 осаждением при помощи КСl получают менее растворимый К 2 Сr 2 O 7. • Соединения хрома (VI) — сильные окислители, переходят в окислительно-восстановительных процессах в производные Сr (III). В нейтральной среде образуется гидроксид хрома (III): Сr 2 О 72 - + 3(NН 4)2 S +H 2 O=2 Сr(ОН)3 +3 S +6 Н 3 N+ 2 OН • в кислой — производные катионного комплекса [Сr(ОН 2)6]3+ Сr 2 O 72 - + 3 SO 32 - + 8 Н+ = 2 Сr 3+ + 3 SO 42 - + 4 Н 2 O • в щелочной производные анионного комплекса [Сr(ОН)6]3 - : 2 Сr. O 42 - +3(NН 4)2 S +2 OН- +2 Н 2 O=2[Сr(OН)6]3 - +S+6 Н 3 N 34
 • Подгруппа марганца • Марганец Мn, технеций Тс и рений Rе — полные электронные аналоги с конфигурацией валентных электронов (n— 1)d 5 ns 2. Атомные и ионные радиусы технеция и рения близки (следствие лантаноидного сжатия), поэтому их свойства более сходны между собой, чем с марганцем. Для марганца характерны степени окисления +2, +4 и +7, что отвечает устойчивой несвязывающей электронной конфигурации d 5 или d 3, а также d 0. Существуют соединения марганца, в которых он проявляет степени окисления 0, +3, +5 и +6. Для технеция и рения устойчива высшая степень окисления +7. 35
• Подгруппа марганца • Марганец Мn, технеций Тс и рений Rе — полные электронные аналоги с конфигурацией валентных электронов (n— 1)d 5 ns 2. Атомные и ионные радиусы технеция и рения близки (следствие лантаноидного сжатия), поэтому их свойства более сходны между собой, чем с марганцем. Для марганца характерны степени окисления +2, +4 и +7, что отвечает устойчивой несвязывающей электронной конфигурации d 5 или d 3, а также d 0. Существуют соединения марганца, в которых он проявляет степени окисления 0, +3, +5 и +6. Для технеция и рения устойчива высшая степень окисления +7. 35
 • С ростом степени окисления у марганца и у его аналогов тенденция к образованию анионных комплексов возрастает, а катионных падает (усиливается кислотный характер их бинарных соединений), для химии марганца очень характерны окислительновосстановительные реакции. При этом кислая среда способствует образованию катионных комплексов Мn(II), а сильнощелочная среда — анионных комплексов Мn(VI). В нейтральной среде (а также слабокислой и слабощелочной) при окислительновосстановительных процессах, образуются производные Мn(IV) (чаще всего Мn. O 2). 36
• С ростом степени окисления у марганца и у его аналогов тенденция к образованию анионных комплексов возрастает, а катионных падает (усиливается кислотный характер их бинарных соединений), для химии марганца очень характерны окислительновосстановительные реакции. При этом кислая среда способствует образованию катионных комплексов Мn(II), а сильнощелочная среда — анионных комплексов Мn(VI). В нейтральной среде (а также слабокислой и слабощелочной) при окислительновосстановительных процессах, образуются производные Мn(IV) (чаще всего Мn. O 2). 36
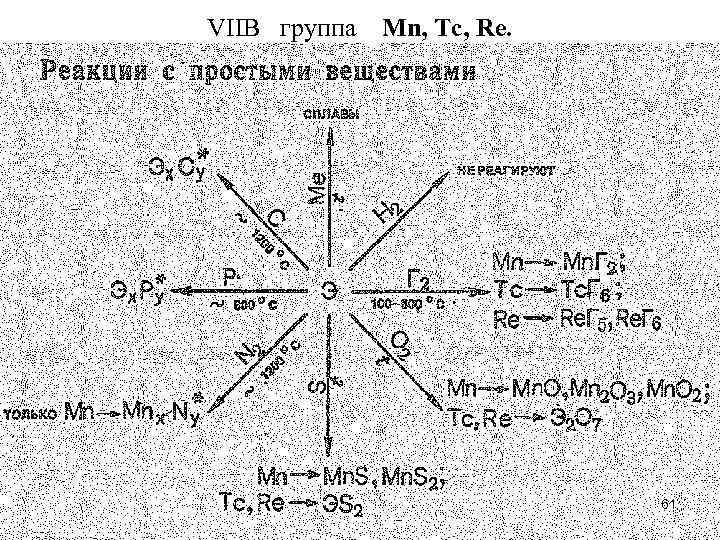
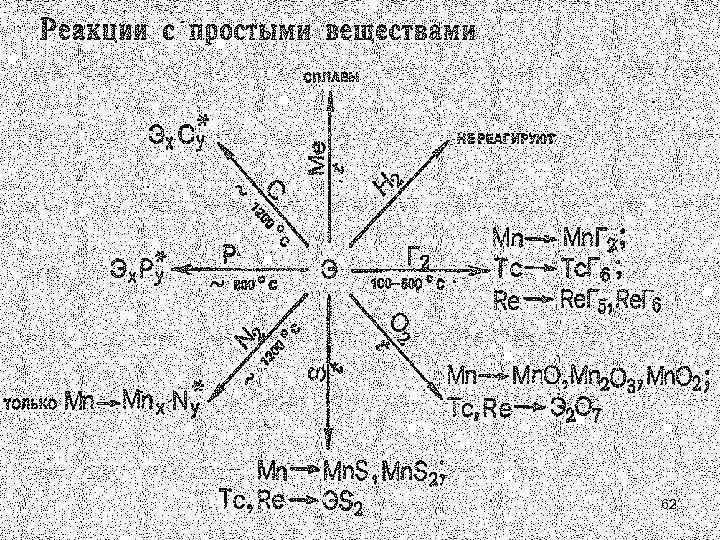
 • Простые вещества марганца и его аналогов представляют собой металлы серебристо-белого цвета. Для марганца известны четыре модификации. Возрастание теплоты возгонки (атомизации), температур плавления и кипения в ряду Мn—Тс—Rе объясняется, как полагают, усилением доли ковалентной связи, образованной за счет (n — 1)d-орбиталей. По тугоплавкости рений (Тпл. 3190 о. С) уступает лишь вольфраму (Тпл. 3380 о. С). • Химическая активность простых веществ в ряду Мn—Тс—Rе понижается. • Так, в ряду напряжений Мn располагается до водорода, а Тс и Rе после него. 37
• Простые вещества марганца и его аналогов представляют собой металлы серебристо-белого цвета. Для марганца известны четыре модификации. Возрастание теплоты возгонки (атомизации), температур плавления и кипения в ряду Мn—Тс—Rе объясняется, как полагают, усилением доли ковалентной связи, образованной за счет (n — 1)d-орбиталей. По тугоплавкости рений (Тпл. 3190 о. С) уступает лишь вольфраму (Тпл. 3380 о. С). • Химическая активность простых веществ в ряду Мn—Тс—Rе понижается. • Так, в ряду напряжений Мn располагается до водорода, а Тс и Rе после него. 37
 • Марганец довольно активно взаимодействует с разбавленной HСl и Н 2 SО 4, а технеций и рений реагируют лишь с НNO 3. В соответствии с устойчивыми степенями окисления взаимодействие марганца с разбавленными кислотами приводит к образованию катионного аквокомплекса [Мn(ОН 2)6]2+ : Мn + 2 ОН 3+ + 4 Н 2 О = [Мn(ОН 2)6]2+ + Н 2 • а взаимодействие технеция и рения с азотной кислотой к образованию анионного оксокомплекса [ЭО 4]- : 3 Тс + 7 НNO 3 = 3 НТс. О 4 +7 NO + 2 Н 2 O 38
• Марганец довольно активно взаимодействует с разбавленной HСl и Н 2 SО 4, а технеций и рений реагируют лишь с НNO 3. В соответствии с устойчивыми степенями окисления взаимодействие марганца с разбавленными кислотами приводит к образованию катионного аквокомплекса [Мn(ОН 2)6]2+ : Мn + 2 ОН 3+ + 4 Н 2 О = [Мn(ОН 2)6]2+ + Н 2 • а взаимодействие технеция и рения с азотной кислотой к образованию анионного оксокомплекса [ЭО 4]- : 3 Тс + 7 НNO 3 = 3 НТс. О 4 +7 NO + 2 Н 2 O 38
 • Вследствие довольно высокой активности марганец легко окисляется, в особенности в порошкообразном состоянии, при нагревании кислородом, серой, галогенами. Компактный металл на воздухе устойчив, так как покрывается оксидной пленкой, которая препятствует дальнейшему окислению металла. Еще более устойчивая пленка образуется при действии на Мn холодной азотной кислоты. Технеций и рений вступают в химическое взаимодействие с неметаллами при достаточно сильном нагревании. Так, при 400 °С они сгорают в атмосфере кислорода, образуя Э 2 О 7. 39
• Вследствие довольно высокой активности марганец легко окисляется, в особенности в порошкообразном состоянии, при нагревании кислородом, серой, галогенами. Компактный металл на воздухе устойчив, так как покрывается оксидной пленкой, которая препятствует дальнейшему окислению металла. Еще более устойчивая пленка образуется при действии на Мn холодной азотной кислоты. Технеций и рений вступают в химическое взаимодействие с неметаллами при достаточно сильном нагревании. Так, при 400 °С они сгорают в атмосфере кислорода, образуя Э 2 О 7. 39
 • Марганец получают электролизом водного раствора его сульфата и восстановлением из оксидов методом кремнийтермии: Мn. O 2 + Si = Мn + Si. O 2 • Рений обычно выделяют нагреванием NН 4 Rе. О 4 в токе водорода: N— 3 Н 4 Rе+7 О 4 + 4 H 2 = 2 Re 0 + N 20 + 8 H 2 O • Источником для получения технеция в относительно больших количествах являются продукты деления урана — отходы атомной промышленности. 40
• Марганец получают электролизом водного раствора его сульфата и восстановлением из оксидов методом кремнийтермии: Мn. O 2 + Si = Мn + Si. O 2 • Рений обычно выделяют нагреванием NН 4 Rе. О 4 в токе водорода: N— 3 Н 4 Rе+7 О 4 + 4 H 2 = 2 Re 0 + N 20 + 8 H 2 O • Источником для получения технеция в относительно больших количествах являются продукты деления урана — отходы атомной промышленности. 40
 • Основную массу марганца выплавляют в виде ферромарганца (сплав 60— 90% Мn и 40— 10% Fе) при восстановлении смеси железных и марганцевых руд. Около 90% марганца применяется в металлургии для раскисления и легирования сталей. Он придает сплавам железа коррозионную стойкость, вязкость и твердость. Технеций коррозионностоек и устойчив против действия нейтронов, поэтому может применяться как конструкционный материал для атомных реакторов. Рений в основном используется в электротехнической промышленности и как катализатор. 41
• Основную массу марганца выплавляют в виде ферромарганца (сплав 60— 90% Мn и 40— 10% Fе) при восстановлении смеси железных и марганцевых руд. Около 90% марганца применяется в металлургии для раскисления и легирования сталей. Он придает сплавам железа коррозионную стойкость, вязкость и твердость. Технеций коррозионностоек и устойчив против действия нейтронов, поэтому может применяться как конструкционный материал для атомных реакторов. Рений в основном используется в электротехнической промышленности и как катализатор. 41
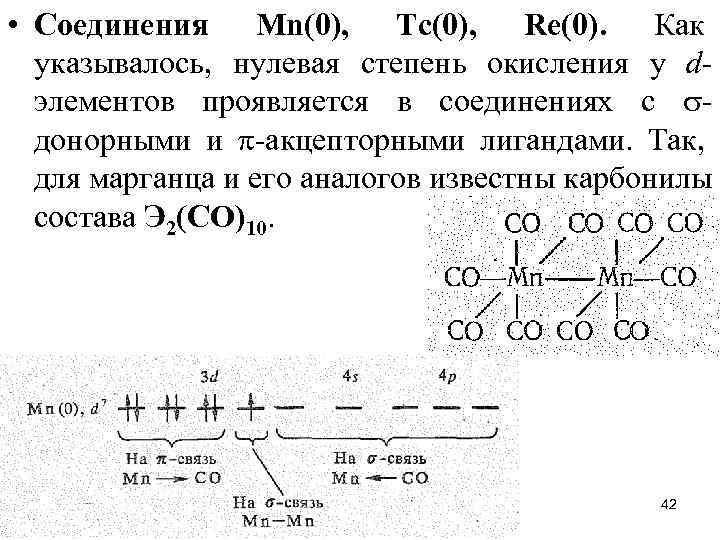 • Соединения Мn(0), Тс(0), Rе(0). Как указывалось, нулевая степень окисления у dэлементов проявляется в соединениях с донорными и -акцепторными лигандами. Так, для марганца и его аналогов известны карбонилы состава Э 2(СО)10. 42
• Соединения Мn(0), Тс(0), Rе(0). Как указывалось, нулевая степень окисления у dэлементов проявляется в соединениях с донорными и -акцепторными лигандами. Так, для марганца и его аналогов известны карбонилы состава Э 2(СО)10. 42
 • Эти соединения диамагнитны, следовательно, атомам марганца и его аналогов в степени окисления 0 можно приписать электронную конфигурацию d 7. Химическая связь М—СО в карбонилах металлов включает и связи. -Связь образуется по донорно-акцепторному механизму за счет свободных р-орбиталей атома dэлемента и электронных пар углерода молекул СО. -Связь возникает по дативному механизму за счет свободных разр-орбиталей СО и d-электронных пар атома d-элемента. Так, Мn (0) за счет пяти свободных 3 d 4 s 4 р3 -орбиталей присоединяет пять молекул СО, образуя радикал Мn(CO)5. Устойчивость связи Мn—СО повышается за счет дативного -взаимодействия М СО, в котором принимают участие 3 d -электронные пары атома марганца и разр-орбитали молекул СО. За счет непарных электронов атомов марганца возникает -связь Мn—Мn, поэтому радикалы Мn(СО)5 объединяются в молекулу Мn 2(СО)10. 43
• Эти соединения диамагнитны, следовательно, атомам марганца и его аналогов в степени окисления 0 можно приписать электронную конфигурацию d 7. Химическая связь М—СО в карбонилах металлов включает и связи. -Связь образуется по донорно-акцепторному механизму за счет свободных р-орбиталей атома dэлемента и электронных пар углерода молекул СО. -Связь возникает по дативному механизму за счет свободных разр-орбиталей СО и d-электронных пар атома d-элемента. Так, Мn (0) за счет пяти свободных 3 d 4 s 4 р3 -орбиталей присоединяет пять молекул СО, образуя радикал Мn(CO)5. Устойчивость связи Мn—СО повышается за счет дативного -взаимодействия М СО, в котором принимают участие 3 d -электронные пары атома марганца и разр-орбитали молекул СО. За счет непарных электронов атомов марганца возникает -связь Мn—Мn, поэтому радикалы Мn(СО)5 объединяются в молекулу Мn 2(СО)10. 43
 • Соединения Мn(II), Тс(II), Rе(II). Для марганца (II) характерно кч шесть, что соответствует октаэдрическому расположению связей. Соединения Мn(II) парамагнитны и, за исключением цианидов, содержат пять непарных электронов. Большинство солей Мn(II) хорошо растворимы в воде. Малорастворимы Мn. О, Мn. S, Мn. F 2, Мn(ОН)2, Мn. СО 3 и Мn 3(РО 4)2. При растворении в воде соли Мn(II) диссоциируют, образуя аквокомплексы [Мn(ОН 2)6]2+, придающие растворам розовую окраску. Такого же цвета кристаллогидраты Мn(II), например Мn(NО 3)2 6 Н 2 O, Мn(Сl. O 4)2 6 Н 2 O. 44
• Соединения Мn(II), Тс(II), Rе(II). Для марганца (II) характерно кч шесть, что соответствует октаэдрическому расположению связей. Соединения Мn(II) парамагнитны и, за исключением цианидов, содержат пять непарных электронов. Большинство солей Мn(II) хорошо растворимы в воде. Малорастворимы Мn. О, Мn. S, Мn. F 2, Мn(ОН)2, Мn. СО 3 и Мn 3(РО 4)2. При растворении в воде соли Мn(II) диссоциируют, образуя аквокомплексы [Мn(ОН 2)6]2+, придающие растворам розовую окраску. Такого же цвета кристаллогидраты Мn(II), например Мn(NО 3)2 6 Н 2 O, Мn(Сl. O 4)2 6 Н 2 O. 44
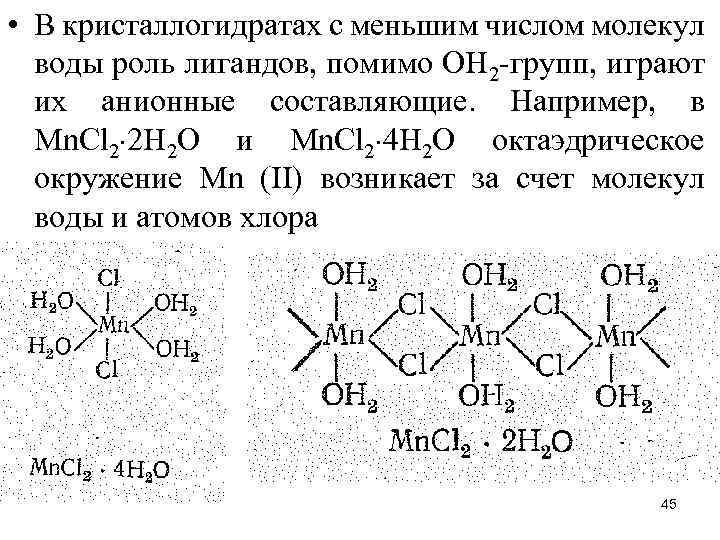 • В кристаллогидратах с меньшим числом молекул воды роль лигандов, помимо ОН 2 -групп, играют их анионные составляющие. Например, в Мn. Сl 2 2 Н 2 О и Мn. Сl 2 4 Н 2 О октаэдрическое окружение Мn (II) возникает за счет молекул воды и атомов хлора 45
• В кристаллогидратах с меньшим числом молекул воды роль лигандов, помимо ОН 2 -групп, играют их анионные составляющие. Например, в Мn. Сl 2 2 Н 2 О и Мn. Сl 2 4 Н 2 О октаэдрическое окружение Мn (II) возникает за счет молекул воды и атомов хлора 45
 • По химическим свойствам бинарные соединения Мn(II) амфотерны (преобладают признаки основных соединений). В реакциях без изменения степени окисления для них наиболее характерен переход в катионные комплексы. Оксид Мn. О, как и гидроксид Мn(ОН)2, легко взаимодействует с кислотами: Mn. O + 2 OH 3+ + 3 H 2 O = [Mn(OH 2)6]2+ • Со щелочами же они реагируют только при достаточно сильном и длительном нагревании: Mn(OH)2 + 4 OH- = [Mn(OH)6]446
• По химическим свойствам бинарные соединения Мn(II) амфотерны (преобладают признаки основных соединений). В реакциях без изменения степени окисления для них наиболее характерен переход в катионные комплексы. Оксид Мn. О, как и гидроксид Мn(ОН)2, легко взаимодействует с кислотами: Mn. O + 2 OH 3+ + 3 H 2 O = [Mn(OH 2)6]2+ • Со щелочами же они реагируют только при достаточно сильном и длительном нагревании: Mn(OH)2 + 4 OH- = [Mn(OH)6]446
 • Оксид Мn. О (серо-зеленого цвета, Tпл. 1780 o. С) имеет переменный состав (Мn. О—Мn. О 1, 5), обладает полупроводниковыми свойствами. Его обычно получают, нагревая Мn. O 2 в атмосфере водорода или термически разлагая Мо. СО 3. • Поскольку Мn. О с водой не взаимодействует, Мn(ОН)2 (белого цвета) получают косвенным путем — действием щелочи на раствор соли Мn(II): Mn. SO 4 (р) + 2 КОН (р) == Мn(ОН)2 (т) + К 2 SO 4 (р) • Известны также аммиакаты Мn(II), например [Мn(NН 3)6]Сl 2, [Мn(NН 3)6](Сl. О 4)2. Аммиакаты легко разрушаются водой: [Мn(NН 3)6]Сl 2 + 2 Н 2 О Мn (ОН)2 + 2 NН 4 Сl + 4 Н 3 N и могут существовать лишь в твердом состоянии или в растворах с большим избытком аммиака и солей 47 аммония.
• Оксид Мn. О (серо-зеленого цвета, Tпл. 1780 o. С) имеет переменный состав (Мn. О—Мn. О 1, 5), обладает полупроводниковыми свойствами. Его обычно получают, нагревая Мn. O 2 в атмосфере водорода или термически разлагая Мо. СО 3. • Поскольку Мn. О с водой не взаимодействует, Мn(ОН)2 (белого цвета) получают косвенным путем — действием щелочи на раствор соли Мn(II): Mn. SO 4 (р) + 2 КОН (р) == Мn(ОН)2 (т) + К 2 SO 4 (р) • Известны также аммиакаты Мn(II), например [Мn(NН 3)6]Сl 2, [Мn(NН 3)6](Сl. О 4)2. Аммиакаты легко разрушаются водой: [Мn(NН 3)6]Сl 2 + 2 Н 2 О Мn (ОН)2 + 2 NН 4 Сl + 4 Н 3 N и могут существовать лишь в твердом состоянии или в растворах с большим избытком аммиака и солей 47 аммония.
 • Кислотные признаки соединения Мn(II) проявляют при взаимодействии с однотипными производными щелочных металлов. Так, нерастворимый в воде Мn(СN)2 (белого цвета) за счет комплексообразования растворяется в присутствии КСN: 4 КNС + Мn(СN)2 = К 4[Мn(СN)6] гексацианоманганат (II) • Аналогичным образом протекают реакции 4 КF + Мn. F 2 = К 4[Мn. F 6] гексафтороманганат (II) 2 КСl + Мn. Сl 2 = К 2[Мn. Сl 4] тетрахлороманганат (II) • Большинство манганатов (II) (кроме комплексных цианидов) в разбавленных растворах распадается. 48
• Кислотные признаки соединения Мn(II) проявляют при взаимодействии с однотипными производными щелочных металлов. Так, нерастворимый в воде Мn(СN)2 (белого цвета) за счет комплексообразования растворяется в присутствии КСN: 4 КNС + Мn(СN)2 = К 4[Мn(СN)6] гексацианоманганат (II) • Аналогичным образом протекают реакции 4 КF + Мn. F 2 = К 4[Мn. F 6] гексафтороманганат (II) 2 КСl + Мn. Сl 2 = К 2[Мn. Сl 4] тетрахлороманганат (II) • Большинство манганатов (II) (кроме комплексных цианидов) в разбавленных растворах распадается. 48
 • При действии окислителей производные Мn(II) проявляют восстановительные свойства. Так, в щелочной среде Мn(ОН)2 легко окисляется даже молекулярным кислородом воздуха, поэтому осадок Мn(ОН)2, получаемый по обменной реакции, быстро темнеет: 6 Mn+2 (OH)2 + O 2 = 2 Мn+4 O 4 + 6 H 2 O • В сильнощелочной среде окисление сопровождается образованием оксоманганатов (VI) — производных комплекса Мn. О 42 -: сплавление 3 Mn+2 SO 4 + 2 KCl+5 O 3 + 12 KOH ====== 3 K 2 Mn+6 O 4 + 2 KCl-1 + 3 K 2 SO 4 + 6 H 2 O. • Сильные окислители, такие, как Рb. О 2 (окисляет в кислой среде), переводят соединения Мn(II) в оксоманганаты (VII) — производные комплекса Мn. О 4 -: 2 Мn+2 SО 4 + 5 Рb+4 O 2 + 6 НNO 3 = 2 HМn+7 O 4 + 3 Рb+2(NO 3)2 + 2 Рb+2 SO 4 + 2 Н 2 O. 49
• При действии окислителей производные Мn(II) проявляют восстановительные свойства. Так, в щелочной среде Мn(ОН)2 легко окисляется даже молекулярным кислородом воздуха, поэтому осадок Мn(ОН)2, получаемый по обменной реакции, быстро темнеет: 6 Mn+2 (OH)2 + O 2 = 2 Мn+4 O 4 + 6 H 2 O • В сильнощелочной среде окисление сопровождается образованием оксоманганатов (VI) — производных комплекса Мn. О 42 -: сплавление 3 Mn+2 SO 4 + 2 KCl+5 O 3 + 12 KOH ====== 3 K 2 Mn+6 O 4 + 2 KCl-1 + 3 K 2 SO 4 + 6 H 2 O. • Сильные окислители, такие, как Рb. О 2 (окисляет в кислой среде), переводят соединения Мn(II) в оксоманганаты (VII) — производные комплекса Мn. О 4 -: 2 Мn+2 SО 4 + 5 Рb+4 O 2 + 6 НNO 3 = 2 HМn+7 O 4 + 3 Рb+2(NO 3)2 + 2 Рb+2 SO 4 + 2 Н 2 O. 49
 • Соединения Мn (IV), Тс (IV), Rе (IV). Диоксид Мn. O 2 черно-бурое твердое вещество, обычно переменного состава. Это наиболее устойчивое соединение марганца (не растворяется в воде). Мn. O 2 широко распространен в земной коре (пиролюзит и др. ). • По химической природе Мn. O 2 амфотерен. Так, известна черная соль Мn(SO 4)2, получаемая окислением Мn. SO 4. В водных растворах это соединение гидролизуется нацело. При сплавлении со щелочами или основными оксидами, например Мn. О 2 + Са. О = Са. Мn. О 3 образуются оксоманганаты (IV) (манганиты) весьма разнообразного и сложного состава. Простейшие из манганитов М+2 Мn. О 3 и М+14 Мn. О 4. 50
• Соединения Мn (IV), Тс (IV), Rе (IV). Диоксид Мn. O 2 черно-бурое твердое вещество, обычно переменного состава. Это наиболее устойчивое соединение марганца (не растворяется в воде). Мn. O 2 широко распространен в земной коре (пиролюзит и др. ). • По химической природе Мn. O 2 амфотерен. Так, известна черная соль Мn(SO 4)2, получаемая окислением Мn. SO 4. В водных растворах это соединение гидролизуется нацело. При сплавлении со щелочами или основными оксидами, например Мn. О 2 + Са. О = Са. Мn. О 3 образуются оксоманганаты (IV) (манганиты) весьма разнообразного и сложного состава. Простейшие из манганитов М+2 Мn. О 3 и М+14 Мn. О 4. 50
 • Соединения Мn (IV) — сильные окислители: Мn. О 2 + 4 Н+ + 2 е = Мn 2+ + 2 Н 2 O, Е 0298 = 1, 23 В • Так при нагревании с кислотами Мn. О 2 не образует аквокомплексы, а проявляет окислительные свойства, например окисляет концентрированную соляную кислоту: Мn+4 О 2 + 4 НСl— 1 = Мn+2 Сl 2 + Сl 02 + 2 Н 2 O • Диоксид марганца при взаимодействии с горячей Н 2 SO 4 или НNO 3 разлагается с выделением кислорода. В качестве дешевого окислителя Мn. О 2 широко используется в технике и лабораторной практике. В стекольном производстве применяется для обесцвечивания 51 стекла, используется в спичечном производстве.
• Соединения Мn (IV) — сильные окислители: Мn. О 2 + 4 Н+ + 2 е = Мn 2+ + 2 Н 2 O, Е 0298 = 1, 23 В • Так при нагревании с кислотами Мn. О 2 не образует аквокомплексы, а проявляет окислительные свойства, например окисляет концентрированную соляную кислоту: Мn+4 О 2 + 4 НСl— 1 = Мn+2 Сl 2 + Сl 02 + 2 Н 2 O • Диоксид марганца при взаимодействии с горячей Н 2 SO 4 или НNO 3 разлагается с выделением кислорода. В качестве дешевого окислителя Мn. О 2 широко используется в технике и лабораторной практике. В стекольном производстве применяется для обесцвечивания 51 стекла, используется в спичечном производстве.
 • Соединения Мn(VI), Тс(VI), Rе(VI). Соединения, в которых степень окисления марганца и его аналогов +6, немногочисленны. Степень окисления +6 марганца несколько стабилизируется в анионе Мn. O 42 -, называемом манганатом. Производные Мn. O 42 -, Тс. О 42 - и Rе. О 42 - (темно-зеленого цвета) в водных растворах существуют лишь при большом избытке щелочи, в противном случае диспропорционируют по схеме 3 Э+6 О 42 - + 2 Н 2 О =2 Э+7 О 4 - + Э+4 О 2 + 4 ОН • Особо легко этот процесс, происходит в кислой среде, поэтому производные водорода типа Н 2 ЭО 4 не образуются. 52
• Соединения Мn(VI), Тс(VI), Rе(VI). Соединения, в которых степень окисления марганца и его аналогов +6, немногочисленны. Степень окисления +6 марганца несколько стабилизируется в анионе Мn. O 42 -, называемом манганатом. Производные Мn. O 42 -, Тс. О 42 - и Rе. О 42 - (темно-зеленого цвета) в водных растворах существуют лишь при большом избытке щелочи, в противном случае диспропорционируют по схеме 3 Э+6 О 42 - + 2 Н 2 О =2 Э+7 О 4 - + Э+4 О 2 + 4 ОН • Особо легко этот процесс, происходит в кислой среде, поэтому производные водорода типа Н 2 ЭО 4 не образуются. 52
 • Соединения Мn(VI) — сильные окислители, в особенности в кислой среде: Мn. O 42 - + 4 Н+ + 2 е = Мn. О 2 + 2 Н 2 O, E 0298 = 2, 2 В • Однако при действии более сильных окислителей они превращаются в оксоманганаты (VII): 2 К 2 Мn+6 О 4 + Сl 20 = 2 КМn+7 О 4 + 2 КСl-1 • Производные Тс(VI) и Rе(VI), наоборот, легко окисляются даже молекулярным кислородом воздуха: 4 К 2 Э+6 О 4 + О 2 + 2 Н 2 О = 4 КЭ+7 О 4 + 4 КОН 53
• Соединения Мn(VI) — сильные окислители, в особенности в кислой среде: Мn. O 42 - + 4 Н+ + 2 е = Мn. О 2 + 2 Н 2 O, E 0298 = 2, 2 В • Однако при действии более сильных окислителей они превращаются в оксоманганаты (VII): 2 К 2 Мn+6 О 4 + Сl 20 = 2 КМn+7 О 4 + 2 КСl-1 • Производные Тс(VI) и Rе(VI), наоборот, легко окисляются даже молекулярным кислородом воздуха: 4 К 2 Э+6 О 4 + О 2 + 2 Н 2 О = 4 КЭ+7 О 4 + 4 КОН 53
 • Соединения Мn(VII), Тс(VII), Rе(VII). • Устойчивость соединений в ряду - Мn(VII), Тс(VII) и Rе(VII) повышается. • Оксид марганца (VII) Мn 2 O 7 ( Нf 0 = — 743 к. Дж/моль) — неустойчивая зеленовато-черная маслянистая жидкость. Его получают действием концентрированной Н 2 SO 4 на манганаты (VII): 2 КМn. O 4 + Н 2 SO 4 = Мn 2 O 7 + К 2 SO 4 + Н 2 O • Если не применять специальных мер, Мn 2 O 7 разлагается со взрывом: 2 Мn 2 O 7 = 4 Мn. O 2 + 3 O 2 54
• Соединения Мn(VII), Тс(VII), Rе(VII). • Устойчивость соединений в ряду - Мn(VII), Тс(VII) и Rе(VII) повышается. • Оксид марганца (VII) Мn 2 O 7 ( Нf 0 = — 743 к. Дж/моль) — неустойчивая зеленовато-черная маслянистая жидкость. Его получают действием концентрированной Н 2 SO 4 на манганаты (VII): 2 КМn. O 4 + Н 2 SO 4 = Мn 2 O 7 + К 2 SO 4 + Н 2 O • Если не применять специальных мер, Мn 2 O 7 разлагается со взрывом: 2 Мn 2 O 7 = 4 Мn. O 2 + 3 O 2 54
 • Соединения марганца (VII) сильные окислители. Например, при соприкосновении с Мn 2 O 7 эфир и спирт воспламеняются. Тетраоксоманганаты (VII) в качестве сильных окислителей широко применяются в лабораторной практике. Возможны следующие направления восстановления иона Мn. O 4 -, 55
• Соединения марганца (VII) сильные окислители. Например, при соприкосновении с Мn 2 O 7 эфир и спирт воспламеняются. Тетраоксоманганаты (VII) в качестве сильных окислителей широко применяются в лабораторной практике. Возможны следующие направления восстановления иона Мn. O 4 -, 55
![• В кислой среде образуются катионные комплексы типа [Мn(ОН 2)6]2+, в сильнощелочной среде • В кислой среде образуются катионные комплексы типа [Мn(ОН 2)6]2+, в сильнощелочной среде](https://present5.com/presentation/179731412_176052086/image-56.jpg) • В кислой среде образуются катионные комплексы типа [Мn(ОН 2)6]2+, в сильнощелочной среде — анионы Мn. О 42 -, в нейтральной и щелочной — производные Мn(IV), обычно Мn. O 2. • При нагревании оксоманганаты (VII) распадаются: 2 КМn. О 4 = К 2 Мn. О 4 + Мn. О 2 + O 2 • Эта реакция используется в лаборатории для получения кислорода. • Ионы Мn. O 4 - устойчивее ионов Мn. O 42 -. Еще менее устойчивы ионы Мn. O 43 - и Мn. O 44 -. 56
• В кислой среде образуются катионные комплексы типа [Мn(ОН 2)6]2+, в сильнощелочной среде — анионы Мn. О 42 -, в нейтральной и щелочной — производные Мn(IV), обычно Мn. O 2. • При нагревании оксоманганаты (VII) распадаются: 2 КМn. О 4 = К 2 Мn. О 4 + Мn. О 2 + O 2 • Эта реакция используется в лаборатории для получения кислорода. • Ионы Мn. O 4 - устойчивее ионов Мn. O 42 -. Еще менее устойчивы ионы Мn. O 43 - и Мn. O 44 -. 56
 • По многим свойствам с молекулой СО сходна молекула N 2. Последняя в частности, способна к -донорному и -акцепторному дативному взаимодействию и может выступать в качестве лиганда в комплексных соединениях. Большой теоретический и практический интерес представляют соединения, в которых роль лиганда играют молекулы азота. К подобным соединениям, называемым нитрогенильными, относится, например [Ru(NН 3)5(N 2)]Сl 2. • Образование комплексов с участием молекул N 2 в качестве лигандов играет важную роль при фиксации атмосферного азота микроорганизмами, а также в процессе каталитического синтеза аммиака. Повидимому, в естественных условиях (обычные температура и давление) биохимическое связывание атмосферного азота осуществляется с участием 57 комплексов Fе и Мо.
• По многим свойствам с молекулой СО сходна молекула N 2. Последняя в частности, способна к -донорному и -акцепторному дативному взаимодействию и может выступать в качестве лиганда в комплексных соединениях. Большой теоретический и практический интерес представляют соединения, в которых роль лиганда играют молекулы азота. К подобным соединениям, называемым нитрогенильными, относится, например [Ru(NН 3)5(N 2)]Сl 2. • Образование комплексов с участием молекул N 2 в качестве лигандов играет важную роль при фиксации атмосферного азота микроорганизмами, а также в процессе каталитического синтеза аммиака. Повидимому, в естественных условиях (обычные температура и давление) биохимическое связывание атмосферного азота осуществляется с участием 57 комплексов Fе и Мо.
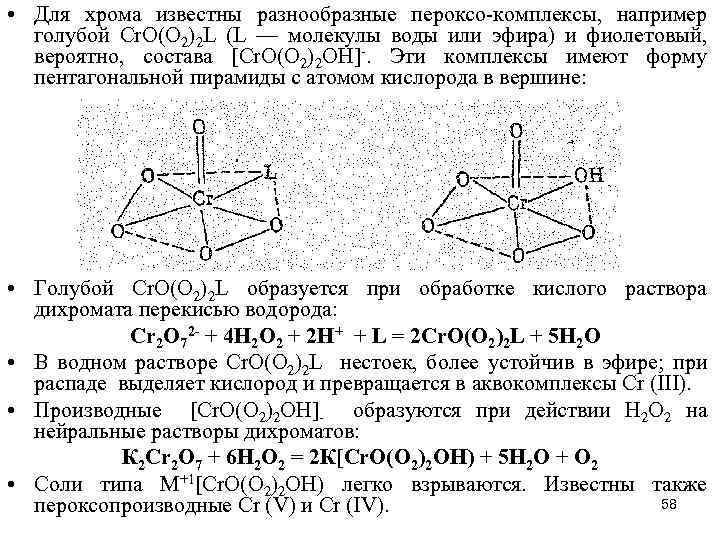 • Для хрома известны разнообразные пероксо-комплексы, например голубой Сr. О(О 2)2 L (L — молекулы воды или эфира) и фиолетовый, вероятно, состава [Сr. О(O 2)2 OН]-. Эти комплексы имеют форму пентагональной пирамиды с атомом кислорода в вершине: • Голубой Сr. О(O 2)2 L образуется при обработке кислого раствора дихромата перекисью водорода: Сr 2 O 72 - + 4 Н 2 O 2 + 2 Н+ + L = 2 Сr. О(O 2)2 L + 5 Н 2 O • В водном растворе Сr. О(O 2)2 L нестоек, более устойчив в эфире; при распаде выделяет кислород и превращается в аквокомплексы Сr (III). • Производные [Сr. О(O 2)2 OН]- образуются при действии Н 2 O 2 на нейральные растворы дихроматов: К 2 Сr 2 О 7 + 6 Н 2 O 2 = 2 К[Сr. О(O 2)2 OН) + 5 H 2 O + O 2 • Соли типа М+1[Сr. О(O 2)2 OН) легко взрываются. Известны также 58 пероксопроизводные Сr (V) и Сr (IV).
• Для хрома известны разнообразные пероксо-комплексы, например голубой Сr. О(О 2)2 L (L — молекулы воды или эфира) и фиолетовый, вероятно, состава [Сr. О(O 2)2 OН]-. Эти комплексы имеют форму пентагональной пирамиды с атомом кислорода в вершине: • Голубой Сr. О(O 2)2 L образуется при обработке кислого раствора дихромата перекисью водорода: Сr 2 O 72 - + 4 Н 2 O 2 + 2 Н+ + L = 2 Сr. О(O 2)2 L + 5 Н 2 O • В водном растворе Сr. О(O 2)2 L нестоек, более устойчив в эфире; при распаде выделяет кислород и превращается в аквокомплексы Сr (III). • Производные [Сr. О(O 2)2 OН]- образуются при действии Н 2 O 2 на нейральные растворы дихроматов: К 2 Сr 2 О 7 + 6 Н 2 O 2 = 2 К[Сr. О(O 2)2 OН) + 5 H 2 O + O 2 • Соли типа М+1[Сr. О(O 2)2 OН) легко взрываются. Известны также 58 пероксопроизводные Сr (V) и Сr (IV).
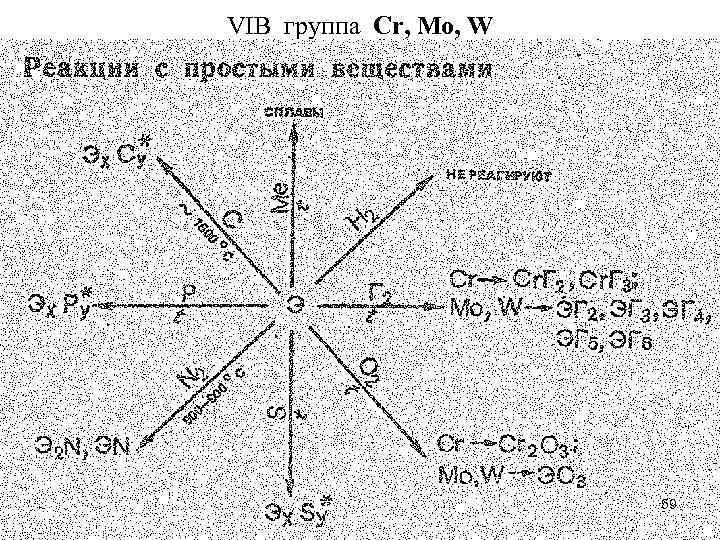 VIB группа Cr, Mo, W 59
VIB группа Cr, Mo, W 59
 60
60
 VIIB группа Mn, Tc, Re. 61
VIIB группа Mn, Tc, Re. 61
 62
62


