Catalysis by metals 2.ppt
- Количество слайдов: 20

Связь с хемосорбированными атомами – за счет «выступающих» орбиталей атома. Возможность образования нормальных ковалентных связей. Катализ металлами Вычисление по Полингу: Qадс = 2 E(M–H) – E(H–H) E(M–H) = ½ [E(M–M) + E(H–H)] + 96. 5(χM – χH) 2 Вычислено Эксперимент Ni 122 151 Fe 134 142 Rh 134 117 Pd 96 117 Q, кдж/моль, хемосорбция водорода 1
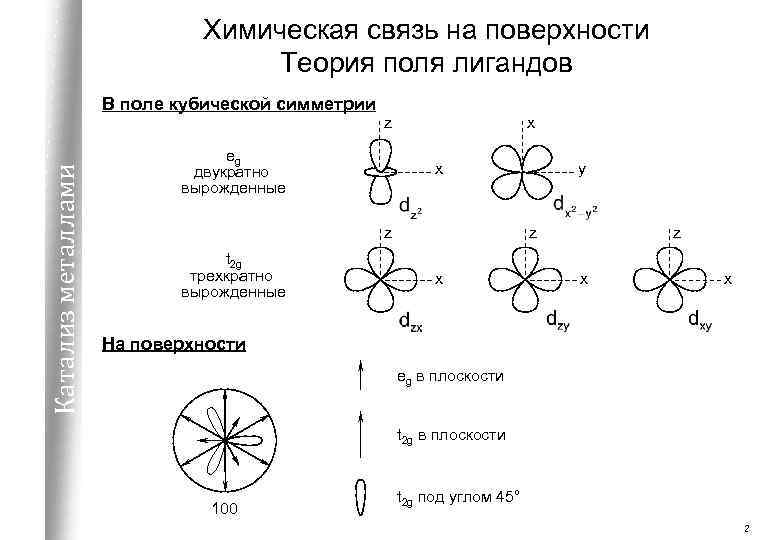
Химическая связь на поверхности Теория поля лигандов В поле кубической симметрии Катализ металлами z eg двукратно вырожденные x x z t 2 g трехкратно вырожденные y z x x На поверхности eg в плоскости t 2 g в плоскости 100 t 2 g под углом 45° 2

Хемосорбция Катализ металлами Типы хемосорбированных частиц (лигандов), которые могут образовываться на моноядерных центрах 3

Хемосорбция Катализ металлами Типы хемосорбированных частиц, которые могут образовываться на полиядерных центрах: 4
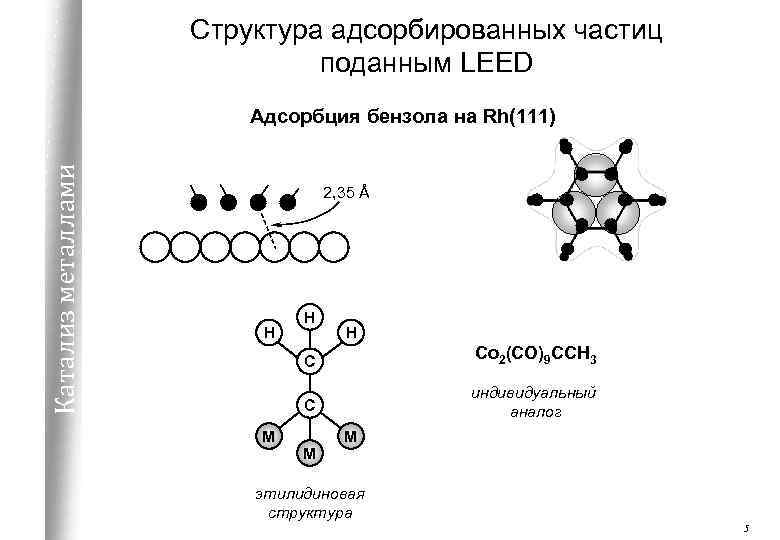
Структура адсорбированных частиц поданным LEED Катализ металлами Адсорбция бензола на Rh(111) 2, 35 Å H H H С С M Co 2(CO)9 CCH 3 индивидуальный аналог M M этилидиновая структура 5
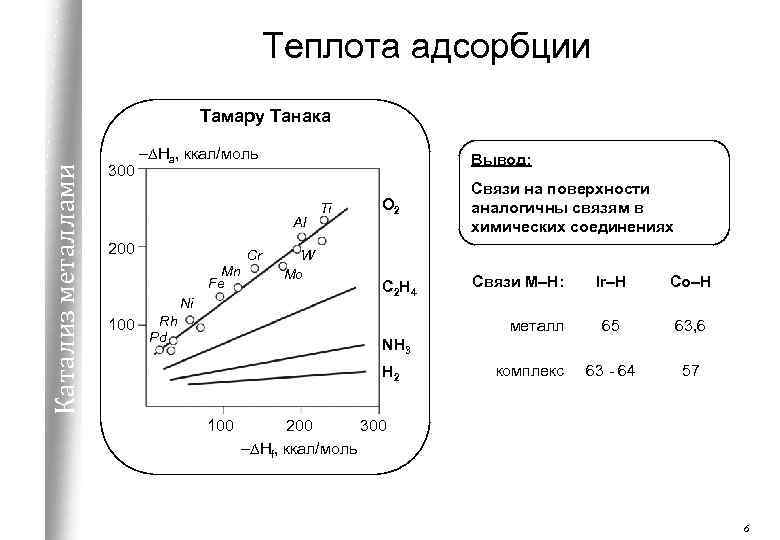
Теплота адсорбции Катализ металлами Тамару Танака 300 –DHa, ккал/моль Вывод: Al 200 Mn Fe Ni 100 Rh Pd Cr W Mo Ti O 2 Связи на поверхности аналогичны связям в химических соединениях C 2 H 4 Связи М–Н: металл Ir–H Co–H 65 63, 6 63 - 64 57 NH 3 H 2 100 комплекс 200 300 –DHf, ккал/моль 6

Катализ металлами Идеальные формы кристаллов г. ц. к. тетраэдр куб октаэдр кубоктаэдр о. ц. к. куб ромбододекаэдр г. п. у. гексагональная и усеченная бипирамида 7

Влияние размера частиц на структуру тетраэдр Катализ металлами 9 Van Hardeveld, Hartog, 1969 Ni Fs Fs – поверхностная энергия 6 Ni – число атомов на поверхности, имеющих ближайших соседей 3 d – относительный диаметр 8 Ni куб Fs 5 3 Минимальная поверхностная энергия: кубоктаэдр ромбододекаэдр d г. ц. к. усеченная гексагональная пирамида (г. п. у. ) 8

Металлы на носителях Катализ металлами Работа адгезии металла на окислах в атмосфере Н 2: Ag – a-Al 2 O 3 0, 435 дж/м 2 Cu – a-Al 2 O 3 0, 475 дж/м 2 Ni – a-Al 2 O 3 0, 65 дж/м 2 Число атомов 1, 8 × 1019 м– 2 Работа адгезии 8 – 30 кдж/моль Это соответствует вандерваальсовскому взаимодействию. 9
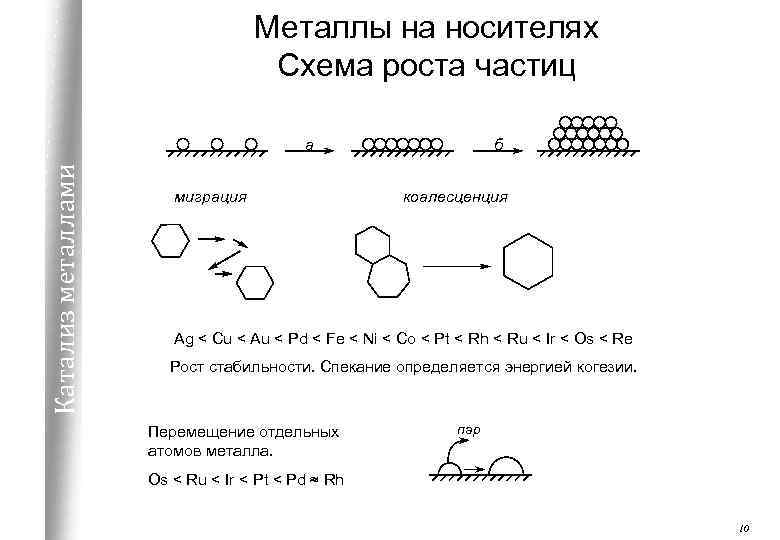
Металлы на носителях Схема роста частиц Катализ металлами а миграция б коалесценция Ag < Cu < Au < Pd < Fe < Ni < Co < Pt < Rh < Ru < Ir < Os < Re Рост стабильности. Спекание определяется энергией когезии. Перемещение отдельных атомов металла. пар Os < Ru < Ir < Pt < Pd ≈ Rh 10

Зависимость каталитических свойств от дисперсности Правило Борескова: Катализ металлами (ЖФХ, 20 б 2560 (1956)) S, см 2 Активность на 1 г Pt на 1 см 2 0, 2% Pt/Si. O 2 3, 5· 103 1, 1· 103 0, 33 0, 5% Pt/Si. O 2 7, 0· 105 2, 8· 103 0, 40 Губчатая Pt 1, 7· 103 3, 9 0, 23 Проволока 20, 6 0, 054 0, 26 Классификация Будара: (M. Boudart, Advan. Catal. , 20, 153 (1969)) 1. “facile” or “structure-insensitive” reactions 2. “demanding” or “structure-sensitive” reactions 11

Катализ металлами ШСтруктурно-нечувствительные реакции: ü Дегидрирование циклогексана ü Гидрирование олефинов ШСтруктурно-чувствительные реакции: ü Гидрогенолиз неопентана ü Реакции скелетной изомеризации 12

Катализ металлами Морфология кристаллов металла на поверхности 13

Нанесенные металлы Сильное взаимодействие металл – носитель Катализ металлами Носители: Ti. O 2, Nb 2 O 5, Ta 2 O 5, V 2 O 5 (Al 2 O 3) Металлы: Pt, Pd, Rh, Ir Восстановление при температуре >500°С Проявление СВМН: 1. Понижение адсорбции Н 2 и СО 2. Неизменная адсорбция О 2 3. Снижение активности в гидрогенолизе, изомеризации, гидрировании 4. Эффекты СВМН исчезают при окислении и последующем мягком восстановлении 14

Принцип геометрического соответствия в мультиплетной теории Баландина Rh 0 Pd – 1, 0 lg K Катализ металлами Секстетная адсорбция циклогексана на плотноупакованной грани металла Ni – 3, 0 Требуемое межатомное расстояние 2, 5 – 2, 8 Å Pt Fe W Ta – 5, 0 0, 35 0, 45 Постоянная решетки 15
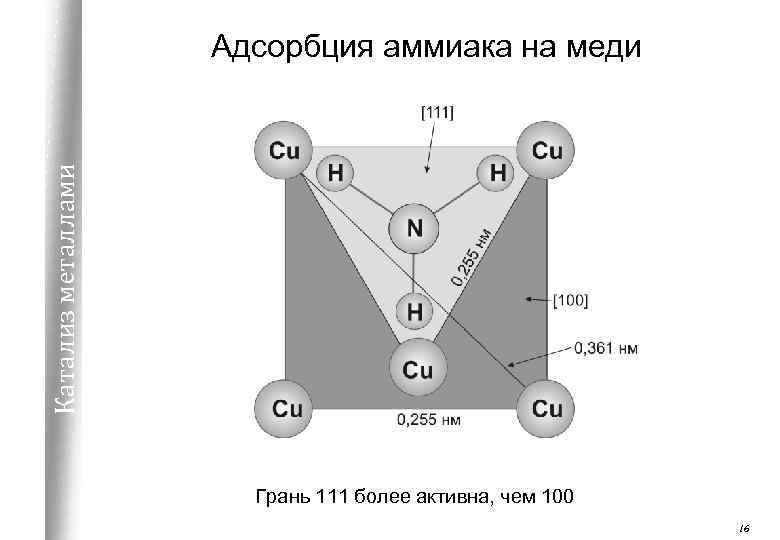
Катализ металлами Адсорбция аммиака на меди Грань 111 более активна, чем 100 16

Корреляция Захтлера-Фаренфорта между активностью и теплотой образования наиболее стабильного окисла Катализ металлами Rh Ru lg K Pd Co Pt Ni Fe Ta W Cr 17

Зависимость скорости реакции от стабильности адсорбированных частиц Катализ металлами Разложение HCOOH Pt Ir Rh DH – теплота образования формиатов (Dowden, 1973) Cu Ni W Ag Fe Au 250 450 18
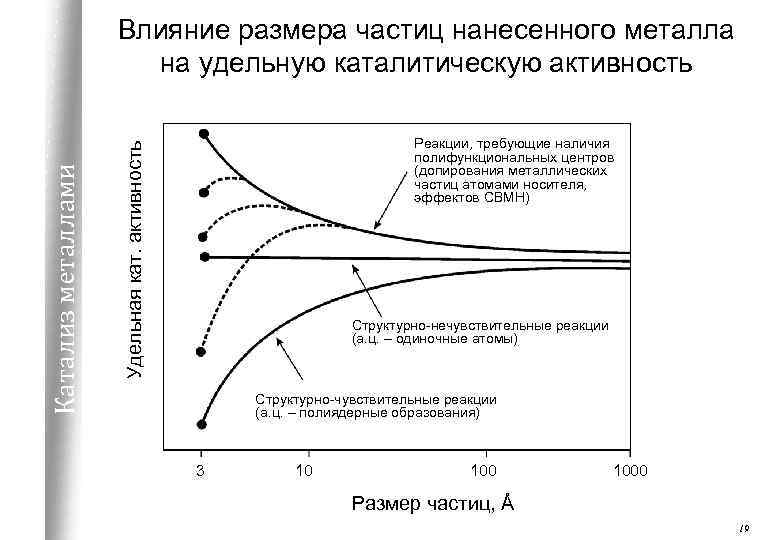
Реакции, требующие наличия полифункциональных центров (допирования металлических частиц атомами носителя, эффектов СВМН) Удельная кат. активность Катализ металлами Влияние размера частиц нанесенного металла на удельную каталитическую активность Структурно-нечувствительные реакции (а. ц. – одиночные атомы) Структурно-чувствительные реакции (а. ц. – полиядерные образования) 3 10 1000 Размер частиц, Å 19

DH Eакт 2 DH 1 DH Катализ металлами Энергетическое соответствие по Баландину Еакт = А ± a. DH Eопт SEi. K – прочность связи хемосорбированных частиц с катализатором 20
Catalysis by metals 2.ppt