Свойства сульфидов металлов.pptx
- Количество слайдов: 12
 Свойства сульфидов металлов Физические свойства Отношение сульфидов металлов щелочных, щелочноземельных, Al, Mn, Fe, Cr, Cu, Ag, Zn, Hg, а также пирита (Fe. S 2) к воде, раствору соляной кислоты
Свойства сульфидов металлов Физические свойства Отношение сульфидов металлов щелочных, щелочноземельных, Al, Mn, Fe, Cr, Cu, Ag, Zn, Hg, а также пирита (Fe. S 2) к воде, раствору соляной кислоты
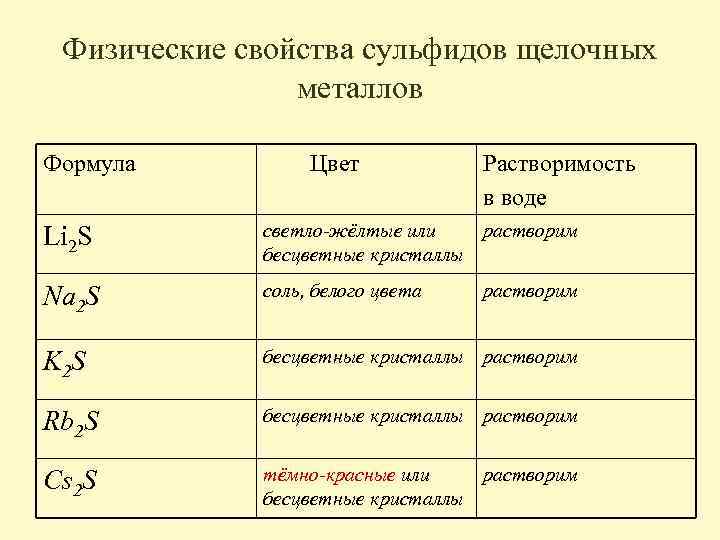 Физические свойства сульфидов щелочных металлов Формула Цвет Растворимость в воде Li 2 S светло-жёлтые или растворим бесцветные кристаллы Na 2 S соль, белого цвета K 2 S бесцветные кристаллы растворим Rb 2 S бесцветные кристаллы растворим Cs 2 S тёмно-красные или растворим бесцветные кристаллы растворим
Физические свойства сульфидов щелочных металлов Формула Цвет Растворимость в воде Li 2 S светло-жёлтые или растворим бесцветные кристаллы Na 2 S соль, белого цвета K 2 S бесцветные кристаллы растворим Rb 2 S бесцветные кристаллы растворим Cs 2 S тёмно-красные или растворим бесцветные кристаллы растворим
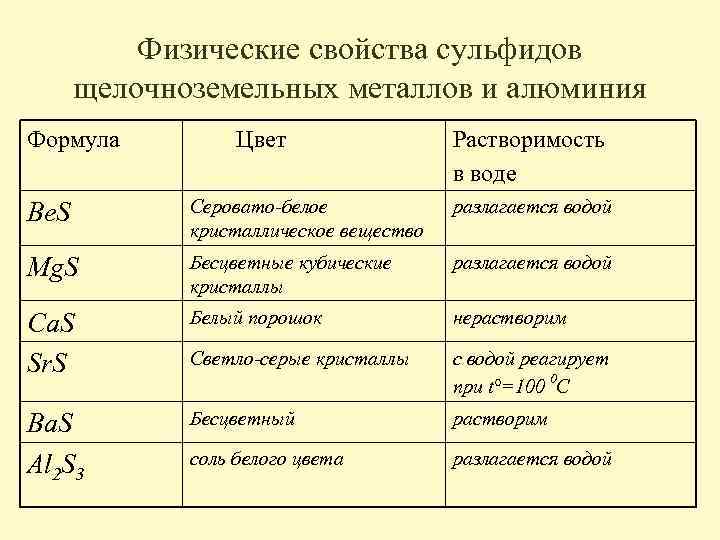 Физические свойства сульфидов щелочноземельных металлов и алюминия Формула Цвет Растворимость в воде Be. S Серовато-белое кристаллическое вещество разлагается водой Mg. S Бесцветные кубические кристаллы разлагается водой Ca. S Sr. S Белый порошок нерастворим Светло-серые кристаллы с водой реагирует при t°=100 0 С Ba. S Al 2 S 3 Бесцветный растворим соль белого цвета разлагается водой
Физические свойства сульфидов щелочноземельных металлов и алюминия Формула Цвет Растворимость в воде Be. S Серовато-белое кристаллическое вещество разлагается водой Mg. S Бесцветные кубические кристаллы разлагается водой Ca. S Sr. S Белый порошок нерастворим Светло-серые кристаллы с водой реагирует при t°=100 0 С Ba. S Al 2 S 3 Бесцветный растворим соль белого цвета разлагается водой
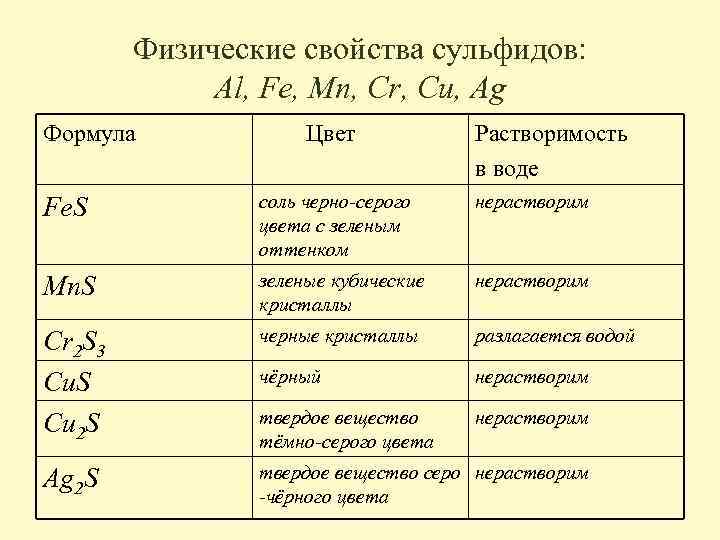 Физические свойства сульфидов: Al, Fe, Mn, Cr, Cu, Ag Формула Цвет Растворимость в воде Fe. S соль черно-серого цвета с зеленым оттенком нерастворим Mn. S зеленые кубические кристаллы нерастворим Cr 2 S 3 Cu. S Cu 2 S черные кристаллы разлагается водой чёрный нерастворим твердое вещество тёмно-серого цвета нерастворим Ag 2 S твердое вещество серо нерастворим -чёрного цвета
Физические свойства сульфидов: Al, Fe, Mn, Cr, Cu, Ag Формула Цвет Растворимость в воде Fe. S соль черно-серого цвета с зеленым оттенком нерастворим Mn. S зеленые кубические кристаллы нерастворим Cr 2 S 3 Cu. S Cu 2 S черные кристаллы разлагается водой чёрный нерастворим твердое вещество тёмно-серого цвета нерастворим Ag 2 S твердое вещество серо нерастворим -чёрного цвета
 Отношение к воде 1. Сульфиды щелочных металлов хорошо растворимы воде, сильно гидролизуются по аниону, образуется гидросульфид металла Na 2 S = 2 Na 1+ + S 2− (катион сильного основания, анион слабой кислоты) S 2− + H+─OH− ⇄ HS 1− + OH 1− Na+ + H 2 O ≠ S 2− + H 2 O + 2 Na 1+ ⇄ HS 1− + OH 1− + 2 Na 1+ Na 2 S + H 2 O ⇄ Na. HS + Na. OH p. H >7, щелочная среда, обратимый гидролиз 2. Сульфиды щелочноземельных металлов, а также сульфиды алюминия и хрома (III) гидролизуются практически необратимо: IIА Me. S + 2 Н 2 О = Ме(OH)2 +Н 2 S↑ Al 2 S 3 + 6 Н 2 О = 2 Al(OH)3↓+ ЗН 2 S↑ Cr 2 S 3 + 6 Н 2 О = 2 Cr(OH)3↓+ ЗН 2 S↑ 3. Нерастворимые сульфиды металлов не диссоциируют и не гидролизуются Fe. S + Н 2 О ≠ Mn. S + Н 2 О ≠ Ag 2 S+ Н 2 О ≠ Сu. S + Н 2 О ≠
Отношение к воде 1. Сульфиды щелочных металлов хорошо растворимы воде, сильно гидролизуются по аниону, образуется гидросульфид металла Na 2 S = 2 Na 1+ + S 2− (катион сильного основания, анион слабой кислоты) S 2− + H+─OH− ⇄ HS 1− + OH 1− Na+ + H 2 O ≠ S 2− + H 2 O + 2 Na 1+ ⇄ HS 1− + OH 1− + 2 Na 1+ Na 2 S + H 2 O ⇄ Na. HS + Na. OH p. H >7, щелочная среда, обратимый гидролиз 2. Сульфиды щелочноземельных металлов, а также сульфиды алюминия и хрома (III) гидролизуются практически необратимо: IIА Me. S + 2 Н 2 О = Ме(OH)2 +Н 2 S↑ Al 2 S 3 + 6 Н 2 О = 2 Al(OH)3↓+ ЗН 2 S↑ Cr 2 S 3 + 6 Н 2 О = 2 Cr(OH)3↓+ ЗН 2 S↑ 3. Нерастворимые сульфиды металлов не диссоциируют и не гидролизуются Fe. S + Н 2 О ≠ Mn. S + Н 2 О ≠ Ag 2 S+ Н 2 О ≠ Сu. S + Н 2 О ≠
 Отношение к соляной кислоте – взаимодействуют с соляной кислотой с образованием соли и выделением сероводорода 1. Сульфиды щелочных металлов: Ме 2 S + 2 НCl =2 Ме. Cl + Н 2 S↑ 2 Ме+ + S 2−+ 2 H+ + 2 Cl− = 2 Ме+ + 2 Cl− + Н 2 S↑ S 2− + 2 H+ = Н 2 S↑ 2. Сульфиды щелочноземельных металлов: Ме. S + 2 НCl = Ме. Cl 2 + Н 2 S↑ Ме. S + 2 H+ + 2 Cl− = Ме 2+ + 2 Cl− + Н 2 S↑ Ме. S + 2 H+ = Ме 2+ + Н 2 S↑
Отношение к соляной кислоте – взаимодействуют с соляной кислотой с образованием соли и выделением сероводорода 1. Сульфиды щелочных металлов: Ме 2 S + 2 НCl =2 Ме. Cl + Н 2 S↑ 2 Ме+ + S 2−+ 2 H+ + 2 Cl− = 2 Ме+ + 2 Cl− + Н 2 S↑ S 2− + 2 H+ = Н 2 S↑ 2. Сульфиды щелочноземельных металлов: Ме. S + 2 НCl = Ме. Cl 2 + Н 2 S↑ Ме. S + 2 H+ + 2 Cl− = Ме 2+ + 2 Cl− + Н 2 S↑ Ме. S + 2 H+ = Ме 2+ + Н 2 S↑
 Отношение к соляной кислоте – взаимодействуют с соляной кислотой с образованием соли и выделением сероводорода 3. Сульфиды алюминия и хрома (III) Al 2 S 3 + 6 НCl = 2 Al. Cl 3 + 3 Н 2 S↑ Al 2 S 3 +6 H+ + 6 Cl− =2 Al 3+ + 6 Cl− +3 Н 2 S↑ Al 2 S 3 + 6 H+ = 2 Al 3++ 3 Н 2 S↑ Cr 2 S 3 + 6 НCl = 2 Cr. Cl 3 + 3 Н 2 S↑ Cr 2 S 3 + 6 H++ 6 Cl− = 2 Cr 3+ + 6 Cl− + 3 Н 2 S↑ Cr 2 S 3 + 6 H+= 2 Cr 3+ + 3 Н 2 S↑ 4. Сульфиды цинка, марганца (II), железа (II) Zn. S, Fe. S, Mn. S (Me. S): II Ме. S + 2 НCl = Ме. Cl 2 + Н 2 S↑ Ме. S + 2 H++2 Cl− = Ме 2+ + 2 Cl− + Н 2 S↑ Ме. S + 2 H+= Ме 2+ + Н 2 S↑
Отношение к соляной кислоте – взаимодействуют с соляной кислотой с образованием соли и выделением сероводорода 3. Сульфиды алюминия и хрома (III) Al 2 S 3 + 6 НCl = 2 Al. Cl 3 + 3 Н 2 S↑ Al 2 S 3 +6 H+ + 6 Cl− =2 Al 3+ + 6 Cl− +3 Н 2 S↑ Al 2 S 3 + 6 H+ = 2 Al 3++ 3 Н 2 S↑ Cr 2 S 3 + 6 НCl = 2 Cr. Cl 3 + 3 Н 2 S↑ Cr 2 S 3 + 6 H++ 6 Cl− = 2 Cr 3+ + 6 Cl− + 3 Н 2 S↑ Cr 2 S 3 + 6 H+= 2 Cr 3+ + 3 Н 2 S↑ 4. Сульфиды цинка, марганца (II), железа (II) Zn. S, Fe. S, Mn. S (Me. S): II Ме. S + 2 НCl = Ме. Cl 2 + Н 2 S↑ Ме. S + 2 H++2 Cl− = Ме 2+ + 2 Cl− + Н 2 S↑ Ме. S + 2 H+= Ме 2+ + Н 2 S↑
 Отношение к соляной кислоте – НЕ взаимодействуют с соляной кислотой сульфиды металлов, стоящих в ряду напряжений правее железа 5. Нерастворимые сульфиды малоактивных и неактивных металлов Cu. S + НCl ≠ Ag 2 S + НCl ≠
Отношение к соляной кислоте – НЕ взаимодействуют с соляной кислотой сульфиды металлов, стоящих в ряду напряжений правее железа 5. Нерастворимые сульфиды малоактивных и неактивных металлов Cu. S + НCl ≠ Ag 2 S + НCl ≠
 Свойства сульфидов металлов Отношение сульфидов металлов щелочных, щелочноземельных, Al, Mn, Fe, Cr, Cu, Ag, Zn, Hg, а также пирита (Fe. S 2) к кислороду – обжиг сульфидов
Свойства сульфидов металлов Отношение сульфидов металлов щелочных, щелочноземельных, Al, Mn, Fe, Cr, Cu, Ag, Zn, Hg, а также пирита (Fe. S 2) к кислороду – обжиг сульфидов
 Отношение сульфидов щелочных и щелочноземельных металлов к кислороду IА Me 2 S– 2 +2 О 2=Me 2 S+6 О 4 Na 2 S– 2 +2 О 2=Na 2 S+6 О 4 IIА Мe. S– 2 +2 O 2=Мe. S+6 O 4 Mg. S– 2 +2 O 2 = Mg. S+6 O 4
Отношение сульфидов щелочных и щелочноземельных металлов к кислороду IА Me 2 S– 2 +2 О 2=Me 2 S+6 О 4 Na 2 S– 2 +2 О 2=Na 2 S+6 О 4 IIА Мe. S– 2 +2 O 2=Мe. S+6 O 4 Mg. S– 2 +2 O 2 = Mg. S+6 O 4
 Сульфиды металлов 2 Al 2 S– 23 + 9 O 2 =2 Al 2 O 3 + 6 S+4 O 2 2 Cr 2 S– 23 + 9 O 2= 2 Cr 2 О 3 + 6 S+4 O 2 2 Cu+2 S– 2 + 3 O 2=2 Cu+2 O + 2 S+4 O 2 При обжиге сульфидов металлов низких степеней окисления образуются оксиды металлов более высоких степеней окисления Cu+12 S– 2 + 2 O 2=2 Cu+2 O + S+4 O 2 Fe+2 S– 2 + 7 O 2 = 2 Fe+32 O 3 + 4 S+4 O 2 Mn+2 S– 2 + 2 O 2 = Mn+4 O 2 + S+4 O 2 Zn. S(влажный) +2 O 2= Zn. S+6 O 4 2 Zn. S– 2 + 3 O 2=2 Zn. O + 2 S+4 O 2 Ag 2 S– 2 + O 2= 2 Ag + S+4 O 2 Hg. S– 2 + O 2= Hg + S+4 O 2
Сульфиды металлов 2 Al 2 S– 23 + 9 O 2 =2 Al 2 O 3 + 6 S+4 O 2 2 Cr 2 S– 23 + 9 O 2= 2 Cr 2 О 3 + 6 S+4 O 2 2 Cu+2 S– 2 + 3 O 2=2 Cu+2 O + 2 S+4 O 2 При обжиге сульфидов металлов низких степеней окисления образуются оксиды металлов более высоких степеней окисления Cu+12 S– 2 + 2 O 2=2 Cu+2 O + S+4 O 2 Fe+2 S– 2 + 7 O 2 = 2 Fe+32 O 3 + 4 S+4 O 2 Mn+2 S– 2 + 2 O 2 = Mn+4 O 2 + S+4 O 2 Zn. S(влажный) +2 O 2= Zn. S+6 O 4 2 Zn. S– 2 + 3 O 2=2 Zn. O + 2 S+4 O 2 Ag 2 S– 2 + O 2= 2 Ag + S+4 O 2 Hg. S– 2 + O 2= Hg + S+4 O 2
 Пирит • Пирит − это сырье для производства серной кислоты. (первая стадия производства) • 4 Fe+2 S− 12 + 11 O 2 → 2 Fe 2 O 3+ 8 SO 2
Пирит • Пирит − это сырье для производства серной кислоты. (первая стадия производства) • 4 Fe+2 S− 12 + 11 O 2 → 2 Fe 2 O 3+ 8 SO 2


