ЕГЭ задание 31.pptx
- Количество слайдов: 81
 Свойства неорганических веществ (задание 31 ЕГЭ по химии)
Свойства неорганических веществ (задание 31 ЕГЭ по химии)
 Свойства неорганических веществ (задание 37 ЕГЭ по химии) От названий к формулам Характеризуем вещества Свойства неорганических веществ Устанавливаем последовательность превращений
Свойства неорганических веществ (задание 37 ЕГЭ по химии) От названий к формулам Характеризуем вещества Свойства неорганических веществ Устанавливаем последовательность превращений
 От названий к формулам
От названий к формулам
 От названий к формулам
От названий к формулам
 От названий к формулам
От названий к формулам
 От названий к формулам
От названий к формулам
 От названий к формулам Mn. O 2 (диоксид марганца) – пиролюзит Cr. O 3 (оксид хрома (VI)) – хромовый ангидрид
От названий к формулам Mn. O 2 (диоксид марганца) – пиролюзит Cr. O 3 (оксид хрома (VI)) – хромовый ангидрид
 Термины, используемые при описании эксперимента • Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). • Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. • «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Отфильтровать — отделить осадок от раствора. • Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
Термины, используемые при описании эксперимента • Навеска — это просто некоторая порция вещества определенной массы (её взвесили на весах). • Прокалить — нагреть вещество до высокой температуры и греть до окончания химических реакций. • «Взорвали смесь газов» — это значит, что вещества прореагировали со взрывом. Обычно для этого используют электрическую искру. Отфильтровать — отделить осадок от раствора. • Профильтровать — пропустить раствор через фильтр, чтобы отделить осадок.
 Термины, используемые при описании эксперимента • Фильтрат — это профильтрованный раствор. • Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли Na. Cl получается раствор поваренной же соли Na. Cl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т. д. • Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
Термины, используемые при описании эксперимента • Фильтрат — это профильтрованный раствор. • Растворение вещества — это переход вещества в раствор. Оно может происходить без химических реакций (например, при растворении в воде поваренной соли Na. Cl получается раствор поваренной же соли Na. Cl, а не щелочь и кислота отдельно), либо в процессе растворения вещество реагирует с водой и образует раствор другого вещества (при растворении оксида бария получится раствор гидроксида бария). Растворять можно вещества не только в воде, но и в кислотах, в щелочах и т. д. • Выпаривание — это удаление из раствора воды и летучих веществ без разложения содержащихся в растворе твёрдых веществ.
 Термины, используемые при описании эксперимента • Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения. • Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. • Осадок и остаток. Очень часто путают эти термины. Хотя это совершенно разные понятия. «Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. «Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком.
Термины, используемые при описании эксперимента • Упаривание — это просто уменьшение массы воды в растворе с помощью кипячения. • Сплавление — это совместное нагревание двух или более твёрдых веществ до температуры, когда начинается их плавление и взаимодействие. • Осадок и остаток. Очень часто путают эти термины. Хотя это совершенно разные понятия. «Реакция протекает с выделением осадка» — это означает, что одно из веществ, получающихся в реакции, малорастворимо. «Остаток» — это вещество, которое осталось, не истратилось полностью или вообще не прореагировало. Например, если смесь нескольких металлов обработали кислотой, а один из металлов не прореагировал — его могут назвать остатком.
 Наиболее характерные признаки газов, растворов, твердых веществ ГАЗЫ: Окрашенные: Cl 2 – желто-зеленый; NO 2 – бурый; O 3 – голубой (все имеют запахи). Все ядовиты, растворяются в воде, Cl 2 и NO 2 реагируют с ней. Бесцветные без запаха: Н 2, N 2, O 2, CO (яд), NO (яд), инертные газы. Все плохо растворимы в воде. Бесцветные с запахом: HF, HCl, HBr, HI, SO 2 (резкие запахи), NH 3(нашатырного спирта) –хорошо растворимы в воде и ядовиты, PH 3(чесночный), H 2 S(тухлых яиц) мало растворимы в воде, ядовиты.
Наиболее характерные признаки газов, растворов, твердых веществ ГАЗЫ: Окрашенные: Cl 2 – желто-зеленый; NO 2 – бурый; O 3 – голубой (все имеют запахи). Все ядовиты, растворяются в воде, Cl 2 и NO 2 реагируют с ней. Бесцветные без запаха: Н 2, N 2, O 2, CO (яд), NO (яд), инертные газы. Все плохо растворимы в воде. Бесцветные с запахом: HF, HCl, HBr, HI, SO 2 (резкие запахи), NH 3(нашатырного спирта) –хорошо растворимы в воде и ядовиты, PH 3(чесночный), H 2 S(тухлых яиц) мало растворимы в воде, ядовиты.
 ОКРАШЕННЫЕ РАСТВОРЫ: желтые Хроматы, например K 2 Cr. O 4 Дихроматы, например, K 2 Cr 2 O 7 Растворы солей железа (III), например, Fe. Cl 3, бромная вода, cпиртовые и спиртово водные оранжевые растворы йода – в зависимости от концентрации от жёлтого до бурого зеленые Гидроксокомплексы хрома (III), например, K 3[Cr(OH)6], соли никеля (II), например Ni. SO 4, манганаты, например, K 2 Mn. O 4 голубые Соли меди (II), например Сu. SO 4 От розового до Перманганаты, например, KMn. O 4 фиолетового От зеленого до Соли хрома (III), например, Cr. Cl 3 синего
ОКРАШЕННЫЕ РАСТВОРЫ: желтые Хроматы, например K 2 Cr. O 4 Дихроматы, например, K 2 Cr 2 O 7 Растворы солей железа (III), например, Fe. Cl 3, бромная вода, cпиртовые и спиртово водные оранжевые растворы йода – в зависимости от концентрации от жёлтого до бурого зеленые Гидроксокомплексы хрома (III), например, K 3[Cr(OH)6], соли никеля (II), например Ni. SO 4, манганаты, например, K 2 Mn. O 4 голубые Соли меди (II), например Сu. SO 4 От розового до Перманганаты, например, KMn. O 4 фиолетового От зеленого до Соли хрома (III), например, Cr. Cl 3 синего
 ОКРАШЕННЫЕ ОСАДКИ, ПОЛУЧАЮЩИЕСЯ ПРИ ВЗАИМОДЕЙСТВИИ РАСТВОРОВ желтые Ag. Br, Ag. I, Ag 3 PO 4, Ba. Cr. O 4, Pb. I 2, Cd. S бурые Fe(OH)3, Mn. O 2 черные, черно- Сульфиды меди, серебра, железа, свинца бурые синие зеленые Cu(OH)2, KFе[Fe(CN)6] Cr(OH)3 – серо зеленый Fe(OH)2 – грязно зеленый, буреет на воздухе
ОКРАШЕННЫЕ ОСАДКИ, ПОЛУЧАЮЩИЕСЯ ПРИ ВЗАИМОДЕЙСТВИИ РАСТВОРОВ желтые Ag. Br, Ag. I, Ag 3 PO 4, Ba. Cr. O 4, Pb. I 2, Cd. S бурые Fe(OH)3, Mn. O 2 черные, черно- Сульфиды меди, серебра, железа, свинца бурые синие зеленые Cu(OH)2, KFе[Fe(CN)6] Cr(OH)3 – серо зеленый Fe(OH)2 – грязно зеленый, буреет на воздухе
 ДРУГИЕ ОКРАШЕННЫЕ ВЕЩЕСТВА желтые оранжевые красные черные Серые с металлическим блеском зеленые сера, золото, хроматы oксид меди (I) – Cu 2 O дихроматы бром (жидкость), медь (аморфная), фосфор красный, Fe 2 O 3, Cr. O 3 Сu. O, Fe. O, Cr. O Графит, кристаллический кремний, кристаллический йод (при возгонке – фиолетовые пары), большинство металлов. Cr 2 O 3, малахит (Cu. OH)2 CO 3, Mn 2 O 7 (жидкость)
ДРУГИЕ ОКРАШЕННЫЕ ВЕЩЕСТВА желтые оранжевые красные черные Серые с металлическим блеском зеленые сера, золото, хроматы oксид меди (I) – Cu 2 O дихроматы бром (жидкость), медь (аморфная), фосфор красный, Fe 2 O 3, Cr. O 3 Сu. O, Fe. O, Cr. O Графит, кристаллический кремний, кристаллический йод (при возгонке – фиолетовые пары), большинство металлов. Cr 2 O 3, малахит (Cu. OH)2 CO 3, Mn 2 O 7 (жидкость)
 ДРУГИЕ ОКРАШЕННЫЕ ВЕЩЕСТВА желтые оранжевые красные черные Серые с металлическим блеском зеленые сера, золото, хроматы oксид меди (I) – Cu 2 O дихроматы бром (жидкость), медь (аморфная), фосфор красный, Fe 2 O 3, Cr. O 3 Сu. O, Fe. O, Cr. O Графит, кристаллический кремний, кристаллический йод (при возгонке – фиолетовые пары), большинство металлов. Cr 2 O 3, малахит (Cu. OH)2 CO 3, Mn 2 O 7 (жидкость)
ДРУГИЕ ОКРАШЕННЫЕ ВЕЩЕСТВА желтые оранжевые красные черные Серые с металлическим блеском зеленые сера, золото, хроматы oксид меди (I) – Cu 2 O дихроматы бром (жидкость), медь (аморфная), фосфор красный, Fe 2 O 3, Cr. O 3 Сu. O, Fe. O, Cr. O Графит, кристаллический кремний, кристаллический йод (при возгонке – фиолетовые пары), большинство металлов. Cr 2 O 3, малахит (Cu. OH)2 CO 3, Mn 2 O 7 (жидкость)
 Последовательность превращений Чёрный порошок, который образовался при длительном нагревании металла красного цвета в избытке воздуха, растворили в 10% ной серной кислоте и получили раствор голубого цвета. В раствор добавили щёлочь и выпавший осадок отделили и растворили в избытке концентрированного раствора аммиака. Сu Cu. O Сu. SO 4 Cu(OH)2 [Сu(NH 3)4](OH) 2
Последовательность превращений Чёрный порошок, который образовался при длительном нагревании металла красного цвета в избытке воздуха, растворили в 10% ной серной кислоте и получили раствор голубого цвета. В раствор добавили щёлочь и выпавший осадок отделили и растворили в избытке концентрированного раствора аммиака. Сu Cu. O Сu. SO 4 Cu(OH)2 [Сu(NH 3)4](OH) 2
 2 1) 2 Последовательность превращений Сu Cu. O Сu. SO 4 Cu(OH)2 [Сu(NH 3)4](OH) 2 1) 2](https://present5.com/presentation/354079291_445392313/image-17.jpg) Последовательность превращений Сu Cu. O Сu. SO 4 Cu(OH)2 [Сu(NH 3)4](OH) 2 1) 2 Сu + O 2 = 2 Cu. O 2) Cu. O + H 2 SO 4 = Сu. SO 4 + H 2 O 3) Сu. SO 4 + 2 Na. OH =Cu(OH)2↓ + Na 2 SO 4 4) Cu(OH)2 +4 NH 4 OH = [Сu(NH 3)4](OH) 2+ 4 H 2 O
Последовательность превращений Сu Cu. O Сu. SO 4 Cu(OH)2 [Сu(NH 3)4](OH) 2 1) 2 Сu + O 2 = 2 Cu. O 2) Cu. O + H 2 SO 4 = Сu. SO 4 + H 2 O 3) Сu. SO 4 + 2 Na. OH =Cu(OH)2↓ + Na 2 SO 4 4) Cu(OH)2 +4 NH 4 OH = [Сu(NH 3)4](OH) 2+ 4 H 2 O
 Последовательность превращений P P 2 O 5 H 3 PO 4 Ca 3(PO 4)2 Ca(H 2 PO 4)2 Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт при нагревании растворили в большом количестве воды. Раствор нейтрализовали негашеной известью. Образовавшееся вещество используют для получения двойного суперфосфата. Напишите уравнения описанных реакций.
Последовательность превращений P P 2 O 5 H 3 PO 4 Ca 3(PO 4)2 Ca(H 2 PO 4)2 Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт при нагревании растворили в большом количестве воды. Раствор нейтрализовали негашеной известью. Образовавшееся вещество используют для получения двойного суперфосфата. Напишите уравнения описанных реакций.
 Последовательность превращений Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт при нагревании растворили в большом количестве воды. Раствор нейтрализовали негашеной известью. Образовавшееся вещество используют для получения двойного суперфосфата. Напишите уравнения описанных реакций. 1) 4 P +5 O 2 = 2 P 2 O 5 2) P 2 O 5+ 3 H 2 O = 2 H 3 PO 4 3) 2 H 3 PO 4 + 3 Ca. O =Ca 3 (PO 4)2↓ + 3 H 2 O 4) Ca 3 (PO 4)2 +4 H 3 PO 4 = 3 Сa(H 2 PO 4)2
Последовательность превращений Вещество красного цвета, которое используется в производстве спичек, сожгли в избытке воздуха и продукт при нагревании растворили в большом количестве воды. Раствор нейтрализовали негашеной известью. Образовавшееся вещество используют для получения двойного суперфосфата. Напишите уравнения описанных реакций. 1) 4 P +5 O 2 = 2 P 2 O 5 2) P 2 O 5+ 3 H 2 O = 2 H 3 PO 4 3) 2 H 3 PO 4 + 3 Ca. O =Ca 3 (PO 4)2↓ + 3 H 2 O 4) Ca 3 (PO 4)2 +4 H 3 PO 4 = 3 Сa(H 2 PO 4)2
 Свойства неорганических веществ Задание 37 требует от участника ЕГЭ знание свойств разнообразных неорганических веществ, связанных с протеканием как ОВР между веществами, так и обменных реакций, протекающих в растворах. Реакция лития или магния с азотом: 6 Li+N 2=2 Li 3 N 3 Mg+N 2=Mg 3 N 2 Горение магния в углекислом газе: 2 Mg+CO 2=2 Mg. O+C Особое свойство плавиковой кислоты: Si. O + 4 HF = 2 H O+ Si. F
Свойства неорганических веществ Задание 37 требует от участника ЕГЭ знание свойств разнообразных неорганических веществ, связанных с протеканием как ОВР между веществами, так и обменных реакций, протекающих в растворах. Реакция лития или магния с азотом: 6 Li+N 2=2 Li 3 N 3 Mg+N 2=Mg 3 N 2 Горение магния в углекислом газе: 2 Mg+CO 2=2 Mg. O+C Особое свойство плавиковой кислоты: Si. O + 4 HF = 2 H O+ Si. F
 Свойства неорганических веществ Необходимо обратить внимание на окислительно восстановительные реакции с участием озона, которые встречаются в материалах ЕГЭ: Na 2 S + 4 O 3 = Na 2 SO 4+ 4 2 O При подготовке к ЕГЭ необходимо помнить, что железо, реагируя с фтором, хлором и бромом, окисляется до степени окисления +3 и образует галогениды Fe. F 3, Fe. Cl 3, Fe. Br 3, но в реакции с иодом оно дает иодид железа (II) Fe. I 2
Свойства неорганических веществ Необходимо обратить внимание на окислительно восстановительные реакции с участием озона, которые встречаются в материалах ЕГЭ: Na 2 S + 4 O 3 = Na 2 SO 4+ 4 2 O При подготовке к ЕГЭ необходимо помнить, что железо, реагируя с фтором, хлором и бромом, окисляется до степени окисления +3 и образует галогениды Fe. F 3, Fe. Cl 3, Fe. Br 3, но в реакции с иодом оно дает иодид железа (II) Fe. I 2
 Свойства неорганических веществ Окислительные свойства солей трехвалентного железа: 2 Fe. Cl 3+Cu=Cu. Cl 2+2 Fe. Cl 2 2 Fe. Cl 3+Fe=3 Fe. Cl 2
Свойства неорганических веществ Окислительные свойства солей трехвалентного железа: 2 Fe. Cl 3+Cu=Cu. Cl 2+2 Fe. Cl 2 2 Fe. Cl 3+Fe=3 Fe. Cl 2
 Свойства неорганических веществ Восстановительные свойства аммиака: NH 3+O 2= kat NH 3+O 2= NH 3+Cu. O= NH 3+Br 2= NH 3+KMn. O 4=
Свойства неорганических веществ Восстановительные свойства аммиака: NH 3+O 2= kat NH 3+O 2= NH 3+Cu. O= NH 3+Br 2= NH 3+KMn. O 4=
 Свойства неорганических веществ Восстановительные свойства аммиака: 4 NH 3+3 O 2=2 N 2+6 H 2 О kat 4 NH 3+5 O 2=4 NO+6 H 2 О 2 NH 3+3 Cu. O=N 2+3 Cu+3 H 2 О 8 NH 3+3 Br 2=N 2+6 NH 4 Br 2 NH 3+2 KMn. O 4=N 2+2 Mn. O 2+2 KOH +2 H О 2
Свойства неорганических веществ Восстановительные свойства аммиака: 4 NH 3+3 O 2=2 N 2+6 H 2 О kat 4 NH 3+5 O 2=4 NO+6 H 2 О 2 NH 3+3 Cu. O=N 2+3 Cu+3 H 2 О 8 NH 3+3 Br 2=N 2+6 NH 4 Br 2 NH 3+2 KMn. O 4=N 2+2 Mn. O 2+2 KOH +2 H О 2
 Свойства неорганических веществ Малохарактерные для него окислительные свойства аммиак проявляет в реакциях с активными металлами: 2 NH 3+6 Mg=2 Mg 3 N 2+3 H 2 2 NH 3+2 Al=2 Al. N+3 H 2 Могут пригодиться знания об аммиачных комплексах: Cu. SO 4+4 NH 3=[Cu(NH 3)4]SO 4 Ag. Cl+2 NH 3=[Ag(NH 3)2]Cl
Свойства неорганических веществ Малохарактерные для него окислительные свойства аммиак проявляет в реакциях с активными металлами: 2 NH 3+6 Mg=2 Mg 3 N 2+3 H 2 2 NH 3+2 Al=2 Al. N+3 H 2 Могут пригодиться знания об аммиачных комплексах: Cu. SO 4+4 NH 3=[Cu(NH 3)4]SO 4 Ag. Cl+2 NH 3=[Ag(NH 3)2]Cl
 Свойства неорганических веществ Трудными оказываются уравнения реакций, которые редко записывают или вообще не употребляют в учебном процессе: K 2 SО 4 + Н 2 = Ag 2 SО 4 + Н 2 = Ba. SО 4 + Н 2 = Na 2 SО 4 + C = Ba. SО 4 + C = Na 2 SO 3 + S = Ca 3(РО 4)2 + Al =
Свойства неорганических веществ Трудными оказываются уравнения реакций, которые редко записывают или вообще не употребляют в учебном процессе: K 2 SО 4 + Н 2 = Ag 2 SО 4 + Н 2 = Ba. SО 4 + Н 2 = Na 2 SО 4 + C = Ba. SО 4 + C = Na 2 SO 3 + S = Ca 3(РО 4)2 + Al =
 Свойства неорганических веществ Трудными оказываются уравнения реакций, которые редко записывают или вообще не употребляют в учебном процессе: K 2 SО 4 + 4 Н 2 = К 2 S + 4 Н 2 О Ag 2 SО 4 + Н 2 = 2 Ag + Н 2 SО 4 Ba. SО 4 + 4 Н 2 = Ba. S + 4 Н 2 О Na 2 SО 4 + 4 C = Na 2 S + 4 CО Ba. SО 4 + 4 C = Ba. S + 4 CО Na 2 SO 3 + S = Na 2 S 2 O 3 3 Ca 3(РО 4)2 + 16 Al = 3 Ca 3 Р 2 + 8 Al 2 О 3
Свойства неорганических веществ Трудными оказываются уравнения реакций, которые редко записывают или вообще не употребляют в учебном процессе: K 2 SО 4 + 4 Н 2 = К 2 S + 4 Н 2 О Ag 2 SО 4 + Н 2 = 2 Ag + Н 2 SО 4 Ba. SО 4 + 4 Н 2 = Ba. S + 4 Н 2 О Na 2 SО 4 + 4 C = Na 2 S + 4 CО Ba. SО 4 + 4 C = Ba. S + 4 CО Na 2 SO 3 + S = Na 2 S 2 O 3 3 Ca 3(РО 4)2 + 16 Al = 3 Ca 3 Р 2 + 8 Al 2 О 3
 Кислоты. Основания. Соли. Оксиды. Для получения азотной кислоты оксид азота (IV) должен быть доокислен, например кислородом воздуха: 4 NO 2 + 2 H 2 О = 4 HNO 3 Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту Na. Cl (тв. ) + H 2 SO 4(конц. ) = Na. HSO 4 + HCl
Кислоты. Основания. Соли. Оксиды. Для получения азотной кислоты оксид азота (IV) должен быть доокислен, например кислородом воздуха: 4 NO 2 + 2 H 2 О = 4 HNO 3 Лабораторный способ получения хлороводорода: к твердому хлориду натрия приливают концентрированную серную кислоту Na. Cl (тв. ) + H 2 SO 4(конц. ) = Na. HSO 4 + HCl
 Кислоты. Основания. Соли. Оксиды. Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту: Na. Br+ H 3 PO 4 (конц. ) = Na. H 2 PO 4 + HBr Кислоты-неокислители реагируют с металлами, стоящими в ряду активности металлов до водорода, с выделением водорода и образованием соответствующей соли: Fe + 2 HCl = Fe. Cl 2 + H 2
Кислоты. Основания. Соли. Оксиды. Для получения бромоводорода из бромида натрия, концентрированная серная кислота не подойдет, так как выделяющийся бромоводород будет загрязнен парами брома. Можно использовать концентрированную фосфорную кислоту: Na. Br+ H 3 PO 4 (конц. ) = Na. H 2 PO 4 + HBr Кислоты-неокислители реагируют с металлами, стоящими в ряду активности металлов до водорода, с выделением водорода и образованием соответствующей соли: Fe + 2 HCl = Fe. Cl 2 + H 2
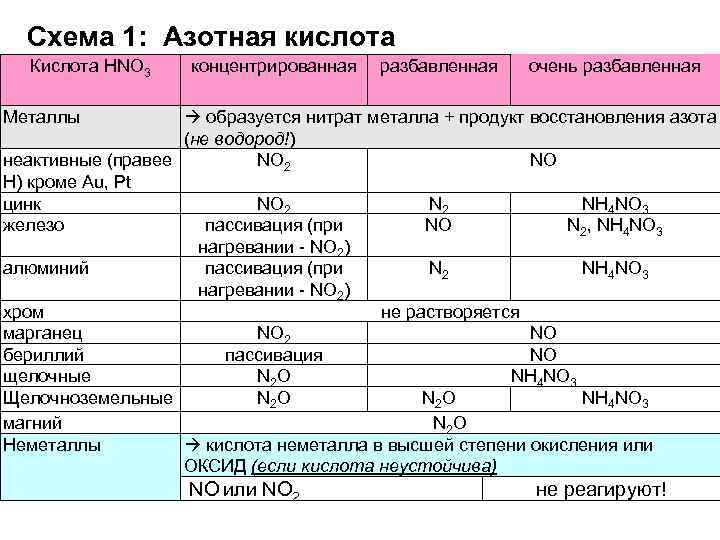 Схема 1: Азотная кислота Кислота HNO 3 концентрированная разбавленная очень разбавленная Металлы образуется нитрат металла + продукт восстановления азота (не водород!) неактивные (правее NO 2 NO Н) кроме Au, Pt цинк NO 2 NH 4 NO 3 железо пассивация (при NO N 2, NH 4 NO 3 нагревании NO 2) алюминий пассивация (при N 2 NH 4 NO 3 нагревании NO 2) хром не растворяется марганец NO 2 NO бериллий пассивация NO щелочные N 2 O NH 4 NO 3 Щелочноземельные N 2 O NH 4 NO 3 магний N 2 O кислота неметалла в высшей степени окисления или Неметаллы ОКСИД (если кислота неустойчива) NO или NO 2 не реагируют!
Схема 1: Азотная кислота Кислота HNO 3 концентрированная разбавленная очень разбавленная Металлы образуется нитрат металла + продукт восстановления азота (не водород!) неактивные (правее NO 2 NO Н) кроме Au, Pt цинк NO 2 NH 4 NO 3 железо пассивация (при NO N 2, NH 4 NO 3 нагревании NO 2) алюминий пассивация (при N 2 NH 4 NO 3 нагревании NO 2) хром не растворяется марганец NO 2 NO бериллий пассивация NO щелочные N 2 O NH 4 NO 3 Щелочноземельные N 2 O NH 4 NO 3 магний N 2 O кислота неметалла в высшей степени окисления или Неметаллы ОКСИД (если кислота неустойчива) NO или NO 2 не реагируют!
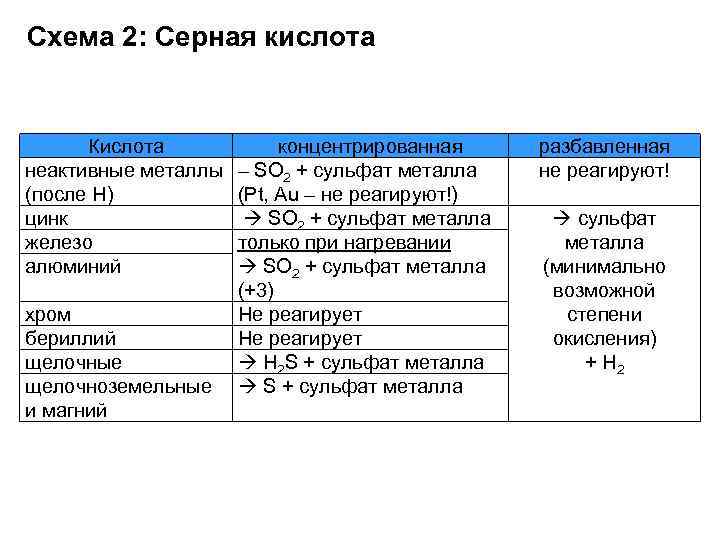 Схема 2: Серная кислота Кислота неактивные металлы (после Н) цинк железо алюминий хром бериллий щелочные щелочноземельные и магний концентрированная – SO 2 + сульфат металла (Pt, Au – не реагируют!) SO 2 + сульфат металла только при нагревании SO 2 + сульфат металла (+3) Не реагирует Н 2 S + сульфат металла разбавленная не реагируют! сульфат металла (минимально возможной степени окисления) + Н 2
Схема 2: Серная кислота Кислота неактивные металлы (после Н) цинк железо алюминий хром бериллий щелочные щелочноземельные и магний концентрированная – SO 2 + сульфат металла (Pt, Au – не реагируют!) SO 2 + сульфат металла только при нагревании SO 2 + сульфат металла (+3) Не реагирует Н 2 S + сульфат металла разбавленная не реагируют! сульфат металла (минимально возможной степени окисления) + Н 2
 Окислительные свойства азотной и серной кислот в реакциях с неметаллами P + HNO 3 (конц. ) = S + HNO 3 (конц. ) = H 2 S + HNO 3 (конц. ) = Fe. S 2 + HNO 3 (конц. ) =
Окислительные свойства азотной и серной кислот в реакциях с неметаллами P + HNO 3 (конц. ) = S + HNO 3 (конц. ) = H 2 S + HNO 3 (конц. ) = Fe. S 2 + HNO 3 (конц. ) =
 Окислительные свойства азотной и серной кислот в реакциях с неметаллами P + 5 HNO 3 (конц. ) = H 3 PO 4 + 5 NO 2 + H 2 O S + 6 HNO 3 (конц. ) = H 2 SO 4 + 6 NO 2 + 2 H 2 O H 2 S + 8 HNO 3 (конц. ) = H 2 SO 4 + 8 NO 2 + 4 H 2 O Fe. S 2 + 8 HNO 3 (конц. ) = Fe(NO 3)3 + 2 H 2 SO 4 + 5 NO + 2 H 2 O
Окислительные свойства азотной и серной кислот в реакциях с неметаллами P + 5 HNO 3 (конц. ) = H 3 PO 4 + 5 NO 2 + H 2 O S + 6 HNO 3 (конц. ) = H 2 SO 4 + 6 NO 2 + 2 H 2 O H 2 S + 8 HNO 3 (конц. ) = H 2 SO 4 + 8 NO 2 + 4 H 2 O Fe. S 2 + 8 HNO 3 (конц. ) = Fe(NO 3)3 + 2 H 2 SO 4 + 5 NO + 2 H 2 O
 Кислоты. Основания. Соли. Оксиды. HI + H 2 SO 4 (конц. ) = HBr + H 2 SO 4 (конц. ) = P + H 2 SO 4 (конц. ) =
Кислоты. Основания. Соли. Оксиды. HI + H 2 SO 4 (конц. ) = HBr + H 2 SO 4 (конц. ) = P + H 2 SO 4 (конц. ) =
 Кислоты. Основания. Соли. Оксиды. Серная кислота окисляет галогеноводороды HI и HBr ( но не HCl) до свободных галогенов, а неметаллы – до соответствующих им кислот: 8 HI + H 2 SO 4 (конц. ) = H 2 S + 4 I 2 + 4 H 2 O 2 HBr + H 2 SO 4 (конц. ) = SO 2 + Br 2 + 2 H 2 O 2 P + 5 H 2 SO 4 (конц. ) =2 H 3 PO 4 + 5 SO 2 + 2 H 2 O
Кислоты. Основания. Соли. Оксиды. Серная кислота окисляет галогеноводороды HI и HBr ( но не HCl) до свободных галогенов, а неметаллы – до соответствующих им кислот: 8 HI + H 2 SO 4 (конц. ) = H 2 S + 4 I 2 + 4 H 2 O 2 HBr + H 2 SO 4 (конц. ) = SO 2 + Br 2 + 2 H 2 O 2 P + 5 H 2 SO 4 (конц. ) =2 H 3 PO 4 + 5 SO 2 + 2 H 2 O
 Кислоты. Основания. Соли. Оксиды. Кислоты взаимодействуют с солями более слабых и более летучих кислот: Нелетучая, хотя и не самая сильная, серная кислота вытесняет все кислоты из их солей, а ее не может вытеснить ни одна кислота. Исключение: Cu. SO 4+H 2 S=Cu. S+ Н 2 SO 4
Кислоты. Основания. Соли. Оксиды. Кислоты взаимодействуют с солями более слабых и более летучих кислот: Нелетучая, хотя и не самая сильная, серная кислота вытесняет все кислоты из их солей, а ее не может вытеснить ни одна кислота. Исключение: Cu. SO 4+H 2 S=Cu. S+ Н 2 SO 4
 Кислоты. Основания. Соли. Оксиды. Ортофосфорная кислота по первой стадии диссоциирует как кислота средней силы, по второй как слабая, а по третьей стадии диссоциация настолько незначительна, что в растворе ничтожно мало ионов РО 43. Поэтому в ее растворе из анионов преобладают H 2 PO 4 , в меньшем количестве присутствуют HPO 42. По этой причине фосфат калия в кислотной среде не образуется Н 3 РО 4 + КОН = КН 2 РО 4 + Н 2 О 2 Н 3 РО 4 + 2 К = 2 КН 2 РО 4 + Н 2
Кислоты. Основания. Соли. Оксиды. Ортофосфорная кислота по первой стадии диссоциирует как кислота средней силы, по второй как слабая, а по третьей стадии диссоциация настолько незначительна, что в растворе ничтожно мало ионов РО 43. Поэтому в ее растворе из анионов преобладают H 2 PO 4 , в меньшем количестве присутствуют HPO 42. По этой причине фосфат калия в кислотной среде не образуется Н 3 РО 4 + КОН = КН 2 РО 4 + Н 2 О 2 Н 3 РО 4 + 2 К = 2 КН 2 РО 4 + Н 2
 Кислоты. Основания. Соли. Оксиды. Фосфат калия можно получить лишь при избытке щелочи: Н 3 РО 4 + 3 КОН(изб. ) = К 3 РО 4 + 3 Н 2 О Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль: NH 3 + H 3 PO 4 = NH 4 H 2 PO 4 Избыток щелочи переводит кислые соли в средние: Na 2 НРО 4 + Na. ОН (изб. ) = Na 3 РО 4 + Н 2 О
Кислоты. Основания. Соли. Оксиды. Фосфат калия можно получить лишь при избытке щелочи: Н 3 РО 4 + 3 КОН(изб. ) = К 3 РО 4 + 3 Н 2 О Продуктом реакции аммиака с фосфорной кислотой может также быть кислая соль: NH 3 + H 3 PO 4 = NH 4 H 2 PO 4 Избыток щелочи переводит кислые соли в средние: Na 2 НРО 4 + Na. ОН (изб. ) = Na 3 РО 4 + Н 2 О
 Кислоты. Основания. Соли. Оксиды. Чтобы получить из основной соли среднюю соль нужно подействовать кислотой: Mg. OHCl + HCl = Mg. Cl 2 + H 2 O При добавлении сильной кислоты все соли ортофосфорной кислоты превращаются в дигидрофосфаты, которые растворимы в воде: Na 3 РО 4 + 2 НCl = Na. Н 2 РО 4 + 2 Na. Cl РО 43 + 2 Н+= Н 2 РО 4 Общее свойство всех нерастворимых фосфатов – их растворимость в растворах сильных кислот: Ca 3(РО 4)2 + 4 HNО 3 = Са(H 2 РО 4)2 + 2 Ca(NО 3)2
Кислоты. Основания. Соли. Оксиды. Чтобы получить из основной соли среднюю соль нужно подействовать кислотой: Mg. OHCl + HCl = Mg. Cl 2 + H 2 O При добавлении сильной кислоты все соли ортофосфорной кислоты превращаются в дигидрофосфаты, которые растворимы в воде: Na 3 РО 4 + 2 НCl = Na. Н 2 РО 4 + 2 Na. Cl РО 43 + 2 Н+= Н 2 РО 4 Общее свойство всех нерастворимых фосфатов – их растворимость в растворах сильных кислот: Ca 3(РО 4)2 + 4 HNО 3 = Са(H 2 РО 4)2 + 2 Ca(NО 3)2
 Кислоты. Основания. Соли. Оксиды. Более сильное основание вытесняет более слабое из его солей: Al. Cl 3 + 3 Na. OH = Al(OH)3 + 3 Na. Cl Mg. Cl 2 + KOH = Mg. OHCl + KCl NH 4 Сl + Na. OH = Na. Cl + NH 3 + H 2 O Гидроксиды металлов разлагаются при нагревании, кроме Na. OH, KOH: 2 Al(OH)3 = Al 2 O 3 + 3 H 2 O 2 Fe(OH)3 = Fe 2 O 3 + 3 H 2 O
Кислоты. Основания. Соли. Оксиды. Более сильное основание вытесняет более слабое из его солей: Al. Cl 3 + 3 Na. OH = Al(OH)3 + 3 Na. Cl Mg. Cl 2 + KOH = Mg. OHCl + KCl NH 4 Сl + Na. OH = Na. Cl + NH 3 + H 2 O Гидроксиды металлов разлагаются при нагревании, кроме Na. OH, KOH: 2 Al(OH)3 = Al 2 O 3 + 3 H 2 O 2 Fe(OH)3 = Fe 2 O 3 + 3 H 2 O
 Кислоты. Основания. Соли. Оксиды. Определенную трудность могут представлять окислительно восстановительные реакции щелочей с неметаллами: Cl 2 + 2 KOH = KCl + H 2 O + KCl. O (на холоду) (аналогично с Br 2, I 2) Cl 2 + 6 KOH = 5 KCl + KCl. O 3 + 3 H 2 O (при нагревании) (аналогично с Br 2, I 2) Si + 2 KOH+ H 2 O = K 2 Si. O 3 + 2 H 2 3 S + 6 KOH = K 2 SO 3 + 2 K 2 S+ 3 H 2 O 8 P + 3 Ba(OH)2+ 6 H 2 O = 3 Ba(H 2 PO 2)2 + 2 PH 3 гипофосфит бария
Кислоты. Основания. Соли. Оксиды. Определенную трудность могут представлять окислительно восстановительные реакции щелочей с неметаллами: Cl 2 + 2 KOH = KCl + H 2 O + KCl. O (на холоду) (аналогично с Br 2, I 2) Cl 2 + 6 KOH = 5 KCl + KCl. O 3 + 3 H 2 O (при нагревании) (аналогично с Br 2, I 2) Si + 2 KOH+ H 2 O = K 2 Si. O 3 + 2 H 2 3 S + 6 KOH = K 2 SO 3 + 2 K 2 S+ 3 H 2 O 8 P + 3 Ba(OH)2+ 6 H 2 O = 3 Ba(H 2 PO 2)2 + 2 PH 3 гипофосфит бария
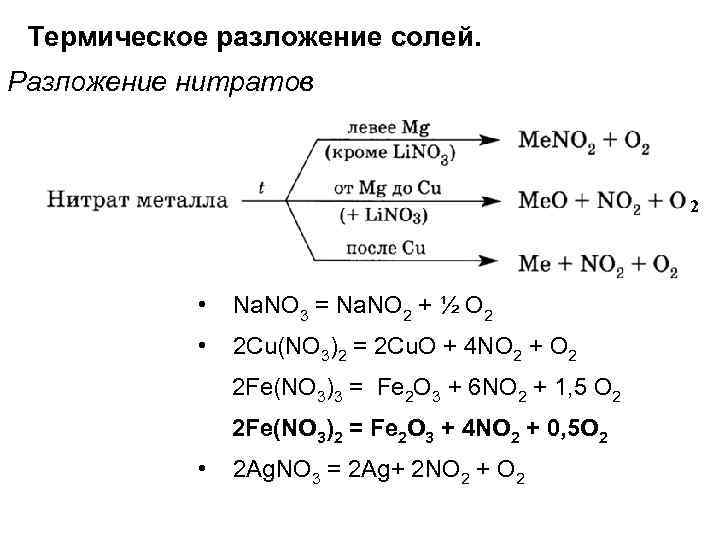 Термическое разложение солей. Разложение нитратов 2 • Na. NO 3 = Na. NO 2 + ½ O 2 • 2 Cu(NO 3)2 = 2 Cu. O + 4 NO 2 + О 2 2 Fe(NO 3)3 = Fe 2 O 3 + 6 NO 2 + 1, 5 O 2 2 Fe(NO 3)2 = Fe 2 O 3 + 4 NO 2 + 0, 5 O 2 • 2 Ag. NO 3 = 2 Ag+ 2 NO 2 + O 2
Термическое разложение солей. Разложение нитратов 2 • Na. NO 3 = Na. NO 2 + ½ O 2 • 2 Cu(NO 3)2 = 2 Cu. O + 4 NO 2 + О 2 2 Fe(NO 3)3 = Fe 2 O 3 + 6 NO 2 + 1, 5 O 2 2 Fe(NO 3)2 = Fe 2 O 3 + 4 NO 2 + 0, 5 O 2 • 2 Ag. NO 3 = 2 Ag+ 2 NO 2 + O 2
 Термическое разложение солей. Разложение солей аммония На аммиак и соответствующую кислоту разлагаются при нагревании только те соли аммония, которые содержат анион, не обладающий окислительными свойствами: (NH 4)2 CO 3 = 2 NH 3 + CO 2+ H 2 O (NH 4)2 HPO 4 = 2 NH 3 + H 3 PO 4 Чем сильнее кислота, тем труднее разложить соль: (NH 4)2 SO 4 = 2 NH 3 + NH 4 HSO 4 Если анион соли обладает окислительными свойствами, то аммиак не образуется: NH 4 NO 3 = N 2 O + 2 H 2 O NH 4 NO 2 = N 2 + 2 H 2 O (NH 4)2 Cr 2 O 7 = N 2 + Cr 2 O 3+ 4 H 2 O
Термическое разложение солей. Разложение солей аммония На аммиак и соответствующую кислоту разлагаются при нагревании только те соли аммония, которые содержат анион, не обладающий окислительными свойствами: (NH 4)2 CO 3 = 2 NH 3 + CO 2+ H 2 O (NH 4)2 HPO 4 = 2 NH 3 + H 3 PO 4 Чем сильнее кислота, тем труднее разложить соль: (NH 4)2 SO 4 = 2 NH 3 + NH 4 HSO 4 Если анион соли обладает окислительными свойствами, то аммиак не образуется: NH 4 NO 3 = N 2 O + 2 H 2 O NH 4 NO 2 = N 2 + 2 H 2 O (NH 4)2 Cr 2 O 7 = N 2 + Cr 2 O 3+ 4 H 2 O
 Термическое разложение солей. Разложение солей угольной кислоты Не разлагаются при нагревании карбонаты щелочных металлов (кроме Li 2 CO 3). Все остальные карбонаты и карбонат лития разлагаются на оксид металла и углекислый газ: Li 2 CO 3= Li 2 O + CO 2 Сa. CO 3= Ca. O + CO 2 Все гидрокарбонаты разлагаются сначала до карбонатов: Ca(HCO 3)2 = Сa. CO 3 + CO 2+ H 2 O При дальнейшем нагревании образовавшийся карбонат разлагается, как показано выше.
Термическое разложение солей. Разложение солей угольной кислоты Не разлагаются при нагревании карбонаты щелочных металлов (кроме Li 2 CO 3). Все остальные карбонаты и карбонат лития разлагаются на оксид металла и углекислый газ: Li 2 CO 3= Li 2 O + CO 2 Сa. CO 3= Ca. O + CO 2 Все гидрокарбонаты разлагаются сначала до карбонатов: Ca(HCO 3)2 = Сa. CO 3 + CO 2+ H 2 O При дальнейшем нагревании образовавшийся карбонат разлагается, как показано выше.
 Термическое разложение солей. Разложение кислородосодержащих солей – окислителей: 2 KCl. O 3 = 2 KCl+ 3 O 2 4 KCl. O 3 = KCl+ 3 KCl. O 4 2 KMn. O 4 = K 2 Mn. O 4+ Mn. O 2 2 + O Разложение комплексных солей При нагревании разлагаются все комплексные соли, образованные амфотерными гидроксидами: Na Al(OH)4 = Na. Al. O 2 + 2 H 2 O Na 2[Zn(OH)4] = Na Zn. O 2 + 2 H 2 O 2 Разложение основных солей При нагревании разлагаются многие основные соли: (Cu. OH)2 CO 3 = 2 Cu. O + CO 2+ H 2 O
Термическое разложение солей. Разложение кислородосодержащих солей – окислителей: 2 KCl. O 3 = 2 KCl+ 3 O 2 4 KCl. O 3 = KCl+ 3 KCl. O 4 2 KMn. O 4 = K 2 Mn. O 4+ Mn. O 2 2 + O Разложение комплексных солей При нагревании разлагаются все комплексные соли, образованные амфотерными гидроксидами: Na Al(OH)4 = Na. Al. O 2 + 2 H 2 O Na 2[Zn(OH)4] = Na Zn. O 2 + 2 H 2 O 2 Разложение основных солей При нагревании разлагаются многие основные соли: (Cu. OH)2 CO 3 = 2 Cu. O + CO 2+ H 2 O
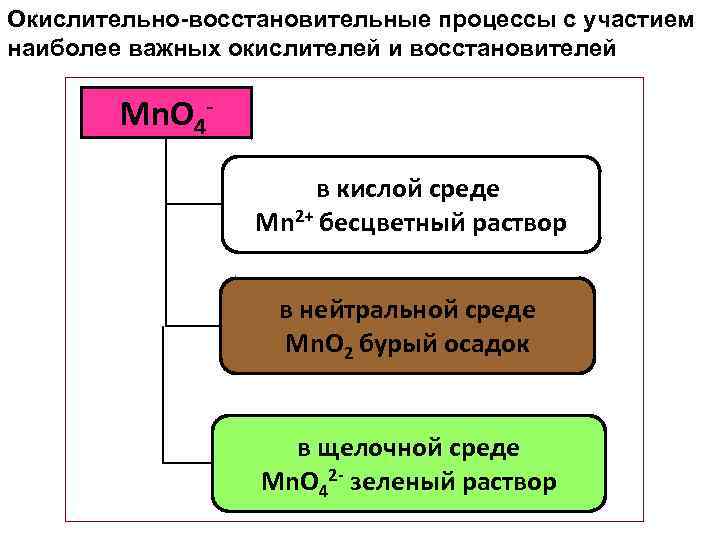 Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей Mn. O 4 в кислой среде Mn 2+ бесцветный раствор в нейтральной среде Mn. O 2 бурый осадок в щелочной среде Mn. O 42 - зеленый раствор
Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей Mn. O 4 в кислой среде Mn 2+ бесцветный раствор в нейтральной среде Mn. O 2 бурый осадок в щелочной среде Mn. O 42 - зеленый раствор
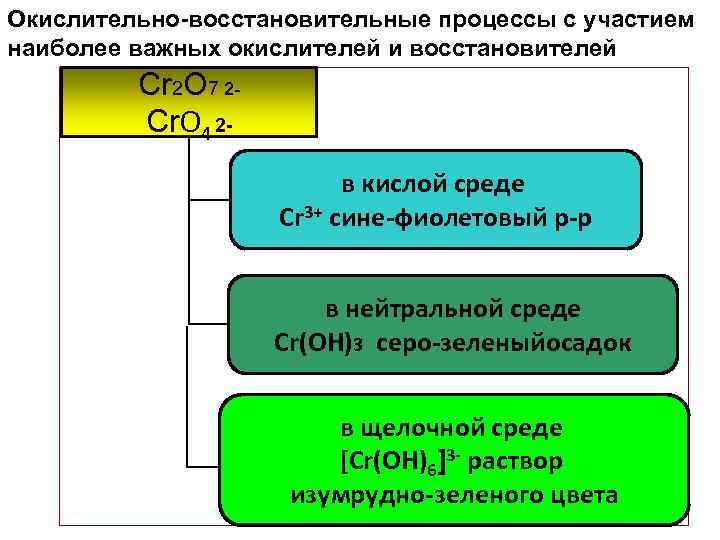 Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей Cr 2 O 7 2 Cr. O 4 2 в кислой среде Cr 3+ сине-фиолетовый р-р в нейтральной среде Cr(OH)3 серо-зеленыйосадок в щелочной среде [Cr(OН)6]3 - раствор изумрудно-зеленого цвета
Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей Cr 2 O 7 2 Cr. O 4 2 в кислой среде Cr 3+ сине-фиолетовый р-р в нейтральной среде Cr(OH)3 серо-зеленыйосадок в щелочной среде [Cr(OН)6]3 - раствор изумрудно-зеленого цвета
 Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей кислотная среда: 5 Na 2 SО 3 + 2 КМn. О 4 + 3 H 2 SO 4 = 2 Mn. SO 4 +K 2 SO 4 + 5 Na 2 SО 4 + ЗН 2 О щелочная среда: Na 2 SО 3 + 2 КМn. О 4 + 2 KOH =2 K 2 Mn. O 4 + Na 2 SО 4 + Н 2 О нейтральная среда: 3 Na 2 SО 3 + 2 КМn. О 4 + H 2 O = 2 Mn. O 2 + 3 Na 2 SО 4 +2 KOН Примеры: P + КМn. О 4 + H 2 SO 4 = NH 3 + KMn. O 4 = K 2 Cr 2 O 7 + C + H 2 SO 4 =
Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей кислотная среда: 5 Na 2 SО 3 + 2 КМn. О 4 + 3 H 2 SO 4 = 2 Mn. SO 4 +K 2 SO 4 + 5 Na 2 SО 4 + ЗН 2 О щелочная среда: Na 2 SО 3 + 2 КМn. О 4 + 2 KOH =2 K 2 Mn. O 4 + Na 2 SО 4 + Н 2 О нейтральная среда: 3 Na 2 SО 3 + 2 КМn. О 4 + H 2 O = 2 Mn. O 2 + 3 Na 2 SО 4 +2 KOН Примеры: P + КМn. О 4 + H 2 SO 4 = NH 3 + KMn. O 4 = K 2 Cr 2 O 7 + C + H 2 SO 4 =
 Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей Примеры: P + 2 КМn. О 4 + H 2 SO 4 = 2 Mn. SO 4 + KH 2 PO 4 2 NH 3 + 2 KMn. O 4 = N 2 + 2 Mn. O 2 + 2 KOH + 2 H 2 O 2 K 2 Cr 2 O 7 + 3 C + 8 H 2 SO 4 = 3 CO 2 +2 Cr 2(SO 4)3 2 SO 4+ 8 H 2 O +2 K
Окислительно-восстановительные процессы с участием наиболее важных окислителей и восстановителей Примеры: P + 2 КМn. О 4 + H 2 SO 4 = 2 Mn. SO 4 + KH 2 PO 4 2 NH 3 + 2 KMn. O 4 = N 2 + 2 Mn. O 2 + 2 KOH + 2 H 2 O 2 K 2 Cr 2 O 7 + 3 C + 8 H 2 SO 4 = 3 CO 2 +2 Cr 2(SO 4)3 2 SO 4+ 8 H 2 O +2 K
 Электролиз
Электролиз
 Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода: 2 Hg. SO 4 + 2 H 2 O = 2 Hg + О 2 + 2 H 2 SO 4 1) на катоде: Hg 2+ + 2 e = Hg° 2) на аноде: 2 Н 2 О – 4 е = О 2 + 4 Н+ до водорода: Са. I 2 + 2 Н 2 О = Н 2 + I 2 + Са(ОН)2 1) на катоде: 2 Н 2 О + 2 e = 2 ОН + Н 2 2) на аноде: 2 I 2 e = I 2 электролиз раствора сульфата натрия: 1) на катоде: 2 H 2 O + 2 e = H 2 + 2 OH– 2) на аноде: 2 H 2 O – 4 e = O 2 + 4 H+ 3) Составлено общее уравнение электролиза: 2 H 2 O = 2 H 2 + O 2
Электролиз растворов солей металлов, стоящих в ряду напряжения после водорода: 2 Hg. SO 4 + 2 H 2 O = 2 Hg + О 2 + 2 H 2 SO 4 1) на катоде: Hg 2+ + 2 e = Hg° 2) на аноде: 2 Н 2 О – 4 е = О 2 + 4 Н+ до водорода: Са. I 2 + 2 Н 2 О = Н 2 + I 2 + Са(ОН)2 1) на катоде: 2 Н 2 О + 2 e = 2 ОН + Н 2 2) на аноде: 2 I 2 e = I 2 электролиз раствора сульфата натрия: 1) на катоде: 2 H 2 O + 2 e = H 2 + 2 OH– 2) на аноде: 2 H 2 O – 4 e = O 2 + 4 H+ 3) Составлено общее уравнение электролиза: 2 H 2 O = 2 H 2 + O 2
 Электролиз При электролизе солей, образованных металлами, находящимися в ряду активности между алюминием и водородом 4 Fe. Cl 3 + 6 H 2 O = 3 H 2 + 2 Fe + 6 Cl 2 + 2 Fe (OH)3 на катоде происходит конкурирующие восстановление катиона металла и воды, в результате на катоде выделяются металл и водород, а в растворе образуется гидроксид соответствующего металла; на аноде происходит окисление анионов бескислородных кислот, в частности выделяется Cl 2.
Электролиз При электролизе солей, образованных металлами, находящимися в ряду активности между алюминием и водородом 4 Fe. Cl 3 + 6 H 2 O = 3 H 2 + 2 Fe + 6 Cl 2 + 2 Fe (OH)3 на катоде происходит конкурирующие восстановление катиона металла и воды, в результате на катоде выделяются металл и водород, а в растворе образуется гидроксид соответствующего металла; на аноде происходит окисление анионов бескислородных кислот, в частности выделяется Cl 2.
 Электролиз солей карбоновых кислот -К -A CH 3 CH 2 COONa 3 CH 2 COO- + Na+ CH H 2 O Na+: H 2 O: 2 H 2 O + 2ē = H 20 + 2 OHАнод = графит – инертный! CH 3 CH 2 COOO- - ē = CH 3 CH 2 COO· свободный радикал, неустойчив CH 3 CH 2 COO· = CO 2 + C 2 H 5· свободный радикал, неустойчив CH 3 CH 2· + C 2 H 5· = CH 3 CH 2–CH 2 CH 3 CH 2 COONa + 2 H 2 O = = H 2 + 2 Na. OH + 2 CO 2 + CH 3 CH 2 -CH 2 CH 3
Электролиз солей карбоновых кислот -К -A CH 3 CH 2 COONa 3 CH 2 COO- + Na+ CH H 2 O Na+: H 2 O: 2 H 2 O + 2ē = H 20 + 2 OHАнод = графит – инертный! CH 3 CH 2 COOO- - ē = CH 3 CH 2 COO· свободный радикал, неустойчив CH 3 CH 2 COO· = CO 2 + C 2 H 5· свободный радикал, неустойчив CH 3 CH 2· + C 2 H 5· = CH 3 CH 2–CH 2 CH 3 CH 2 COONa + 2 H 2 O = = H 2 + 2 Na. OH + 2 CO 2 + CH 3 CH 2 -CH 2 CH 3
 Электрохимический ряд напряжения металлов 1. Чем ближе стоит металл к началу ряда, тем сильнее его восстановительные свойства и тем слабее окислительная способность его ионов. 2. Металлы, стоящие до водорода, способны вытеснять его из растворов кислот. Но следует иметь в виду, что свинец, стоящий перед водородом, не может вытеснить его из раствора серной кислоты, так как при контакте с этой кислотой на поверхности металла сразу же образуется защитный слой нерастворимого сульфата Pb. SO 4. Этот слой изолирует металл от кислоты.
Электрохимический ряд напряжения металлов 1. Чем ближе стоит металл к началу ряда, тем сильнее его восстановительные свойства и тем слабее окислительная способность его ионов. 2. Металлы, стоящие до водорода, способны вытеснять его из растворов кислот. Но следует иметь в виду, что свинец, стоящий перед водородом, не может вытеснить его из раствора серной кислоты, так как при контакте с этой кислотой на поверхности металла сразу же образуется защитный слой нерастворимого сульфата Pb. SO 4. Этот слой изолирует металл от кислоты.
 Электрохимический ряд напряжения металлов 3. Металлы, стоящие до магния (щелочные и щелочно – земельные), вытесняют водород также из воды и любого водного раствора. По этой причине уравнения реакций между этими металлами и растворами кислот неокислителей (HCl, HBr, HI, H 2 SO 4 (разб. )) не записывают. 4. По этой же причине не записывают уравнения реакций щелочных и щелочно – земельных металлов с растворами солей. Щелочной металл не вытесняет менее активный металл из раствора его соли. 5. Электрохимический ряд напряжений характеризует восстановительную способность металлов в водных растворах солей и не применим к расплавам солей. расплав Например: 2 Al + 3 Ca. Cl 2 = 2 Al. Cl 3 + 3 Ca
Электрохимический ряд напряжения металлов 3. Металлы, стоящие до магния (щелочные и щелочно – земельные), вытесняют водород также из воды и любого водного раствора. По этой причине уравнения реакций между этими металлами и растворами кислот неокислителей (HCl, HBr, HI, H 2 SO 4 (разб. )) не записывают. 4. По этой же причине не записывают уравнения реакций щелочных и щелочно – земельных металлов с растворами солей. Щелочной металл не вытесняет менее активный металл из раствора его соли. 5. Электрохимический ряд напряжений характеризует восстановительную способность металлов в водных растворах солей и не применим к расплавам солей. расплав Например: 2 Al + 3 Ca. Cl 2 = 2 Al. Cl 3 + 3 Ca
 Гидролиз При сливании растворов солей, содержащих катион слабого основания и анион слабой кислоты, соль не образуется, так как идет гидролиз и по катиону, и по аниону: Al 2(SO 4)3 + 3 K 2 CO 3 + 3 H 2 O = 2 Al(OH)3 + 3 CO 2 + 3 K 2 SO 4 2 Fe. Cl 3 + 3 K 2 CO 3 + 3 H 2 O = 2 Fe(OH)3 + 3 CO 2 + 6 KCl 2 Al. Br 3 + 3 K 2 CO 3 + 3 H 2 O = 2 Al(OH)3 + 3 CO 2 + 6 KBr 2 Al. CL 3 + 3 Na 2 S + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S + 6 Na. Cl Гидролиз следует учитывать, рассматривая реакции металлов с растворами солей. Mg + 2 NН 4 Cl = Mg. Cl 2 + 2 NH 3 + 2 H 2 Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк: Mg+Mg. Cl +2 H O=2 Mg. OHCl+H
Гидролиз При сливании растворов солей, содержащих катион слабого основания и анион слабой кислоты, соль не образуется, так как идет гидролиз и по катиону, и по аниону: Al 2(SO 4)3 + 3 K 2 CO 3 + 3 H 2 O = 2 Al(OH)3 + 3 CO 2 + 3 K 2 SO 4 2 Fe. Cl 3 + 3 K 2 CO 3 + 3 H 2 O = 2 Fe(OH)3 + 3 CO 2 + 6 KCl 2 Al. Br 3 + 3 K 2 CO 3 + 3 H 2 O = 2 Al(OH)3 + 3 CO 2 + 6 KBr 2 Al. CL 3 + 3 Na 2 S + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S + 6 Na. Cl Гидролиз следует учитывать, рассматривая реакции металлов с растворами солей. Mg + 2 NН 4 Cl = Mg. Cl 2 + 2 NH 3 + 2 H 2 Растворы солей, имеющие кислую реакцию среды, вследствие гидролиза, способны растворять активные металлы, например, магний или цинк: Mg+Mg. Cl +2 H O=2 Mg. OHCl+H
 Гидролиз Особую трудность вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов: Mg. SO 4+Na 2 CO 3=Mg. CO 3+Na 2 SO 4 2 Mg. SO 4+2 Na 2 CO 3+H 2 O=(Mg. OH)2 CO 3+2 Na 2 SO 4+CO 2 2 Mg. SO 4+2 Na 2 CO 3+2 H 2 O=2 Mg(OH)2+2 Na 2 SO 4+2 CO 2 Составление подобных уравнений реакций может потребоваться при выполнении заданий № 37 ЕГЭ по химии. 3 K[Al(OH)4] + Al. Cl 3 = 3 KCl + 4 Al(OH)3 3 Cl 2 + 3 K 2 CO 3 = KCl. O 3 + 3 CO 2 + 5 KCl
Гидролиз Особую трудность вызывают сложные случаи взаимодействия растворов веществ солей подвергающихся гидролизу. Так для взаимодействия раствора сульфата магния с карбонатом натрия можно записать целых три уравнения возможных процессов: Mg. SO 4+Na 2 CO 3=Mg. CO 3+Na 2 SO 4 2 Mg. SO 4+2 Na 2 CO 3+H 2 O=(Mg. OH)2 CO 3+2 Na 2 SO 4+CO 2 2 Mg. SO 4+2 Na 2 CO 3+2 H 2 O=2 Mg(OH)2+2 Na 2 SO 4+2 CO 2 Составление подобных уравнений реакций может потребоваться при выполнении заданий № 37 ЕГЭ по химии. 3 K[Al(OH)4] + Al. Cl 3 = 3 KCl + 4 Al(OH)3 3 Cl 2 + 3 K 2 CO 3 = KCl. O 3 + 3 CO 2 + 5 KCl
 Гидролиз бинарных соединений Al 4 C 3 + Н 2 О = Al 2 S 3 + Н 2 О = Ba. S+ Н 2 О = Ca. C 2 + Н 2 О = Ca 3 P 2 + Н 2 О = Ca. H 2 + Н 2 О = Si. H 4 + Н 2 О = Mg 3 N 2 + Н 2 О = PCl 3 + H 2 O = PCl 5 + H 2 O =
Гидролиз бинарных соединений Al 4 C 3 + Н 2 О = Al 2 S 3 + Н 2 О = Ba. S+ Н 2 О = Ca. C 2 + Н 2 О = Ca 3 P 2 + Н 2 О = Ca. H 2 + Н 2 О = Si. H 4 + Н 2 О = Mg 3 N 2 + Н 2 О = PCl 3 + H 2 O = PCl 5 + H 2 O =
 Гидролиз бинарных соединений Al 4 C 3 + 12 Н 2 О = 4 Аl(ОН)3 + ЗСН 4 Al 2 S 3 + 6 Н 2 О = 2 Аl(ОН)3 + ЗН 2 S Ba. S+ 2 Н 2 О = Ba(ОН)3 + Н 2 S Ca. C 2 + 2 Н 2 О = Ca(ОН)2 + С 2 Н 2 Ca 3 P 2 + 6 Н 2 О = 3 Ca(ОН)2 + 2 PН 3 Ca. H 2 + 2 Н 2 О = Ca(ОН)2 + 2 Н 2 Si. H 4 + 2 Н 2 О = Si. О 2 + 4 Н 2 Mg 3 N 2 + 6 Н 2 О = 3 Mg(ОН)2 + 2 NH 3 PCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl PCl 5 + 4 H 2 O = H 3 PO 4 + 5 HCl Не гидролизуются: SF 6, NF 3, CF 4, CS 2, Al. N, Si 3 N 4, Si. C, Li 4 Si
Гидролиз бинарных соединений Al 4 C 3 + 12 Н 2 О = 4 Аl(ОН)3 + ЗСН 4 Al 2 S 3 + 6 Н 2 О = 2 Аl(ОН)3 + ЗН 2 S Ba. S+ 2 Н 2 О = Ba(ОН)3 + Н 2 S Ca. C 2 + 2 Н 2 О = Ca(ОН)2 + С 2 Н 2 Ca 3 P 2 + 6 Н 2 О = 3 Ca(ОН)2 + 2 PН 3 Ca. H 2 + 2 Н 2 О = Ca(ОН)2 + 2 Н 2 Si. H 4 + 2 Н 2 О = Si. О 2 + 4 Н 2 Mg 3 N 2 + 6 Н 2 О = 3 Mg(ОН)2 + 2 NH 3 PCl 3 + 3 H 2 O = H 3 PO 3 + 3 HCl PCl 5 + 4 H 2 O = H 3 PO 4 + 5 HCl Не гидролизуются: SF 6, NF 3, CF 4, CS 2, Al. N, Si 3 N 4, Si. C, Li 4 Si
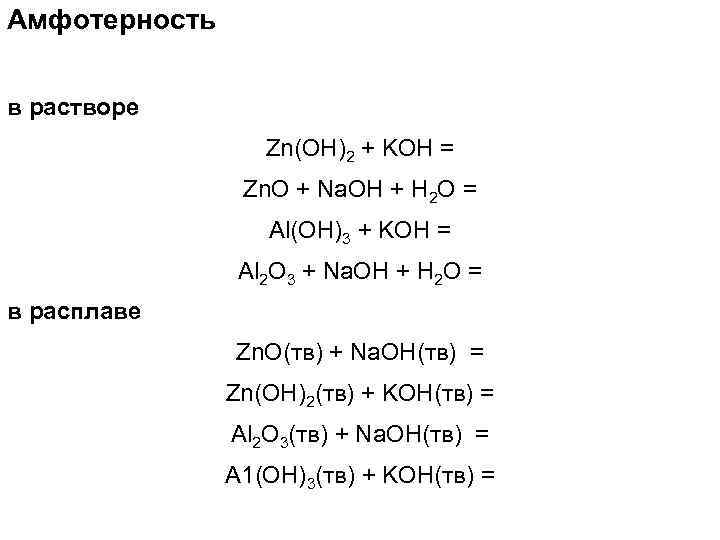 Амфотерность в растворе Zn(OH)2 + KOH = Zn. O + Na. OH + H 2 O = Al(OH)3 + KOH = Al 2 O 3 + Na. OH + H 2 O = в расплаве Zn. O(тв) + Na. OH(тв) = Zn(OH)2(тв) + KOH(тв) = Al 2 O 3(тв) + Na. OH(тв) = A 1(OH)3(тв) + KOH(тв) =
Амфотерность в растворе Zn(OH)2 + KOH = Zn. O + Na. OH + H 2 O = Al(OH)3 + KOH = Al 2 O 3 + Na. OH + H 2 O = в расплаве Zn. O(тв) + Na. OH(тв) = Zn(OH)2(тв) + KOH(тв) = Al 2 O 3(тв) + Na. OH(тв) = A 1(OH)3(тв) + KOH(тв) =
![Амфотерность в растворе Zn(OH)2 + 2 KOH = K 2[Zn(OH)4] Zn. O + 2 Амфотерность в растворе Zn(OH)2 + 2 KOH = K 2[Zn(OH)4] Zn. O + 2](https://present5.com/presentation/354079291_445392313/image-61.jpg) Амфотерность в растворе Zn(OH)2 + 2 KOH = K 2[Zn(OH)4] Zn. O + 2 Na. OH + H 2 O = Na 2[Zn(OH)4] Al(OH)3 + KOH = K[Al(OH)4] Al 2 O 3 + 2 Na. OH + 3 H 2 O = 2 Na[Al(OH)4] в расплаве Zn. O(тв) + 2 Na. OH(тв) = Na 2 Zn. О 2 + H 2 O Zn(OH)2(тв) + 2 KOH(тв) = K 2 Zn. О 2 + 2 H 2 O Al 2 O 3(тв) + 2 Na. OH(тв) = 2 Na. Al. O 2 + H 2 O A 1(OH)3(тв) + KOH(тв) = Na. Al. O 2 + 2 H 2 O
Амфотерность в растворе Zn(OH)2 + 2 KOH = K 2[Zn(OH)4] Zn. O + 2 Na. OH + H 2 O = Na 2[Zn(OH)4] Al(OH)3 + KOH = K[Al(OH)4] Al 2 O 3 + 2 Na. OH + 3 H 2 O = 2 Na[Al(OH)4] в расплаве Zn. O(тв) + 2 Na. OH(тв) = Na 2 Zn. О 2 + H 2 O Zn(OH)2(тв) + 2 KOH(тв) = K 2 Zn. О 2 + 2 H 2 O Al 2 O 3(тв) + 2 Na. OH(тв) = 2 Na. Al. O 2 + H 2 O A 1(OH)3(тв) + KOH(тв) = Na. Al. O 2 + 2 H 2 O
 Амфотерность Слабо амфотерные гидроксиды железа (III) и хрома (III) реагируют лишь с расплавами щелочей или с концентрированными растворами щелочей: с расплавами щелочей Cr(OH)3(тв) + KOH(тв) = KCr. О 2 + 2 H 2 O Fe(OH)3(тв) + KOH(тв) = KFe. O 2 + 2 H 2 O с концентрированными растворами щелочей Cr(OH)3 + 3 KOH(конц. ) = K 3[Cr(OH)6] Fe(OH)3 + 3 KOH(конц. ) = K 3[Fe(OH)6] Заметим, что в материалах ЕГЭ можно встретить и такое уравнение реакции: Fe(OH)3 + KOH = K[Fe(OH)4]
Амфотерность Слабо амфотерные гидроксиды железа (III) и хрома (III) реагируют лишь с расплавами щелочей или с концентрированными растворами щелочей: с расплавами щелочей Cr(OH)3(тв) + KOH(тв) = KCr. О 2 + 2 H 2 O Fe(OH)3(тв) + KOH(тв) = KFe. O 2 + 2 H 2 O с концентрированными растворами щелочей Cr(OH)3 + 3 KOH(конц. ) = K 3[Cr(OH)6] Fe(OH)3 + 3 KOH(конц. ) = K 3[Fe(OH)6] Заметим, что в материалах ЕГЭ можно встретить и такое уравнение реакции: Fe(OH)3 + KOH = K[Fe(OH)4]
 Амфотерность Металлы, оксиды и гидроксиды которых амфотерны, также могут реагировать и с кислотами, и со щелочами: Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] + H 2 Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 Для хрома и железа подобная реакция не характерна. При гидролизе солей, полученных из амфотерных соединений, образуются комплексные соли: KAl. O 2 + 2 H 2 O = K [Al(OH)4] Амфотерные оксиды при сплавлении реагируют с карбонатами активных металлов: Al 2 O 3 + K 2 CO 3 = 2 KAl. O 2 + CO 2
Амфотерность Металлы, оксиды и гидроксиды которых амфотерны, также могут реагировать и с кислотами, и со щелочами: Be + 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] + H 2 Zn + 2 Na. OH + 2 H 2 O = Na 2[Zn(OH)4] + H 2 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH)4] + 3 H 2 Для хрома и железа подобная реакция не характерна. При гидролизе солей, полученных из амфотерных соединений, образуются комплексные соли: KAl. O 2 + 2 H 2 O = K [Al(OH)4] Амфотерные оксиды при сплавлении реагируют с карбонатами активных металлов: Al 2 O 3 + K 2 CO 3 = 2 KAl. O 2 + CO 2
 Способы разрушения комплексных солей При действии избытка сильной кислоты получается две средних соли и вода: Na Al(OH)4 + 4 HClизб. = Na. Cl + Al. Cl 3 + 4 H 2 O K 3 Cr(OH)6 + 6 HNO 3 изб. = 3 KNO 3 + Cr(NO 3)3 + 6 H 2 O При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода: Na Al(OH)4 + HClнед. = Na. Cl + Al(OH)3 + H 2 O K 3 Cr(OH)6 + 3 HNO 3 нед. = 3 KNO 3 + Cr(OH)3 + 3 H 2 O При действии слабой кислоты получается кислая соль активного металла, амфотерный гидроксид и вода: Na Al(OH)4 + H 2 S = Na. HS + Al(OH)3 + H 2 O K 3 Cr(OH)6 + 3 H 2 CO 3 = 3 KHCO 3 + Cr(OH)3 + 3 H 2 O
Способы разрушения комплексных солей При действии избытка сильной кислоты получается две средних соли и вода: Na Al(OH)4 + 4 HClизб. = Na. Cl + Al. Cl 3 + 4 H 2 O K 3 Cr(OH)6 + 6 HNO 3 изб. = 3 KNO 3 + Cr(NO 3)3 + 6 H 2 O При действии недостатка сильной кислоты получается средняя соль активного металла, амфотерный гидроксид и вода: Na Al(OH)4 + HClнед. = Na. Cl + Al(OH)3 + H 2 O K 3 Cr(OH)6 + 3 HNO 3 нед. = 3 KNO 3 + Cr(OH)3 + 3 H 2 O При действии слабой кислоты получается кислая соль активного металла, амфотерный гидроксид и вода: Na Al(OH)4 + H 2 S = Na. HS + Al(OH)3 + H 2 O K 3 Cr(OH)6 + 3 H 2 CO 3 = 3 KHCO 3 + Cr(OH)3 + 3 H 2 O
 Способы разрушения комплексных солей При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид: Na Al(OH)4 + CO 2 = Na. HCO 3 + Al(OH)3 K 3 Cr(OH)6 + 3 SO 2 = 3 KHSO 3 + Cr(OH)3 При действии солей, образованных сильными кислотами и катионами Fe 3+, Al 3+ и Cr 3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла: 3 Na Al(OH)4 + Fe. Cl 3 = 3 Al(OH)3 + Fe(OH)3 + 3 Na. Cl K 3 Cr(OH)6 + Al(NO 3)3 = Al(OH)3 + Cr(OH)3 + 3 KNO 3 При нагревании выделяется вода: Na Al(OH)4 = Na. Al. O 2 + 2 H 2 O K 3 Cr(OH)6 = KCr. O 2 + 2 H 2 O + 2 KOH
Способы разрушения комплексных солей При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид: Na Al(OH)4 + CO 2 = Na. HCO 3 + Al(OH)3 K 3 Cr(OH)6 + 3 SO 2 = 3 KHSO 3 + Cr(OH)3 При действии солей, образованных сильными кислотами и катионами Fe 3+, Al 3+ и Cr 3+ происходит взаимное усиление гидролиза, получается два амфотерных гидроксида и соль активного металла: 3 Na Al(OH)4 + Fe. Cl 3 = 3 Al(OH)3 + Fe(OH)3 + 3 Na. Cl K 3 Cr(OH)6 + Al(NO 3)3 = Al(OH)3 + Cr(OH)3 + 3 KNO 3 При нагревании выделяется вода: Na Al(OH)4 = Na. Al. O 2 + 2 H 2 O K 3 Cr(OH)6 = KCr. O 2 + 2 H 2 O + 2 KOH
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Азот Оксид азота (I), оксид диазота, закись азота, «веселящий газ» слабый окислитель: 2 N 2 O =2 N 2 + O 2 N 2 O +H 2 =N 2 + H 2 O 6 N 2 O + P 4 = 6 N 2 + P 4 O 6 2 N 2 O + C (графит) = 2 N 2 + CO 2 слабый восстановитель: N 2 O + H 2 SO 4(конц. , гор. ) = 2 NO + SO 2+ H 2 O Оксид азота (II), монооксид азота. 2 NO + O 2 = 2 NO 2 2 NO + C(графит) = N 2+ CO 2 2 NO + 2 Mg = N 2+ 2 Mg. O
НЕОРГАНИЧЕСКАЯ ХИМИЯ Азот Оксид азота (I), оксид диазота, закись азота, «веселящий газ» слабый окислитель: 2 N 2 O =2 N 2 + O 2 N 2 O +H 2 =N 2 + H 2 O 6 N 2 O + P 4 = 6 N 2 + P 4 O 6 2 N 2 O + C (графит) = 2 N 2 + CO 2 слабый восстановитель: N 2 O + H 2 SO 4(конц. , гор. ) = 2 NO + SO 2+ H 2 O Оксид азота (II), монооксид азота. 2 NO + O 2 = 2 NO 2 2 NO + C(графит) = N 2+ CO 2 2 NO + 2 Mg = N 2+ 2 Mg. O
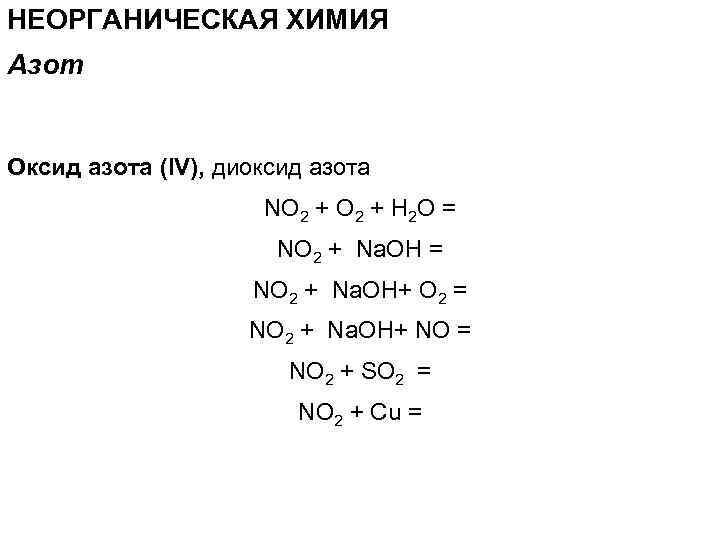 НЕОРГАНИЧЕСКАЯ ХИМИЯ Азот Оксид азота (IV), диоксид азота NO 2 + H 2 О = NO 2 + Na. OH+ O 2 = NO 2 + Na. OH+ NO = NO 2 + SO 2 = NO 2 + Cu =
НЕОРГАНИЧЕСКАЯ ХИМИЯ Азот Оксид азота (IV), диоксид азота NO 2 + H 2 О = NO 2 + Na. OH+ O 2 = NO 2 + Na. OH+ NO = NO 2 + SO 2 = NO 2 + Cu =
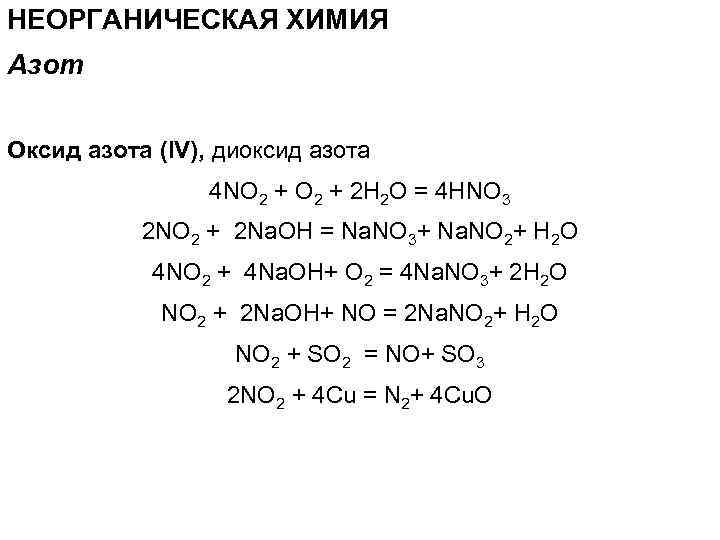 НЕОРГАНИЧЕСКАЯ ХИМИЯ Азот Оксид азота (IV), диоксид азота 4 NO 2 + 2 H 2 О = 4 HNO 3 2 NO 2 + 2 Na. OH = Na. NO 3+ Na. NO 2+ H 2 O 4 NO 2 + 4 Na. OH+ O 2 = 4 Na. NO 3+ 2 H 2 O NO 2 + 2 Na. OH+ NO = 2 Na. NO 2+ H 2 O NO 2 + SO 2 = NO+ SO 3 2 NO 2 + 4 Cu = N 2+ 4 Cu. O
НЕОРГАНИЧЕСКАЯ ХИМИЯ Азот Оксид азота (IV), диоксид азота 4 NO 2 + 2 H 2 О = 4 HNO 3 2 NO 2 + 2 Na. OH = Na. NO 3+ Na. NO 2+ H 2 O 4 NO 2 + 4 Na. OH+ O 2 = 4 Na. NO 3+ 2 H 2 O NO 2 + 2 Na. OH+ NO = 2 Na. NO 2+ H 2 O NO 2 + SO 2 = NO+ SO 3 2 NO 2 + 4 Cu = N 2+ 4 Cu. O
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Галогены Получение: 16 HCl + 2 KMn. O 4 =5 Cl 2 + 2 Mn. Cl 2 + 2 KCl + 8 H 2 O 4 HCl + Mn. O 2 =Cl 2 + Mn. Cl 2 + 2 H 2 O Cвойства С менее электроотрицательными неметаллами: 2 P + 5 Cl 2 = 2 PCl 5 2 P + 3 PCl 5 = 5 PCl 3 2 S + Cl 2 = S 2 Cl 2 + Cl 2 = 2 SCl 2 Важно отметить, что непосредственно с азотом и кислородом хлор не взаимодействует.
НЕОРГАНИЧЕСКАЯ ХИМИЯ Галогены Получение: 16 HCl + 2 KMn. O 4 =5 Cl 2 + 2 Mn. Cl 2 + 2 KCl + 8 H 2 O 4 HCl + Mn. O 2 =Cl 2 + Mn. Cl 2 + 2 H 2 O Cвойства С менее электроотрицательными неметаллами: 2 P + 5 Cl 2 = 2 PCl 5 2 P + 3 PCl 5 = 5 PCl 3 2 S + Cl 2 = S 2 Cl 2 + Cl 2 = 2 SCl 2 Важно отметить, что непосредственно с азотом и кислородом хлор не взаимодействует.
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Галогены Взаимодействие с водой: Cl 2 + H 2 O = HCl+ HCl. O 2 F 2 + 2 H 2 O = 4 HF+ O 2 Окислительные свойства: 2 HCl + F 2 = 2 HF + Cl 2 2 NH 3 + 3 Br 2 = N 2 + 6 HBr PH 3 + 4 Br 2 + 4 Н 2 О = Н 3 РО 4 + 8 НВг KNO 2 + Br 2 + Н 2 О = KNO 3 + 2 НВг
НЕОРГАНИЧЕСКАЯ ХИМИЯ Галогены Взаимодействие с водой: Cl 2 + H 2 O = HCl+ HCl. O 2 F 2 + 2 H 2 O = 4 HF+ O 2 Окислительные свойства: 2 HCl + F 2 = 2 HF + Cl 2 2 NH 3 + 3 Br 2 = N 2 + 6 HBr PH 3 + 4 Br 2 + 4 Н 2 О = Н 3 РО 4 + 8 НВг KNO 2 + Br 2 + Н 2 О = KNO 3 + 2 НВг
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Галогены не взаимодействуют с кислотами. Только I 2 при взаимодействии с концентрированной азотной кислотой образует иодноватую кислоту HIO 3: I 2 + 10 HNO 3 (конц. ) = 2 HIO 3 + 10 NO 2 + 4 H O 2 Галогеноводороды Восстановительные свойства (кроме HF): 6 HCl + 2 HNO 3 (конц. ) = 3 Cl 2 + 2 NO + 4 H O 2 4 HI + Mn. O 2 = I 2 + Mn. I 2 + 2 H 2 O 2 HBr + H 2 SO 4 = Br 2 + SO 2 + 2 H 2 O 8 HI + H 2 SO 4 = 4 I 2 + H 2 S + 4 H 2 O 2 HI + Br 2 = 2 HBr + I 2
НЕОРГАНИЧЕСКАЯ ХИМИЯ Галогены не взаимодействуют с кислотами. Только I 2 при взаимодействии с концентрированной азотной кислотой образует иодноватую кислоту HIO 3: I 2 + 10 HNO 3 (конц. ) = 2 HIO 3 + 10 NO 2 + 4 H O 2 Галогеноводороды Восстановительные свойства (кроме HF): 6 HCl + 2 HNO 3 (конц. ) = 3 Cl 2 + 2 NO + 4 H O 2 4 HI + Mn. O 2 = I 2 + Mn. I 2 + 2 H 2 O 2 HBr + H 2 SO 4 = Br 2 + SO 2 + 2 H 2 O 8 HI + H 2 SO 4 = 4 I 2 + H 2 S + 4 H 2 O 2 HI + Br 2 = 2 HBr + I 2
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Сера Особым свойством серы является взаимодействие ее с сульфитами и образование тиосульфатов, солей несуществующей в свободном состоянии тиосерной кислоты H 2 S 2 O 3: Na 2 SO 3 + S = Na 2 S 2 O 3 При действии на тиосульфаты кислот происходит их разложение с образованием серы и сернистого газа: Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 + S + H 2 O
НЕОРГАНИЧЕСКАЯ ХИМИЯ Сера Особым свойством серы является взаимодействие ее с сульфитами и образование тиосульфатов, солей несуществующей в свободном состоянии тиосерной кислоты H 2 S 2 O 3: Na 2 SO 3 + S = Na 2 S 2 O 3 При действии на тиосульфаты кислот происходит их разложение с образованием серы и сернистого газа: Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 + S + H 2 O
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Сера Оксид серы (IV) может быть доокислен кислородом: 2 SO 2 + O 2 = 2 SO 3 2 SO 2 + 2 H 2 O = 2 H 2 SO 4 и выступать в роли окислителя: SO 2 + 2 H 2 S = 3 S + 2 H 2 O и в роли восстановителя: SO 2 + Pb. O 2 = Pb. SO 4 SO 2 + Br 2 + 2 H 2 O = H 2 SO 4+ 2 НBr SO 2 + NO 2 + H 2 O = H 2 SO 4+ NO 3 SO 2 + 2 КМn. О 4 + 2 H 2 O = 2 H 2 SO 4+ 2 Mn. O 2+ K 2 SО 4 окислительные свойства оксида серы (VI): 5 SO 3 + 2 P = 5 SO 2+ P 2 O 5
НЕОРГАНИЧЕСКАЯ ХИМИЯ Сера Оксид серы (IV) может быть доокислен кислородом: 2 SO 2 + O 2 = 2 SO 3 2 SO 2 + 2 H 2 O = 2 H 2 SO 4 и выступать в роли окислителя: SO 2 + 2 H 2 S = 3 S + 2 H 2 O и в роли восстановителя: SO 2 + Pb. O 2 = Pb. SO 4 SO 2 + Br 2 + 2 H 2 O = H 2 SO 4+ 2 НBr SO 2 + NO 2 + H 2 O = H 2 SO 4+ NO 3 SO 2 + 2 КМn. О 4 + 2 H 2 O = 2 H 2 SO 4+ 2 Mn. O 2+ K 2 SО 4 окислительные свойства оксида серы (VI): 5 SO 3 + 2 P = 5 SO 2+ P 2 O 5
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Фосфор получение фосфора: Са 3(Р 04)2 + 5 С + 3 Si. O 2 = 3 Ca. Si. O 3 + 5 СО + 2 Р взаимодействие с азотной кислотой: 3 P + 5 HNO 3 + 2 H 2 O = 3 H 3 PO 4 + 5 NO со щелочами: 4 P + 3 Na. OH + 3 H 2 O = 3 Na. H 2 PO 2 + PH 3 с солями – окислителями: 6 P + 5 KCl. O 3 = 3 P 2 O 5 + 5 KCl (со взрывом).
НЕОРГАНИЧЕСКАЯ ХИМИЯ Фосфор получение фосфора: Са 3(Р 04)2 + 5 С + 3 Si. O 2 = 3 Ca. Si. O 3 + 5 СО + 2 Р взаимодействие с азотной кислотой: 3 P + 5 HNO 3 + 2 H 2 O = 3 H 3 PO 4 + 5 NO со щелочами: 4 P + 3 Na. OH + 3 H 2 O = 3 Na. H 2 PO 2 + PH 3 с солями – окислителями: 6 P + 5 KCl. O 3 = 3 P 2 O 5 + 5 KCl (со взрывом).
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. При взаимодействии железа с галогенами образуются галогениды состава Fe. F 3, Fe. Cl 3, Fe. Br 3, но в реакции с иодом Fe. I 2 Fe + I 2 = Fe. I 2 Железо пассивируется концентрированными серной и азотной кислотами, но при нагревании реагирует с ними: 2 Fe + 6 H 2 SO 4(конц. ) = Fe 2(SO 4)3 + 3 SO 2+ 6 H 2 O Fe + 6 HNO 3(конц. ) = Fe(NO 3)3 + 3 NO 2+ 3 H 2 O Железо взаимодействует со щелочными расплавами окислителей: Fe + 3 KNO 3 + 2 KOH = K 2 Fe. O 4 + 3 KNO 2+ H 2 O
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. При взаимодействии железа с галогенами образуются галогениды состава Fe. F 3, Fe. Cl 3, Fe. Br 3, но в реакции с иодом Fe. I 2 Fe + I 2 = Fe. I 2 Железо пассивируется концентрированными серной и азотной кислотами, но при нагревании реагирует с ними: 2 Fe + 6 H 2 SO 4(конц. ) = Fe 2(SO 4)3 + 3 SO 2+ 6 H 2 O Fe + 6 HNO 3(конц. ) = Fe(NO 3)3 + 3 NO 2+ 3 H 2 O Железо взаимодействует со щелочными расплавами окислителей: Fe + 3 KNO 3 + 2 KOH = K 2 Fe. O 4 + 3 KNO 2+ H 2 O
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. Оксид железа (II) Fe. O обладает основными и восстановительными свойствами. Fe. O + 2 HI = Fe. I 2 +H 2 O Fe. O + 4 HNO 3(конц. ) = Fe(NO 3)3 + NO 2+ 2 H 2 O Оксид железа (III) обладает слабоамфотерными свойствами: Fe 2 O 3 + 6 HNO 3 = 2 Fe(NO 3)3+ 3 H 2 O С растворами щелочей он не взаимодействует. При сплавлении со щелочами и карбонатами щелочных металлов образуются ферриты: Fe 2 O 3 + 2 Na. OH = 2 Na. Fe. O 2+ H 2 O Fe 2 O 3 + Na 2 CO 3 = 2 Na. Fe. O 2+ CO 2 Для него характерны также окислительные свойства: Fe 2 O 3 + 6 HI = 2 Fe. I 2+3 H 2 O (реакция обмена невозможна, так как Fe+3 – окислитель, I 1 – восстановитель; по той же причине Fe. I 3 – не существует).
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. Оксид железа (II) Fe. O обладает основными и восстановительными свойствами. Fe. O + 2 HI = Fe. I 2 +H 2 O Fe. O + 4 HNO 3(конц. ) = Fe(NO 3)3 + NO 2+ 2 H 2 O Оксид железа (III) обладает слабоамфотерными свойствами: Fe 2 O 3 + 6 HNO 3 = 2 Fe(NO 3)3+ 3 H 2 O С растворами щелочей он не взаимодействует. При сплавлении со щелочами и карбонатами щелочных металлов образуются ферриты: Fe 2 O 3 + 2 Na. OH = 2 Na. Fe. O 2+ H 2 O Fe 2 O 3 + Na 2 CO 3 = 2 Na. Fe. O 2+ CO 2 Для него характерны также окислительные свойства: Fe 2 O 3 + 6 HI = 2 Fe. I 2+3 H 2 O (реакция обмена невозможна, так как Fe+3 – окислитель, I 1 – восстановитель; по той же причине Fe. I 3 – не существует).
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. Гидроксид железа (II) Fe(OH)2 проявляет основные и восстановительные свойства: Fe(OH)2 + 2 HCl = Fe. Cl 2 + 2 H 2 O 2 Fe(OH)2 + H 2 O 2 = 2 Fe(OH)3 4 Fe(OH)2 + O 2 = 4 Fe. O(OH)+ 2 H 2 O Fe(OH)2 + 2 Br 2 + 6 Na. OH = Na 2 Fe. O 4+ 4 Na. Br+ 4 H 2 O В материалах ЕГЭ встречается такая запись состава гидроксида железа(III): Fe. O(OH) – метагидроксид железа (III). Он проявляет слабоамфотерные и окислительные свойства: 2 Fe. O(OH) + 3 H 2 SO 4= Fe 2(SO 4)3 + 4 H 2 O Fe. O(OH) + 3 Na. OH(конц. )+H 2 O= Na 3[Fe(OH)6] + 4 H 2 O 2 Fe. O(OH) + 6 HI= 2 Fe. I 2 + 4 H 2 O + I 2
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. Гидроксид железа (II) Fe(OH)2 проявляет основные и восстановительные свойства: Fe(OH)2 + 2 HCl = Fe. Cl 2 + 2 H 2 O 2 Fe(OH)2 + H 2 O 2 = 2 Fe(OH)3 4 Fe(OH)2 + O 2 = 4 Fe. O(OH)+ 2 H 2 O Fe(OH)2 + 2 Br 2 + 6 Na. OH = Na 2 Fe. O 4+ 4 Na. Br+ 4 H 2 O В материалах ЕГЭ встречается такая запись состава гидроксида железа(III): Fe. O(OH) – метагидроксид железа (III). Он проявляет слабоамфотерные и окислительные свойства: 2 Fe. O(OH) + 3 H 2 SO 4= Fe 2(SO 4)3 + 4 H 2 O Fe. O(OH) + 3 Na. OH(конц. )+H 2 O= Na 3[Fe(OH)6] + 4 H 2 O 2 Fe. O(OH) + 6 HI= 2 Fe. I 2 + 4 H 2 O + I 2
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. Соли Fe 3+ сильно гидролизуются, поэтому активные металлы растворяются в них с выделением водорода: Fe. Cl 3 + 2 H 2 O + Zn = Fe(OH)2 Cl + Zn. Cl 2+ H 2 Соли Fe 3+ окислители, соли Fe 2+ восстановители: 2 Fe. Cl 3 + Fe = 3 Fe. Cl 2 3 Fe. Cl 3 + Cu = 2 Fe. Cl 2 + Cu. Cl 2 2 Fe. Cl 2 + Cl 2 = 2 Fe. Cl 3 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 Ферраты – сильные окислители: 2 Na 2 Fe. O 4+ 16 HCl = 3 Cl 2 + 4 Na. Cl+ 2 Fe. Cl 3 + 8 H 2 O Обратим внимание на реакции соединений железа, где в окислительно восстановительном процессе участвуют три элемента: Fe. S 2 + 8 HNO 3 = Fe(NO 3)3 + 5 NO+2 H 2 SO 4+2 H 2 O
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Железо. Соли Fe 3+ сильно гидролизуются, поэтому активные металлы растворяются в них с выделением водорода: Fe. Cl 3 + 2 H 2 O + Zn = Fe(OH)2 Cl + Zn. Cl 2+ H 2 Соли Fe 3+ окислители, соли Fe 2+ восстановители: 2 Fe. Cl 3 + Fe = 3 Fe. Cl 2 3 Fe. Cl 3 + Cu = 2 Fe. Cl 2 + Cu. Cl 2 2 Fe. Cl 2 + Cl 2 = 2 Fe. Cl 3 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 Ферраты – сильные окислители: 2 Na 2 Fe. O 4+ 16 HCl = 3 Cl 2 + 4 Na. Cl+ 2 Fe. Cl 3 + 8 H 2 O Обратим внимание на реакции соединений железа, где в окислительно восстановительном процессе участвуют три элемента: Fe. S 2 + 8 HNO 3 = Fe(NO 3)3 + 5 NO+2 H 2 SO 4+2 H 2 O
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Хром. Оксид хрома (II) Cr. O черного цвета, соответствующий гидроксид Cr(OH)2 – желтого. Оксид хрома (III) Cr 2 O 3 в виде порошка темно-зеленого цвета, в кристаллическом состоянии он черный с металлическим блеском. Гидроксид хрома (III) Cr(OH)3 – серо-зеленый. Оба соединения амфотерны. Реагируя с избытком щелочи, гидроксид хрома (III) образует изумруднозеленое соединение состава Na 3 Cr(OH)6. Оксид хрома (VI) Cr. O 3 – это кислотный оксид темно-красного цвета. При его растворении в воде образуются две кислоты: хромовая H 2 Cr. O 4 и дихромовая H 2 Cr 2 O 7. Это сильные кислоты, дихромовая существует только в растворе. Соли хромовой кислоты – хроматы (K 2 Cr. O 4, Na 2 Cr. O 4 – желтого цвета, соли дихромовой кислоты – дихроматы (K 2 Cr 2 O 7, Na 2 Cr 2 O 7 – оранжевого цвета.
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Хром. Оксид хрома (II) Cr. O черного цвета, соответствующий гидроксид Cr(OH)2 – желтого. Оксид хрома (III) Cr 2 O 3 в виде порошка темно-зеленого цвета, в кристаллическом состоянии он черный с металлическим блеском. Гидроксид хрома (III) Cr(OH)3 – серо-зеленый. Оба соединения амфотерны. Реагируя с избытком щелочи, гидроксид хрома (III) образует изумруднозеленое соединение состава Na 3 Cr(OH)6. Оксид хрома (VI) Cr. O 3 – это кислотный оксид темно-красного цвета. При его растворении в воде образуются две кислоты: хромовая H 2 Cr. O 4 и дихромовая H 2 Cr 2 O 7. Это сильные кислоты, дихромовая существует только в растворе. Соли хромовой кислоты – хроматы (K 2 Cr. O 4, Na 2 Cr. O 4 – желтого цвета, соли дихромовой кислоты – дихроматы (K 2 Cr 2 O 7, Na 2 Cr 2 O 7 – оранжевого цвета.
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Хроматы устойчивы в щелочной среде, а дихроматы – в кислотной. Na 2 Cr 2 O 7 +2 KOH = Na 2 Cr. O 4 + K 2 Cr. O 4+ H 2 O 2 K 2 Cr. O 4 +H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4+ H 2 O При действии на дихроматы концентрированной серной кислотой образуется оксид хрома (VI): K 2 Cr 2 O 7 +2 H 2 SO 4 = 2 Cr. O 3 +2 KHSO 4+ H 2 O Оксид хрома (VI) и дихроматы – сильнейшие окислители. Хроматы – окислители более слабые, чем дихроматы: 2 K 2 Cr. O 4 +2 H 2 O+3 H 2 S= 2 Cr(OH)3 + 3 S+ 4 KOH K 2 Cr 2 O 7 +H 2 O+3 H 2 S= 2 Cr(OH)3 + 3 S+ 2 KOH
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Хроматы устойчивы в щелочной среде, а дихроматы – в кислотной. Na 2 Cr 2 O 7 +2 KOH = Na 2 Cr. O 4 + K 2 Cr. O 4+ H 2 O 2 K 2 Cr. O 4 +H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4+ H 2 O При действии на дихроматы концентрированной серной кислотой образуется оксид хрома (VI): K 2 Cr 2 O 7 +2 H 2 SO 4 = 2 Cr. O 3 +2 KHSO 4+ H 2 O Оксид хрома (VI) и дихроматы – сильнейшие окислители. Хроматы – окислители более слабые, чем дихроматы: 2 K 2 Cr. O 4 +2 H 2 O+3 H 2 S= 2 Cr(OH)3 + 3 S+ 4 KOH K 2 Cr 2 O 7 +H 2 O+3 H 2 S= 2 Cr(OH)3 + 3 S+ 2 KOH
 НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Хром. Окислительные свойства соединений хрома(VI) наиболее сильно выражены в кислотной среде, а восстановительные свойства соединений хрома (III) - в щелочной: K 2 Cr 2 O 7 +H 2 SO 4+ 3 SO 2 = Cr 2(SO 4)3 +K 2 SO 4+ H 2 O Cr 2(SO 4)3 +3 H 2 O 2+ 10 Na. OH = 2 Na 2 Cr. O 4+3 Na 2 SO 4+ 8 H 2 O
НЕОРГАНИЧЕСКАЯ ХИМИЯ Металлы побочных подгрупп. Хром. Окислительные свойства соединений хрома(VI) наиболее сильно выражены в кислотной среде, а восстановительные свойства соединений хрома (III) - в щелочной: K 2 Cr 2 O 7 +H 2 SO 4+ 3 SO 2 = Cr 2(SO 4)3 +K 2 SO 4+ H 2 O Cr 2(SO 4)3 +3 H 2 O 2+ 10 Na. OH = 2 Na 2 Cr. O 4+3 Na 2 SO 4+ 8 H 2 O


