Свойства неметаллов.pptx
- Количество слайдов: 89
 Свойства неметаллов
Свойства неметаллов
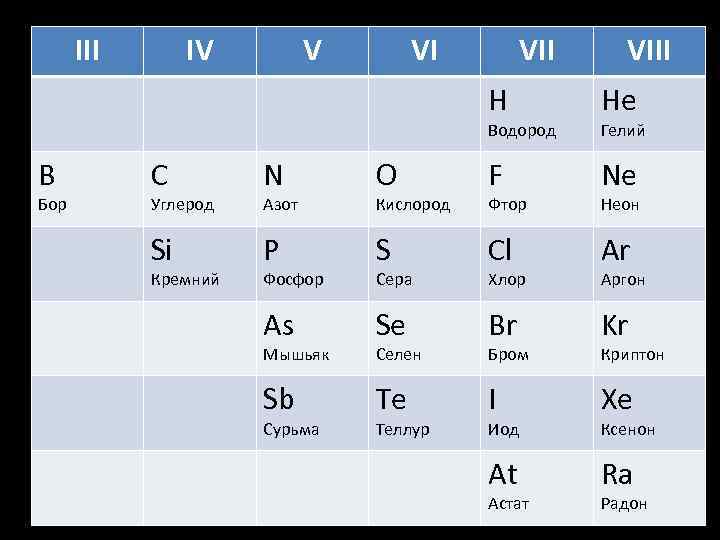 III IV V VI VIII H He Водород B Бор Гелий C N O F Ne Si P S Cl Ar As Se Br Kr Sb Te I Xe At Ra Углерод Кремний Азот Фосфор Мышьяк Сурьма Кислород Сера Селен Теллур Фтор Хлор Бром Иод Астат Неон Аргон Криптон Ксенон Радон
III IV V VI VIII H He Водород B Бор Гелий C N O F Ne Si P S Cl Ar As Se Br Kr Sb Te I Xe At Ra Углерод Кремний Азот Фосфор Мышьяк Сурьма Кислород Сера Селен Теллур Фтор Хлор Бром Иод Астат Неон Аргон Криптон Ксенон Радон
 Элементы VII A группы Галогены
Элементы VII A группы Галогены
 Строение атомов галогенов Электронная формула валентного уровня ns 2 np 5
Строение атомов галогенов Электронная формула валентного уровня ns 2 np 5
 Свойства простых веществ Молекулы галогенов двухатомны: F 2 F-F F: F Cl 2 Cl-Cl Br 2 I 2 Кратность связи = 1
Свойства простых веществ Молекулы галогенов двухатомны: F 2 F-F F: F Cl 2 Cl-Cl Br 2 I 2 Кратность связи = 1
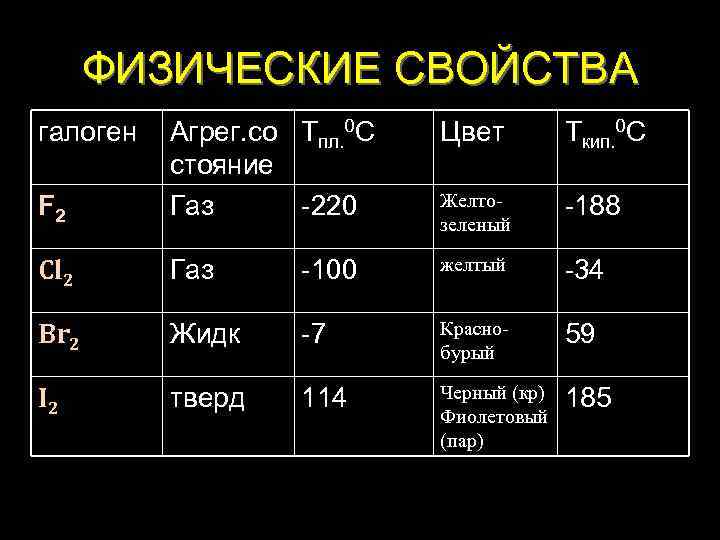 ФИЗИЧЕСКИЕ СВОЙСТВА галоген Цвет Ткип. 0 С F 2 Агрег. со Тпл. 0 С стояние Газ -220 Желтозеленый -188 Cl 2 Газ -100 желтый -34 Br 2 Жидк -7 Краснобурый 59 I 2 тверд 114 Черный (кр) Фиолетовый (пар) 185
ФИЗИЧЕСКИЕ СВОЙСТВА галоген Цвет Ткип. 0 С F 2 Агрег. со Тпл. 0 С стояние Газ -220 Желтозеленый -188 Cl 2 Газ -100 желтый -34 Br 2 Жидк -7 Краснобурый 59 I 2 тверд 114 Черный (кр) Фиолетовый (пар) 185
 Хлор в газообразном и твердом состоянии
Хлор в газообразном и твердом состоянии
 Бром жидкий, газообразный и твердый
Бром жидкий, газообразный и твердый
 Иод твердый и пары
Иод твердый и пары
 Астат
Астат
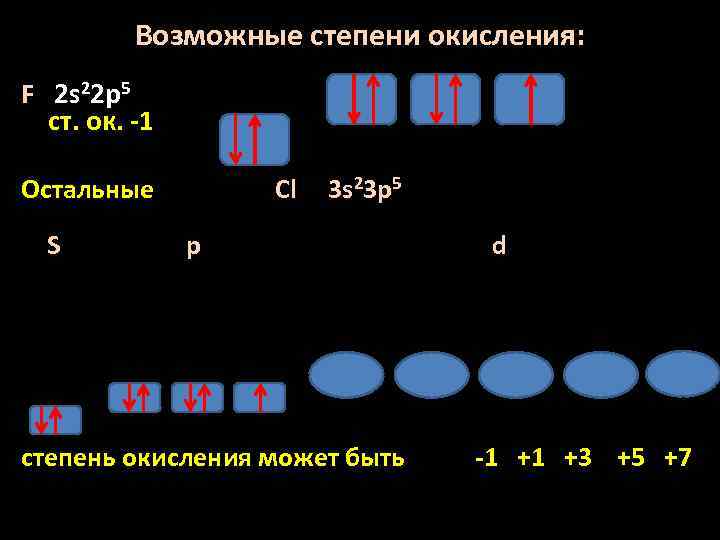 Возможные степени окисления: F 2 s 22 p 5 ст. ок. -1 Остальные S Cl 3 s 23 p 5 p степень окисления может быть d -1 +1 +3 +5 +7
Возможные степени окисления: F 2 s 22 p 5 ст. ок. -1 Остальные S Cl 3 s 23 p 5 p степень окисления может быть d -1 +1 +3 +5 +7
 Химические свойства простых веществ
Химические свойства простых веществ
 Фтор взаимодействует со всеми элементами, даже с инертными газами (с Xe, Kr, Rn). В фторе горят S, P, Si: H 2+F 2 = 2 HF (взрыв) S+3 F 2 SF 6 2 Р+5 F 2 2 PF 5
Фтор взаимодействует со всеми элементами, даже с инертными газами (с Xe, Kr, Rn). В фторе горят S, P, Si: H 2+F 2 = 2 HF (взрыв) S+3 F 2 SF 6 2 Р+5 F 2 2 PF 5
 Металлы окисляются фтором до высшей степени окисления: 2 Na + F 2 = 2 Na. F (взрыв) Ni + F 2 = Ni. F 2 (прочная пленка) 2 Au + 3 F 2 = 2 Au. F 3 (при нагревании)
Металлы окисляются фтором до высшей степени окисления: 2 Na + F 2 = 2 Na. F (взрыв) Ni + F 2 = Ni. F 2 (прочная пленка) 2 Au + 3 F 2 = 2 Au. F 3 (при нагревании)
 Взаимодействует с оксидом кремния (песком, стеклом, кварцем) Si. O 2 + 2 F 2 = Si. F 4 + O 2 Взаимодействуя с кислородом, образует фторид кислорода 2 F 2 + O 2 = 2 OF 2 Взаимодействует с инертными газами (кроме He и Ne) Хе+ 2 F 2 = Xe. F 4
Взаимодействует с оксидом кремния (песком, стеклом, кварцем) Si. O 2 + 2 F 2 = Si. F 4 + O 2 Взаимодействуя с кислородом, образует фторид кислорода 2 F 2 + O 2 = 2 OF 2 Взаимодействует с инертными газами (кроме He и Ne) Хе+ 2 F 2 = Xe. F 4
 От водородных соединений других элементов фтор отнимает водород. Большинство оксидов разлагается им с вытеснением кислорода. Фтор разлагает воду при любой температуре
От водородных соединений других элементов фтор отнимает водород. Большинство оксидов разлагается им с вытеснением кислорода. Фтор разлагает воду при любой температуре
 Хлор менее химически активен чем фтор, но и его окислительная активность чрезвычайно велика, он соединяется почти со всеми металлами (иногда лишь в присутствии следов воды или при нагревании) и со всеми неметаллами, кроме С, N 2 и O 2. 2 Fe+3 Cl 2 = 2 Fe. Cl 3 2 K+Cl 2 = 2 KCl
Хлор менее химически активен чем фтор, но и его окислительная активность чрезвычайно велика, он соединяется почти со всеми металлами (иногда лишь в присутствии следов воды или при нагревании) и со всеми неметаллами, кроме С, N 2 и O 2. 2 Fe+3 Cl 2 = 2 Fe. Cl 3 2 K+Cl 2 = 2 KCl
 При полном отсутствии влаги хлор не действует на железо. Это и позволяет хранить его в стальных баллонах. Многие органические вещества сгорают в хлоре:
При полном отсутствии влаги хлор не действует на железо. Это и позволяет хранить его в стальных баллонах. Многие органические вещества сгорают в хлоре:
 Хлор растворяется в воде, растворяясь в воде частично реагирует с водой: На холоду Cl 2 + H 2 O =HCl + HCl. O При об. у. 3 Cl 2 + 3 H 2 O =5 HCl + HCl. O 3 Взаимодействует с щелочами: Сl 2 + 2 КОН = КСl. О+ КСl + Н 2 О
Хлор растворяется в воде, растворяясь в воде частично реагирует с водой: На холоду Cl 2 + H 2 O =HCl + HCl. O При об. у. 3 Cl 2 + 3 H 2 O =5 HCl + HCl. O 3 Взаимодействует с щелочами: Сl 2 + 2 КОН = КСl. О+ КСl + Н 2 О
 Жидкий бром часто реагирует с металлами и неметаллами активнее, чем хлор. Br 2+ S + 4 H 2 O = 6 HBr + H 2 SO 4 2 Al + 3 Br 2 = 2 Al. Br 3 C водой бром взаимодействует незначительно, хотя в ней растворяется (раствор брома в воде называется бромная вода). Реагирует со щелочами: 3 Br 2 + 6 Na. OH = 5 Na. Br + Na. Br. O 3 +3 H 2 О
Жидкий бром часто реагирует с металлами и неметаллами активнее, чем хлор. Br 2+ S + 4 H 2 O = 6 HBr + H 2 SO 4 2 Al + 3 Br 2 = 2 Al. Br 3 C водой бром взаимодействует незначительно, хотя в ней растворяется (раствор брома в воде называется бромная вода). Реагирует со щелочами: 3 Br 2 + 6 Na. OH = 5 Na. Br + Na. Br. O 3 +3 H 2 О
 Иод в воде растворим мало, с ней не реагирует, хорошо растворяется в спирте. Окислительные свойства его выражены слабее, чем для остальных галогенов.
Иод в воде растворим мало, с ней не реагирует, хорошо растворяется в спирте. Окислительные свойства его выражены слабее, чем для остальных галогенов.
 Химические свойства соединений галогенов
Химические свойства соединений галогенов
 ГАЛОГЕНОВОДОРОДЫ HF фтороводород HCl хлороводород HBr бромоводород HI иодоводород • Газы, с резким удушающим запахом, бесцветные, хорошо растворимые в воде.
ГАЛОГЕНОВОДОРОДЫ HF фтороводород HCl хлороводород HBr бромоводород HI иодоводород • Газы, с резким удушающим запахом, бесцветные, хорошо растворимые в воде.
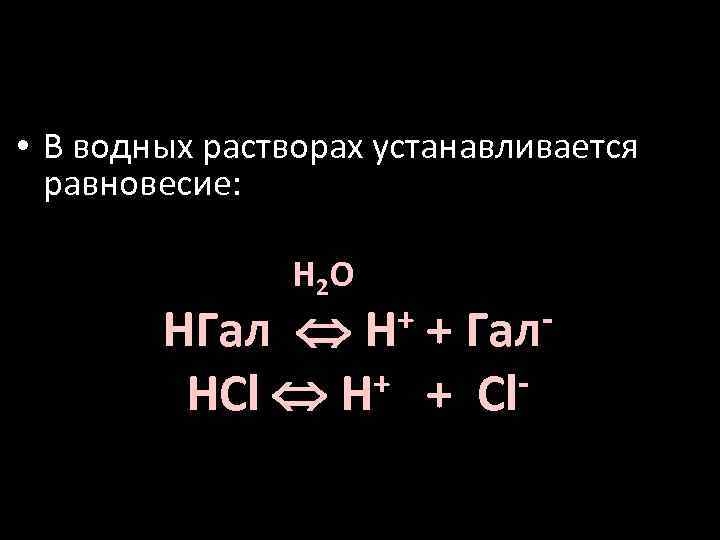 • В водных растворах устанавливается равновесие: H 2 O + + Гал H HГал + + Cl. HCl H
• В водных растворах устанавливается равновесие: H 2 O + + Гал H HГал + + Cl. HCl H
 Растворы галогеноводородов – кислоты. HF фтороводородная кислота (плавиковая) HCl хлороводородная ( соляная) кислота HBr бромоводородная кислота HI иодородная кислота Сила кислот в ряду HF-HCl-HBr-HI растет Соляная, бромоводородная и иодоводородная кислоты – сильные.
Растворы галогеноводородов – кислоты. HF фтороводородная кислота (плавиковая) HCl хлороводородная ( соляная) кислота HBr бромоводородная кислота HI иодородная кислота Сила кислот в ряду HF-HCl-HBr-HI растет Соляная, бромоводородная и иодоводородная кислоты – сильные.
 Особенностью фтороводорода и плавиковой кислоты является способность взаимодействовать с материалами, содержащими оксид кремния (IV) — Si. O 2 + 4 НF = Si. F 4 + 2 Н 2 O Поэтому фтороводород нельзя получать и сохранять в стеклянных сосудах
Особенностью фтороводорода и плавиковой кислоты является способность взаимодействовать с материалами, содержащими оксид кремния (IV) — Si. O 2 + 4 НF = Si. F 4 + 2 Н 2 O Поэтому фтороводород нельзя получать и сохранять в стеклянных сосудах
 Галогенводородные кислоты проявляют все свойства, характерные для кислот – взаимодействуют: 1. с металлами 2. 3. 4. Fe +HCl = Fe. Cl 2 + H 2 основными оксидами Ca. O + 2 HBr = Ca. Br 2 + H 2 O основаниями Mg(OH)2 + 2 HCl = Mg. Cl 2 + 2 H 2 O солями слабых кислот Ca. CO 3 + HI = Ca. I 2 + H 2 O + CO 2
Галогенводородные кислоты проявляют все свойства, характерные для кислот – взаимодействуют: 1. с металлами 2. 3. 4. Fe +HCl = Fe. Cl 2 + H 2 основными оксидами Ca. O + 2 HBr = Ca. Br 2 + H 2 O основаниями Mg(OH)2 + 2 HCl = Mg. Cl 2 + 2 H 2 O солями слабых кислот Ca. CO 3 + HI = Ca. I 2 + H 2 O + CO 2
 Кислородсодержащие соединения галогенов
Кислородсодержащие соединения галогенов
 Cl 2 O оксид хлора (I) - газ желто-бурый (tкип=+2, 2 о. С), жидкий взрывается. при об. у. Cl 2 O Сl 2 + Cl. O 2 При взаимодействии с водой образует кислоту Cl 2 O + H 2 O = 2 HCl. O (хлорноватистая кислота)
Cl 2 O оксид хлора (I) - газ желто-бурый (tкип=+2, 2 о. С), жидкий взрывается. при об. у. Cl 2 O Сl 2 + Cl. O 2 При взаимодействии с водой образует кислоту Cl 2 O + H 2 O = 2 HCl. O (хлорноватистая кислота)
 Cоли хлорноватистой кислоты – гипохлориты При взаимодействии хлора с Са(ОН)2 “гашёной известью” образуется гипохлорит-хлорид кальция – «хлорная известь» : Сl 2 + Са(ОН)2 = Сl Са ОCl + H 2 O Сильный окислитель – отбеливающее и дезинфицирующее действие.
Cоли хлорноватистой кислоты – гипохлориты При взаимодействии хлора с Са(ОН)2 “гашёной известью” образуется гипохлорит-хлорид кальция – «хлорная известь» : Сl 2 + Са(ОН)2 = Сl Са ОCl + H 2 O Сильный окислитель – отбеливающее и дезинфицирующее действие.
 HBr. O – бромоватистая HIO –иодоватистая
HBr. O – бромоватистая HIO –иодоватистая
 Соединения со Ст. ок. +3 (Сl 2 O 3) неизвестен HCl. O 2 – хлористая кислота Даже в водном растворе разлагается 4 HCl. O 2=2 Сl. O 2 +HCl. O 3+HCl+H 2 O Соли – хлориты. С органическими веществами взрываются Na. Cl. O 2 =Na. Cl+Na. Cl. O 3 Na. Cl. O 2 =Na. Cl+O 2
Соединения со Ст. ок. +3 (Сl 2 O 3) неизвестен HCl. O 2 – хлористая кислота Даже в водном растворе разлагается 4 HCl. O 2=2 Сl. O 2 +HCl. O 3+HCl+H 2 O Соли – хлориты. С органическими веществами взрываются Na. Cl. O 2 =Na. Cl+Na. Cl. O 3 Na. Cl. O 2 =Na. Cl+O 2
 Соединения Cl (+5) (Сl 2 O 5) неизвестен HCl. O 3 – хлорноватая кислота. Конц. растворы. Сильная Соли – хлораты KCl. O 3 (бертолетовая соль) При нагревании разлагаются : 4 KCl. O 3 =KCl+3 KCl. O 4 2 KCl. O 3=2 KCl+3 O 2 Спички 5 KCl. O 3+6 P = 5 KCl+3 P 2 O 5 DH = -3653, 8 к. Дж/моль
Соединения Cl (+5) (Сl 2 O 5) неизвестен HCl. O 3 – хлорноватая кислота. Конц. растворы. Сильная Соли – хлораты KCl. O 3 (бертолетовая соль) При нагревании разлагаются : 4 KCl. O 3 =KCl+3 KCl. O 4 2 KCl. O 3=2 KCl+3 O 2 Спички 5 KCl. O 3+6 P = 5 KCl+3 P 2 O 5 DH = -3653, 8 к. Дж/моль
 Соединения Сl (+7) Cl 2 O 7 б/ц жидкость неустойчив 2 Cl 2 O 7 = 2 Cl 2 +7 O 2 ( со взрывом при 1200 С) HCl. O 4 –хлорная кислота. Очень сильная При хранении конц. краснеет, взрыв. Соли – перхлораты. Na. Cl. O 4 Fe(Cl. O 4)3 Перхлораты тяжелых металлов взрываются, щелочных - устойчивы
Соединения Сl (+7) Cl 2 O 7 б/ц жидкость неустойчив 2 Cl 2 O 7 = 2 Cl 2 +7 O 2 ( со взрывом при 1200 С) HCl. O 4 –хлорная кислота. Очень сильная При хранении конц. краснеет, взрыв. Соли – перхлораты. Na. Cl. O 4 Fe(Cl. O 4)3 Перхлораты тяжелых металлов взрываются, щелочных - устойчивы
 Элементы VI A группы ХАЛЬКОГЕНЫ (Образующие руды)
Элементы VI A группы ХАЛЬКОГЕНЫ (Образующие руды)
 O S Se Te Po Кислород - (лат Oxygenium, от греч. Oxys кислый и gennao рождаю). Сера Селен (селена – Луна) Теллур (Земля) Полоний (Польша)
O S Se Te Po Кислород - (лат Oxygenium, от греч. Oxys кислый и gennao рождаю). Сера Селен (селена – Луна) Теллур (Земля) Полоний (Польша)
 Возможные валентности и степени окисления Кислород 1 s 22 p 4 P s Валентность = 2. Ст. ок. = +2 (со фтором); -2 (с остальными элементами); -1 ( в пероксидах -O-O - )
Возможные валентности и степени окисления Кислород 1 s 22 p 4 P s Валентность = 2. Ст. ок. = +2 (со фтором); -2 (с остальными элементами); -1 ( в пероксидах -O-O - )
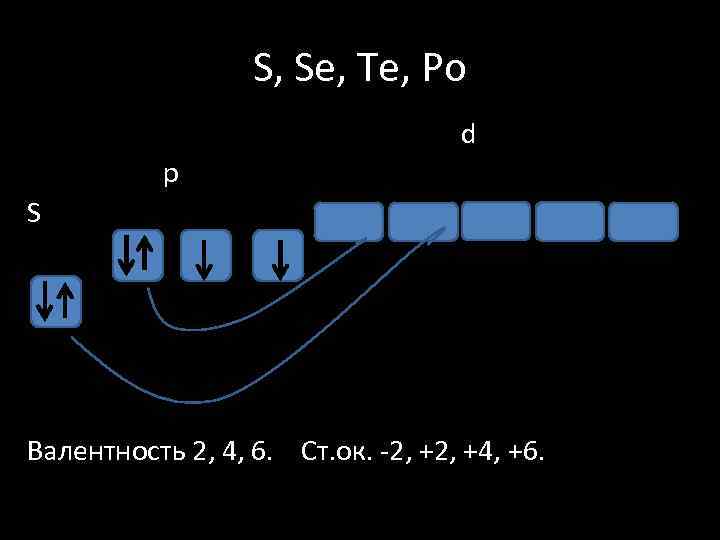 S, Se, Te, Po d p S Валентность 2, 4, 6. Ст. ок. -2, +4, +6.
S, Se, Te, Po d p S Валентность 2, 4, 6. Ст. ок. -2, +4, +6.
 Простое вещество Две модификации О 2 – кислород О=О газ, бц. бз, в 100 об Н 2 О растворяется 3 об О 2 Tкип= -183 0 С. Тплавл. = -2190 С О 3 – озон газ, синего цвета, запах, ПДК 10 -5%, растворимость больше.
Простое вещество Две модификации О 2 – кислород О=О газ, бц. бз, в 100 об Н 2 О растворяется 3 об О 2 Tкип= -183 0 С. Тплавл. = -2190 С О 3 – озон газ, синего цвета, запах, ПДК 10 -5%, растворимость больше.
 Получение кислорода В природе: В промышленности Из воздуха или электролиз воды
Получение кислорода В природе: В промышленности Из воздуха или электролиз воды
 •
•
 Химические свойства Кислород является одним из самых активных химических элементов, по активности уступает только фтору. С большинством простых веществ взаимодействует непосредственно (кроме галогенов, инертных газов, платины и золота).
Химические свойства Кислород является одним из самых активных химических элементов, по активности уступает только фтору. С большинством простых веществ взаимодействует непосредственно (кроме галогенов, инертных газов, платины и золота).
 При обычных условиях кислород взаимодействует с белым фосфором, барием, рубидием и цезием, воспламеняясь. 4 P + 5 O 2→ 2 P 2 O 5 (оксид фосфора V) Cs+ O 2→Cs 2 O 2 (пероксид цезия)
При обычных условиях кислород взаимодействует с белым фосфором, барием, рубидием и цезием, воспламеняясь. 4 P + 5 O 2→ 2 P 2 O 5 (оксид фосфора V) Cs+ O 2→Cs 2 O 2 (пероксид цезия)
 Окисление магния начинается при температуре около 500 0 С и сопровождается выделением света: 2 Mg + O 2→ 2 Mg. O При нагревании идет окисление серы, селена, теллура, металлов. S + O 2 = SO 2
Окисление магния начинается при температуре около 500 0 С и сопровождается выделением света: 2 Mg + O 2→ 2 Mg. O При нагревании идет окисление серы, селена, теллура, металлов. S + O 2 = SO 2
 C азотом кислород реагирует только при температуре более 3000 0 С с образованием оксида азота (II): N 2 + O 2 → 2 NO Кислород энергично окисляет органические соединения.
C азотом кислород реагирует только при температуре более 3000 0 С с образованием оксида азота (II): N 2 + O 2 → 2 NO Кислород энергично окисляет органические соединения.
 ОЗОН Озон - реакционноспособное химическое вещество, химическая активность которого исключительно велика. Это его свойство обусловлено тем что трёхатомная молекула озона способна к лёгкому распаду и дополнительному выделению энергии.
ОЗОН Озон - реакционноспособное химическое вещество, химическая активность которого исключительно велика. Это его свойство обусловлено тем что трёхатомная молекула озона способна к лёгкому распаду и дополнительному выделению энергии.
 При комнатной температуре озон взаимодействует практически со всеми химическими элементами и их химическими соединениями. Под действием газообразного озона все металлы кроме Au, Pt, Ir превращаются в оксиды или покрываются тонкой оксидной плёнкой, Сульфиды, селениды, теллуриды окисляются до сульфатов, селенатов, теллурато.
При комнатной температуре озон взаимодействует практически со всеми химическими элементами и их химическими соединениями. Под действием газообразного озона все металлы кроме Au, Pt, Ir превращаются в оксиды или покрываются тонкой оксидной плёнкой, Сульфиды, селениды, теллуриды окисляются до сульфатов, селенатов, теллурато.
 Некоторые типы реакций с озоном: 2 Cu. Cl 2 + 2 HCl + O 3 → 2 Cu. Cl 3 + H 2 O + O 2 Озон повышает степень окисления оксидов: NO + O 3 → NO 2 + O 2 2 NO 2 + O 3 → N 2 O 5 + O 2 Озон реагирует с углеродом при нормальной температуре : C + 2 O 3 → CO 2 + 2 O 2
Некоторые типы реакций с озоном: 2 Cu. Cl 2 + 2 HCl + O 3 → 2 Cu. Cl 3 + H 2 O + O 2 Озон повышает степень окисления оксидов: NO + O 3 → NO 2 + O 2 2 NO 2 + O 3 → N 2 O 5 + O 2 Озон реагирует с углеродом при нормальной температуре : C + 2 O 3 → CO 2 + 2 O 2
 Соединения кислорода Оксиды: 1. Характеристические – оксиды. подчиняющиеся правилу формальной валентности (О-2) 2. Катионизбыточные – металлиды (Ti 3 O) 3. Анионизбыточные – пероксиды, озониды, супероксиды.
Соединения кислорода Оксиды: 1. Характеристические – оксиды. подчиняющиеся правилу формальной валентности (О-2) 2. Катионизбыточные – металлиды (Ti 3 O) 3. Анионизбыточные – пероксиды, озониды, супероксиды.
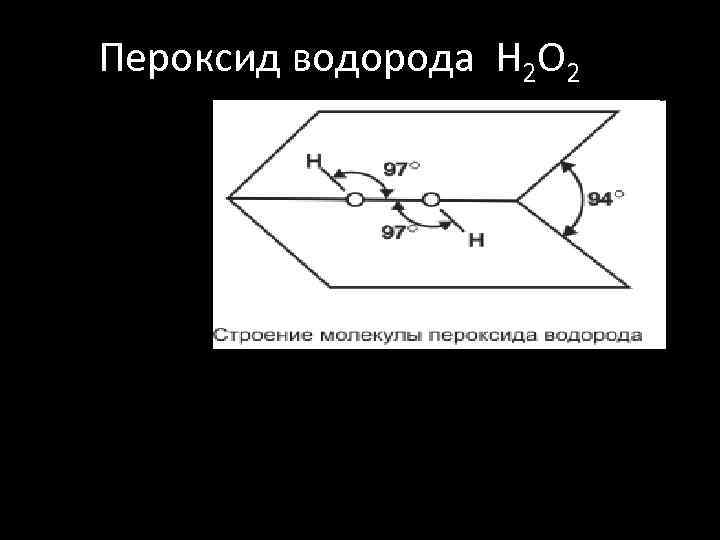 Пероксид водорода H 2 O 2
Пероксид водорода H 2 O 2
 Растворы Н 2 О 2, особенно концентрированные, сильные окислители. Так, при действии 65%-ного раствора Н 2 О 2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие красители.
Растворы Н 2 О 2, особенно концентрированные, сильные окислители. Так, при действии 65%-ного раствора Н 2 О 2 на бумагу, опилки и другие горючие вещества они воспламеняются. Менее концентрированные растворы обесцвечивают многие красители.
 Окислительное действие разбавленных растворов Н 2 О 2 больше всего проявляется в кислой среде, например, H 2 O 2 + H 2 C 2 O 4 = 2 H 2 O + 2 CO 2 но возможно окисление и в щелочной среде: 2 K 3[Cr(OH)6] + 3 H 2 O 2 = 2 KCr. O 4 + 2 KOH +8 H 2 O.
Окислительное действие разбавленных растворов Н 2 О 2 больше всего проявляется в кислой среде, например, H 2 O 2 + H 2 C 2 O 4 = 2 H 2 O + 2 CO 2 но возможно окисление и в щелочной среде: 2 K 3[Cr(OH)6] + 3 H 2 O 2 = 2 KCr. O 4 + 2 KOH +8 H 2 O.
 В присутствии сильных окислителей, а также веществ, легко отдающих кислород. Н 2 О 2 может выступать как восстановитель : 2 KMn. O 4+5 H 2 O 2+3 H 2 SO 4=K 2 SO 4+2 Mn. SO 4+5 O 2 + 8 H 2 O
В присутствии сильных окислителей, а также веществ, легко отдающих кислород. Н 2 О 2 может выступать как восстановитель : 2 KMn. O 4+5 H 2 O 2+3 H 2 SO 4=K 2 SO 4+2 Mn. SO 4+5 O 2 + 8 H 2 O
 При нагревании и на свету пероксид водорода разлагается. Реакция ускоряется при нагревании, на свету или в присутствии катализатора (Mn. O 2) H 2 O 2 = O 2+H 2 O Диспропорционирование
При нагревании и на свету пероксид водорода разлагается. Реакция ускоряется при нагревании, на свету или в присутствии катализатора (Mn. O 2) H 2 O 2 = O 2+H 2 O Диспропорционирование
 Свойства простого вещества - серы Активный неметалл. При нагревании окисляет металлы, водород: Ag + S = Ag 2 S (сульфид серебра) Cu + S = Cu. S (сульфид меди) Hg + S = Hg. S (сульфид ртути) (даже при -1900 C медленно) H 2+ S = H 2 S (сероводород) Кислородом и галогенами окисляется: S + O 2 =SO 2 (оксид серы IV) S + F 2 = SF 6 (Фторид серы VI)
Свойства простого вещества - серы Активный неметалл. При нагревании окисляет металлы, водород: Ag + S = Ag 2 S (сульфид серебра) Cu + S = Cu. S (сульфид меди) Hg + S = Hg. S (сульфид ртути) (даже при -1900 C медленно) H 2+ S = H 2 S (сероводород) Кислородом и галогенами окисляется: S + O 2 =SO 2 (оксид серы IV) S + F 2 = SF 6 (Фторид серы VI)
 •
•
 Свойства серы Активный неметалл. При нагревании окисляет металлы, водород: Ag + S = Ag 2 S (сульфид серебра) Cu + S = Cu. S (сульфид меди) Hg + S = Hg. S (сульфид ртути) (даже при -1900 C медленно) H 2+ S = H 2 S (сероводород) Кислородом и галогенами окисляется: S + O 2 =SO 2 (оксид серы IV) S + F 2 = SF 6 (Фторид серы VI)
Свойства серы Активный неметалл. При нагревании окисляет металлы, водород: Ag + S = Ag 2 S (сульфид серебра) Cu + S = Cu. S (сульфид меди) Hg + S = Hg. S (сульфид ртути) (даже при -1900 C медленно) H 2+ S = H 2 S (сероводород) Кислородом и галогенами окисляется: S + O 2 =SO 2 (оксид серы IV) S + F 2 = SF 6 (Фторид серы VI)
 •
•
 Соединения серы (-2) •
Соединения серы (-2) •
 В воде диссоциирует как слабая кислота K 1 = 6. 10 -6 H 2 S + (H 2 O) ↔ H+ + HS (гидросульфид-ион) HS- + (H 2 O) ↔ H+ + S 2 (сульфид-ион)
В воде диссоциирует как слабая кислота K 1 = 6. 10 -6 H 2 S + (H 2 O) ↔ H+ + HS (гидросульфид-ион) HS- + (H 2 O) ↔ H+ + S 2 (сульфид-ион)
 Сероводород - восстановитель Подожженный на воздухе сероводород сгорает: при избытке кислорода 2 H 2 S + 3 O 2 = 2 H 2 O + 2 SO 2 при недостатке кислорода 2 H 2 S + O 2 = 2 H 2 O + 2 S
Сероводород - восстановитель Подожженный на воздухе сероводород сгорает: при избытке кислорода 2 H 2 S + 3 O 2 = 2 H 2 O + 2 SO 2 при недостатке кислорода 2 H 2 S + O 2 = 2 H 2 O + 2 S
 Соли сероводородной кислоты - сульфиды Na 2 S Mg. S Al 2 S 3 Гидросульфиды Na. HS Mg(HS)2 Растворимы сульфиды щелочных и щелочеземельных металлов, а также аммония (NH 4)2 S Остальные сульфиды малорастворимы As 2 S 3 Sb 2 S 3 Bi 2 S 3
Соли сероводородной кислоты - сульфиды Na 2 S Mg. S Al 2 S 3 Гидросульфиды Na. HS Mg(HS)2 Растворимы сульфиды щелочных и щелочеземельных металлов, а также аммония (NH 4)2 S Остальные сульфиды малорастворимы As 2 S 3 Sb 2 S 3 Bi 2 S 3
 ПОЛИСУЛЬФИДЫ M 2 Sn структура: Na 2 S + (n-1) S = Na 2 Sn Пирит Fe. S 2 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 (обжиг пирита, 1 стадия получения серной кислоты) H 2 S 2 и H 2 Sn - многосернистый водород, смесь - сульфан
ПОЛИСУЛЬФИДЫ M 2 Sn структура: Na 2 S + (n-1) S = Na 2 Sn Пирит Fe. S 2 4 Fe. S 2 + 11 O 2 = 2 Fe 2 O 3 + 8 SO 2 (обжиг пирита, 1 стадия получения серной кислоты) H 2 S 2 и H 2 Sn - многосернистый водород, смесь - сульфан
 SO 2 оксид серы IV (сернистый газ) бесцветный газ с характерным резким запахом, хорошо растворим в воде SO 2 + H 2 O ↔ H 2 SO 3
SO 2 оксид серы IV (сернистый газ) бесцветный газ с характерным резким запахом, хорошо растворим в воде SO 2 + H 2 O ↔ H 2 SO 3
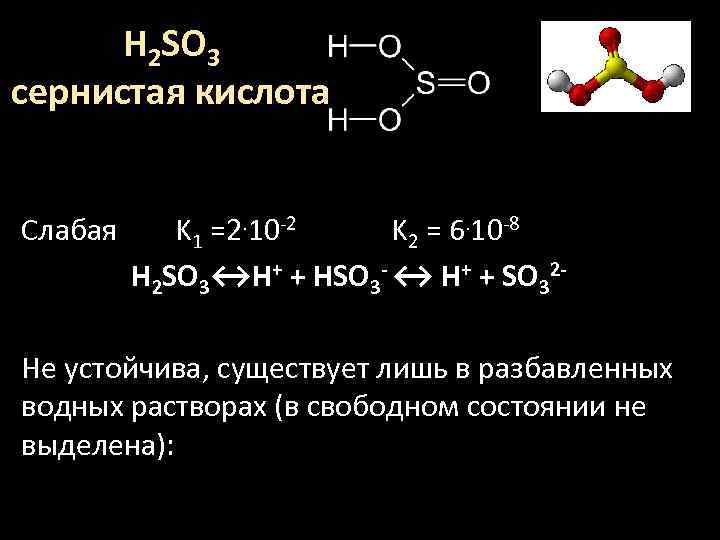 H 2 SO 3 сернистая кислота Слабая K 1 =2. 10 -2 K 2 = 6. 10 -8 H 2 SO 3↔H+ + HSO 3 - ↔ H+ + SO 32 Не устойчива, существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
H 2 SO 3 сернистая кислота Слабая K 1 =2. 10 -2 K 2 = 6. 10 -8 H 2 SO 3↔H+ + HSO 3 - ↔ H+ + SO 32 Не устойчива, существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
 SO 2 + O 2 2 SO 3 Процесс с заметной скоростью пропекает только при достаточно высокой температурах и присутствии катализатора (V 2 O 5, Pt ).
SO 2 + O 2 2 SO 3 Процесс с заметной скоростью пропекает только при достаточно высокой температурах и присутствии катализатора (V 2 O 5, Pt ).
 SO 3 — типичный кислотный оксид, ангидрид серной кислоты. При взаимодействии с водой образует серную кислоту: SO 3 + H 2 O → H 2 SO 4 Взаимодействует с основными и амфотерными оксидами, с основаниями: 2 KOH + SO 3 → K 2 SO 4 + H 2 O Характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида: 2 SO 3 + 2 KI → SO 2 + I 2 + K 2 SO 4
SO 3 — типичный кислотный оксид, ангидрид серной кислоты. При взаимодействии с водой образует серную кислоту: SO 3 + H 2 O → H 2 SO 4 Взаимодействует с основными и амфотерными оксидами, с основаниями: 2 KOH + SO 3 → K 2 SO 4 + H 2 O Характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого ангидрида: 2 SO 3 + 2 KI → SO 2 + I 2 + K 2 SO 4
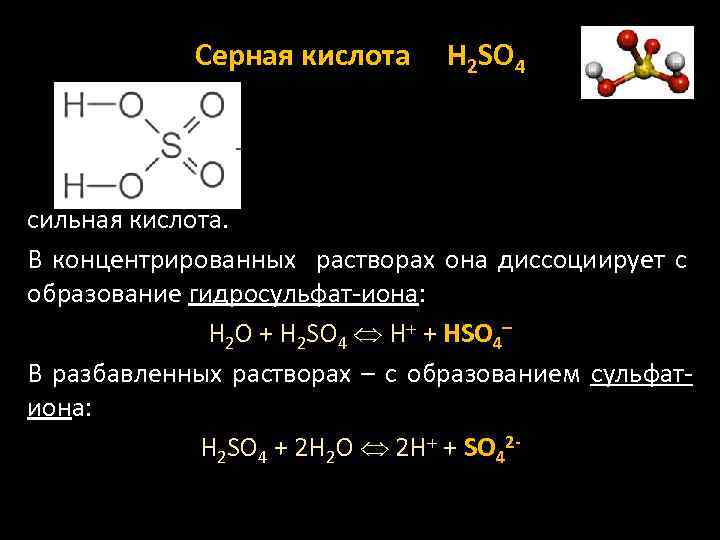 Серная кислота H 2 SO 4 сильная кислота. В концентрированных растворах она диссоциирует с образование гидросульфат-иона: Н 2 О + Н 2 SО 4 Н + НSO 4 В разбавленных растворах – с образованием сульфатиона: Н 2 SО 4 + 2 Н 2 О 2 Н + SO 42 -
Серная кислота H 2 SO 4 сильная кислота. В концентрированных растворах она диссоциирует с образование гидросульфат-иона: Н 2 О + Н 2 SО 4 Н + НSO 4 В разбавленных растворах – с образованием сульфатиона: Н 2 SО 4 + 2 Н 2 О 2 Н + SO 42 -
 Концентрированная H 2 SO 4 является сильным окислителем, особенно при нагревании. 2 HI +H 2 SO 4(конц) = I 2 + SO 2 +2 H 2 O Окисляет большинство металлов: Cu + 2 H 2 SO 4(конц) = Cu. SO 4 + SO 2 + H 2 O 4 Ca + 5 H 2 SO 4(конц) = 4 Ca. SO 4 + H 2 S + 4 H 2 O Устойчивы по отношению к концентрированной серной кислоте Fe, Au, Pt
Концентрированная H 2 SO 4 является сильным окислителем, особенно при нагревании. 2 HI +H 2 SO 4(конц) = I 2 + SO 2 +2 H 2 O Окисляет большинство металлов: Cu + 2 H 2 SO 4(конц) = Cu. SO 4 + SO 2 + H 2 O 4 Ca + 5 H 2 SO 4(конц) = 4 Ca. SO 4 + H 2 S + 4 H 2 O Устойчивы по отношению к концентрированной серной кислоте Fe, Au, Pt
 От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду: C 12 H 22 O 11 + H 2 SO 4(конц) → C + H 2 SO 4. H 2 O
От многих органических веществ, содержащих в своём составе водород и кислород, она отнимает воду: C 12 H 22 O 11 + H 2 SO 4(конц) → C + H 2 SO 4. H 2 O
 VА группа «Пниктогены» (рождающие удушье pnikt- удушливый, плохо пахнущий)
VА группа «Пниктогены» (рождающие удушье pnikt- удушливый, плохо пахнущий)
 N АЗОТ Nitrogenium порядковый номер 7, атомная масса 14, 0067 1 s 22 p 3 Валентность 3 и 4 Ст. ок. -3 до +5
N АЗОТ Nitrogenium порядковый номер 7, атомная масса 14, 0067 1 s 22 p 3 Валентность 3 и 4 Ст. ок. -3 до +5
 N 2 2 N (при 3000 0 С 0, 1%) Eсв =945, 3 к. Дж/моль • Физические свойства: газ. б/ц, б/з, плохо растворим в воде, tкип =-196, tпл =-210
N 2 2 N (при 3000 0 С 0, 1%) Eсв =945, 3 к. Дж/моль • Физические свойства: газ. б/ц, б/з, плохо растворим в воде, tкип =-196, tпл =-210
 Химические свойства При обычных условиях реагирует только с литием: 6 Li + N 2 → 2 Li 3 N (нитрид лития) при нагревании реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды: 3 Mg + N 2 → Mg 3 N 2, 2 В + N 2 → 2 BN, 3 H 2 +N 2 → 2 H 3 N (NH 3)
Химические свойства При обычных условиях реагирует только с литием: 6 Li + N 2 → 2 Li 3 N (нитрид лития) при нагревании реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды: 3 Mg + N 2 → Mg 3 N 2, 2 В + N 2 → 2 BN, 3 H 2 +N 2 → 2 H 3 N (NH 3)
 Нитрид водорода - Аммиак NH 3 Газ б/ц, с резким запахом, токсичен. Tкип=-330 С, Tпл=-780 С. Высокая теплота испарения – хладоагент В 1 об воды растворяется 1200 об при 00 С
Нитрид водорода - Аммиак NH 3 Газ б/ц, с резким запахом, токсичен. Tкип=-330 С, Tпл=-780 С. Высокая теплота испарения – хладоагент В 1 об воды растворяется 1200 об при 00 С
 В воде NH 3 + H 2 O ↔ NH 3. H 2 O ↔ NH 4+ + OHKдис = 10 -5 Из-за донорной активности атома азота аммиак в водном растворе проявляет свойства основания
В воде NH 3 + H 2 O ↔ NH 3. H 2 O ↔ NH 4+ + OHKдис = 10 -5 Из-за донорной активности атома азота аммиак в водном растворе проявляет свойства основания
 Получение аммиака 3 H 2+ N 2 ↔ 2 NH 3 450 0 С, З 0 м. Па, катализатор (Fe) Лабораторный способ 2 NH 4 Cl + Ca(OH)2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O
Получение аммиака 3 H 2+ N 2 ↔ 2 NH 3 450 0 С, З 0 м. Па, катализатор (Fe) Лабораторный способ 2 NH 4 Cl + Ca(OH)2 = 2 NH 3 + Ca. Cl 2 + 2 H 2 O
 При нагревании аммиак проявляет восстановительные свойства. Oн горит в атмосфере кислорода. 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 20 Окисление аммиака воздухом на платиновом катализаторе 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O (стадия получения азотной кислоты) Воспламеняется с галогенами 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl
При нагревании аммиак проявляет восстановительные свойства. Oн горит в атмосфере кислорода. 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 20 Окисление аммиака воздухом на платиновом катализаторе 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O (стадия получения азотной кислоты) Воспламеняется с галогенами 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl
 Взаимодействуя с кислотами аммиак даёт соответствующие соли аммония: NH 3 + HNO 3 → NH 4 NO 3 в воде подвергаются гидролизу NH 4 NO 3 + H 2 O = NH 3 +HNO 3 (запах)
Взаимодействуя с кислотами аммиак даёт соответствующие соли аммония: NH 3 + HNO 3 → NH 4 NO 3 в воде подвергаются гидролизу NH 4 NO 3 + H 2 O = NH 3 +HNO 3 (запах)
 При взаимодействии солей аммония со щелочью выделяется аммиак: NH 4 Cl + Na. OH = NH 3 + Na. Cl + H 2 O
При взаимодействии солей аммония со щелочью выделяется аммиак: NH 4 Cl + Na. OH = NH 3 + Na. Cl + H 2 O
 Оксид азота (I) N 2 O бесцветный газ со слабым запахом, растворим в воде, но с нею не взаимодействует. Не реагирует с растворами кислот и щелочей - несолеобразующий. При нагревании выше 7000 С разлагается: 2 N 2 O = 2 N 2 + O 2 При нагревании окисляет металлы, P, C, S, органические вещества: Cu+ N 2 O = Cu. O + N 2 NH 3 + N 2 O= N 2 +H 2 O (при соприкосновении с пламенем - взрыв)
Оксид азота (I) N 2 O бесцветный газ со слабым запахом, растворим в воде, но с нею не взаимодействует. Не реагирует с растворами кислот и щелочей - несолеобразующий. При нагревании выше 7000 С разлагается: 2 N 2 O = 2 N 2 + O 2 При нагревании окисляет металлы, P, C, S, органические вещества: Cu+ N 2 O = Cu. O + N 2 NH 3 + N 2 O= N 2 +H 2 O (при соприкосновении с пламенем - взрыв)
 Оксид азота (II) NO Газ бесцветный, с резким запахом, незначительно растворим в воде. Несолеобразующий. При обычной температуре NO соединяется с кислородом с образованием NO 2. Сильными окислителями окисляется до азотной кислоты.
Оксид азота (II) NO Газ бесцветный, с резким запахом, незначительно растворим в воде. Несолеобразующий. При обычной температуре NO соединяется с кислородом с образованием NO 2. Сильными окислителями окисляется до азотной кислоты.
 (азотистый ангидрид) Неустойчив Взаимодействует с водой, образуя азотистую кислоту HNO 2. N 2 O 3+H 2 O = 2 HNO 2
(азотистый ангидрид) Неустойчив Взаимодействует с водой, образуя азотистую кислоту HNO 2. N 2 O 3+H 2 O = 2 HNO 2
 бурый газ, c резким запахом, токсичен, тяжелее воздуха, легко сжижается. Выше 1500 С разлагается 2 NO 2=2 NO+O 2 Взаимодействует с водой: 2 NO 2 + Н 2 О = HNO 3 + HNO 2 и растворами щелочей: 2 NO 2+2 Na. OH=Na. NO 3+Na. NO 2+H 2 О
бурый газ, c резким запахом, токсичен, тяжелее воздуха, легко сжижается. Выше 1500 С разлагается 2 NO 2=2 NO+O 2 Взаимодействует с водой: 2 NO 2 + Н 2 О = HNO 3 + HNO 2 и растворами щелочей: 2 NO 2+2 Na. OH=Na. NO 3+Na. NO 2+H 2 О
 • (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО 2 и О 2. • Сильный окислитель. • В воде легко растворяется с образованием азотной кислоты HNO 3.
• (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО 2 и О 2. • Сильный окислитель. • В воде легко растворяется с образованием азотной кислоты HNO 3.
 Азотная кислота HNO 3 Летучая жидкость б/ц, с резким запахом, растворима в воде в любых соотношениях. Дымящая быстро буреет: 4 HNO 3 =4 NO 2 +2 H 2 O + O 2
Азотная кислота HNO 3 Летучая жидкость б/ц, с резким запахом, растворима в воде в любых соотношениях. Дымящая быстро буреет: 4 HNO 3 =4 NO 2 +2 H 2 O + O 2
 Азотная кислота – сильный окислитель Продукты ее восстановления зависят от активности металла и концентрации кислоты:
Азотная кислота – сильный окислитель Продукты ее восстановления зависят от активности металла и концентрации кислоты:
 1) Разбавленная (3 -20%) – N 2; N 2 O; NO; H 2 (Mn и Mg – смесь в которой 80% H 2; Zn – N 2 и N 2 O) 2) Сильно разбавленная (менее 5%) – NH 4+ 3) Средней концентрации (20 -60%) – NO 4) Концентрированная NO 2
1) Разбавленная (3 -20%) – N 2; N 2 O; NO; H 2 (Mn и Mg – смесь в которой 80% H 2; Zn – N 2 и N 2 O) 2) Сильно разбавленная (менее 5%) – NH 4+ 3) Средней концентрации (20 -60%) – NO 4) Концентрированная NO 2
 Нитраты • Хорошо растворимые соли, при нагревании безводные разлагаются: 1. 2 КNO 3→ 2 KNO 2+O 2 2. 2 Na. NO 3→ 2 Na. NO 2+O 2 4 Na. NO 3→ 2 Na 2 O+2 N 2+O 2 3. 4 Li. NO 3→ 2 Li 2 O+4 NO 2 +O 2 4. 2 Zn(NO 3)2 → 2 Zn. O+4 NO 2 +O 2 5. 2 Ag. NO 3 → 2 Ag+2 NO 2 +O 2 и
Нитраты • Хорошо растворимые соли, при нагревании безводные разлагаются: 1. 2 КNO 3→ 2 KNO 2+O 2 2. 2 Na. NO 3→ 2 Na. NO 2+O 2 4 Na. NO 3→ 2 Na 2 O+2 N 2+O 2 3. 4 Li. NO 3→ 2 Li 2 O+4 NO 2 +O 2 4. 2 Zn(NO 3)2 → 2 Zn. O+4 NO 2 +O 2 5. 2 Ag. NO 3 → 2 Ag+2 NO 2 +O 2 и


