Элементы теории валентных связей.ppt
- Количество слайдов: 30
 Свойства ковалентной связи • Согласно методу валентных связей основными свойствами ковалентной связи является • насыщаемость, напрямленость, полярность и поляризованость. Насыщаемость - это способность атомов образовывать ограниченное количество ковалентних связей. • • В результате насыщаемости связи молекулы имеют определенный химический состав и существуют в виде дискретных частиц с определенной структурой (H 2, H 2 O, CH 4). Теоретическое обоснование насыщаемости связи впервые было рассмотрено Гайтлером и Лондоном. На основе квантово-механических расчетов они доказали невозможность взаимодействия молекулы водорода с атомом водорода. В системе Н 2 + Н спин электрона третьего атома водорода будет совпадать со спином одного из электронов молекулы водорода. Потому между атомом Н и молекулой Н 2 будут действовать лишь силы отталкивания, перекрытия электронных облаков не происходит. Насыщаемость характерна лишь для ковалентной связи.
Свойства ковалентной связи • Согласно методу валентных связей основными свойствами ковалентной связи является • насыщаемость, напрямленость, полярность и поляризованость. Насыщаемость - это способность атомов образовывать ограниченное количество ковалентних связей. • • В результате насыщаемости связи молекулы имеют определенный химический состав и существуют в виде дискретных частиц с определенной структурой (H 2, H 2 O, CH 4). Теоретическое обоснование насыщаемости связи впервые было рассмотрено Гайтлером и Лондоном. На основе квантово-механических расчетов они доказали невозможность взаимодействия молекулы водорода с атомом водорода. В системе Н 2 + Н спин электрона третьего атома водорода будет совпадать со спином одного из электронов молекулы водорода. Потому между атомом Н и молекулой Н 2 будут действовать лишь силы отталкивания, перекрытия электронных облаков не происходит. Насыщаемость характерна лишь для ковалентной связи.
 Напрямленость ковалентной связи • Напрямленость ковалентной связи предопределяет пространственную структуру молекул - геометрию молекул. Количественной характеристикой напрямлености ковалентной связи являются валентные углы. Образование ковалентной связи является следствием перекрывания электронных облаков взаимодействующих атомов. Поскольку электронные облака имеют разную форму, а p-, d- и f -орбитали определенным образом ориентированы в пространстве, то их площадь перекрытия размещается в определенном направлении по отношению к взаимодействующим атомам. В зависимости от способа перекрытия и симметрии электронного облака, которое образуется, различают σ-, π- и δ-связи.
Напрямленость ковалентной связи • Напрямленость ковалентной связи предопределяет пространственную структуру молекул - геометрию молекул. Количественной характеристикой напрямлености ковалентной связи являются валентные углы. Образование ковалентной связи является следствием перекрывания электронных облаков взаимодействующих атомов. Поскольку электронные облака имеют разную форму, а p-, d- и f -орбитали определенным образом ориентированы в пространстве, то их площадь перекрытия размещается в определенном направлении по отношению к взаимодействующим атомам. В зависимости от способа перекрытия и симметрии электронного облака, которое образуется, различают σ-, π- и δ-связи.
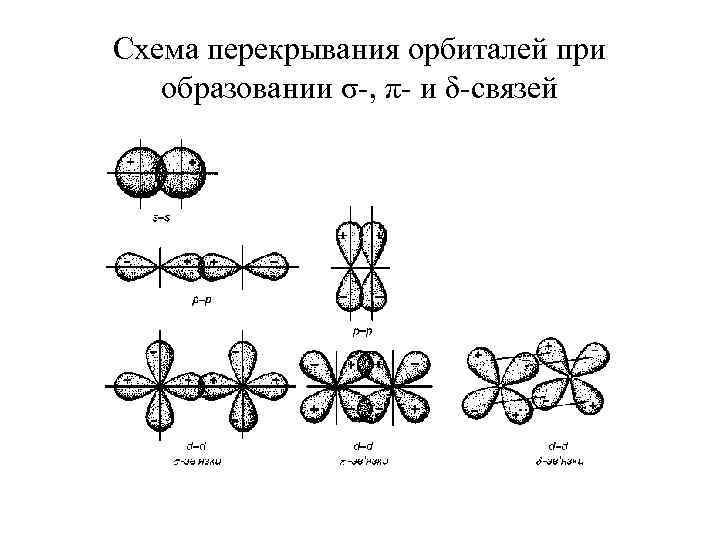 Схема перекрывания орбиталей при образовании σ-, π- и δ-связей
Схема перекрывания орбиталей при образовании σ-, π- и δ-связей
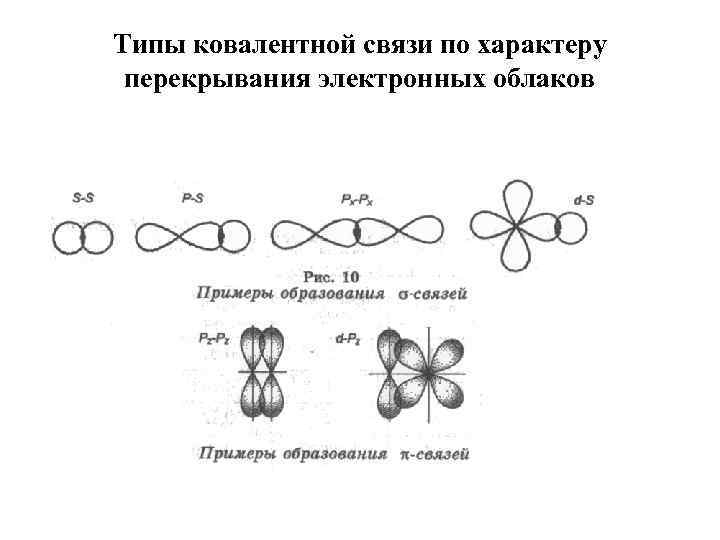 Типы ковалентной связи по характеру перекрывания электронных облаков
Типы ковалентной связи по характеру перекрывания электронных облаков
 Сигма и пи-связи s- связь – однократное перекрывание облаков по линии соединяющей центры атомов Сигма связи присутствуют во всех молекулах.
Сигма и пи-связи s- связь – однократное перекрывание облаков по линии соединяющей центры атомов Сигма связи присутствуют во всех молекулах.
 • π - связь – двукратное перекрывание электронных облаков по обе стороны от линии соединяющей центры атомов.
• π - связь – двукратное перекрывание электронных облаков по обе стороны от линии соединяющей центры атомов.
 • π связи присутствуют в молекулах, имеющих двойные (молекула кислорода, этилена и др. ) и тройные связи (молекула азота, СО и др. ). Если в молекуле вещества несколько связей, то одна из них сигма, остальные пи.
• π связи присутствуют в молекулах, имеющих двойные (молекула кислорода, этилена и др. ) и тройные связи (молекула азота, СО и др. ). Если в молекуле вещества несколько связей, то одна из них сигма, остальные пи.
 Гибридизация Для объяснения геометрической формы молекул (направленности ковалентной связи) используют представление о гибридизации атомных орбиталей. Идею о гибридизации атомных орбиталей выдвинул американский ученый Лайнус Карл Полинг в 1901 году.
Гибридизация Для объяснения геометрической формы молекул (направленности ковалентной связи) используют представление о гибридизации атомных орбиталей. Идею о гибридизации атомных орбиталей выдвинул американский ученый Лайнус Карл Полинг в 1901 году.
 Суть гибридизации Смешение разных (s-, p-, d-) атомных орбиталей центрального атома. При этом орбитали должны иметь близкие значения энергии. Результат гибридизации – образование одинаковых по плотности, объему, энергии гибридных орбиталей. • Количество исходных атомных и образовавшихся гибридных орбиталей одинаково. В гибридной орбитали электронная плотность смещена в сторону от ядра, что позволяет добиться большего перекрывания с атомной орбиталью другого атома.
Суть гибридизации Смешение разных (s-, p-, d-) атомных орбиталей центрального атома. При этом орбитали должны иметь близкие значения энергии. Результат гибридизации – образование одинаковых по плотности, объему, энергии гибридных орбиталей. • Количество исходных атомных и образовавшихся гибридных орбиталей одинаково. В гибридной орбитали электронная плотность смещена в сторону от ядра, что позволяет добиться большего перекрывания с атомной орбиталью другого атома.
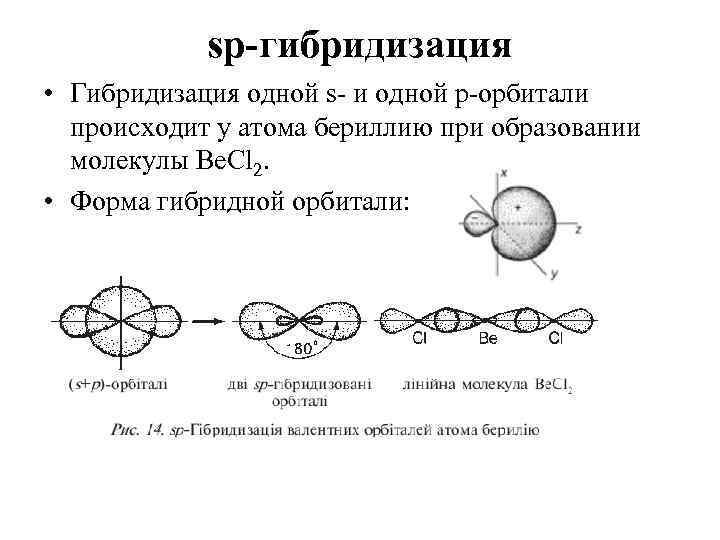 sр-гибридизация • Гибридизация одной s- и одной р-орбитали происходит у атома бериллию при образовании молекулы Be. Cl 2. • Форма гибридной орбитали:
sр-гибридизация • Гибридизация одной s- и одной р-орбитали происходит у атома бериллию при образовании молекулы Be. Cl 2. • Форма гибридной орбитали:
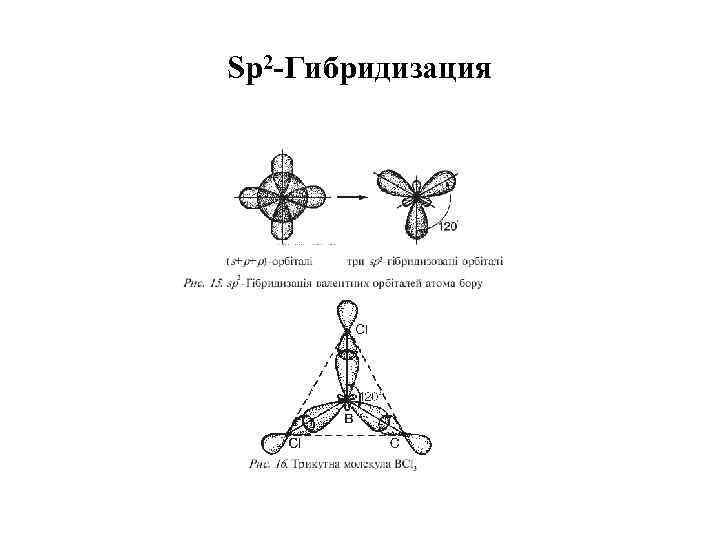 Sр2 -Гибридизация
Sр2 -Гибридизация
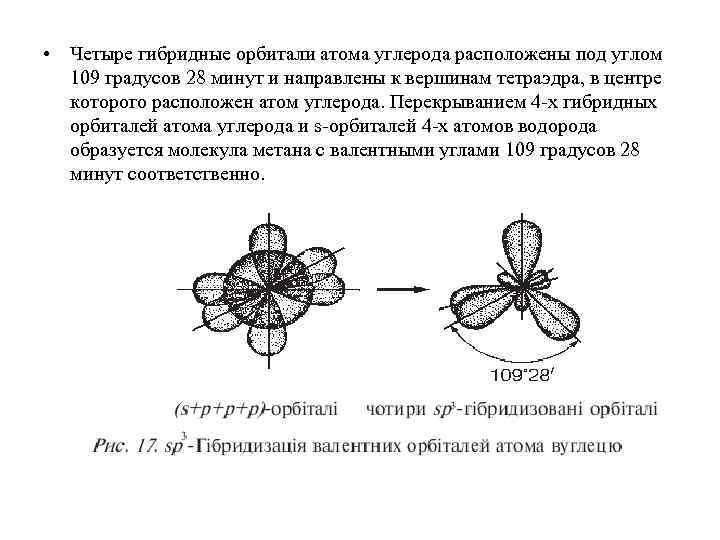 • Четыре гибридные орбитали атома углерода расположены под углом 109 градусов 28 минут и направлены к вершинам тетраэдра, в центре которого расположен атом углерода. Перекрыванием 4 -х гибридных орбиталей атома углерода и s-орбиталей 4 -х атомов водорода образуется молекула метана с валентными углами 109 градусов 28 минут соответственно.
• Четыре гибридные орбитали атома углерода расположены под углом 109 градусов 28 минут и направлены к вершинам тетраэдра, в центре которого расположен атом углерода. Перекрыванием 4 -х гибридных орбиталей атома углерода и s-орбиталей 4 -х атомов водорода образуется молекула метана с валентными углами 109 градусов 28 минут соответственно.
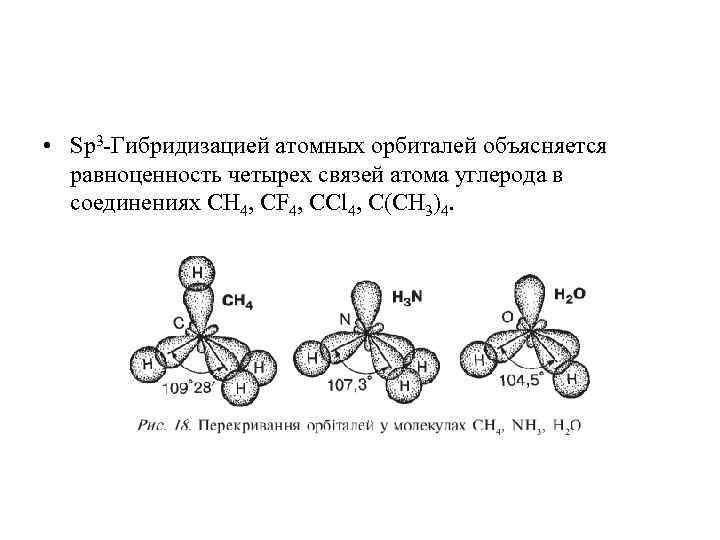 • Sp 3 -Гибридизацией атомных орбиталей объясняется равноценность четырех связей атома углерода в соединениях СH 4, CF 4, CCl 4, C(CH 3)4.
• Sp 3 -Гибридизацией атомных орбиталей объясняется равноценность четырех связей атома углерода в соединениях СH 4, CF 4, CCl 4, C(CH 3)4.
 • Sp 3 -Гибридизация атомных орбиталей характерна не только для соединений углерода. Вследствии Sp 3 гибридизации орбиталей атома азота, бора, кремния и германия тетраэдрическую структуру имеют ионы NH 4+. BH 4 -, BF 4 -, молекулы гидридов и галогенидов кремния и германия (Si. H 4, Si. F 4, Ge. Cl 4 и других молекул.
• Sp 3 -Гибридизация атомных орбиталей характерна не только для соединений углерода. Вследствии Sp 3 гибридизации орбиталей атома азота, бора, кремния и германия тетраэдрическую структуру имеют ионы NH 4+. BH 4 -, BF 4 -, молекулы гидридов и галогенидов кремния и германия (Si. H 4, Si. F 4, Ge. Cl 4 и других молекул.
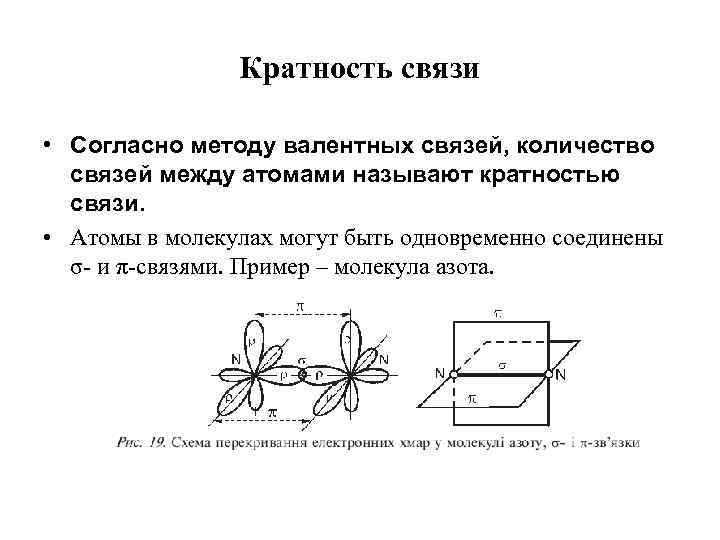 Кратность связи • Согласно методу валентных связей, количество связей между атомами называют кратностью связи. • Атомы в молекулах могут быть одновременно соединены σ- и π-связями. Пример – молекула азота.
Кратность связи • Согласно методу валентных связей, количество связей между атомами называют кратностью связи. • Атомы в молекулах могут быть одновременно соединены σ- и π-связями. Пример – молекула азота.
 Нелокализованные химические связи • Рассмотренную выше химическая связь, образованную общей электронной парой, которая принадлежит ядрам двух атомов, называют локализованным. Большинство химических соединений обнаруживают нелокализованную (делокализованную) химическую связь, которая объединяет больше двух атомов. Такие связи называют многоцентровыми. • Примером молекулы с делокализованными связями является молекула SO 2. У атома серы с электронной конфигурацией 1 s 22 р63 s 23 р4, два p-электрона неспарены.
Нелокализованные химические связи • Рассмотренную выше химическая связь, образованную общей электронной парой, которая принадлежит ядрам двух атомов, называют локализованным. Большинство химических соединений обнаруживают нелокализованную (делокализованную) химическую связь, которая объединяет больше двух атомов. Такие связи называют многоцентровыми. • Примером молекулы с делокализованными связями является молекула SO 2. У атома серы с электронной конфигурацией 1 s 22 р63 s 23 р4, два p-электрона неспарены.
 • За счет этих электронов атом серы образует две связи с атомом кислорода. • В результате наличия у атома серы двух неподеленных пар электронов она играет роль донора электронных пар, то есть образует связи по донорно-акцепторному механизму. Акцептором электронной пары является атом кислорода, который переходит в возбужденное состояние, в результате чего спариваются его 2 р-электрона. Таким образом, валентная схема молекулы SO 2 имеет вид:
• За счет этих электронов атом серы образует две связи с атомом кислорода. • В результате наличия у атома серы двух неподеленных пар электронов она играет роль донора электронных пар, то есть образует связи по донорно-акцепторному механизму. Акцептором электронной пары является атом кислорода, который переходит в возбужденное состояние, в результате чего спариваются его 2 р-электрона. Таким образом, валентная схема молекулы SO 2 имеет вид:
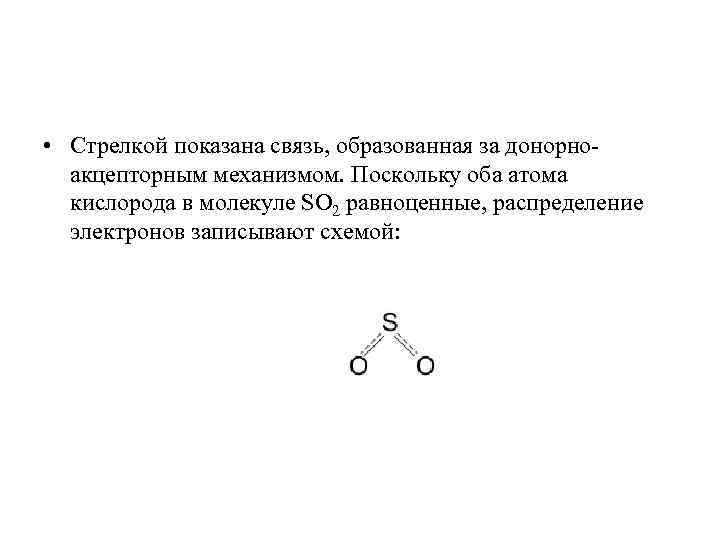 • Стрелкой показана связь, образованная за донорноакцепторным механизмом. Поскольку оба атома кислорода в молекуле SO 2 равноценные, распределение электронов записывают схемой:
• Стрелкой показана связь, образованная за донорноакцепторным механизмом. Поскольку оба атома кислорода в молекуле SO 2 равноценные, распределение электронов записывают схемой:
 Полярность и поляризованность связи • В молекуле HСl на атоме водорода δН равняется 0, 18+, а на атоме хлору δС 1 = 0, 18 - абсолютного заряда электрона. На основе эффективных зарядов можно сказать, что связь в молекуле HСl на 18 % имеет ионный характер, то есть связь полярная ковалентная. • По степени смещения связывающего электронного облака связь может быть неполярная, полярная и ионная. Неполярная и ионная связи - крайние случаи полярной связи. Полярность связи можно установить на основе значений относительной электроотрицательности взаимодействующих атомов. Если разница электроотрицательности Δχ > 1, 9 – связь ионная.
Полярность и поляризованность связи • В молекуле HСl на атоме водорода δН равняется 0, 18+, а на атоме хлору δС 1 = 0, 18 - абсолютного заряда электрона. На основе эффективных зарядов можно сказать, что связь в молекуле HСl на 18 % имеет ионный характер, то есть связь полярная ковалентная. • По степени смещения связывающего электронного облака связь может быть неполярная, полярная и ионная. Неполярная и ионная связи - крайние случаи полярной связи. Полярность связи можно установить на основе значений относительной электроотрицательности взаимодействующих атомов. Если разница электроотрицательности Δχ > 1, 9 – связь ионная.
 • • • Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и возможность ее поляризации, то есть способность превращаться в полярную или более полярную. Последнее является результатом воздействия на молекулу внешнего электрического поля. Неполярные молекулы должны поляризоваться при действии на них полярных молекул. В результате поляризации может происходить разрыв связи с переходом общей электронной пары к одному из атомов и образованием положительно заряженного и отрицательно заряженного ионов. Такой разрыв связи называют гетеролитическим. Связь может разрушаться при распаде молекул с образованием атомов и радикалов. В этом случае разрушается связывающий электронный пар. Такой разрыв связи называют гомолитическим. В соответствии со сказанным различают процесс диссоциации и процесс ионизации. Первый наблюдается при термическом распаде молекулы на атомы, второй - в растворах, при распаде на ионы под действием полярных молекул воды.
• • • Для характеристики реакционной способности молекул важно знать не только исходное распределение электронной плотности, но и возможность ее поляризации, то есть способность превращаться в полярную или более полярную. Последнее является результатом воздействия на молекулу внешнего электрического поля. Неполярные молекулы должны поляризоваться при действии на них полярных молекул. В результате поляризации может происходить разрыв связи с переходом общей электронной пары к одному из атомов и образованием положительно заряженного и отрицательно заряженного ионов. Такой разрыв связи называют гетеролитическим. Связь может разрушаться при распаде молекул с образованием атомов и радикалов. В этом случае разрушается связывающий электронный пар. Такой разрыв связи называют гомолитическим. В соответствии со сказанным различают процесс диссоциации и процесс ионизации. Первый наблюдается при термическом распаде молекулы на атомы, второй - в растворах, при распаде на ионы под действием полярных молекул воды.
 • • • Степень окисления элементов Пользуясь значениями относительной электроотрицательности элементов, можно количественно оценить состояние атома в соединении в виде так называемой степени окисления. Под степенью окисления понимают электрический заряд атома в соединении, который вычисляют из предположения, что соединение состоит из ионов. Другими словами, степень окисления - условный заряд, который имел бы атом при полном переходе электронных пар, которые образуют связь, к более электроотрицательному атому. Для большинства элементов степень окисления в их соединениях переменна. Элементы имеют положительные и отрицательные степени окисления. Значение положительной степени окисления отвечает числу оттянутых от атома электронов, а значения отрицательной - числу притянутых атомом электронов. Например, в молекуле Li. H литий и водород связаны одной общей электронной парой, смещенной к более электроотрицательному водороду: литий и водород одновалентны. Степень окисления менее электроотрицательного лития +1, а более электроотрицательного водорода, составляет -1. В молекуле HСl наоборот, водород является менее электроотрицательным елементом: окисления водорода +1, хлора - -1.
• • • Степень окисления элементов Пользуясь значениями относительной электроотрицательности элементов, можно количественно оценить состояние атома в соединении в виде так называемой степени окисления. Под степенью окисления понимают электрический заряд атома в соединении, который вычисляют из предположения, что соединение состоит из ионов. Другими словами, степень окисления - условный заряд, который имел бы атом при полном переходе электронных пар, которые образуют связь, к более электроотрицательному атому. Для большинства элементов степень окисления в их соединениях переменна. Элементы имеют положительные и отрицательные степени окисления. Значение положительной степени окисления отвечает числу оттянутых от атома электронов, а значения отрицательной - числу притянутых атомом электронов. Например, в молекуле Li. H литий и водород связаны одной общей электронной парой, смещенной к более электроотрицательному водороду: литий и водород одновалентны. Степень окисления менее электроотрицательного лития +1, а более электроотрицательного водорода, составляет -1. В молекуле HСl наоборот, водород является менее электроотрицательным елементом: окисления водорода +1, хлора - -1.
 Типы ковалентных молекул • В зависимости от характера распределения электронной плотности, молекулы могут быть полярными и неполярными. В полярных молекулах центры положительных и отрицательных зарядов не совпадают. При образовании химической связи между атомами с разной электроотрицательностью электронные облака смещаются к атомам с большей электроотрицательностью, в результате чего молекулы принимают характер электрических диполей. Диполь - это система, которая состоит из двух равных за величиной и противоположных за знаком зарядов. Молекулы такого типа называют полярными. Полярность связи, как и полярность молекул, количественно оценивают величиной электрического момента диполя μ, который является произведением абсолютного значения заряда электрона q на расстояние между центрами позитивного и негативного зарядов в молекуле l: • Длина диполя и приобретает значения, близкие к диаметру атома 10 -10 м, а заряд q принимают равным заряду электрона 1, 6·10 -19 Кл. Электрический момент диполя таким образом имеет размерность Кл ·м. Его иногда выражают в дебаях и помечают Д. 1 Д = 3, 33·10 -30 Кл·м.
Типы ковалентных молекул • В зависимости от характера распределения электронной плотности, молекулы могут быть полярными и неполярными. В полярных молекулах центры положительных и отрицательных зарядов не совпадают. При образовании химической связи между атомами с разной электроотрицательностью электронные облака смещаются к атомам с большей электроотрицательностью, в результате чего молекулы принимают характер электрических диполей. Диполь - это система, которая состоит из двух равных за величиной и противоположных за знаком зарядов. Молекулы такого типа называют полярными. Полярность связи, как и полярность молекул, количественно оценивают величиной электрического момента диполя μ, который является произведением абсолютного значения заряда электрона q на расстояние между центрами позитивного и негативного зарядов в молекуле l: • Длина диполя и приобретает значения, близкие к диаметру атома 10 -10 м, а заряд q принимают равным заряду электрона 1, 6·10 -19 Кл. Электрический момент диполя таким образом имеет размерность Кл ·м. Его иногда выражают в дебаях и помечают Д. 1 Д = 3, 33·10 -30 Кл·м.
 Межмолекулярное взаимодействие • • Молекулы, как и атомы, - сложные электрические системы. При суммарной электронейтральности они являются совокупностью позитивных и негативных зарядов. При сближении молекул между ними действуют силы притягивания и отталкивания. Их называют силами Ван-дер-ваальса по именем голландского физико-химика Вандерваальса, который впервые в 1873 году количественно определил силу притягивания молекул реального газа. Природа этих сил определяется электрическим взаимодействием диполей, механизм возникновения которых для разных веществ индивидуален. На сравнительно больших расстояниях между молекулами, действует сила притяжения: чем большие дипольные моменты молекул, тем она большая. Межмолекулярные силы отличаются от сил, которые определяют химическое взаимодействие, универсальностью, ненасыщенностью, меньшей величиной энергии и тем, что проявляются на больших расстояниях. Электростатическое взаимодействие молекул разделяется на ориентационное, индукционное и дисперсионное. Ориентационное (диполь-дипольное) взаимодействие осуществляется между полярными молекулами. Последние при сближении ориентируются друг относительно друга противоположно заряженными концами диполей. В то же время с ориентацией происходит деформация молекул, в результате чего увеличиваются диполи взаимодействующих молекул. Сила притягивания между двумя полярными молекулами зависят вот размеров полярных молекул и максимальны в том случае, когда их дипольные моменты направлены вдоль одной линии.
Межмолекулярное взаимодействие • • Молекулы, как и атомы, - сложные электрические системы. При суммарной электронейтральности они являются совокупностью позитивных и негативных зарядов. При сближении молекул между ними действуют силы притягивания и отталкивания. Их называют силами Ван-дер-ваальса по именем голландского физико-химика Вандерваальса, который впервые в 1873 году количественно определил силу притягивания молекул реального газа. Природа этих сил определяется электрическим взаимодействием диполей, механизм возникновения которых для разных веществ индивидуален. На сравнительно больших расстояниях между молекулами, действует сила притяжения: чем большие дипольные моменты молекул, тем она большая. Межмолекулярные силы отличаются от сил, которые определяют химическое взаимодействие, универсальностью, ненасыщенностью, меньшей величиной энергии и тем, что проявляются на больших расстояниях. Электростатическое взаимодействие молекул разделяется на ориентационное, индукционное и дисперсионное. Ориентационное (диполь-дипольное) взаимодействие осуществляется между полярными молекулами. Последние при сближении ориентируются друг относительно друга противоположно заряженными концами диполей. В то же время с ориентацией происходит деформация молекул, в результате чего увеличиваются диполи взаимодействующих молекул. Сила притягивания между двумя полярными молекулами зависят вот размеров полярных молекул и максимальны в том случае, когда их дипольные моменты направлены вдоль одной линии.
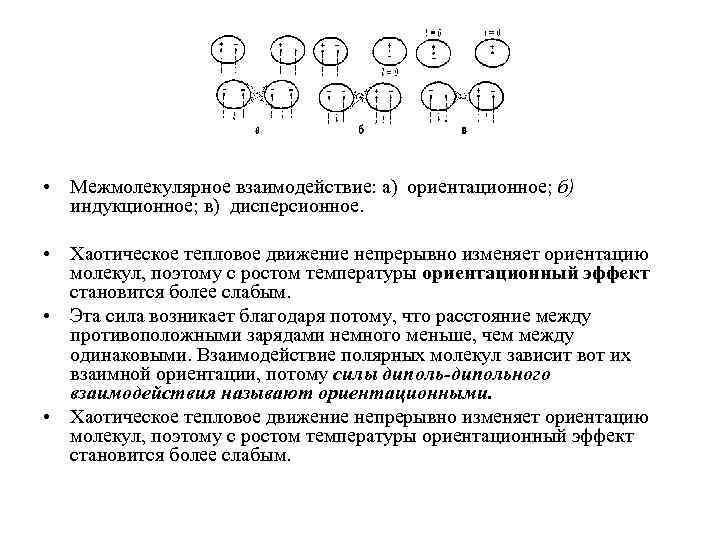 • Межмолекулярное взаимодействие: а) ориентационное; б) индукционное; в) дисперсионное. • Хаотическое тепловое движение непрерывно изменяет ориентацию молекул, поэтому с ростом температуры ориентационный эффект становится более слабым. • Эта сила возникает благодаря потому, что расстояние между противоположными зарядами немного меньше, чем между одинаковыми. Взаимодействие полярных молекул зависит вот их взаимной ориентации, потому силы диполь-дипольного взаимодействия называют ориентационными. • Хаотическое тепловое движение непрерывно изменяет ориентацию молекул, поэтому с ростом температуры ориентационный эффект становится более слабым.
• Межмолекулярное взаимодействие: а) ориентационное; б) индукционное; в) дисперсионное. • Хаотическое тепловое движение непрерывно изменяет ориентацию молекул, поэтому с ростом температуры ориентационный эффект становится более слабым. • Эта сила возникает благодаря потому, что расстояние между противоположными зарядами немного меньше, чем между одинаковыми. Взаимодействие полярных молекул зависит вот их взаимной ориентации, потому силы диполь-дипольного взаимодействия называют ориентационными. • Хаотическое тепловое движение непрерывно изменяет ориентацию молекул, поэтому с ростом температуры ориентационный эффект становится более слабым.
 • Молекулы большинства веществ могут достаточно легко поляризоваться под действием соседних молекул, атомов или ионов. У них возникает индукционный дипольный момент. Взаимодействие, которое возникает при этом, называют индукционным. Iндукционное (поляризационное) взаимодействие возникает между полярной и неполярной молекулами. • Под действием полярной молекулы происходит деформация неполярной, в ней возникает (индуцируется) диполь, в результате обе молекулы взаимодействуют как диполи. Индукционный диполь притягивается к постоянному диполю полярной молекулы. Индукционное взаимодействие тем значительнее, чем больший диполь и поляризованность взаимодействующих молекул. Например, при взаимодействии полярной молекулы HСl и неполярной CH 4 сила межмолекулярного взаимодействия будет зависеть от полярности молекулы HСl и деформации СН 4. Индукционные силы почти всегда малые и не зависят от температуры.
• Молекулы большинства веществ могут достаточно легко поляризоваться под действием соседних молекул, атомов или ионов. У них возникает индукционный дипольный момент. Взаимодействие, которое возникает при этом, называют индукционным. Iндукционное (поляризационное) взаимодействие возникает между полярной и неполярной молекулами. • Под действием полярной молекулы происходит деформация неполярной, в ней возникает (индуцируется) диполь, в результате обе молекулы взаимодействуют как диполи. Индукционный диполь притягивается к постоянному диполю полярной молекулы. Индукционное взаимодействие тем значительнее, чем больший диполь и поляризованность взаимодействующих молекул. Например, при взаимодействии полярной молекулы HСl и неполярной CH 4 сила межмолекулярного взаимодействия будет зависеть от полярности молекулы HСl и деформации СН 4. Индукционные силы почти всегда малые и не зависят от температуры.
 • Дисперсионное взаимодействие между неполярными молекулами. Она возникает в результате взаимного притягивания мгновенных диполей, которые возникают в нейтральных молекулах.
• Дисперсионное взаимодействие между неполярными молекулами. Она возникает в результате взаимного притягивания мгновенных диполей, которые возникают в нейтральных молекулах.
 Водородная связь • Принято считать, что водород образует одну химическую связь, то есть он одновалентен. Такое представление неполно отображает способность водорода взаимодействовать с другими атомами. Экспериментальные данные показывают, что водород, который образовал крепкую химическую связь с какимнибудь атомом Х, часто может образовать дополнительную химическую связь с другим более электроотрицательным атомом или группой атомов У. Такую связь называют водородной и помечают тремя точками Х - Н ··· В. Часто, но не всегда эта связь намного слабее первой.
Водородная связь • Принято считать, что водород образует одну химическую связь, то есть он одновалентен. Такое представление неполно отображает способность водорода взаимодействовать с другими атомами. Экспериментальные данные показывают, что водород, который образовал крепкую химическую связь с какимнибудь атомом Х, часто может образовать дополнительную химическую связь с другим более электроотрицательным атомом или группой атомов У. Такую связь называют водородной и помечают тремя точками Х - Н ··· В. Часто, но не всегда эта связь намного слабее первой.
 • Водородная связь, подобно другим химическим связям, образуется лишь при непосредственном контакте между молекулами. Для нее характерны напрямленность в пространстве и насыщенность. Прочность водородной связи превышает Ван-дер-ваальсовские силы, но она обычно на порядок слабее ковалентной связи. Ее энергия составляет 8 -40 к. Дж/моль. • Учитывают, что водородные связи образуются соединениями водорода с более электроотрицательными элементами: фтором, кислородом, азотом, хлором, реже с серой и фосфором, которые входят в состав других молекул. • Механизм образования водородной связи в значительной мере сводится к донорно-акцепторному взаимодействию, где донором электронной пары является атом электроотрицательного элемента, а ее акцептором - атом водорода (протон). Атом водорода, который образовал ковалентную связь, притягивает электроны электроотрицательного элемента другой молекулы. Образование водородной связи происходит благодаря малому размеру атома водорода и его способности глубоко проникать в электронную оболочку других атомов.
• Водородная связь, подобно другим химическим связям, образуется лишь при непосредственном контакте между молекулами. Для нее характерны напрямленность в пространстве и насыщенность. Прочность водородной связи превышает Ван-дер-ваальсовские силы, но она обычно на порядок слабее ковалентной связи. Ее энергия составляет 8 -40 к. Дж/моль. • Учитывают, что водородные связи образуются соединениями водорода с более электроотрицательными элементами: фтором, кислородом, азотом, хлором, реже с серой и фосфором, которые входят в состав других молекул. • Механизм образования водородной связи в значительной мере сводится к донорно-акцепторному взаимодействию, где донором электронной пары является атом электроотрицательного элемента, а ее акцептором - атом водорода (протон). Атом водорода, который образовал ковалентную связь, притягивает электроны электроотрицательного элемента другой молекулы. Образование водородной связи происходит благодаря малому размеру атома водорода и его способности глубоко проникать в электронную оболочку других атомов.
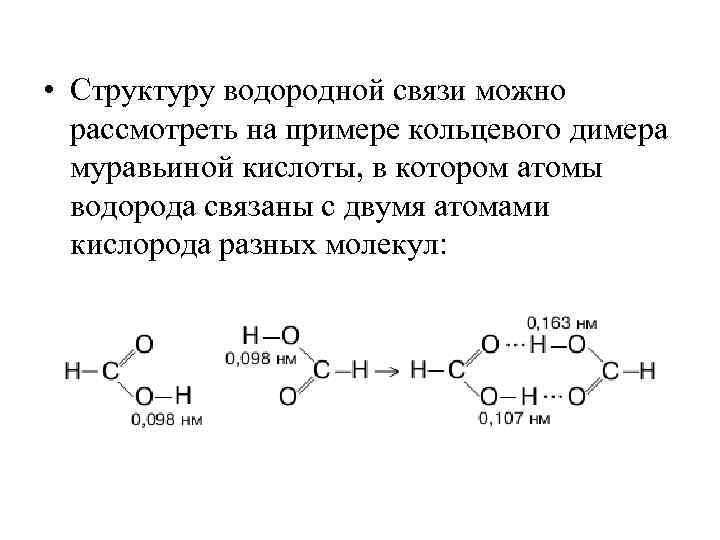 • Структуру водородной связи можно рассмотреть на примере кольцевого димера муравьиной кислоты, в котором атомы водорода связаны с двумя атомами кислорода разных молекул:
• Структуру водородной связи можно рассмотреть на примере кольцевого димера муравьиной кислоты, в котором атомы водорода связаны с двумя атомами кислорода разных молекул:
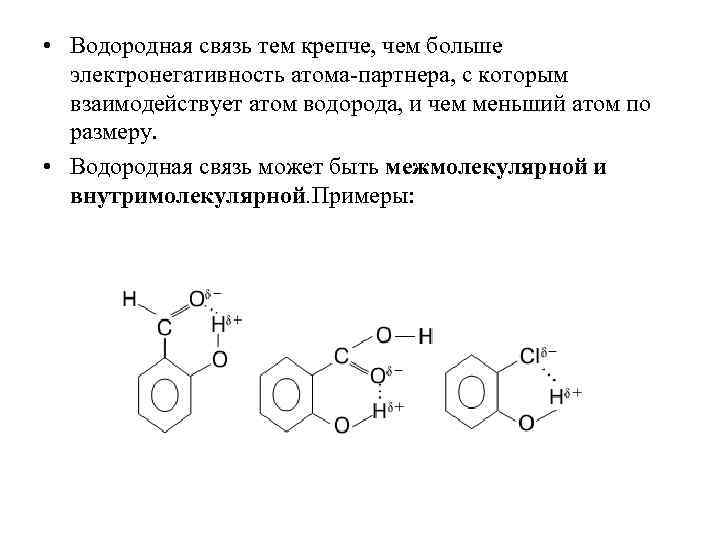 • Водородная связь тем крепче, чем больше электронегативность атома-партнера, с которым взаимодействует атом водорода, и чем меньший атом по размеру. • Водородная связь может быть межмолекулярной и внутримолекулярной. Примеры:
• Водородная связь тем крепче, чем больше электронегативность атома-партнера, с которым взаимодействует атом водорода, и чем меньший атом по размеру. • Водородная связь может быть межмолекулярной и внутримолекулярной. Примеры:


