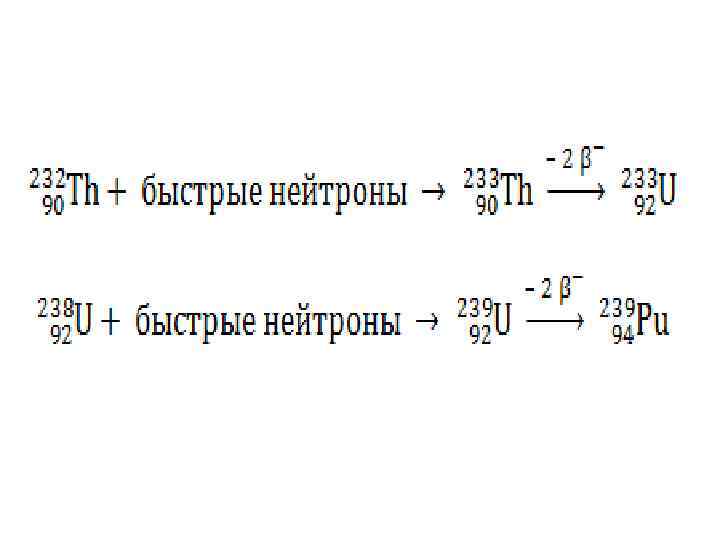эл-ты 3й группы.pptx
- Количество слайдов: 51
 Свойства элементов III-й группы ПСЭ
Свойства элементов III-й группы ПСЭ
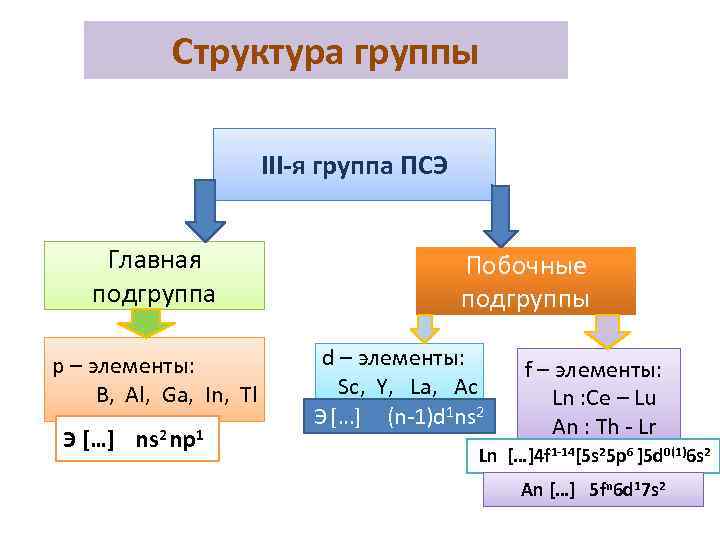 Структура группы III-я группа ПСЭ Главная подгруппа p – элементы: B, Al, Ga, In, Tl Э […] ns 2 np 1 Побочные подгруппы d – элементы: Sc, Y, La, Ac Э […] (n-1)d 1 ns 2 f – элементы: Ln : Ce – Lu An : Th - Lr Ln […]4 f 1 -14[5 s 25 p 6 ]5 d 0(1)6 s 2 An […] 5 fn 6 d 17 s 2
Структура группы III-я группа ПСЭ Главная подгруппа p – элементы: B, Al, Ga, In, Tl Э […] ns 2 np 1 Побочные подгруппы d – элементы: Sc, Y, La, Ac Э […] (n-1)d 1 ns 2 f – элементы: Ln : Ce – Lu An : Th - Lr Ln […]4 f 1 -14[5 s 25 p 6 ]5 d 0(1)6 s 2 An […] 5 fn 6 d 17 s 2
 Свойства элементов III группы Общие свойства: § Все элементы имеют общую валентность III и общий состав химических соединений. • Элементы характеризуются металлическими свойствами , за исключением бора. § Для оксидов и гидроксидов характерны основные свойства , кроме Al, Ga, Sc. • Элементы имеют подобные растворимые и нерастворимые соединения.
Свойства элементов III группы Общие свойства: § Все элементы имеют общую валентность III и общий состав химических соединений. • Элементы характеризуются металлическими свойствами , за исключением бора. § Для оксидов и гидроксидов характерны основные свойства , кроме Al, Ga, Sc. • Элементы имеют подобные растворимые и нерастворимые соединения.
 Различные свойства • Элементы главной подгруппы имеют иное электронное строение. Являются p-элементами (менее активные металлы). • d- и f- элементы имеют на внешнем уровне ns- два электрона, поэтому являются типичными металлами • Различие в свойствах элементов побочных подгрупп определяется электронным строением предшествующих электронных слоев.
Различные свойства • Элементы главной подгруппы имеют иное электронное строение. Являются p-элементами (менее активные металлы). • d- и f- элементы имеют на внешнем уровне ns- два электрона, поэтому являются типичными металлами • Различие в свойствах элементов побочных подгрупп определяется электронным строением предшествующих электронных слоев.
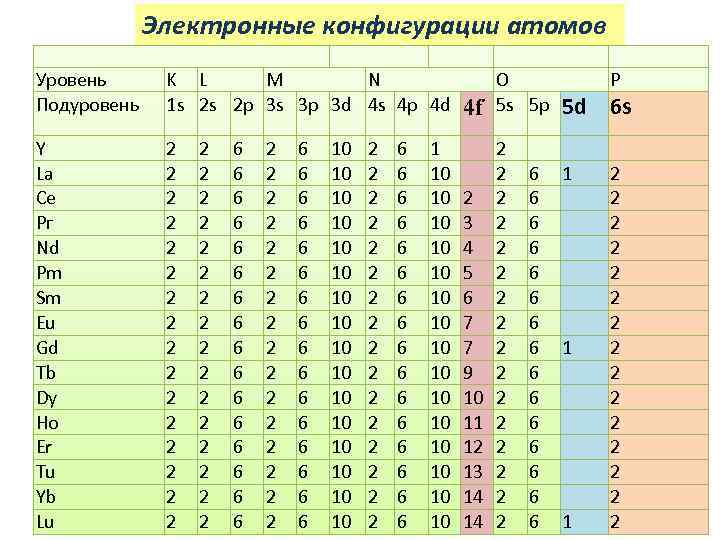 Электронные конфигурации атомов Уровень Подуровень K L M N 1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d Y La Се Рг Nd Pm Sm Eu Gd Tb Dy Ho Er Tu Yb Lu 2 2 2 2 2 2 2 2 6 6 6 6 2 2 2 2 6 6 6 6 10 10 10 10 2 2 2 2 6 6 6 6 1 10 10 10 10 4 f O 5 s 5 p 2 3 4 5 6 7 7 9 10 11 12 13 14 14 2 2 2 2 6 6 6 6 P 5 d 6 s 1 1 1 2 2 2 2
Электронные конфигурации атомов Уровень Подуровень K L M N 1 s 2 s 2 p 3 s 3 p 3 d 4 s 4 p 4 d Y La Се Рг Nd Pm Sm Eu Gd Tb Dy Ho Er Tu Yb Lu 2 2 2 2 2 2 2 2 6 6 6 6 2 2 2 2 6 6 6 6 10 10 10 10 2 2 2 2 6 6 6 6 1 10 10 10 10 4 f O 5 s 5 p 2 3 4 5 6 7 7 9 10 11 12 13 14 14 2 2 2 2 6 6 6 6 P 5 d 6 s 1 1 1 2 2 2 2
 Характеристика РЗЭ • Лантаноиды – элементы, следующие за лантаном и имеющие сходные с ним свойства. • Лантаноиды относятся к f-элементам и имеют общее электронное строение: Ln […]4 f 1 -14[5 s 25 p 6 ]5 d 0(1) 6 s 2 • Лантан, гадолиний и лютеций склонны проявлять только валентность равную III • Церий, празеодим, тербий могут проявлять как валентность III, так и валентность IV • Самарий, Европий, иттербий могут проявлять валентность II • Радиусы атомов и ионов РЗЭ уменьшаются от La к Lu - эффект «лантаноидного сжатия»
Характеристика РЗЭ • Лантаноиды – элементы, следующие за лантаном и имеющие сходные с ним свойства. • Лантаноиды относятся к f-элементам и имеют общее электронное строение: Ln […]4 f 1 -14[5 s 25 p 6 ]5 d 0(1) 6 s 2 • Лантан, гадолиний и лютеций склонны проявлять только валентность равную III • Церий, празеодим, тербий могут проявлять как валентность III, так и валентность IV • Самарий, Европий, иттербий могут проявлять валентность II • Радиусы атомов и ионов РЗЭ уменьшаются от La к Lu - эффект «лантаноидного сжатия»
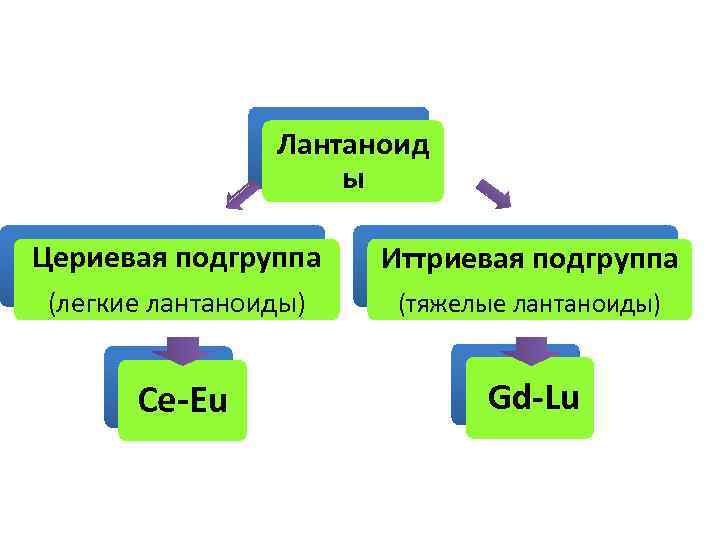 Лантаноид ы Цериевая подгруппа Иттриевая подгруппа (легкие лантаноиды) (тяжелые лантаноиды) Се-Eu Gd-Lu
Лантаноид ы Цериевая подгруппа Иттриевая подгруппа (легкие лантаноиды) (тяжелые лантаноиды) Се-Eu Gd-Lu
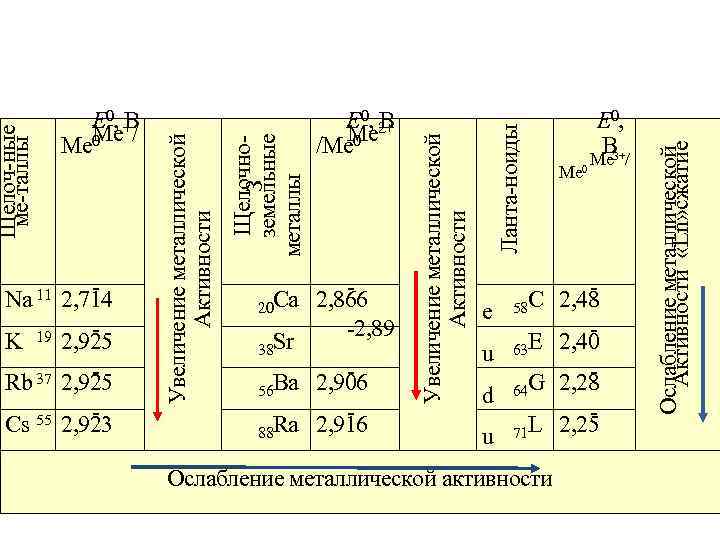 Me 0 E 0, B 3+ Me / C 2, 48 e 58 E 2, 40 u 63 G 2, 28 d 64 L 2, 25 u 71 Ослабление металлической активности Ослабление металлической Активности «Ln» сжатие Ca 2, 866 20 2, 89 Sr 38 Ba 2, 906 56 Ra 2, 916 88 Ланта ноиды Щелочно З земельные металлы E 0, 2+ B Me /Me 0 Увеличение металлической Активности Na 11 2, 714 K 19 2, 925 Rb 37 2, 925 Cs 55 2, 923 Увеличение металлической Активности Щелоч ные ме таллы E 0, + B Me / Me 0
Me 0 E 0, B 3+ Me / C 2, 48 e 58 E 2, 40 u 63 G 2, 28 d 64 L 2, 25 u 71 Ослабление металлической активности Ослабление металлической Активности «Ln» сжатие Ca 2, 866 20 2, 89 Sr 38 Ba 2, 906 56 Ra 2, 916 88 Ланта ноиды Щелочно З земельные металлы E 0, 2+ B Me /Me 0 Увеличение металлической Активности Na 11 2, 714 K 19 2, 925 Rb 37 2, 925 Cs 55 2, 923 Увеличение металлической Активности Щелоч ные ме таллы E 0, + B Me / Me 0
 Основные Химические свойства РЗЭ На воздухе легкие. Lnокисляются при комнатной t, остальные при t=180 200 °С: 4 Ln 0+3 O 20 t 2 Ln 2+3 O 3 -2 Ln 0 -3 е Ln+3 O 02+4 е 2 O-2 Се и богатые Се сплавы пирофорны. Се 0+О 20 Се+4 О 2 -2 Се 0 4 е Се+4 O 02+4 е 2 O 2 С галогенами взаимодействуют при сравнительно невысокой температуре 2 РЗЭ+3 Cl 2 t 2 РЗЭCl 3 РЗЭ 0 3 е РЗЭ+3 Cl 02+2 е 2 Cl интенсивность взаимодействия уменьшается от фтора к йоду.
Основные Химические свойства РЗЭ На воздухе легкие. Lnокисляются при комнатной t, остальные при t=180 200 °С: 4 Ln 0+3 O 20 t 2 Ln 2+3 O 3 -2 Ln 0 -3 е Ln+3 O 02+4 е 2 O-2 Се и богатые Се сплавы пирофорны. Се 0+О 20 Се+4 О 2 -2 Се 0 4 е Се+4 O 02+4 е 2 O 2 С галогенами взаимодействуют при сравнительно невысокой температуре 2 РЗЭ+3 Cl 2 t 2 РЗЭCl 3 РЗЭ 0 3 е РЗЭ+3 Cl 02+2 е 2 Cl интенсивность взаимодействия уменьшается от фтора к йоду.
 РЗЭ реагируют с водой (при нагревании – быстро). 4 РЗЭ+2(OH)2 +O 02+2 H 2 O 4 РЗЭ+3(O-2 H)3 РЗЭ+2 е РЗЭ+3 O 02+4 е 2 O 2 2 РЗЭ 0+6 H+2 O 2 РЗЭ+3(OH)3+3 H 02 РЗЭ 0 3 е РЗЭ+3 2 H+ +2 е H 02 Замещаются металлами: 2 РЗЭ+3 Cl 3+Ca 0 t 2 РЗЭ 0+3 Ca+2 Cl 2 РЗЭ+3+3 е РЗЭ 0 Ca 0 2 е Ca+2
РЗЭ реагируют с водой (при нагревании – быстро). 4 РЗЭ+2(OH)2 +O 02+2 H 2 O 4 РЗЭ+3(O-2 H)3 РЗЭ+2 е РЗЭ+3 O 02+4 е 2 O 2 2 РЗЭ 0+6 H+2 O 2 РЗЭ+3(OH)3+3 H 02 РЗЭ 0 3 е РЗЭ+3 2 H+ +2 е H 02 Замещаются металлами: 2 РЗЭ+3 Cl 3+Ca 0 t 2 РЗЭ 0+3 Ca+2 Cl 2 РЗЭ+3+3 е РЗЭ 0 Ca 0 2 е Ca+2
 При плавлении с серой, теллуром, селеном образуют сульфиды, теллуриды, хлориды. 2 РЗЭ 0+3 S 0+6 O 02 t РЗЭ+32(S-2 O-24)3 С углеродом и углеродсодержащими газами образуют карбиды РЗЭ 2 О 3+7 С t 2 РЗЭС 2+3 СО РЗЭ 2(CO 3)3 t РЗЭ 2 O 3 + 3 CO 2 РЗЭ 2(C 2 O 4)4 t РЗЭ 2 O 3 + 5 CO + 3 CO 2 с Н 2(медленно- при комнатной температуре, быстро–при надревании) образуют гидриды Ln. H 3 2 Ln 0+3 H 20 2 Ln+3 H 3 и Ln. H 2 0 0 Ln +H 2 Ln. H 2 нестехиометрический гидрид При нагревании до температуры красного каления реагируют с азотом, образуя нитриды Ln. N 2 Ln 0+3 N 20 +9 О 20 2 Ln(NО 3)3
При плавлении с серой, теллуром, селеном образуют сульфиды, теллуриды, хлориды. 2 РЗЭ 0+3 S 0+6 O 02 t РЗЭ+32(S-2 O-24)3 С углеродом и углеродсодержащими газами образуют карбиды РЗЭ 2 О 3+7 С t 2 РЗЭС 2+3 СО РЗЭ 2(CO 3)3 t РЗЭ 2 O 3 + 3 CO 2 РЗЭ 2(C 2 O 4)4 t РЗЭ 2 O 3 + 5 CO + 3 CO 2 с Н 2(медленно- при комнатной температуре, быстро–при надревании) образуют гидриды Ln. H 3 2 Ln 0+3 H 20 2 Ln+3 H 3 и Ln. H 2 0 0 Ln +H 2 Ln. H 2 нестехиометрический гидрид При нагревании до температуры красного каления реагируют с азотом, образуя нитриды Ln. N 2 Ln 0+3 N 20 +9 О 20 2 Ln(NО 3)3
 РЗЭ реагируют с кислотами: соляной, серной, азотной. 2 РЗЭ+3 H 2 SO 4 РЗЭ 2(SO 4)3+3 H 2 РЗЭ 0 3 е РЗЭ+3 2 H+ +2 е H 02 8 РЗЭ 0+30 HN+5 O 3 3 N-3 H 4 NO 3+8 РЗЭ(NO 3)3+9 H 2 O РЗЭ 0 3 е РЗЭ+3 N+5+8 е N 3 Реагируют с солями: РЗЭ 2(SO 4)3 +3 Na 2 CO 3 РЗЭ 2(CO 3)3 +3 Na 2 SO 4 РЗЭ+3+3 NH 4 F РЗЭ F 3 +3 NH 4+ Щелочи на них не действуют даже при нагревании. РЗЭ+Na. OH t не идет
РЗЭ реагируют с кислотами: соляной, серной, азотной. 2 РЗЭ+3 H 2 SO 4 РЗЭ 2(SO 4)3+3 H 2 РЗЭ 0 3 е РЗЭ+3 2 H+ +2 е H 02 8 РЗЭ 0+30 HN+5 O 3 3 N-3 H 4 NO 3+8 РЗЭ(NO 3)3+9 H 2 O РЗЭ 0 3 е РЗЭ+3 N+5+8 е N 3 Реагируют с солями: РЗЭ 2(SO 4)3 +3 Na 2 CO 3 РЗЭ 2(CO 3)3 +3 Na 2 SO 4 РЗЭ+3+3 NH 4 F РЗЭ F 3 +3 NH 4+ Щелочи на них не действуют даже при нагревании. РЗЭ+Na. OH t не идет
 Редкоземельные металлы – хорошие восстановители; 2 РЗЭ+3 СО t 3 C+РЗЭ 2 O 3 4 РЗЭ+3 СО 2 t 3 C+2 РЗЭ 2 O 3 РЗЭ образуют комплексные соединения: Се(С 2 О 4)2 +2(NH 4)2 С 2 O 4 (NH 4)4[Се(С 2 О 4)4](кч=8)
Редкоземельные металлы – хорошие восстановители; 2 РЗЭ+3 СО t 3 C+РЗЭ 2 O 3 4 РЗЭ+3 СО 2 t 3 C+2 РЗЭ 2 O 3 РЗЭ образуют комплексные соединения: Се(С 2 О 4)2 +2(NH 4)2 С 2 O 4 (NH 4)4[Се(С 2 О 4)4](кч=8)

![• Электронная конфигурация атома церия Се [ ] 4 f 2[5 s 25 • Электронная конфигурация атома церия Се [ ] 4 f 2[5 s 25](https://present5.com/presentation/2162905_32128534/image-15.jpg) • Электронная конфигурация атома церия Се [ ] 4 f 2[5 s 25 p 6]5 d 06 s 2 • 58 • Церий активный металл. • Церий взаимодействует при нагревании с большинством неметаллов (O 2, H 2, N 2, Cl 2, C, S, P и т. д. ) с образованием соответствующих бинарных соединений. • 2 Ce + N 2 2 Ce. N • Бурно взаимодействует с кислородом • Ce + O 2 → Ce. O 2
• Электронная конфигурация атома церия Се [ ] 4 f 2[5 s 25 p 6]5 d 06 s 2 • 58 • Церий активный металл. • Церий взаимодействует при нагревании с большинством неметаллов (O 2, H 2, N 2, Cl 2, C, S, P и т. д. ) с образованием соответствующих бинарных соединений. • 2 Ce + N 2 2 Ce. N • Бурно взаимодействует с кислородом • Ce + O 2 → Ce. O 2
 Хим. свойства церия Реагирует с водой с выделением Н 2. В ряду активности Церий и др. лантаноиды можно расположить между Са и Mg. Се +3 Н 2 О Ce (OН)3+3 H 2 Карбонаты Церия горят на воздухе: Ce+32(CO 3)3 + O 02 t Ce+4 O 2 + 6 CO 2. Се+3 е Се+4 4 восстановитель Eвос=1. 61 В; O 02 +4 е 2 O 2 1 окислитель Еок=1. 23 В; E = Eок Eвос = 0. 38
Хим. свойства церия Реагирует с водой с выделением Н 2. В ряду активности Церий и др. лантаноиды можно расположить между Са и Mg. Се +3 Н 2 О Ce (OН)3+3 H 2 Карбонаты Церия горят на воздухе: Ce+32(CO 3)3 + O 02 t Ce+4 O 2 + 6 CO 2. Се+3 е Се+4 4 восстановитель Eвос=1. 61 В; O 02 +4 е 2 O 2 1 окислитель Еок=1. 23 В; E = Eок Eвос = 0. 38
 Свойства соединений церия Ce 3+. Кислотно-основные свойства Гидроксид в водных растворах проявляет основной характер. Ce(NO 3)3+3 Na. OH Ce(OH)3 (бел. )+3 Na. NO 3; 2 Ce(OH)3 +3 H 2 SO 4 Ce 2(SO 4)3 + 3 H 2 O Ce(OH)3 +Na. OH ; Получение малорастворимых солей Церия(III) 2 Ce(NO 3)3+3(NH 4)C 2 O 4 Ce 2(C 2 O 4)3 (бел)+6 NH 4 NO 3; 2 Ce(NO 3)3+3 Na 2 CO 3 Ce 2(CO 3)3 (бел)+6 Na. NO 3; Ce(NO 3)3+Na 3 PO 4 Ce. PO 4 (бел)+3 Na. NO 3; Ce(NO 3)3+3 Na. F Ce. F 3 (бел)+3 Na. NO 3;
Свойства соединений церия Ce 3+. Кислотно-основные свойства Гидроксид в водных растворах проявляет основной характер. Ce(NO 3)3+3 Na. OH Ce(OH)3 (бел. )+3 Na. NO 3; 2 Ce(OH)3 +3 H 2 SO 4 Ce 2(SO 4)3 + 3 H 2 O Ce(OH)3 +Na. OH ; Получение малорастворимых солей Церия(III) 2 Ce(NO 3)3+3(NH 4)C 2 O 4 Ce 2(C 2 O 4)3 (бел)+6 NH 4 NO 3; 2 Ce(NO 3)3+3 Na 2 CO 3 Ce 2(CO 3)3 (бел)+6 Na. NO 3; Ce(NO 3)3+Na 3 PO 4 Ce. PO 4 (бел)+3 Na. NO 3; Ce(NO 3)3+3 Na. F Ce. F 3 (бел)+3 Na. NO 3;
 Окислтельно-восстановительнык свойства Ce 3+ восстановитель Переход Ce 3+ + окислитель Ce 4+ достаточно легко осуществим в водных растворах. 3 Ce+3(OH)3 + KMn+7 O 4 + 2 H 2 O 3 Ce+4(OH)4 + Mn+4 O 2 + KOH(p. Н > 7) Се+3 е Се+4 восстановитель Eвос=1. 61 В; 3 Mn+7+3 е Mn+4 окислитель Eок=0. 6 В; 1 E = Eок Eвос =1, 01 В. 2 Ce (NO 3)3+Na. Bi+5 O 3 +6 HNO 3 2 Ce(NO 3)4(ж. )+Bi+3(NO 3)3+Na. NO 3+3 H 2 O(p. H<7) Bi+5+2 e Bi+3 окислитель Eок=1. 86 В; 1 Ce+3 e Ce+4 восстановитель Eвос=1. 61 В; 2 E = Eок Eвос = 0, 25 В.
Окислтельно-восстановительнык свойства Ce 3+ восстановитель Переход Ce 3+ + окислитель Ce 4+ достаточно легко осуществим в водных растворах. 3 Ce+3(OH)3 + KMn+7 O 4 + 2 H 2 O 3 Ce+4(OH)4 + Mn+4 O 2 + KOH(p. Н > 7) Се+3 е Се+4 восстановитель Eвос=1. 61 В; 3 Mn+7+3 е Mn+4 окислитель Eок=0. 6 В; 1 E = Eок Eвос =1, 01 В. 2 Ce (NO 3)3+Na. Bi+5 O 3 +6 HNO 3 2 Ce(NO 3)4(ж. )+Bi+3(NO 3)3+Na. NO 3+3 H 2 O(p. H<7) Bi+5+2 e Bi+3 окислитель Eок=1. 86 В; 1 Ce+3 e Ce+4 восстановитель Eвос=1. 61 В; 2 E = Eок Eвос = 0, 25 В.
 Свойства Ce 4+. • Кислотно - основные: Слабые амфотерные свойства реализуются Ce(OH)4 только при высоких температурах( при спекании с щелочью): • Ce(SO 4)2(жёлт. )+4 Na. OH Ce(OH)4(бел. ) +2 Na 2 SO 4; • Ce(OH)4 +Na. OH водный р-р; • Ce(OH)4 + • 2 Na. OН t Na 2 Ce. O 3 + 3 H 2 O ; • Ce(OH)4 +2 H 2 SO 4 Ce(SO 4)2 + 4 H 2 O;
Свойства Ce 4+. • Кислотно - основные: Слабые амфотерные свойства реализуются Ce(OH)4 только при высоких температурах( при спекании с щелочью): • Ce(SO 4)2(жёлт. )+4 Na. OH Ce(OH)4(бел. ) +2 Na 2 SO 4; • Ce(OH)4 +Na. OH водный р-р; • Ce(OH)4 + • 2 Na. OН t Na 2 Ce. O 3 + 3 H 2 O ; • Ce(OH)4 +2 H 2 SO 4 Ce(SO 4)2 + 4 H 2 O;
 Окислительно-восстановительные свойства. Ce(IV) 2 Ce(SO 4)2+2 KI I 2+K 2 SO 4+Ce 2(SO 4)3 (p. H<7 , Ce+4+e Ce+3 окислитель Eок=1. 61 В; В 2 I 2 e I 2 восстановитель Eвост= 0. 54 В; Ер=Еок Евост=1. 07 В; 2 1 2 Ce(SO 4)2+H 2 O 2 Ce 2(SO 4)3+O 2 +H 2 SO 4 Ce+4+e Ce+3 окислитель Еок=1. 61 В; 2 2 O 1 2 e O 20 восстановитель Евост=1. 23 В; 1 Ер=Еок Евост=0. 38 В. Ионы Ce 4+ сильные окислители в кислых средах: 2 Ce+4(OH)4+8 HCl-1 2 Ce+3 Cl 3+Cl 2 +8 H 2 O Ce+4+e Ce+3 окислитель Еок=1. 61 В; 2 2 Cl 1 2 e Cl 20 восстановитель Евост=1. 36 В; 1 • Ер=Еок Евост=0, 25 В;
Окислительно-восстановительные свойства. Ce(IV) 2 Ce(SO 4)2+2 KI I 2+K 2 SO 4+Ce 2(SO 4)3 (p. H<7 , Ce+4+e Ce+3 окислитель Eок=1. 61 В; В 2 I 2 e I 2 восстановитель Eвост= 0. 54 В; Ер=Еок Евост=1. 07 В; 2 1 2 Ce(SO 4)2+H 2 O 2 Ce 2(SO 4)3+O 2 +H 2 SO 4 Ce+4+e Ce+3 окислитель Еок=1. 61 В; 2 2 O 1 2 e O 20 восстановитель Евост=1. 23 В; 1 Ер=Еок Евост=0. 38 В. Ионы Ce 4+ сильные окислители в кислых средах: 2 Ce+4(OH)4+8 HCl-1 2 Ce+3 Cl 3+Cl 2 +8 H 2 O Ce+4+e Ce+3 окислитель Еок=1. 61 В; 2 2 Cl 1 2 e Cl 20 восстановитель Евост=1. 36 В; 1 • Ер=Еок Евост=0, 25 В;
 Отделение. Ce от других РЗЭ. Комплексообразование В основе — способность церия проявлять степень окисления +4. Ce 2(C 2 O 4)3 + (NH 4)C 2 O 4 не идёт. Ce(C 2 O 4)2 + 2(NH 4)2 C 2 O 4 (NH 4)4[Ce(C 2 O 4)4]4 -. Ce(OH)3 + 3 HCl Ce. Cl 3 + 3 H 2 O. РЗЭ(OH)3 + HCl РЗЭCl 3 + 3 H 2 O. (p. H = 6, 5) 2 H 2 O+Ce. Cl 3+KMn. O 4+8 Na. OH Ce(OH)4 +Mn. O 2 +KCl+8 Na. Cl
Отделение. Ce от других РЗЭ. Комплексообразование В основе — способность церия проявлять степень окисления +4. Ce 2(C 2 O 4)3 + (NH 4)C 2 O 4 не идёт. Ce(C 2 O 4)2 + 2(NH 4)2 C 2 O 4 (NH 4)4[Ce(C 2 O 4)4]4 -. Ce(OH)3 + 3 HCl Ce. Cl 3 + 3 H 2 O. РЗЭ(OH)3 + HCl РЗЭCl 3 + 3 H 2 O. (p. H = 6, 5) 2 H 2 O+Ce. Cl 3+KMn. O 4+8 Na. OH Ce(OH)4 +Mn. O 2 +KCl+8 Na. Cl
 Качественные реакции на ионы церия. • Ce(NO 3)3+3 NH 4 OH Ce(OH)3 (бел. )+3 NH 4 NO 3; 2 Ce(OH)3+H 2 O 2 2 Ce(OH)4 (желт. ) (p. H > 7); Се+3 е Се+4 восстановитель Eвос=1. 61 В; H 2 O 2+2 е+2 Н+ НО 2+ОН окислитель Еок=1. 77 В; Ер=Еок Евост=0. 16 В. 1 1 • Ce(OH)4 +H 2 O 2 Ce(OH)3(OOH) (оранж. )+H 2 O(p. H > 7);
Качественные реакции на ионы церия. • Ce(NO 3)3+3 NH 4 OH Ce(OH)3 (бел. )+3 NH 4 NO 3; 2 Ce(OH)3+H 2 O 2 2 Ce(OH)4 (желт. ) (p. H > 7); Се+3 е Се+4 восстановитель Eвос=1. 61 В; H 2 O 2+2 е+2 Н+ НО 2+ОН окислитель Еок=1. 77 В; Ер=Еок Евост=0. 16 В. 1 1 • Ce(OH)4 +H 2 O 2 Ce(OH)3(OOH) (оранж. )+H 2 O(p. H > 7);
 АКТИНОИДЫ
АКТИНОИДЫ
![электронное строение • • [Rn] 5 f k 6 d m 7 s 2, электронное строение • • [Rn] 5 f k 6 d m 7 s 2,](https://present5.com/presentation/2162905_32128534/image-24.jpg) электронное строение • • [Rn] 5 f k 6 d m 7 s 2, где k изменяется от 2 до 14, а m равно 0 или 1 Различие в энергиях 5 f- и 6 d-орбиталей меньше, чем 4 f- и 5 d-орбиталей
электронное строение • • [Rn] 5 f k 6 d m 7 s 2, где k изменяется от 2 до 14, а m равно 0 или 1 Различие в энергиях 5 f- и 6 d-орбиталей меньше, чем 4 f- и 5 d-орбиталей
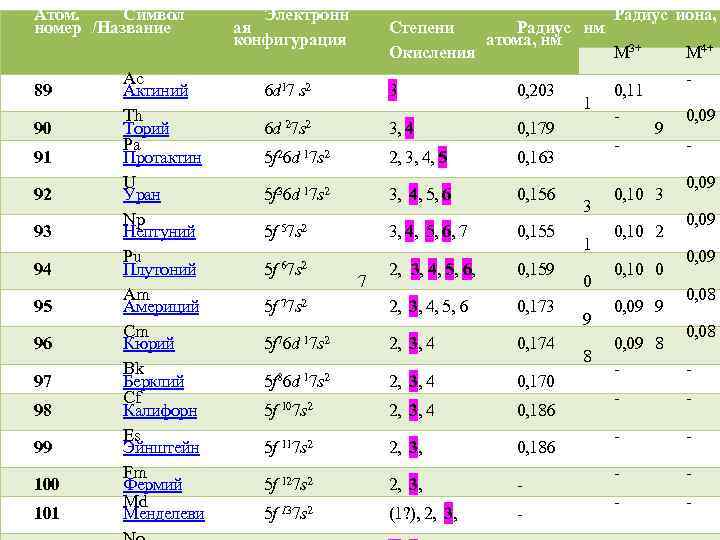 Атом. Символ номер /Название 89 90 91 92 93 94 95 96 97 98 99 100 101 Ac Актиний Th Торий Pa Протактин U Уран Np Нептуний Pu Плутоний Am Америций Cm Кюрий Bk Берклий Cf Калифорн Es Эйнштейн Fm Фермий Md Менделеви Электронн ая конфигурация 6 d 17 s 2 6 d 27 s 2 5 f 26 d 17 s 2 5 f 36 d 17 s 2 5 f 57 s 2 5 f 67 s 2 5 f 76 d 17 s 2 5 f 86 d 17 s 2 5 f 107 s 2 5 f 117 s 2 5 f 127 s 2 5 f 137 s 2 7 Радиус иона, Степени Радиус нм атома, нм M 3+ M 4+ Окисления 3 0, 203 0, 11 1 0, 09 3, 4 0, 179 9 2, 3, 4, 5 0, 163 0, 09 3, 4, 5, 6 0, 156 0, 10 3 3 0, 09 3, 4, 5, 6, 7 0, 155 0, 10 2 1 0, 09 2, 3, 4, 5, 6, 0, 159 0, 10 0 0 0, 08 2, 3, 4, 5, 6 0, 173 0, 09 9 9 0, 08 2, 3, 4 0, 174 0, 09 8 8 2, 3, 4 0, 170 2, 3, 4 0, 186 2, 3, (1? ), 2, 3,
Атом. Символ номер /Название 89 90 91 92 93 94 95 96 97 98 99 100 101 Ac Актиний Th Торий Pa Протактин U Уран Np Нептуний Pu Плутоний Am Америций Cm Кюрий Bk Берклий Cf Калифорн Es Эйнштейн Fm Фермий Md Менделеви Электронн ая конфигурация 6 d 17 s 2 6 d 27 s 2 5 f 26 d 17 s 2 5 f 36 d 17 s 2 5 f 57 s 2 5 f 67 s 2 5 f 76 d 17 s 2 5 f 86 d 17 s 2 5 f 107 s 2 5 f 117 s 2 5 f 127 s 2 5 f 137 s 2 7 Радиус иона, Степени Радиус нм атома, нм M 3+ M 4+ Окисления 3 0, 203 0, 11 1 0, 09 3, 4 0, 179 9 2, 3, 4, 5 0, 163 0, 09 3, 4, 5, 6 0, 156 0, 10 3 3 0, 09 3, 4, 5, 6, 7 0, 155 0, 10 2 1 0, 09 2, 3, 4, 5, 6, 0, 159 0, 10 0 0 0, 08 2, 3, 4, 5, 6 0, 173 0, 09 9 9 0, 08 2, 3, 4 0, 174 0, 09 8 8 2, 3, 4 0, 170 2, 3, 4 0, 186 2, 3, (1? ), 2, 3,
 Радиусы атомов и ионов актиноидов уменьшаются с ростом порядкового номера. По аналогии с лантаноидным, эффект называется "актиноидное сжатие". Для актиноидов первой половины ряда энергии 5 f, 6 d, 7 s и 7 p орбиталей примерно одинаковы. Эти орбитали перекрываются и могут принимать участие в образовании химических связей. Благодаря этому легкие актиноиды характеризуются большим разнообразием степеней окисления, и более склонны к образованию комплексных соединений,
Радиусы атомов и ионов актиноидов уменьшаются с ростом порядкового номера. По аналогии с лантаноидным, эффект называется "актиноидное сжатие". Для актиноидов первой половины ряда энергии 5 f, 6 d, 7 s и 7 p орбиталей примерно одинаковы. Эти орбитали перекрываются и могут принимать участие в образовании химических связей. Благодаря этому легкие актиноиды характеризуются большим разнообразием степеней окисления, и более склонны к образованию комплексных соединений,
 Химические свойства актиноидов • Обладают большой склонностью к комплексообразованию, особенно с кислородсодержащими лигандами ; • В ряду легких актиноидов (от актиния до америция) свойства элементов сильно различаются, • В ряду тяжелых актиноидов (от кюрия до лоуренсия) они в значительной степени аналогичны и похожи на свойства лантаноидов;
Химические свойства актиноидов • Обладают большой склонностью к комплексообразованию, особенно с кислородсодержащими лигандами ; • В ряду легких актиноидов (от актиния до америция) свойства элементов сильно различаются, • В ряду тяжелых актиноидов (от кюрия до лоуренсия) они в значительной степени аналогичны и похожи на свойства лантаноидов;
 • Склонность к гидролизу для каждого типа ионов M 3+, M 4+, MO 2+ и MO 22+ повышается с ростом атомного номера элемента; • В водных растворах актиноиды образуют разнообразные ацидокомплексы, в которых часто проявляет координационное число, равное 8, Na 4[U(C 2 O 4)4] и Na 4[Th(CO 3)4]. • Для катионов склонность к комплексообразованию снижается в ряду M 4+ > MO 22+ ≥ M 3+ > MO 2+, • а при замене лиганда - в рядах фторид > нитрат > хлорид > перхлорат и карбонат > оксалат > сульфат;
• Склонность к гидролизу для каждого типа ионов M 3+, M 4+, MO 2+ и MO 22+ повышается с ростом атомного номера элемента; • В водных растворах актиноиды образуют разнообразные ацидокомплексы, в которых часто проявляет координационное число, равное 8, Na 4[U(C 2 O 4)4] и Na 4[Th(CO 3)4]. • Для катионов склонность к комплексообразованию снижается в ряду M 4+ > MO 22+ ≥ M 3+ > MO 2+, • а при замене лиганда - в рядах фторид > нитрат > хлорид > перхлорат и карбонат > оксалат > сульфат;
 Свойства тория • Природный торий содержит практически один изотоп 232 Th, • период полураспада равен 1, 4· 1010 лет • Электронная формула 6 d 2 7 s 2 • Основная степень окисления +4,
Свойства тория • Природный торий содержит практически один изотоп 232 Th, • период полураспада равен 1, 4· 1010 лет • Электронная формула 6 d 2 7 s 2 • Основная степень окисления +4,
 Свойства тория • Торий — активный металл, по реакционной способности близкий к лантаноидам, но отличается от них степенью окисления • При нагревании торий реагирует со многими неметаллами: O 2. . Н 2, С, Cl 2, Br 2, S, N 2.
Свойства тория • Торий — активный металл, по реакционной способности близкий к лантаноидам, но отличается от них степенью окисления • При нагревании торий реагирует со многими неметаллами: O 2. . Н 2, С, Cl 2, Br 2, S, N 2.
 • Торий взаимодействует с азотом при 800 °C с образованием нитрида тория Th. N, • 2 Th + N 2 2 Th. N • Взаимодействия тория с углеродом • Th + C Th. C • Th + 2 C Th. C 2 • карбиды разлагаются водой с образованием углеводородов. • Th. C + H 2 O Th(OH)4 + CH 4↑ • Th. C 2 + H 2 O Th(OH)4 + C 2 H 4↑
• Торий взаимодействует с азотом при 800 °C с образованием нитрида тория Th. N, • 2 Th + N 2 2 Th. N • Взаимодействия тория с углеродом • Th + C Th. C • Th + 2 C Th. C 2 • карбиды разлагаются водой с образованием углеводородов. • Th. C + H 2 O Th(OH)4 + CH 4↑ • Th. C 2 + H 2 O Th(OH)4 + C 2 H 4↑
 Взаимодействие тория с водой, кислотами • Торий - ативный восстановитель (Е о = -1, 9 В) • Торий вытесняет водород из кипящей воды Th + 4 H 2 O Th(OH)4 + 2 H 2↑ • медленно растворяется в разбавленных фтороводородной, азотной или серной кислотах • Th +2 H 2 SO 4(разб) Th (SO 4)2 + 2 H 2↑ • Th + 4 HF(разб) Th. F 4 + 2 H 2↑
Взаимодействие тория с водой, кислотами • Торий - ативный восстановитель (Е о = -1, 9 В) • Торий вытесняет водород из кипящей воды Th + 4 H 2 O Th(OH)4 + 2 H 2↑ • медленно растворяется в разбавленных фтороводородной, азотной или серной кислотах • Th +2 H 2 SO 4(разб) Th (SO 4)2 + 2 H 2↑ • Th + 4 HF(разб) Th. F 4 + 2 H 2↑
 Соединения тория (IV) Th(OH)4 - имеет основной характер Th (SO 4)2 + 4 NH 4 OH → Th (OH)4↓ +2(NH 4)2 SO 4 Th (OH)4↓ Th. O 2 + 2 H 2 O Th (OH)4↓ + 4 HCl(разб) Th. Cl 4 + 2 H 2 O Th (OH)4↓ + CO 2 → Th OCO 3↓ + H 2 O • к растворимым в воде соединениям относятся нитраты, хлориды и сульфаты тория (IV) • Гидролиз солей • Th(NO 3)4 + H 2 O Th. O(NO 3)2 + 2 HNO 3 Th(NO 3)4 + 2 Na 2 CO 3 + H 2 O Th. O CO 3 + H 2 CO 3 + 4 Na. NO 3
Соединения тория (IV) Th(OH)4 - имеет основной характер Th (SO 4)2 + 4 NH 4 OH → Th (OH)4↓ +2(NH 4)2 SO 4 Th (OH)4↓ Th. O 2 + 2 H 2 O Th (OH)4↓ + 4 HCl(разб) Th. Cl 4 + 2 H 2 O Th (OH)4↓ + CO 2 → Th OCO 3↓ + H 2 O • к растворимым в воде соединениям относятся нитраты, хлориды и сульфаты тория (IV) • Гидролиз солей • Th(NO 3)4 + H 2 O Th. O(NO 3)2 + 2 HNO 3 Th(NO 3)4 + 2 Na 2 CO 3 + H 2 O Th. O CO 3 + H 2 CO 3 + 4 Na. NO 3
 комплексообразование • В водных растворах торий образует комплексные соединения с КЧ=6, 8 и реже 10 или 12. Комплексообразование используют для растворения труднорастворимых соединений тория (карбонатов, оксалатов). • Th. OCO 3↓ + 3 Na 2 CO 3 + H 2 O → Na 4[Th(CO 3)4] + 2 Na. OH • Th(C 2 O 4)2 ↓ + 2(NH 4)2 C 2 O 4 → (NH 4)4[Th(C 2 O 4)4]
комплексообразование • В водных растворах торий образует комплексные соединения с КЧ=6, 8 и реже 10 или 12. Комплексообразование используют для растворения труднорастворимых соединений тория (карбонатов, оксалатов). • Th. OCO 3↓ + 3 Na 2 CO 3 + H 2 O → Na 4[Th(CO 3)4] + 2 Na. OH • Th(C 2 O 4)2 ↓ + 2(NH 4)2 C 2 O 4 → (NH 4)4[Th(C 2 O 4)4]
 Получение тория • минерал монацит вскрывают сернокислотным или щелочным способом Th 3(PO 4)4+12 Na. OH → 3 Th(OH)4↓+4 Na 3 PO 4 • оксид тория Th. O 2 подвергают металлотермическому восстановлению кальцием в атмосфере инертного газа: Th. O 2+2 Ca Th + 2 Ca. O • электролиз расплава галогенида тория Th. F 4 или Th. Cl 4.
Получение тория • минерал монацит вскрывают сернокислотным или щелочным способом Th 3(PO 4)4+12 Na. OH → 3 Th(OH)4↓+4 Na 3 PO 4 • оксид тория Th. O 2 подвергают металлотермическому восстановлению кальцием в атмосфере инертного газа: Th. O 2+2 Ca Th + 2 Ca. O • электролиз расплава галогенида тория Th. F 4 или Th. Cl 4.
 УРАН И ЕГО СВОЙСТВА
УРАН И ЕГО СВОЙСТВА
 Уран • Уран — самый тяжелый из встречающихся в природе элементов • Его содержание в земной коре составляет 3· 10 -4 % по массе • Он имеет три изотопа: 99, 28% природного урана составляет изотоп 238 U, период полураспада которого равен 4, 5· 109 лет; • 0, 715 % – изотоп 235 U с периодом полураспада 7, 1· 108 лет; • 0, 005 % – изотоп 234 U с периодом полураспада 2, 47· 105 лет. • Изотоп 233 U получен в результате ядерных реакций.
Уран • Уран — самый тяжелый из встречающихся в природе элементов • Его содержание в земной коре составляет 3· 10 -4 % по массе • Он имеет три изотопа: 99, 28% природного урана составляет изотоп 238 U, период полураспада которого равен 4, 5· 109 лет; • 0, 715 % – изотоп 235 U с периодом полураспада 7, 1· 108 лет; • 0, 005 % – изотоп 234 U с периодом полураспада 2, 47· 105 лет. • Изотоп 233 U получен в результате ядерных реакций.
 Электронное строение и СО урана • U 5 f 36 d 17 s 2 • степени окисления от +3 , +4, +5, +6, • наиболее устойчивыми среди них являются степени окисления +4 и +6 • в степени окисления +6 – амфотерные свойства; • Его температура плавления равна 1132 °C • Он химически активен и реагирует со многими элементами периодической системы.
Электронное строение и СО урана • U 5 f 36 d 17 s 2 • степени окисления от +3 , +4, +5, +6, • наиболее устойчивыми среди них являются степени окисления +4 и +6 • в степени окисления +6 – амфотерные свойства; • Его температура плавления равна 1132 °C • Он химически активен и реагирует со многими элементами периодической системы.
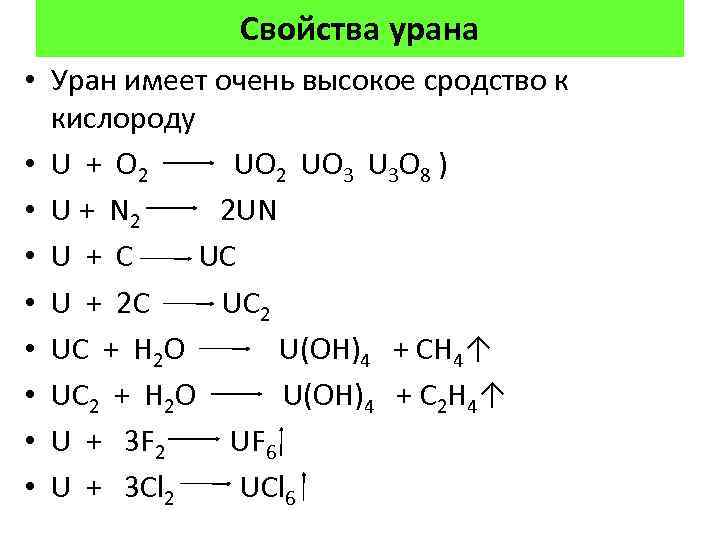 Свойства урана • Уран имеет очень высокое сродство к кислороду • U + O 2 UO 2 UO 3 U 3 O 8 ) • U + N 2 2 UN • U + C UC • U + 2 C UC 2 • UC + H 2 O U(OH)4 + CH 4↑ • UC 2 + H 2 O U(OH)4 + C 2 H 4↑ • U + 3 F 2 UF 6 • U + 3 Cl 2 UCl 6
Свойства урана • Уран имеет очень высокое сродство к кислороду • U + O 2 UO 2 UO 3 U 3 O 8 ) • U + N 2 2 UN • U + C UC • U + 2 C UC 2 • UC + H 2 O U(OH)4 + CH 4↑ • UC 2 + H 2 O U(OH)4 + C 2 H 4↑ • U + 3 F 2 UF 6 • U + 3 Cl 2 UCl 6
 Свойства U(IV) • Безводный тетрафторид получают из диоксида урана UO 2+4 HF UF 4↓+2 H 2 O • восстановлением гексафторида урана различными восстановителями, например, водородом UF 6+H 2 UF 4↓+2 HF
Свойства U(IV) • Безводный тетрафторид получают из диоксида урана UO 2+4 HF UF 4↓+2 H 2 O • восстановлением гексафторида урана различными восстановителями, например, водородом UF 6+H 2 UF 4↓+2 HF
 Свойства U(IV) • • U(IV) -аналог Th 4+ характерны: основные свойства U(SO 4)2 Гидролиз U (NO 3)4 + H 2 O UOH(NO 3)3 + HNO 3 Комплексообразование ОВР
Свойства U(IV) • • U(IV) -аналог Th 4+ характерны: основные свойства U(SO 4)2 Гидролиз U (NO 3)4 + H 2 O UOH(NO 3)3 + HNO 3 Комплексообразование ОВР
 • Под действием окислителей уран (IV) переходит в уран (VI) U(SO 4)2 + 2 Ce(SO 4)2 + 2 H 2 O → UO 2 SO 4 + Ce 2(SO 4)3 + 2 H 2 SO 4 2 U(SO 4)2 + 2 KMn. O 4 + 2 H 2 O → 5 UO 2 SO 4 + 2 Mn. SO 4 + KHSO 4 + H 2 SO 4 • Под действием восстановителей уран (IV) переходит в уран (I I I) 2 U(SO 4)2 + Zn + → U 2(SO 4)3 + Zn. SO 4
• Под действием окислителей уран (IV) переходит в уран (VI) U(SO 4)2 + 2 Ce(SO 4)2 + 2 H 2 O → UO 2 SO 4 + Ce 2(SO 4)3 + 2 H 2 SO 4 2 U(SO 4)2 + 2 KMn. O 4 + 2 H 2 O → 5 UO 2 SO 4 + 2 Mn. SO 4 + KHSO 4 + H 2 SO 4 • Под действием восстановителей уран (IV) переходит в уран (I I I) 2 U(SO 4)2 + Zn + → U 2(SO 4)3 + Zn. SO 4
 Свойства U(VI) • Гидролиз солей: UCl 6 + 2 H 2 O → UO 2 Cl 2 + 4 HCl • Амфотерность • при растворении в кислотах образуются соли диоксоурана UO 2(OH)2 + H 2 SO 4 → UO 2 SO 4 + 2 H 2 O • при растворении в концентрированных щелочах – уранаты • UO 2(OH)2 +2 Na. OH → Na 2 UO 4 + 2 H 2 O • или диуранаты 2 UO 2(OH)2 +2 Na. OH → Na 2 U 2 O 7 + 3 H 2 O
Свойства U(VI) • Гидролиз солей: UCl 6 + 2 H 2 O → UO 2 Cl 2 + 4 HCl • Амфотерность • при растворении в кислотах образуются соли диоксоурана UO 2(OH)2 + H 2 SO 4 → UO 2 SO 4 + 2 H 2 O • при растворении в концентрированных щелочах – уранаты • UO 2(OH)2 +2 Na. OH → Na 2 UO 4 + 2 H 2 O • или диуранаты 2 UO 2(OH)2 +2 Na. OH → Na 2 U 2 O 7 + 3 H 2 O
 комплексообразование • Трикарбонатный комплекс катиона диоксоурана хорошо растворим UO 2 SO 4 + 3 Na 2 CO 3 → Na 4[UO 2(CO 3)3] + Na 2 SO 4 • (NH 4)2 U 2 O 7↓ + 6(NH 4)2 CO 3 + 3 H 2 O → 2(NH 4)4[UO 2(CO 3)3] + 6 Na. OH • В карбонатных комплексах иона диоксоурана два координационных места заняты атомами кислорода
комплексообразование • Трикарбонатный комплекс катиона диоксоурана хорошо растворим UO 2 SO 4 + 3 Na 2 CO 3 → Na 4[UO 2(CO 3)3] + Na 2 SO 4 • (NH 4)2 U 2 O 7↓ + 6(NH 4)2 CO 3 + 3 H 2 O → 2(NH 4)4[UO 2(CO 3)3] + 6 Na. OH • В карбонатных комплексах иона диоксоурана два координационных места заняты атомами кислорода
 Окислительно-восстановительные свойства • U 6+ окислитель • восстановление шестивалентного урана проводят электрохимически или с использованием таких металлов, как железо или цинк: • UO 2 SO 4 + Zn + 2 H 2 SO 4 → U(SO 4)2 + Zn. SO 4 + 2 H 2 O
Окислительно-восстановительные свойства • U 6+ окислитель • восстановление шестивалентного урана проводят электрохимически или с использованием таких металлов, как железо или цинк: • UO 2 SO 4 + Zn + 2 H 2 SO 4 → U(SO 4)2 + Zn. SO 4 + 2 H 2 O
 Получение и очистка урана • Металлический уран получают восстановлением тетрафторида урана UF 4 кальцием или магнием в инертной атмосфере: • UF 4+2 Ca U+2 Ca. F 2
Получение и очистка урана • Металлический уран получают восстановлением тетрафторида урана UF 4 кальцием или магнием в инертной атмосфере: • UF 4+2 Ca U+2 Ca. F 2
 Получение урана • Для урана известно около 200 минералов • промышленное значение имеет минерал настуран (урановая смолка) U 3 O 8 • урановую смоляную руду, обрабатывают минеральными кислотами, например азотной или серной кислотой, в присутствии Mn. O 2, для окисления урана(IV): • U 3 O 8 + Mn. O 2 + 4 H 2 SO 4 → Mn. SO 4 + 3 UO 2 SO 4 + 4 H 2 O
Получение урана • Для урана известно около 200 минералов • промышленное значение имеет минерал настуран (урановая смолка) U 3 O 8 • урановую смоляную руду, обрабатывают минеральными кислотами, например азотной или серной кислотой, в присутствии Mn. O 2, для окисления урана(IV): • U 3 O 8 + Mn. O 2 + 4 H 2 SO 4 → Mn. SO 4 + 3 UO 2 SO 4 + 4 H 2 O
 Карбонатная очистка • Трикарбонатный комплекс катиона диоксоурана хорошо растворим и используется в технологии для отделения урана от металлов, образующих труднорастворимые карбонаты или гидроксиды • UO 2 SO 4 + 3 Na 2 CO 3 → Na 4[UO 2(CO 3)3] + Na 2 SO 4
Карбонатная очистка • Трикарбонатный комплекс катиона диоксоурана хорошо растворим и используется в технологии для отделения урана от металлов, образующих труднорастворимые карбонаты или гидроксиды • UO 2 SO 4 + 3 Na 2 CO 3 → Na 4[UO 2(CO 3)3] + Na 2 SO 4
 применение • расщепляющие материалы, к которым относятся изотопы урана 235 U, 233 U, плутония 239 Pu и 241 Pu • в природе встречается только 235 U • за один акт деления урана в расчете на 1 г ядерного топлива выделяется около 180 Мэ. В, что соответствует 7, 4· 107 к. Дж.
применение • расщепляющие материалы, к которым относятся изотопы урана 235 U, 233 U, плутония 239 Pu и 241 Pu • в природе встречается только 235 U • за один акт деления урана в расчете на 1 г ядерного топлива выделяется около 180 Мэ. В, что соответствует 7, 4· 107 к. Дж.
 ядерные реакции
ядерные реакции